肌球蛋白是鱼肌肉蛋白的主要成分,约占鱼肌原纤维蛋白的55%~60%[1]。肌球蛋白分子是长型不对称结构,含有两个球状头部和一个棒状尾部,在体外高盐(如0.6 mol/L KCl)溶液中,分子以单体或可溶性寡聚体形式存在[2-3]。温度会影响肌球蛋白单体或低聚物的自组装,加热时,肌球蛋白单体和低聚物会发生变性、聚集,最终形成弹性凝胶[4-5]。
Guo等[6]研究表明L-赖氨酸(L-Lys)和L-组氨酸能够促进肌球蛋白展开,导致α-螺旋含量下降,从而暴露更多的疏水基团和巯基基团,最终增加肌球蛋白的溶解度。Chen Xing等[7]研究表明5 mmol/L的L-组氨酸对高盐下蛋白的凝胶强度和热凝胶形成能力均无显著影响。Takai等[8]研究表明精氨酸能够增加肌球蛋白在生理盐浓度下的溶解度而不改变其二级结构。精氨酸能够在不改变蛋白三级结构的情况下抑制蛋白聚集[9],但抑制聚集的机制尚不明确,而L-Lys多被用来研究其对蛋白溶解度及构象的影响[6,8]。但是,关于氨基酸对肌球蛋白热诱导凝胶形成的影响鲜见报道。因此,本研究的目的是探究L-Lys对鲢肌球蛋白的热聚集行为有何影响,并尝试分析其具体的影响机制,从而通过控制L-Lys的添加量获得不同凝胶强度的鱼糜制品,以适应更多人群的饮食需求。
1 材料与方法
1.1 材料与试剂
新鲜花鲢为市购,置于冰块上30 min内带至实验室,选取背部鱼肉,去皮、去刺,剁成肉糜备用。
牛血清白蛋、L-Lys、三(羟甲基)氨基甲烷(Tris) 国药集团化学试剂有限公司;腺苷-5’-三磷酸二钠盐水合物(adenosine triphosphate,ATP) 上海阿拉丁生化科技股份有限公司;其余化学试剂均为国产分析纯。
试剂A:0.1 mmol/L氯化钾,20 mmol/L Tris,用盐酸调节pH 7.5;试剂B:0.45 mmol/L氯化钾,0.2 mol/L乙酸镁,1 mmol/L乙二醇双(2-氨基乙基醚)四乙酸,20 mmol/L Tris,5 mmol/L β-巯基乙醇,用马来酸调节pH 6.8;试剂C:0.5 mmol/L氯化钾,20 mmol/L Tris,5 mmol/L β-巯基乙醇,用盐酸调节pH 7.5。
1.2 仪器与设备
Avanti J-26XP超高速冷冻离心机 德国贝克曼库尔特有限公司;T18分散仪 德国IKA公司;UV1600紫外-可见分光光度计 北京瑞利分析仪器有限公司;TE-124S电子天平 赛多利斯科学仪器(北京)有限公司;HH-S2数显恒温水浴锅 金坛市医疗仪器厂;TA-XT Plus食品物性仪 英国Stable Micro Systems公司;FE 20 pH计 梅特勒-托利多仪器(上海)有限公司;DISCOVERY HR-1流变仪 美国TA仪器公司。
1.3 方法
1.3.1 肌球蛋白的提取
肌球蛋白的制备是根据Park等[10]的方法并进行一定调整。将新鲜鳙鱼去头、去内脏、去皮,取其背部白肉、去骨、清洗,切成肉糜状,加入10 倍体积的试剂A,用均质机在11 000 r/min均质3~5 min,4 ℃反应15 min,离心(3 000×g、5 min、4 ℃),取沉淀物,加入5 倍体积的试剂B,向悬浮液中加入ATP,使之终浓度为10 mmol/L,混合均匀后,在4 ℃静置90 min,然后进行离心(11 000×g、13 min、4 ℃),取上清液,加入5倍体积的1 mmol/L碳酸氢钾溶液,4 ℃放置20 min,离心(11 000×g、13 min、4 ℃),取沉淀物,加入2.5 倍体积的试剂C,4 ℃反应10 min,然后再加入5 倍体积的1 mmol/L碳酸氢钾溶液,往混合物中加入氯化镁,使混合液的终浓度为10 mmol/L,4 ℃条件下进行过夜反应。第2天进行离心(11 000×g、25 min、4 ℃),得到肌球蛋白颗粒,加入到0.5 mol/L NaCl-20 mmol/L Tris-HCl(pH 7.0)缓冲液中,离心(5 000×g、10 min、4 ℃),取上清液备用。
用双缩脲法[11]检测上清液蛋白含量,并进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,用Gel-Pro analyzer软件采用光密度法,对肌球蛋白的纯度进行定量分析。
1.3.2 肌球蛋白-L-Lys热诱导凝胶的制备
参考叶蕾蕾等[12]的方法并加以调整:将肌球蛋白溶液的质量浓度调至20 mg/mL,同时加入L-Lys,使L-Lys最终浓度分别为0、1、5、10 mmol/L和20 mmol/L。将上述制备的各样品进行二段式加热,即先在40 ℃加热60 min,再在90 ℃加热30 min,然后放入冰水中迅速冷却,在4 ℃冰箱中放置12 h。
1.3.3 L-Lys对肌球蛋白溶液pH值的影响
将肌球蛋白溶液的质量浓度调为1.0 mg/mL,同时加入L-Lys,使L-Lys的终浓度分别为0、1、5、10 mmol/L和20 mmol/L。参考Techaratanakrai等[13]的方法,用pH计测定各样品的pH值,每个样品设3 个平行。
1.3.4 L-Lys对肌球蛋白溶液浊度的影响
将肌球蛋白溶液的质量浓度调为1.0 mg/mL,同时加入L-Lys,使L-Lys的终浓度分别为0、1、5、 10 mmol/L和20 mmol/L。将各样品溶液分别进行未加热(25 ℃稳定30 min)、预加热(40 ℃加热60 min)和二段式加热(40 ℃加热60 min的基础上90 ℃加热30 min),形成不同加热条件下的肌球蛋白-L-Lys混合溶液。参考文献[11]方法,使用紫外-可见分光光度计,在340 nm波长处,测定样品的吸光度即为蛋白样品的浊度,每个样品设3 个平行。
1.3.5 L-Lys对肌球蛋白流变特性的影响
参考Verbeken等[14]的方法并加以调整。将肌球蛋白溶液的质量浓度调至15 mg/mL,同时加入L-Lys,使L-Lys的终浓度分别为0、1、5、10 mmol/L和20 mmol/L。选用流变仪的振荡模式,夹具型号为40 mmol/L平行板,间距为1 000 μm,将样品置于圆台上,修边后在周围滴上标准黏度液,防止样品蒸发。温度扫描时,振荡频率设置为0.1 Hz,应变为2%,以2 ℃/min的速率从25 ℃程序升温至90 ℃,再以4 ℃/min的速率从90 ℃程序降温至25 ℃,记录整个程序升温和程序降温过程中的储能模量(G’)、损耗模量(G”)和相位角(δ)。每个样品设3 个平行。
1.3.6 L-Lys对肌球蛋白凝胶强度的影响
参考Zhou Yanzi等[15]的方法并稍加改动。采用TA-XT Plus食品物性仪,测定肌球蛋白-L-Lys混合凝胶的破断力,以破断力的大小表征凝胶的强度。参数设定:探头选择P/0.5,测前速率1.5 mm/s,测试速率1.0 mm/s,测后速率1.0 mm/s,穿刺距离4 mm,触发力4 g。每个样品设3 个平行。
1.4 数据处理
数据的处理与分析采用Origin 8.0、SPSS Statistics 17.0和Microsoft Excel软件进行。
2 结果与分析
2.1 L-Lys对肌球蛋白溶液pH值的影响
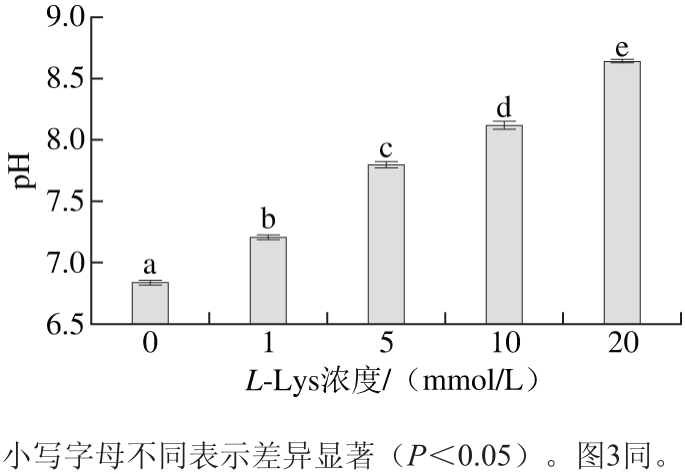
图1 肌球蛋白溶液pH值随L-Lys浓度的变化
Fig. 1 Changes in pH of myosin solutions with increasing concentration of L-Lys
由图1可知,L-Lys能够提高肌球蛋白溶液的pH值(P<0.05),且随着L-Lys浓度的增加,溶液pH值也越来越大。氨基酸的碱性不是—NH2表现的结合质子能力,而是—COO-表现的接受质子的能力,碱性氨基酸含有第2个碱性官能团(氨基、胍基、咪唑基),可以接受更多的H+而呈现较强碱性[16]。L-Lys为碱性氨基酸[17],添加的L-Lys浓度越大,则可接受的H+越多,溶液的碱性越强,pH值越大。
2.2 L-Lys对肌球蛋白溶液浊度的影响
表1 L-Lys浓度对肌球蛋白溶液浊度的影响
Table 1 Effect of L-Lys concentration on the turbidity of myosin solutions

注:小写字母不同表示差异显著(P<0.05)。
随着加热温度的升高和时间的延长,样品浊度显著增加,这是因为温度升高肌球蛋白会聚集,使光发生散射,所以浊度升高[18]。由表1可以看出,未加热时,添加1、5 mmol/L和10 mmol/L的L-Lys对溶液的浊度无显著影响,但添加20 mmol/L的L-Lys能够使溶液的浊度显著降低;经预加热后,溶液的浊度会随L-Lys浓度变化(1~20 mmol/L)而发生不同程度的降低,但降低的幅度与L-Lys的浓度未呈线性关系,这可能与40 ℃条件下蛋白容易复性导致溶液体系不稳定有关;二段式加热后,1~20 mmol/L的L-Lys均能使肌球蛋白溶液的浊度显著降低。结果显示,在同一加热方式下,L-Lys能够使溶液的浊度降低,一方面,这可能是因为带正电的L-Lys能够与带负电的肌球蛋白结合,从而降低了肌球蛋白之间在加热条件下相互结合的机会,抑制了蛋白的聚集;另一方面,可能是因为L-Lys的添加增加了溶液的pH值(图1),pH值的升高会增强肌球蛋白间的静电斥力,从而抑制蛋白的聚集,导致溶液的浊度降低。此外,Guo等[6]研究表明L-Lys能使肌球蛋白纤丝聚集作用减弱,溶解度增加,这可能也是浊度下降的原因之一。
2.3 L-Lys对肌球蛋白流变特性的影响
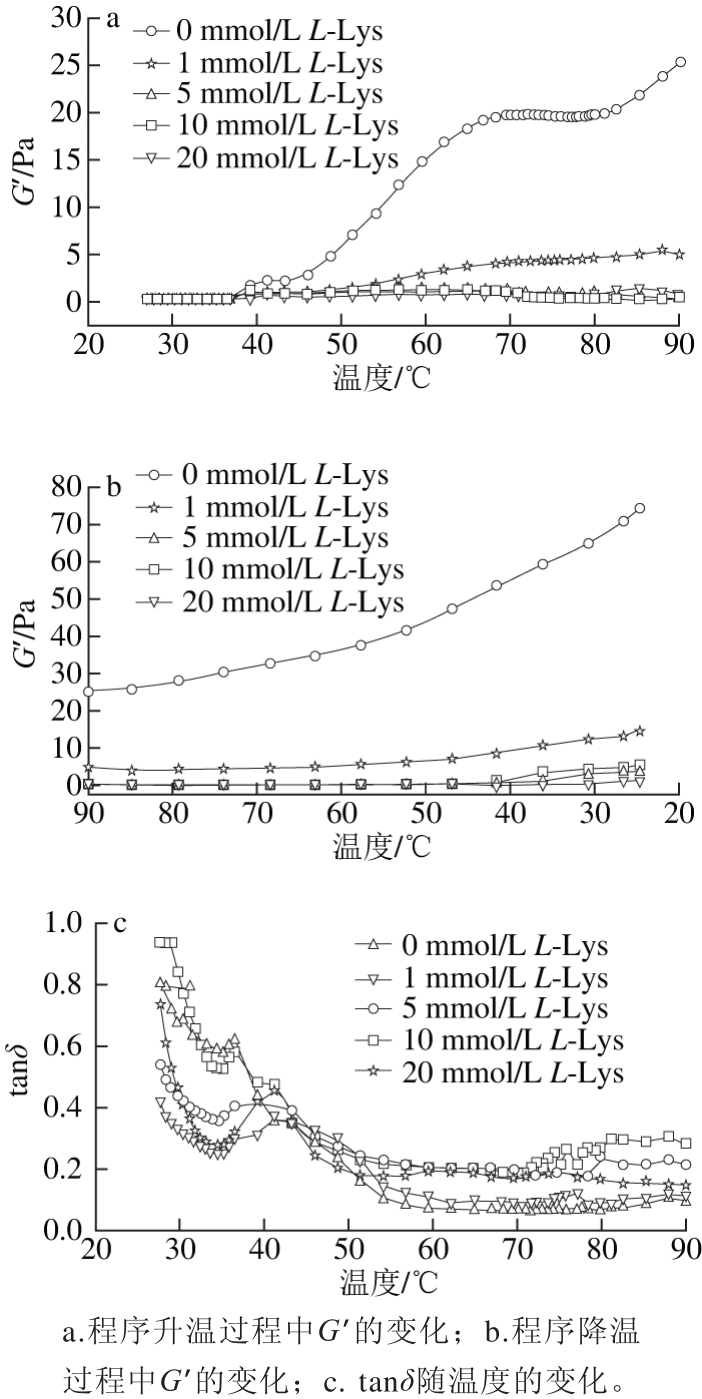
图2 L-Lys对肌球蛋白流变行为的影响
Fig. 2 Dynamic rheological properties of myosin solutions with various concentrations of L-Lys
流变学参数包括G’、G”和δ,分别表征凝胶体的弹性特征、黏性特征以及凝胶体是类似固体特征行为还是液体特征行为,tanδ的大小用黏性值与弹性值的比值来表示[19]。高的G’值代表蛋白质具有更好的凝胶化能力[20],由图2a、b可以看出,在程序升温和程序降温的过程中,添加L-Lys组的G’值均低于空白组,说明L-Lys降低了肌球蛋白的凝胶化能力,原因可能是L-Lys在加热的过程中增加了蛋白的流动性,抑制了热聚集[21]。此外,由图2c可知,在程序升温的过程中,添加L-Lys组的tanδ值先低于对照组后高于对照组,说明在加热结束后,添加L-Lys的样品更偏向于黏性流体。
表2 L-Lys对肌球蛋白溶液G’关键变化点的影响
Table 2 Key points of G’ of myosin solutions containing different concentrations of L-Lys
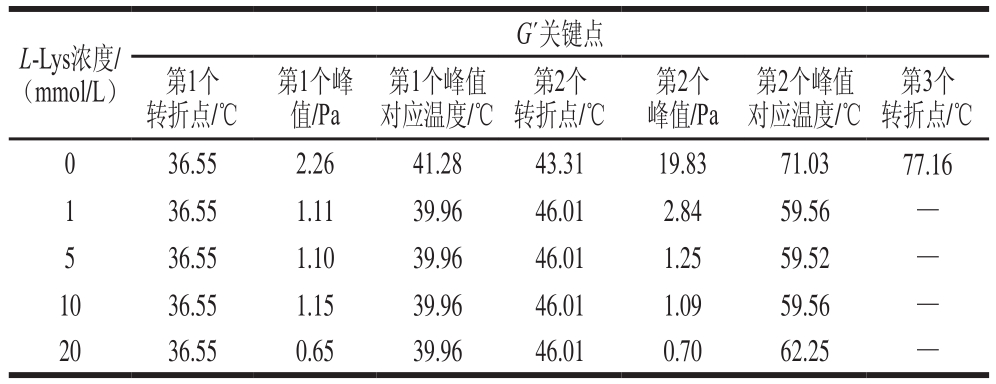
注:—.无检测值。
肌肉蛋白质的凝胶过程是一个多步骤的热力动力学过程,包括变性、凝集和三维网络结构的形成[22]。表2列出了L-Lys对肌球蛋白溶液G’关键变化点的影响结果,其中,G’的第1个峰值和第2个峰值对应的温度分别是蛋白变性和凝集的温度[23],对于空白组而言,在经历第3个转折点后G’处于持续增加的状态(图2a),表征的是肌球蛋白三维网络结构在该转折点处开始形成。加入L-Lys后,G’的第1个峰值和第2个峰值对应的温度均有所提前,表征蛋白变性和凝集的过程提前,说明L-Lys的添加使体系变得更不稳定,这与付渊等[24]研究发现的L-精氨酸可使肌球蛋白热稳定性下降的结论一致。另外,添加L-Lys后G’的峰值降低,且没有出现第3个转折点,说明L-精氨酸能够降低肌球蛋白的凝胶形成能力,且形成的凝胶网络强度较弱。此外,由图1可知,添加L-Lys后,溶液的pH值增加,Liu Ru等[25]曾报道:在一定范围内,G´值随pH值的增加而降低,所以L-Lys导致pH值的增加可能也是G’值降低的一个原因。
2.4 L-Lys对肌球蛋白凝胶强度的影响
为了直观地观察L-Lys对肌球蛋白凝胶强度的影响,本研究对制备好的肌球蛋白-L-Lys混合凝胶进行质构性能的检测,用破断力表征其凝胶强度。由图3可知,相对于空白组,添加了L-Lys的高浓度肌球蛋白热诱导凝胶强度显著降低(P<0.05),这与前面提到的L-Lys对肌球蛋白流变特性的影响所得出的结论一致。Ma Fei等[26]研究表明,在超高压的条件下向盐溶蛋白体系添加卡拉胶和CaCl2后,其凝胶强度显著降低(P<0.05),刘海梅等[27]发现较高浓度的CaCl2会使肌球蛋白重链交联受阻,凝胶强度降低,李睿智等[28]的实验表明鲢鱼鱼糜在凝胶过程中水分和凝胶特性会发生显著变化,许艳顺等[29]发现葡萄糖酸内酯能够诱导鲢鱼糜形成凝胶,且食盐添加量对内酯鱼糜凝胶的持水性和质构特性具有显著影响,刘茹等[30]认为鱼肉/猪肉复合肉糜凝胶的破断强度、凝胶强度和保水性均随着谷氨酰胺转移酶添加量的增加而增大。付渊等[24]推测精氨酸的添加能够显著改变肌球蛋白体系的pH值,导致凝胶强度降低,但Qin Hao等[21]发现添加精氨酸能够增加鸡胸肌肉盐溶蛋白的凝胶强度,这与本研究结果相反,可能与蛋白来源及氨基酸种类有关。L-Lys在凝胶形成过程中能够通过增加肌球蛋白的静电荷增强蛋白分子间的相互排斥作用,从而阻止肌球蛋白的相互聚集,最终导致凝胶强度下降。
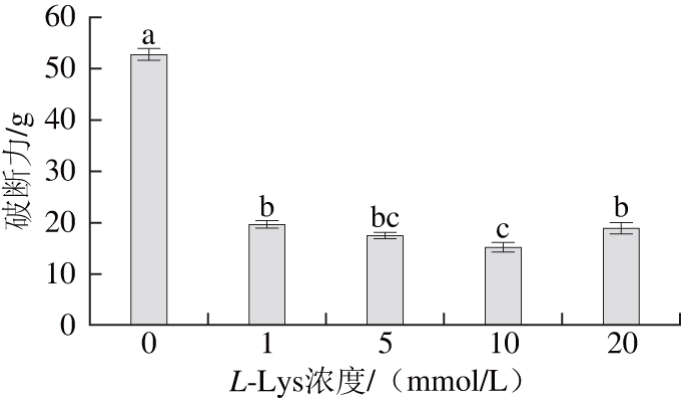
图3 L-Lys对肌球蛋白凝胶强度的影响
Fig. 3 Effects of L-Lys concentration on the gel strength of myosin gels
3 结 论
L-Lys随着其添加量的不同,可对鲢肌球蛋白的热聚集行为产生不同的影响。随着L-Lys浓度从1 mmol/L增加到20 mmol/L,肌球蛋白体系的pH值越来越高;在加热的条件下,L-Lys能够显著降低肌球蛋白溶液的浊度;L-Lys能够降低肌球蛋白的成胶能力和凝胶强度。
在肌球蛋白-L-Lys混合溶液中,带正电的L-Lys能够与带负电的肌球蛋白结合,从而减少了加热过程中肌球蛋白相互结合,抑制了肌球蛋白的热聚集;此外,L-Lys的添加显著提高了肌球蛋白体系的pH值,pH值的增大会使肌球蛋白间的静电斥力增强,从而抑制肌球蛋白在加热条件下的聚集。
参考文献:
[1] PARK J W. Surimi and surimi seafood[M]//LANIER T C,YONGSAWATDIGUL J, CARVAJAL-R ONDANELLI P. Surimi gelation chemistry. New York: CRC Press Inc., 2013: 101-140.
[2] LUCK J M. Annual review of biochemistry[J]. Endocrinology, 1945,37(4): 300. DOI:10.1210/endo-37-4-300.
[3] TSUNASHIMA Y, AKUTAGAWA T. Structure transition in myosin association with the change of concentration: solubility equilibrium under specified KCl and pH condition[J]. Biopolymers, 2004, 75(3):264-277. DOI:10.1002/bip.20114.
[4] FUKAZAWA T, HASHIMOTO Y, YASUI T. Effect of some proteins on the binding quality of an experimental sausage[J]. Journal of Food Science, 1961, 26(5): 541-549. DOI:10.1111/j.1365-2621.1961.tb00403.x.
[5] SAMEJIMA K, HASHIMOTO Y, YASUI T, et al. Heat gelling properties of myosin, actin, actomyosin and myosin-subunits in a saline model system[J]. Journal of Food Science, 1969, 34(3): 242-245.DOI:10.1111/j.1365-2621.1969.tb10331.x.
[6] GUO X Y, PENG Z Q, ZHANG Y W, et al. The solubility and conformational characteristics of porcine myosin as affected by the presence of L-lysine and L-histidine[J]. Food Chemistry, 2015, 170:212-217. DOI:10.1016/j.foodchem.2014.08.045.
[7] CHEN X, LI Y, ZHOU R, et al. L-histidine improves water retention of heat-induced gel of chicken breast myofibrillar proteins in low ionic strength solution[J]. International Journal of Food Science &Technology, 2016, 51(5): 1195-1203. DOI:10.1111/ijfs.13086.
[8] TAKAI E, YOSHIZAWA S, EJIMA D, et al. Synergistic solubilization of porcine myosin in physiological salt solution by arginine[J].International Journal of Biological Macromolecules, 2013, 62(11):647-651. DOI:10.1016/j.ijbiomac.2013.09.035.
[9] ARAKAWA T, TSUMOTO K. The effects of arginine on refolding of aggregated proteins: not facilitate refolding, but suppress aggregation[J]. Biochemical & Biophysical Research Commol/Lunications, 2003, 304(1): 148-152. DOI:10.1016/S0006-291X(03)00578-3.
[10] PARK J W, LANIER T C. Scanning calorimetric behavior of tilapia myosin and actin due to processing of muscle and protein purification[J]. Journal of Food Science, 1989, 54(1): 49-51.DOI:10.1111/j.1365-2621.1989.tb08564.x.
[11] GORNALL A G, BARDAWILL C J, DAVID M M. Determination of serum proteins by means of Biuret reaction[J]. Journal of Biological Chemistry, 1949, 177(2): 751-766.
[12] 叶蕾蕾, 吴晨曦, 刘茹, 等. 阳离子种类和添加量对鲢鱼糜凝胶力学特性的影响[J]. 食品安全质量检测学报, 2014(8): 2319-2326.
[13] TECHARATANAKRAI B, OKAZAKI E, OSAKO K. Effect of organic salts on setting gels and their corresponding acids on kamaboko gels prepared from squid Todarodes pacificus mantle muscle[J]. Fisheries Science, 2012, 78(3): 707-715. DOI:10.1007/s12562-012-0475-7.
[14] VERBEKEN D, NEIRINCK N, VAN DER MEEREN P, et al.Influence of κ-carrageenan on the thermal gelation of salt-soluble meat proteins[J]. Meat Science, 2005, 70(1): 161-166. DOI:10.1016/j.meatsci.2004.12.007.
[15] ZHOU Y Z, CHEN C G, CHEN X, et al. Contribution of three ionic types of polysaccharides to the thermal gelling properties of chicken breast myosin[J]. Journal of Agricultural & Food Chemistry, 2014,62(12): 2655-2662. DOI:10.1021/jf405381z.
[16] 乔明艳, 李全斌. 对生物化学中氨基酸分类有关问题的讨论[J]. 卫生职业教育, 2006, 24(23): 153-154.
[17] KAUSHIK S J, FAUCONNEAU B. Effects of lysine administration on plasma arginine and on some nitrogenous catabolites in rainbow trout[J]. Comparative Biochemistry & Physiology Part A Physiology,1984, 79(3): 459-462.
[18] GILL T A, CHAN J K, PHONCHAREON K F, et al. Effect of salt concentration and temperature on heat-induced aggregation and gelation of fish myosin[J]. Food Research International, 1992, 25(5):333-341. DOI:10.1016/0963-9969(92)90108-H.
[19] EGELANDSDAL B, MARTINSEN B, AUTIO K. Rheological parameters as predictors of protein functionality: a model study using myofibrils of different fibre-type composition[J]. Meat Science, 1995,39(1): 97-111. DOI:10.1016/0309-1740(95)80011-5.
[20] THAWORNCHINSOMBUT S, PARK J W. Effect of NaCl on gelation characteristics of acid-and alkali-treated pacific whiting fish protein isolates[J]. Journal of Food Biochemistry, 2007, 31(4): 427-455.DOI:10.1111/j.1745-4514.2007.00121.x.
[21] QIN H, XU P, ZHOU C L, et al. Effects of L-arginine on water holding capacity and texture of heat-induced gel of salt-soluble proteins from breast muscle[J]. LWT-Food Science and Technology, 2015, 63(2):912-918. DOI:10.1016/j.lwt.2015.04.048.
[22] 徐幸莲. 兔骨骼肌肌球蛋白浊度、溶解度及热诱导凝胶强度研究[D].南京: 南京农业大学, 2003: 5-6.
[23] 盖静. 不同加热温度对鳙鱼肌球蛋白聚集行为的影响及其机理研究[D]. 镇江: 江苏大学, 2016: 23-26.
[24] 付渊, 周存六. L-精氨酸对鸡胸肉中肌球蛋白凝胶特性的影响[J]. 肉类研究, 2016, 30(6): 6-9. DOI:10.15922/j.cnki.rlyj.2016.06.002.
[25] LIU R, ZHAO S M, LIU Y M, et al. Effect of pH on the gel properties and secondary structure of fish myosin[J]. Food Chemistry, 2010,121(1): 196-202. DOI:10.1016/j.foodchem.2009.12.030.
[26] MA F, CHEN C G, ZHENG L, et al. Effect of high pressure processing on the gel properties of salt-soluble meat protein containing CaCl2and κ-carrageenan[J]. Meat Science, 2013, 95(1): 22-26. DOI:10.1016/j.meatsci.2013.04.025.
[27] 刘海梅, 熊善柏, 谢笔钧. 钙离子对白鲢鱼糜热诱导凝胶化的影响[J]. 食品科学, 2006, 27(8): 87-90. DOI:10.3321/j.issn:1002-6630.2006.08.016.
[28] 李睿智, 王嵬, 仪淑敏, 等. 白鲢鱼鱼糜凝胶过程中水分及凝胶特性的变化[J]. 现代食品科技, 2016(5): 91-97.
[29] 许艳顺, 葛黎红, 姜启兴, 等. 盐添加量和热处理对内酯鱼糜凝胶品质的影响[J]. 食品工业科技, 2013, 34(11): 69-72.
[30] 刘茹, 汪丽, 熊善柏. 三种添加剂在鱼肉猪肉复合凝胶中的作用[J].食品工业科技, 2011, 32(9): 350-353.