乳化剂在现代食品工业中扮演重要的角色,在乳制品、酱汁及冰淇淋等甜品的工艺中应用广泛。多种蛋白质由于其两亲性结构和表面活性而具有良好的乳化性,蛋白吸附于油水界面阻止油滴的聚集,被视为环境友好型乳化剂。然而,蛋白的乳化活性在等电点或者高温和高盐的加工条件下大幅度降低。国内外学者讨论了美拉德反应的方法对糖基化产物物化性质的影响,如干热、湿热及超声辅助等方法,以及糖基化产物在水包油乳化剂和作为活性物质包封、运输载体方面的热点应用[1]。
多糖对蛋白的修饰在其乳化性应用上取得巨大的成就[2-7]。大豆分离蛋白(soy protein isolate,SPI)与麦芽糊精和阿拉伯胶干热产物都显著提高了乳液的乳化稳定性[2];大豆乳清蛋白与葫芦巴胶糖基化产物的粒径在蛋白等电点和高盐条件下显著减小,并且证明了热处理糖基化产物后(75 ℃和85 ℃)制备的乳液的性能更加稳定[3]。近些年,花生蛋白借助其营养价值和良好的表面活性受到了广泛的关注。花生蛋白与葡聚糖、麦芽糖共价接枝改善了花生蛋白在等电点的物化性质。在超声辅助条件下,不同制备参数快速得到不同接枝程度花生蛋白-麦芽糊精糖基化产物,表面疏水性变化明显,在乳化体系中的稳定性提高[7]。但是其加工性能易受到环境改变的影响。
葡聚糖在溶液中呈中性,分子的主链结构由α(1→6)糖苷键连接葡萄糖单位聚合而成,葡聚糖分子中也可能含有少量α(1→2)和α(1→4)等糖苷键,α(1→6)糖苷键增加了葡聚糖的水溶性,每个葡聚糖分子都有一个还原末端可以和氨基酸发生接枝反应[8-11]。作为中性多糖的葡聚糖具有简单的直链结构和良好的水溶性和稳定性。此外,葡聚糖尚有清除游离基、抗辐射、溶解胆固醇,预防高脂血症作用及抵抗滤过性病毒、真菌、细菌等引起的感染等作用,因此被广泛应用在蛋白质和多糖的糖基化研究中[12-14]。
纳米技术作为包埋活性物质的手段,能够增强人体对活性物质的吸收和起到控释的作用,在功能性食品和药物学领域中越来越受到关注。纳米包埋材料来源丰富,其中天然高分子材料,如固体脂、脂质体、蛋白质和多糖,由于其不同的特性及丰富的营养备受关注[15]。但是,可以广泛获得并且经济环保的植物蛋白(主要是大豆蛋白)在其等电点的应用受到极大限制[16]。糖基化产物作为克服蛋白质在等电点不具溶解性的绿色包埋介质在国内外被广泛研究。Yang Yuexi等[17]研究了大豆蛋白-大豆多糖增强了含有柠檬醛的水包油乳液的物理稳定性。Feng Jin等[18]研究了关于通过美拉德反应制备卵白蛋白-葡聚糖纳米凝胶提高姜黄素的生物利用价值,在等电点获得的稳定纳米凝胶作为包封材料显示出重要的意义。由于美拉德产物接枝程度不均一,是多种产物的混合体系,对其包埋效果产生一定的影响。
随着“大分子拥挤”体系在蛋白-多糖型美拉德反应领域的广泛研究,不同程度上达到了蛋白分子处于非聚集状态的反应效果,显著改善了糖基化产物的物化性能[19]。大分子拥挤体系产物在其功能上的应用效果也十分显著,作为乳化剂及活性物质运送基质具有重要意义。很多研究已对美拉德型蛋白-多糖糖基化产物的反应参数进行了讨论,大分子拥挤体系改变产物的接枝度,进而对其功能特性产生影响。在大分子拥挤体系的基础上,通过分级分离手段获得的糖基化产物的物化性质研究备受关注[20]。
本实验将通过美拉德反应制备SPI-葡聚糖共价接枝物,并且根据在酸性条件下溶解度的差异将接枝物分离的产物应用于蛋白等电点附近水包油乳液及制备姜黄素纳米颗粒体系中。着重研究等电点条件下制备的美拉德反应产物与中性条件下制备的产物在水包油乳化体系中的贮藏稳定性和对疏水活性物质姜黄素的运载性能,比较两组分在不同体系中的功能性质差异,为其工业应用提供指导。探讨改变乳液pH值、添加盐离子和热处理对乳液稳定性的影响;表征纳米颗粒的荷载率、粒度、电位和微观结构,对胶体和化学稳定性进行对比,引入了一种新的包装材料。
1 材料与方法
1.1 材料与试剂
脱脂大豆粕 山东禹王有限公司;姜黄素(纯度>90%) 美国Sigma公司。
1.2 仪器与设备
高效液相色谱系统(2487高效液相泵、2487紫外双波长检测器) 美国Waters公司;Himac CR 22G高速冷冻离心机、CS150NX超速离心机 日本Hitachi公司;Alpha-4冷冻干燥机 德国Christ公司;Rapid N Dumas定氮仪法国Elementar公司;DYCZ-30垂直板电泳仪 北京六一仪器厂;UV2300紫外-可见分光光度计 上海天美公司;Nano-ZS激光动态粒度扫描仪、Mastersizer 2000激光粒度仪 英国Malvern公司;MultiMode SPM扫描电子显微镜 美国Veeco公司。
1.3 方法
1.3.1 SPI的制备
根据Frankel等[21]的方法,从低温脱脂豆粕中提取。蛋白含量使用凯氏定氮法测定约为(86.86±0.79)%(N含量×6.25)。
1.3.2 SPI-葡聚糖糖基化物的制备及分级分离
在大分子拥挤体系条件下,通过美拉德反应制备SPI-葡聚糖糖基化产物。将SPI与葡聚糖(1∶3,m/m)混合后分散于磷酸盐缓冲溶液中(10 mmol/L,pH 6.8),质量浓度分别为5 g/100 mL和15 g/100 mL。溶液搅拌至充分溶解,于4 ℃过夜充分水化,恒温95 ℃条件下加热搅拌6 h,立即通过冰浴结束美拉德反应,得到样品为美拉德产物(SPI-dextran conjugates,CON)。用1 mol/L HCl溶液调节糖基化产物pH值至4.5,搅拌2 h后离心(10 000×g,30 min),其中取上清液回调pH 6.8并透析、冷冻干燥后得到组分MC45。离心后沉淀以质量比1∶10的比例用磷酸缓冲液复溶,使用1 mol/L NaOH溶液调节pH值至6.5,10 000×g离心30 min,将上清液透析、冷冻干燥后得到组分MC65。采用Dumas法测得冻干的MC45和MC65样品中蛋白质质量分数分别为4.21%和70.33%(干质量,N含量×5.71)。SPI与葡聚糖据上述比例混合、冻干,得到样品为MIX。
1.3.3 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分析
依据Laemmli[22]的方法进行SDS-PAGE。将样品置于样品缓冲液中(0.125 mol/L Tris-HCl缓冲液,含1 g/100 mL SDS,体积分数5%甘油溶液,体积分数2%2-巯基乙醇溶液和0.025 g/100 mL溴酚蓝溶液),电泳前煮沸5 min,10 000×g离心10 min,取上清液上样,上清液中蛋白质质量浓度为2.0 mg/mL,上样量为10 μL。分离胶为13%,浓缩胶为5%。凝胶电泳于恒定电流条件下进行,样品在浓缩胶中的电流设定为20 mA,样品进入浓缩胶与分离胶界面后,将电流调节为40 mA,当电泳跑至距离电泳槽橡胶底边约1.5 cm时,关闭电源。分别用考马斯亮蓝R-250试剂和PAS染色法对凝胶胶片进行蛋白质及糖染色。脱色完成后,对胶片拍照并进行分析。
1.3.4 分子质量分布测定
糖基化产物的生成及其分子质量分布使用高效液相色谱测定。SE-HPLC在Waters高效液相色谱系统中执行,色谱柱为TSK G 4000 PW XL(300 mm×7.8 mm,10 μm)。其中流动相为磷酸盐缓冲液(pH 7.2,50 mmol/L NaCl),样品过滤膜(0.45 μm)后利用超声脱气,洗脱速率为0.6 mL/min,洗脱液在波长280 nm处检测,柱温25 ℃。氨基酸标准品分别用磷酸缓冲液配制为质量分数0.5%的标准样品液,进样量为20 µL。取0.05 g样品用流动相配成质量浓度为5 g/L的样液,高速离心(9 300×g,10 min),上清液过0.22 µm水相微孔滤膜过滤,按照上述色谱条件进行分析。用于绘制分子质量分布标准曲线的标准物质分别为:甲状腺球蛋白(669 kDa)、铁蛋白(430 kDa)、醛缩酶(158 kDa)、伴清蛋白(75 kDa)和卵白蛋白(43 kDa)。
1.3.5 乳液的制备
参考Zhu Dan等[19]的方法,并稍作修改。将SPI、MIX、CON、MC45和MC65样品过夜水化,与纯化的玉米油混合。混合物通过均质后(10 000×g,2 min)再通过高压微射流处理2 次(40 MPa)。最后得到蛋白质量浓度为1 g/100 mL,油质量浓度为20 g/100 mL的乳液。在制备好的乳液中添加0.04 g/100 mL叠氮钠抑制微生物的生长。
乳液的酸耐受性测定:将新鲜的乳液调节pH值为3.0~7.0。乳液的热耐受性质测定:新鲜乳液调节pH值为3.0,30、50、70 ℃和90 ℃条件下进行热处理,处理时间为30 min,处理后立即冷却。离子浓度对乳液影响的测定:在新鲜的乳液中加入NaCl后使乳液中离子浓度为0、50、100 mmol/L和200 mmol/L,并且调节pH值为3.0。所有制备的乳液在室温条件下放置24 h后测定。
1.3.6 粒度分布和Zeta电位测定
样品的乳液采用Mastersizer 3000粒度分布仪测定乳状液滴的粒径大小。实验采用d43,体积平均直径来表征液滴平均粒径。
样品的Zeta电位采用Zetasizer Nano-ZS仪器测量。激光器为4 mV的He-Ne激光器,入射波长为633 nm,25 ℃条件下测量3 次取平均值。
1.3.7 姜黄素纳米颗粒的制备
参考Patel等[23]的方法制备姜黄素纳米颗粒。将样品(蛋白质的质量浓度为1 mg/mL)分散于磷酸缓冲液中(10 mmol/L,pH 6.8),滴加溶于无水乙醇的姜黄素溶液(3 mg/mL)最终质量浓度为150 μg/mL。离心(4 ℃,10 000×g,20 min)后,将上清液避光保存于4 ℃待用。
1.3.8 复合纳米颗粒姜黄素荷载量的测定
使用高效液相色谱系统进行荷载量分析,并连接紫外分光光度检测器[24]。将姜黄素溶于甲醇,在20.0 mL容量瓶中定容,终质量浓度为1.0 mg/mL。将溶液超声处理5 min。用甲醇(1.0 mg/mL)稀释标准溶液,试样制备不同质量浓度溶液备用(0.5~75.0 μg/mL)。
测定姜黄素的标准曲线为y=0.44x+0.001 5,x和y分别为吸光度和质量浓度(μg/mL),R2=0.999 4。取5 mg样品加入5 mL无水乙醇中充分振荡,以C18为分离柱,甲醇为流动相,利用高效液相色谱测定波长420 nm处的吸光度,根据标准曲线计算不同样品的姜黄素质量浓度。取3 次结果平均值。
1.3.9 1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力测定
参考O’Regan等[25]的方法分析纳米颗粒的抗氧化活性分析。用无水乙醇溶解19.72 mg姜黄素纳米颗粒定容至50 mL,用无水乙醇稀释10 倍备用;将稀释至200 μg/mL样品取1.5 mL和1.5 mL DPPH溶液充分混匀,静置30 min,在波长517 nm处测定待测样品的吸光度。DPPH自由基清除率按下式计算:
式中:A0和A1分别为蒸馏水和样品反应液吸光度。
1.3.10 纳米颗粒微观结构分析
将样品均匀黏附于扫描电子显微镜的样品台上进行喷金。对薄片进行拍照,拍照时的电压为15 kV。
2 结果与分析
2.1 SPI-葡聚糖糖基化物的形成与鉴定
2.1.1 SDS-PAGE分析
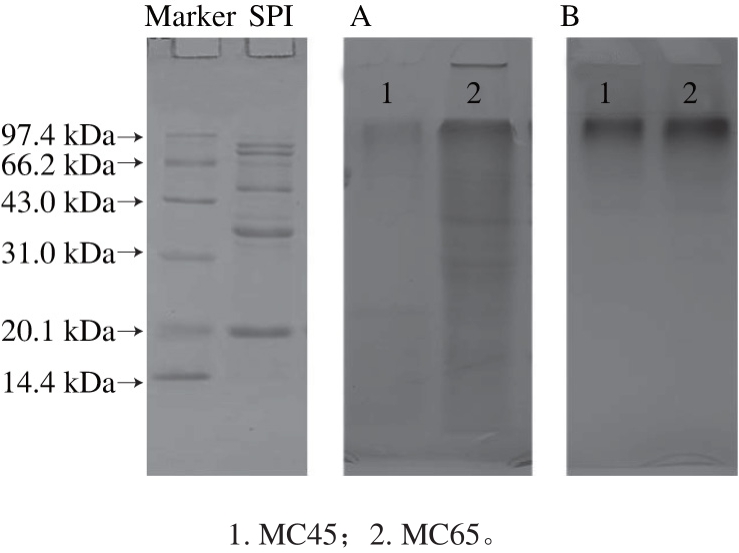
图1 蛋白质染色(A)和糖染色(B)的SDS-PAGE图
Fig. 1 SDS-PAGE patterns with protein staining (A) and carbohydrate staining (B)
通过SDS-PAGE鉴定共价复合物的形成,结果如图1所示。蛋白质染色和糖染色分离胶的顶部产生高分子质量的产物,证明大分子糖基化产物的形成。蛋白染色中,MC45组分的条带较MC65组分浅,而在糖染色中显示出相近的糖含量,说明了MC45组分接枝程度较高。蛋白质染色中,MC65组分底端中有小分子物质存在,条带较为分散。说明大分子体系条件下,蛋白发生水解生成小分子物质。糖基化物经过不同的pH值分级分离,得到的MC45组分中只存在大量高分子糖基化产物,而MC65中则存在较多小分子物质。
2.1.2 分子质量分析
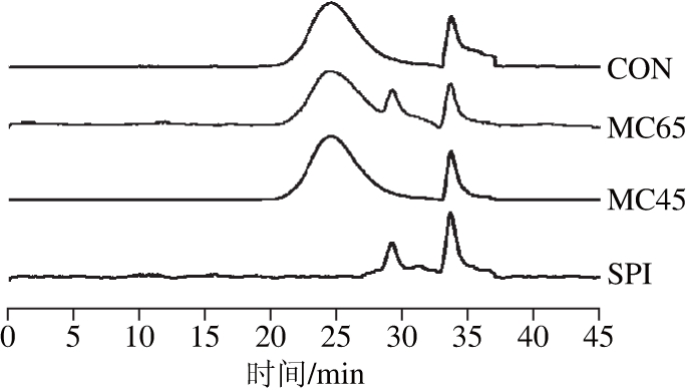
图2 糖基化分级分离组分的凝胶排阻色谱
Fig. 2 Gel permeation chromatography of conjugates and control samples
如图2所示,样品在33 min左右出现的峰形为溶剂峰。糖基化产物及其分级分离产物的出峰时间比较集中,进一步说明其分子质量的分布比较集中。与MC45相比,MC65组分出现2 个峰,在20~28 min出现的峰为糖基化产物的分子质量分布区间,紧随其后出现的小峰可能是糖基化过程中未反应及水解的蛋白组分,其平均分子质量为68 913 kDa。MC45组分的平均分子质量最大,为74 132 kDa,而SPI的平均分子质量为9 257 kDa。结合电泳分析可知,其多糖与蛋白的糖基化程度较高,同时存在的未反应葡聚糖分子的分子质量分布与MC45组分相近,故分子质量较高且分布集中。结合SDS-PAGE、分子质量分布结果分析以及Weng Jingyi等[20]的研究,大分子体系条件下制备的糖基化产物经过分级分离后制备得到的2 个组分显示出不同的物化特征,对其功能特性可能产生较大影响。
2.2 糖基化物稳定的乳液乳化性质分析
2.2.1 pH值对不同糖基化产物稳定的乳液性质影响
蛋白稳定乳液的突出问题是乳液在蛋白等电点附近的絮凝。与天然蛋白相比,很多共价复合物已显示出良好的酸耐受性能。然而,蛋白等电点附近乳液的稳定性仍然没有达到预期的效果。本实验希望通过分级分离手段改善乳液的酸稳定性。

图3 pH值对SPI、MIX和不同条件分级分离糖基化产物稳定乳液性质的影响
Fig. 3 Influence of pH on the properties of the emulsions stabilized with SPI, MIX and SPI-dextran conjugates
如图3所示,由SPI制备的乳液粒径明显受到pH值的影响,在等电点附近获得最大值(SPI制备的乳液最大粒径约为14 µm)。与中性条件下制备的乳液相比,当pH 4.5时,乳液的Zeta电位绝对值接近零,液滴间的相互排斥作用大大减弱,导致聚集作用增强。MIX制备乳液的Zeta电位与粒径变化与SPI在不同pH值条件下变化趋势几乎相近,说明未发生共价结合的葡聚糖对SPI的乳化性影响较小。由此可见,SPI-葡聚糖非共价混合物的乳化性能借助于蛋白表面静电相互排斥作用。
MC45组分制备的乳液平均粒径为10 µm左右,并且不随pH值的变化而变化。其Zeta电位值变化较小,绝对值接近零。以上现象出现的原因可能是由于MC45组分中的多糖分子对蛋白表面电荷的屏蔽作用,导致乳液液滴表面净电荷减少。MC45组分在SPI等电点附近优越的乳化性质由于糖基化程度较高,为体系增加了空间位阻作用,同时展现了葡聚糖耐受pH值干扰的特性,油滴周围覆盖的糖层明显削弱了酸性环境的不利影响。与天然蛋白相比,MC65组分制备的乳液液滴表面电荷较低,与未经过分级分离的糖基化产物相近。然而,MC65制备乳液的平均粒径随pH值变化显著,在SPI等电点附近平均粒径大于30 µm。由于其糖基化程度较低,空间位阻作用弱,并且组分中存在未参加糖基化过程的天然蛋白及水解物,导致乳液液滴聚集程度增加。在酸性环境中,葡聚糖的加入形成消耗性絮凝可能是MC65组分乳化稳定性降低的原因。
通过研究pH值对分级分离糖基化产物稳定乳液的研究,分级分离产物的乳化稳定性结果差异明显,对糖基化产物的功能特性开发应用具有指导意义。
2.2.2 离子浓度对不同糖基化产物稳定的乳液性质影响

图4 NaCl浓度对SPI、MIX和不同条件分级分离糖基化产物稳定乳液的性质的影响
Fig. 4 Influence of NaCl concentration on the properties of the emulsions stabilized with SPI, MIX and SPI-dextran conjugates
如图4a所示,随着离子浓度的增加,各组分制备的乳液液滴表面电荷显著减小。其结果与很多糖基化物研究结果一致,盐离子对带电颗粒溶液或乳液有一定的屏蔽作用[26-27]。在酸性条件下,SPI及MIX的平均粒径随着离子浓度的增加而增加。结合Zeta电位分析结果,进一步说明未经过糖基化的葡聚糖加入对SPI的修饰作用较弱,不能有效改善其功能特性。MC45组分制备的乳液Zeta电位值表明其表面电荷受到离子浓度的影响极小,其平均粒径也不受离子浓度的影响。MC45组分中葡聚糖与蛋白高效共价接枝,一定程度改变了蛋白的物化性质,进而对其乳化稳定性产生了积极作用。MC65组分制备的乳液受离子浓度影响很大,一方面其糖基化程度低,多糖对蛋白的修饰作用不明显,另一方面由于组分中存在可溶解的蛋白聚集物、天然蛋白及蛋白水解物等,导致其功能特性表征较差。
2.2.3 热处理对不同糖基化产物稳定的乳液性质影响

图5 热处理对SPI、MIX和不同条件分级分离糖基化产物稳定乳液性质的影响
Fig. 5 Influence of thermal treatment on the properties of the emulsions stabilized with SP, MIXI and SPI-dextran conjugates
如图5所示,在酸性条件下,天然SPI制备的乳液经过热处理后Zeta电位绝对值减小较其他组分明显,平均粒径随着温度的升高明显增加。当SPI与葡聚糖通过糖基化反应形成共价复合物后,由于葡聚糖包裹在蛋白的表面,共价复合物制备的乳液液滴表面电荷变化较小。MC45组分制备的乳液平均粒径在加热过程中变化较小,表现出较好的热稳定性。而MC65组分制备的乳液平均粒径在加热温度大于50 ℃时,粒径明显增大。
糖基化产物分级分离后在酸性条件下的乳化性质差异较大,对pH值、离子浓度以及温度耐受性差异明显。大分子体系环境中制备的糖基化产物经过分级分离对糖基化产物的研究具有重要意义。
2.3 姜黄素纳米颗粒性能表征
2.3.1 荷载量分析
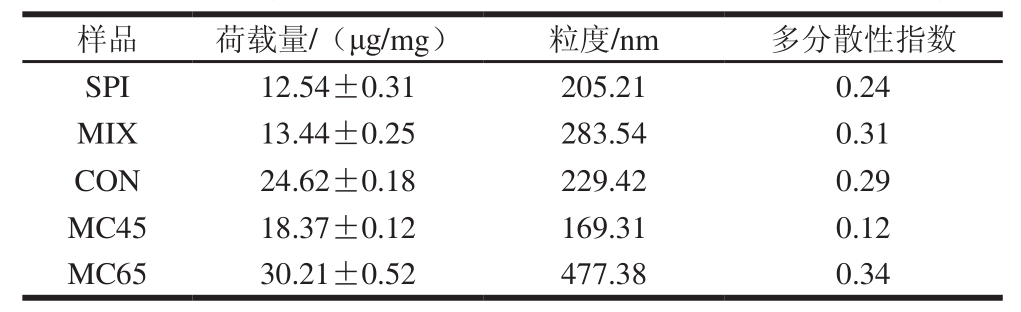
蛋白质-多糖纳米复合物已经广泛用于在过去几十年中的药物和营养物的递送[28-29]。姜黄素是近年来备受关注的生物活性成分,但在水中溶解性较差,生物利用率极低,并且在胃肠液中易发生化学或代谢降解。如图6所示,姜黄素水溶液浑浊,加入SPI、MIX和糖基化产物后溶液不同程度地澄清。结合姜黄素荷载量的结果,分析SPI、MIX和不同条件分级分离得到的糖基化产物对姜黄素荷载能力。中性条件下,MC45、MC65、CON 3 种复合纳米颗粒的姜黄素荷载量较高,分别为18.37、30.21 μg/mg和24.62 μg/mg(表1)。与SPI和MIX相比,糖基化产物具有良好的荷载能力。已有研究证明,蛋白质用作亲脂性化合物的物质空间,而由亲水性片段组成的壳保护蛋白质免于在胃中的酶水解,并确保在肠内控制释放。根据糖基化产物分离后得到不同组分的物化性质差异,亲疏水平衡后对姜黄素表现的运载能力也不同,糖基化程度较高的MC45组分由于其亲水性较强,故荷载量较低。

图6 姜黄素水溶液和不同组分荷载姜黄素蛋白水溶液外观图
Fig. 6 Visual observations of free curcumin and curcumin-loaded proteins
表1 SPI、MIX和分级分离糖基化产物包埋姜黄素的荷载量及粒度
Table 1 Loading amount and size of curcumin in SPI-dextran conjugates
2.3.2 DPPH自由基清除率分析

图7 SPI-葡聚糖分级分离糖基化产物DPPH自由基清除能力
Fig. 7 DPPH scavenging capacity of soy dextran conjugates and fractions
姜黄素多酚类物质,具有很强的游离基清除能力,但是在强氧化条件易发生氧化而失去活性。需要特殊的包埋材料保护。如图7所示,SPI和MIX组分在包埋姜黄素后对DPPH自由基的清除率接近,在50%~60%范围内。而CON对DPPH自由基的清除率为15%左右,其对游离基的敏感度下降,对姜黄素起到保护作用。MC45和MC65组分DPPH自由基的清除率分别为8.43%和18.33%。与MC65比较,MC45荷载量较小,但是对姜黄素活性物质的保护作用增强,原因是等电点条件下得到的MC45组分糖基化程度高。根据Weng Jingyi[20]、Sasahara[30]等的研究,糖基化产物经过分级分离后的产物接枝程度不同,MC45包埋姜黄素提高DPPH游离基稳定性的原因可能是由于其结构对外界氧化剂的隔绝作用增强,减少同外界的氧气、光线以及氧化剂的接触。
2.3.3 扫描电子显微镜分析
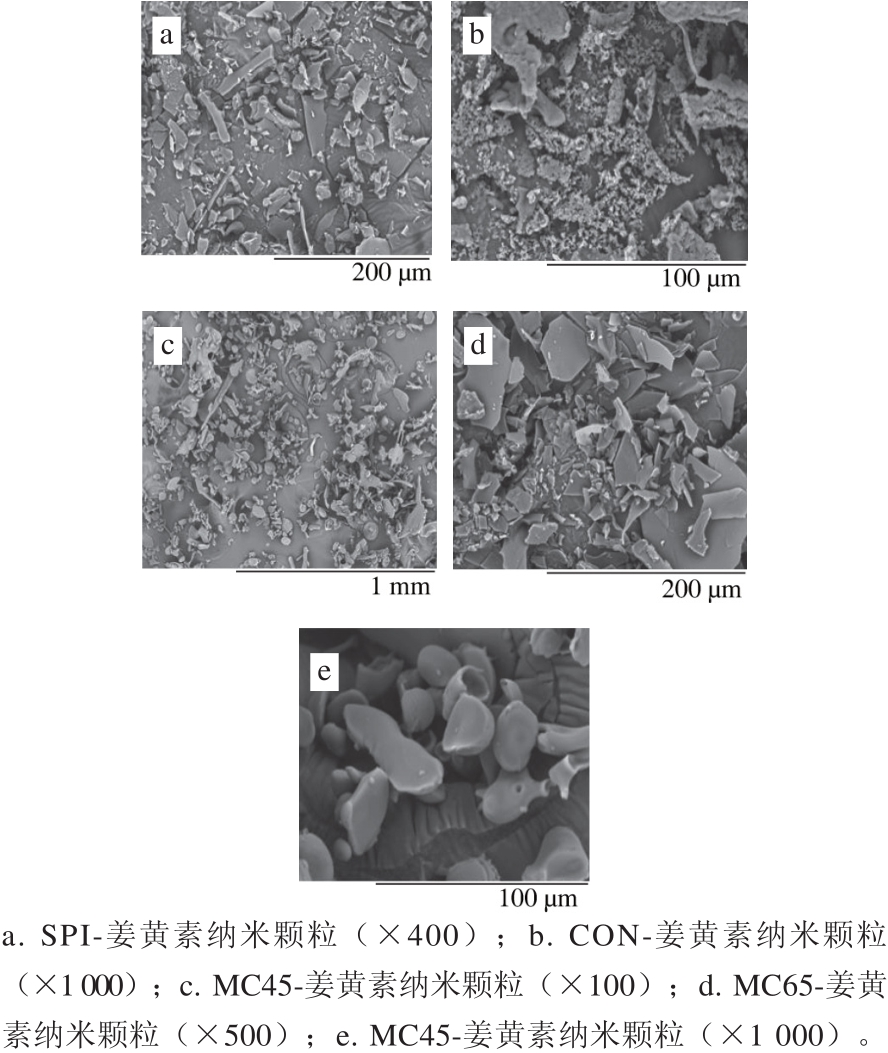
图8 SPI-葡聚糖分级分离糖基化产物包埋姜黄素电子显微镜扫描图
Fig. 8 SEM photos of curcumin-loading nanoparticles with SPI-dextran conjugates and fractions
由图8可知,SPI制备的姜黄素纳米颗粒呈现典型冷冻干燥样品无定型片状结构。图8b显示大量海绵状多孔结构,有利于样品水化,提高样品水溶解性,与本实验前文研究结果一致。如图8c所示,MC45组分包埋姜黄素纳米颗粒中显示较多的圆球形结构,放大倍数后可见完整的球状结构,表明MC45通过反溶剂法包埋姜黄素主要形成了球状纳米颗粒(图8e)。
3 结 论
大分子拥挤体系条件下,SPI和葡聚糖通过美拉德反应生成了糖基化产物,根据不同溶解度将产物分级分离得到MC45和MC65组分。两组分的乳化稳定性及制备得到的姜黄素纳米颗粒性能存在较大差异。MC45稳定的乳液对pH值、离子浓度和热处理都具有较高的耐受性,MC65稳定的乳液受环境因素干扰较大,乳化稳定性较差。相反,利用反溶剂纳米沉淀法制备的纳米颗粒使姜黄素水溶性得到改善,并且MC65的荷载量大于MC45。相对表面疏水性较强的MC65与姜黄素的相互作用更强,对姜黄素的荷载量更高,MC45则荷载量较低。分离分级手段制备的糖基化产物为其应用提供更多的可能性,需要进一步的研究。
参考文献:
[1] LEE Y Y, TANG T K, PHUAH E T, et al. New functionalities of Maillard reaction products as emulsifiers and encapsulating agents, and the processing parameters: a brief review[J]. Journal of the Science of Food & Agriculture, 2016, 97(5): 1379-1385. DOI:10.1002/jsfa.8124.
[2] FENG X, CHEN L, ZHU X W, et al. Comparative studies on the physicochemical properties of soy protein isolate-maltodextrin and soy protein isolate-gum acacia conjugate prepared through Maillard reaction[J]. Food Research International, 2013, 51(2): 490-495.DOI:10.1016/j.foodres.2013.01.012.
[3] KARAN M, CUI S W, GOFF H D. Emulsifying properties of soy whey protein isolate-fenugreek gum conjugates in oil-in-water emulsion model system[J]. Food Hydrocolloids, 2013, 30(2): 691-697.DOI:10.1016/j.foodhyd.2012.09.002.
[4] AL-HAKKAK J, AL-HAKKAK F. Functional egg white-pectin conjugates prepared by controlled Maillard reaction[J]. Journal of Food Engineering, 2010, 99(1): 152-159. DOI:10.1016/j.jfoodeng.2010.03.040.
[5] TAMNAK S, MIRHOSSEINI H, TAN C P, et al. Physicochemical properties, rheological behavior and morphology of pectin-pea protein isolate mixtures and conjugates in aqueous system and oil in water emulsion[J]. Food Hydrocolloids, 2016, 56: 405-416. DOI:10.1016/j.foodhyd.2015.12.033.
[6] TAKAHASHI K, LOU X F, ISHII Y, et al. Lysozyme-glucose stearic acid monoester conjugate formed through the Maillard reaction as an antibacterial emulsifier[J]. Journal of Agricultural & Food Chemistry,2000, 48(6): 2044-2049. DOI:10.1021/jf990989c.
[7] CHEN L, XUE H R, CHEN Z Y, et al. Comparative studies on the physicochemical properties of peanut protein isolate-polysaccharide conjugates prepared by ultrasonic treatment or classical heating[J].Food Research International, 2014, 57: 1-7. DOI:10.1016/j.foodres.2013.12.038.
[8] AJONGWEN W J, BARKER P E. Scale-up of non-aerated fermentation of dextransucrase and the industrial synthesis of dextran using enzymatic route[J]. Journal of Chemical Technology and Biotechnology, 1993, 56: 113-118. DOI:10.1002/chin.199316287.
[9] LAZIC M L, VELZKOVIC V B, VUCETIC J I, et al. Effect of pH and aeration on dextran production by Leuconostoc mesenteroides[J].Enzyme and Microbial Technology, 1993, 15(4): 334-338.DOI:10.1016/0141-0229(93)90160-4.
[10] EL-SAYED A H M M, MAHMOUD W M, COUGHLIN R W. Production of dextransucrase and dextran by Leuconostoc mesenteroides immobilized in calcium-alginate beads: II.Semicontinuous fed-batch fermentations[J]. Biotechnology and Bioengineering, 1990, 36: 346-353. DOI:10.1002/bit.260360405.
[11] LEBRUN L, JUNTER G A, JOUENNE T, et al. Exopolysaccharide production by free and immobilized microbial cultures[J]. Enzyme and Microbial Technology, 1994, 16(12): 1048-1054. DOI:10.1016/0141-0229(94)90141-4.
[12] NAESSENS M, CERDOBBEL A, SOETAERT W, et al. Leuconostoc dextransucrase and dextran: production, properties and applications[J].Journal of Chemical Technology and Biotechnology, 2005, 80(8): 845-860. DOI:10.1002/jctb.1322.
[13] SPOTTI M J, PERDUCA M, PIAGENTINI A, et al. Dose dextran molecular weight affect the mechanical properties of whey protein/dextran conjugate gels[J]. Food Hydrocolloids, 2013, 32(1): 204-210.DOI:10.1016/j.foodhyd.2012.12.022.
[14] SHAVEJ A, RICHARD F T, ALISTAIR C, et al. Dextran and 5-aminosalicylic acid (5-ASA) conjugates: synthesis, characterisation and enzymic hydrolysis[J]. Carbohydrate Research, 2006, 341(16):2694-2701. DOI:10.1016/j.carres.2006.08.015.
[15] WAN Z L, GUO J, YANG X Q. Plant protein-based delivery systems for bioactive ingredients in foods[J]. Food Function, 2015, 6(9): 2876-2889. DOI:10.1039/c5fo00050e.
[16] NISHINARI K, FANF Y, GUO S, et al. Soy proteins: a review on composition, aggregation and emulsification[J]. Food Hydrocolloids,2014, 39(2): 301-318. DOI:10.1016/j.foodhyd.2014.01.013.
[17] YANG Y X, CUI S W, GONG J, et al. A soy protein-polysaccharides Maillard reaction product enhanced the physical stability of oil-inwater emulsions containing citral[J]. Food Hydrocolloids, 2015, 48:155-164. DOI:10.1016/j.foodhyd.2015.02.004.
[18] FENG J, WU S S, WANG H, et al. Improved bioavailability of curcumin in ovalbumin-dextran nanogels prepared by Maillard reaction[J]. Journal of Functional Foods, 2016, 27: 55-68.DOI:10.1016/j.jff.2016.09.002.
[19] ZHU D, DAMODARAN S, LUCEY J A. Physicochemical and emulsifying properties of whey protein isolate (WPI)-dextran conjugates produced in aqueous solution[J]. Ournal of Agricultural &Food Chemistry, 2010, 58(5): 2988-2994. DOI:10.1021/jf903643p.
[20] WENG J Y, QI J R, YIN S W, et al. Fractionation and characterization of soy β-conglycinin-dextran conjugates via macromolecular crowding environment and dry heating[J]. Food Chemistry, 2016, 196: 1264-1271. DOI:10.1016/j.foodchem.2015.10.072.
[21] FRANKEL E, HUANG S, KANNER J, et al. Interfacial phenomena in the evaluation of antioxidants: bulk oils vs. emulsions[J]. Journal of Agricultural and Food Chemistry, 1994, 42: 1054-1059. DOI:10.1021/jf00041a001.
[22] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227(5259): 680-685.
[23] PATEL A, HU Y, TIWARI J K, et al. Synthesis and characterisation of zein-curcumin colloidal particles[J]. Soft Matter, 2010, 6(24): 6192-6199. DOI:10.1039/C0SM00800A.
[24] FONSECA-SANTOS B, GREMIÃO M P D, CHORILLI M. A simple reversed phase high-performance liquid chromatography (HPLC)method for determination of in situ gelling curcumin-loaded liquid crystals in in vitro performance tests[J]. Arabian Journal of Chemistry,2016, 6(10): 1-14. DOI:10.1016/j.arabjc.2016.01.014.
[25] O’REGAN J, MULVIHILL D M. Preparation, characterisation and selected functional propertie of sodium caseinate-maltodextrin conjugates[J]. Food Chemistry, 2009, 115: 1257-1267. DOI:10.1016/j.foodchem.2009.01.045.
[26] QIAN C, DECKER E A, XIAO H, et al. Comparison of biopolymer emulsifier performance in formation and stabilization of orange oil-inwater emulsions[J]. Journal of the American Oil Chemists’ Society,2011, 88(1): 47-55. DOI:10.1007/s11746-010-1658-y.
[27] ZHANG J B, WU N N, LAN T, et al. Improvement in emulsifying properties of soy protein isolate by conjugation with maltodextrin using high-temperature, short-time dry-heating Maillard reaction[J].International Journal of Food Science & Technology, 2014, 49(2):460-467. DOI:10.1111/ijfs.12323.
[28] CHEN F P, OU S Y, TANG C H. Core-shell soy protein-soy polysaccharide complex (nano) particles as carriers for improved stability and sustained release of curcumin[J]. Journal of Agricultural &Food Chemistry, 2016, 64: 5053-5059. DOI:10.1021/acs.jsfc.6b01176.
[29] WANG C N, LIU Z J, XU G R, et al. BSA-dextran emulsion for protection and oral delivery of curcumin[J]. Food Hydrocolloids, 2016,61: 11-19. DOI:10.1016/j.foodhyd.2016.04.037.
[30] SASAHARA K, MCPHIE P, MINTON A P. Effect of dextran on protein stability and conformation attributed to macromolecular crowding[J]. Journal of Molecular Biology, 2003, 326(4): 1227-1237.DOI:10.1016/S0022-2836(02)01443-2.