玉米蛋白粉中约含62%~71%的蛋白质,是湿法玉米淀粉加工中产量最大、蛋白质含量最高的副产物。玉米蛋白的主要组分是玉米醇溶蛋白(65%~68%)和谷蛋白(22%~33%)[1]。玉米醇溶蛋白的主要氨基酸组成是亮氨酸(约占20%)、谷氨酸(包含谷氨酸钠)(约占21%~26%)、脯氨酸(约占10%)和丙氨酸(约占10%)[2],其二级结构以螺旋型结构为主[3]。玉米醇溶蛋白的氨基酸组成和结构特点导致其水溶性差、疏水性较强,限制了其在食品工业中的应用。另外,在玉米醇溶蛋白的多肽链中存在多种生物活性的功能区,如抗氧化、抗高血压、促进乙醇代谢等多肽功能序列[4-6],也因其水溶性差而不能表现出来。所以,要使玉米醇溶蛋白的生理功能和加工特性都能表现出来,必须要改善其水溶性。
目前,食品蛋白质的改性主要是采用美拉德反应。美拉德反应是指还原糖与氨基酸、蛋白质之间的复杂反应。美拉德反应能够显著改善蛋白质的溶解性、乳化性、泡沫性、凝胶性以及抗氧化活性[7-11]。然而,美拉德反应难以控制糖基化度,还会导致产生致突变物而存在安全隐患,所以需要研究一种更安全、更有效的方法来替代美拉德反应进行食品蛋白质的糖基化修饰。
转谷氨酰胺酶(transglutaminase,TGase,EC 2,3,2,13)属于酰基转移酶,能催化蛋白质中谷氨酰胺残基的γ-甲酰胺(供体)和不同化合物的ε-氨基(受体)之间异肽键的形成[12]。如果受体由含有赖氨酸残基的蛋白质提供,则发生蛋白质分子内或分子间的交联反应;如果受体由含有伯胺基团的糖提供,则发生糖与蛋白质的共价结合反应,即发生蛋白质的酶法糖基化修饰。已有研究表明,TGase催化的蛋白质糖基化反应能够增强蛋白质的热稳定性,改善蛋白质的溶解性、乳化性、起泡性、流变学性质等功能性质[13-15],并且其反应条件比美拉德糖基化更温和,不存在美拉德反应中所存在的副反应。
玉米蛋白含有高比例的酰胺基氨基酸,且赖氨酸残基含量少,因此,在含有伯胺基团的糖的反应体系中,TGase催化的糖基化反应主要发生在玉米蛋白与供糖体之间,而发生在蛋白质之间的交联反应几率低,因此,玉米蛋白是酶法糖基化修饰的良好底物。目前为止,鲜见壳寡糖酶法糖基化修饰玉米醇溶蛋白的相关文献报道。在本课题组的前期工作中,已经确定了TGase催化壳寡糖与玉米醇溶蛋白分子共价结合的糖基化反应条件[16]。本实验在前期工作基础上,研究糖基化反应对玉米醇溶蛋白功能性质的影响,为糖基化修饰玉米醇溶蛋白在食品工业中的应用提供参考依据。
1 材料与方法
1.1 材料与试剂
玉米蛋白粉由中粮生化能源(龙江)有限公司提供,外观呈金黄色颗粒状。
微生物TGase(酶活力1 000 U/g) 泰兴市一鸣生物制品有限公司;壳寡糖(脱乙酰度90%,平均分子质量1 500 Da) 山东博智汇力生物科技有限公司;8-苯氨基-1-萘磺酸铵盐(8-anilinonaphthalene-1-sulfonic acid,ANS)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2-脱氧-D-核糖 美国Sigma公司;其他试剂均为国产分析纯。
1.2 仪器与设备
PC/PLCLD-53真空冷冻干燥机 美国Millrock公司;TDL-5-A离心机、DL-1集热式磁力加热搅拌器上海安亭科学仪器厂;pB-10 pH计 北京赛多利斯仪器有限公司; IKA T25高剪切分散乳化机 德国IKA集团;RF-530荧光分光光度计 日本岛津公司;Zetasizer Nano ZS90电位分析仪 英国Malvern公司;Spectrum One傅里叶变换红外光谱仪 美国Perkin Elmer公司。
1.3 方法
1.3.1 玉米醇溶蛋白的糖基化修饰
向3%的玉米醇溶蛋白悬浮液中添加壳寡糖,保证反应体系中蛋白质酰基供体与壳寡糖酰基受体的物质的量比为1∶3(玉米醇溶蛋白与壳聚糖的质量比为5∶4.026),用浓度为2 mol/L NaOH溶液调节pH值至7.7,按60 U/g蛋白的加酶量加入TGase,反应混合物充分混匀后,置于37 ℃恒温水浴振荡器中反应8 h。反应结束后,置于85 ℃水浴锅中灭酶5 min,冷却至室温。4 ℃透析除去反应体系中未反应的壳寡糖,样品冷冻干燥后即为糖基化玉米醇溶蛋白。在上述反应体系中,不加壳寡糖时制备交联玉米醇溶蛋白。在此条件下,玉米醇溶蛋白糖基化的反应得率为(69.97±0.39)%,交联玉米醇溶蛋白的反应得率为(5.15±0.98)%。在进行物化性质和抗氧化活性测定时,采用离心的方法将发生糖基化或交联的玉米醇溶蛋白与未反应完全的玉米醇溶蛋白分离。
1.3.2 玉米醇溶蛋白及其糖基化修饰产物表面疏水性的测定
参照Kato等[17]的方法,略有改动。称取玉米醇溶蛋白和糖基化修饰产物样品各0.3 g,分别加入30 mL 0.01 mol/L的磷酸盐缓冲溶液(phosphate buffered solution,PBS,pH 7.0),放在室温条件下进行溶解。24 h后蛋白质样品在10 000 r/min离心10 min,用Folin-酚法测定上清液中的蛋白质含量,然后用0.01 mol/L的PBS(pH 7.0)稀释该上清液得到系列质量浓度(0.01~0.2 mg/mL)的蛋白质溶液。取蛋白质溶液4 mL,加入20 μL ANS(8 mmol/L,用pH 7.0的0.01 mol/L PBS配制),旋涡混匀,在室温条件避光反应15 min。在激发波长390 nm、发射波长470 nm以及狭缝5 nm的条件下,测定ANS结合物的相对应荧光强度,以相对荧光强度对蛋白质质量浓度作图,以线性关系良好的回归曲线的斜率表示表面疏水性。
1.3.3 玉米醇溶蛋白及其糖基化修饰产物乳化性及乳化稳定性的测定
采用浊度法,测定方法参照文献[18]。
1.3.4 玉米醇溶蛋白及其糖基化修饰产物起泡性及泡沫稳定性的测定
采用搅打法,测定方法参照文献[18]。
1.3.5 玉米醇溶蛋白及其糖基化修饰产物持水性的测定
取10 mL离心管,准确称取0.1 g玉米醇溶蛋白及其糖基化修饰产物(以蛋白基计),分别加入5 mL蒸馏水,搅拌使蛋白质样品与水充分混合。在室温放置30 min后,10 000 r/min离心30 min,倒出上清液,称沉淀质量m2,采用Folin-酚法测上清液蛋白质含量m1。样品持水性的计算公式如下:
式中:m0为加入蛋白质干质量/g;m1为上清液中蛋白质质量/g;m2为离心后沉淀质量/g。
1.3.6 玉米醇溶蛋白及其糖基化修饰产物吸油性的测定取10 mL离心管,准确称取0.1 g玉米醇溶蛋白及其糖基化修饰产物(以蛋白基计),分别加入5 mL大豆色拉油,混匀,室温放置30 min后10 000 r/min离心30 min,移除上清液中的油,测量油的体积,蛋白质的吸油率用每克蛋白质吸收油的体积表示。样品吸油率的计算公式如下:
式中:V1为大豆色拉油总体积/mL;V0为未被吸附的大豆色拉油体积/mL;m为样品质量/g。
1.3.7 玉米醇溶蛋白及其糖基化修饰产物的红外光谱分析
将蛋白样品进行压片制样,用傅里叶红外光谱仪测定波数为4 000~400 cm-1的红外光谱,分辨率4 cm-1,波数精度0.01 cm-1,扫描次数32 次,环境温度25 ℃。利用Omnic V8.0软件对谱图进行处理。
1.3.8 玉米醇溶蛋白及其糖基化修饰产物抗氧化活性的测定
抗氧化活性测定指标包括DPPH自由基清除活性、超氧阴离子自由基清除活性、羟自由基清除活性、还原力和亚铁离子螯合能力,测定方法参照文献[19]。
1.3.9 玉米醇溶蛋白及其糖基化修饰产物游离氨基含量的测定
采用OPA法[20],利用L-亮氨酸标准曲线计算样品中游离氨基的含量,结果以mol/kg蛋白质表示。
1.3.10 玉米醇溶蛋白及其糖基化修饰产物Zeta电位的测定
将待测样品放入Zeta电位分析仪中,设定测量时间为2 min,溶剂的保留指数为1.326,温度为25 ℃的条件下进行测定。
1.4 数据分析
所有数据均以 ±s表示,应用SPSS 19.0统计软件进行数据处理。采用多重比较进行差异显著性分析,P小于0.05表示具有显著性差异。
2 结果与分析
2.1 玉米醇溶蛋白及其糖基化修饰产物的物化性质
2.1.1 玉米醇溶蛋白及其糖基化修饰产物的表面疏水性
疏水性在蛋白质构象及与其他蛋白质的相互作用等方面具有重要的作用,并且被认为与蛋白质的功能性质密切相关。以玉米醇溶蛋白和交联玉米醇溶蛋白为双对照,对糖基化玉米醇溶蛋白的表面疏水性进行测定,结果如图1所示。
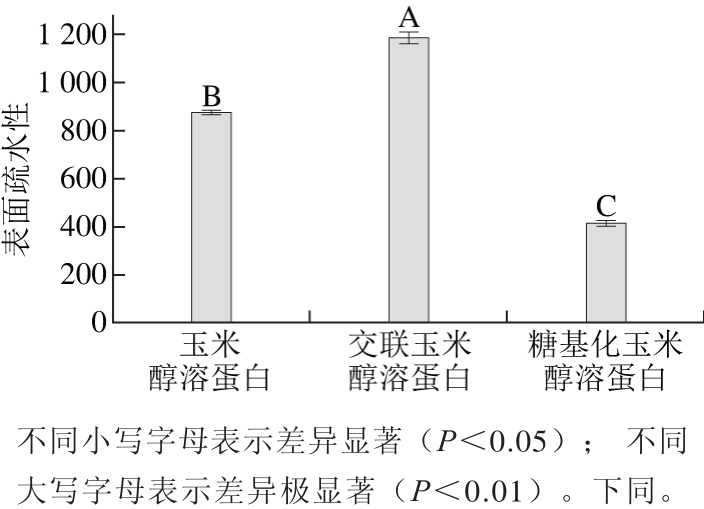
图1 玉米醇溶蛋白及其糖基化修饰产物的表面疏水性
Fig. 1 Surface hydrophobicity of zein and its modified products
由图1可以看出,与玉米醇溶蛋白和交联玉米醇溶蛋白相比,糖基化玉米醇溶蛋白的表面疏水性显著降低。壳寡糖分子中含有较多的羟基,所以糖基的导入会降低玉米醇溶蛋白的表面疏水性。交联反应使表面疏水性显著增加的可能原因是TGase的作用导致了玉米醇溶蛋白结构伸展,使包埋在蛋白质分子内部的疏水性氨基酸暴露出来,因而交联玉米醇溶蛋白的表面疏水性增加,这与Jiang Shujuan[13]和Song Chunli[14]等的报道结果相一致。
2.1.2 玉米醇溶蛋白及其糖基化修饰产物的乳化性和乳化稳定性
蛋白质的乳化能力包括乳化性和乳化稳定性两个指标。乳化性指每克蛋白质在转变前所能乳化油的体积,而乳化稳定性指蛋白质维持稳定的分散体系而不被外界破坏的能力[21]。分别测定玉米醇溶蛋白、交联玉米醇溶蛋白和糖基化玉米醇溶蛋白的乳化性和乳化稳定性,结果如图2所示。
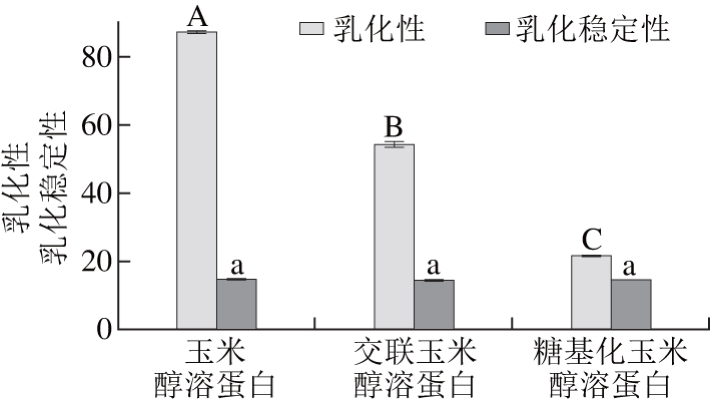
图2 玉米醇溶蛋白及其糖基化修饰产物的乳化性和乳化稳定性
Fig. 2 Emulsifying capacity and emulsion stability of zein and its modified products
由图2可以看出,玉米醇溶蛋白的乳化性最高,而糖基化玉米醇溶蛋白的乳化性最低。3 种样品的乳化稳定性之间无显著性差异(P>0.05)。蛋白质的乳化性与其溶解性及表面疏水性等因素有关,糖基化修饰后,玉米醇溶蛋白的表面疏水性降低,表面吸附能力下降,不能阻止油滴的聚结,同时整个体系的稳定性下降,导致乳化能力降低[20]。交联玉米醇溶蛋白的乳化能力也降低,可能的原因是交联反应产生了高分子聚合物,导致交联玉米醇溶蛋白的溶解性降低,进而使其乳化性降低。这与TGase催化芸豆分离蛋白的交联反应破坏了蛋白质的乳化性的结果相一致[22]。
2.1.3 玉米醇溶蛋白及其糖基化修饰产物的持水性和吸油性
持水性指在加工过程中,对蛋白质中的水分以及添加到制品中参与加工的水分的保持能力;吸油性指蛋白质产品吸附油的能力[23]。以玉米醇溶蛋白和交联玉米醇溶蛋白为双对照,在蛋白质质量浓度相同的条件下测定糖基化修饰对玉米醇溶蛋白持水功能和吸油性的改善程度,结果如图3所示。
从图3可以看出,玉米醇溶蛋白的持水性最高,其次是交联玉米醇溶蛋白,糖基化玉米醇溶蛋白的持水性最低。蛋白质具有良好持水性需要具备3 个条件:1)蛋白质复水后是否能充分溶胀但不溶解;2)蛋白质颗粒复水后具有很高的黏度;3)蛋白质可以形成凝胶网络[24]。玉米醇溶蛋白经糖基化修饰后表面疏水性下降、溶解性增加,在水溶液中呈现溶解状态而非溶胀状态,故持水性降低。玉米醇溶蛋白本身虽然疏水性强,但因其球状体颗粒间存在间隙,测定时会有一部分水阻留在间隙内,使得其持水性较高。

图3 玉米醇溶蛋白及其糖基化修饰产物的持水性和吸油性
Fig. 3 Water-binding and oil-binding capacities of zein and its modified products
从图3还可以看出,原玉米醇溶蛋白的吸油性最大,而糖基化玉米醇溶蛋白的吸油性最低。可能的原因是糖基化修饰改善了玉米醇溶蛋白的溶解性,使油与玉米醇溶蛋白之间的疏水作用减弱,所以其吸油性降低。玉米醇溶蛋白与交联玉米醇溶蛋白的吸油性间没有显著差异。TGase处理的大豆蛋白的持油性增加,与本研究结果不一致。分析可能的原因是,TGase处理的大豆蛋白同时发生了分子间和分子内的交联反应,大豆蛋白溶解性改善的同时也生成了一些大分子物质,这些大分子物质具有吸油性[13]。而在本实验中,糖基化反应只发生在玉米醇溶蛋白和壳寡糖之间,没有或仅有少量的分子内交联产生的大分子物质,溶解性改善的更好,导致吸油性下降。
2.1.4 玉米醇溶蛋白及其糖基化修饰产物的起泡性和泡沫稳定性
蛋白质起泡性体现了蛋白质液相体系形成稳定的包裹小气体的黏层能力。采用搅打法测定玉米醇溶蛋白、交联玉米醇溶蛋白、糖基化玉米醇溶蛋白的起泡性和泡沫稳定性,结果如图4所示。
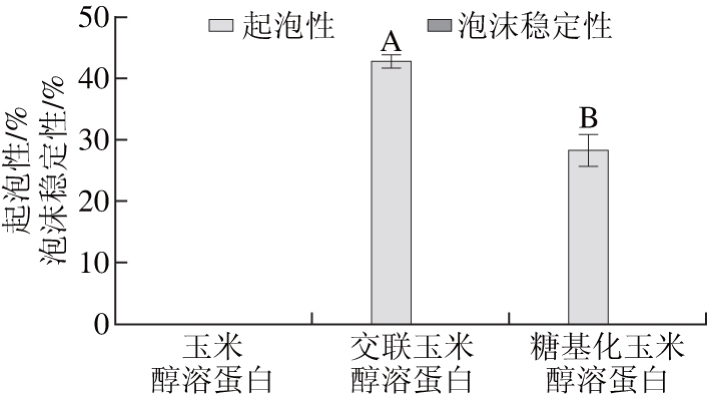
图4 玉米醇溶蛋白及其糖基化修饰产物的起泡性和泡沫稳定性
Fig. 4 Foaming ability and foam stability of zein and its modified products
由图4可以看出,玉米醇溶蛋白本身没有起泡能力,交联玉米醇溶蛋白的起泡性最高,为42.60%,糖基化玉米醇溶蛋白的起泡性为28.16%。3 种蛋白样品溶液在搅打后形成的细小泡沫会迅速形成大的泡沫而破裂,导致3 种醇溶蛋白样品均不具有泡沫稳定性。交联玉米醇溶蛋白起泡性能的提高可能是因为TGase的作用导致玉米醇溶蛋白结构伸展,在搅拌时产生大的界面面积进而增强起泡的能力。而糖基化玉米醇溶蛋白起泡性能的增强是由于糖基导入玉米醇溶蛋白分子中使蛋白溶解性增强的同时,提高了体系的黏度,当受到急速机械搅拌时,大量气体混入形成气液界面,溶液中的蛋白质快速吸附至气液界面,表面张力降低,起泡性能增强。
2.2 玉米醇溶蛋白及其糖基化修饰产物的红外光谱分析

图5 玉米醇溶蛋白及其糖基化修饰产物的红外光谱图
Fig. 5 FT-IR spectra of zein and its modified products
从图5可以看出,与玉米醇溶蛋白和交联玉米醇溶蛋白相比,糖基化玉米醇溶蛋白在波数1 140~1 023 cm-1范围内明显不同,而在此范围内,玉米醇溶蛋白和交联玉米醇溶蛋白基本没有差异,说明交联没有显著影响玉米醇溶蛋白基团的振动。波数1 080~1 025 cm-1处的峰是环状COH,COC和CH2OH的C—O伸缩振动区(ν(C—O))[25]。波数1 050~1 150 cm-1处的峰是ν(C—O)和—OH的变形振动区[15]。糖基化玉米醇溶蛋白在1 075.74 cm-1处的伸缩振动显著增强,说明糖基化玉米醇溶蛋白含有更多的C—OH,也进一步说明在TGase的催化下,壳寡糖与玉米醇溶蛋白之间发生了共价结合,而与玉米醇溶蛋白共价结合的壳寡糖使玉米醇溶蛋白的水溶性增强,疏水性性能下降,与2.1.1节部分的实验结果相一致。
2.3 玉米醇溶蛋白及其糖基化修饰产物的抗氧化活性
2.3.1 玉米醇溶蛋白及其糖基化修饰产物的DPPH自由基清除活性
由图6可知,随着质量浓度的增加,3 种蛋白样品对DPPH自由基的清除能力均呈逐渐增加的变化趋势。在相同质量浓度下,壳寡糖糖基化修饰玉米醇溶蛋白的DPPH自由基清除率均高于玉米醇溶蛋白,而玉米醇溶蛋白和交联玉米醇溶蛋白的DPPH自由基清除能力无显著差异。通过EC50值的计算,玉米醇溶蛋白的EC50值为1.776 mg/mL,交联玉米醇溶蛋白的EC50值为2.317 mg/mL,糖基化玉米醇溶蛋白的EC50值为0.945 mg/mL。

图6 不同质量浓度条件下玉米醇溶蛋白及其糖基化修饰产物的DPPH自由基清除率
Fig. 6 DPPH radical scavenging capacities of zein and its modified products at different concentrations
DPPH是一种以氮为中心很稳定的自由基,如果受试物能清除DPPH自由基,则说明受试物具有供氢或接受电子的能力[16]。通过上述结果可知,与玉米醇溶蛋白相比,糖基化玉米醇溶蛋白的DPPH自由基清除率显著增高,可能是由于糖基化产物中的壳寡糖可以提供更多的氢原子与DPPH自由基反应,以形成稳定的DPPH-H分子,使DPPH自由基被清除。
2.3.2 玉米醇溶蛋白及其糖基化修饰产物的还原力
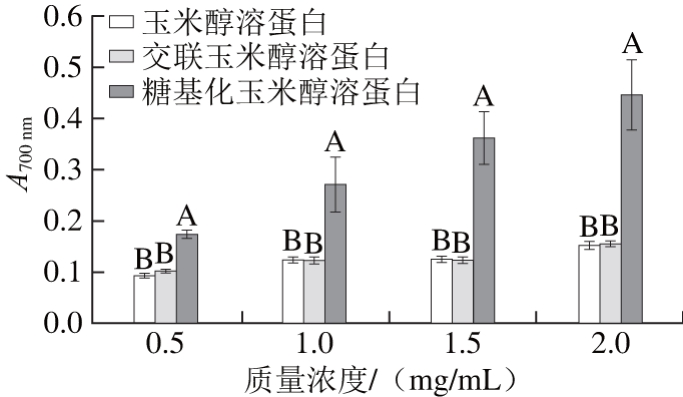
图7 不同质量浓度条件下玉米醇溶蛋白及其糖基化修饰产物的还原力
Fig. 7 Reducing power of zein and its modified products at different concentrations
由图7可以看出,3 种玉米醇溶蛋白样品的还原力均随着质量浓度的增加而增加。在相同的质量浓度下,壳寡糖糖基化修饰玉米醇溶蛋白的还原力均显著高于玉米醇溶蛋白,而玉米醇溶蛋白和交联玉米醇溶蛋白的还原能力无显著差异。在质量浓度为2 mg/mL时,糖基化玉米醇溶蛋白的还原力为0.448,比玉米醇溶蛋白高0.294,可能是因为糖蛋白上的糖基提供电子给铁离子,将其还原成亚铁离子形式,使A700nm升高,糖基化样品的还原力增强,即糖基化修饰改善了玉米醇溶蛋白的还原力。
2.3.3 玉米醇溶蛋白及其糖基化修饰产物的亚铁离子螯合能力
由图8可知,玉米醇溶蛋白本身不具有螯合亚铁离子的能力,经壳寡糖糖基化修饰后玉米醇溶蛋白的亚铁离子螯合率随着质量浓度的增加而增加,在质量浓度为2 mg/mL时,亚铁离子螯合率最大,达46.27%。而交联玉米醇溶蛋白仅在质量浓度为2 mg/mL时才表现出螯合亚铁离子的能力。壳寡糖糖基化修饰改善了玉米醇溶蛋白对亚铁离子的螯合能力,可能是由于玉米醇溶蛋白分子上共价结合的壳寡糖分子中存在的氨基含有孤对电子,可以形成壳寡糖-亚铁离子复合物,因此具有较强的离子络合能力[26]。亚铁离子可以与H2O2反应产生羟基,而羟基是反应活性很强的自由基,因此抗氧化剂具有高的亚铁离子螯合能力,就可以阻止羟基的产生,因而具有抗氧化的活性。
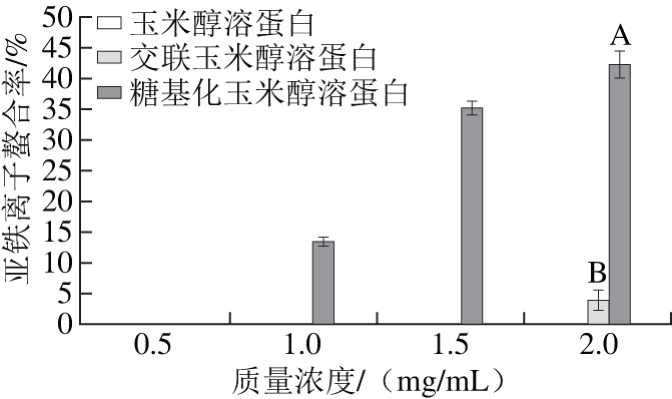
图8 不同质量浓度下玉米醇溶蛋白及其糖基化修饰产物的亚铁离子螯合率
Fig. 8 Ferrous ion-chelating activities of zein and its modified products at different concentrations
2.3.4 玉米醇溶蛋白及其糖基化修饰产物的羟自由基清除能力
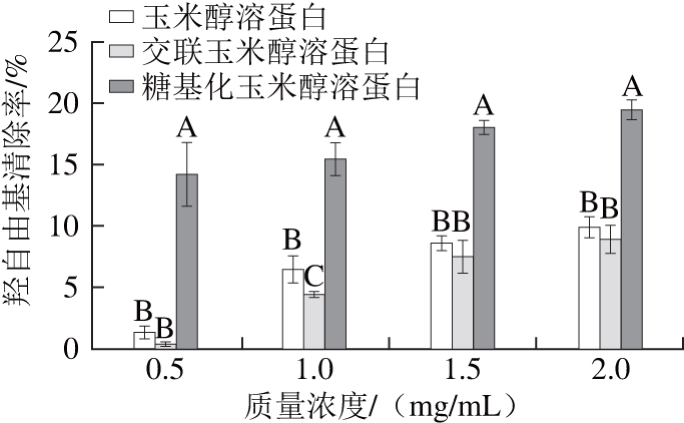
图9 不同质量浓度条件下玉米醇溶蛋白及其糖基化修饰产物的羟自由基清除率
Fig. 9 Hydroxyl radical scavenging capacities of zein and its modified products at different concentrations
由图9可知,玉米醇溶蛋白及其糖基化修饰产物的羟自由基清除率均随着质量浓度的增加呈现出递增的变化趋势。在相同的质量浓度条件下,糖基化玉米醇溶蛋白的羟自由基清除率均显著高于玉米醇溶蛋白,而交联玉米醇溶蛋白对羟自由基的清除能力略低于原玉米醇溶蛋白。在质量浓度为2 mg/mL时,糖基化玉米醇溶蛋白的羟自由基清除率为19.39%,比玉米醇溶蛋白高9.47%。说明经过糖基化修饰改善了玉米醇溶蛋白对羟自由基的清除活性,可能是由于玉米醇溶蛋白和壳寡糖共价结合后,不仅供氢能力增强,而且其亚铁离子螯合能力也增强,亚铁离子与H2O2间的Fenton反应就有可能被束缚,减少了羟自由基的产生,最终达到阻断自由基链式反应的目的[27]。
2.3.5 玉米醇溶蛋白及其糖基化修饰产物的超氧阴离子自由基清除能力
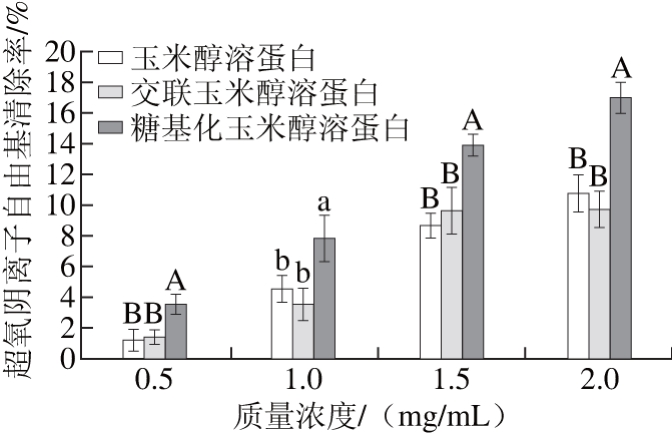
图10 不同质量浓度条件下玉米醇溶蛋白及其糖基化修饰产物的超氧阴离子自由基清除率
Fig. 10 Superoxide radical scavenging capacities of zein and its modified products at different concentrations
由图10可知,玉米醇溶蛋白及其糖基化修饰产物均具有超氧阴离子自由基的清除能力,且清除能力随着质量浓度的增加均呈递增的变化趋势。在每一个相同的质量浓度下,糖基化玉米醇溶蛋白对超氧阴离子自由基的清除能力均高于玉米醇溶蛋白和交联玉米醇溶蛋白。在质量浓度为2 mg/mL时,壳寡糖修饰玉米醇溶蛋白的超氧阴离子自由基清除率为17.01%,比玉米醇溶蛋白高6.29%,可能是因为玉米醇溶蛋白分子上共价结合的壳寡糖分子中的氨基能在溶液中结合一个氢离子而形成NH3+,NH3+中的氢离子可与自由基反应形成稳定的物质,从而起到清除自由基的作用[22]。
综上所述,糖基化修饰改善了玉米醇溶蛋白的抗氧化活性,可能是由于玉米醇溶蛋白分子上共价结合的壳寡糖部分通过提供更多的氢原子与游离自由基反应阻断自由基链式反应和/或通过螯合金属离子如亚铁离子等使自由基失活或处于不溶性状态。而交联玉米醇溶蛋白与原玉米醇溶蛋白的抗氧化活性之间没有显著差异,这是因为玉米醇溶蛋白中谷氨酰胺的γ-甲酰胺与赖氨酸的ε-氨基之间的交联反应很少发生导致的,因为玉米醇溶蛋白分子中缺少赖氨酸。
2.4 玉米醇溶蛋白及其糖基化修饰产物的游离氨基含量和Zeta电位
为了证实糖基化样品的亚铁离子螯合能力和自由基清除能力与壳寡糖分子上的游离氨基有关,分别测定玉米醇溶蛋白和经过糖基化处理后样品的游离氨基含量和Zeta电位,结果如表1所示。
表1 玉米醇溶蛋白及其糖基化修饰产物的游离氨基含量和Zeta电位的变化
Table 1 Free amino group contents and Zeta potentials of zein and its modified products

注:采用单因素中Duncan’s多重比较。同行肩标小写字母不同表示差异显著(P<0.05);大写字母不同表示差异极显著(P<0.01)。
由表1可以看出,糖基化玉米醇溶蛋白的游离氨基含量显著高于玉米醇溶蛋白和交联玉米醇溶蛋白,说明壳寡糖的共价结合使玉米醇溶蛋白具有较高的游离氨基含量,也证实了糖基化玉米醇溶蛋白抗氧化活性的改善与游离氨基有关。交联玉米醇溶蛋白的游离氨基含量略低于玉米醇溶蛋白,主要是由于玉米醇溶蛋白的赖氨酸中的ε-氨基参与了蛋白质的自交联反应导致,但两者在统计学上没有显著性差异,说明与糖基化反应相比,蛋白质分子间的交联反应的发生几率较低。
由表1还可以看出,玉米醇溶蛋白的Zeta电位为-43.5 mV,说明玉米醇溶蛋白表面带负电荷。通过糖基化修饰后,糖基化玉米醇溶蛋白和交联玉米醇溶蛋白Zeta电位的绝对值均显著变小,可能是由于长链壳寡糖的共价结合或交联反应生成的大分子物质屏蔽了玉米醇溶蛋白表面的部分电荷而导致的[28]。另外,Zeta电位的绝对值越大,粒子间的静电排斥力较大,就不易发生聚沉,则溶液的稳定性越强,反之则溶液的稳定性越差[29-30]。壳寡糖的共价结合使玉米醇溶蛋白的Zeta电位的绝对值变小,即整个体系趋于不稳定,增加了糖基化玉米醇溶蛋白提供电子和与自由基结合的能力,最终表现为糖基化玉米醇溶蛋白清除自由基的能力得到增强,同时乳化能力下降。
3 结 论
由于玉米醇溶蛋白不溶于水且结构稳定,限制了其在食品工业中的应用。本实验以玉米醇溶蛋白为原料,利用TGase催化的糖基化反应对玉米醇溶蛋白进行改性,以期利用壳寡糖的溶解性改善玉米醇溶蛋白的功能性质。红外光谱和游离氨基含量的测定结果表明,在转谷氨酰胺酶的催化下,玉米醇溶蛋白与壳寡糖发生了共价结合。与玉米醇溶蛋白和交联玉米醇溶蛋白相比,糖基化玉米醇溶蛋白的表面疏水性显著降低,表明其水溶性显著改善;糖基化玉米醇溶蛋白的抗氧化活性(包括DPPH自由基、超氧阴离子自由基和羟自由基清除活性,还原力和亚铁离子螯合能力)显著提高;糖基化玉米醇溶蛋白的持水性、吸油性、乳化性和Zeta电位的绝对值均显著降低,而起泡性显著高于玉米醇溶蛋白,但低于交联玉米醇溶蛋白。这些实验结果为糖基化玉米醇溶蛋白在食品工业的应用提供参考。例如,吸油性低的蛋白质可用于油炸食品的制作可以减少对油的吸留量;溶解性好且具有良好抗氧化活性的蛋白质可以取代或部分取代化学抗氧化剂应用于肉类等食品加工中。
参考文献:
[1] GIOIA L D, CUQ B, GUILBERT S. Effect of hydrophilic plasticizers on thermomechanical properties of corn gluten meal[J]. Cereal Chemistry, 1998, 75(4): 514-519. DOI:10.1094/CCHEM.1998.75.4.514.
[2] KIM S, XU J. Aggregate formation of zein and its structural inversion in aqueous ethanol[J]. Journal of Cereal Science, 2008, 47(1): 1-5.DOI:10.1016/j.jcs.2007.08.004.
[3] BUGS M R, FORATO L A, BORTOLETO-BUGS R K, et al.Spectroscopic characterization and structural modeling of prolamin from maize and pearl millet[J]. European Biophysics Journal, 2004,33(4): 335-343. DOI:10.1007/s00249-003-0354-3.
[4] JIN D X, LIU X L, ZHENG X Q, et al. Preparation of antioxidative corn protein hydrolysates, purification and evaluation of three novel corn antioxidant peptides[J]. Food Chemistry, 2016, 204(2): 427-436.DOI:10.1016/j.foodchem.2016.02.119.
[5] MA Z L, ZHANG W J, YU G C, et al. The primary structure identification of a corn peptide facilitating alcohol metabolism by HPLC-MS/MS[J]. Peptides, 2012, 37(1): 138-143. DOI:10.1016/j.peptides.2012.07.004.
[6] KIM J M, WHANG J H, SUH H J. Enhancement of angiotension I converting enzyme inhibitory activity and improvement of the emulsifying and foaming properties of corn gluten hydrolysate using ultrafiltration membranes[J]. European Food Research and Technology, 2004, 218(2):133-138. DOI:10.1007/s00217-003-0825-x.
[7] LI Y, ZHONG F, JI W, et al. Functional properties of Maillard reaction products of rice protein hydrolysates with mono-, oligoand polysaccharides[J]. Food Hydrocolloids, 2013, 30(1): 53-60.DOI:10.1016/j.foodhyd.2012.04.013.
[8] XUE F, LI C, ZHU X, et al. Comparative studies on the physicochemical properties of soy protein isolate-maltodextrin and soy protein isolate-gum acacia conjugate prepared through Maillard reaction[J]. Food Research International, 2013, 51(2): 490-495.DOI:10.1016/j.foodres.2013.01.012.
[9] SU G W, ZHENG L, CUI C, et al. Characterization of antioxidant activity and volatile compounds of Maillard reaction products derived from different peptide fractions of peanut hydrolysate[J]. Food Research International, 2011, 44(10): 3250-3258. DOI:10.1016/j.foodres.2011.09.009.
[10] 王梦萍, 陈燕琼, 王金梅, 等. 糖接枝处理改善大豆蛋白纤维聚集体泡沫稳定性[J]. 农业工程学报, 2016, 32(4): 249-255. DOI:10.11975/j.issn.1002-6819.2016.04.035.
[11] 孔繁惠, 刘景胜, 修琳, 等. 玉米醇溶蛋白湿热法糖基化初步研究[J].中国食物与营养, 2012, 18(4): 55-58.
[12] KIELISZEK M, MISIEWICZ A. Microbial transglutaminase and its application in the food industry: a review[J]. Folia Microbiologica,2014, 59(3): 241-250. DOI:10.1007/s12223-013-0287-x.
[13] JIANG S J, ZHAO X H. Cross-linking and glucosamine conjugation of casein by transglutaminase and the emulsifying property and digestibility in vitro of the modified product[J]. International Journal of Food Properties, 2012, 15(6): 1286-1299. DOI:10.1080/10942912.2010.521274.
[14] SONG C L, ZHAO X H. The preparation of an oligochitosanglycosylated and cross-linked caseinate obtained by a microbial transglutaminase and its functional properties[J]. International Journal of Dairy Technology, 2014, 67(1): 110-116. DOI:10.1111/1471-0307.12091.
[15] SONG C L, ZHAO X H. Structure and property modification of an oligochitosan-glycosylated and crosslinked soybean protein generated by microbial transglutaminase[J]. Food Chemistry, 2014, 163(11):114-119. DOI:10.1016/j.foodchem.2014.04.089.
[16] WANG X J, ZHENG X Q, LIU X L, et al. Preparation of glycosylated zein and retarding effect on lipid oxidation of ground pork[J]. Food Chemistry, 2017, 227(7): 335-341. DOI:10.1016/j.foodchem.2017.01.069.
[17] KATO A, NAKAI S. Hydrophobicity determined by a fluorescence probe method and its correlation with surface properties of proteins[J].Biochimica et Biophysica Acta (BBA)-Protein Structure, 1980, 624(1):13-20. DOI:10.1016/0005-2795(80)90220-2.
[18] 王晓杰, 郑喜群, 刘晓兰, 等. 双酶复合水解对玉米肽物化性质的影响[J]. 食品研究与开发, 2010, 31(11): 22-26.
[19] WANG X J, ZHENG X Q, KOPPARAPU N K, et al. Purification and evaluation of a novel antioxidant peptide from corn protein hydrolysate[J]. Process Biochemistry, 2014, 49(9): 1562-1569.DOI:10.1016/j.procbio.2014.05.014.
[20] 姚欣彤. 酪蛋白和大豆蛋白的脱酰胺和酶法糖基化交联修饰及产物性质[D]. 哈尔滨: 东北农业大学, 2014: 46.
[21] 郭兴凤, 阮诗丰. 影响大豆分离蛋白乳化稳定性测定的几种因素研究[J]. 食品研究与开发, 2006, 27(6): 59-61.
[22] TANG C H, SUN X, YIN S W, et al. Transglutaminase-induced crosslinking of vicilin-rich kidney protein isolate: influence on the functional properties and in vitro digestibility[J]. Food Research International,2008, 41(10): 941-947. DOI:10.1016/j.foodres.2008.07.015.
[23] 白一帆, 王辉, 杨霞, 等. 豌豆蛋白加工特性及在乳化香肠中的应用[J].肉类研究, 2014, 28(12): 14-16.
[24] 华欲飞, 顾玉兴. 大豆蛋白的吸水和持水性能[J]. 中国油脂, 1999,24(4): 64-66.
[25] PALUSZKIEWICZ C, STODOLAK E, HASIK M, et al. FT-IR study of montmorillonite-chitosan nanocomposite materials[J].Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2011, 79(4): 784-788. DOI:10.1016/j.saa.2010.08.053.
[26] 钟佳, 刘进辉, 肖定福, 等. 壳寡糖及其衍生物的抗氧化活性[J]. 动物医学进展, 2015, 36(7): 118-121.
[27] 冯慧萍, 李亦聪. 羟自由基与水杨酸反应机理的初探[J]. 光谱实验室, 2009, 26(4): 931-938.
[28] 孙炜炜. 乳清分离蛋白-葡聚糖接枝改性及功能性质研究[D]. 广州:华南理工大学, 2012: 47-49.
[29] 张明镝, 邢杰, 李幸芳, 等. PEF技术对抗氧化活性肽MMCTD的DPPH自由基清除活性和结构的影响[J]. 现代食品科技, 2016,32(9): 180-185. DOI:10.13982/j.mfst.1673-9078.2016.9.027.
[30] 齐宝坤, 李杨, 王中江, 等. 不同品种大豆分离蛋白Zeta电位和粒径分布与表面疏水性的关系[J]. 食品科学, 2017, 38(3): 114-118.DOI:10.7506/spkx1002-6630-201703019.