人类对海洋资源的深度开发,一方面捕获了大批未被充分利用的物种(南极磷虾和鲱鱼等),另一方面制造了大量水产品加工的副产物(鱼头、鱼骨和鱼皮等)。本质上,它们和“鱼肉”一样同属优质蛋白,有关将其中的蛋白质分离回收,转化成人类食品的研究从未中断。然而,传统鱼糜对原料要求较高,显然不具备回收分离此类蛋白质的能力。与传统鱼糜相比,分离鱼蛋白在蛋白质分离回收方面具有明显优势。目前的研究表明,分离鱼蛋白具有脱脂、脱臭和脱色等诸多优点,完全有潜力成为新型食品蛋白配料。
多数鱼蛋白都面临蛋白质受热变性,自溶降解的风险,导致其食品功能特性受损,甚至影响人类食用。常见解决方法有在贮藏或加工过程抑制蛋白质变性,如低温冷藏和水洗处理等;再者是通过技术手段提高蛋白质的功能特性,即蛋白质改性。主流的改性方法有高压处理,提高六齿金线鱼[1]、梅鱼[2]等的凝胶性;转谷氨酰胺酶交联,提高竹荚鱼[3]、鲤鱼[4]及虹鳟[5]等的凝胶性;糖基化,提高鲤鱼[6]、鲢鱼[7]、黑皮旗鱼[8]、虾夷扇贝[9]和狗鲑[10]等乳化性、热稳定性和溶解性;酶解,提高石首鱼[11]、鲣鱼[12]、鳗鱼[13]、阿根廷鱿鱼[14]、近江牡蛎[15]的溶解性、乳化性、吸油性和发泡性。不难看出,蛋白质改性适用于各类水产动物及其副产物,对它们的凝胶性、乳化性、溶解性和发泡性等重要食品功能特性均有改善作用。可见,蛋白质改性通过修复鱼蛋白受损的功能特性,使食用性差的鱼蛋白原料能够被人类接受作为食品蛋白,进而帮助水产蛋白实现资源最大化利用。
本研究以栉孔扇贝(Chlamys farreri)和鲤鱼(Cyprinus carpio)为研究对象,比较二者分离蛋白的糖基化效果,并对比扇贝分离蛋白糖基化(直接糖基化)和分离蛋白先经酶修饰后糖基化(间接糖基化)的功能改善作用,以探索功能性食品蛋白配料新思路。
1 材料与方法
1.1 材料、试剂与仪器
活栉孔扇贝购于大连新长兴水产品市场,壳长(6±0.5)cm。30 min内运输至实验室,取闭壳肌,冰中保藏。活鲤鱼购于大连沃尔玛(软件园)超市,质量(1.5±0.2)kg。现场速杀,去头、内脏、鱼鳞,15 min内运输至实验室,取白色背肌,冰中保藏。
糖化血清蛋白测试盒 南京建成生物工程研究所;MD34透析袋(8 000~14 000 kDa)、胰凝乳蛋白酶、葡萄糖(分析纯) 北京索莱宝科技有限公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳试剂 美国Sigma公司;氯化钠、硫酸铜(均为分析纯) 天津市科密欧化学试剂有限公司。
BS224S分析天平、BS224S型精密电子天平 北京赛多利斯有限公司;垂直平板电泳槽 北京伯乐生命科学发展有限公司;79-1磁力搅拌器 常州国华电器有限公司;IMS-25制冰机 常州市雪科电器有限公司;721型分光光度计 上海光谱仪器有限公司。
1.2 方法
1.2.1 分离蛋白制备
用碱溶出法制备扇贝、鲤鱼的分离蛋白[16]。取剁碎的肉糜与4 倍体积的冷蒸馏水混合,10 000 r/min条件下均质90 s。用2 mol/L氢氧化钠调pH值至12.0,冰水浴条件下搅拌30 min,10 000×g离心15 min,收集上清液为碱溶蛋白,用3 mol/L盐酸溶液调pH值至7.0,冷冻干燥后即为扇贝分离鱼蛋白(fish protein isolate of scallop,FPIs)和鲤鱼分离鱼蛋白(fish protein isolate of carp,FPIc)。
1.2.2 胰凝乳蛋白酶修饰
选用胰凝乳蛋白酶对扇贝碱溶蛋白进行酶修饰[17]。将碱溶蛋白用3 mol/L盐酸溶液调pH值至8.0,30 ℃水浴预热5min,酶和蛋白质量比为1∶100,30 ℃水浴加热1 h,1 mmol/L苯甲基磺酰氟灭酶活,冷冻干燥后即为经酶修饰的分离蛋白(H-FPIs)。
1.2.3 糖基化
反应体系内蛋白质量浓度为12 mg/mL,蛋白和葡萄糖质量比为1∶5,糖基化反应温度为60 ℃,反应相对湿度为65%,反应时间分别为0、2、4 h和6 h。反应结束后,将样品立即置于冰水浴中冷却降温,与15 mL蒸馏水混合,7 000 r/min均质30 s,调pH值至7.0,即为糖基化产物。
1.2.4 指标测定
赖氨酸含量测定:将糖基化产物4 000×g离心15 min,取上清液进行分析。按照Goodno等[18]方法进行测定。160 mg邻苯二甲醛(o-phthaldehyde,OPA)用4 mL 95%乙醇溶液溶解;2 g十二烷基硫酸钠(sodium dodecyl sulfonate,SDS)用10 mL蒸馏水溶解;38.1 g硼砂用蒸馏水溶解后,用氢氧化钠调pH 9.5,加水定容至1 L;将2 mL OPA、5 mL SDS、50 mL硼砂及0.2 mL巯基乙醇用水定容至100 mL,即为OPA试剂,当天使用。赖氨酸制作标准曲线。50 μL样液与2 mL OPA试剂混合,静置2 min,于波长340 nm处测吸光度。
果糖胺含量[19]测定:将糖基化产物4 000×g离心15 min,将上清液透析24 h后进行分析。按照试剂盒方法测定。50 μL样液与1 mL试剂混合,37 ℃水浴加热15 min,室温条件下冷却,于波长530 nm处测吸光度。
吸光度测定[20]:将糖基化产物4 000×g离心15 min,取上清液进行分析。0.2 mL样液与1 mL 0.1% SDS混匀,于波长420 nm处测吸光度。
SDS-PAGE分析:使用SDS-UM蛋白上样液将糖基化产物稀释至蛋白质量浓度为1~2 mg/mL,充分溶解后100 ℃加热5 min。样品进样量为10~15 μL。用8%分离胶,6%浓缩胶配制胶板。
乳化性测试[21]:使用蒸馏水将糖基化产物稀释至蛋白质量浓度为5 mg/mL。2 mL大豆油与8 mL样品混合,13 500 r/min均质1 min,迅速从底部取50 μL,与5 mL 0.1% SDS混合,于波长500 nm处测吸光度。乳化性按下式计算:
式中:A500nm为吸光度;F为稀释倍数(100);C为蛋白质质量浓度(0.005 g/mL);φ为油相占体积比(0.25)。
热稳定性测定[22]:使用蒸馏水将糖基化产物稀释至蛋白质量浓度为5 mg/mL。70 ℃水浴加热15 min,反应结束后,冰水浴冷却,4 000×g离心15 min,使用双缩脲法测定上清液中蛋白质质量浓度。
1.3 数据统计分析
所有实验均进行了3 次重复,数据以平均值表示,用Excel 2010软件进行分析处理。
2 结果与分析
2.1 鱼贝分离蛋白糖基化特性的分析比较
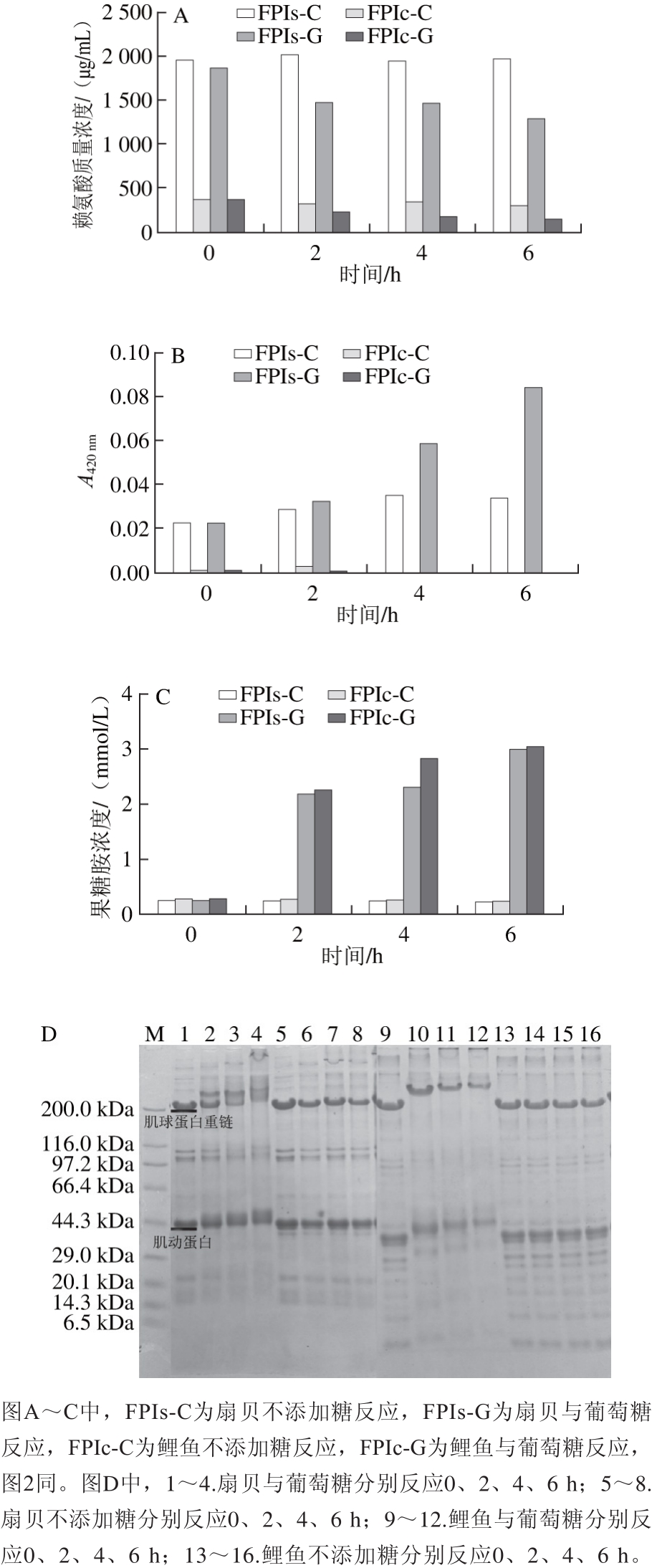
图1 鲤鱼肌肉与栉孔扇贝闭壳肌的分离蛋白糖基化程度
Fig. 1 Characterization of glycosylation of protein isolates from Cyprinus carpio muscle and Chlamys farreri adductor muscle
如图1所示,鲤鱼与扇贝分离蛋白的糖基化程度相同。随反应的进行,糖基化组(FPIs-G和FPIc-G)的赖氨酸质量浓度减少;果糖胺浓度逐渐积累;肌球蛋白重链和肌动蛋白的电泳条带迁移率降低且有大分子质量新条带出现,显示交联聚集发生;而对照组(FPIs-C和FPIc-C)4 个指标均不发生改变。其中,反应6 h后,鲤鱼(FPIc-G)的赖氨酸质量浓度从356.54 μg/mL减少到143.02 μg/mL,下降59.89%,扇贝(FPIs-G)赖氨酸质量浓度从1 857.56 μg/mL减少到1 282.90 μg/mL,下降30.94%;FPIc-G吸光度在0.000基本保持不变,FPIs-G吸光度0.023增加到0.084;FPIc-G果糖胺浓度从0.28 mmol/L增加到3.04 mmol/L,FPIs-G果糖胺浓度从0.25 mmol/L增加到2.99 mmol/L。由此可见,鲤鱼赖氨酸初始质量浓度低于扇贝,但赖氨酸下降率高于扇贝;鲤鱼吸光度初始值低于扇贝,且褐变程度小于扇贝;两者果糖胺浓度和电泳变化情况相似。
分离鱼蛋白的糖基化研究鲜见系统报道。目前,多数鱼蛋白糖基化的研究是围绕特异蛋白组分开展的,如Saeki[23]以鲤鱼的肌原纤维蛋白为研究对象,整个反应过程无褐变发生;Maitena等[24]对鲤鱼的肌球蛋白进行糖基化后发现,72 h才发生显著褐变;二人均认为其研究中的鲤鱼糖基化反应属于美拉德早期反应,是不会生成引起褐变的类黑素。Wahyuni等[8]利用葡萄糖对黑皮旗鱼水溶性蛋白进行糖基化,60 ℃条件下反应6 h,赖氨酸含量减少35%,果糖胺含量显著增加,仅发生轻微褐变;Decourcelle等[25]对北极甜虾酶解物进行木糖接枝后,赖氨酸含量减少30.2%,体系pH值从8.39降至5.72;Nishimura等[26]用褐藻胶寡糖交联狗鲑肌原纤维蛋白,60 ℃条件下反应6 h,赖氨酸含量减少41%,结合糖含量为74.8 μg/mg。Katayama等[27]则对比鲤鱼和虾夷扇贝进行了比较研究,针对肌球蛋白尾部组分(胰凝乳蛋白酶消化)糖基化程度时,反应前6 h,鲤鱼消耗的赖氨酸含量远大于扇贝,12 h时两者持平(鲤鱼69%,扇贝73%)。结合上述同类研究可得,各种水产动物,如脊椎动物、双壳类和甲壳类等均具备良好的糖基化效果,针对的蛋白组分具有特异性,如肌原纤维蛋白、酶解产物、水溶蛋白以及本研究中的分离蛋白等。尽管物种间糖基化程度存在差异,但糖基化程度主要由蛋白源、蛋白组分、处理方式以及糖基化条件决定,即当不同蛋白源使用相同方式进行蛋白质提取和糖基化时,其反应程度相似。
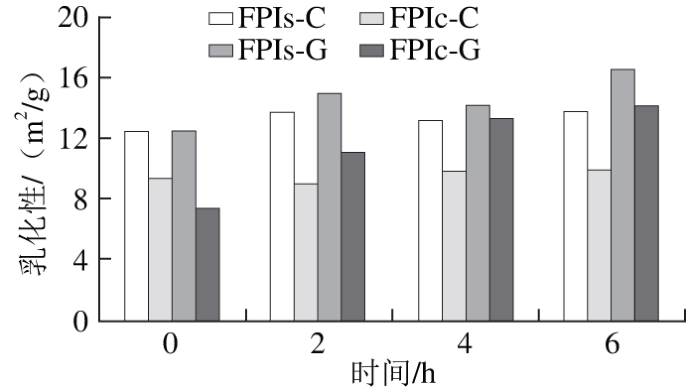
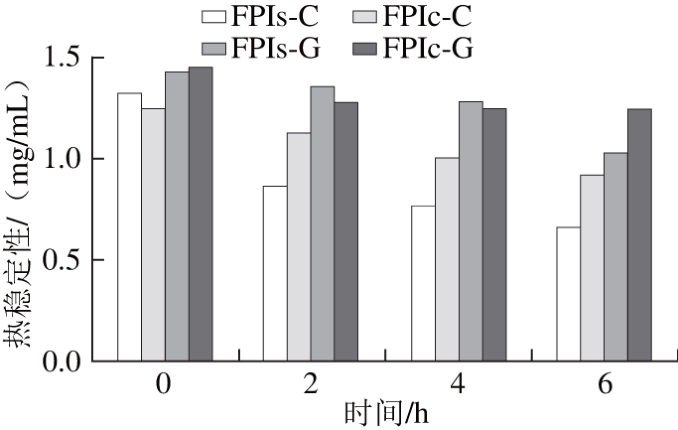
图2 鲤鱼肌肉与栉孔扇贝闭壳肌的分离蛋白糖基化产物功能特性
Fig. 2 Functional properties of glycosylated protein isolates from Cyprinus carpio muscle and Chlamys farreri adductor muscle
如图2所示,糖基化是一种有效分离鱼蛋白功能改性方法,且对鲤鱼和扇贝的乳化性和热稳定性的改善作用一致。对照组(FPIs-C和FPIc-C)乳化性基本不变,热稳定性大幅下降,而糖基化组(FPIs-G和FPIc-G)乳化性则逐渐增加,同时热稳定性下降明显趋缓。从糖基化效果来看,FPIc-G在6 h后乳化性从7.39 m2/g增至14.08 m2/g,FPIs-G乳化性从12.35 m2/g增至16.44 m2/g;FPIc-G和FPIc-C的热稳定性分别下降14%和26%,FPIs-G和FPIs-C的热稳定性分别下降28%和50%。Maitena等[24]报道鲤鱼肌球蛋白-褐藻胶寡糖产物经过50 ℃、6 h加热后,热稳定性没有显著减少,而对照组(鲤鱼肌球蛋白)却减少了63%;陈欣[28]对罗非鱼肌原纤维蛋白-葡聚糖干热反应进行实验,乳化活性指数为1.908±0.013,乳化稳定性指数为31.545±0.4,热稳定性为(43.53±0.55)%;Liu Yongle等[29]将鲣鱼酶解物与褐藻胶进行反应后,乳化性和乳化稳定性均显著提高;Decourcelle等[30]北极甜虾酶解物糖基化产物乳液的稠度指数从0.54 Pa·sn增加至4.72 Pa·sn,表观黏度从0.27 Pa·s增至0.81 Pa·s。从上述研究可知,糖基化对功能改善作用适用于各种水产动物及其相关蛋白源类型,能够赋予鱼蛋白优良的乳化性和热稳定性。值得注意的是,目前糖基化涉及的功能特性主要集中为乳化性和热稳定性,下一步可以尝试对发泡性和凝胶性进行探索。
2.2 胰凝乳蛋白酶修饰对分离蛋白糖基化的影响
如图3所示,酶修饰对扇贝分离蛋白糖基化反应有促进作用。反应6 h后,对照组(H-FPIs-C和FPIs-C)4 个指标均无明显变化。直接糖基化组(FPIs-G)的赖氨酸质量浓度从1 857.56 μg/mL减少到1 282.90 μg/mL,下降30.94%,间接糖基化组(H-FPIs-G)赖氨酸质量浓度从2 369.65 μg/mL减少到766.86 μg/mL,下降67.64%;FPIs-G吸光度从0.023增至0.084,增长265%,H-FPIs-G吸光度从0.015增至0.087,增长500%;FPIs-G果糖胺浓度从0.25 mmol/L增加到2.99 mmol/L,H-FPIs-G果糖胺浓度从0.50 mmol/L增加到5.72 mmol/L;H-FPIs-G的电泳各条带迁移率减少幅度大于直接糖基化,表明,且交联聚集的速率更快。推测原因是,分离蛋白经酶修饰后,首先蛋白质链变短,并且还暴露出更多的氨基,都更有利于与糖结合;另外蛋白质结构的变化,导致空间位阻改变,也帮助蛋白与糖结合。目前关于分离鱼蛋白糖基化(直接糖基化)和分离蛋白先经酶修饰后糖基化(间接糖基化)的比较缺乏系统报道,本研究作为初步探索性尝试,得出酶修饰对分离鱼蛋白糖基化反应有促进作用,可以为之后相关研究提供参考。

图3 栉孔扇贝闭壳肌的分离蛋白与酶修饰物糖基化程度
Fig. 3 Characterization of glycosylation of protein isolate and hydrolysate from Chlamys farreri adductor muscle

图4 栉孔扇贝闭壳肌的分离蛋白与酶修饰物糖基化产物功能特性
Fig. 4 Functional properties of glycosylated protein isolate and hydrolysate from Chlamys farreri adductor muscle
如图4所示,酶修饰可以提高分离蛋白糖基化的功能改善作用,分离鱼蛋白可以通过复合改性(酶修饰加糖基化)获得更好的功能特性。其中反应6 h后,直接糖基化组(FPIs-G)的乳化性提高33.11%,间接糖基化组(H-FPIs-G)的乳化性提高37.38%;两者热稳定性分别下降28%和3%。水产蛋白中围绕酶修饰和糖基化复合改性对比的研究鲜见系统报道,但已有大量研究证实酶修饰是水产蛋白有效的功能改性方式,如石首鱼[11]、鲣鱼[12]、鳗鱼[13]等,另外也有许多关于酶修饰物的糖基化研究,如王军等[31]的金带细鲹胰蛋白酶修饰物葡萄糖糖基化研究、Decourcelle等[30]的北极甜虾酶解物研究及Liu Yongle等[29]的鲣鱼酶解物研究等,且均表明糖基化可以改善酶修饰物的功能特性,将这两类研究报道结合起来可得,酶修饰和糖基化复合改性可以改善水产蛋白功能性,此推论与本研究结论一致。而该复合改性针对大豆蛋白的研究较系统:Zhang Yating等[32]比较了大豆分离蛋白、大豆分离蛋白酶解物和大豆分离蛋白酶解物糖基化产物的功能特性,发现大豆分离蛋白的乳化性为86.137 8 m2/g,大豆分离蛋白酶解物的乳化性为91.577 8 m2/g,大豆分离蛋白酶解物-麦芽糊精糖基化产物的乳化性为109.077 8 m2/g;三者热变性温度依次为96.99、98.32 ℃和100.78 ℃;另有张晋博[33]在对大豆7S蛋白先进行先糖基化修饰,后对其产物进行胰蛋白酶酶解,得到大豆7S、大豆7S-葡聚糖糖基化产物和大豆7S-葡聚糖糖基化产物水解物的油-水界面的πsat分别为(13.8±0.5)、(17.3±0.6)mN/m和(19.2±0.5)mN/m,且大豆7S-葡聚糖糖基化产物水解物具有最高的乳液液滴表面吸附量。由此可见,无论是已商业化的大豆蛋白,亦或是尚处在研究阶段的水产蛋白,蛋白质经过酶修饰和糖基化复合改性可以大大提高其功能特性。
3 结 论
本研究以分离鱼蛋白为出发点进行了糖基化功能改性尝试,在分离鱼蛋白的糖基化特性,无脊椎贝类和脊椎鱼类不同蛋白源之间的差异,以及胰凝乳蛋白酶修饰对分离蛋白糖基化的促进效果等方面获得有价值的发现。对分离鱼蛋白的糖基化功能改性的基本规律有了初步了解。总体研究结论为分离鱼蛋白可以有效进行糖基化且功能有所改善;鱼类与贝类的分离蛋白糖基化特性基本没有差异;分离鱼蛋白可以通过复合改性,即胰凝乳蛋白酶修饰后再糖基化,可以获得更好的功能特性。
本研究仅选择胰凝乳蛋白酶作为工具酶,今后可以考虑结合不同蛋白酶,探讨由蛋白特异性水解所带来的具有不同功能性蛋白改性产物的可能性。此外,未来可继续深入水产蛋白的复合改性研究,尝试结合如羟甲基化等其他改性手段对蛋白质进行叠加修饰。
参考文献:
[1] 周爱梅, 林丽英, 梁燕, 等. 超高压诱导鱼糜凝胶性能的研究[J].现代食品科技, 2013, 29(9): 2058-2062. DOI:10.13982/j.mfst.1673-9078.2013.09.029.
[2] 郑捷, 尚校兰, 刘安军. 超高压处理对海鲈鱼鱼肉凝胶形成作用[J].食品科学, 2013, 34(19): 88-92. DOI:10.7506/spkx1002-6630-201319020.
[3] DONDERO M, CUROTTO E, FIGUEROA V. Transglutaminase effects on gelation of Jack Mackerel Surimi (“Trachurus Murphyi”)[J].Food Science and Technology International, 2002, 8(1): 49-54.DOI:10.1106/108201302022905.
[4] MARUYAMA N, NOZAWA H, KIMURA I, et al. Transglutaminaseinduced polymerization of a mixture of different fish myosins[J].Fisheries Science, 1995, 61(3): 495-500. DOI:10.2331/fishsci.61.495.
[5] NAKAHARA C, HISANORI N, SEKI N. A comparison of cross-linking of fish myofibrillar by endogenous and microbial transglutaminases[J]. Fisheries Science, 1999, 65(1): 138-144.DOI:10.2331/fishsci.65.138.
[6] FUJIWARA K, OOSAWA T, SAEKI H. Improved thermal stability and emulsifying properties of carp myofibrillar proteins by conjugation with dextran[J]. Journal of Agricultural and Food Chemistry, 1998,46(4): 1257-1261.
[7] 尤娟. 鲢鱼鱼肉蛋白抗氧化肽的制备及其糖基化产物功能特性的研究[D]. 北京: 中国农业大学, 2014.
[8] WAHYUNI M, ISHIZAKI S, TANAKA M. Improvement of thermal stability of fish water soluble proteins with glucose-6-phosphate through the Maillard reaction[J]. Fisheries Science, 1998, 64(6): 973-978. DOI:10.2331/fishsci.64.973.
[9] KATAYAMA S, SHIMA J, SAEKI H. Solubility improvement of shellfish muscle proteins by reaction with glucose and its soluble state in low-ionic-strength medium[J]. Journal of Agricultural and Food Chemistry, 2002, 50(15): 4327-4332. DOI:10.1021/jf011717o.
[10] TAKEDA H, IIDA T, OKADA A, et al. Feasibility study on water solubilization of spawned out salmon meat by conjugation with alginate oligosaccharide[J]. Fisheries Science, 2007, 73(4): 924-930.DOI:10.1111/j.1444-2906.2007.01415.x.
[11] CHOI Y J, HUR S, CHOI B, et al. Enzymatic hydrolysis of recovered protein from frozen small croaker and functional properties of its hydrolysates[J]. Journal of Food Science, 2009, 74(1): C17-C24.DOI:10.1111/j.1750-3841.2008.00988.x.
[12] INTARASIRISAWAT R, BENJAKUI S, VISESSANGUAN W, et al.Antioxidative and functional properties of protein hydrolysate from defatted skipjack (Katsuwonous pelamis) roe[J]. Food Chemistry,2012, 135: 3039-3048. DOI:10.1016/j.foodchem.2012.06.076.
[13] JAMIL N H, HALIM N R, SARBON N M. Optimization of enzymatic hydrolysis condition and functional properties of eel (Monopterus sp.)protein using response surface methodology (RSM)[J]. International Food Research Journal, 2016, 23(1): 1-9.
[14] 林燕, 王鸿飞, 李和生, 等. 鱿鱼皮酶解产物的功能特性[J]. 中国食品学报, 2011, 11(5): 83-88. DOI:10.16429/j.1009-7848.2011.05.021.
[15] 张晶晶. 牡蛎蛋白的组成及其功能特性的研究[D]. 湛江: 广东海洋大学, 2014.
[16] 梁姗姗, 刘俊荣, 马永生, 等. 虾夷扇贝(Patinopecten yessoensis)外套膜蛋白的分离提取及功能特性[J]. 食品科学, 2014, 35(7): 12-16.DOI:10.7506/spkx1002-6630-201407003.
[17] CENTENARO G S, SALAS-MELLADO M, PIRES C, et al.Fractionation of protein hydrolysates of fish and chicken using membrane ultrafiltration: investigation of antioxidant activity[J].Applied Biochemistry and Biotechnology, 2014, 172(6): 2877-2893.DOI:10.1007/s12010-014-0732-6.
[18] GOODNO C C, SWAISGOOD H E, CATIGNANI G L. A fluorimetric assay for available lysine in proteins[J]. Analytical Biochemistry,1981, 115(1): 203-211.
[19] JOHNSON R N, METCALF P A, BAKER J R. Fructosamine: a new approach to the estimation of serum glycosylprotein. An index of diabetic control[J]. Clinica Chimica Acta, 1983, 127(1): 87-95.DOI:10.1016/0009-8981(83)90078-5.
[20] 王晓丹, 董学艳, 刘继超, 等. 大麦蛋白湿法糖基化反应研究[J].分子科学学报, 2011, 27(4): 252-257. DOI:10.13563/j.cnki.jmolsci.2011.04.002.
[21] PEARCE K N, KINSELLA J E. Emulsifying properties of proteins:evaluation of a turbidimetric technique[J]. Journal of Agricultural and Food Chemistry, 1978, 26(3): 716-723.
[22] JIMENEZCASTANO L, LOPEZFANDINO R, OLANO A, et al.Study on the beta-lactoglobulin glycosylation with dextran: effect on solubility and heat stability[J]. Food Chemistry, 2005, 93(4): 689-695.DOI:10.1016/j.foodchem.2004.09.050.
[23] SAEKI H. Preparation of neoglycoprotein from carp myofibrillar protein by maillard reaction with glucose: biochemical properties and emulsifying properties[J]. Journal of Agricultural and Food Chemistry,1997, 45(3): 680-684. DOI:10.1021/jf960325s.
[24] MAITENA U, KATAYAMA S, SATO R, et al. Improved solubility and stability of carp myosin by conjugation with alginate oligosaccharide[J]. Fisheries Science, 2004, 70(5): 896-902.DOI:10.1111/j.1444-2906.2004.00884.x.
[25] DECOURCELLE N, SABOURIN C, DAUER G, et al. Effect of the Maillard reaction with xylose on the emulsifying properties of a shrimp hydrolysate (Pandalus borealis)[J]. Food Research International, 2010,43(8): 2155-2160. DOI:10.1016/j.foodres.2010.07.026.
[26] NISHIZAWA M, SAIGUSA M, SAEKI H. Conjugation with alginate oligosaccharide via the controlled Maillard reaction in a dry state is an effective method for the preparation of salmon myofibrillar protein with excellent anti-inflammatory activity[J]. Fisheries Science, 2016,82(2): 357-367. DOI:10.1007/s12562-015-0959-3.
[27] KATAYAMA S, SAEKI H. Water solubilization of glycated carp and scallop myosin rods, and their soluble state under physiological conditions[J]. Fisheries Science, 2007, 73(2): 446-452. DOI:10.1111/j.1444-2906.2007.01353.x.
[28] 陈欣. 罗非鱼肉肌原纤维蛋白糖基化改性研究[D]. 湛江: 广东海洋大学, 2016.
[29] LIU Y L, LI X, CHEN Z, et al. Characterization of structural and functional properties of fish protein hydrolysates from surimi processing by-products[J]. Food Chemistry, 2014, 151: 459-465.DOI:10.1016/j.foodchem.2013.11.089.
[30] DECOURCELLE N, SABOURIN C, AUBRY T, et al. Emulsifying and antioxidant properties of a shrimp (Pandalus borealis) hydrolysate conjugated with xylose or dextran through the Maillard reaction by dry-heating in mild conditions[J]. Journal of Food Research, 2014,3(3): 144-157. DOI:10.5539/jfr.v3n3p144.
[31] 王军, 王忠合, 傅力, 等. 美拉德反应对金带细鲹鱼肉蛋白酶解物功能特性及潜在危害物形成的影响[J]. 食品与发酵工业, 2015,41(11): 23-28. DOI:10.13995/j.cnki.11-1802/ts.201511005.
[32] ZHANG Y T, TAN C, ZHANG X, et al. Effects of maltodextrin glycosylation following limited enzymatic hydrolysis on the functional and conformational properties of soybean protein isolate[J]. European Food Research and Technology, 2014, 238(6): 969-980. DOI:10.1007/s00217-014-2164-5.
[33] 张晋博. 多糖对大豆蛋白的修饰及其界面、乳化和凝胶性质的研究[D]. 广州: 华南理工大学, 2013.