红曲霉(Monascus spp.)具有有性生殖和无性生殖2 个生殖期。有性生殖期形成子囊和闭囊壳,无性繁殖过程中形成分生孢子[1]。红曲是以大米为原料,经过红曲霉发酵而成的一种紫红色米曲,被李时珍称为“造化之巧着”,是药食两用之奇才[2-3]。红曲色素是一种天然染色剂,同时红曲霉的次级代谢产物还具有降血脂、降血压、抑制癌细胞增殖等功效[4-12]。近年来,红曲发酵产物被用于治疗登革热病毒感染[13]。莫纳可林K(Monacolin K,MK)又叫洛伐他汀,是功能性红曲霉次级代谢产物中主要功能成分[14-15]。不同培养基种类能够影响MK产量[16-19]。祁田甜等[20]通过等离子体诱变技术选育高产MK的红曲霉突变株。2010年,Chen Yipei等[21]将mok H基因过表达,发现能够提高MK产量。
红曲霉mok E基因对应编码脱氢酶,该脱氢酶与土曲霉中由lov C编码的烯醇还原酶相似度为84%[22]。研究表明,lov C编码的烯醇还原酶能催化反应,使土曲霉MK合成前体物质——九酮化合物[23]。本课题组基于前期研究结果,确定了表达量与MK产量呈正相关的基因[17]。选取MK生物合成基因簇中mok E基因进行基因过表达,以提高MK产量,通过扫描电镜对转化子菌丝体及孢子形态进行观察,为进一步研究基因过表达与MK产量及菌体、孢子之间的相关性提供理论支持。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种与原料
红曲霉M1由天津科技大学食品生物技术研究室保存。
大麦芽、大米 市售;RNA提取试剂盒 美国Omega公司;GV3301农杆菌、pCAMBIA1301质粒 天津科技大学食品生物技术研究室;T4连接酶、SYBRII Mix日本TaKaRa公司;HiFi-Script cDNA第一链合成试剂盒 康为世纪生物科技有限公司;Bsp119I、BglII内切酶 美国Thermo Fisher Scientific公司。
1.1.2 培养基
麦芽汁培养基:将大麦芽粉碎,称取500 g,加入2 L水,55~60 ℃保温糖化3~4 h,滤去残渣,煮沸、过滤,加水稀释至糖度为12°Brix,加入3%琼脂,121 ℃灭菌20 min。
种子液培养基:葡萄糖60 g/L,蛋白胨20 g/L,NaNO310 g/L,MgSO4·7H2O 5 g/L,KH2PO410 g/L。取100 mL培养液分装至250 mL三角瓶中,121 ℃灭菌20 min。
固态发酵培养基:在液体种子培养基中加入3%琼脂,121 ℃灭菌20 min。超净工作台内将培养基倒入已灭菌的平板中,待培养基凝固后,铺上已剪好的无菌玻璃纸,将气泡赶出,备用。
1.2 仪器与设备
1260型高效液相色谱仪 美国安捷伦科技有限公司;LRH-250-GII型培养箱 广东省医疗器械厂;KCL-2000W型恒温恒湿培养箱 日本东京理化器械株氏会社;XL-3型扫描式电子显微镜 日本日立公司;SW-CJ-1FD型号超净工作台 苏州安泰空气技术有限公司;DK-S24型电热恒温水浴锅 上海森信实验仪器有限公司。
1.3 方法
1.3.1 过表达载体连接与转化
对pCAMBIA1301质粒及mok E基因(含酶切位点及保护碱基)通过Bsp119I及BglII分别进行双酶切,纯化,在T4连接酶作用下16 ℃连接过夜[24],连接产物经双酶切验证,确认连接成功。连接产物通过农杆菌介导红曲霉进行转化,转化步骤参考邵彦春[25]方法:将野生型红曲霉孢子与经乙酰丁香酮诱导剂处理的农杆菌共培养,在含有潮霉素抗性培养基上涂布,30 ℃黑暗培养3 d,有菌体长出则为转化子。
1.3.2 mok E基因表达水平的测定
分别称取转化子菌体100 mg,提取菌丝体RNA,反转录为cDNA,利用逆转录实时荧光定量聚合酶链式反应(reverse transcription-quantitative real-time polymerase chain reaction,RT-qPCR)法测定mok E基因表达水平,确定mok E基因过表达成功的转化子。RT-qPCR体系为:11 μL水;12 μL SYBRII Mix;1 μL cDNA;上下游引物各0.5 μL;总体系25 μL;每个样品做3 个平行实验。反应程序如下:95 ℃、30 s循环1 次;95 ℃、5 s,57 ℃、20 s,72 ℃、15 s,共循环40 次。所用引物序列见表1。
表1 引物序列
Table 1 List of primers used in RT-qPCR

1.3.3 发酵产物中MK的检测
1.3.3.1 MK固态发酵及样品处理
将在麦芽汁培养基上30 ℃活化7 d的红曲霉M1接种至种子液培养基,30 ℃培养48 h,在无菌操作台中用4~6 层无菌纱布过滤孢子悬液,用无菌水将孢子浓度调至106个/mL。在固态发酵培养基中心位置加入20 μL孢子悬液,待菌液干燥后,30 ℃倒置培养6 d后,于25 ℃培养12 d。分别将培养至18 d的野生型红曲霉M1及经筛选的转化子玻璃纸取下,剥落玻璃纸,得菌体,50 ℃烘干,研磨成粉末,称取0.50 g。用10 mL 75%乙醇溶液分3 次进行萃取,每次超声30 min,3 500 r/min离心15 min,上清液经0.22 μm滤膜过滤,待测。每个样品做3 个平行实验。
1.3.3.2 MK标准品的制备及检测
配制质量浓度分别为5.00、10.00、50.00、100.00、200.00、400.00 μg/mL的MK标准溶液。用高效液相色谱法测定MK标准品,并绘制标准曲线。
1.3.3.3 高效液相色谱检测条件
检测器:二极管阵列检测器;检测波长237 nm;色谱柱:Agilent X DB-C18(4.6 mm×150 mm,5 μm);进样体积:20 μL;柱温:25 ℃;流速:1 mL/min;流动相:乙腈-0.1%甲酸溶液体积比60∶40,等度洗脱。
1.3.3.4 扫描电镜观察
分别将野生型红曲霉M1及转化子培养至18 d,取菌体,放置于2.5%戊二醛溶液中固定6 h,用pH 7.2,0.1 mol/L的磷酸盐缓冲液漂洗3 次,经50%、70%、90%和100%乙醇溶液梯度脱水,每次15 min,冷冻干燥,待用。用Eiko IB-3型离子溅射仪喷金,XL-3型扫描式电子显微镜(20 kV)扫描[26-27]观察形态。
2 结果与分析
2.1 过表达载体质粒连接与转化结果
mok E基因长度为1 294 bp,连接于Bsp119I及BglII两个位点之间。位于CaMV 35s启动子下游,mok E基因含有终止子。质粒图谱[24]如图1所示。mok E基因片段全长为1 294 bp,由图2可知,在1 000~2 000 bp之间有片段,且与目的片段大小相符,表明mok E基因与pCAMBIA1301质粒连接成功,可用于后续的转化实验。
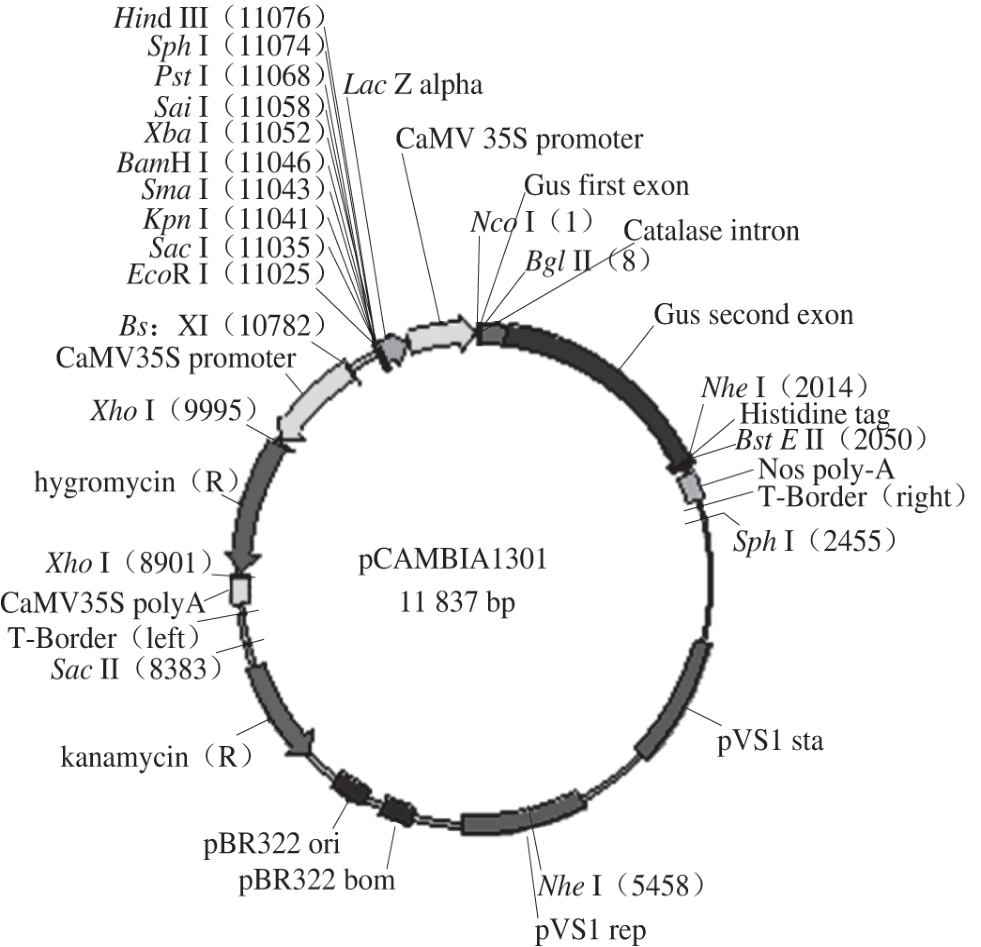
图1 过表达质粒图谱
Fig. 1 Schematic representation of the overexpression vector

图2 连接产物双酶切验证凝胶电泳结果
Fig. 2 Agarose gel electrophoresis of pCAMBIA-mok E with double enzyme digestion
pCAMBIA1301质粒含有潮霉素抗性基因,按照1.3.1节农杆菌介导丝状真菌的转化方法,对连接好的过表达质粒进行转化,共得到240 个转化子,按照选取菌落直径大、长势良好的9 个转化子(部分转化子如图3所示)进行遗传稳定性检测,结果表明5 代遗传稳定。

图3 野生型及转化子菌落形态
Fig. 3 Morphological features of the wild-type strain and transformants
2.2 mok E基因表达量测定结果
由图4可知,WS M1为野生型红曲霉M1菌株中mok E基因表达水平,T1转化子为转入空质粒的转化子,作为阴性对照,其mok E基因水平未增加。T2、T8、T9菌株中mok E基因水平均增加,表明在T2、T8、T9菌株中mok E基因过表达成功,其mok E基因表达量分别为野生型mok E基因表达量的1.57、4.63、2.39 倍。

图4 野生型红曲霉M1与转化子mok E基因表达水平
Fig. 4 Expression levels of mok E gene in the wild-type strain M1 and transformants
2.3 MK产量测定结果
2.3.1 MK标准曲线
根据MK标准溶液浓度及峰面积计算得到MK标准曲线的线性回归方程为y=63.48x+13.50,相关系数R2=0.999。
2.3.2 野生型红曲霉M1及转化子内酯型MK产量
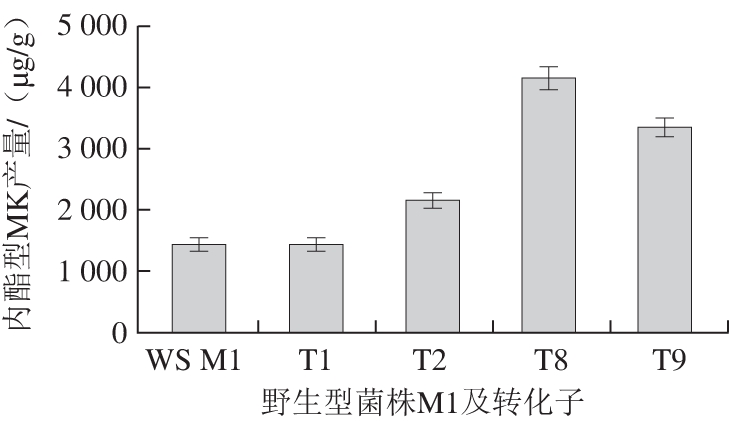
图5 野生型红曲霉M1与4 株转化子的内酯型MK产量
Fig. 5 Monacolin K lactone production by wild-type strain M1 and 4 transformants
由图5可知,野生型红曲霉M1 MK产量为1 447.8 μg/g,T2、T8、T9转化子内酯型MK产量增长明显,而转入空质粒的T1转化子内酯型MK产量增长不明显,表明mok E基因过表达能够提高红曲霉MK产量。这与Chen Yipei等[21]的结论一致,对与MK产量呈正相关的基因进行过表达能够提高MK产量。其中,T8转化子内酯型MK产量最高为4 177.6 μg/g,比野生型红曲霉内酯型MK产量提高了188.5%。T2、T9转化子内酯型MK产量分别为2 159.7、3 365.7 μg/g,MK产量较野生型分别提高了49.2%、132.5%。
2.4 基因过表达对菌丝及孢子形态的影响
由图6a可知,红曲霉菌丝有大量分枝,菌丝体密实,多呈网结联合,在分枝的顶端具有单个或成串的球形或椭圆形囊实体。这与Ji等[28]的描述一致。野生型红曲霉存在大量的分生孢子,即在菌丝顶端或侧面小梗顶端的倒梨形球体。由图6b~d可知,T2、T8、T9转化子中分生孢子数量少,球状闭囊壳数量多。以分生孢子进行的繁殖为无性繁殖,而产生闭囊壳的过程为有性繁殖[29]。这表明mok E基因过表达,对红曲霉菌丝及孢子形态有一定的影响。推测mok E基因过表达使菌丝体长度变短,菌丝之间网结联合减少,从而促进MK产生。而菌丝体较短,网联结构稀疏能够促进丝状真菌次级代谢产物的产生,这与王莉衡[30]的研究结果一致。有研究表明,利于菌丝生长的环境也利于无性繁殖,即分生孢子的产生,但一般不利于有性繁殖[31],这与本实验结果一致。

图6 野生型M1及mok E基因过表达转化子扫描电镜(×800)
Fig. 6 Scanning electron micrographs of wild-type strain M1 and mok E overexpressing transformants (× 800)
3 结 论
选取红曲霉MK生物基因簇中mok E基因进行过表达,共得到240 个转化子;挑取菌落直径大、生长良好的9 个转化子,测定其mok E基因表达量,发现3 株mok E基因表达量增加的转化子T2、T8、T9。MK产量测定结果表明,T2、T8、T9转化子内酯型MK产量比野生型红曲霉的内酯型MK产量分别提高了49.2%、188.5%及132.5%。说明mok E基因过表达能够提高MK产量。
对野生型红曲霉M1及转化子菌丝、孢子进行扫描电镜观察。结果显示mok E基因过表达,对红曲霉的菌体生长、孢子形态及生殖方式均有影响。推测mok E基因过表达是通过影响红曲霉菌丝体及孢子的生长,最终影响MK的产生。该结果对通过生物技术手段研究MK产生与菌体、孢子生长的相关性提供了理论支持。
参考文献:
[1] 王璐, 高梦祥, 周开相, 等. 红曲霉代谢产物及其调控方法的研究进展[J]. 长江大学学报(自然科学版), 2012, 9(1): 38-41. DOI:10.3969/j.issn.1673-1409(S).2012.01.011.
[2] LU W, XU M X. Research status and application prospects of Monascus sp.[J]. Agricultural Science & Technology, 2015(1): 192-196. DOI:10.3969/j.issn.1009-4229.2015.01.042.
[3] PATAKOVA P. Monascus secondary metabolites: production and biological activity[J]. Journal of Industrial Microbiology & Biotechnology,2013, 40(2): 169-181. DOI:10.1007/s10295-012-1216-8.
[4] CHENG M J, WU M D, CHEN I S. Secondary metabolites isolated from the fungus Monascus pilosus[J]. Revue Roumaine De Chimie,2010, 55(5): 335-341.
[5] LI X M, SHEN X H, DUAN Z W, et al. Advances on the pharmacological effects of red yeast rice[J]. Chinese Journal of Natural Medicines, 2011, 9(3): 161-166. DOI:10.3724/SP.J.1009.2011.00161.
[6] 侯敏, 周端顼, 王艳新, 等. 红曲霉的研究进展[J].安徽农业科学,2014, 42(11): 3382-3384. DOI:10.3969/j.issn.0517-6611.2014.11.086.
[7] ENDO A, MONACOLIN K. A new hypocholesterolemic agent produced by a Monascus species[J]. Journal of Antibiotics, 1979,32(8): 852-854. DOI:10.7164/antibiotics.32.852.
[8] CICERO A F, BRANCALEONI M, LAGHI L, et al.Antihyperlipidaemic effect of a Monascus purpureus brand dietary supplement on a large sample of subjects at low risk for cardiovascular disease: a pilot study[J]. Complementary Therapies in Medicine, 2006,13(4): 273-278. DOI:10.1016/j.ctim.2005.07.008.
[9] LEE C L, TSAI T Y, WANG J J, et al. In vivo hypolipidemic effects and safety of low dosage Monascus powder in a hamster model of hyperlipidemia[J]. Applied Microbiology and Biotechnology, 2006,70(5): 533-540. DOI:10.1007/s00253-005-0137-0.
[10] KONO I, HIMENO K. Changes in γ-aminobutyric acid content during beni-koji making[J]. Bioscience, Biotechnology, and Biochemistry,2000, 64(3): 617-619. DOI:10.1271/bbb.64.617.
[11] 王婧, 王昌禄, 陈勉华, 等. 红曲霉M1发酵糙米代谢产物抗S180细胞增殖效应研究[J]. 食品科学技术学报, 2013, 31(2): 31-36.
[12] LI J J, SHANG X Y, LI L L, et al. New cytotoxic azaphilones from Monascus purpureus-fermented rice (red yeast rice)[J]. Molecules(Basel, Switzerland), 2010, 15 (3): 1958-1966. DOI:10.3390/molecules15031958.
[13] SUHARTO N, TRIYONO E A. Uses of red yeast rice in treating dengue virus infection: US20090167640[P/OL]. 2010-10-14[2017-05-01].http://xueshu.baidu.com/s?wd=paperuri%3A%289edf4b0c76 d17ee373f6c896046f8619%29&filter=sc_long_sign&tn=SE_xueshusource_2kduw22v&sc_vurl=http%3A%2F%2Feuropepmc.org%2Fpatents%2FPAT%2FWO2010116336&ie=utf-8&sc_us=5438047833412703737.
[14] SRIANTA I, RISTIARINI S, NUGERAHANI I, et al. Recent research and development of Monascus fermentation products[J]. International Food Research Journal, 2014, 21(1): 1-12.
[15] BARRIOS-GONZÁLEZ J, MIRANDA R U. Biotechnological production and applications of statins[J]. Applied Microbiology and Biotechnology,2010, 85(4): 869-883. DOI:10.1007/s00253-009-2239-6.
[16] XU B J, WANG Q J, JIA X Q. Enhanced lovastatin production by solid state fermentation of Monascus ruber[J]. Biotechnology and Bioprocess Engineering, 2005, 10(1): 78-84. DOI:10.1007/BF02931187.
[17] 林琳, 李贞景, 陈勉华, 等. 4 种培养基对红曲霉M1莫纳可林K产量影响及基因差异表达分析[J]. 食品科学技术学报, 2016, 34(5): 43-47. DOI:10.3969/j.issn.2095-6002.2016.05.006.
[18] SANG H L, JANG G Y, MIN Y K, et al. Effect of Monascus fermentation on content of Monacolin K and antioxidant activities of germinated brown rice[J]. Journal of the Korean Society of Food Science & Nutrition, 2015,44 (8): 1186-1193. DOI:10.3746/jkfn.2015.44.8.1186.
[19] OH P S, LIM K T. Glycoprotein isolated from Dioscorea batatas Decne modulates expressions of IL-4 and IL-10 in primary-cultured mouse lymphocytes[J]. Cell Biochemistry & Function, 2009, 27(5):316-322. DOI:10.1002/cbf.1577.
[20] 祁田甜, 张婵, 胡济美, 等. 常压室温等离子体诱变技术选育高产Monacolin K紫色红曲霉突变株[J]. 食品科学, 2015, 36(9): 66-70.DOI:10.7506/spkx1002-6630-201509013.
[21] CHEN Y P, YUAN G F, HSIEH S Y, et al. Identification of the mok H gene encoding transcription factor for the upregulation of monacolin K biosynthesis in Monascus pilosus[J]. Journal of Agricultural and Food Chemistry, 2010, 58(1): 287-293. DOI:10.1021/jf903139x.
[22] CHEN Y P, TSENG C P, LIAW L L, et al. Cloning and characterization of Monacolin K biosynthetic gene cluster from Monascus pilosus[J].Journal of Agricultural & Food Chemistry, 2008, 56(14): 5639-5646.DOI:10.1021/jf800595k.
[23] AMES B D, NGUYEN C, BRUEGGER J, et al. Crystal structure and biochemical studies of the trans-acting polyketide enoyl reductase LovC from lovastatin biosynthesis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 109(28):11144-11149. DOI:10.1073/pnas.1113029109.
[24] 姚琳. 哈茨木霉聚酮合成酶基因功能鉴定及基因工程菌株的构建[D].哈尔滨: 哈尔滨工业大学, 2014: 23-31.
[25] 邵彦春. 红曲霉产色素相关基因的克隆及功能研究[D]. 武汉: 华中农业大学, 2007: 24-25.
[26] 胡春辉, 徐青, 孙璇, 等. 几种典型扫描电镜生物样本制备[J]. 湖北农业科学, 2016, 55(20): 5389-5392.
[27] 张慧茹, 孟素香, 曹健, 等. 绞股蓝内生真菌抗大肠杆菌抗菌机制的研究[J]. 微生物学通报, 2015, 42(1): 157-162. DOI:10.13344/j.microbiol.china.140378.
[28] JI Y K, KIM H J, OH J H, et al. Characteristics of Monascus sp.isolated from Monascus, fermentation products[J]. Food Science and Biotechnology, 2010, 19(5): 1151-1157. DOI:10.1007/s10068-010-0164-1.
[29] 吴芳彤. 高产洛伐他汀红曲菌的分离鉴定及其红曲发酵条件的优化[D]. 福州: 福建农林大学, 2014: 1-3.
[30] 王莉衡. 土曲霉发酵条件对菌体形态与产物产量影响的研究[D].西安: 西北大学, 2004: 20-37.
[31] 高慧民. 红曲菌的分类鉴定及其固态发酵产孢条件的优化[D].天津: 天津科技大学, 2015: 12-14.