丁二酸(又名琥珀酸),是一种重要的四碳平台化合物,可以取代苯合成包括四氢呋喃、N-甲基吡咯烷酮、γ-丁内酯、1,4-丁二醇、己二酸等在内的250 种以上专用化学品或大宗化学品,可广泛应用于食品、塑料、医药、香料等工业[1]。此外,丁二酸还是合成可降解塑料的主要原料,它可以与丁二醇、乙二醇、丙二醇等缩合聚合生产聚丁二酸丁二醇酯、聚乙二醇丁二酸酯、聚丙二醇丁二酸酯等具有优良特性且可完全被生物降解的高分子材料,是丁二酸潜在的最具发展前景的领域[2]。美国能源部2004年公布的12 种最有潜力大宗产品中,丁二酸排在第一位[3]。目前商品化的丁二酸的主要是以顺丁烯二酸、顺丁烯二酸酐等石油基材料为原料通过催化加氢或电化学合成,其过程中伴随大量温室气体及有毒废弃物的排放,对环境污染严重。随着石油资源供应日益紧张以及环境意识的日益增强,化学法合成逐渐受到限制,不利于丁二酸相关产业的发展。而微生物发酵法生产丁二酸具有以可再生的生物质资源为原料、发酵条件温和、可固定CO2等一系列优点,成为近年来国内外的研究热点之一[4-5]。在众多产丁二酸的微生物中,产琥珀酸放线杆菌(Actinobacillus succinogenes)以其产量高(最高可达110 g/L)、耐受性强(最高可耐160 g/L葡萄糖)等优点,是目前最具发展前景的生产菌种之一[6]。但目前微生物发酵法生产丁二酸的生产成本偏高,影响了其产业化的进程。采用廉价或废弃的非粮生物质资源替代葡萄糖进行丁二酸生产,不仅是对废弃的生物质资源再利用,而且可以有效降低丁二酸生产原料成本,对促进丁二酸生物发酵法生产具有重要的意义[7]。国内外学者对乳清[8]、甘蔗汁[9]、糖蜜[10]、面包加工废料[11]及农业废弃物[12-13]等原料发酵生产丁二酸进行了研究,取得了较好的效果,丁二酸生产成本明显下降。但与化学合成法相比,生产成本仍然偏高,需要进一步探索更为低廉的原料进行丁二酸生产。
甘油是作为酒精发酵和油脂皂化反应中的副产物被发现的,在生物柴油的制备过程中,每生产9 t生物柴油就会副产约1 t粗甘油[14]。伴随生物柴油规模的不断增大,粗甘油产量也会相应提高。粗甘油在制备过程中带入了盐类、甲醇、皂等杂质,只有经过进一步的纯化和精制后才能在医药、化妆品和食品等领域使用,但粗甘油纯化精制成本较高,在经济上不可行,导致目前粗甘油价格急剧下跌,几乎成了工业的废弃物,若不及时处理,有可能会成为一种新的污染源[15],进而增加了生物柴油生产企业的处理成本,降低了经济效益。利用生物技术将粗甘油作为底物转化为高价格的产品引起了越来越多研究者的关注[16]。当前甘油利用的有效途径包括:发酵生产1,3-丙二醇、乙醇、3-羟基丙酸等;制备环氧氯丙烷、乙二醇二羟基丙酮等[17]。但利用微生物将甘油转化为丁二酸的研究较少,尚处于起步阶段[18-19]。与葡萄糖发酵产丁二酸相比,粗甘油不仅价格低廉,而且还原性更强,发酵过程中产生的还原力是葡萄糖的两倍[20]。但目前甘油发酵产丁二酸的产量较低,批次发酵最高只有29.3 g/L[18],远低于葡萄糖发酵水平(110 g/L[6]),需要对发酵工艺进一步优化。而国内有关粗甘油发酵产丁二酸的研究目前还鲜见报道。
本研究对实验室前期筛选到的产琥珀酸放线杆菌GXAS137发酵粗甘油产丁二酸的培养基进行了优化,先利用单因素试验对影响发酵的主要因素进行优化,再利用响应面试验对筛选出的关键因素的浓度进行进一步优化,提高丁二酸产量,降低生产成本。与葡萄糖发酵产丁二酸相比,粗甘油不仅能够降低生产成本,而且还实现了废物资源的有效利用,提高其经济附加值,在资源的有效利用及环境保护方面均具有重要意义。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
粗甘油购自南京长江江宇油脂有限公司,其甘油质量分数约为85%,其他杂质(水、部分聚甘油等)质量分数约为15%。
1.1.2 菌种与培养基
产琥珀酸放线杆菌GXAS137[9]为本实验室选育获得,保藏号为:CCTCCM 2011399。
种子培养基:葡萄糖20 g/L,酵母提取物10 g/L,玉米浆5 g/L,NaCl 2 g/L,NaH2PO4·2H2O 8.5 g/L,K2HPO415.5 g/L,NaHCO32 g/L,半胱氨酸盐酸盐1 g/L,pH值自然,115 ℃灭菌20 min。
原始甘油发酵培养基:粗甘油30 g/L,酵母提取物10 g/L,NaCl 5 g/L,(NH4)2SO41 g/L,MgCl2·6H2O 0.5 g/L,CaCl20.5 g/L,MgCO330 g/L,115 ℃条件下灭菌20 min。
1.1.3 试剂
酵母提取物、蛋白胨 英国Oxoid公司;葡萄糖、碳酸氢钠、氯化钠、磷酸二氢钠、磷酸氢二钾 生物工程(上海)股份有限公司;其他均为分析纯。
1.2 仪器与设备
DG250小型厌氧工作站 英国Don Whitley Scientific公司;U-3000高效液相色谱(high performance liquid chromatography,HPLC)仪 美国戴安公司;色谱柱Rezex ROA-Organic Acid H+(8%)(300 mm×7.8 mm) 美国菲罗门公司。
1.3 方法
1.3.1 培养与发酵条件
种子培养:将甘油保藏的菌种接种到液体种子培养基进行活化,37 ℃培养15 h后,按照5%接种量(体积分数,下同)接种于装有95 mL种子三角摇瓶(容积为250 mL)中,37 ℃培养8 h,可得到成熟种子。
发酵过程:按8%接种量接种于装有92 mL发酵培养基的三角摇瓶中进行发酵,置37 ℃发酵72 h进行产物分析。
1.3.2 样品分析测定[9]
1.3.2.1 样品预处理
样品在转速为12 000 r/min条件下离心10 min,取上清液进行适当稀释,然后用0.22 μm孔径的无菌滤膜过滤后,HPLC检测发酵液丁二酸、乙酸、甲酸及残甘油质量浓度。
1.3.2.2 有机酸含量测定
采用HPLC法,自动进样器,流动相为2.5 mmol/L H2SO4溶液(pH 2.5),流速0.6 mL/min,柱温45 ℃,自动进样器进样,进样量10 μL,紫外检测器的波长为210 nm。
1.3.2.3 甘油含量测定
采用HPLC法,紫外检测器与示差检测器联用,示差检测器的温度为50 ℃。
1.3.3 粗甘油发酵产丁二酸条件优化
1.3.3.1 单因素试验
在前期实验的基础上[9-10],对粗甘油发酵产丁二酸条件进行了预实验,发现碳源、氮源及电子受体对丁二酸产量影响较大,需要进一步进行优化。在粗甘油质量浓度为30 g/L时,考察不同电子受体对甘油发酵产丁二酸的影响;在确定电子受体情况下,考察粗甘油质量浓度对丁二酸发酵的影响;在确定电子受体及粗甘油质量浓度时,考察不同种类的氮源对丁二酸产量的影响,以期筛选出合适廉价氮源,以替代价格昂贵的酵母提取物。
1.3.3.2 响应面优化试验
在单因素试验的基础上,借助响应面试验设计Design-Expert 8.0软件的Box-Behnken设计原理,以丁二酸产量考察指标,对粗甘油、电子受体二甲基亚砜(dimethyl sulfoxide,DMSO)及玉米浆质量浓度这3 个显著性影响因素各取低(-1)、原点(0)、高(1)三水平进行响应面优化试验,各个因素水平如表1所示。
表1 响应面试验因素与水平
Table 1 Coded levels and corresponding actual levels of independent variables used in central composite design

1.4 数据处理
实验数据取3 次平均值;图表采用Origin 8.0及Excel 2007进行处理绘制,响应面试验设计与分析采用Design-Expert 8.0软件。
2 结果与分析
2.1 不同电子受体对甘油发酵产丁二酸的影响
微生物代谢甘油过程中为了维持氧化还原电位平衡,一部分被还原成1,3-丙二醇排除细胞外,另一部分被氧化成磷酸二羟丙酮进入糖酵解途径。但产琥珀酸放线杆菌的代谢通路中缺少1,3-丙二醇代谢途径,所以代谢过程中电子受体供应不足,在以甘油为碳源培养基中生长较差,只有在外源添加电子受体的情况下才能实现FAD+的再生[18]。所以本研究在初始发酵培养基的基础上,分别添加10 g/L亚甲基蓝、DMSO、乙偶姻、二羟基丙酮、亚硝酸钠为电子受体进行丁二酸生产。37 ℃条件下发酵72 h,HPLC分析测定样品,每组设3 个平行,结果取平均值(下同)。
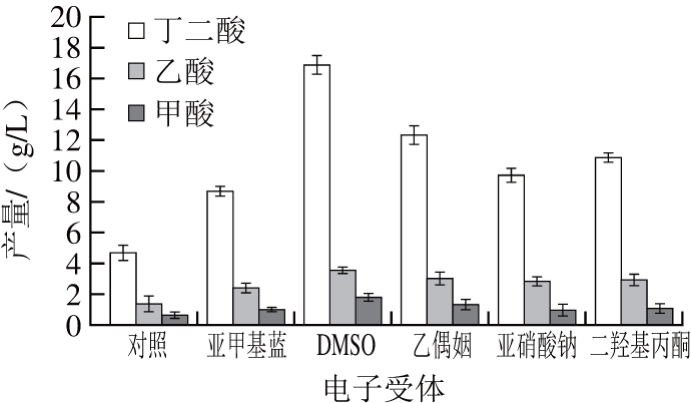
图1 不同电子受体对粗甘油发酵产丁二酸的影响
Fig. 1 Effect of different electron acceptors on the production of succinic acid
从图1可知,产琥珀酸放线杆菌GXAS137可以利用粗甘油发酵产丁二酸,丁二酸为主要产物,主要副产物为乙酸和甲酸。但不添加任何电子受体时,丁二酸产量较低,只有4.76 g/L,而且菌体生长较差,这与文献报道的产琥珀酸放线杆菌CGMCC 1593[20]及NJ 113[21]不能利用甘油不同,这可能是不同菌株的代谢差异造成的。当添加DMSO为电子受体时,丁二酸产量最高,可达16.88 g/L;而添加其他电子受体丁二酸产量高于对照组,但低于DMSO组。因此,DMSO为粗甘油发酵产丁二酸合的最适电子受体。这可能是由于外源添加DMSO有利于维持细胞的氧化还原平衡(FAD+/FADH2),实现细胞体内辅酶的再生,从而增加了丁二酸产量[19]。
2.2 粗甘油质量浓度对丁二酸产量的影响
碳源含量对产琥珀酸放线杆菌生长和丁二酸合成影响极大,碳源含量较低时,不利于丁二酸高浓度生产[22];但碳源含量过高时会抑制菌体生长及丁二酸合成。Urbance等[23]研究表明,当葡萄糖为碳源时,70 g/L或者更高质量浓度的葡萄糖会抑制产琥珀酸放线杆菌生长,这一结论得到大多数学者验证[24-25]。为了研究粗甘油质量浓度对丁二酸产量的影响,在初始发酵培养基(不含碳源)的基础上,分别添加粗甘油质量浓度为30、40、50、60、70 g/L,并添加10 g/L的DMSO作为电子受体,考察粗甘油质量浓度对丁二酸产量的影响,结果见图2。
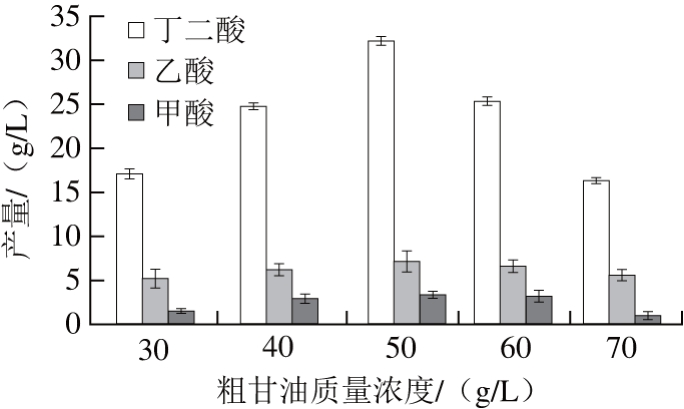
图2 粗甘油质量浓度对粗甘油发酵产丁二酸的影响
Fig. 2 Effect of crude glycerol concentration on the production of succinic acid
从图2可以看出,当粗甘油质量浓度低于50 g/L时,丁二酸随着粗甘油质量浓度的增加而升高;而当质量浓度超过50 g/L时,丁二酸产量会随粗甘油质量浓度增加而降低;当粗甘油质量浓度为70 g/L,丁二酸的合成受到严重抑制,产量只有16.21 g/L。因此,粗甘油最适质量浓度为50 g/L,此时丁二酸产量最高,达到32.06 g/L。粗甘油发酵产丁二酸的最适质量浓度远低于葡萄糖(70~75 g/L)[10,12],这可能与粗甘油的渗透压较高且含有甲醇、盐类等有害成分有关。
2.3 氮源种类及质量浓度对丁二酸产量的影响
氮源是构成微生物菌体和一些代谢产物的必需营养元素,产琥珀酸放线杆菌本身不能合成生物素、烟酸、甲硫氨酸等生长因素[26],需要添加合适的氮源来提供生长所需的氨基酸和维生素等生长因素,因此,对氮源的要求较高。前人研究表明酵母提取物为氮源时,丁二酸产量远高于其他氮源[12,25]。但酵母提取物的价格较高,会显著增加生产成本,严重阻碍丁二酸大规模工业化生产,需要积极探索其他价格低廉的替代氮源。因此,以50 g/L的粗甘油为碳源,分别添加酵母粉(总氮质量分数12.5%)8 g/L、蛋白胨(总氮质量分数12.7%)7.87 g/L、牛肉膏(总氮质量分数13.1%)7.63 g/L、玉米浆(总氮质量分数7.4%)13.51 g/L、硫酸铵(总氮质量分数21%)4.76 g/L作为氮源,设定添加总氮终质量浓度为1.0 g/L,对照组不加入任何氮源,考察不同种类的氮源对粗甘油发酵产丁二酸的影响。发酵72 h后,分析测定样品,结果见图3。
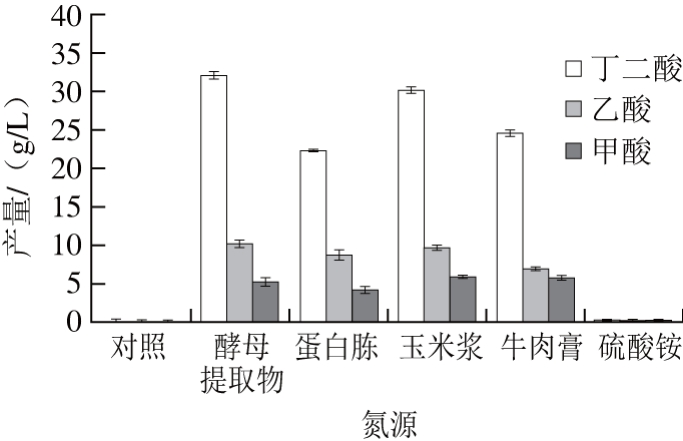
图3 不同氮源对粗甘油发酵产丁二酸的影响
Fig. 3 Effect of different nitrogen sources on the production of succinic acid
从图3可以看出,酵母提取物为粗甘油发酵产丁二酸的最适氮源,此时,丁二酸产量为32.13 g/L,其次为玉米浆,丁二酸产量达到30.24 g/L;蛋白胨及牛肉膏为氮源时,丁二酸产量分别为22.35 g/L和24.61 g/L;而空白对照及硫酸铵为氮源时几乎无丁二酸产生。
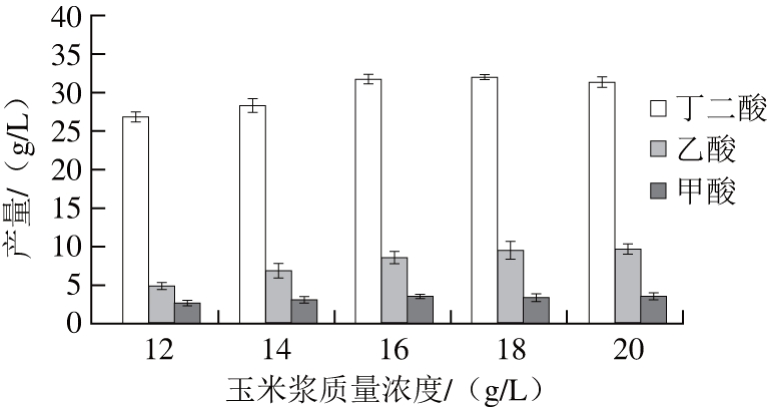
图4 玉米浆质量浓度对粗甘油发酵产丁二酸的影响
Fig. 4 Effect of corn steep liquor concentration on the production of succinic acid
通过进一步对玉米浆质量浓度进一步优化(图4),当玉米浆质量浓度为16 g/L时,丁二酸产量达到32.06 g/L,几乎与酵母提取物为氮源时的丁二酸产量相当,这可能与玉米浆中含有丰富的可溶性蛋白、生长素和一些前体物质,能满足产琥珀酸放线杆菌的生长、发酵[10]。而玉米浆价格(国产约2 500 元/t)远低于酵母提取物(国产约5 000 元/t),可显著降低丁二酸生产成本。因此,选择玉米浆作为粗甘油发酵产丁二酸的氮源。
2.4 响应面试验结果
2.4.1 响应面试验设计及结果
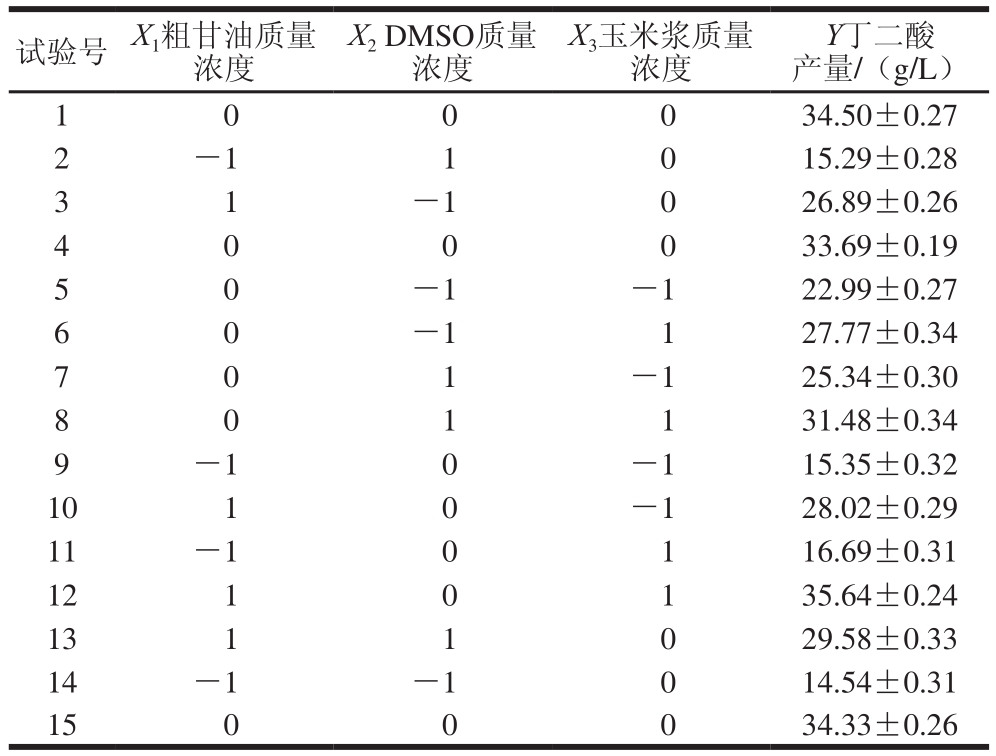
根据单因素试验确定的3 个因素,利用Box-Behnken试验设计三因素三水平共15 个试验点进行响应面分析。析因点共12 个,用于考察3 个变量在3 个不同水平下对丁二酸产量的影响;零点为区域的中心点,重复3 次(试验号1、4、15),用于估计试验的误差。结果见表2。
表2 Box-Behnken试验设计与结果
Table 2 Box-Behnken design with response variable
2.4.2 模型方程的建立与显著性检验
根据表2的试验结果,利用Design-Expert 8.0对丁二酸产量Y值与各因素进行多元回归分析,同时拟合得二次回归方程:
方程的决定系数R2为0.994 0,说明该回归方程的拟合度很好,可以通过该回归方程对实际试验结果进行分析。进一步对响应面试验方差进行分析,结果见表3。
表3 Box-Behnken试验方差分析结果
Table 3 Analysis of variance of response surface regression model
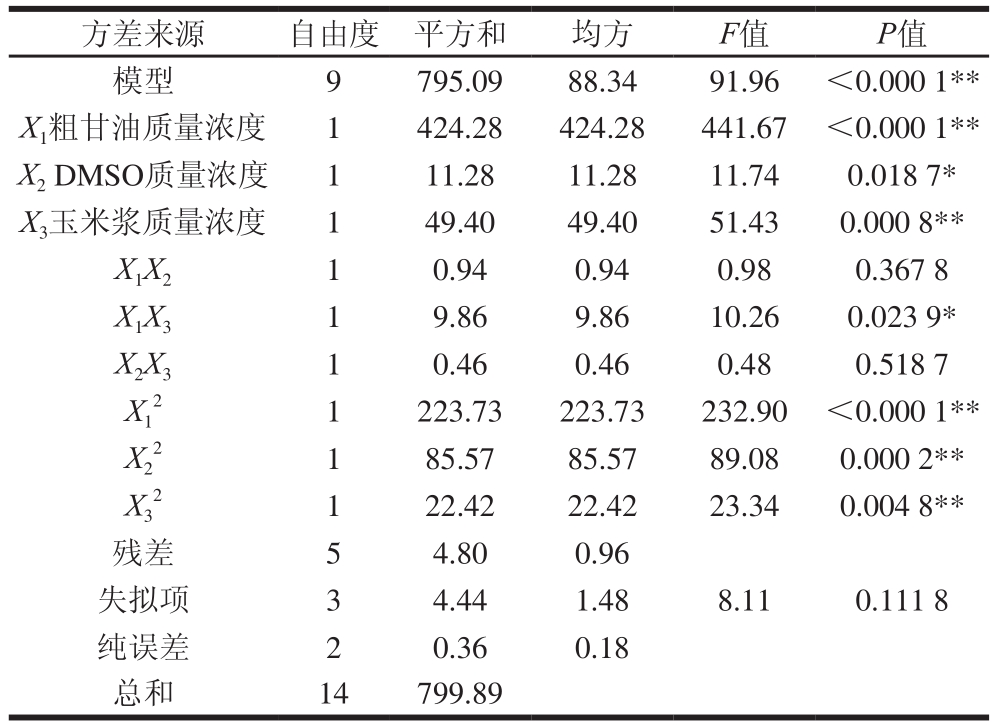
注:*.差异显著(P<0.05);**.差异极显著(P<0.01)。
由表3可知,模型P<0.0001,达到极显著水平,说明该试验模型显著;决定系数R2等于0.994 0,说明建立的该模型能解释99%响应值的变化;复合相关系数R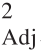 为0.983 2,说明该模型拟合程度良好,失拟项不显著(P>0.05)。以上分析表明模型拟合度较好,试验误差较小,模型的预测值能与实际试验值间具有高度相关度[14]。
为0.983 2,说明该模型拟合程度良好,失拟项不显著(P>0.05)。以上分析表明模型拟合度较好,试验误差较小,模型的预测值能与实际试验值间具有高度相关度[14]。
由表3回归模型系数显著性检验结果可知:因素一次项X1、X3对丁二酸的产量影响极显著(P<0.01),X2影响显著(P<0.05);交互项X1X3影响显著(P<0.05),X1X2、X2X3影响不显著(P>0.05);二次项X12、X22、X32对丁二酸产量影响极显著(P<0.01);这表明试验各因素与响应值之间不是简单的线性关系[27]。各因素对丁二酸产量的影响程度为:X1>X3>X2,即粗甘油质量浓度>玉米浆质量浓度>DMSO质量浓度。
2.4.3 响应面分析
响应面是各因素对响应值影响对所构成的三维空间曲面图,它可以直观反映出各个因素与响应值的交互作用,提供一种形象的观测响应值和试验参数水平关系的方法[28]。曲面越陡峭,说明因素对响应值影响越大。响应面中各因素的等高线形状可以反映因素间交互作用的显著程度。如等高线的性状为椭圆形,表明两因素交互作用显著;但如果等高线性状为圆形,则表明两因素的交互作用不显著[29]。通过对上述多元回归方程作响应面及等高线图,结果见图5。
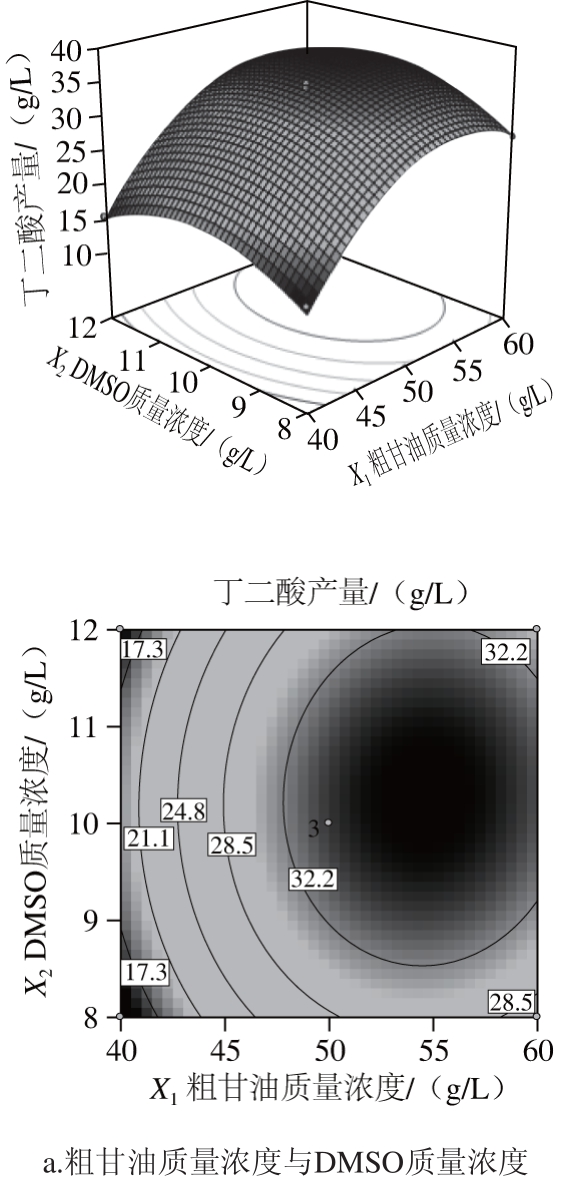
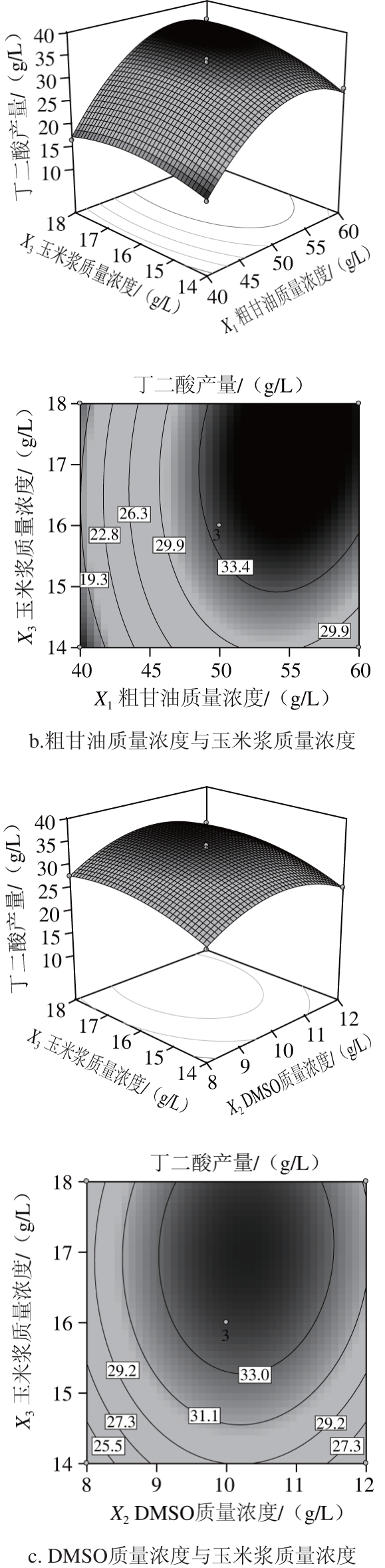
图5 各因素交互作用对丁二酸产量影响的响应面及等高线图
Fig. 5 Response surface and contour pots showing the interactive effects of variables on succinic acid yield
由图5可知,各因素对响应面的陡峭程度的影响为:粗甘油质量浓度>玉米浆质量浓度>DMSO质量浓度,这说明粗甘油对丁二酸产量影响最大,其次为玉米浆,DMSO影响最小,这与方差分析结果一致。从等高线图可知,因素粗甘油与DMSO质量浓度及DMSO与玉米浆质量浓度间的等高线为圆形,因素的交互影响不显著;而粗甘油与玉米浆质量浓度的等高线为椭圆形,沿粗甘油方向峰值移动的等高线密度明显大于玉米浆方向,这说明粗甘油与玉米浆见有交互影响,且粗甘油对丁二酸产量影响较大。
2.4.4 模型最高点预测及验证实验结果
对获得的模型中影响不显著的因素X1X2、X2X3去除,运用软件Design-Expert 8.0重新构建模型,并对方程的最大值进行求解,得到响应面的最高点。最佳点时X1、X2、X3的值分别为0.543、0.176、0.689,对应各因素的实际值分别为粗甘油55.43 g/L、DMSO 10.35 g/L、玉米浆17.69 g/L,此点丁二酸产量为37.11 g/L。
为了检验模型预测的准确性,在最优条件下设置3 个平行实验进行验证,37 ℃发酵72 h,HPLC分析测定结果。获得丁二酸产量的平均值为(37.02±0.41)g/L,与预测值基本一致(P>0.05),这说明建立的模型具有很好的可靠性和重复性。此时,丁二酸得率为66.79%,生产强度为0.51 g/(L·h),与优化前丁二酸产量16.88 g/L相比,提高了1.19 倍。从而也证明了响应面法优化培养基配方的有效性,对于其他发酵条件优化也具有一定的参考价值。
3 结 论
本研究对产琥珀酸放线杆菌GXAS137发酵粗甘油产丁二酸的条件进行优化,提高了丁二酸产量,降低了生产成本。先通过单因素试验对粗甘油发酵产丁二酸的电子受体、粗甘油质量浓度及氮源进行了优化,又通过响应面试验确定重要参数的最佳水平。结果表明:DMSO是粗甘油发酵产丁二酸的最适电子受体,玉米浆可替换价格昂贵的酵母粉作为发酵的氮源,各因素的最佳条件为粗甘油55.43 g/L、DMSO 10.35 g/L、玉米浆17.69 g/L,此条件下丁二酸产量达到37.02 g/L,丁二酸得率为66.79%,生产强度为0.51 g/(L·h)。与优化前的丁二酸产量16.88 g/L相比,丁二酸产量提高1.19 倍,说明模型准确有效。研究结果表明产琥珀酸放线杆菌GXAS137可以高效率转化粗甘油生产丁二酸,不仅可为丁二酸的生物炼制提供廉价的可再生原料,而且还可以废弃甘油排放带来的环境问题,实现废物的资源化,在资源的有效利用及环境保护方面均具有重要意义。
参考文献:
[1] BECHTHOLD K, BRETZ S, KABASCI R, et al. Succinic acid: a new platform chemical for biobased polymers from renewable resources[J].Chemical Engineering and Technology, 2008, 31(5): 647-654.DOI:10.1002/ceat.200800063.
[2] MCKINLAY J B, VIEILLE C, ZEIKUS J G. Prospects for a bio-based succinate industry[J]. Applied Microbiology and Biotechnology, 2007,76: 727-740. DOI:10.1007/s00253-007-1057-y.
[3] WERPY T, PETERSEN G. Top value added chemicals from biomass[M]. Washington, DC: Department of Energy, 2004.
[4] ZEIKUS J G, JAIN M K, ELANKOVAN P. Biotechnology of succinic acid production and markets for derived industrial products[J]. Applied Microbiology and Biotechnology, 1999, 51(5): 545-552. DOI:10.1007/s002530051431.
[5] CORNNA-GONZALEZ R I, MIRAMONTES-MURILLO R,ARRIOLA-GUEVARA E, et al. Immobilization of Actinobacillus succinogenes by adhesion or entrapment for the production of succinic acid[J]. Bioresource Technology, 2014, 164: 113-118. DOI:10.1016/j.biortech.2014.04.081.
[6] GUETTLER M V, RUMLER D, JAIN M K. Actinobacillus succinogenes sp. nov., a novel succinic-acid-producing strain from the bovine rumen[J]. International Journal of Systematic Bacteriology,1999, 49(1): 207-216. DOI:10.1099/00207713-49-1-207.
[7] 白雪飞, 陈可泉, 叶贵子, 等. 发酵产丁二酸过程中废弃细胞的循环利用[J]. 生物工程学报, 2010, 26(9): 1276-1280. DOI:10.13345/j.cjb.2010.09.003.
[8] WAN C, LI Y, SHAHBAZI A, et al. Succinic acid production from cheese whey using Actinobacillus succinogenes 130 Z[J]. Applied Biochemistry and Biotechnology, 2008, 145(1/2/3): 111-119.DOI:10.1007/s12010-007-8031-0.
[9] 申乃坤, 王青艳, 秦艳, 等. 木薯粉同步糖化发酵(SSF)产丁二酸[J].微生物学通报, 2014, 41(8): 1507-1515. DOI:10.13344/j.microbiol.china.130712.
[10] SHEN N K, QIN Y, WANG Q Y, et al. Production of succinic acid from sugarcane molasses supplemented with a mixture of corn steep liquor powder and peanut meal as nitrogen sources by Actinobacillus succinogenes[J]. Letters in Applied Microbiology, 2015, 60(6): 544-551. DOI:0.1111/lam.12399.
[11] ZHANG A Y Z, SUN Z, LEUNG C C J, et al. Valorization of bakery waste for succinic acid production[J]. Green Chemistry, 2013, 15(3):690-695. DOI:10.1039/C2GC36518A.
[12] XI Y L, CHEN K Q, DAI W Y, et al. Succinic acid production by Actinobacillus succinogenes NJ113 using corn steep liquor powder as nitrogen source[J]. Bioresource Technology, 2013, 136: 775-779.DOI:10.1016/j.biortech.2013.03.107.
[13] ZHAO Y, CAO W J, WANG Z, et al. Enhanced succinic acid production from corncob hydrolysate by microbial electrolysis cells[J]. Bioresource Technology, 2016, 202: 152-157. DOI:10.1016/j.biortech.2015.12.002.
[14] THOMPSON J C, HE B B. Characterization of crude glycerol from biodiesel production from multiple feedstocks[J]. Applied Engineering in Agriculture, 2006, 22(2): 261-265. DOI:10.13031/2013.20272.
[15] 吴论文, 杨美慧, 姚瑶, 等. 生物柴油副产品粗甘油质量浓度对裂殖壶菌生长与积累油脂的影响[J]. 食品与发酵工业, 2015, 41(5): 30-34. DOI:10.13995/j.cnki.11-1802/ts.201505006.
[16] 朱大伟, 张九花, 马江锋, 等. A. succinogenes甘油利用突变株对丁二酸合成的影响[J]. 化工时刊, 2013, 27(7): 1-4.
[17] 牛坤, 秦海彬, 柳志强, 等. 甘油发酵生产3-羟基丙酸的代谢改造工程菌研究进展[J]. 食品与发酵工业, 2006, 40(4): 567-569.DOI:10.13995/j.cnki.11-1802/ts.201506044.
[18] CARVALHO M, MATOS M, ROCA C, et al. Succinic acid production from glycerol by Actinobacillus succinogenes using dimethylsulfoxide as electron acceptor[J]. New Biotechnology, 2014, 31(1): 133-139.DOI:10.1016/j.nbt.2013.06.006.
[19] VLIYSIDIS A, BINNS M, WEBB C, et al. Glycerol utilization for the production of chemicals: conversion to succinic acid, a combined experimental and computational study[J]. Biochemical Engineering Journal, 2011, 58: 1-11. DOI:10.1016/j.bej.2011.07.004.
[20] 刘宇鹏, 郑璞, 倪晔, 等. 碳源对琥珀酸放线杆菌发酵产丁二酸的影响及其代谢流量分析[J]. 微生物学通报, 2009, 32(9): 1283-1288.DOI:10.13344/j.microbiol.china.2009.09.009.
[21] 姜岷, 蔡婷, 陈可泉, 等. 一株丁二酸高产菌株的筛选和鉴定[J]. 工业微生物, 2008, 38(3): 38-42.
[22] LIN S K C, DU C, KOUTINAS A, et al. Substrate and production inhibition kinetics in succinic acid production by Actinobacillus succinogenes[J]. Biochemistry Engineer Journal, 2008, 41: 128-135.DOI:10.1016/j.bej.2008.03.013.
[23] URBANCE S E, POMETTO A L, DISPIRITO A A, et al. Evaluation of succinic acid continuous and repeat-batch biofilm fermentation by Actinobacillus succinogenes using plastic composite support bioreactors[J]. Applied Microbiology and Biotechnology, 2004, 65:664-670. DOI:10.1007/s00253-004-1634-2.
[24] GUNNARSSON I B, KARAKASHEV D, ANGELIDAKI I. Succinic acid production by fermentation of Jerusalem artichoke tuber hydrolysate with Actinobacillus succinogenes 130Z[J]. Industry Crop Production, 2014, 62: 125-129. DOI:10.1016/j.indcrop.2014.08.023.
[25] THUY N T H, KONGKAEW A, FLOOD A, et al. Fermentation and crystallization of succinic acid from Actinobacillus succinogenes ATCC55618 using fresh cassava root as the main substrate[J].Bioresource Technology, 2017, 233: 342-352. DOI:10.1016/j.biortech.2017.02.114.
[26] XI Y L, CHEN K Q, JIANG M, et al. Effect of biotin and similar compound on succinic acid fermentation by Actinobacillus succinogenes in a chemically defined medium[J]. Biochemistry Engineer Journal, 2012, 69: 87-92. DOI:10.1016/j.bej.2012.08.016.
[27] 申乃坤, 王青艳, 黄日波, 等. 响应面法优化耐高温酵母生产高浓度乙醇[J]. 生物工程学报, 2010, 26(1): 42-47. DOI:10.13345/j.cjb.2010.01.010.
[28] 陈炼红, 杨丽珠, 索化夷, 等. 响应面法优化松茸多糖酶法提取工艺及其体外抗氧化性分析[J]. 食品科学, 2014, 35(16): 23-28.DOI:10.7506/spkx1002-6630-201416005.
[29] 蒲立柠, 陈光静, 阚建全. 响应面试验优化青稞麸皮薏仁红曲霉发酵工艺[J]. 食品科学, 2017, 38(2): 264-270. DOI:10.7506/spkx1002-6630-201702041.