藏灵菇是我国西藏牧区常用的乳品发酵剂,其发酵乳具有调节血压和血脂等多种保健功能,是潜在功能性乳品发酵剂菌株的来源[1],工业生产性能受到了广泛关注。藏灵菇是一种混菌体系,有乳酸菌、酵母菌、乙酸菌等,藏灵菇在发酵牛乳时,能同时进行乳酸、乙酸、酒精发酵,它们之间通过相互混合、相互作用,会产生区别于其他酸奶的特殊风味[2-3]。
干酪是乳制品中营养价值很高的一种产品,在许多国家干酪已成为人们膳食中的必需品。近年来中国的干酪消费增长也较快,但是中国居民的饮食习惯、对奶酪的认知情况和消费能力等因素制约了干酪在中国的发展[4-5]。利用我国特色微生物资源发展适合消费者饮食习惯的干酪是重要途径之一。藏灵菇发酵乳的研究已经有很多,本实验采用藏灵菇发酵干酪,通过适当时间进行成熟,使其产生独特的风味和口感,制成品比藏灵菇发酵乳具有更好的保藏性能。
由于干酪的成熟及风味的形成是一个昂贵且费时的过程,许多研究者通过建立模型达到快速准确评价添加特定菌株对干酪成熟及品质的影响。Kristofferse等[6]报道了采用新鲜的干酪凝乳浆可以加快成熟,干酪浆体系含有较高的水分,并且采用较高的成熟温度(30~32 ℃),从而起到了快速成熟的效果。国外许多研究者采用或改进此模型,将其作为一种快速可靠的工具用于评价不同添加物对干酪成熟的影响[7-8]。国内目前有周蕊等[9]用干酪浆模型研究干酪的蛋白质降解。本研究采用一种切达干酪浆快速成熟模型,通过控制干酪凝乳及干酪模型的制备条件,使外界野生非发酵剂乳酸菌的影响降至最小,评价藏灵菇在干酪模型成熟过程中对挥发性风味物质形成的影响。
国外采用固相微萃取(solid phase micro-extraction,SPME)法对干酪风味的研究成果较多[10],而国内目前有张国农[11]、衣宇佳[12]等采用SPME法对再制干酪和国产干酪风味进行初步研究,对藏灵菇发酵切达干酪的风味研究鲜见报道。本研究采用SPME与气相色谱-嗅闻-质谱联用技术(gas chromatography-olfactometry-mass spectrometry,GC-O-MS)对不同成熟期的藏灵菇发酵切达干酪模型中的挥发性风味成分进行分析研究[13],同时与商业发酵剂制作的切达干酪模型进行比较,对重要风味组分的可能来源及其对干酪风味的贡献特征进行讨论,并结合感官分析,以期为我国传统藏灵菇发酵切达干酪制品的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
生牛乳 北京市沙河春山奶牛场;R-704奶酪商业发酵剂 丹麦科汉森公司;藏灵菇 实验室保藏;CHY-MAX凝乳酶 丹麦科汉森公司;脱脂乳粉、氯化钠均为食品级。
1.2 仪器与设备
PL203电子天平 梅特利-托利多仪器(上海)有限公司;数显恒温水浴锅、恒温培养箱 上海一恒科技有限公司;固相微萃取手动进样手柄、DVB-CAR-PDMS(2 cm,50/30 μm)纤维头 美国Supelco公司;GC-MS联用仪、ODP Gerstel嗅闻检测器 美国Agilent公司;高压蒸汽灭菌锅 日本Sanyo公司;超净工作台 北京东联哈尔仪器制造有限公司。
1.3 方法
1.3.1 藏灵菇发酵乳的制备
取低温保存的藏灵菇1 g接入100 mL质量分数11%的经杀菌处理(115 ℃,15 min)的脱脂乳培养基中,置于25 ℃恒温培养箱中静置培养活化24 h后,用无菌生理盐水将藏灵菇冲洗干净,称取1 g接种至100 mL已灭菌的牛乳中,25 ℃发酵24 h,过滤出藏灵菇获得藏灵菇发酵乳。
1.3.2 干酪凝乳的制作工艺流程
原料乳→杀菌(65 ℃,30 min)→冷却(30 ℃)→接菌种(1%商业发酵剂)→搅拌→静置发酵→添加凝乳酶(pH值为6.5时加0.002%凝乳酶)→搅拌→凝乳→切割(约1 cm3的小方块)→热烫排乳清(缓慢加热至42 ℃,每5 min升高1 ℃)→凝块堆砌(至排出乳清pH值降至5.5)→切块即得干酪凝乳
1.3.3 干酪浆模型的制作[14]
分别取100 g上述干酪凝乳装入无菌真空袋中,对照组加入50 mL 5 g/100 mL的灭菌氯化钠溶液,实验组加入47 mL 5 g/100 mL的灭菌氯化钠溶液和3 mL(接菌量为1%)的藏灵菇发酵乳,搅打成浆状,真空密封。对照组与实验组在30 ℃培养箱中培养,分别于0、12 d取样分析。上述操作均在无菌操作室内进行,制作过程中所用的搅拌器及切割刀等所用器具使用前蒸汽灭菌(121 ℃,60 min)。
1.3.4 SPME-GC-MS条件
SPME条件:分别取对照组第0天干酪样品、实验组第0天干酪样品及在30 ℃培养箱中培养12 d的对照组和实验组干酪样品各5 g,磨碎后加入到30 mL萃取瓶中,加入1 μL质量浓度为9.0 μg/mL的二甲基戊酸作内标,用聚四氟乙烯隔热垫密封。置于60 ℃水浴中平衡30 min,然后将老化好的纤维萃取头插入萃取瓶中进行萃取,顶空萃取30 min。然后在GC-MS进样口解吸5 min,进行GC-MS联机分析,为保证实验结果的稳定性,每个萃取条件重复实验3 次。
GC条件:采用DB-WAX毛细管柱(30 m×250 μm,0.25 μm)。色谱柱升温程序为:初始温度40 ℃,保持2.5 min,以5 ℃/min升温到200 ℃,再以10 ℃/min升温到230 ℃,保持5 min。载气为He,恒定流速3 mL/min,进样口温度250 ℃。
MS条件:电子电离源,电子能量70 eV,传输线温度280 ℃,离子源温度230 ℃,四极杆温度150 ℃,质量扫描范围m/z 35~400。
1.3.5 GC-O-MS检测
嗅觉检测器接口温度200 ℃,为防止实验员鼻孔干燥,检测时通入湿润空气。流出物以1∶1的分流比分别流入MS和嗅闻检测器。
毛细管末端采用GC-MS法分析样品,得到样品中各挥发性风味化合物的保留时间,同时由感官评价员进行嗅闻实验。采用时间强度法检测样品中的特征风味化合物。具体步骤为:感官评价员在嗅到气味时按下手柄按钮以记录嗅闻时间,并选择手柄上的气味强度同时在耳麦中描述气味特征。手柄上的气味强度选项为S、M、L(S=弱,M=中,L=强)。此外为避免嗅觉疲劳,待测样品每人嗅闻20 min后换下一人,交替进行。
1.3.6 感官评定
由10 名从事食品研究、有一定感官评定经验的人员组成感官评定小组,每次评定由每个评定员单独进行,相互不接触,样品评定之间用纯净水漱口。根据Muir等[15]描述的对半硬质干酪感官评定的方法,选定9 个描述干酪风味的指标,分别为风味强度、奶香味、水果香甜味、酸味、坚果味、咸味、苦味、不洁风味、风味接受度。评定采取五分制,其打分标准为:1 分(气味或滋味极淡,程度极低);2 分(气味或滋味较淡,程度较低);3 分(气味或滋味稍浓,程度中等);4 分(气味或滋味较浓,程度较高);5 分(气味或滋味很浓,程度极高)。
1.4 数据处理
挥发性成分分析:运用NIST14谱库检索,保留匹配度大于或等于800的成分;通过计算保留指数结合文献保留指数进一步对化合物进行定性。采用内标法进行定量分析,通过峰面积比值计算各组分含量。
数据分析:每个样品均设3 次重复,数据以 ±s表示,采用SPSS 12.0软件进行方差分析,P<0.05表示差异显著。
2 结果与分析
2.1 SPME-GC-O-MS检测结果与成分分析
2.1.1 SPME-GC-O-MS检测结果
成熟第0天、第12天的商业发酵剂制作的切达干酪模型(对照组)和藏灵菇发酵的切达干酪模型(实验组)在相同的取样条件和分析条件下进行比较,GC-MS分离鉴定各干酪样品中挥发性风味成分的种类及含量见表1。
表1 切达干酪模型挥发性成分GC-MS分析结果
Table 1 GC-MS analysis of volatile flavor compounds in Cheddar cheese models
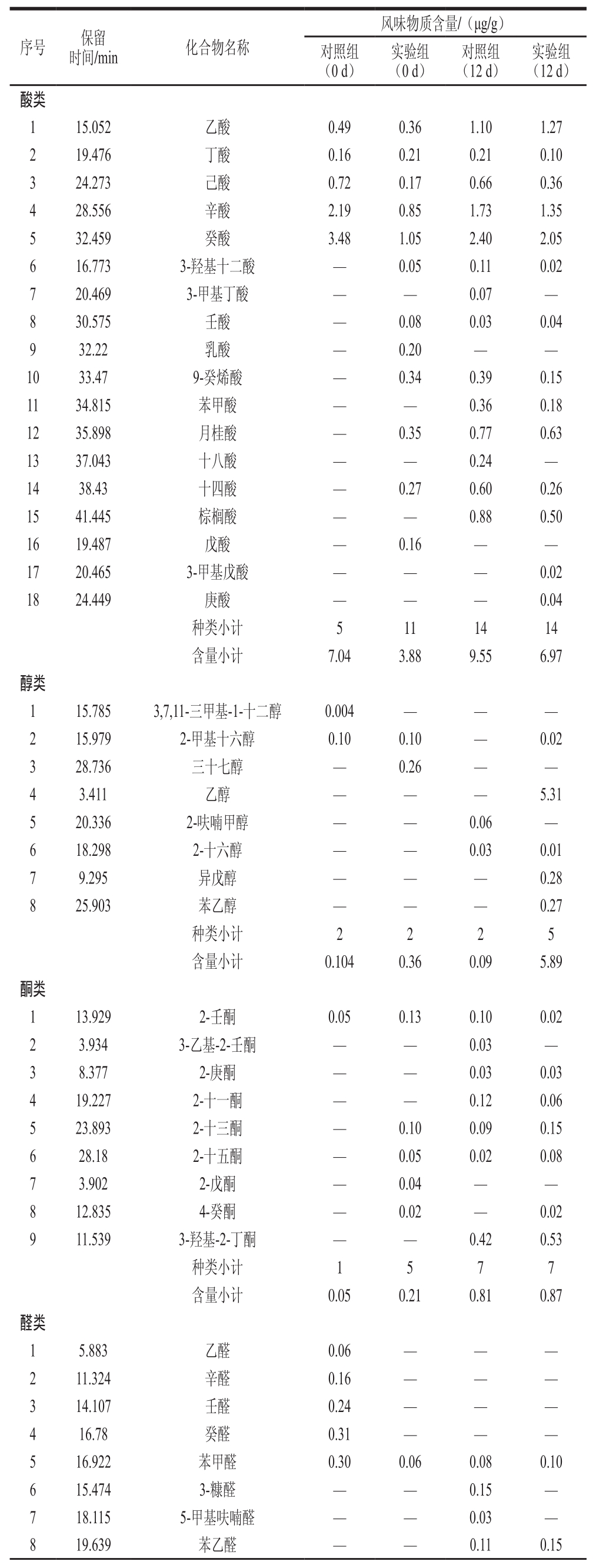
续表1
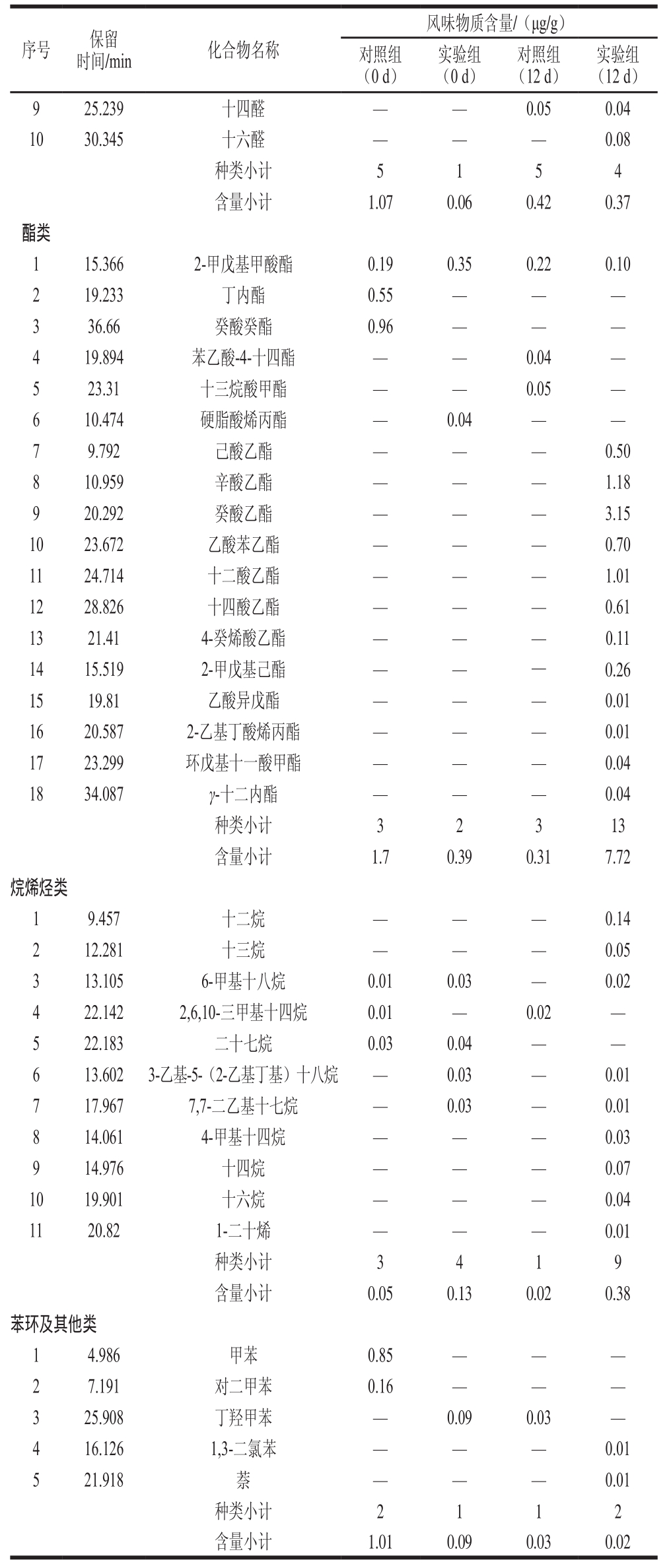
注:—.未检出。
由表1可以看出,对照组和实验组干酪样品在不同发酵期的挥发性成分数量及含量都存在较大差异。利用GC-MS从成熟第0天的商业发酵剂干酪样品中鉴定出21 种挥发性风味成分,其中酸类5 种、醇类2 种、酮类1 种、醛类5 种、酯类3 种、烃类3 种及苯环类2 种;从成熟第0天的藏灵菇干酪样品中鉴定出26 种挥发性风味成分,包括酸类11 种、醇类2 种、酮类5 种、醛类1 种、酯类2 种、烃类4 种及苯环1 种;从成熟第12天的商业发酵剂制作的干酪样品中鉴定出33 种挥发性风味成分,包括酸类14 种、醇类2 种、酮类7 种、醛类5 种、酯类3 种、烃类1 种及苯环1 种;从成熟第12天的藏灵菇干酪样品中鉴定出54 种挥发性风味成分,包括酸类14 种、醇类5 种、酮类7 种、醛类4 种、酯类13 种、烃类9 种及苯环2 种。大多数化合物与半硬质干酪成熟期间形成的风味化合物[16]一致,这也说明采用促熟的干酪浆模型来研究菌株对干酪成熟过程中挥发性风味化合物的影响具有可行性。
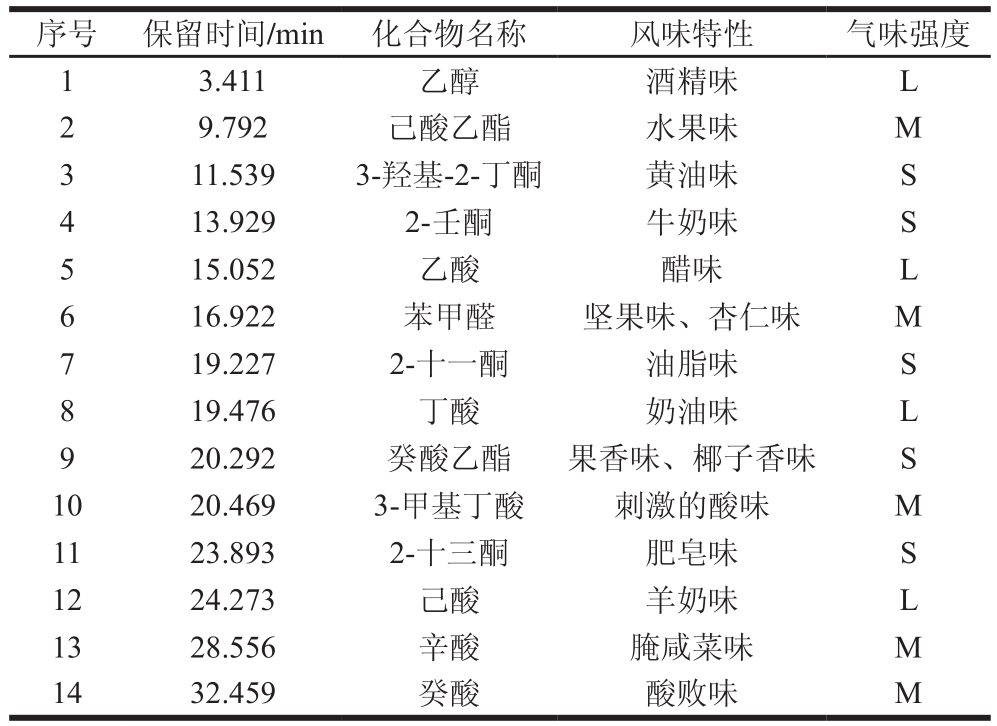
2.1.2 挥发性物质分析
由表1可知,切达干酪风味物质较丰富的主要是酸类、酯类、醛类和醇类,成熟第12天的藏灵菇切达干酪可检出的风味物质明显增加。且不同发酵阶段挥发性风味化合物的种类和含量有较大差别,成熟初期(0 d)以脂肪酸类物质为主,成熟后期(12 d)以芳香族类、醇类、酮类物质为主。
2.1.2.1 酸类化合物
挥发性有机酸主要由乳中脂肪在脂肪酶的作用下水解形成[17],有显著的特征气味,是乳制品清爽口感和乳香味的主要来源。脂肪水解后形成的各种脂肪酸类物质本身具有挥发性风味而且还是其他风味物质(如甲基酮、醇、酯等)的前体物质[18]。通常干酪中脂肪酸类化合物的来源主要有3 种:一是原料乳中固有的,如丁酸;二是通过发酵剂中微生物代谢产生,如丙酸;三是发酵过程中乳脂肪或氨基酸降解产生[19]。商业发酵剂制作的切达干酪模型在成熟第0天时,检测到5 种酸类化合物;成熟到第12天时,检测到14 种酸类化合物,酸类总含量为9.55 μg/g;藏灵菇发酵的切达干酪模型在成熟第0天时,检测到11 种酸类化合物;成熟第12天时,检测到14 种化合物,且酸类总含量为6.97 μg/g。成熟第12天的实验组和对照组干酪模型中脂肪酸类物质总含量均明显高于成熟第0天的现象,说明干酪成熟过程中凝块中残存的乳酸菌释放的胞外脂肪酶和乳酸菌自溶产生的胞内脂肪酶共同将干酪中脂肪水解成为游离脂肪酸,使总酸含量在成熟过程中显著增加;而在成熟第12天的实验组干酪比对照组干酪酸类化合物含量要低,是因为到成熟后期,脂肪酸经过一系列生化反应进一步转变为甲基酮或自动氧化为醛类[20],同时酸类和醇类会反应生成酯类,导致酸类化合物总量有所下降,所以成熟后期干酪中的酸类化合物的生成量增加有限。短链脂肪酸(C4~C12)的生成,具有某些显著的特征气味且风味阈值较低,对于形成干酪的风味是非常重要的[21]。由表2可知,乙酸、丁酸、己酸、辛酸、癸酸等酸类物质是使干酪呈现出特殊酸味的关键物质,构成了切达干酪的主体特征气味。
2.1.2.2 醇类化合物
醇类化合物在成熟第12天的实验组干酪中有较高的产生量,尤其是检测出较多的乙醇,分析原因一是藏灵菇中含有酵母菌,可以产生乙醇;二是干酪生化反应途径中的脂肪酶对干酪中的脂肪酸进行降解生成醇类化合物。乙醇主要由乳糖代谢中磷酸戊糖途径生成[22],干酪中醇类物质还可能来源于甲基酮还原[23]、氨基酸代谢、亚油酸及亚麻酸降解[24]。一般来讲,醇类化合物由于阈值较高,对干酪风味的贡献没有像酯类化合物那么明显,但是醇类化合物和酸类化合物在干酪成熟过程中会反应生成酯类,间接影响干酪风味化合物的变化。本研究中检测到的3-甲基-1-丁醇(异戊醇)具有一定的果香、香蕉香;2-呋喃甲醇具有甜香;乙醇具有酒香味。苯乙醇在大部分软质奶酪中都能检测到,具有花香味,对于干酪香气轮廓的形成具有重要作用[25]。醇类化合物在干酪中的贡献主要提供酒香、植物香味,由表2可知,乙醇所带来的酒香味是藏灵菇发酵切达干酪模型风味的一大特色。
2.1.2.3 酮类化合物
对照组干酪成熟第0天与第12天的酮类化合物含量分别为0.05 μg/g和0.81 μg/g,实验组干酪成熟第0天与第12天的酮类化合物含量分别为0.21 μg/g和0.87 μg/g,对照组和实验组酮类含量相差不大。酮类化合物主要是由不饱和脂肪酸的β氧化降解或热降解以及氨基酸降解或者微生物代谢产生[26],该类化合物阈值低,可以赋予乳制品典型的风味[27],同时也是干酪中不可或缺的风味组分[28]。在对照组干酪和实验组干酪中均检测出2-庚酮,2-庚酮是由亚油酸氧化产生,赋予干酪奶油气味,是切达、青纹干酪所具有的独特风味物质。在成熟第12天的对照组干酪中检出3-羟基-2-丁酮(乙偶姻),3-羟基-2-丁酮具有强烈的黄油、脂肪气味[29];2-壬酮呈奶香、奶油的气味[17];2-戊酮具有轻微的乳样香气[30],由表2可知,酮类化合物嗅闻出了黄油味、油脂味和牛奶味。
2.1.2.4 醛类化合物
干酪中醛类大多由脂肪酸和游离脂肪酸发生自动氧化而生成,具有强烈刺鼻气味,随分子质量增大,刺激性逐渐减小,并呈现愉快香气,通常表现出青透气息[31],如3-糠醛和苯甲醛都提供苦杏仁味香气[17]。醛类化合物的化学性质比较活泼,属于不稳定的中间体化合物,在一定条件下易被还原成相应的醇,因此通常而言,这类化合物在乳制品中的含量都不高。尽管如此,由于这类化合物风味阈值较低,对香气的贡献较大,因而仍是乳制品风味中不可缺少的部分。本实验中检出的醛类化合物主要有乙醛、辛醛、壬醛和苯甲醛。乙醛呈清爽的芳香味,是干酪中典型的挥发性风味物质,在发酵过程中主要由乳酸菌通过乳糖代谢和分解作用生成以及苏氨酸在苏氨酸醛缩酶催化作用下降解生成[22]。辛醛有很强烈的水果香味,壬醛具有板油气息[32]。苯甲醛是由色氨酸或苯丙氨酸转化而来的,对干酪整体良好风味的形成有重要作用[33],具有苦杏仁、樱桃及坚果香气[17],与表2嗅闻分析结果一致。
2.1.2.5 酯类化合物
酯类化合物是成熟第12天的藏灵菇发酵切达干酪模型中最重要的芳香物质,乙酯类化合物又是干酪中酯类物质最重要的一类,共检测出13 种酯类化合物,其中乙酯类化合物7 种。乙酯类化合物是由乙醇和干酪中的脂肪酸反应产生,干酪会呈现果实香气,故干酪中的水果味可认为是由于乙醇或它的前体物过量产生的[34]。例如己酸乙酯可以提供果香味和蜡味;辛酸乙酯有水果香和椰子香味;癸酸乙酯既有果香味还具有明显的椰子香味[35],和表2嗅闻分析结果相同。短链的酯类化合物不仅在常温条件下挥发性较强,还具有极低的阈值(10-9级),因而中、短碳链的脂肪酸乙酯具有较大的风味贡献潜力,己酸乙酯、辛酸乙酯、丁酸乙酯等,这类酯类物质的混合物被称为黄油酯[17],是乳制品中的特征风味组分,因而对于干酪香气轮廓的形成具有重要的意义。
2.1.2.6 烯烃、苯环及其他类化合物
烃类化合物普遍存在于干酪成分中,但由于烃类物质具有较高的芳香阈值,因此对于干酪的整体风味贡献较小[12]。但由苯环、萘环组成的芳香烃具有较强的芳香风味[32]。例如甲苯具有一定的果仁味、杏仁味及苦涩味[36]。烃类化合物种类繁多,包括直链烷烃和支链烯烃等。本实验检测出的烷烃主要是一些短链直链烷烃。这类组分大部分阈值也较高,对于干酪风味轮廓的贡献也相对较小。
2.2 不同发酵剂制作的切达干酪模型不同成熟期的感官品质分析
表3 感官评价实验结果
Table 3 Results of sensory evaluation
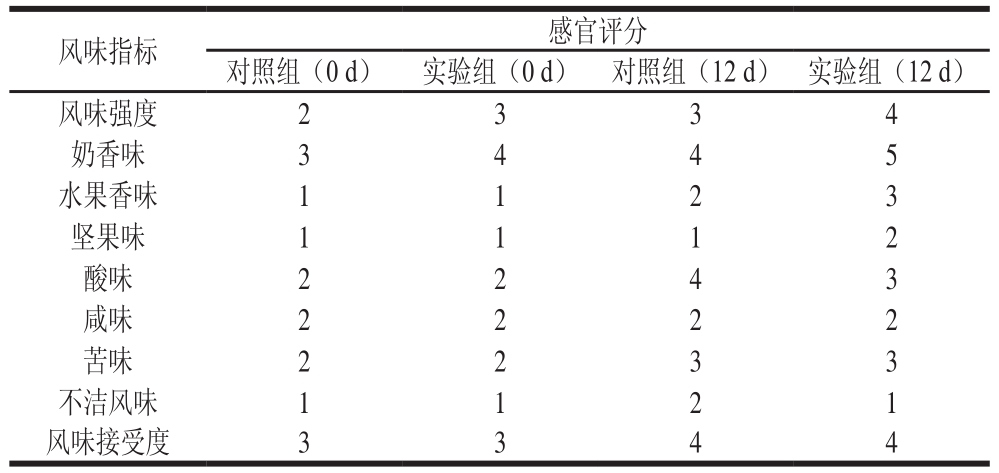
由表3可知,比较4 组干酪模型,风味强度最强的是成熟第12天藏灵菇发酵的切达干酪模型,其水果香味较其他3 组突出,结合GC-O-MS结果可知,主要是因为成熟第12天的实验组中酯类化合物种类多且含量高。因为藏灵菇中含有酵母菌,可以产生大量乙醇,乙醇和干酪中的脂肪酸反应产生乙酯类化合物,故乙醇带来的酒香味和酯类带来的水果香味是藏灵菇发酵切达干酪模型的一大特色,因此使得藏灵菇发酵的切达干酪模型香气更加浓厚。
表4 主成分分析相关系数矩阵Table 4 Correlation matrix of PCA

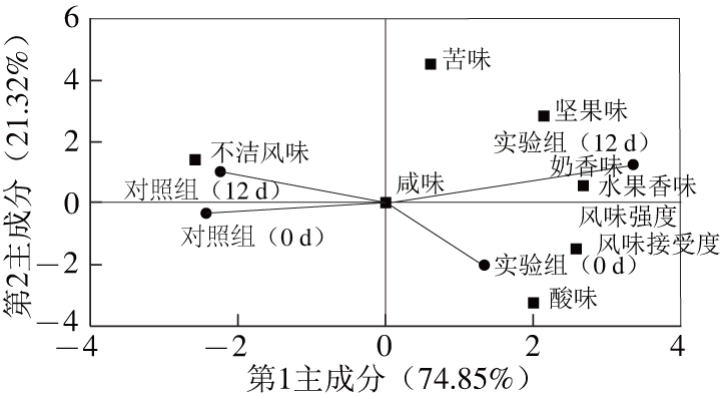
图1 4 种干酪和9 种风味指标在第1和第2主成分上的分布散点图
Fig. 1 PCA biplots for 4 Cheese samples with 9 flavor indexes
不同发酵剂制作的切达干酪模型的风味物质种类和含量上均有较大差异,含量差异最大的是酯类化合物,其次是醇类化合物。这使得不同发酵剂制作的切达干酪模型表现出不同的风味趋向、不同的感官评价结果。为明确藏灵菇对切达干酪模型风味的影响,利用主成分分析法考察了感官指标与样品间的分布关系。由表4可以看出,风味强度与奶香味、水果香味和坚果味存在极显著相关关系,与酸味也有着较显著相关关系。由此可见,许多指标之间直接的相关性比较强,证明它们存在信息上的重叠。由图1可知,风味强度、坚果味、水果香味、奶香味、风味接受度在第1主成分上有较高载荷,说明第1主成分基本反映了这些指标的信息;酸味和苦味在第2主成分上有较高载荷,说明第2主成分基本反映了这2 个指标的信息。所以提取2 个主成分是可以基本反映全部指标的信息。第1主成分和第2主成分的累计贡献率为96.17%。第1主成分将对照组和实验组干酪模型区分,说明藏灵菇对切达干酪模型的风味产生了影响。藏灵菇发酵切达干酪模型增强了干酪的风味强度,赋予干酪以较强的水果香味和奶香味。
3 结 论
本实验成功构建了快速成熟切达干酪模型并用GC-MS和GC-O技术结合感官评价验证了此模型。本研究所检测到的大多数化合物与文献报道的半硬质干酪成熟期间形成的风味化合物一致,说明促熟的切达干酪浆模型的可行性。通过SPME-GC-O-MS对不同成熟期的藏灵菇发酵切达干酪的挥发性风味组分研究结果表明,醇类和酯类是成熟过程中的主要风味物质。成熟初期以脂肪酸类物质为主;成熟后期以醇类、酮类和芳香族类物质为主。分离检测所得的酯类物质中癸酸乙酯、辛酸乙酯、己酸乙酯的含量较高,形成了果味特征,赋予干酪以淡淡的果味气息。醇类物质主要是乙醇和异戊醇,表现出温和的花香味及酒香味。酸类物质以乙酸、己酸、辛酸和癸酸为主,主要贡献了干酪风味中的醋味、酸味以及部分奶香味,由于酸类化合物风味阈值较高,所以带给干酪的风味较弱些。醛、酮类物质分离检测出的较少,这是由于它们在干酪成熟过程中属于过渡态化合物,不会在干酪中进行显著积累。藏灵菇发酵的切达干酪增强了干酪的风味强度,乙醇带来的酒香味及酯类带来的水果香味是本干酪的一大特色。
参考文献:
[1] 姜岸, 祁正华, 田小川, 等. 藏灵菇微生物学及保健功能研究开发进展[J]. 黑龙江医药, 2015, 28(4): 713-718. DOI:10.14035/j.cnki.hljyy.2015.04.005.
[2] CAIS S D, WOJTOWSKLI J, PIKUL J, et al. Formation of volatile compounds in kefir made of goat and sheep milk with high polyunsaturated fatty acid content[J]. Journal of Dairy Science, 2015,98(10): 6692-6705. DOI:10.3168/jds.2015-9441.
[3] 李剑, 周剑忠, 孙宇辉, 等. 藏灵菇中有益微生物的分离与鉴定[J]. 江苏农业科学, 2009(1): 242-244. DOI:10.15889/j.issn.1002-1302.2009.01.060.
[5] 王丁棉. 奶酪在中国的发展现状及对策[J]. 食品工业科技, 2006,27(8): 11-14. DOI:10.13386/j.issn1002-0306.2006.08.001.
[6] KRISTOFFERSEN T, MILCOLAJCIK E M, GOULD I A. Cheddar cheese flavor. IV. Directed and accelerated ripening process[J].Dairy Science, 1967, 50(3): 292-297. DOI:10.3168/jds.S0022-0302(67)87412-5.
[7] ROBERTS M, WIJESUNDERA C M, BRUNINENBER P G, et al.Development of an aseptic cheese curd slurry system for cheese ripening studies[J]. Dairy Technology, 1995, 50: 66-69.
[8] CLIFFE A J, LAW B A. Peptide composition of enzyme-treated Cheddar cheese slurries, determined by reverse phase high performance liquid chromatography[J]. Food Chemistry, 1990, 36: 73-80.DOI:10.1016/0308-8146(90)90009-S.
[9] 周蕊, 李晓东, 潘超. 促熟干酪的非发酵剂乳酸菌筛选及其对干酪浆模型蛋白质降解的研究[J]. 食品科学, 2012, 33(1): 131-135.
[10] CENTENOA J A, GARABAL J I, DOCAMPO F. Recovering traditional raw-milk Tetilla cheese flavour and sensory attributes by using Kocuria varians and Yarrowia lipolytica adjunct cultures[J].International Journal of Food Microbiology, 2017, 251(19): 33-40.DOI:10.1016/j.ijfoodmicro.2017.03.014.
[11] 张国农, 顾敏锋, 李彦荣, 等. SPME-GC/MS测定再制干酪中的风味物质[J]. 中国乳品工业, 2006, 34(9): 52-60.
[12] 衣宇佳, 田怀香, 汤坚. 国产类契达干酪的风味研究[D]. 无锡: 江南大学, 2008.
[13] ACHOURI A, BOYE J, ZAMANI Y. Identification of volatile compounds in soymilk using solid-phase microextractiongas chromatography[J]. Food Chemistry, 2006, 99(4): 759-766.DOI:10.1016/j.foodchem.2005.09.001.
[14] 莫蓓红, 赵建, 苗君莅, 等. 一种植物乳杆菌对干酪模型成熟中微生物及蛋白质水解的影响[J]. 食品工业科技, 2012, 33(7): 100-104.DOI:10.13386/j.issn1002-0306.2012.07.062.
[15] MUIR D D, HUNTER E A. Sensory evaluation of Cheddar cheese:order of tasting and carryover effects[J]. Food Quality, 1991, 3: 141-145.DOI:10.1016/0950-3293(91)90050-O.
[16] O’RIORDAN P, DELAHUNTY C, WALLACE J M. Identification of odour active volatile compounds in Cheddar cheese by gas chromatography-olfactometry[J]. Agriculture and Food Research,1999, 38(1): 160.
[17] 孙宝国. 食用调香术[M]. 北京: 化学工业出版社, 2003.
[18] TERZIĆ-VIDOJEVIĆ A, TONKOVIĆ K, PAVUNC A L, et al.Evaluation of autochthonous lactic acid bacteria as starter cultures for production of white pickled and fresh soft cheeses[J]. LWT-Food Science and Technology, 2015, 68(1): 298-306. DOI:10.1016/j.lwt.2015.03.050.
[19] 吴娜, 王锡昌, 陶宁萍, 等. 动物源食品中脂质氧化降解产物检测的研究进展[J]. 食品安全质量检测学报, 2014, 5(10): 3042-3046.
[20] 丁耐克. 食品风味化学[M]. 北京: 中国轻工业出版社, 1996.
[21] PRICE E J, LINFORTH R S T, DODD C E R, et al. Study of the influence of yeast inoculum concentration (Yarrowia lipolytica and Kluyveromyces lactis) on blue cheese aroma development using microbiological models[J]. Food Chemistry, 2014, 145(6): 464-472.DOI:10.1016/j.foodchem.2013.08.081.
[22] GÓMEZ-TORRES N, ÁVILA M, DELGADO D, et al. Effect of reuterin-producing Lactobacillus reuteri coupled with glycerol on the volatile fraction, odour and aroma of semi-hard ewe milk cheese[J].International Journal of Food Microbiology, 2016, 90: 103-110.DOI:10.1016/j.ijfoodmicro.2016.05.031.
[23] 赵丹, 杜仁鹏, 刘鹏飞, 等. 代谢组学在乳酸菌发酵食品研究中的应用[J]. 中国农学通报, 2015, 31(8): 240-244.
[24] RYCHLIK M, BOSSET J O. Flavour and off-flavour compounds of Swiss Gruyere cheese. evaluation of potent odorants[J]. International Dairy Journal, 2001, 11(11/12): 895-901. DOI:10.1016/S0958-6946(01)00108-X.
[25] 徐幸, 舒平, 张晓鸣. 偏最小二乘回归分析乳扇在贮藏期间挥发性物质与感官特性的关系[J]. 现代食品科技, 2016, 32(12): 1-8.DOI:10.13982/j.mfst.1673-9078.2016.12.048.
[26] BETOLINO M, DOLCI P, GIORDANO M, et al. Evolution of chemico-physical characteristics during manufacture and ripening of Castelmagno PDO cheese in winter time[J]. Food Chemistry, 2011,129(3): 1001-1011. DOI:10.1016/j.foodchem.2011.05.060.
[27] SULEJMANI E, HAYALOGLU A A. Influence of curd heating on proteolysis and volatiles of Kashkaval cheese[J]. Food Chemistry,2016, 211(15): 160-170. DOI:10.1016/j.foodchem.2016.05.054.
[28] 张玥琪, 郭贝贝, 张丰义, 等. 蓝波奶酪挥发性风味成分的分离与鉴定[J]. 食品科学, 2015, 36(16): 132-136.
[29] SINGH T K, DRAKE M A, CADWALLADER K R. Flavor of Cheddar cheese: a chemical and sensory perspective[J]. Comprehensive Reviews in Food Science and Food Safety, 2003, 2(4): 166-189.DOI:10.1111/j.1541-4337.2003.tb00021.x.
[30] 林翔云. 香料香精辞典[M]. 北京: 化学工业出版社, 2007.
[31] OZTURKOGLU-BUDAK S, GURSOY A, AYLCAS D P, et al.Volatile compound profiling of Turkish Divle Cave cheese during production and ripening[J]. Dairy Science, 2016, 99(7): 5120-5131.DOI:10.3168/jds.2015-10828.
[32] 张晓鸣. 食品风味化学[M]. 北京: 中国轻工业出版社, 2009.
[33] LAWLOR J B, DELAHUNTY C M, WILKINSON M G, et al.Relationships between the sensory characteristics, neutral volatile composition and gross composition of ten cheese varieties[J]. Lait,2001, 81(4): 487-507.
[34] 田怀香, 衣宇佳, 郑小平. 同时蒸馏萃取与气相色谱-质谱法分析国产干酪挥发性风味物质[J]. 食品工业科技, 2009, 30(4): 73-76.DOI:10.13386/j.issn1002-0306.2009.04.023.
[35] MOLIMARD P, SPINNLER H E. Review: compounds involved in the flavor of surface mold-ripened cheeses: origins and properties[J].Journal of Dairy Science, 1996, 79(2): 169-184. DOI:10.3168/jds.S0022-0302(96)76348-8.
[36] 孙宝国, 刘玉平. 食用香料手册[M]. 北京: 中国石化出版社, 2004.