纳米技术包埋食品添加剂制备缓释型纳米胶囊在食品领域中应用广泛[1],与宏观状态下食品性质与功能相比,将食品材料纳米化可赋予食品许多优良性质[2],包括风味、质构、加工性能[3]以及货架期的稳定性[4]等。自组装是包埋生物活性化合物的有效途径,其定义为基本结构单元(分子、纳米材料等)在氢键、亲疏水作用、范德华力、静电力等非共价键作用力下,自发形成有序结构或形态的过程[5-6],制备过程简单,易操作,不需使用交联剂,可以产生稳定的纳米尺寸颗粒[7]。
丁香酚(4-烯丙基-2-甲氧基苯酚)是从桃金娘科丁香属植物提取的天然酚类化合物,是丁香精油中主要的抑菌成分,作为植物源天然食品防腐抗菌剂,其抑菌谱广,兼备抗氧化性,但其不溶于水、易挥发、稳定性差[8],直接应用难以保证其功能得到充分发挥,在食品实际应用中受到一定的限制[9-10]。将丁香酚作为芯材制成缓释型纳米胶囊,可以达到缓慢释放、延长抑菌作用时间、提高其生物利用度的效果,目前成为研究的热点[11-12]。壳聚糖是一种经甲壳素脱乙酰化衍生的天然产物,是具有广泛来源的唯一阳离子多糖,由于其无毒性,具备良好的生物相容性、生物可降解性以及成凝胶、成颗粒的能力,被用作各种维生素、蛋白质、营养素和酚类化合物的外包封材料[13-19]。明胶来源于胶原蛋白,除缺乏色氨酸外,各类氨基酸丰富,能通过静电力、氢键等相互作用与其他活性物质相结合,被广泛用作食品纳米载体材料[20-24]。
本实验选用明胶、壳聚糖作为载体,采用自组装制备丁香酚-明胶-壳聚糖纳米胶囊(eugenol-gelatin-chitosan nanocapsule,Euo-Gel-CS NPs),通过正交试验得到最佳制备工艺条件,采用包封率、缓释效果和纳米表征方法,评价Euo-Gel-CS NPs形态、微观结构和活性成分含量。
1 材料与方法
1.1 材料与试剂
壳聚糖(脱乙酰度≥95%) 上海阿拉丁试剂有限公司;明胶 国药集团化学试剂有限公司;丁香酚(纯度99%) 上海麦克林生化科技有限公司;冰醋酸、氢氧化钠 广东光华科技股份有限公司;乙醇 成都市科隆化学品有限公司;所用水为超纯水。
1.2 仪器与设备
MS-01H恒温测速磁力搅拌器 美国精祺有限公司;DK-98-II电热恒温水浴锅 天津市泰斯特仪器有限公司;pHS-3C精密pH计 上海日岛科学仪器有限公司;UV-1900双光束紫外-可见分光光度计 上海佑科仪器仪表有限公司;ZS90激光粒度分析仪 英国马尔文仪器有限公司;HT7700透射电子显微镜 日立高新技术公司;Vetex 70傅里叶变换红外光谱仪 德国布鲁克公司;Q2000差示扫描量热仪 美国TA公司;HC-3018R高速冷冻离心机 安徽中科中佳科学仪器有限公司。
1.3 方法
1.3.1 丁香酚标准曲线的建立
根据韩春然等[25]描述方法稍作改进,用无水乙醇溶解1 mg/L丁香酚对照品,配制成不同质量浓度梯度的丁香酚溶液,横坐标为丁香酚质量浓度,纵坐标为吸光度,得到丁香酚标准曲线回归方程为y=22.62x-0.053 2,R2=0.999。
1.3.2 可溶性明胶-壳聚糖复合物的制备
称取一定量的壳聚糖和明胶,分别溶解于0.5%醋酸溶液和超纯水中,制备成2 mg/mL的壳聚糖溶液和2 mg/mL明胶溶液,用0.45 μm的微孔滤膜过滤,将壳聚糖溶液缓慢滴入明胶溶液中(使明胶-壳聚糖质量比分别为1∶1、2∶1、3∶1、4∶1、5∶1、6∶1、7∶1),调节pH值至6.0,转速800 r/min搅拌30 min,60 ℃水浴加热20 min,在600 nm波长处测定各混合溶液的吸光度,空白对照为2 mg/mL壳聚糖溶液,测定其吸光度,利用ZS90激光粒度分析仪进行粒径分析,得到可溶性复合物最佳质量比。
1.3.3 Euo-Gel-CS NPs的制备
量取一定体积丁香酚液体,溶于40%乙醇溶液,与2 mg/mL壳聚糖溶液均匀混合后(壳聚糖-丁香酚质量比固定为1∶2),逐滴缓慢加入2 mg/mL明胶溶液中,转速为800 r/min,室温状态下搅拌10 min后,调节体系pH值至6.0,匀速搅拌30 min后,60 ℃水浴加热20 min,即形成Euo-Gel-CS NPs。
1.3.4 单因素试验
分别以壳聚糖质量浓度(0.5、1.0、2.0、3.0、4.0、5.0 mg/mL)、明胶质量浓度(1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0 mg/mL)、交联时间(10、20、30、40、60 min)、转速(600、700、800、900、1 000 r/min)、丁香酚质量浓度(1.0、2.0、3.0、4.0、5.0、6.0 mg/mL)为单因素试验条件,考察其对Euo-Gel-CS NPs粒径及包封率的影响。
1.3.5 正交试验
基于单因素试验结果,选取壳聚糖质量浓度、明胶质量浓度、丁香酚质量浓度进行三因素三水平正交试验,固定条件为转速800 r/min以及交联时间30 min,试验因素与水平见表1。综合加权评分根据武陶等[26]描述方法稍作改进,包封率占60%权重,粒径占40%权重,其加权分数为粒径与包封率按照权重相加而得,确定制备Euo-Gel-CS NPs的最优制备工艺。
表1 正交试验因素与水平
Table 1 Code and level of independent variables used in orthogonal array design

1.3.6 包封率的测定
精确吸取5 mL的Euo-Gel-CS NPs溶液于Ultra-15超滤离心管,4 000 r/min转速离心30 min,截留Euo-Gel-CS NPs,分离出未被包埋的丁香酚芯材部分,在282 nm波长处测定其吸光度,通过丁香酚标准曲线计算平均包封率。包封率按公式(1)计算:
1.3.7 粒径分布的测定和形态观察
采用ZS90激光粒度分析仪测定其粒径大小及分布。取Euo-Gel-CS NPs悬浮液,用质量分数2%磷钨酸复染后置于铜网上,自然干燥后,置于样品台上用透射电子显微镜观察颗粒的外观形态。
1.3.8 Euo-Gel-CS NPs的傅里叶变换红外光谱分析
分别取干燥明胶、壳聚糖、丁香酚、Euo-Gel-CS NPs与纯KBr粉末质量比为1∶100混合,分别研磨成细粉末,压成片状,使用纯KBr粉末作为背景。光谱数值范围为500~4 000 cm-1进行扫描,分辨率为2 cm-1。
1.3.9 Euo-Gel-CS NPs的差示扫描量热分析
以壳聚糖、明胶、丁香酚粉末、明胶-壳聚糖复合物和Euo-Gel-CS NPs冻干颗粒为样品,每份样品测试质量范围保持5~7 mg,温度升高速率10 ℃/min,扫描样品温度范围25~225 ℃。
1.3.10 Euo-Gel-CS NPs体外释放实验
精确称取Euo-Gel-CS NPs 10 mg,于截留分子质量为10 kDa的透析袋中,加入5 mL PBS缓冲液(pH 7.4)使其完全溶解,置于装有50 mL PBS的小烧杯中,封口膜密封。37 ℃恒温100 r/min振荡。分别于1、2、4、10、12 h取5 mL透析液在282 nm波长处测定吸光度,并向体系补加5 mL PBS缓冲液(pH 7.4)使其完全溶解,置于装有50 mL PBS的小烧杯中,封口膜密封。37 ℃恒温100 r/min振荡。分别于1、2、4、10、12 h取5 mL透析液在282 nm波长处测定吸光度,并向体系补加5 mL PBS溶液以保持后续被测定透析液的体积,采用PBS缓冲溶液为对照,由标准曲线方程计算丁香酚含量。体外释放率按公式(2)计算:
1.4 数据处理
利用Excel 2007及SPSS 20进行数据处理,新复极差法(Duncan’s multiple)进行统计学处理,在P<0.05和P<0.01水平下进行显著性分析。
2 结果与分析
2.1 可溶性明胶-壳聚糖复合物的制备结果
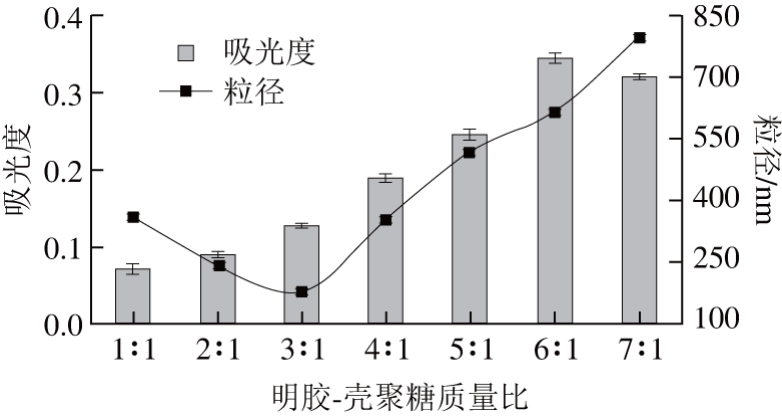
图1 不同质量比明胶-壳聚糖吸光度、粒径测定结果
Fig. 1 Effect of gelatin to chitosan on absorbance and particle size
如图1所示,第1阶段:明胶-壳聚糖质量比小于3∶1,溶液体系pH值为6.0,介于壳聚糖解离常数与明胶的等电点之间,壳聚糖和明胶间发生静电作用形成可溶性络合物,明胶在加热时变性凝胶化得到微型纳米尺度凝胶,发生了静电自组装。第2阶段:随明胶-壳聚糖质量比增加,溶液pH值超过静电平衡点,体系形成肉眼可见的不可溶性凝胶颗粒,吸光度与粒径均增大。体系中明胶-壳聚糖质量比为3∶1时,溶液出现淡蓝色乳光且有丁达尔效应,粒径达到最小值为182.34 nm,明胶与壳聚糖产生糖基化反应,体系趋于稳定,为制备可溶性复合物创造最佳条件。
2.2 单因素试验结果
2.2.1 壳聚糖质量浓度对粒径及包封率的影响
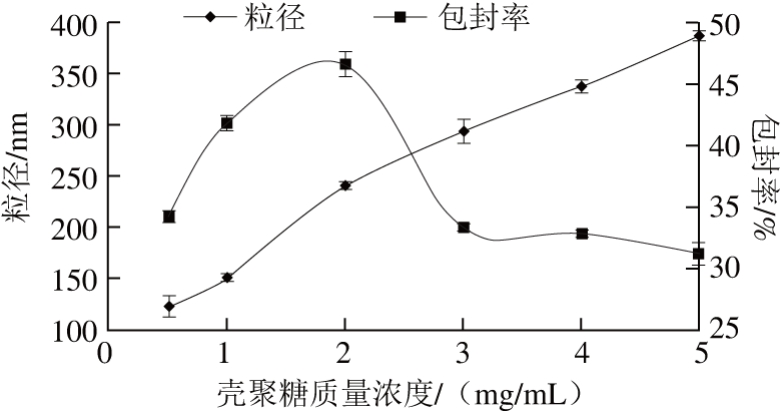
图2 壳聚糖质量浓度对粒径及包封率的影响
Fig. 2 Effect of chitosan concentration on particle size and encapsulation efficiency
由图2可知,随着壳聚糖质量浓度的增加,Euo-Gel-CS NPs的粒径以近似直线的趋势上升,各组间均有显著性差异(P<0.01)。体系中壳聚糖分子增多,除交联外还存在壳聚糖和明胶分子间多形式的相互作用[27],导致体系纳米粒径增大。同时包封率呈现先增大后减小的趋势,壳聚糖质量浓度为2 mg/mL时,包封率达到最大值为46.67%(P<0.01),壳聚糖质量浓度大于2 mg/mL时,随壳聚糖质量浓度增加,体系黏度增大,阻碍了体系内分子自由运动,导致Euo-Gel-CS NPs包封率降低。
2.2.2 明胶质量浓度对粒径及包封率的影响
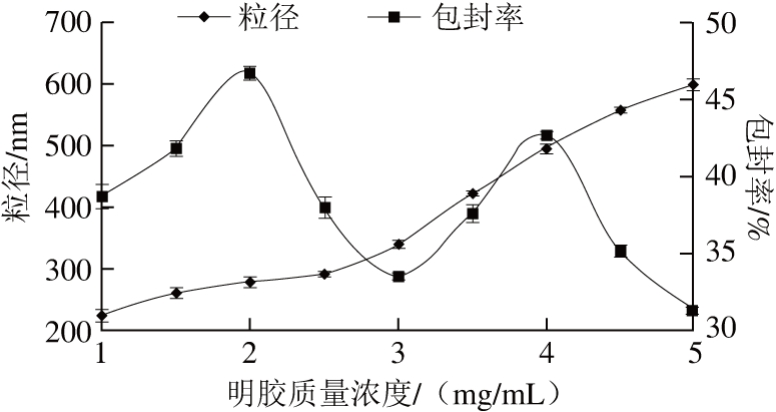
图3 明胶质量浓度对粒径及包封率的影响
Fig. 3 Effect of gelatin concentration on particle size and encapsulation efficiency
由图3可知,当明胶质量浓度较低时,难以满足交联要求,体系Euo-Gel-CS NPs包封率较低,粒径较小;随着明胶质量浓度增加,明胶与丁香酚非共价键相互作用增强,包埋效果明显增加[28]。当明胶质量浓度为2 mg/mL时,包封率达到最大值为46.67%(P<0.05),明胶质量浓度超过2 mg/mL,颗粒包封率下降,其原因可能为壳聚糖分子与明胶分子链端的—COOH与—NH2基团发生分子间相互作用,占据了有效作用位点,同时粒径增大。明胶质量浓度过高,体系稳定性差,易于析出不溶性物质,Euo-Gel-CS NPs难以形成。
2.2.3 交联时间对粒径及包封率的影响

图4 交联时间对粒径及包封率的影响
Fig. 4 Effect of cross-linking time on particle size and encapsulation efficiency
由图4可知,交联时间较短时有效交联Euo-Gel-CS NPs难以形成。交联时间最佳值为30 min,体系粒径达到最小值为243.50 nm(P<0.05),包封率达到最大值为46.67%(P<0.05),且体系稳定;交联时间延长,明胶与壳聚糖分子黏度降低,颗粒包封率下降,导致颗粒形态不规则、分散度不佳。
2.2.4 转速对粒径及包封率的影响

图5 转速对粒径及包封率的影响
Fig. 5 Effects of stirring speed on particle size and encapsulation efficiency
由图5可知,转速过低时丁香酚和壳聚糖溶液滴加到明胶溶液后不能立即充分分散,造成混合体系中局部浓度过高,不能发生有效交联。随着转速的增加,基团间交联充分,当转速达到最优值800 r/min时,Euo-Gel-CS NPs粒径达最小值为237.60 nm(P<0.05),包封率达到最大值为45.53%(P<0.05)。超过最佳转速时,过高的转速形成了高剪切力,破坏了体系壳聚糖与明胶分子的内部结构和体系稳定性,溶液出现分子凝聚,使得包封率降低,Euo-Gel-CS NPs粒径增大。
2.2.5 丁香酚质量浓度对粒径及包封率的影响

图6 丁香酚质量浓度对粒径及包封率的影响
Fig. 6 Effect of eugenol concentration on particle size and encapsulation efficiency
如图6所示,少量丁香酚分子吸附在明胶分子表面,并未与其形成包附作用,通过高速离心力可以使其小分子分离,导致Euo-Gel-CS NPs包封率较小,丁香酚质量浓度为4 mg/mL时,壳聚糖、明胶、丁香酚分子达到最优配比,包封率为48.02%(P<0.05),观察体系溶液出现淡蓝色乳光,略有丁香香气,气味柔和不刺激。过量的丁香酚影响明胶分子内的氢键相互作用,导致明胶自身网络结构被破坏使粒径增大,包封率降低。
2.3 正交试验结果
在得到的最佳单因素条件为转速800 r/min、壳聚糖质量浓度2 mg/mL、明胶质量浓度2 mg/mL、明胶-壳聚糖质量比3∶1、交联时间30 min、丁香酚质量浓度4 mg/mL基础上,进行壳聚糖质量浓度、明胶质量浓度和丁香酚质量浓度三因素三水平的正交试验。Euo-Gel-CS NPs制备的正交试验设计与结果如表2所示。
表2 正交试验设计与结果
Table 2 Orthogonal array design with response variables
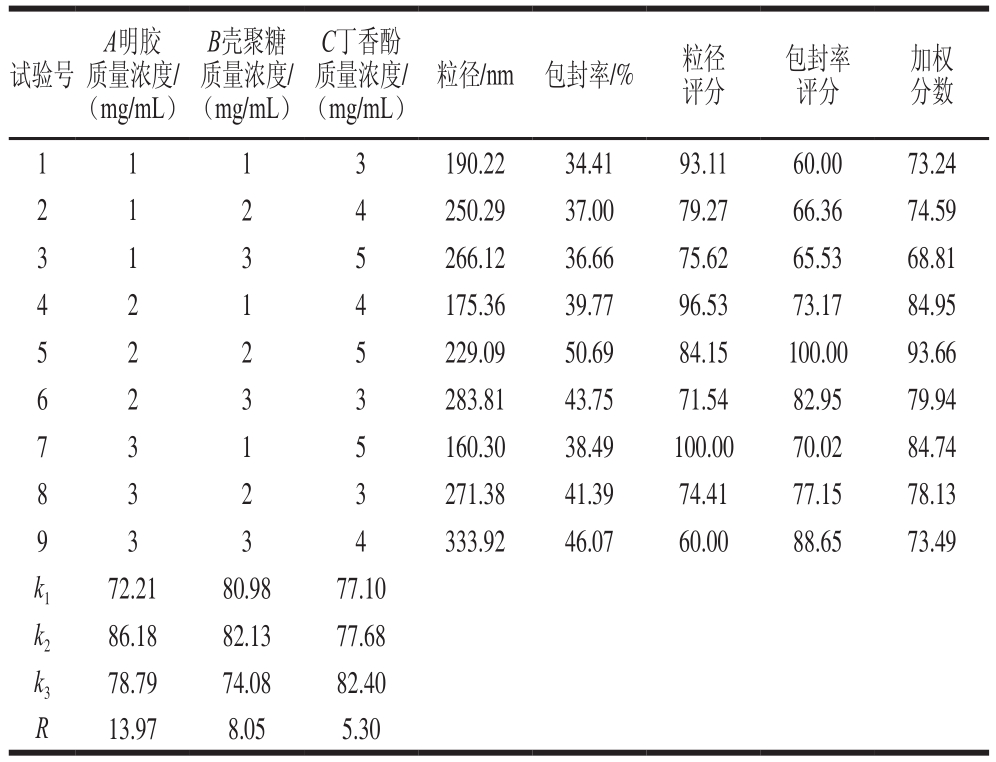
3 个因素的影响主次顺序为:明胶质量浓度>壳聚糖质量浓度>丁香酚质量浓度。观察正交试验的各加权分数,最优为93.66分,得出制备Euo-Gel-CS NPs的最优组合为A2B2C3,最优制备工艺为壳聚糖质量浓度2 mg/mL、明胶质量浓度2 mg/mL、丁香酚质量浓度5 mg/mL,调节pH值至6.0,转速800 r/min,交联时间30 min,搅拌结束后在60 ℃水浴加热20 min。经验证得Euo-Gel-CS NPs粒径为229.09 nm,包封率达到50.69%。
2.4 Euo-Gel-CS NPs的表征
2.4.1 Euo-Gel-CS NPs的粒径大小、分布和形态

图7 Euo-Gel-CS NPs粒径分布
Fig. 7 Particle size distribution of Euo-Gel-CS NPs
由图7可知,最优制备工艺下Euo-Gel-CS NPs的平均粒径为229.09 nm,粒径分布系数为0.251,小于0.3,证明Euo-Gel-CS NPs的分散性良好,可用于后续实验。

图8 Euo-Gel-CS NPs的透射电镜图
Fig. 8 TEM micrograph of Euo-Gel-CS NPs
由图8可知,Euo-Gel-CS NPs颗粒呈较规则圆形,粒径均匀,形态饱满,粒径约为220 nm,与激光粒度仪测量结果一致。
2.4.2 红外光谱分析
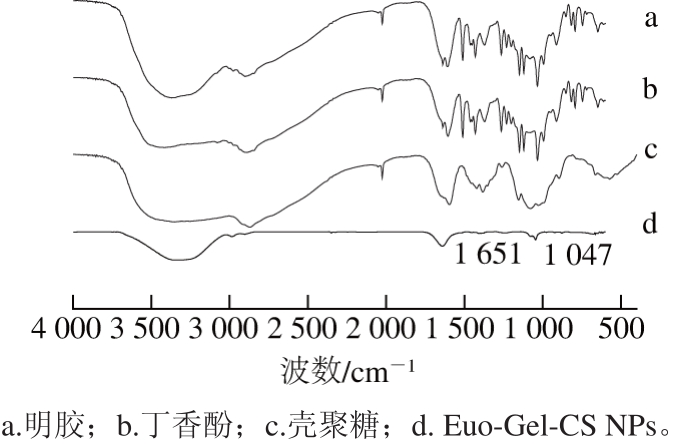
图9 傅里叶变换红外光谱检测结果
Fig. 9 FTIR spectra
由图9可知,壳聚糖在1 597 cm-1的吸收峰是—NH2的伸缩振动,而Euo-Gel-CS NPs的傅里叶红外光谱在1 539 cm-1出现了新峰,说明壳聚糖—NH2与明胶的—COOH相互作用形成了C—N键;丁香酚—OH伸缩振动在3 452 cm-1处有吸收峰,Euo-Gel-CS NPs在3 500~3 300 cm-1内出现一个宽峰,说明纳米胶囊中存在较强的氢键。明胶傅里叶红外光谱图显示了典型的酰胺I和II峰分别在1 674 cm-1和1 539 cm-1处,酰胺I带的吸收主要是由于C=O伸缩振动,而酰胺II带由C—N拉伸和C—N—H在平面弯曲两者组成[29],丁香酚在1 423 cm-1处的吸收峰是—OCH中C—O伸缩振动,Euo-Gel-CS NPs的吸收峰在1 651 cm-1和1 047 cm-1处,表现出向低波数的转移,表明丁香酚和明胶-壳聚糖之间的作用主要由氢键和疏水相互作用组成,与文献[30]中结果一致,傅里叶变换红外光谱技术的定性分析是确定丁香酚装载到纳米颗粒中的直接方法,反映丁香酚的成功装载。
2.4.3 差示扫描量热分析结果
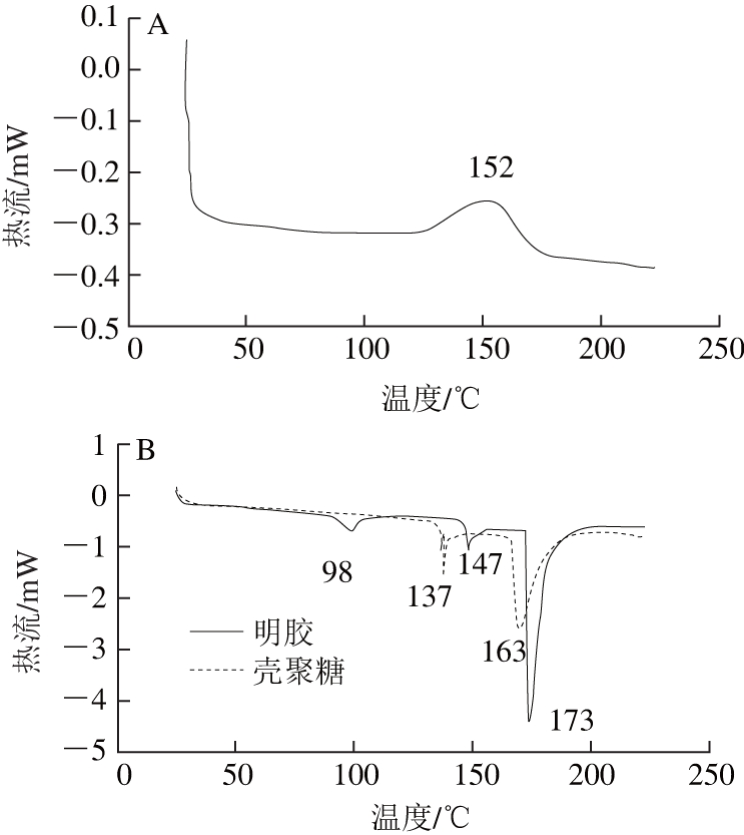

图10 差示扫描量热分析图
Fig. 10 DSC curves
如图10所示,丁香酚在152 ℃有一个较宽的放热峰;在98、147、173 ℃位置明胶均有吸热峰;壳聚糖吸热峰分别在137、163 ℃出现。明胶-壳聚糖复合物的差示扫描量热分析图显示在59 ℃的吸热峰和在171 ℃的吸热峰,出现吸热峰融合的现象,说明明胶与壳聚糖分子发生静电作用形成了复合凝聚络合物。Euo-Gel-CS NPs仅在较高温度(150 ℃)显示吸热峰,说明三者之间发生强相互作用[31],促使化学键交联形成结构紧密的纳米颗粒,与红外光谱图结果相符。
2.4.4 体外释放实验分析
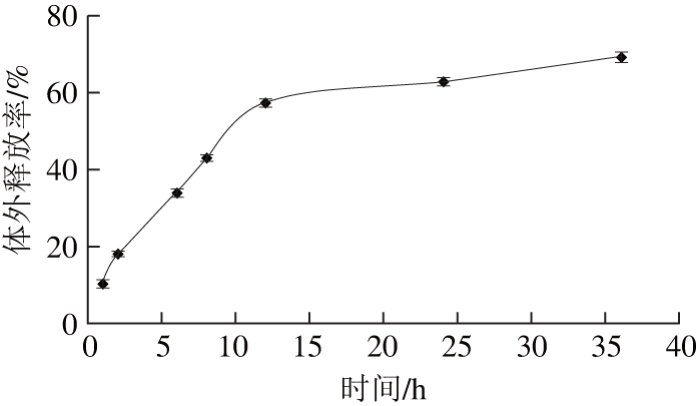
图11 Euo-Gel-CS NPs体外释放率
Fig. 11 Release rate of Euo-Gel-CS NPs in vitro
如图11所示,在37 ℃的条件下,Euo-Gel-CS NPs在6 h和8 h后丁香酚释放率分别为34.02%和43.12%,处于初期快速释放阶段。而10 h后为缓慢释放阶段,此阶段壳聚糖和明胶的溶胀能力减弱,抑制丁香酚从纳米胶囊的网状结构释放通道扩散到介质中,验证了丁香酚在明胶-壳聚糖的可溶性络合物中达到了控制释放的效果。
3 结 论
本实验探究了明胶与壳聚糖自组装最适质量比,制备Euo-Gel-CS NPs的单因素优化条件,最后通过正交试验得出最优工艺为壳聚糖质量浓度2 mg/mL、明胶质量浓度2 mg/mL、丁香酚质量浓度5 mg/mL、转速800 r/min、交联时间30 min,制得的Euo-Gel-CS NPs粒径为229.09 nm,包封率达到50.69%。制备不使用交联剂,过程绿色。傅里叶变换红外光谱、差示扫描量热对Euo-Gel-CS NPs微观化学结构进行分析,表明丁香酚和明胶间主要由氢键和疏水相互作用组成,确定了丁香酚被装载到纳米颗粒中;体外释放实验证明Euo-Gel-CS NPs具有缓释作用。考察和表征了Euo-Gel-CS NPs的部分特性,其防腐抗菌作用还有待进一步深入研究。
参考文献:
[1] BEVERLYA R L, JANES M E, PRINYAWIWATKULA W, et al.Edible chitosan films on ready-to-eat roast beef for the control of Listeria monocytogenes[J]. Food Microbiology, 2008, 25(3): 534-537.DOI:10.10 16/j.fm.2007.11.002.
[2] ZHAO L, LI F, CHEN G, et al. Effect of nanocomposite-based packaging on preservation quality of green tea[J]. International Journal of Food Science & Technology, 2012, 47(3): 572-578. DOI:10.1111/j.1365-2621.2011.02879.x.
[3] SEABRA A B, DURÁN N. Nitric oxide-releasing vehicles for biomedical applications[J]. Journal of Materials Chemistry, 2009,20(9): 1624-1637. DOI:10.1039/B912493B.
[4] BHATTACHARYYA A, BHAUMIK A, RANI P U, et al. Nanoparticles-a recent approach to insect pest control[J]. African Journal of Biotechnology, 2010, 9(24): 3489-3493.
[5] CHUANG C Y, DON T M, CHIU W Y. Preparation of environmentalresponsive chitosan-based nanoparticles by self-assembly method[J].Carbohydrate Polymers, 2011, 84(2): 765-769. DOI:10.1016/j.carbpol.2010.01.053.
[6] YANG J, HAN S, ZHENG H, et al. Preparation and application of micro/nanoparticles based on natural polysaccharides[J]. Carbohydrate Polymers, 2015, 123(9/10): 53-66. DOI:10.1016/j.carbpol.2015.01.029.
[7] MCCLEMENTS J, MCCLEMENTS D J. Standardization of nanoparticle characterization: methods for testing properties, stability and functionality of edible nanoparticles[J]. Critical Reviews in Food Science & Nutrition, 2015, 56(8): 1334-1362. DOI:10.1080/10408398.2014.970267.
[8] WORANUCH S, YOKSAN R. Eugenol-loaded chitosan nanoparticles:I. thermal stability improvement of eugenol through encapsulation[J].Carbohydrate Polymers, 2013, 96(2): 578-585. DOI:10.1016/j.carbpol.2012.08.117.
[9] SEBAALY C, JRAIJ A, FESSI H, et al. Preparation and characterization of clove essential oil-loaded liposomes[J].Food Chemistry, 2015, 178(3): 52-62. DOI:10.1016/j.foodchem.2015.01.067.
[10] WORANUCH S, YOKSAN R. Eugenol-loaded chitosan nanoparticles:II. application in bio-based plastics for active packaging[J].Carbohydrate Polymers, 2013, 96(2): 586-592. DOI:10.1016/j.carbpol.2012.09.099.
[11] 朱庆英, 张永辉, 朱琼, 等. 丁香酚-β-环糊精包合物的制备与表征[J].中国药房, 2016, 27(1): 86-89. DOI:10.6039/j.issn.1001-0408.2016.01.28.[12] 成琪, 吕世明, 谭艾娟, 等. 丁香酚脂质体的制备及其质量评价[J].中国农学通报, 2011, 27(26): 79-82.
[13] HARISH PRASHANTH K V, THARANATHAN R N. Chitin/chitosan: modifications and their unlimited application potential-an overview[J]. Trends in Food Science & Technology, 2007, 18(3): 117-131. DOI:10.1016/j.tifs.2006.10.022.
[14] AHMED T A, ALJAEID B M. Preparation, characterization, and potential application of chitosan, chitosan derivatives, and chitosan metal nanoparticles in pharmaceutical drug delivery[J]. Drug Design Development & Therapy, 2016, 10: 483-507. DOI:10.2147/DDDT.S99651.
[15] ZOU T, PERCIVAL S S, CHENG Q, et al. Preparation,characterization, and induction of cell apoptosis of cocoa procyanidins-gelatin-chitosan nanoparticles[J]. European Journal of Pharmaceutics & Biopharmaceutics, 2012, 82(1): 36-42. DOI:10.1016/j.ejpb.2012.05.006.
[16] LAI P, DAEAR W, LÖBENBERG R, et al. Overview of the preparation of organic polymeric nanoparticles for drug delivery based on gelatine, chitosan, poly(d,l-lactide-co-glycolic acid) and polyalkylcyanoacrylate[J]. Colloids & Surfaces B: Biointerfaces, 2014,118: 154-163. DOI:10.1016/j.colsurfb.2014.03.017.
[17] 于湛, 于敏, 贾宏光, 等. 壳聚糖多孔明胶微球温敏凝胶载药体的建立与评价[J]. 解剖科学进展, 2016(5): 490-492.
[18] 陈婷, 李国源, 毕春洋, 等. 麦胚凝集素修饰的EGCG-明胶-壳聚糖纳米粒的制备、表征及体外抗肿瘤活性研究[J]. 南京中医药大学学报, 2017(1): 82-86.
[19] 胡诗保, 刘军, 丁克毅. pH敏感型明胶-壳聚糖载药微球的制备及表征[J]. 中国皮革, 2016, 45(11): 23-28. DOI:10.13536/j.cnki.issn1001-6813.2016-011-007.
[20] BAO S, XU S, WANG Z. Antioxidant activity and properties of gelatin films incorporated with tea polyphenol-loaded chitosan nanoparticles[J]. Journal of the Science of Food & Agriculture, 2010,89(15): 2692-2700. DOI:10.1002/jsfa.3775.
[21] FAZIL M, MD S, HAQUE S, et al. Development and evaluation of rivastigmine loaded chitosan nanoparticles for brain targeting[J].European Journal of Pharmaceutical Sciences, 2012, 47(1): 6-15.DOI:10.1016/j.ejps.2012.04.013.
[22] BIGI A, PANZAVOLTA S, RUBINI K. Relationship between triple-helix content and mechanical properties of gelatin films[J]. Biomaterials, 2004, 25(25): 5675-5680. DOI:10.1016/j.biomaterials.2004.01.033.
[23] 曲凤华, 栗明献, 陈微, 等. 壳聚糖微球及壳聚糖-明胶复合物微球的制备及缓释性能研究[J]. 化工科技, 2012, 20(3): 43-48.DOI:10.3969/j.issn.1008-0511.2012.03.012.
[24] GAO M L, WANG D F, YANG W, et al. Ionic cross-linking chitosan/alginate biodegradable composite film[J]. Periodical of Ocean University of China, 2011, 41(10): 61-66.
[25] 韩春然, 张静, 李煜. 超声波法制备丁香精油-β-环糊精微胶囊[J].食品科学, 2013, 34(22): 97-100. DOI:10.7506/spkx1002-6630-201322019.
[26] 武陶, 丁武. 山梨酸纳米防腐颗粒的制备、表征及其缓释性能[J].食品科学, 2014, 35(10): 57-61. DOI:10.7506/spkx1002-6630-201410011.
[27] ESPINOSAANDREWS H, SANDOVALCASTILLA O,VÁZQUEZTORRES H, et al. Determination of the gum Arabicchitosan interactions by Fourier transform infrared spectroscopy and characterization of the microstructure and rheological features of their coacervates[J]. Carbohydrate Polymers, 2010, 79(3): 541-546.DOI:10.1016/j.carbpol.2009.08.040.
[28] 丁立忠, 杨剑, 黄文. 食用香精微胶囊化研究进展[J]. 中国调味品,2009, 34(2): 90-95. DOI:10.3969/j.issn.1000-9973.2009.02.021.
[29] MOUSIA Z, FARHAT I A, PEARSON M, et al. FTIR microspectroscopy study of composition fluctuations in extruded amylopectin-gelatin blends[J]. Biopolymers, 2001, 62(4): 208-218.DOI:10.1002/bip.1015.
[30] CHANG M C, KO C C, DOUGLAS W H. Preparation of hydroxyapatitegelatin nanocomposite[J]. Biomaterials, 2003, 24(17): 2853-2862.
[31] FEYZIOGLU G C, TORNUK F. Development of chitosan nanoparticles loaded with summer savory (Satureja hortensis L.)essential oil for antimicrobial and antioxidant delivery applications[J].LWT-Food Science and Technology, 2016, 70: 104-110. DOI:10.1016/j.lwt.2016.02.037.