乐果是一种内吸性有机磷农药,化学名称为O,O-二甲基-S-(N-甲基氨基甲酰基)二硫代磷酸酯,其是农业生产中最常使用的有机磷农药之一[1-2]。农业生产中使用的有机磷农药有很大一部分进入自然环境,对生态造成严重污染,现在有机磷农药在自然界的含量已被列为国际评判自然环境质量重要参数[3-4],所以建立快速、精确的农药检测体系已尤为重要。
传统的农药检测方法有气相色谱法[5]、高效液相色谱法[6]、色谱-质谱联用法[7]等,这些方法虽然具有灵敏度高、可靠性强的优势,但检测耗时长、仪器价格昂贵、需专业人士操作等缺点,所以不满足现场检测的需求;现场快速检测方法有酶联免疫法[8]、酶抑制法[9]等,但这些方法利用乙酰胆碱酶、植物酯酶等,这些生物蛋白具有制备成本高、受天然蛋白工作条件限制等缺点。所以建立便捷、精确、快速、低成本的可视化检测方法更符合现场检测的需要。
自从基于金纳米粒子(gold nanoparticles,AuNPs)的比色检测方法建立后,近年来其在生物分析和环境污染物检测方面的应用备受关注[10-12]。Weerathunge等[13]在AuNPs修饰上能特异性结合啶虫脒的核酸适配体实现了对啶虫脒高灵敏度的检测,但适配体价格昂贵而且对环境条件要求苛刻限制了其在实际检测中的应用;Liu Yanpin等[14]发现带负电的AuNPs具有过氧化物模拟酶活性,利用多巴胺吸附到AuNPs,减少3,3’,5,5,’-四甲基联苯胺(3,3’,5,5’-tetramethylbenzidine,TMB)蓝色氧化产物生成,导致吸光度下降,从而实现对多巴胺的检测,该检测方法不仅检测精度高,而且具有操作方便、成本低、贮存性能好等优点;Momić等[15]研究中发现有机磷农药乐果能稳定有效地吸附在带正电性的纳米金表面;为了合成带正电性的AuNPs过氧化物模拟酶采用金晶种生长法制备AuNPs,该AuNPs模拟酶比表面带负电的AuNPs有更高的催化活性[16];利用AuNPs模拟酶催化H2O2产生自由基氧化TMB,生成蓝色氧化产物(ox-TMB),最后加入H2SO4稳定反应体系同时溶液变为黄色,测定波长450 nm处紫外吸收峰信号。农药乐果能通过带负电性的酰胺键结合在AuNPs表面,从而降低模拟酶的催化活性减少ox-TMB的生成,据此建立如图1所示的便捷、快速、可视化的比色农药检测方法。

图1 AuNPs模拟酶检测乐果的方法
Fig. 1 Schematic of the detection of rogor with AuNPs as peroxidase mimetics
1 材料与方法
1.1 材料与试剂
绿茶叶 八马茶业有限公司;溴化十六烷基三甲铵(cetyl trimethylamine bromide,CTAB)、TMB、四水合氯金酸(HAuCl4·4H2O) 国药集团(上海)化学试剂有限公司;乐果标准品 北京世纪奥科生物技术有限公司;实验所用试剂均为分析纯,实验用水均为二次蒸馏水。
1.2 仪器与设备
Infinite PRO TWIN 200型酶标仪 瑞士Tecan公司;JSM-7001F场发射扫描电镜 日本电子株式会社;Nicolet is50型傅里叶红外光谱仪 美国热电赛默飞世尔有限公司;恒温鼓风干燥箱 上海一恒科学仪器有限公司;85-2型恒温磁力加热搅拌器 江苏省金坛市宏华仪器厂;TGL-15B型高速台式离心机 上海安亭科学仪器厂。
1.3 方法
1.3.1 金晶种生长法制备AuNPs
在30 ℃恒温水浴中向5 mL浓度为0.2 mol/L的CTAB溶液中加入5 mL浓度为0.5 mmol/L的氯金酸溶液,搅拌混匀后加入0.6 mL置于冰水浴中浓度为0.01 mol/L的硼氢化钠溶液,反应溶液由无色变为棕黄色,最后700 r/min搅拌2 min并静置2 h,得到AuNPs晶的金晶种溶胶[17]。
在5 mL浓度为0.2 mol/L的CTAB溶液中分别加入150 μL浓度为4 mmol/L的硝酸银溶液和5 mL浓度为0.5 mmol/L的氯金酸溶液,搅拌均匀后缓慢加入70 μL浓度为78.8 mmol/L的VC溶液,VC将溶液立即由棕黄色还原至无色,将反应溶液700 r/min搅拌2 min得到生长溶液;将12 μL金晶种溶胶加入10 mL生长液中200 r/min搅拌3 min溶液由无色变为紫红色,将溶液放置在35 ℃条件下12 h;最后取10 mL溶液在8 000 r/min条件下离心10 min,去掉上清液;加同样量的去离子水,超声处理2 min后,同样条件下离心,得到浓度为1.41 nmol/L的AuNPs[18]。
1.3.2 AuNPs的表征
将一滴AuNPs溶液滴在经过丙酮处理过的硅片上风干后通过扫描电镜测量AuNPs的平均直径;测量400~900 nm全波段紫外吸收光谱,通过AuNPs长波纵向表面等离子体共振吸收峰的峰位与其轴比和粒子周围介质的介电常数的关系计算AuNPs的平均轴比,共振吸收峰的峰位按公式(1)计算[19]:
式中:λmax为AuNPs的长波纵向表面等离子体共振吸收峰的峰位/nm;R为AuNPs的平均轴比;εm为AuNPs周围介质的介电常数。
1.3.3 检测机理
利用傅里叶变换红外光谱图研究乐果的活性基团结合到AuNPs表面的机理。在1 mL未稀释的AuNPs溶液中加入1 mL 1 mg/mL乐果溶液,在微型振荡器上振荡1 min后35 ℃湿盒温育30 min制得待测液;用压片法在傅里叶变换红外光谱仪上进行测定,仪器参数为:波数范围400~4 000 cm-1,分辨率4 cm-1,扫描总数32 次,环境温度22 ℃。
1.3.4 建立标准曲线和特异性
先将乐果农药标准品用丙酮配制成1、20、40、60、80 mmol/L不同梯度的溶液。测定乐果的标准曲线如下,第1步:用微量加样器依次取40 μL pH 4.0的邻苯二甲酸氢钾缓冲液、不同梯度的有机磷农药溶液、1.41 nmol/L AuNPs溶液加入到无色96 孔板样孔中,在微型振荡器上振荡1 min后35 ℃湿盒温育30 min;第2步,向上述反应溶液中加入40 μL 5 mmol/L TMB溶液和40 μL 50 mmol/L H2O2溶液,在微型振荡器上振荡1 min后35 ℃湿盒育30 min,最后加入50 μL浓度为2 mmol/L硫酸溶液终止反应,溶液由蓝色变为黄色,测定溶液在波长450 nm处测定吸光度(A450nm),以乐果浓度为横坐标、抑制率为纵坐标建立标准曲线,其中抑制率按公式(2)计算:
式中:A0为未加入农药的吸光度;A1为未加入TMB反应溶液的吸光度;A2为加入不同浓度乐果后的吸光度。
检出限按公式(3)计算:
式中:LOD为检出限;SD空白和b分别为空白对照和抑制率标准曲线斜率的标准偏差[20]。
为研究本检测方法的特异性,及其他农药的对检测结果的影响,实验选用与乐果结构相似的乙酰甲胺磷、带负电的敌百虫、杀螟松、氯甲磷和灭线磷有机磷农药,在农药浓度为100 mmol/L条件下测试其单独作用时的抑制率,研究不同农药对AuNPs模拟酶活性的影响。
1.3.5 茶叶样品中的乐果检测
回收率实验是通过标准加入法,将已知量的乐果标准品加入至绿茶叶提取液中进行检测,参照文献[21]进行预处理。具体步骤:称量1 g样品茶到50 mL的圆底烧瓶中,加入10 mL二氯甲烷,并进行15 min的超声振荡。此提取振荡过程重复3 次,滤除叶渣,收集滤液。随后,取提取的混合液至旋转蒸发器进行蒸发浓缩;接着,加入不同浓度的乐果标准品,均匀混合;最终,收集上清液根据1.3.4节步骤进行检测。
2 结果与分析
2.1 AuNPs表征结果
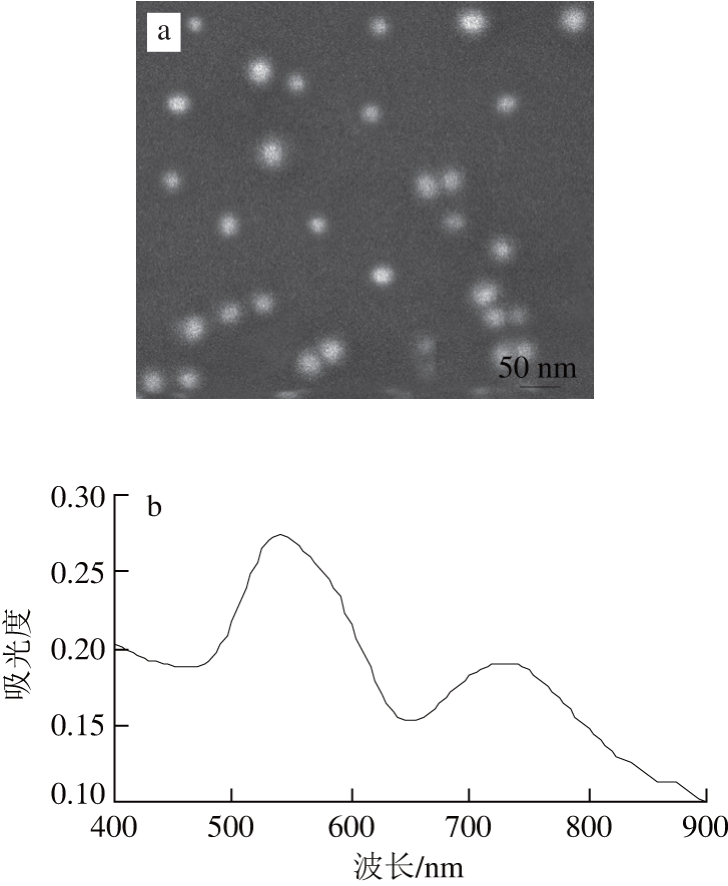
图2 AuNPs扫描电镜图(a)和紫外吸收光谱(b)
Fig. 2 TEM image (a) and UV-Vis absorption spectrum of AuNPs (b)
以CTAB作为稳定剂,VC为还原剂的金晶种生长法制备得到表面带正电性的AuNPs。由图2a可知,扫描电镜的结果显示AuNPs的平均直径为25 nm,由图2b可知,种子液生长法制备的AuNPs在波长540 nm和735 nm处有2 个吸收峰[17],在波长540 nm处的吸收峰是电子沿长轴方向的共振引起的短波横向表面等离子体共振吸收峰,在波长735 nm处的峰是电子沿短轴方向的共振引起的长波纵向表面等离子体共振吸收峰;根据长轴的峰的位置确定AuNPs的轴向比为1.35。
2.2 检测机理

图3 傅里叶变换红外光谱图
Fig. 3 Fourier transform infrared spectrum of AuNPs rogor
如图3A所示,乐果出现明显的吸收峰,1 644 cm-1处的吸收峰是酰胺I谱带C=O的伸缩振动,1 566 cm-1处的吸收峰是酰胺II谱带C—N的伸缩振动,3 088 cm-1和3 252 cm-1处的吸收峰来自于C—N中酰胺III谱带和N—H的振动[22]。AuNPs的吸收峰主要是其表面的CTAB的吸收峰(图3B),2 845 cm-1和2 914 cm-1对应CH3的对称伸缩振动和不对称伸缩振动,C—N的伸缩振动峰出现在960 cm-1。乐果加入到AuNPs后(图3C),酰胺I谱带的吸收峰向频率高位迁移至1 652 cm-1,酰胺II谱带迁移到1 555 cm-1,而N—H键的吸收峰迁移到了3 078 cm-1和3 274 cm-1处且谱带范围变宽;CH3的对称和不对称伸缩振动峰分别迁移到2 852 cm-1和2 924 cm-1,而且C—N吸收峰迁移到了968 cm-1。通过傅里叶变换红外光谱的变化推断乐果可能是通过酰胺键结合到AuNPs表面的CTAB上,降低AuNPs周围由H2O2产生的羟自由基局部浓度,从而抑制AuNPs的过氧化物酶活性[23-26]。
2.3 AuNPs过氧化物模拟酶催化活性分析及实验条件优化
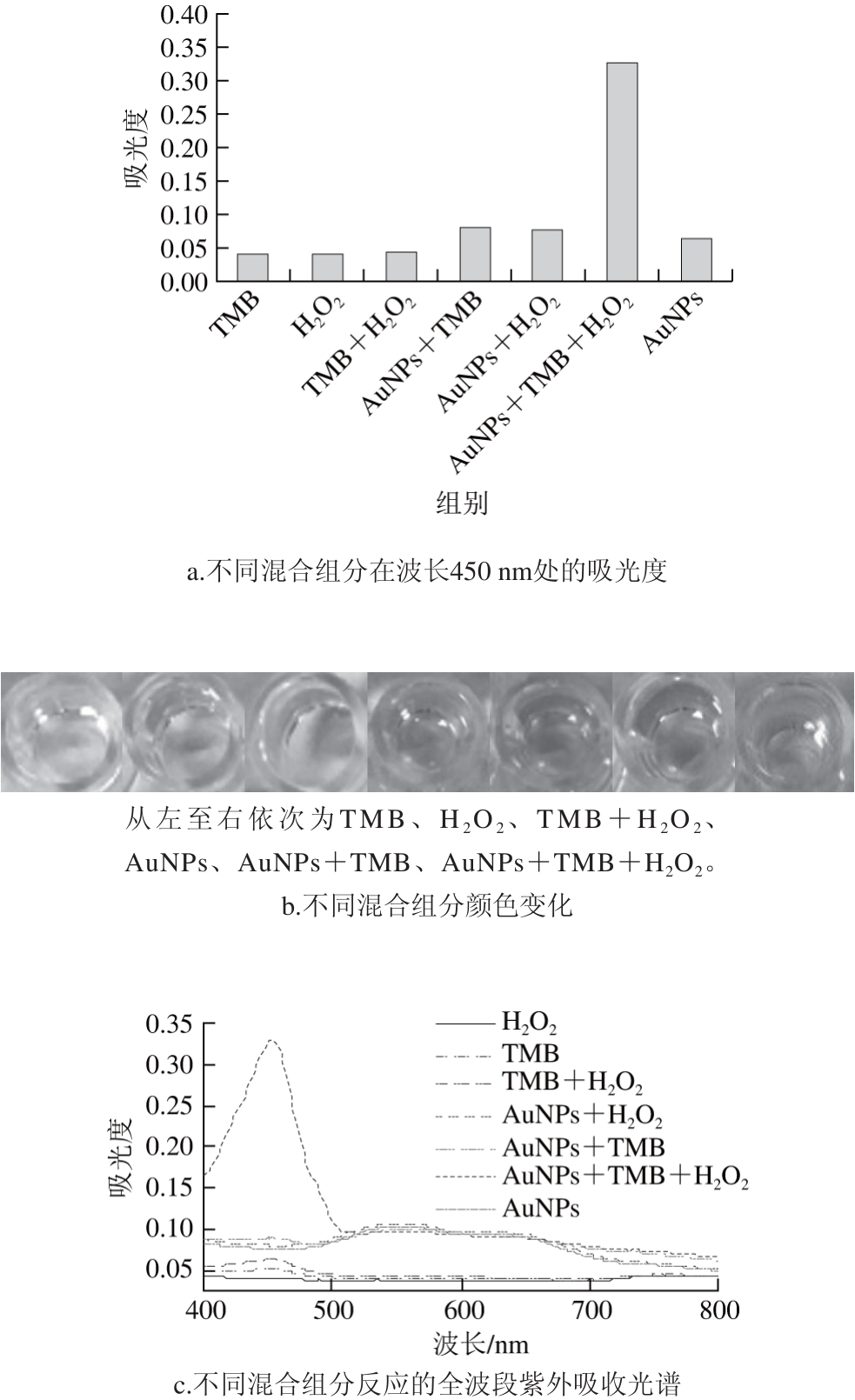
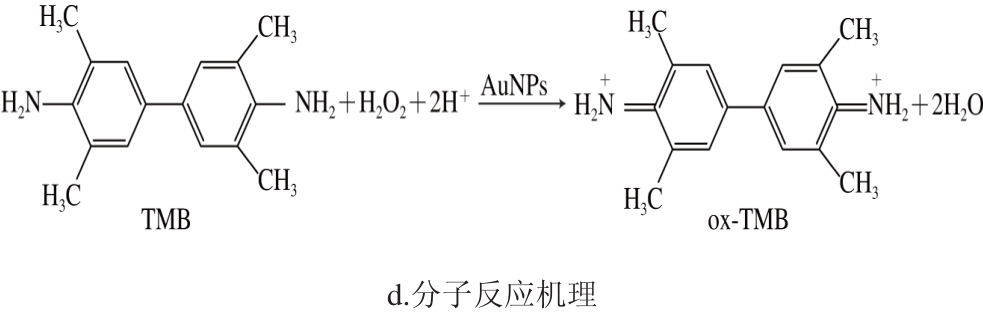
图4 不同混合组分吸收光谱和反应机理
Fig. 4 Absorption spectra of different reaction products and schematic of molecular reaction mechanism
为了证明AuNPs模拟酶催化活性,分析在显色反应中单一物质、两两物质混合后的全波段吸收光谱和颜色变化。用AuNPs作为催化剂,在H2O2存在和不存在的情况下对典型的过氧化物酶底物TMB进行催化显色实验。结果表明,当AuNPs加入TMB与H2O2的反应体系中才能显色,而且反应体系在波长450 nm处具有最大吸光度,如图4a~c所示,其反应式如图4d所示;在本实验建立的催化显色反应体系中,H2O2在水中能电离产生过氧根孤对电子,且AuNPs中的Au核外电子轨道有空轨道容易配位过氧根;在弱酸环境中过氧根的O—O键可被打断形成羟自由基(·OH),所以AuNPs周围羟自由基局部浓度增高[16],从而能够催化H2O2氧化TMB,体现出其过氧化物模拟酶活性[27-28]。
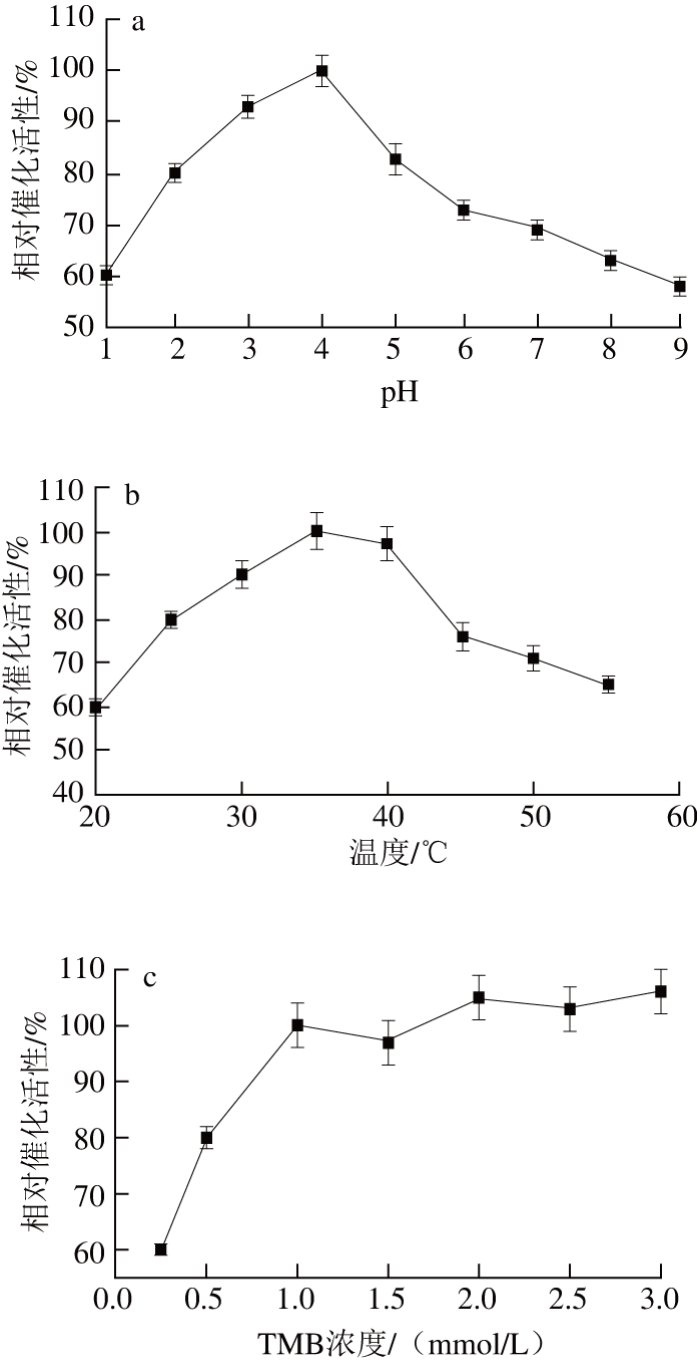

图5 反应条件优化图
Fig. 5 Optimization of reaction conditions
AuNPs的催化显色速率依赖于pH值、温度、TMB浓度和H2O2浓度。固定加入40 μL AuNPs通过改变pH值从1.0~9.0,温度从20~55 ℃,TMB浓度从0~3 mmol/L,过氧化氢浓度从3~60 mmol/L,测量反应液体的吸光度后比较相对催化活性(A450nm/Amax),相对催化活性最大时的条件为最佳条件。如图5所示,AuNPs反应的最佳条件是pH 4.0、温度35 ℃、TMB浓度1 mmol/L和H2O2浓度10 mmol/L。因为在pH值为4的条件下,溶液中H+有利于H2O2配位在AuNPs表面产生自由基,促进催化反应的进行;模拟酶在广泛的温度范围内保持良好的催化性能;适量浓度的双氧水有利于催化反应的进行,但当浓度过高时,会抑制TMB显色且容易发生非特异性反应产生黑色沉淀;作为显色底物的TMB在浓度升高时有利于催化反应的进行。
2.4 抑制率标准曲线的建立和特异性
在最优条件下测定乐果农药,抑制率与乐果浓度在1~80 mmol/L范围内呈良好的线性关系,其线性回归方程为y=0.527x+3.881(y为抑制率,x为乐果浓度),相关系数为0.985。检出限为1.39 mmol/L。
为研究本检测方法的特异性,及其他农药对检测结果的影响,实验选用与乐果结构相似的乙酰甲胺磷、带负电的敌百虫、杀螟松、氯甲磷和灭线磷有机磷农药在100 mmol/L浓度条件下单独进行测试。如图6所示,分子结构中含有酰胺键的乐果和乙酰甲胺磷的抑制率远高于其他4 种没有酰胺键的农药,所以该方法能特异性的检测乐果这一类带有带酰胺键的农药。
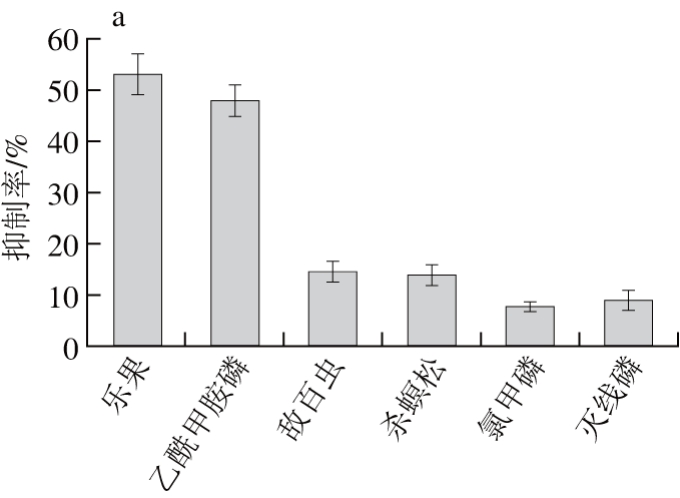
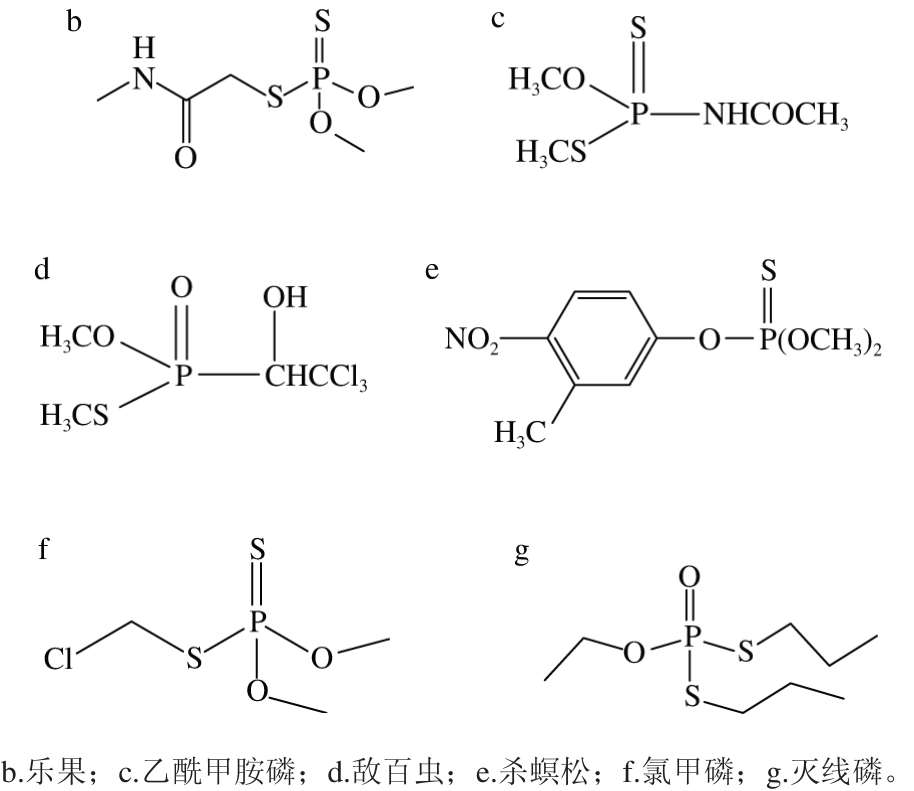
图6 6 种有机磷农药的抑制率(a)及其化学结构(b~g)
Fig. 6 Inhibitory rates of six organophosphorus pesticides (a) and chemical structures of six organophosphorus pesticides (b-g)
2.5 茶叶样本中乐果的检测结果
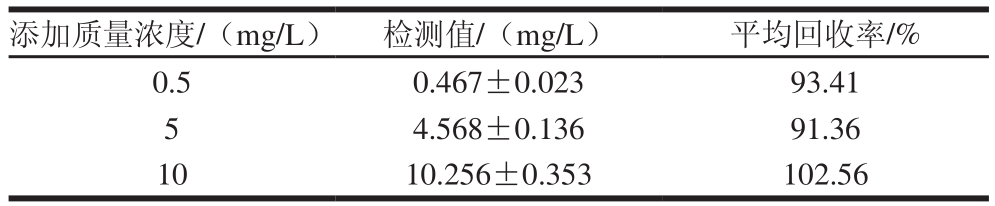
为了研究该方法在实际绿茶叶样本中检测乐果农药的可行性与可靠性,利用标准加入法进行考察。按照1.3.5节步骤处理3 个不同乐果农药梯度的茶叶样本,然后按照1.3.4节方法进行检测分析。如表1所示,数据表明在茶叶实际样本中乐果农药的回收率范围为91.36%~102.56%,相对标准偏差小于5%。结果表明该方法可以准确的在实际样品中分析乐果农药残留。
表1 茶叶中乐果的检测结果
Table 1 Determination of rogor in tea by the proposed method
2.6 AuNPs的稳定性
将AuNPs放在室温避光贮存,每隔15 d取出在最佳反应条件下进行反应,以催化TMB显色反应后于波长450 nm处的吸光度代表催化活性,由图7a可知,在室温贮存15 d,吸光度保持0.32,催化活性基本无影响;在室温贮存30 d,吸光度为0.3,依然具有良好的催化性能;贮存75 d后,AuNPs基本失活。实验结果表明AuNPs在贮存过程中能保持良好的稳定性。由图7b可知,AuNPs在贮存75 d后粒子由直径25 nm团聚成直径400 nm的球状大颗粒子,团聚现象可能是造成AuNPs酶催化活性降低的原因。据文献[29]记载CTAB以单室囊泡形式均匀的包裹在AuNPs表面,只有当表面的CTAB囊泡含量较低时,AuNPs易形成聚集状态;并且因为囊泡结构的物质在水中的溶解度小,迁移的速度慢,相对层状结构有熵增加的特点,所以其在水中具有保存几周至几个月的稳定性[30-31];由于CTAB囊泡在水中的稳定性好的特点,也增加了AuNPs贮存中的稳定性。
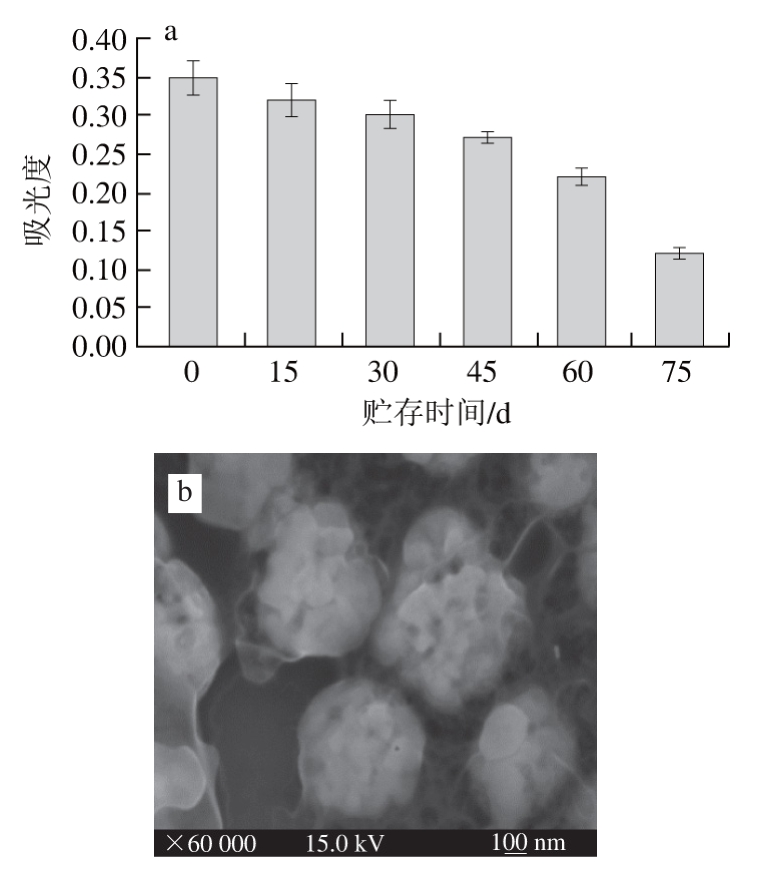
图7 AuNPs在室温贮存不同时间的催化活性(a)和贮存75 d后的AuNPs扫描电镜图(b)
Fig. 7 Reactivity after different days of storage (a) and scanning electron micrograph after 75 days of storage (b)
3 结 论
本实验实现了AuNPs作为过氧化物模拟酶对有机磷农药乐果的快速检测方法。AuNPs能够催化过氧化氢典型的酶底物TMB产生显色反应,说明其具有过氧化物酶活性;有机磷农药乐果能结合到AuNPs表面从而降低过氧化物酶活性。在最优条件下,乐果在1~80 mmol/L浓度范围内与抑制率呈线性相关,相关系数R2为0.985,检出限为1.39 mmol/L;并且该方法能特异性检测实际样品中带有酰胺键的农药残留。此外,实验证明AuNPs室温条件下避光存放1 个月依然能保持良好的催化活性并能实现乐果有效的检测,具有良好的贮存特性。
参考文献:
[1] 王海博. 纳米氧化锆电极的制备及其对有机磷农药检测的研究[D].哈尔滨: 哈尔滨工业大学, 2015: 2-3.
[2] PESCE S, MORIN S, LISSALDE S, et al. Combining polar organic chemical integrative samplers (POCIS) with toxicity testing to evaluate pesticide mixture effects on natural phototrophic biofilms[J].Environmental Pollution, 2011, 159(3): 735-741. DOI:10.1016/j.envpol.2010.11.034.
[3] BAJWA U, SANDHU K. Effect of handling and processing on pesticide residues in food: a review[J]. Journal of Food Science and Technology, 2014, 51(2): 201-220. DOI:10.1007/s13197-011-0499-5.
[4] HAO H, SUN B, ZHAO Z. Effect of land use change from paddy to vegetable field on the residues of organochlorine pesticides in soils[J].Environmental Pollution, 2008, 156(3): 1046-1052. DOI:10.1007/s13197-011-0499-5.
[5] FONTANA A, CAMARGO A, ALTAMIRANO J. Coacervative microextraction ultrasound-assisted back-extraction technique for determination of organophosphates pesticides in honey samples by gas chromatography-mass spectrometry[J]. Journal of Chromatography A,2010, 1217(41): 6334-6341. DOI:10.1016/j.chroma.2010.08.021.
[6] 沈英, 孙福生, 董杰. 分散液相微萃取-高效液相色谱法测定水中丙溴磷农药[J]. 分析化学, 2010, 38(4): 551-554. DOI:10.3724/SP.J.1096.2010.00551.
[7] HUANG Z, LI Y, CHEN B, YAO S. Simultaneous determination of 102 pesticide residues in Chinese teas by gas chromatographymass spectrometry[J]. Journal of Chromatography B Analytical Technologies in the Biomedical & Life Sciences, 2007, 853(1/2): 154-162. DOI:10.1016/j.jchromb.2007.03.013.
[8] ZHANG H, WANG S, FANG G. Applications and recent developments of multi-analyte simultaneous analysis by enzymelinked immunosorbent assays[J]. Journal of Immunological Methods,2011, 368(1/2): 1-23. DOI:10.1016/j.jim.2011.02.011.
[9] 王小红. 酶抑制法检测蔬菜中的有机磷农药残留的方法研究[D].武汉: 华中农业大学, 2006: 12-23.
[10] XIE J, ZHANG X, WANG H, et al. Analytical and environmental applications of nanoparticles as enzyme mimetics[J]. Trac Trends in Analytical Chemistry, 2012, 39: 114-129. DOI:10.1016/j.trac.2012.03.021.
[11] DENG H, WEI S, PENG Y, et al. Nanoparticulate peroxidase/catalase mimetic and its application[J]. Chemistry-A European Journal, 2012,18(29): 8906-8911. DOI:10.1002/chem.201200643.
[12] LIN Y, REN J, QU X. Catalytically active nanomaterials: a promising candidate for artificial enzymes[J]. Accounts of Chemical Research,2014, 47(4): 1097-1105. DOI:10.1021/ar400250z.
[13] WEERATHUNGE P, RAMANATHAN R, SHUKLA R, et al.Aptamer-controlled reversible inhibition of gold nanozyme activity for pesticide sensing[J]. Analytical Chemistry, 2014, 86(24): 11937-11942. DOI:10.1021/ac5028726.
[14] LIU Y P, WANG C, CAI N, et al. Negatively charged gold nanoparticles as an intrinsic peroxidase mimic and their applications in the oxidation of dopamine[J]. Journal of Materials Science, 2014,49(20): 7143-7150. DOI:10.1007/s10853-014-8422-x.
[15] MOMIĆ T, PAŠTI T, BOGDANOVIĆ U, et al. Adsorption of organophosphate pesticide dimethoate on gold nanospheres and nanorods[J]. Journal of Nanomaterials, 2016, 12(4): 2014-2019.DOI:10.1155/2016/8910271.
[16] CHEN Y, WU H. Regulation of alpha-chymotrypsin activity on the surface of substrate-functionalized gold nanoparticles[J]. Chemical Communications, 2006, 27: 2905-2907. DOI:10.1039/b605508g.
[17] AND B, ELSAYED M. Preparation and growth mechanism of gold nanorods (NRs) using seed-mediated growth method[J]. Chemistry of Materials, 2003, 15(10): 1957-1962. DOI:10.1021/cm020732l.
[18] VIGDERMAN L, MANNA P, ZUBAREV E. Quantitative replacement of cetyl trimethylammonium bromide by cationic thiol ligands on the surface of gold nanorods and their extremely large uptake by cancer cells[J]. Angewandte Chemie International Edition,2012, 51(3): 636-644. DOI:10.1002/ange.201107304.
[19] YAN B, WANG Y. Comment on “simulation of the optical absorption spectra of gold nanorods as a function of their aspect ratio and the effect of the medium dielectric constant”[J]. Journal of Physical Chemistry B, 2003, 107(34): 315-319. DOI:10.1021/jp035241i.
[20] AHMED S, TAKEMEURA K, LI T, et al. Size-controlled preparation of peroxidase-like graphene-gold nanoparticle hybrids for the visible detection of norovirus-like particles[J]. Biosensors & Bioelectronics,2016, 87: 558-564. DOI:10.1016/j.bios.2016.08.101.
[21] HOU R, JIAO W, QIAN X, et al. Effective extraction method for determination of neonicotinoid residues in tea[J]. Journal of Agricultural & Food Chemistry, 2013, 61(51): 12565-12571.DOI:10.1021/jf404100x.
[22] VUJAČIĆ A, VASIĆ V, DRAMIĆANIN M, et al. Fluorescence quenching of 5,5’-disulfopropyl-3,3’-dichlorothiacyanine dye adsorbed on gold nanoparticles[J]. Journal of Physical Chemistry C, 2013,117(13): 6567-6577. DOI:10.1021/jp311015w.
[23] ESUMI K, TORIGOE K. Preparation and characterization of noble metal nanoparticles using dendrimers as protective colloids[M].Heidelberg: Springer, 2001: 80-87. DOI:10.1007/3-540-45405-5_15.
[24] VONNEMANN J, BEZIERE N, BÖTTCHER C, et al.Polyglycerolsulfate functionalized gold nanorods as optoacoustic signal nanoamplifiers for in vivo bioimaging of rheumatoid arthritis[J].Theranostics, 2014, 4(6): 629-641. DOI:10.7150/thno.8518.
[25] LIM J, LEE N, LEE E, et al. Surface modification of citrate-capped gold nanoparticles using CTAB micelles[J]. Bulletin-Korean Chemical Society, 2014, 35(8): 2567-2569. DOI:10.5012/bkcs.2014.35.8.2567.
[26] ALKILANY A, NAGARIA P, WYATT M, et al. Cation Exchange on the surface of gold nanorods with a polymerizable surfactant:polymerization, stability, and toxicity evaluation[J]. Langmuir the Acs Journal of Surfaces & Colloids, 2010, 26(12): 9328-9335.DOI:10.1021/la100253k.
[27] 隆异娟. 基于纳米金模拟酶活性的生物分析化学研究[D]: 重庆: 西南大学, 2012: 30-31.
[28] LONG Y, LI Y, LIU Y, et al. Visual observation of the mercurystimulated peroxidase mimetic activity of gold nanoparticles[J].Chemical Communications, 2011, 47(43): 11939-11941. DOI:10.1039/c1cc14294a.
[29] LIM J, LEE N, LEE E, YOON S. Surface modification of citratecapped gold nanoparticles using CTAB micelles[J]. Bulletin-Korean Chemical Society, 2014, 35(8): 2567-2569. DOI:10.5012/bkcs.2014.35.8.2567.
[30] 周文婷. 表面活性剂囊泡形成的机理研究[D]. 厦门: 厦门大学,2007: 2-15.
[31] 李东华, 徐晓明, 周文婷, 等. 季铵盐型Gemini表面活性剂的胶束化动力学研究[J]. 高等学校化学学报, 2006, 27(10): 1927-1931.DOI:10.3321/j.issn:0251-0790.2006.10.025.