苹果生产对农药的依赖性很大,其中使用的农药为有机磷类、氨基甲酸酯类、有机氯类、拟除虫菊酯类、苯氧乙酸类等,这使得苹果存在较大的农药残留安全隐患。早在20世纪80年代,苹果中的农药残留问题就开始受到广泛关注。目前,我国苹果农药残留标准涉及51 种农药,9 种剧毒、高毒、高残留农药不得检出(GB 2763—2014《食品中农药最大残留限量》)。苹果作为新疆果农的主要经济来源之一,一半以上用于出口,而因农药残留问题在对外贸易中造成巨大损失。因此,针对新疆苹果种植特点,建立新疆苹果中农药多残留的快速筛查方法,可快速、高效地对即将出口的新疆苹果进行农药残留筛查,有效避免新疆果农的经济损失,提高出口贸易成功率。
对于农药多残留的检测,早期文献报道多采用气相色谱[1]或气相色谱-质谱联用[2-4]法,虽然这种方法分析速度较快,但受检测器的限制,定性准确性相对较差,并且不适于难挥发、热不稳定的农药的分析检测。高效液相色谱[5-6]和液相色谱-质谱联用[7-11]等在样品的测试范围方面,发挥了较大的优势。但单纯液相色谱定性能力有限,检出限也往往难以满足欧盟等对农药残留检测的要求。传统的液相色谱-质谱联用法,通常配备的是分辨率低于10 000的低分辨质谱,在检测中很难区分0.01 Da的质量差异,常出现假阳性结果。Q Exactive将四极杆和Orbitrap高分辨技术结合起来,在提高灵敏度和改善定性结果准确性的同时,大大提高了其定量能力,在小分子化学污染物的分析方面具有巨大的应用前景[12-17]。
但是,尽管用高分辨质谱,仍会存在±5×10-6Da的质量检测偏差,造成5%假阳性结果。虽然采用母离子-子离子对进行确证可有效提高结果准确度,但前提是母离子必须能够电离出子离子,其次其他化合物电离出的相同质荷比的子离子,也会被记入定量,同样存在较大定量误差。为了解决以上问题,Paul等[18]的研究利用四极杆结合轨道阱液相色谱-质谱联用技术[19-23]的可变数据独立采集(variable data-independent analysis,vDIA)模式代替全离子碎裂电离模式,使母离子与子离子相关联,从而得到了很好的定性、定量结果。
本实验优化了快速样品前处理技术QuEChERS(quick, easy, cheap, effective, rugged and safe)提取方法[24-27]、分散固相萃取(dispersive solid phase extraction,d-SPE)净化条件,并采用超高效液相色谱-串联高分辨质谱(ultra performance liquid chromatography-high resolution tandem mass spectrometry,UPLC-HRMS/MS)[28-30]分离检测新疆苹果中7 种常见农药多残留量的可能性,建立了vDIA-UPLC-HRMS/MS检测新疆苹果中农药多残留量的分析方法。并将此方法应用于实际样品的分析,获得了较好的分析结果。
1 材料与方法
1.1 材料与试剂
苹果为新疆本地产,购于农贸批发市场。
吡虫啉、毒死蜱、氰戊菊酯、辛硫磷、嘧啶磷、氯氰菊酯、杀扑磷标准品(纯度>99%) 农业部环境保护科研监测所;甲醇、乙腈(均为色谱纯)美国Sigma-Aldrich公司;无水硫酸镁、无水醋酸钠、氯化钠(用前在马弗炉500 ℃灼烧4 h,冷却后贮于干燥器中备用)、甲酸、醋酸(均为分析纯) 国药集团化学试剂上海有限公司;N-丙基乙二胺(primary secondary amine,PSA)、C18封端的硅胶(C18E) 日本岛津公司;0.2 μm有机相微孔滤膜 美国Thermo-Fisher公司;实验用水为艾柯纯水仪制备高纯水。
1.2 仪器与设备
Q Exactive四极杆-静电场轨道阱高分辨质谱系统(配有加热电喷雾离子源(heated electrospray ionization,HESI)及Xcalibur 2.0数据处理系统;Dionex UltiMate 3000快速高效液相色谱系统) 美国Thermo-Fisher公司;TD5A-WS离心机 上海湘仪离心机厂;HZQ-50H回旋振荡器 上海一恒科学仪器有限公司。
1.3 方法
1.3.1 色谱条件
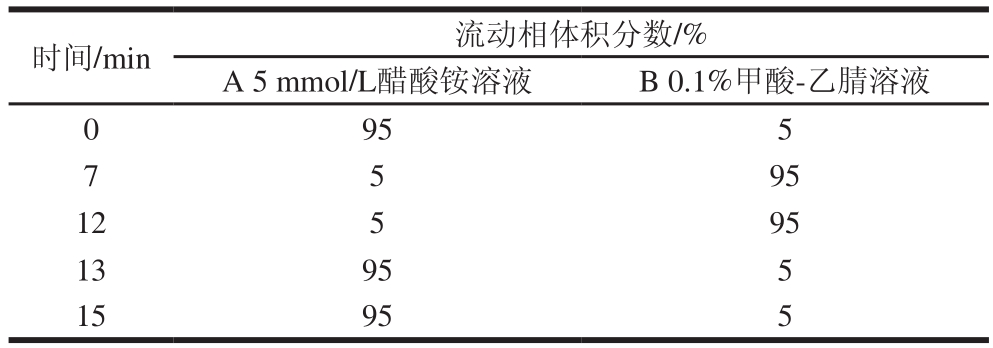
色谱柱:Thermo aQ C18柱(100 mm×2.1 mm,2.6 μm);流动相:5 mmol/L醋酸铵溶液(A)和0.1%甲酸-乙腈溶液(B),梯度洗脱见表1。流速0.2 mL/min,柱温20 ℃;进样量5 μL。
表1 流动相的梯度洗脱程序
Table 1 Gradient program of mobile phase
1.3.2 质谱条件
Q Exactive质谱仪配备HESI(正离子模式);室内环境控制在温度20 ℃、相对湿度40%;喷雾电压:3.5 kV;HESI源温度:300 ℃;离子源温度:250 ℃;鞘气压力:35 arb;辅助气压力:10 arb;反吹气压力:0 arb;射频电压:55 V;源内氮气99%;高能碰撞池及离子阱中的缓冲气均为高纯氮99.99%;每3 d用正离子校正液(包含咖啡因、四肽MRFA、ultrmark及四丁胺)校正一次正离子模式;所有定量数据均由全扫描/target-MS2模式得到,该模式是由全扫描模式联合vDIA碎裂方式,依据碎片离子能量进行二级子离子扫描组成;全扫描质谱的分辨率为70 000 FWHM;自动增益控制设为1.0×106,最大离子进样时间为100 ms;扫描范围m/z 50~500;归一化碰撞能量为35%。
1.3.3 样品前处理方法
1.3.3.1 未加缓冲盐的QuEChERS方法
称取5.0 g试样于50 mL具塞离心管中,加入10.0 mL乙腈,振荡30 min,加入4.00 g无水硫酸镁和1.00 g氯化钠,剧烈振荡1 min,6 000 r/min离心5 min,取1 mL上清液快速加入装有0.75 g无水硫酸镁和0.25 g PSA及0.25 g C18E的10 mL离心管中,快速手动振摇20 次,取上清液过0.2 μm有机相微孔滤膜,取5 μL滤液直接上机检测。
1.3.3.2 加入酸性缓冲液的QuEChERS方法
将1.3.3.1节“加入10.0 mL乙腈、4.00 g无水MgSO4、1.00 g NaCl”改为“加入10.0 mL 1%醋酸-乙腈、4.00 g无水MgSO4、1.00 g无水醋酸钠”;或改为“加入10.0 mL 0.1%甲酸-乙腈、4.00 g无水MgSO4、1.00 g NaCl”其余与1.3.3.1节一致。
1.3.4 实际样品的测定
对乌鲁木齐市购置的苹果样品,采用优化方法进行处理,并采用不含目标化合物的苹果样品作为空白对照,进行条件优化和方法验证。
2 结果与分析
2.1 色谱条件的选择
农药回收溶剂为乙腈,为减少色谱分离过程的波动,采用乙腈-水体系为流动相。采用Thermo aQ C18色谱柱分析,比较纯水和0.1%甲酸溶液为流动相A、乙腈和0.1%甲酸-乙腈为流动相B的效果。在流动相水相中添加5 mmol/L醋酸铵、有机相中添加0.1%甲酸后,既有利于化合物的离子化,提高化合物的响应值,又有利于改善7 种农药的峰形,因此选择5 mmol/L醋酸铵溶液为流动相A,0.1%甲酸-乙腈为流动相B。乙腈洗脱能力强,可减少杂质在色谱柱中的残留,延长色谱柱寿命。除此之外,适量加入甲酸和乙酸铵可以抑制[M+Na]+峰的形成,促进[M+H]+峰的形成,能够在一定程度上改变色谱峰峰形并增强其响应值,从而提高检测的灵敏度。
采用优化的最佳色谱条件(表1)对苹果中常用的7 种农药进行测定,7 种农药混标色谱图见图1,出峰顺序分别为吡虫啉6.81 min、毒死蜱7.34 min、氰戊菊酯7.77 min、辛硫磷8.55 min、嘧啶磷9.26 min、氯氰菊酯9.27 min、杀扑磷9.71 min,峰形尖锐,灵敏度高。


图1 7 种农药的提取离子色谱图
Fig. 1 Extracted ion chromatograms of 7 pesticides
2.2 质谱条件的选择
由于Q Exactive质谱仪结合四极杆质谱与Obitrap质谱各自的优点,具有高分辨率和高灵敏度的特点。与三重四极杆质谱定量手段不同,Q Exactive质谱在全扫描结合dd-MS2模式下应用vDIA碎裂模式,同时进行全扫描和全范围+二级质谱扫描,具有更好的定性、定量准确度。在HESI+模式下,对7 种农药的质谱条件进行了优化,分别采用全扫描和全扫描结合dd-MS2的子离子扫描方式,优化得到了母离子、子离子及最佳碎裂能量,以响应值最大的子离子为定量离子,以相对丰度较高的两个离子对为定性依据,增加了定性的准确度,从而得到了最优的质谱条件(表2)。
表2 7 种农药的质谱采集参数
Table 2 Mass spectral parameters for 7 pesticides

采用Q Exactive质谱仪在UPLC-HRMS/MS条件下,对基质共存的多种农药进行分析,结果发现在纯溶剂中样品的离子峰强度或大于或小于在基质中样品的离子峰强度,说明基质在一定程度上影响着农药的电离。
2.3 样品前处理方法的优化
2.3.1 提取剂的选择
为找到最佳的提取剂,基于QuEChERS方法进行改进。QuEChERS方法中的提取剂对一些弱酸性农药和稳定性差的农药回收率低,这与处理过程未考虑农药本身的性质有关,在中性或弱碱性条件下处理样品,使农药分解,导致提取率偏低。本实验针对这一问题,在提取农药时,加入了甲酸或醋酸调节基质pH值环境,来改善苹果中农药的回收率。
为考察提取剂对7 种农药的提取效果,选择添加100 μg/kg的农药混标的苹果空白为实验对象,分别采用原创QuEChERS方法中的提取剂乙腈,及改良后的提取剂0.1%甲酸-乙腈和1%醋酸-乙腈,对100 μg/kg混合加标的苹果样品进行提取,并按照1.3.3节对提取剂进行净化。测定原创QuEChERS方法平均回收率为85%;以0.1%甲酸-乙腈为提取剂时平均回收率为103%,相对于原创方法,回收率有所提高,但偏差较大;以1%醋酸-乙腈为提取剂时平均回收率为99%,且波动小(表3)。这主要是由于1%醋酸-乙腈为提取剂时,加入的盐为醋酸盐,构成醋酸-醋酸钠的缓冲溶液,使得提取过程pH值控制在5左右,有利于农药的提取。
表3 不同提取剂对回收率的影响
Table 3 Influence of different extractants on the recovery

2.3.2 净化剂的选择
QuEChERS方法采用PSA为净化剂,进行d-SPE净化,PSA直接加入经盐析分层的样品提取液中以吸附基质中的干扰物,固相萃取时间不应过长,否则固相吸附剂也会吸附目标化合物,导致回收率降低,影响测定结果的准确性。因此,d-SPE过程在加入提取剂后,手动上下快速振摇20 次,立即过膜上机测试。
为考察不同净化剂的净化效果,同样选择添加100 μg/kg的农药混标的苹果空白为实验对象,考察PSA、C18E、石墨化炭黑(graphitized carbon black,GCB)及其组合为净化剂(保持总质量为500 mg),采用d-SPE法对提取剂进行净化,其他步骤与1.3.3节同。
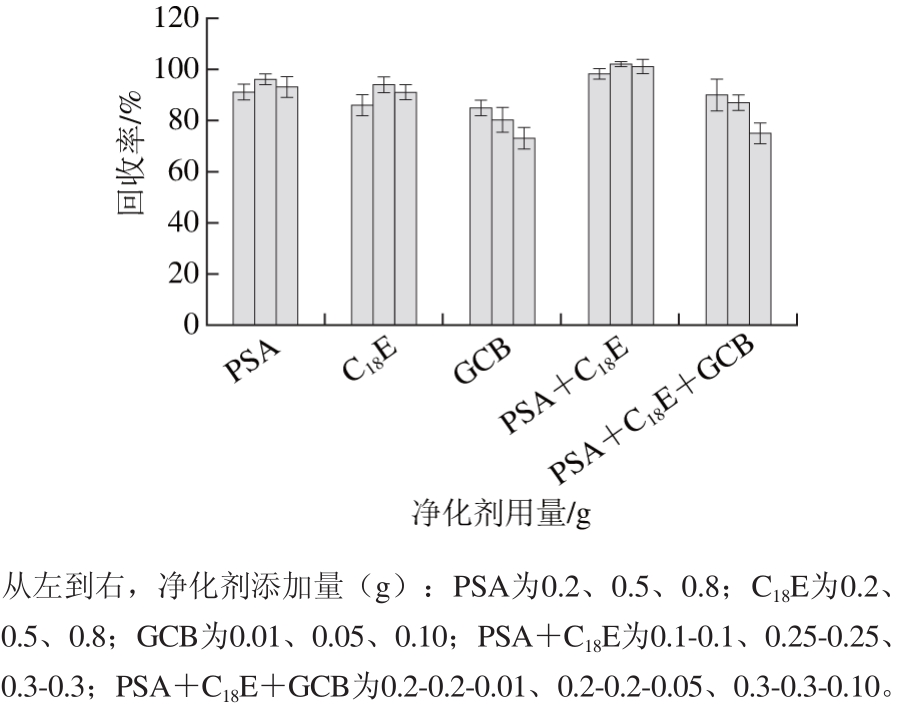
图2 使用不同净化剂的前处理方法对吡虫啉的回收率
Fig. 2 Recoveries of imidacloprid with various purification agents
由图2可见,当添加GCB时,回收率均较低,这可能是由于其较强的吸附能力,吸附了少量农药样品的缘故。单独使用PSA和C18E时回收率均可达90%以上,当组合使用两种净化剂回收率大大提高。净化效果依次为PSA+C18E>PSA≥C18E>PSA+C18E+GCB>GCB,因此选择PSA+C18E为净化剂。
2.3.3 样品与分散剂比例的选择
固定样品提取剂1.0 mL,分别考察当分散剂PSA+C18E分别为0.2、0.5、0.6、0.8、1.0、2.0、3.0 g时7 种农药的回收情况。如图3所示,表明物料比为1.0∶0.5时,净化效果和回收率都比较好。

图3 样品与分散剂的比例
Fig. 3 Effect of dispersing agent dosage on the recovery
因此,最终确定前处理方法:以1%醋酸-乙腈液为提取剂加入醋酸钠作为盐析试剂,构成pH值为5的缓冲提取剂;以PSA+C18E为组合净化剂,物料比为1.0∶0.5。
2.4 方法学验证
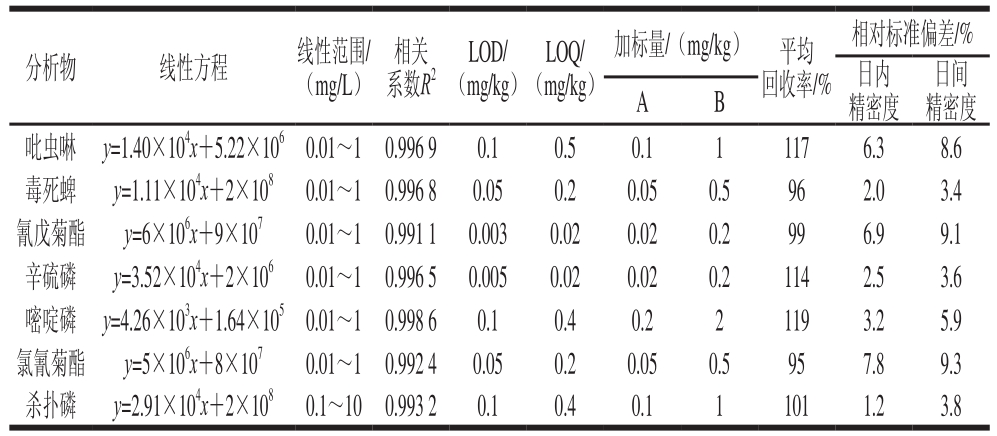
方法学验证结果(表4)表明该方法具有较好的回收率,所有农药的回收率均在70%~120%之间。从表4还可看出,本方法检出限(limits of detection,LOD)为0.003~0.1 mg/kg,定量限(limits of quantification,LOQ)为0.02~0.5 mg/kg,较为满意。7 种农药线性关系良好,可满足每一个目标化合物的分析要求,相关系数均大于0.99。
以空白苹果加标实验(LOD和10×LOD两个加标水平(由于线性范围限制,针对氰戊菊酯和辛硫磷采用LOQ和10×LOQ两个加标水平),取3 个独立样品进行测试),每组加标量平行做3 次,得到平均的回收率。由于电离增强效应及基质效应,使得吡虫啉、辛硫磷和嘧啶磷的回收率略微偏高。验证实验表明,平均回收率在95%~119%之间,相对标准偏差小于10%(n=3)。
表4 方法学验证结果
Table 4 Figures of merit of the method
2.5 实际样品的定量效果验证
为了考察方法的定量准确性,采用建立的vDIAUPLC-HRMS/MS方法对实际苹果样品进行了两个加标水平的测定。由表5可知,通过对空白样品和加标样品的对比分析,可以得到良好的定量结果。
表5 实际苹果样品分析验证结果
Table 5 Recoveries of pesticides from spiked apple samples

注:ND.未检出。
2.6 实际样品的定性效果验证
新疆苹果中农药类污染物质谱数据库的建立,对新疆苹果产业的发展具有重要的意义。建立新疆苹果中常用农药的质谱数据库,可快速、有效地定点筛查出新疆苹果中残留的农药种类及含量,可有效提高日常筛查的工作效率,从而提高农药污染物的确认能力和增加出口贸易成功率。
大量文献表明,基质会干扰农药的测定,因此,在构建标准谱库时,应在基质共存下分析目标化合物。谱库建立的流程如图4所示。
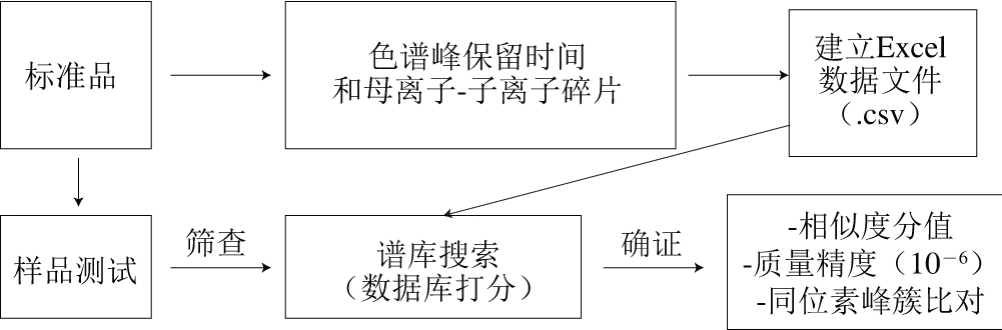
图4 数据库建立及应用工作流程图
Fig. 4 Establishment and application of database to identify analytes in samples
因篇幅有限,此处以吡虫啉为例,探讨自建谱库的流程。图5为自建谱库与标准谱库的基质加标样品中吡虫啉母离子(m/z 256.059 58)及其碎片离子(m/z 209.059 40和m/z 175.097 82)的质量偏差对比,该结果是在苹果基质中加标1×106Da后得到的,这与标准谱库的做法一致,其次吡虫啉和它的两个主要碎片离子与标准谱库进行对比,有较高的符合程度。子离子m/z 209.059 40和m/z 175.097 82在标准谱库中与理论质量相比,质量偏差分别为-3.83×10-6Da和-6.68×10-6Da;而在自建谱库中与理论质量相比,质量偏差分别为-6.17×10-6Da和-9.48×10-6Da。说明自建谱库具有较好的质量精度。为考察所建立方法的适用性,本实验对10 个苹果样品进行了分析,得到了较为满意的结果。
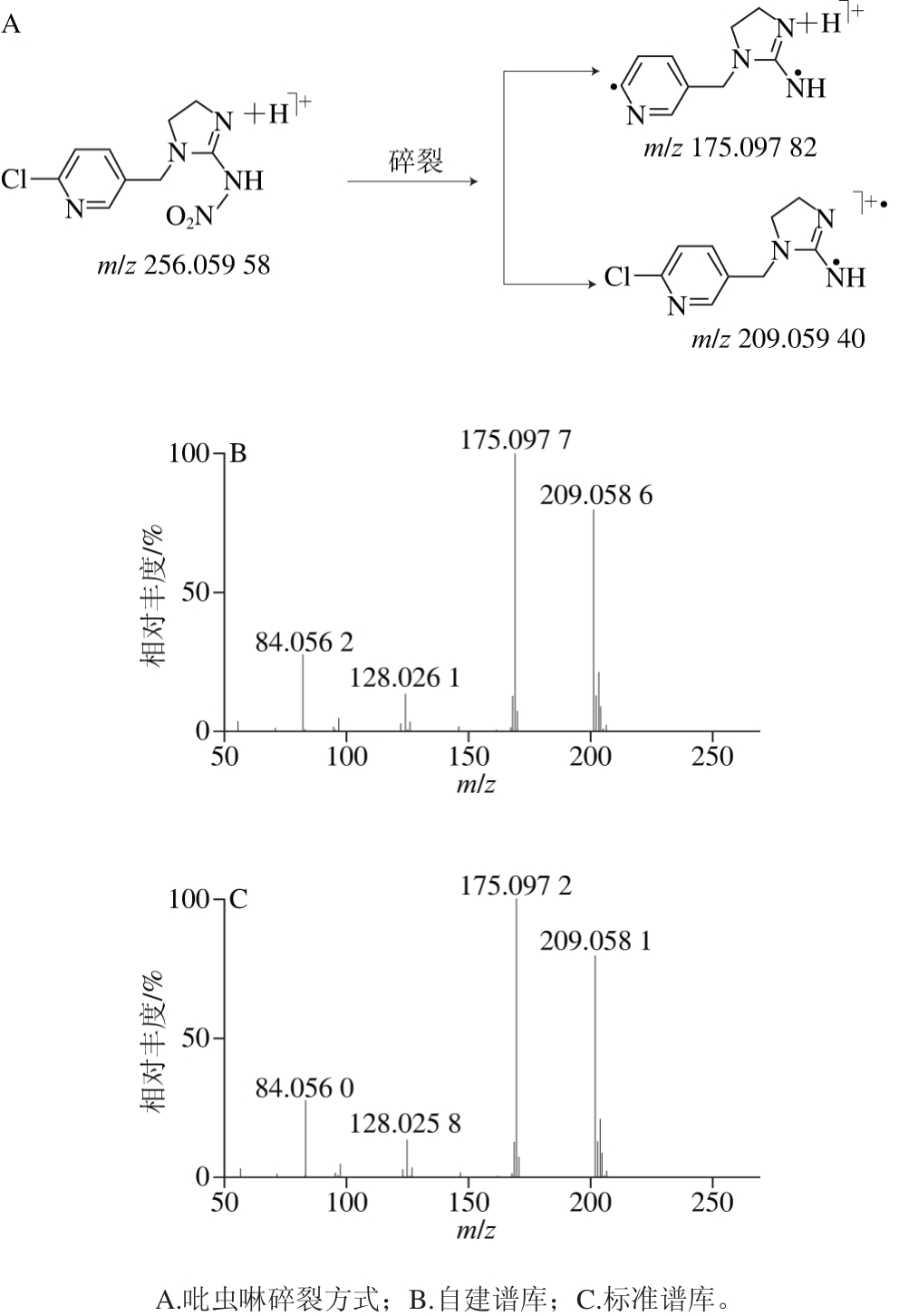
图5 自建谱库与标准谱库的基质加标样品中吡虫啉母离子(m/z 256.059 58)及其碎片离子(m/z 209.059 40和m/z 175.097 82)的质量偏差对比
Fig. 5 Comparison of mass errors of parent (m/z 256.059 58) and fragment (m/z 209.059 40 and 175.097 82) ions imidacloprid in matrixmatched spiked calibration samples between standard library and spectral library established in this study
3 结 论
实验建立了vDIA-UPLC-HRMS/MS法对新疆苹果中的7 种常见农药残留进行分析,考察方法的线性范围、线性方程、检出限、定量限、加标回收率及相对标准偏差,同时对提取剂的种类、d-SPE的分散剂种类与物料比等参数进行优化。通过建立新疆苹果中常见农药的质谱数据库,分别考察建立方法的定性、定量能力。实验结果表明,该方法具有较高的准确度,成本低且简便、快速,具有良好的适用性与普遍的实用价值。
参考文献:
[1] 万益群, 鄢爱平, 谢明勇. 中草药中有机氯农药和拟除虫菊酯农药残留量的测定[J]. 分析化学, 2005, 33(5): 614-618. DOI:10.3321/j.issn:0253-3820.2005.05.006.
[2] 佟玲, 李重九. 含硫蔬菜中50 种农药多残留的气相色谱-串联质谱检测技术研究[J]. 分析测试学报, 2008, 27(9): 930-935.
[3] 施家威, 李继革, 王玉飞, 等. 固相萃取-三重串联四极杆气相色谱/质谱联用分析蔬菜中43 种农药残留[J]. 色谱, 2010, 28(12): 1137-1143.
[4] 姜俊, 李培武, 谢立华, 等. 固相萃取-全二维气相色谱/飞行时间质谱同步快速检测蔬菜中64 种农药残留[J]. 分析化学, 2011, 39(1): 72-76.
[5] BANERJEE T, BANERJEE D, ROY S, et al. A comparative study on the persistence of imidacloprid and beta-cyfluthrin in vegetables[J].Bull Environment Contamination Toxicology, 2012, 89: 193-196.DOI:10.1007/s00128-012-0644-5.
[6] 余晟, 黄克靖, 余萌, 等. 固相萃取-高效液相色谱法同时检测水样中戊唑醇、乙霉威、晴菌唑、精甲霜灵和扑草净5 种农药残留[J]. 分析化学, 2012, 40(7): 1065-1070. DOI:10.3724/SP.J.1096.2012.11256.
[7] 谢文, 丁慧瑛, 蒋晓英, 等. 液相色谱-串联质谱检测蔬菜和茶叶中吡虫啉的残留量[J]. 色谱, 2006, 24(6): 633-635
[8] 王岩松, 杨春晖, 张春野, 等. 高效液相色谱-串联质谱法测定环境水样中多种杀菌剂残留量[J]. 分析化学, 2012, 40(2): 286-291.DOI:10.3724/SP.J.1096.2012.20100.
[9] 张新忠, 罗逢健, 陈宗懋, 等. 超高效液相色谱-串联质谱法测定茶叶、茶汤和土壤中氟环唑、茚虫威和苯醚甲环唑残留[J]. 分析化学, 2013, 41(2): 215-222. DOI:10.3724/SP.J.1096.2013.20628.
[10] 陈丽娜, 宋凤瑞, 郑重, 等. 人参中农药多残留的超高效液相色谱-串联质谱分析方法研究[J]. 化学学报, 2012, 70(7): 843-851.DOI:10.6023/A1110262.
[11] VAN DER HEEFT E, BOLCK Y J C, BEUMER B, et al. Full-scan accurate mass selectivity of ultra-performance liquid chromatography combined with time-of-flight and Orbitrap mass spectrometry in hormone and veterinary drug residue analysis[J]. Journal of American Society Mass Spectrometry, 2009, 20: 451-463. DOI:10.1016/j.jasms.2008.11.002.
[12] WANG J, CHOW W, LEUNG D, et al. Application of ultrahighperformance liquid chromatography and electrospray ionization quadrupole Orbitrap high-resolution mass spectrometry for determination of 166 pesticides in fruits and vegetables[J]. Journal of Agricultural Food Chemistry, 2012, 60(49): 12088-12104.DOI:10.1021/jf303939s.
[13] 郭延垒, 吴明军, 李文娟, 等. Q Exactive四极杆-静电场轨道阱高分辨质谱系统对丹皮酚经大鼠肝微粒体体外代谢产物的分析[J]. 分析化学, 2013, 41(7): 1074-1079. DOI:10.3724/SP.J.1096.2013.20976.
[14] JIA W, CHU X G, LING Y, et al. High-throughput screening of pesticide and veterinary drug residues in baby food by liquid chromatography coupled to quadrupole Orbitrap mass spectrometry[J].Journal of Chromatography A, 2014, 1347: 122-128. DOI:10.1016/j.chroma.2014.04.081.
[15] SENYUVA H Z, GOKMEN V, SARIKAYA E A. Future perspectives in Orbitrap™-high-resolution mass spectrometry in food analysis:a review[J]. Food Additives & Contaminants: Part A, 2015, 32(10):1568-1606. DOI:10.1080/19440049.2015.1057240.
[16] JIANG S Y, TAN H J, GUO C C, et al. Development of an ultrahigh-performance liquid chromatography coupled to high-resolution quadrupole-Orbitrap mass spectrometry method for the rapid detection and confirmation of illegal adulterated sedative-hypnotics in dietary supplements[J]. Food Additives & Contaminants: Part A, 2015,32(10): 1749-1759. DOI:10.1080/19440049.2015.1041427.
[17] KEE C L, GE X W, LOW M Y. Application of Orbitrap-mass spectrometry to differentiate isomeric sildenafil- and thiosildenafil-like analogues used for the adulteration of dietary supplements[J]. Food Additives & Contaminants: Part A, 2015, 32(10): 1737-1748. DOI:10.1080/19440049.2015.1062923.
[18] ZOMER P, MOL H G J. Simultaneous quantitative determination,identification and qualitative screening of pesticides in fruits and vegetables using LC-Q Orbitrap™-MS[J]. Food Additives &Contaminants: Part A, 2015, 32(10): 1628-1636. DOI:10.1080/194400 49.2015.1085652.
[19] GOMEZ-PEREZ M L, PLAZA-BOLANOS P, ROMEROGONZALEZ R, et al. Comprehensive qualitative and quantitative determination of pesticides and veterinary drugs in honey using liquid chromatography-Orbitrap high resolution mass spectrometry[J].Journal of Chromatography A, 2012, 1248: 130-138. DOI:10.1016/j.chroma.2012.05.088.
[20] GOMEZ-PEREZ M L, ROMERO-GONZALEZ R, MARTÍNEZ VIDAL J L, et al. Analysis of veterinary drug and pesticide residues in animal feed by high-resolution mass spectrometry: comparison between time-of-flight and Orbitrap[J]. Food Additives &Contaminants: Part A, 2015, 32(10): 1637-1646. DOI:10.1080/194400 49.2015.1023742.
[21] 于慧娟, 李冰, 蔡友琼, 等. 液相色谱-串联质谱法测定甲壳类水产品中氨基脲的含量[J]. 分析化学, 2012, 40(10): 1530-1535.DOI:10.3724/SP.J.1096.2012.20160.
[22] GÓMEZ-RAMOS M D M, RAJSKI L, HEINZEN H, et al. Liquid chromatography Orbitrap mass spectrometry with simultaneous full scan and tandem MS/MS for highly selective pesticide residue analysis[J]. Analytical & Bioanalytical Chemistry, 2015, 407(21):6317-6326. DOI:10.1007/s00216-015-8709-z.
[23] ORDUNA A R, HUSBY E, YANG C T, et al. Assessment of meat authenticity using bioinformatics, targeted peptide biomarkers and high-resolution mass spectrometry[J]. Food Additives &Contaminants: Part A, 2015, 32(10): 1709-1717. DOI:10.1080/194400 49.2015.1064173.
[24] Standards Policy and Strategy Committee. British Standard. Foods of plant origin, determination of pesticide residues using GC-MS and/or LC-MS/MS following acetonitrile extraction/partitioning and clean-up by dispersive SPE, QuEChERS-method: EN15662:2008:75[S].
[25] 林涛, 邵金良, 刘兴勇, 等. QuEChERS-超高效液相色谱-串联质谱法测定蔬菜中41 种农药残留[J]. 色谱, 2015, 33(3): 235-241.
[26] ALBERT A, KRAMER A, SCHEEREN S, et al. Rapid and quantitative analysis of pesticides in fruits by QuEChERS pretreatment and low-temperature plasma desorption/ionization Orbitrap mass spectrometry[J]. Analysis Methods, 2014, 6: 5463-5471.
[27] SUNGUR S, TUNUR C. Investigation of pesticide residues in vegetables and fruits grown in various regions of Hatay, Turkey[J].Food Additives and Contaminants: Part B, 2012, 5(4): 265-267. DOI:10.1080/19393210.2012.704597.
[28] RUBERT J, ZACHARIASOVA M, HAJSLOVA J. Advances in highresolution mass spectrometry based on metabolomics studies for food:a review[J]. Food Additives & Contaminants: Part A, 2015, 32(10):1685-1708. DOI:10.1080/19440049.2015.1084539.
[29] DE DOMINICIS E, COMMISSATI I, GRITTI E, et al.Quantitative targeted and retrospective data analysis of relevant pesticides, antibiotics and mycotoxins in bakery products by liquid chromatography-single-stage Orbitrap mass spectrometry[J]. Food Additives & Contaminants: Part A, 2015, 32(10): 1617-1627. DOI:10.1080/19440049.2015.1061703.
[30] THESE A, BODI D, UECKER S, et al. A case of human poisoning by grayanotoxins following honey ingestion: elucidation of the toxin profile by mass spectrometry[J]. Food Additives & Contaminants: Part A, 2015, 32(10): 1674-1684. DOI:10.1080/19440049.2015.1042410.