近年来,农药的大量不合理使用使害虫对多种常规农药产生了高水平的抗药性,为控制害虫爆发危害,国内外研究者开发了一些高效、超高效、低毒新型农药品种来防治刺吸式害虫。氟啶虫胺腈是新型烟碱类广谱杀虫剂,主要通过激活烟碱型乙酰胆碱受体,作用于昆虫的神经系统而表现出杀虫活性[1];Pyrifluquinazon是一种具双酰胺结构的新喹唑啉类杀虫剂,通过使害虫停止取食进而饿死而杀灭害虫,在防止植物组织遭受更多损害的同时,限制一些重要病害的传播[2]。螺虫乙酯是新季酮酸衍生物类杀虫剂,主要通过干扰昆虫的脂肪生物合成而促使幼虫死亡,降低成虫的繁殖能力[3-4]。这3 种新型杀虫剂可用于防治蔬菜和果树上蚜虫类、粉虱类、粉蚧类、叶蝉类、蓟马类等各种刺吸性害虫,与有机磷类、拟除虫菊酯类、新烟碱类等杀虫剂无交互抗性,具有高效、低毒、低残留、内吸性好、对非靶标生物安全等优点,是刺吸式害虫综合治理的优选药剂[4-7],3 种农药的结构式如图1所示。

图1 氟啶虫胺腈(a)、Pyrifluquinazon(b)和螺虫乙酯(c)结构式
Fig. 1 Structural formulas of sulfoxaflor, pyrifluquinazon and spirotetramat
随着氟啶虫胺腈、Pyrifluquinazon和螺虫乙酯的登记、推广和使用,作为我国蔬菜、水果主要出口市场的美国、欧盟、韩国、日本、加拿大等国家对其制定了最大允许残留限量(maximum residue limits,MRLs)。食品法典也对氟啶虫胺腈和螺虫乙酯的MRLs进行了规定[8-10]。食品法典、美国、墨西哥、韩国、澳大利亚规定蔬菜和水果中氟啶虫胺腈MRLs为0.01~6.0 mg/kg;韩国规定Pyrifluquinazon在苹果和梨上的MRLs为0.05 mg/kg;日本规定Pyrifluquinazon在苹果、梨、土豆上的MRLs分别为0.5、1.0、0.2 mg/kg,其余均实行0.01 mg/kg的“一律标准”[11];美国、欧盟、加拿大等国家及食品法典规定果蔬中螺虫乙酯MRLs为0.02~9.0 mg/kg。现阶段,国内外对蔬菜和水果中螺虫乙酯残留量检测方法的研究较多[12-18],对氟啶虫胺腈残留量检测方法的报道较少[1,19-20],对Pyrifluquinazon残留量检测方法进行检索发现,除检索到笔者申请的几个专利[21-23]外,鲜见关于果蔬中Pyrifluquinazon残留量检测方法的报道。在已有的报道中,主要采用乙腈提取,QuEChERS(quick, easy, cheap,effective, rugged, safe)基质固相分散萃取净化或固相萃取净化后,液相色谱-串联质谱、液相色谱或气相色谱电子捕获检测器进行分析检测。采用液相色谱和气相色谱电子捕获检测器进行分析时,方法的定量限均不低于0.025 mg/kg,不能满足有些国家对果蔬中螺虫乙酯、氟啶虫胺腈残留限量的要求。在果蔬生长期间,会交替或轮换使用防治刺吸式害虫的这3 种新型杀虫剂,以延缓农药抗药性的产生,为保证果蔬安全,需同时监控这3 种农药的残留状况。目前,鲜见同时检测果蔬中这3 种新型杀虫剂残留量的研究报道,对不同分散固相萃取剂净化效果也未进行较系统的研究。本研究在优化QuEChERS前处理净化剂、明确不同化合物基质效应及影响因素的基础上,建立超高效液相色谱-串联质谱(ultra performance liquid chromatography-tandem mass spectrometry,UPLCMS/MS)测定果蔬中氟啶虫胺腈、Pyrifluquinazon和螺虫乙酯残留量的同时检测方法,为更好应对国外技术壁垒提供了有力地技术支持,将建立的检测方法应用于实际样品检测取得了满意结果。
1 材料与方法
1.1 材料与试剂
乙腈、甲醇、乙酸铵(均为色谱纯) 德国Merke公司;氯化钠、无水硫酸镁(均为分析纯,用前在450 ℃烘5 h,200 ℃时取出冷却备用) 国药集团化学试剂有限公司;十八烷基键合相硅胶(C18)净化剂、乙二胺-N-丙基硅烷(primary secondary amine,PSA)净化剂天津博纳艾杰尔有限公司;QuEChERS分散固相萃取管(15 mL离心管中装150 mg PSA、900 mg无水硫酸镁)、QuEChERS分散固相萃取管(15 mL离心管中装150 mg C18、900 mg无水硫酸镁)、QuEChERS分散固相萃取管(15 mL离心管中装150 mg PSA、45 mg石墨化炭黑(Carb)粉末、855 mg无水硫酸镁)、QuEChERS分散固相萃取管(15 mL离心管中装150 mg PSA、150 mg C18和900 mg无水硫酸镁) 美国Agilent公司;标准品:氟啶虫胺腈(纯度≥98.0%)、Pyrifluquinazon(100 µg/mL)、螺虫乙酯(纯度≥98.0%) 德国Dr.Ehrenstorfer GmbH公司。
1.2 仪器与设备
1290-6460液相色谱-串联质谱仪 美国Agilent公司;3K 15型离心机(配2 mL转子) 德国Sigma公司;ULTRA-TURRAX T-18 basic型均质器 德国IKA公司;MilliQ超纯水器 美国Millipore公司;Vortex3000型旋涡混合器 德国Wiggens公司。
1.3 方法
1.3.1 标准溶液的配制
准确称取适量螺虫乙酯标准品,用乙腈配制成质量浓度为500 µg/mL的标准储备液;取适量100 µg/mL Pyrifluquinazon储备液和500 µg/mL螺虫乙酯储备液,用乙腈配制成质量浓度为10 µg/mL的标准中间液1;将该标准中间液1和100 µg/mL氟啶虫胺腈标准储备液用乙腈配制出Pyrifluquinazon、螺虫乙酯和氟啶虫胺腈质量浓度分别为1、1 µg/mL和10 µg/mL的标准中间液2;取空白样品按样品前处理过程进行处理,得到空白基质提取净化液,用该基质溶液稀释标准中间液2,配制成适当质量浓度的标准工作液,用于UPLC-MS/MS定量分析。
1.3.2 样品处理
将购置于农贸市场的苹果、葡萄、黄瓜、洋葱、菠菜、甘蓝、草莓等蔬菜和水果清洁干净,取可食用部分,粉碎并混合均匀,准确称取10 g(精确至0.01 g),置于50 mL离心管中,准确加入20 mL乙腈溶液,以10 000 r/min均质提取1 min,加入4 g无水MgSO4、1 g NaCl,立即涡旋混匀后,以7 000 r/min离心5 min。吸取2.0 mL上层有机相转移至装有100 mg C18、50 mg PSA和300 mg无水MgSO4粉末的离心管中,加入后立即将其涡旋混匀2 min,7 000 r/min离心5 min,取上清液过0.22 µm滤膜于进样小瓶中,待UPLC-MS/MS测定。
1.3.3 色谱条件
色谱柱:Eclipse plus C18柱(100 mm×2.1 mm,1.8 μm);流动相A:乙腈,流动相B:5 mmol/L乙酸铵溶液,梯度洗脱程序:A初始体积分数为5%,保持0.5 min,0.5~2.0 min,A线性增加至95%,保持3.5 min,5.5~5.6 min回到初始状态,并保持到8 min;流速:0.2 mL/min;进样体积:5 µL;柱温:30 ℃。
1.3.4 质谱条件
电喷雾离子源(electrospray ionization,ESI);正离子扫描多反应监测(multi-reaction monitoring,MRM)模式检测;雾化器压力:275.9 kPa;干燥气温度:350 ℃;干燥气流速:6.0 L/min;鞘气温度:350 ℃;鞘气流速:10.0 L/min;毛细管电压:+3 500 V;监测离子对、毛细管出口电压/碎裂电压和碰撞能量等质谱采集参数见表1。
表1 氟啶虫胺腈、Pyrifluquinazon和螺虫乙酯质谱采集参数
Table 1 Tandem mass spectral parameters for pyrifluquinazon,sulfoxaflor and spirotetramat
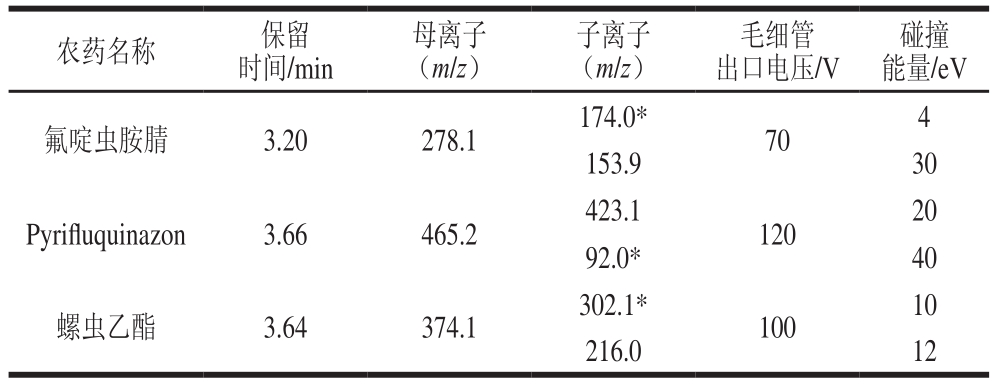
注:*.定量离子。
2 结果与分析
2.1 仪器分析参数的确定
采用1 mg/L的待测化合物的标准溶液以流动注射的方式分别用ESI正离子和负离子模式进行全扫描模式,扫描后发现氟啶虫胺腈、Pyrifluquinazon和螺虫乙酯在ESI正离子模式下响应更高,因此选择采用正离子扫描在此模式下确定了氟啶虫胺腈、Pyrifluquinazon和螺虫乙酯母离子分别为m/z 278.1、465.2和374.1。用0.1 mg/L混合标准溶液,在单离子监测分别对毛细管出口电压进行优化,从中选出丰度最高的毛细管出口电压作为最佳毛细管出口电压。然后在Product模式下,扫描确定母离子产生的响应最高的2 个子离子作为定量离子和定性离子。然后在MRM模式下,分别对不同母离子产生的子离子的碰撞能量进行优化,从中选出丰度最高的碰撞能量作为最佳碰撞能量,建立MRM模式,采集参数见表1。
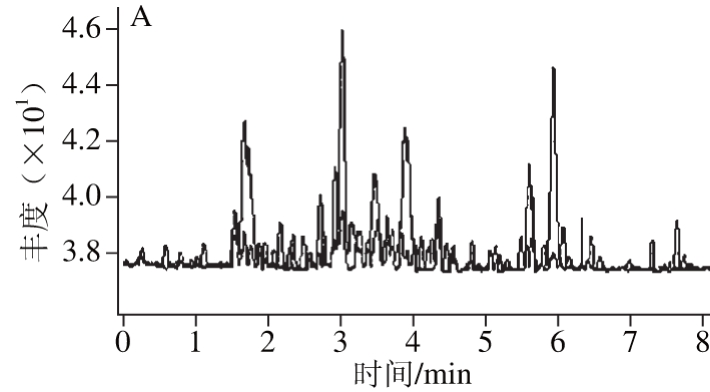

图2 3 种杀虫剂在黄瓜、苹果和洋葱混合空白样品溶液和10 μg/kg加标量条件下的MRM模式色谱图
Fig. 2 MRM chromatograms of mixed blank solution of cucumber,apple and onion and spiked mixture (10 μg/kg sulfoxaflor)
研究发现当采用甲醇作为有机流动相时,Pyrifluquinazon响应值会大大降低,因此选择使用乙腈和5 mmol/L乙酸铵溶液为分析流动相。研究发现,采用不同比例的流动相等度洗脱时,待测农药的灵敏度和重复性均不理想,因此,本研究在检测过程中采用1.3.3节色谱条件中的梯度洗脱程序对化合物进行分析。比较了几个公司生产的色谱柱,结果显示,采用Eclipse plus C18柱(100 mm×2.1 mm,1.8 μm)分析时,待测农药保留时间以及峰形均比较理想。因此,选择该柱作为分析柱。在上述优化后的色谱质谱条件下,分别对黄瓜、苹果和洋葱3 种样品混合空白溶液和添加了3 种杀虫剂的加标回收溶液进行分析,MRM色谱图见图2,样品基质不干扰3 种新型杀虫剂的定性分析。
2.2 样品前处理条件的确定
2.2.1 提取溶剂的选择
采用进行QuEChERS前处理方法时,为解决碱敏感农药(如抑菌灵、百菌清)的降解问题,采用酸化乙腈等酸性溶液来提取[24-26],本研究分别采用乙腈和1%乙酸-乙腈对含有3 种待测农药的阳性样品进行提取实验,提取的平均回收率分别为96.8%和95.4%。以PSA作为分散萃取剂,分别将乙腈提取液和1%乙酸-乙腈提取液进行固相基质分散净化,用2 种净化液分别配制同质量浓度的基质标准溶液,进样后发现,采用1%乙酸-乙腈提取获得的基质匹标准曲线响应值更低一些,这可能是因为加入乙酸等酸性溶液对PSA的净化效果产生了影响。因此,本研究确定使用乙腈对果蔬中残留的氟啶虫胺腈、Pyrifluquinazon和螺虫乙酯进行提取。
2.2.2 基质分散净化剂的选择
基质分散净化常用的净化剂有PSA、C18和Carb[27-28],各种净化剂在去除杂质的同时也可能对目标化合物产生吸附,为选择最佳的净化剂种类和用量,本研究进行了优化实验。
分别将6 mL 20 μg/L氟啶虫胺腈、2 μg/L Pyrifluquinazon和2 μg/L螺虫乙酯混合纯溶剂标准溶液和阴性黄瓜基质标准溶液,经装有不同种类净化剂的4 种QuEChERS分散固相萃取管(萃取管具体成分见1.1节)进行涡旋净化处理,处理后的回收率结果见表2。
表2 3 种杀虫剂混合标准溶液经PSA、C18和Carb吸附剂处理后的回收率
Table 2 Recoveries of 3 insecticides adsorbed by PSA, C18and Carb

由表2可看出,使用纯溶剂标准溶液进行吸附实验时,C18对Pyrifluquinazon产生了很强的吸附,Pyrifluquinazon经C18处理后,回收率仅为3.7%,但使用PSA+C18净化时,回收率反而为增大为31.8%;同时,PSA对Pyrifluquinazon和螺虫乙酯产生了较大的吸附,这2 种杀虫剂经PSA、PSA+C18和PSA+Carb处理后回收率为31.8%~69.8%;但使用黄瓜基质标准溶剂进行同样的吸附实验时,PSA和C18对这3 种杀虫剂均未产生吸附作用,这与使用纯溶剂标准溶液的实验结果很不一致,这可能是因为PSA、C18吸附剂上存在很多活性位点,这些活性位点对待测物产生了一定程度的吸附,而使用基质标准进行实验时,吸附剂上的活性位点被基质占据,对待测农药吸附作用减小。分别使用阴性苹果和洋葱基质标准溶液进行上述实验时,与黄瓜实验结果一致。同时,从表2可以看出,Carb对Pyrifluquinazon产生了较大的吸附作用。因此,本研究选择使用PSA和C18作为基质分散固相萃取剂。
表3 黄瓜、苹果和洋葱混合基质样品中3 种杀虫剂的基质效应
Table 3 Matrix effects of 3 insecticides in composite matrix of cucumber, apple and onion
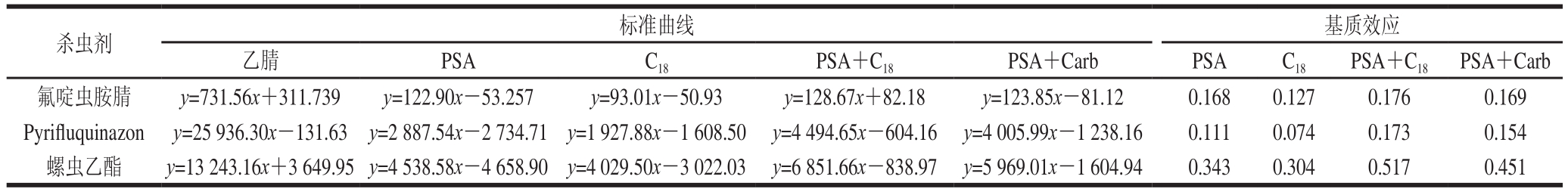
表4 黄瓜、苹果、洋葱和微波处理洋葱中3 种杀虫剂的基质效应Table 4 Matrix effects of 3 insecticides in cucumber, apple, onion and microwave processed onion

采用散装净化剂单独称量的方法进行基质分散固相萃取净化实验时发现:每毫升提取液中PSA添加量超过25 mg时,添加回收率会出现一定程度的降低;每毫升提取液中C18添加量只要不超过50 mg,都不会对这3 种新型杀虫剂产生吸附。因此,本研究选择在每毫升提取液中加入25 mg PSA和50 mg C18对果蔬中残留的3 种杀虫剂进行基质固相分散净化。
2.3 样品基质效应的考察结果
UPLC-MS/MS对化合物进行分析时,ESI容易受样品基质的影响,一般使用正离子模式进行检测时,会产生很强的基质减弱效应。取不含待测农药的黄瓜、苹果和洋葱样品,分别经乙腈提取后,以相同比例混合获得空白基质溶液,将此溶液经上述4 种基质分散固相萃取净化管(即C18、PSA、PSA+C18和PSA+Carb基质分散提取净化剂)净化处理,分别用乙腈和经上述基质分散固相萃取净化管(即C18、PSA、PSA+C18和PSA+Carb基质分散提取净化剂)处理后的混合提取净化液配制系列标准溶液,进样后得到各自的纯溶剂和基质标准曲线。基质效应=基质匹配校准曲线斜率/纯溶剂标准曲线斜率,斜率比越接近1,则基质效应越小[29-30],基质效应结果见表3。从表3可看出,3 种杀虫剂基质标准溶液的基质减弱效应均很大,螺虫乙酯受影响最小,但基质效应范围仍为0.304~0.517,使用同等量的PSA和C18净化后,PSA的基质减弱效应更小一些,使用PSA+C18作为基质分散固相萃取剂时,3 种农药的基质减弱效应均最小,应该是去除了更多的样品杂质,但即使以PSA+C18作为基质分散净化剂净化样品提取液,3 种杀虫剂的基质减弱效应仍较强。
同时,对不含待测农药的黄瓜、苹果、洋葱和经微波处理的洋葱样品经PSA+C18基质分散固相萃取处理后分析得到的相应基质效应进行了考察,结果见表4。
从表4可见,经PSA+C18净化处理后的黄瓜和苹果空白基质标准溶液中3 种杀虫剂的基质减弱效应较小;洋葱基质标准溶液的基质减弱效应特别强,其中螺虫乙酯的基质减弱效应更小一些;洋葱经微波处理后,3 种杀虫剂的基质减弱效应得到了很大改善,这应该是因为洋葱经微波处理时,微波将酶破坏,有效避免了含硫化合物的释放,减少了基质干扰,从而使基质效应降低下来。通过上述实验可知,基质效应主要受样品基质种类、农药化合物性质和净化剂种类等因素的影响,虽然采用净化效果更好的PSA+C18基质分散固相萃取剂进行净化处理,或将样品经微波处理以降低基质干扰等措施都能一定程度上降低基质减弱效应,但并不能完全消除基质效应。为保证实验结果的准确性和可靠性,本研究选择以空白样品进行上述前处理操作后获得的待检测溶液配制基质标准溶液,使标样和样品溶液具有同样的离子化条件,从而消除样品基质效应。另外,虽然葱蒜类样品使用微波处理后可降低杂质干扰,减轻基质效应,但通过微波实验发现,微波会造成螺虫乙酯的分解,因此,不适合使用微波处理进行样品前处理。
2.4 方法的线性范围
将2.2节中配制的系列标准工作溶液,在优化的色谱条件和质谱条件下进行测定,以峰面积为纵坐标(y),质量浓度为横坐标(x)绘制校准曲线,3 种杀虫剂在黄瓜、苹果、洋葱单基质溶液的线性方程见表4,在黄瓜、苹果和洋葱混合样品提取液经PSA+C18净化后的基质溶液中的线性方程见表3,拟合曲线时发现,氟啶虫胺腈在0.2~100 μg/L之间,Pyrifluquinazon在0.02~10 μg/L之间,螺虫乙酯在0.1~10 μg/L之间的范围内线性关系良好,相关系数均大于0.999 0。
2.5 方法的检出限和定量限
方法检出限以空白样品基质稀释标准曲线上的最低质量浓度出峰时,取信噪比为3和样品处理过程的稀释倍数(本方法稀释倍数为2 倍)计算得出,定量限是以空白样品基质稀释标准曲线上的最低质量浓度出峰时,取信噪比为10和样品处理过程的稀释倍数(本方法稀释倍数为2 倍)计算得出。氟啶虫胺腈、Pyrifluquinazon和螺虫乙酯在黄瓜、苹果和洋葱混合基质中的检出限分别为0.100、0.012 2 μg/kg和0.133 μg/kg,定量限分别为0.334、0.040 5 μg/kg和0.378 μg/kg。
2.6 方法的回收率和精密度
在不含氟啶虫胺腈、Pyrifluquinazon和螺虫乙酯的阴性苹果、葡萄、黄瓜和洋葱样品中添加4 个水平的混合标准溶液,待农药添加30 min后按上述处理步骤进行残留量测定,2.0 mg/kg添加量进行3 种杀虫剂残留量测定及0.1 mg/kg添加量进行Pyrifluquinazon和螺虫乙酯残留量测定前,分别用乙腈将净化定容液稀释至残留量在线性范围之内,将测定质量浓度与农药理论添加质量浓度进行比较,得到农药添加回收率,每个添加水平平行测定6 次,得其相对标准偏差,测定结果见表5。由表5可以看出,氟啶虫胺腈、Pyrifluquinazon和螺虫乙酯在苹果、葡萄、黄瓜和洋葱中添加回收率在79.9%~103.9%之间,相对标准偏差在3.3%~8.8%之间,说明本发明方法的回收率较高、重复性好。
表5 样品中氟啶虫胺腈、Pyrifluquinazon和螺虫乙酯残留量回收率和精密度实验结果
Table 5 Mean recoveries and precisions of pyrifluquinazon, sulfoxaflor and spirotetramat in samples spiked at 3 different levels

2.7 实际样品检测结果
按照本方法对菠菜、甘蓝、草莓、苹果、黄瓜、小葱等23 个农贸市场销售的蔬菜和水果进行氟啶虫胺腈、Pyrifluquinazon和螺虫乙酯检测,在1 批黄瓜中检出0.011 mg/kg氟啶虫胺腈,在另一批黄瓜中检出0.002 1 mg/kg螺虫乙酯,其余均未检出上述3 种杀虫剂。
3 结 论
本实验在优化样品前处理条件和仪器条件的基础上,建立了UPLC-MS/MS测定蔬菜和水果中氟啶虫胺腈、Pyrifluquinazon和螺虫乙酯残留量的检测方法,该方法采用优化的QuEChERS方法进行样品前处理,操作简便快捷,对能同时定性和定量的分析仪器分别建立了相应的检测方法,满足了各检测应用单位的需求,方法采用基质匹配标准溶液外标法定量,结果准确可靠,应用于实际蔬菜和水果样品中氟啶虫胺腈、Pyrifluquinazon和螺虫乙酯残留量的检测分析,取得良好效果。
参考文献:
[1] 黄庆, 欧晓明, 陈力华, 等. 气相色谱法测定柑橘与土壤中氟啶虫胺腈的残留量[J]. 光谱实验室, 2013, 30(2): 985-990. DOI:10.3969/j.issn.1004-8138.2013.02.113.
[2] 张亦冰. 新颖昆虫行为控制剂-pyrifluquinazon[J]. 世界农药, 2011,33(4): 57-58. DOI:10.3969/j.issn.1009-6485.2011.04.013.
[3] 仇是胜, 柏亚罗. 螺环季酮酸类杀虫杀螨剂的研究与开发(I)[J]. 现代农药, 2013, 12(3): 1-5; 17. DOI:10.3969/j.issn.1671-5284.2013.04.001.
[4] 刘长令. 世界农药大全: 杀虫剂卷[M]. 北京: 化学工业出版社, 2012:321-325.
[5] 武恩明, 于海波, 宋玉泉, 等. 新型杀虫剂sulfoxaflor的合成与杀虫活性[J]. 农药, 2011, 50(1): 23-25. DOI:10.3969/j.issn.1006-0413.2011.01.006.
[6] 杨吉春, 吴峤, 孙旭峰, 等. 杀虫、杀螨剂开发的新进展[J]. 农药,2012, 51(10): 704-705; 716.
[7] 陈九星, 付启明, 陈力华, 等. 氟啶虫胺腈在不同有机溶剂中的光化学降解[J]. 环境科学学报, 2012, 32(12): 3015-3020.
[8] 宋稳成, 单炜力, 简秋, 等. 国际食品法典农药残留限量标准最新动态及发展趋势[J]. 农药科学与管理, 2013, 34(1): 31-39.DOI:10.3969/j.issn.1002-5480.2013.01.011.
[9] 郑庆伟. 加拿大拟修订稀禾定、2甲4氯和螺虫乙酯的最大残留限量[J]. 农药市场信息, 2013(28): 42.
[10] 代汉慧, 陈冬东, 彭涛, 等. 韩国新修订农产品标准及浅析[J]. 农业机械, 2012(11): 30-31.
[11] 宋稳成, 单炜力, 叶纪明, 等. 国内外农药最大残留限量标准现状与发展趋势[J]. 农药学学报, 2009, 11(4): 414-420. DOI:10.3969/j.issn.1008-7303.2009.04.03.
[12] MOHAPATRA S, DEEPA M, JAGADISH G K. An efficient analytical method for analysis of spirotetramat and its metabolite spirotetramatenol by HPLC[J]. Bulletin of Environmental Contamination &Toxicology, 2012, 88(2): 124-128. DOI:10.1007/s00128-011-0494-6.
[13] ZHU Y L, LIU X G, XU J, et al. Simultaneous determination of spirotetramat and its four metabolitesin fruits and vegetables using a modified quick, easy, cheap, effective, rugged, and safe method and liquid chromatography/tandem mass spectrometry[J]. Journal of Chromatography A, 2013, 1299(14): 71-77. DOI:10.1016/j.chroma.2013.05.049.
[14] HAN Y T, XU J, DONG F S, et al. The fate of spirotetramat and its metabolite spirotetramat-enol in apple samples during apple cider processing[J]. Food Control, 2013, 34(2): 283-290. DOI:10.1016/j.foodcont.2013.05.009.
[15] 严会会, 胡斌, 刘惠民, 等. 高效液相色谱串联质谱法分析烟草中15 种农药残留[J]. 烟草化学, 2011(7): 43-47. DOI:10.3969/j.issn.1002-0861.2011.07.010.
[16] 田宏哲, 杜芳, 苑馨方, 等. 高效液相色谱法测定蔬菜中螺虫乙酯的残留[J]. 农药, 2015, 54(4): 289-291.
[17] 吴育佳, 杨仁斌, 聂红英. 螺虫乙酯在黄瓜及其土壤中残留量检测方法及残留规律研究[J]. 中国农学通报, 2015, 31(35): 110-115.
[18] 李菊颖, 吴文铸, 孔德洋, 等. 超高效液相色谱-质谱法测定柑橘和土壤中螺虫乙酯及4 种代谢产物[J]. 农药, 2016, 55(1): 45-47.
[19] XU J, DONG F S, LIU X G, et al. Determination of sulfoxaflor residues in vegetables, fruits and soil using ultra performance liquid chromatography/tandem mass spectrometry[J]. Analytical Methods,2012, 4(12): 4019-4024. DOI:10.1039/C2AY25782C.
[20] CHEN Z L, DONG F S, XU J, et al. Stereoselective determination of a novel chiral insecticide, sulfoxaflor, in brown rice, cucumber and apple by normal-phase high-performance liquid chromatography[J].Chirality, 2014, 26(2): 114-120. DOI:10.1002/chir.22278.
[21] 崔淑华. 一种Pyrifluquinazon残留量的测定方法:201410025583.3[P]. 2014-04-16.
[22] 山东出入境检验检疫局检验检疫技术. 一种Pyrifluquinazon残留量的测定方法: 201510047238.4[P]. 2015-05-06.
[23] 山东出入境检验检疫局检验检疫技术. 一种Pyrifluquinazon残留量的测定方法: 201510047494.3[P]. 2015-05-06.
[24] LEHOTAY S J. Determination of pesticide residues in nonfatty foods by supercritical fluid extraction and gas chromatography/mass spectrometry: collaborative study[J]. Journal of AOAC International,2002, 85(5): 1148-1166.
[25] LEHOTAY S J. Determination of pesticide residues in foods by acetonitrile extraction and partitioning with magnesium sulfate collaborative study[J]. Journal of AOAC International, 2007, 90(2):485-520.
[26] Standards Policy and Strategy Committes. Foods of plant origindetermination of pesticide residues using GC-MS and/or LC-MS/MS following acetonitrile extraction/partitioning and cleanup by dispersive SPE-QuEChERS-method: BS EN 15662:2008[S]. 2008.
[27] 崔淑华, 许美玲, 钱家亮, 等. 液相色谱-串联质谱法测定果蔬中4种新型卵菌纲杀菌剂残留[J]. 分析化学, 2011, 39(12): 1836-1840.DOI:10.3724/SP.J.1096.2011.01836.
[28] 郭庆龙, 崔淑华, 段浩, 等. 高效液相色谱串联质谱法测定蔬果中啶酰菌胺和环酰菌胺残留[J]. 食品科学, 2012, 33(10): 255-259.
[29] LOZANO A, RAJSKI Ł, VALLES B N, et al. Pesticide analysis in teas and chamomile by liquid chromatography and gas chromatography tandem mass spectrometry using a modified QuEChERS[J]. Journal of Chromatography A, 2012, 1304(23): 109-122. DOI:10.1016/j.chroma.2012.10.013.
[30] 王连珠, 黄小燕, 陈泳, 等. QuEChERS前处理-液相色谱-串联质谱测定果蔬中18 种弱酸性农药残留[J]. 分析测试学报, 2014, 33(10):1102-1108. DOI:10.3969/j.issn.1004-4957.2014.10.002.