近年来,随着生活节奏的加快和工作压力的增加,越来越多的人出现生理或心理疲劳,其形势不可小觑。因此,提高身体机能、促进疲劳恢复成为运动医学和军事医学争相研究的课题[1-2]。研究发现,自由基的大量产生是引起疲劳的重要原因[3]。剧烈运动能引起机体氧化-抗氧化系统失衡,自由基堆积,氧化应激增强,产生活性氧(reactive oxygen species,ROS)。当体内ROS含量过高时,机体免疫力下降,代谢水平失调,引起组织损伤和疲劳[4-6]。天然膳食多肽因其被人体吸收快、能迅速补充体内蛋白质损耗、延缓或促进疲劳恢复的特性引起研究者广泛关注。Ren Jiaoyan等[7]用草鱼蛋白质和多肽灌胃小鼠,结果显示,草鱼多肽在延长小鼠力竭游泳时间、提高肝糖原和肌糖原含量、减少体内乳酸及血清尿素氮水平等方面效果显著,提高了小鼠抗氧化防御机能,具有缓解疲劳的作用。You Lijun等[8]发现经木瓜蛋白酶水解得到的泥鳅多肽具有体外抗氧化能力,实验动物体内抗氧化酶系和乳酸脱氢酶的活力明显提高,肝糖原的储存量增加,具有抗疲劳能力。
低值海洋鱼类价格低廉、蛋白质含量高、氨基酸平衡,是完美的营养物质来源。因此,本实验研究了由碱性和中性蛋白酶分步酶解制得的低值海洋鱼低聚肽的体外抗氧化活性及体内抗疲劳作用。以谷胱甘肽为对照物,通过测定1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、羟自由基和超氧阴离子自由基清除能力以及还原力评价体外抗氧化活性。体内抗疲劳实验中,小鼠灌胃低值海洋鱼低聚肽4 周,记录力竭游泳时间,并测定与疲劳相关的生理生化指标,探讨低值海洋鱼低聚肽的抗疲劳活性,为低值海洋鱼的进一步开发利用提供数据支持。
昆明种雄性小鼠(SPF级),体质量18~22 g,由南通大学实验动物中心提供,动物许可证号:SYXK(苏)2015-0016。
脱脂海洋鱼粉(以鳀鱼为主的海产小杂鱼脱脂鱼粉)中海海洋科技有限公司;碱性蛋白酶和中性蛋白酶诺维信生物技术有限公司;西洋参粉 吉林集安市春及参茸有限公司;2,2’-偶氮二异丁基脒二盐酸盐(2,2’-azodiisobutyramidine dihydrochloride,AAPH)、DPPH 美国Sigma公司;pBR322质粒 赛默飞世尔科技有限公司;乳酸试剂盒、尿素氮试剂盒、肝糖原试剂盒、过氧化氢酶(catalase,CAT)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒及谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒南京建成生物工程研究所;其他试剂均为分析纯,购于上海国药集团。
HH-4数显恒温水浴锅 常州国华电器公司;FA604A电子天平 上海精天电子仪器厂;UV-2450紫外-可见分光光度计、CTO-20AC高效液相色谱仪 日本岛津公司;Legend Micro高速台式离心机 赛默飞世尔科技(中国)有限公司;琼脂糖凝胶电泳仪、xMark全波长酶标仪美国Bio-Rad公司;Milli-Q超纯水仪 美国Millipore公司;L-8900氨基酸自动分析仪 日本日立公司。
1.3.1 低值海洋鱼低聚肽的制备
称取脱脂鱼粉300 g,按照料液比1∶10加入去离子水,总加酶量2 500 U/g,pH 8时碱性蛋白酶酶解2 h,pH 7时中性蛋白酶酶解3 h,酶解温度50 ℃,经灭菌、离心过滤、冷冻干燥工艺制得低值海洋鱼低聚肽。
1.3.2 低值海洋鱼低聚肽氨基酸组成的测定
样品经6 mol/L HCl溶液水解22 h后,用氨基酸自动分析仪分析低值海洋鱼低聚肽氨基酸组成和质量分数。
1.3.3 低值海洋鱼低聚肽的分子质量及分布
采用凝胶过滤色谱法分析低值海洋鱼低聚肽分子质量分布[9]。色谱条件:色谱柱为TSKgel G2000SWXL(300 mm×7.8 mm,5 μm);流动相为乙腈-超纯水-三氟乙酸(体积比45∶55∶0.1);流速0.5 mL/min;柱温30 ℃;检测波长220 nm。选用细胞色素c(分子质量12 400 Da)、抑肽酶(分子质量6 512 Da)、杆菌肽(分子质量1 450 Da)、甘氨酸-甘氨酸-色氨酸-精氨酸(分子质量451 Da)和甘氨酸-甘氨酸-甘氨酸(分子质量189 Da)为标准品。
1.3.4 体外抗氧化活性的测定
DPPH自由基清除活性测定参照文献[10-11]:100 μL待测液与100 μL DPPH(体积分数95%乙醇溶液配制)溶液均匀混合,于黑暗处反应30 min,在517 nm波长处测吸光度(A1)。100 μL DPPH溶液与100 μL去离子水反应为对照组(A2),100 μL体积分数95%乙醇溶液与100 μL去离子水反应为空白组(A0)。以谷胱甘肽(glutathione,GSH)为阳性对照,DPPH自由基清除率计算公式如下。
超氧阴离子自由基、羟自由基清除能力和还原力则分别采用邻苯三酚自氧化法[12]、水杨酸法[13]和铁氰化钾法[14]测定,计算相应的半抑制浓度(half maximal inhibitory concentration,IC50),综合评价低值海洋鱼低聚肽的抗氧化活性。
1.3.5 低值海洋鱼低聚肽对AAPH诱导pBR322氧化损伤的影响
参考Harsha等[15]的研究方法,测定低值海洋鱼低聚肽对DNA氧化损伤的保护能力。对pBR322 DNA加入AAPH造成氧化损伤后,加入不同质量浓度的低值海洋鱼低聚肽于37 ℃孵育60 min,以VC为阳性对照,上样进行琼脂糖凝胶电泳,30 min后在凝胶成像分析系统中观察结果。
1.3.6 低值海洋鱼低聚肽的抗疲劳功效
1.3.6.1 动物实验条件及分组
将72 只昆明种雄性小鼠分笼,适应性饲养一周,日光灯明暗交替12 h,期间自由饮食和饮水,室温(20±2)℃,相对湿度(50±5)%。
取状态良好的健康小鼠,称体质量并随机分为5 组:空白组,阳性对照组(西洋参),低、中、高剂量组,每组12 只。低值海洋鱼低聚肽和西洋参粉在灌胃前配制成水溶液,低、中、高剂量组分别灌胃0.5、2.0、3.5 mg/(g·d mb)低值海洋鱼低聚肽,阳性对照组灌胃0.6 mg/(g·d mb)西洋参,空白组灌胃等体积的蒸馏水,每天早上9:00至10:00按剂量连续灌胃给药4 周。每次灌胃前称小鼠体质量1 次,并观察小鼠的行为特征。
1.3.6.2 力竭游泳实验
末次灌胃30 min后,在小鼠尾根部负荷5%体质量的铅丝,放于水深约40 cm、水温(25±1)℃的游泳箱中游泳。在实验过程中小鼠四肢应时刻保持运动,若小鼠漂浮不动,立即搅动附近水流迫使其不停运动。用秒表记录小鼠从游泳开始至鼻孔完全没入水中7 s无法浮出水面的时间作为小鼠力竭游泳时间[16]。
1.3.6.3 疲劳相关生化指标测定
末次灌胃30 min后,眼球取血,离心取上清液备用。将采血后的小鼠立即处死,取出肝脏,经生理盐水漂洗后用滤纸吸干,保存备用。按照试剂盒提供的方法测定乳酸、尿素氮、肝糖原含量及CAT、SOD和GSH-Px的活力[17-18]。
实验所有数据平行测定3 次,结果采用SPSS软件进行统计学处理,将不同剂量实验组分别和对照组进行独立样本t检验,P<0.05为显著性差异,P<0.01为极显著性差异,采用Excel 2007软件计算平均值及标准偏差。
氨基酸结构组成与其生物活性密切相关。人们普遍认为具有抗氧化功能的氨基酸有亮氨酸、赖氨酸、谷氨酸、缬氨酸及丙氨酸[19-21],丙氨酸、甘氨酸、缬氨酸、异亮氨酸、苏氨酸、丝氨酸和酪氨酸的含量在运动耐力测试中会迅速减少[22]。
表1 低值海洋鱼低聚肽氨基酸组成
Table1 Amino acid composition of the oliogopeptide
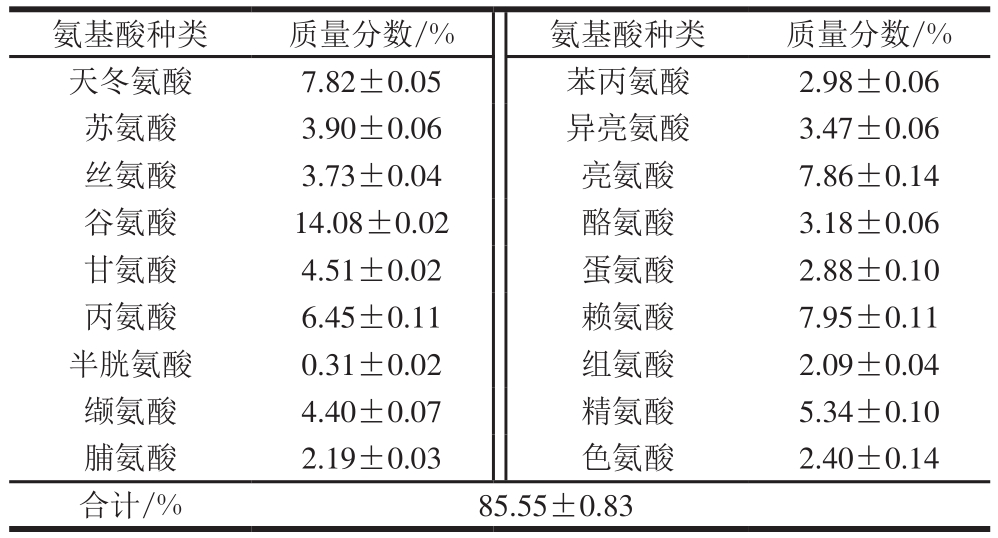
氨基酸种类 质量分数/% 氨基酸种类 质量分数/%天冬氨酸 7.82±0.05 苯丙氨酸 2.98±0.06苏氨酸 3.90±0.06 异亮氨酸 3.47±0.06丝氨酸 3.73±0.04 亮氨酸 7.86±0.14谷氨酸 14.08±0.02 酪氨酸 3.18±0.06甘氨酸 4.51±0.02 蛋氨酸 2.88±0.10丙氨酸 6.45±0.11 赖氨酸 7.95±0.11半胱氨酸 0.31±0.02 组氨酸 2.09±0.04缬氨酸 4.40±0.07 精氨酸 5.34±0.10脯氨酸 2.19±0.03 色氨酸 2.40±0.14合计/% 85.55±0.83
如表1所示,低值海洋鱼低聚肽中亮氨酸等上述5 种氨基酸质量分数为(40.74±0.45)%,丙氨酸等上述7 种氨基酸质量分数约(29.64±0.48)%,提示其摄入后能够提高运动能力。研究发现,在运动过程中谷氨酸能发挥积极作用,天冬氨酸有助于氧化脱氨、降低血液氨浓度,从而延缓疲劳的发生[23-26]。低值海洋鱼低聚肽含有(14.08±0.02)%谷氨酸和(7.82±0.05)%天冬氨酸,推测其具有一定的抗疲劳功效。
小肽能直接参与组织蛋白质合成代谢,具有吸收快、耗能低且不易饱和的特点。高强度运动下,补充小肽可以迅速为机体提供能量,补充消耗的糖原[27-28]。

图1 低值海洋鱼低聚肽凝胶过滤色谱图
Fig.1 Gel fi ltration chromatogram of the oliogopeptide
表2 低值海洋鱼低聚肽分子质量分布
Table2 Molecular mass distribution of the oliogopeptide

分子质量/Da 保留时间/min 峰面积比例/%>1 000 18.43 0.54 500~1 000 18.43~19.32 4.27 180~500 19.32~21.65 87.23<180 21.65 7.96
由图1可知,低值海洋鱼低聚肽的分子质量集中在1 000 Da以下。从表2可以看出,分子质量在180~1 000 Da的组分含量较多,峰面积占总面积的91.50%,其中二肽和三肽(180~500 Da)占87.23%,还有7.96%左右的组分为游离氨基酸和水解过度的氨基酸残基。
以GSH为阳性对照,对低值海洋鱼低聚肽超氧阴离子、DPPH和羟自由基的清除能力以及还原力多个体系进行测定,综合评价其抗氧化活性。
表3 低值海洋鱼低聚肽体外抗氧化活性
Table3 In vitro antioxidant activity of the oliogopeptide

注:还原力. A700 nm为0.5时,样品的质量浓度。
样品 IC50/(mg/mL)还原力/(mg/mL)DPPH自由基 羟自由基 超氧阴离子自由基低值海洋鱼低聚肽 4.76±0.57 5.09±0.21 5.91±0.23 1.31±0.12 GSH 1.81±0.68 5.76±0.43 2.05±0.36 0.75±0.04
从表3可知,低值海洋鱼低聚肽抑制DPPH自由基IC50为(4.76±0.57)mg/mL,高于阳性对照,表明低值海洋鱼低聚肽有DPPH自由基清除活性,但清除活性较弱。低值海洋鱼低聚肽抑制羟自由基IC50为(5.09±0.21)mg/mL,比阳性对照IC50低11.6%,说明低值海洋鱼低聚肽羟自由基清除活性较强。低值海洋鱼低聚肽的还原力、超氧阴离子自由基清除能力IC50分别为(1.31±0.12)mg/mL和(5.91±0.23)mg/mL,分别是阳性对照IC50的1.75 倍和2.88 倍,表明低值海洋鱼低聚肽有一定的还原力及抑制超氧阴离子自由基能力。
AAPH均裂分解产生的自由基能引起DNA、蛋白质等生物大分子氧化损伤,加速细胞衰老与凋亡,导致多种疾病[29-31]。

图2 AAPH对DNA氧化损伤作用
Fig.2 DNA oxidative damage induced by AAPH
如图2所示,对于未处理的pBR322质粒,电泳图谱中超螺旋DNA是优势条带,经AAPH处理后,DNA氧化断裂,超螺旋主要转化为开环态。AAPH浓度为40 mmol/L时,超螺旋DNA条带消失,浓度大于40 mmol/L时,所有形式的DNA都被降解,综合考虑,40 mmol/L为最佳损伤浓度。
如图3所示,以VC为对照,在AAPH诱导体系中,随着低值海洋鱼低聚肽质量浓度的增加,超螺旋DNA逐渐增多,质量浓度为20 mg/mL时开环DNA基本消失,完全起到保护DNA的作用。充分说明了低值海洋鱼低聚肽对DNA氧化损伤具有一定的修复作用,且质量浓度越高保护效果越好。

图3 低值鱼低聚肽对DNA氧化损伤的保护活性
Fig.3 Protective effect of the oliogopeptide on DNA oxidative damage
小鼠体质量的变化反映了低值海洋鱼低聚肽对小鼠健康状况的影响,小鼠体质量增加或减少过快,都不利于其健康。
表1 低值海洋鱼低聚肽对小鼠体质量的影响
Table1 Effect of the oliogopeptide on body mass of mice g

注:同列肩标不同小写字母表示差异显著(P<0.05)。下同。
组别 初始 第1周 第2周 第3周 第4周空白组 20.25±1.18 33.23±1.36 38.78±2.14 43.57±1.37 46.86±2.38阳性对照组 20.27±0.94 32.74±1.76 37.68±2.37 41.86±1.42 45.53±2.82低剂量组 20.25±1.23 31.66±2.12 36.99±2.46 41.74±2.05 44.89±1.95中剂量组 20.30±0.75 32.87±1.44 38.44±2.58 42.28±2.26 46.47±2.18高剂量组 20.29±1.09 33.46±2.34 39.18±2.08 43.95±2.01 47.05±1.88
表4反映了灌胃期间小鼠体质量的变化情况。初始时每组小鼠体质量相差不明显,随着灌胃时间的延长,体质量不断增加,但各组小鼠体质量每周增加幅度无显著性差异(P>0.05),其中实验组与空白组、阳性对照组相比均没有达到显著性差异(P>0.05)。观察小鼠行为特征,各组小鼠均精神状态良好,未发现异常或死亡现象,表明低聚肽并不会影响小鼠正常生长。
力竭游泳是评价抗疲劳能力的一种实验模型,它能够很好地评价小鼠的疲劳耐受能力,再现性较高[32]。
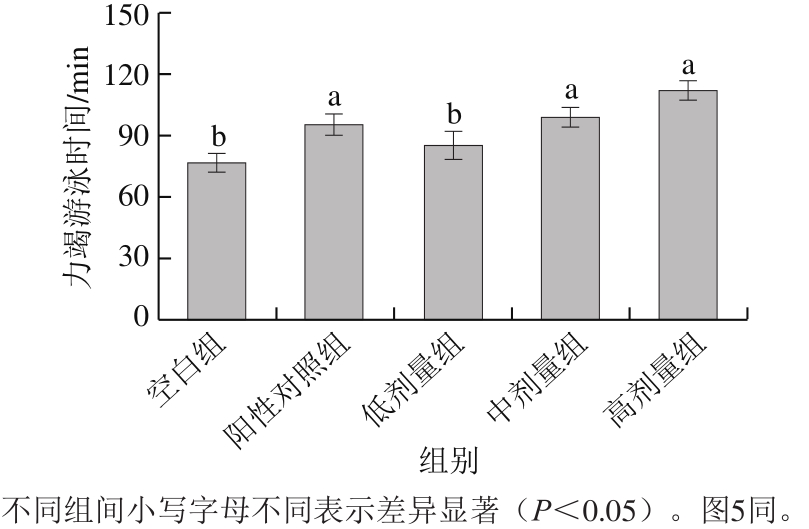
图1 低值海洋鱼低聚肽对小鼠负重力竭游泳时间的影响
Fig.1 Effect of the oliogopeptide on exhaustive swimming time of mice
由图4可知,与空白组相比,中、高剂量组均显著延长了小鼠负重力竭游泳时间(P<0.05),高剂量组力竭游泳时间为(112.16±4.55)min,为空白组的1.46 倍。说明低值海洋鱼低聚肽能延长小鼠负重力竭游泳时间,提高小鼠运动耐力,具有良好的缓解体力疲劳作用。
表5 小鼠乳酸、尿素氮和肝糖原水平的变化
Table5 Changes in lactic acid, blood urea nitrogen and glycogen contents in mice from all groups

肝糖原含量/(mg/g)空白组 12.45±1.36a 5.75±0.47a 3.64±0.42a阳性对照组 10.42±1.21b 3.34±0.55c 5.58±0.51ab低剂量组 11.28±0.88b 5.01±0.32b 6.07±0.44b中剂量组 10.84±1.29b 4.62±0.18b 6.43±0.48b高剂量组 9.86±0.99b 4.45±0.36b 6.96±0.35b组别 乳酸浓度/(mmol/L)尿素氮浓度/(mmol/L)
长时间运动使有氧肌肉活动转变为无氧代谢,糖酵解加快,乳酸大量堆积,肌肉中H+浓度升高,pH值下降,给机体带来延迟性酸痛,造成疲劳。因此,机体内乳酸含量既是引发疲劳的一个主要因素,也是评价机体有氧代谢能力和疲劳程度的敏感指标[33-34]。如表5所示,游泳30 min后,小鼠血液中高、中、低剂量组乳酸浓度分别比空白组降低了20.80%、12.93%和9.40%,且各剂量组与空白组之间达到显著性差异(P<0.05),说明低值海洋鱼低聚肽能够清除或延缓小鼠体内乳酸堆积。
血尿素是蛋白质代谢分解终产物,安静状态下其生成与排泄处于动态平衡[35-36]。剧烈运动后,机体血糖降低、糖原消耗,进一步分解蛋白质满足对能量的需求,最终导致蛋白质氧化功能比例增加。血清尿素氮是能量代谢产物,其浓度直接反映血尿素水平,是衡量机体疲劳程度的重要指标。如表5所示,高、中、低剂量组低值海洋鱼低聚肽血清尿素氮的浓度分别比空白组降低了22.61%、19.65%和9.39%(P<0.05)。说明低值海洋鱼低聚肽在一定程度上减缓小鼠运动后尿素氮浓度的升高,具有抗疲劳功效。
有氧或无氧条件下,糖原均会迅速分解产生ATP,维持机体血糖平衡。因此,糖原含量高低是机体运动耐受力的重要标志,也是测定疲劳程度的一项重要指标[37-39]。
由表5可知,低、中、高剂量组肝糖原含量分别是空白组的1.67、1.77 倍和1.91 倍(P<0.05);阳性对照组与空白组之间无显著性差异(P>0.05)。以上结果表明,低值海洋鱼低聚肽抗疲劳活性与能量代谢的激活及运动代谢的改善有关。
SOD是细胞防御氧自由基的第一道防线,能够特异性地清除超氧阴离子自由基,催化生成H2O2,保护细胞免受自由基攻击[40]。因此,提高其在机体内的活力能够加快ROS自由基的清除,缓解疲劳。
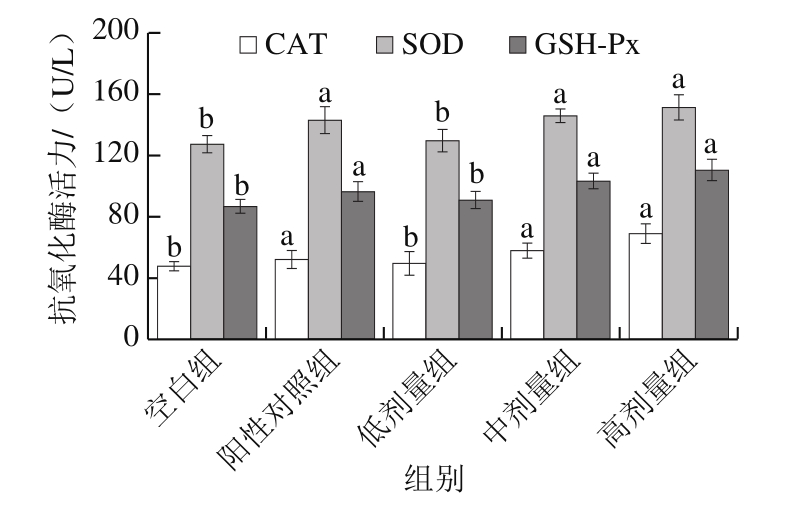
图5 低值海洋鱼低聚肽对CAT、SOD和GSH-Px活力的影响
Fig.5 Effect of the oliogopeptide on antioxidant enzyme activities in mice
如图5所示,与空白组相比,低值海洋鱼低聚肽低、中、高剂量组均使小鼠肝脏中SOD活力提高,分别提高了2.07%、14.77%和19.22%。其中,中、高剂量组与空白组相比差异显著(P<0.05);与阳性对照组相比无显著性差异(P>0.05)。
CAT可催化体内H2O2分解生成H2O和O2,GSH-Px能够阻断体内脂质过氧化,保护细胞膜结构和功能完整[41]。因此,CAT和GSH-Px含量是评价机体抗氧化能力大小的标准。从图5可以看出,低值海洋鱼低聚肽3 个剂量组CAT活力分别比空白组提高了4.80%、22.65%和45.53%,GSH-Px活力比空白组提高了4.60%、14.44%和24.84%。其中,中、高剂量组小鼠肝脏中CAT和GSH-Px活力显著高于空白组(P<0.05);低剂量组与空白组相比无显著性差异(P>0.05)。结果表明,低值海洋鱼低聚肽能提高小鼠体内抗氧化酶系的活力,清除因运动而产生的自由基,缓解疲劳。
羟自由基、超氧阴离子自由基和H2O2是生物系统中主要的ROS自由基,它们可以导致组织脂质过氧化作用加强,生物膜正常结构与功能遭到破坏,ATP合成和供给减少。有抗氧化活性的天然产物能切断或清除过氧化链式反应,减少自由基对机体的损伤,延缓疲劳。鲣鱼(Katsuwonus pelamis)暗色肉[42]、红牙䱛(Otolithes ruber)鱼肉[43]和秋刀鱼(Cololabis saira Brevoort)鱼肉[44]等多种蛋白质酶解物及其分离多肽已显示出体外抗氧化活性。体外抗氧化活性实验结果表明,低值海洋鱼低聚肽具有一定的清除DPPH自由基和超氧阴离子自由基能力及较强的羟自由基清除能力,以及一定的还原力。说明低值海洋鱼低聚肽具有减少体内氧化应激的潜力,能够抗疲劳。
机体不能持续特定水平或器官不能维持预定运动强度的生理状态即为疲劳。耐力测试是评价疲劳程度最直接、最客观的指标。ATP、糖原作为能量物质,乳酸、尿素氮作为机体代谢产物,SOD、CAT等抗氧化酶体系,其水平可作为检测是否具有抗疲劳活性的指标。低值海洋鱼低聚肽动物实验结果与王雪芹[45]研究鲐鱼抗疲劳作用相似,均延长了小鼠力竭游泳时间,降低了运动后乳酸及尿素氮的水平,消除代谢产物的累积,增加了肝糖原储备,提高了内源性抗氧化酶体系的活力。由于抗疲劳机制复杂多变,需要深入研究其构效关系,为以后开发保健食品和新药提供理论支持。
[1] LEE J S, KIM H G, HAN J M, et al. Anti-fatigue effect of Myelophil in a chronic forced exercise mouse model[J]. European Journal of Pharmacology, 2015, 764: 100-108. doi:10.1016/j.ejphar.2015.06.055.
[2] MOON P D, KIM K Y, REW K H, et al. Anti-fatigue effects of porcine placenta and its amino acids in a behavioral test on mice[J].Canadian Journal of Physiology and Pharmacology, 2014, 92(11):937-944. doi:10.1139/cjpp-2014-0068.
[3] FINAUD J, LAC G, FILAIRE E. Oxidative stress: relationship with exercise and training[J]. Sports Medicine, 2006, 36(4): 327-358.doi:10.2165/00007256-200636040-00004.
[4] ANASTASIOU D, POULOGIANNIS G, ASARA J M, et al. Inhibition of pyruvate kinase M2 by reactive oxygen species contributes to cellular antioxidant responses[J]. Science, 2011, 334: 1278-1283.doi:10.1126/science.1211485.
[5] FRANSEN M, NORDGREN M, WANG B, et al. Role of peroxisomes in ROS/RNS-metabolism: implications for human disease[J].Biochimica et Biophysica Acta, 2012, 1822(9): 1363-1373.doi:10.1016/j.bbadis.2011.12.001.
[6] KANE D A. Lactate oxidation at the mitochondria: a lactate-malateaspartate shuttle at work[J]. Frontiers in Neuroscience, 2014, 8: 366-371. doi:10.3389/fnins.2014.00366.
[7] REN Jiaoyan, ZHAO Mouming, WANG Haiyan, et al. Effects of supplementation with grass carp protein versus peptide on swimming endurance in mice[J]. Nutrition, 2011, 27(7/8): 789-795.doi:10.1016/j.nut.2010.08.020.
[8] YOU Lijun, ZHAO Mouming, REGENSTEIN J M, et al. In vitro antioxidant activity and in vivo anti-fatigue effect of loach(Misgurnus anguillicaudatus) peptides prepared by papain digestion[J]. Food Chemistry, 2011, 124(1): 188-194. doi:10.1016/j.foodchem.2010.06.007.
[9] TANG W, ZHANG H, WANG L, et al. Targeted separation of antibacterial peptide from protein hydrolysate of anchovy cooking wastewater by equilibrium dialysis[J]. Food Chemistry, 2015, 168:115-123. doi:10.1016/j.foodchem.2014.07.027.
[10] LEE J K, JI H Y, JEON J K, et al. Effect of antioxidant peptide isolated from brachionus calyciflorus[J]. Journal of the Korean Society for Applied Biological Chemistry, 2010, 53(2): 192-197.doi:10.3839/jksabc.2010.031.
[11] GU R Z, LIU W Y, LIN F, et al. Antioxidant and angiotensin I-converting enzyme inhibitory properties of oligopeptides derived from black-bone silky fowl (Gallus gallus domesticus Brisson)muscle[J]. Food Research International, 2012, 49(1): 326-333.doi:10.1016/j.foodres.2012.07.009.
[12] WANG L S, HUANG J C, CHEN Y L, et al. Identification and characterization of antioxidant peptides from enzymatic hydrolysates of duck meat[J]. Journal of Agricultural & Food Chemistry, 2015,63(13): 3437-3444. doi:10.1021/jf506120w.
[13] ZHAO Y, DU S K, WANG H, et al. In vitro antioxidant activity of extracts from common legumes[J]. Food Chemistry, 2014, 152(2):462-466. doi:10.1016/j.foodchem.2013.12.006.
[14] HE R, GIRGIH A T, MALOMO S A, et al. Antioxidant activities of enzymatic rapeseed protein hydrolysates and the membrane ultrafiltration fractions[J]. Journal of Functional Foods, 2013, 5(1):219-227. doi:10.1016/j.jff.2012.10.008.
[15] HARSHA S N, ANILAKUMAR K R. In vitro free radical scavenging and DNA damage protective property of Coriandrum sativum L.leaves extract[J]. Journal of Food Science & Technology, 2014, 51(8):1533-1539. doi:10.1007/s13197-012-0648-5.
[16] JUNG K A, HAN D, KWON E K, et al. Antifatigue effect of Rubus coreanus Miquel extract in mice[J]. Journal of Medicinal Food, 2007,10(4): 689-693. doi:10.1089/jmf.2006.006.
[17] 陈义明, 孙瑞坤, 张帅, 等. 圆鮀鲣暗色肉酶解物5 ku组分的抗氧化活性与抗疲劳作用[J]. 广东海洋大学学报, 2017, 37(4): 92-97.doi:10.3969/j.issn.1673-9159.2017.04.014.
[18] 陈慧婵, 裴斐, 杨文建, 等. 金针菇、香菇和蛹虫草对小鼠体内抗氧化酶活性的影响[J]. 食品科学, 2014, 35(1): 219-223. doi:10.7506/spkx1002-6630-201401043.
[19] LIU W, GU R, LIN F, et al. Isolation and identif i cation of antioxidative peptides from pilot-scale black-bone silky fowl (Gallus gallus domesticus Brisson) muscle oligopeptides[J]. Journal of the Science of Food and Agriculture, 2013, 93(11): 2782-2788. doi:10.1002/jsfa.6099.
[20] HE S, WANG F, NING Z, et al. Autolysis of anchovy (Engraulis japonicus) protein: evaluation of antioxidant properties and nutritional quality of resulting hydrolysates[J]. Journal of Aquatic Food Product Technology, 2015, 24(5): 417-428. doi:10.1080/10498850.2013.786773.
[21] LIN H M, DENG S G, HUANG S B, et al. Antioxidant activities of ferrous-chelating peptides isolated from fi ve types of low-value fi sh protein hydrolysates[J]. Journal of Food Biochemistry, 2015, 38(6):627-633. doi:10.1111/jfbc.12103.
[22] BAZZARRE T L, MURDOCH S D, WU S M, et al. Plasma amino acid responses of trained athletes to two successive exhaustion trials with and without interim carbohydrate feeding[J]. Journal of the American College of Nutrition, 1992, 11(5): 501-511. doi:10.1080/0 7315724.1992.10718254.
[23] 赵春光, 魏洪波, 徐庆阳, 等. 谷氨酸合成途径基因缺失对大肠杆菌发酵L-色氨酸的影响[J]. 食品与发酵工业, 2016, 42(9): 8-14.doi:10.13995/j.cnki.11-1802/ts.201609002.
[24] 李赵越, 孔海军. 谷氨酸促进运动疲劳恢复研究进展[J]. 武术研究,2017(9): 190-194. doi:10.13293/j.cnki.wskx.006731.
[25] MARQUEZI M L, ROSCHEL H A, DOS S C A, et al. Effect of aspartate and asparagine supplementation on fatigue determinants in intense exercise[J]. International Journal of Sport Nutrition & Exercise Metabolism, 2003, 13(1): 65-75. doi:10.1123/ijsnem.13.1.65.
[26] 池爱平, 张杨, 康亦姜, 等. 五味子多糖对慢性疲劳综合征大鼠治疗效果与代谢机制研究[J]. 中国药学杂志, 2017, 52(5): 391-397.doi:10.11669/cpj.2017.05.012.
[27] 章超桦, 苏阳, 曹文红, 等. 南海圆鮀鲣肌肉组织酶解产物抗疲劳活性的初步研究[J]. 食品科学技术学报, 2017, 35(1): 43-49.doi:10.3969/j.issn.2095-6002.2017.01.007.
[28] 李世成, 杨则宜. 活性肽及其在运动中的应用[J]. 中国运动医学杂志, 2003, 22(2): 174-176; 149. doi:10.16038/j.1000-6710.2003.02.015.
[29] SANTOS R X, CORREIA S C, ZHU X, et al. Mitochondrial DNA oxidative damage and repair in aging and Alzheimer’s disease[J].Antioxidants & Redox Signaling, 2013, 18(18): 2444-2457.doi:10.1089/ars.2012.5039.
[30] SAHU B D, KUNCHA M, SINDHURA G J, et al. Hesperidin attenuates cisplatin-induced acute renal injury by decreasing oxidative stress, inflammation and DNA damage[J]. Phytomedicine, 2013,20(5): 453-460. doi:10.1016/j.phymed.2012.12.001.
[31] NAKAJIMA A, MATSUDA E, MATSUDA Y, et al. Characteristics of the spin-trapping reaction of a free radical derived from AAPH: further development of the ORAC-ESR assay[J]. Analytical & Bioanalytical Chemistry, 2012, 403(7): 1961-1970. doi:10.1007/s00216-012-6021-8.
[32] ZHANG Y, YAO X, BAO B, et al. Anti-fatigue activity of a triterpenoid-rich extract from Chinese bamboo shavings (Caulis bamfusae in taeniam)[J]. Phytotherapy Research, 2006, 20(10): 872-878. doi:10.1002/ptr.1965.
[33] CAIMS S P. Lactic acid and exercise performance[J]. Sports Medicine,2006, 36(4): 279-291. doi:10.2165/00007256-200636040-00001.
[34] ZHANG W, XU J J, LI Y, et al. Anti-fatigue activity of pecan oil in mice[J]. Advanced Materials Research, 2013, 75(2): 1524-1528.doi:10.4028/www.scientif i c.net/AMR.750-752.1524.
[35] 吴海寰, 赫军, 高源, 等. 蛋白质营养水平对大鼠不同强度急性运动时蛋白质代谢的影响[J]. 实用医药杂志, 2015, 32(8): 728-731.doi:10.14172/j.cnki.issn1671-4008.2015.08.026.
[36] 黄诚胤, 潘建华, 李慧. 表没食子儿茶素没食子酸酯对小鼠运动疲劳的拮抗作用[J]. 中国应用生理学杂志, 2015, 31(1): 85-88.doi:10.13459/j.cnki.cjap.2015.01.025.
[37] 陈丽丽, 赵利, 白春清, 等. 草鱼多肽的抗氧化活性与抗疲劳作用研究[J]. 河南工业大学学报(自然科学版), 2015, 36(6): 74-82.doi:10.16433/j.cnki.issn1673-2383.2015.06.014.
[38] 殷娟娟, 曾少葵, 章超桦, 等. 罗非鱼鳞胶原多肽抗疲劳活性研究[J]. 天然产物研究与开发, 2013, 25(11): 1587-1590; 1599.doi:10.16333/j.1001-6880.2013.11.025.
[39] DING J F, LI Y Y, XU J J, et al. Study on effect of jellyf i sh collagen hydrolysate on anti-fatigue and antioxidation[J]. Food Hydrocolloid,2011, 25(5): 1350-1353. doi:10.1016/j.foodhyd.2010.12.013.
[40] ZHANG Y C, ZHANG Q, LI H, et al. Prognostic factors for late mortality after liver transplantation for benign end-stage liver disease[J]. Chinese Medical Journal, 2011, 124(24): 4229-4235.doi:10.3760/cma.j.issn.0366-6999.2011.24.020.
[41] 李旸, 张莉, 陈文帮, 等. 发酵芝麻粕小肽体内抗氧化和免疫活性[J]. 食品科学, 2014, 35(19): 251-254. doi:10.7506/spkx1002-6630-201419050.
[42] 杨龙方. 酶解鲣鱼暗色肉制备抗氧化活性肽的研究[D]. 宁波: 宁波大学, 2015: 32-42.
[43] NAZEER R A, KUMAR N S S, JAI G R. In vitro and in vivo studies on the antioxidant activity of fish peptide isolated from the croaker(Otolithes ruber) muscle protein hydrolysate[J]. Peptides, 2012, 35(2):261-268. doi:10.1016/j.peptides.2012.03.028.
[44] 刘丹. 秋刀鱼蛋白抗氧化肽的分离纯化及其抗疲劳功效研究[D]. 广州: 华南理工大学, 2015: 34-45.
[45] 王雪芹. 鲐鱼多肽的抗氧化活性与抗疲劳作用研究[D]. 北京: 中国科学院大学, 2014: 76-86.
Antioxidant and Anti-fatigue Activity of Marine Trash Fish-Derived Oligopeptide
齐斌(1965—)(ORCID: 0000-0002-2285-116X),男,教授,博士,研究方向为食品生物技术。E-mail: qibin65@126.com
张晶(1971—)(ORCID: 0000-0002-8449-6554),女,教授,博士,研究方向为中药化学。E-mail: zhjing0701@163.com
DING Shuhui, QI Manting, QI Bin, et al. Antioxidant and anti-fatigue activity of marine trash fi sh-derived oligopeptide[J]. Food Science,2019, 40(1): 155-161. (in Chinese with English abstract)doi:10.7506/spkx1002-6630-20170922-328. http://www.spkx.net.cn