咖啡原产于非洲埃塞俄比亚,从植物学上来说,是茜草科咖啡属,最早对其进行食用和栽培的是阿拉伯人[1]。国际上通常根据咖啡果实颗粒的大小,将咖啡的三大原种划分为大粒种咖啡、中粒种咖啡、小粒种咖啡[2]。中国有98%的咖啡出自云南。云南种植的主要是小粒咖啡,具有“浓而不苦、香而不烈、略带果酸味”的独特特点。云南小粒咖啡因其独特的风味而深受消费者喜爱,随着人们生活水平、健康意识的提升,云南小粒咖啡的活性成分及其生理功能也备受瞩目。然而不同烘焙度咖啡的香气和口感也不一样,一般认为烘焙程度较低时,咖啡口感较酸,烘焙程度较高,咖啡口感较苦,适合的烘焙程度,能释放出咖啡豆的最大香气。周斌等[3]的研究表明,云南小粒咖啡采用中烘焙度时口感和香气较好。
咖啡类黑精是咖啡豆在烘焙过程中,咖啡豆中的羰基和氨基化合物发生美拉德反应所形成的一类结构复杂、聚合度不等的棕褐色、大分子聚合物的混合体[4-5]。由于其结构复杂,Bekedam等[6-7]在研究咖啡类黑精分子结构时,采用美拉德反应中间体的结构性能模型系统,将咖啡类黑精分为低分子质量(<3 kDa)和高分子质量(>12 kDa)类黑精,发现低分子质量类黑精中含有咖啡因、绿原酸和一些含氮小分子物质,高分子质量类黑精中含有阿拉伯半乳聚糖、酚基、蛋白质等物质。在功能研究中,通常使用<10 kDa滤膜超滤分离类黑精来研究其功能,发现分子质量<10 kDa咖啡类黑精具有抗氧化、降血压、抗菌活性、改善肠道微环境和结合风味物质等功能[8-12]。分子质量>10 kDa的类黑精抗氧化功能尚未受到关注。目前,国内关于云南小粒咖啡多为其咖啡因、绿原酸、葫芦巴碱等生物活性物质功能的研究;烘焙条件、萃取方法对咖啡豆挥发性成分分析;烘焙条件、种植环境对云南小粒咖啡感官、品质的影响,针对云南小粒咖啡类黑精生理功能的报道较少。为研究云南小粒咖啡类黑精减肥降脂功能及不同分子质量产物抗氧化能力差异,本实验通过提取云南小粒咖啡类黑精及不同分子质量产物(<10、10~100、>100 kDa),用羟自由基、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除力和总还原力来评价类黑精及分级产物抗氧化能力差异;运用大鼠构建肥胖模型,研究类黑精的减肥降脂功能,以期为云南小粒咖啡产品及功能食品开发提供科学依据。
选用清洁级雄性SD大鼠70 只,体质量(260±20)g,购自昆明医科大学实验动物中心,生产许可证号:SCXK(滇)2015-0002。基础词料:从昆明医科大学实验动物中心购置,依照GB 14924.3—2010 《实验动物 配合饲料营养成分》[13]配制,每1 kg基础饲料主要含碳水化合物550 g、脂肪50 g、灰分70 g、蛋白质220 g、纤维素50 g。高热量饲料为实验室配制,参照“国食药监保化[2012]107号”附件8《减肥功能评价方法》高热量模型饲料配方,每5 kg高热量饲料按基础词料3.5 kg、蔗糖0.75 kg、猪油0.75 kg配比制成,烘干待用。
中烘焙度的云南小粒咖啡豆,均从云南本土市场购买。
二氯甲烷、抗坏血酸、无水乙醇、水杨酸、硫酸亚铁、铁氰化钾、乙醚、甲醛、二甲苯、无水硫酸钠、DPPH 美国Sigma公司。
722分光光度计、CT14D11台式高速离心机、732型紫外分光光度计、全自动样品快速研磨仪、冷冻干燥机 美国Labconco公司;Minimate切向流超滤系统美国颇尔公司;415R高速冷冻离心机 德国Eppendorf公司;Cobas c 311全自动生化分析仪 德国罗氏诊断有限公司;RM2235切片机、ASP300S脱水机、DM750显微镜德国LEICA公司。
1.3.1 咖啡类黑精的提取分离及纯化
提取参考Bekedam等[14]的方法并加以改进,称取中烘焙度的云南小粒咖啡豆100 g,用粉碎机粉碎至粒径0.2~0.4 mm颗粒,备用。将研磨好的咖啡粉30 g添加到90 ℃的180 g去离子水中,并在90 ℃水浴中连续搅拌15 min,冷却后用布氏漏斗过滤,滤液用二氯甲烷脱脂,于40 ℃水浴锅中去除二氯甲烷后,将样品预冻后用冷冻干燥机制成冻干样品并称其质量,过滤后的咖啡渣重复上述操作3 次。
将中烘焙度的云南小粒咖啡类黑精样品(M总)配制成2 g/100 mL的溶液,用0.2 μm的滤膜片过滤后,分别用100、10 kDa的滤膜分级截留得到截留液和滤出液[15],滤出液重复超滤4 次,每次吸取截留液后用10 mL去离子水洗滤3 次,以减少样品残留,将最终收集的截留液和滤出液预冻后冷冻干燥,分别得到分子质量为>100、10~100、<10 kDa的咖啡类黑精M1、M2、M3。
以二氯甲烷为溶剂,用索氏提取器进行纯化,脱除类黑精样品中的咖啡因[16]。将提取的中烘焙度云南小粒咖啡类黑精样品放入索氏提取器的滤纸筒中,加入30 mL二氯甲烷,再向圆底烧瓶中加入80 mL二氯甲烷,42 ℃水浴加热回流提取8 h,随后更换新的二氯甲烷80 mL,再继续抽提,当滤纸筒边缘不析出白色晶体时,结束回流提取,挥发干类黑精样品中的二氯甲烷,待用。
1.3.2 清除DPPH自由基能力测定
参考其他物质DPPH自由基清除力测定方法[17-21],精密称取DPPH 78.9 mg,用无水乙醇定容至50 mL,摇匀后得到浓度为4 mmol/L的DPPH母液。使用时将DPPH母液用无水乙醇稀释,工作液浓度为0.1 mmol/L。将不同分子质量样品用无水乙醇稀释为质量浓度分别为0.2、0.4、0.6、0.8、1.0 g/L的溶液,取不同质量浓度样品溶液2 mL,于EP管中进行以下3 组反应:2 mL无水乙醇与2 mL DPPH溶液混合;2 mL样品溶液与2 mL DPPH溶液混合;2 mL样品溶液与2 mL无水乙醇混合。分别摇匀,避光反应30 min。使用紫外-可见分光光度计在517 nm波长处测量各体系吸光度[17-21]。实验平行进行3 次,取平均值,根据式(1)计算DPPH自由基清除率。
式中:A0为2 mL乙醇与2 mL DPPH溶液的吸光度;A1为2 mL样品溶液与2 mL DPPH溶液的吸光度;A2为2 mL样品溶液与2 mL无水乙醇的吸光度。
1.3.3 清除羟自由基能力测定
参考其他物质羟自由基清除能力测定方法[22-27],将不同分子质量样品用蒸馏水溶解,配制成质量浓度分别为1.0、2.0、3.0、4.0、5.0 g/L的溶液,取5 支试管,依次标记为1~5,各试管中分别加入不同质量浓度样液2 mL,再按顺序依次加入9 mmol/L水杨酸-乙醇溶液2 mL、9 mmol/L FeSO4溶液2 mL,最后加入8.8 mmol/L H2O2溶液2 mL启动反应,室温反应1 h后,在510 nm波长处测定各待测液的吸光度AX,以蒸馏水为空白对照A0,考虑到样品本身的吸光度,另取5 支试管,各试管中分别加入不同质量浓度样液2 mL、9 mmol/L水杨酸-乙醇溶液2 mL、9 mmol/L FeSO4溶液2 mL,最后以2 mL去离子水代替8.8 mmol/L H2O2溶液,为类黑精的本底吸光度AX0,根据式(2)计算羟自由基清除率。
式中:A0为空白对照液的吸光度;AX为加入类黑精后的吸光度;AX0为不加H2O2的类黑精溶液本底吸光度。
1.3.4 总还原力测定
参考Benjakul等[28]的方法,采用铁氰化钾法测定总还原力。取不同质量浓度(0.2、0.4、0.6、0.8、1.0 g/L)溶液2.5 mL于离心管中,再依次加入2.5 mL 0.2 mol/L pH 6.6磷酸盐缓冲液、2.5 mL质量分数1%铁氰化钾溶液,混匀后于50 ℃水浴中反应20 min,取出后立即用冷水冷却,并加入2.5 mL质量分数10%三氯乙酸溶液,混匀后于5 000 r/min离心10 min。取2.5 mL上清液,加入2.5 mL蒸馏水和0.5 mL质量分数0.1% FeCl3溶液,混匀室温静置10 min,700 nm波长处测定其吸光度[29],吸光度越高表示样品的还原力越强。
1.3.5 咖啡类黑精对肥胖大鼠的减肥作用
1.3.5.1 实验动物造模
选取精神状态良好、无异常的70 只SD大鼠进入动物房,饲养环境:温度20~25 ℃,相对湿度40%~65%及光照12 h/d,基础饲料适应性饲养7 d,适应期结束后称其体质量,参照“国食药监保化[2012]107号”附件8《减肥功能评价方法》,按照大鼠体质量,将其随机分成2 组,其中10 只大鼠作为空白对照组给予基础饲料,60 只大鼠作为模型组给予高热量饲料。实验过程中,每周记录给食量、撒食量、剩食量,称量体质量1 次。喂养2 周后,给予高热量饲料的60 只大鼠按体质量增量排序,淘汰1/3体质量增量较低的大鼠,对组内余下的40 只大鼠继续饲喂高热量饲料。饲喂6 周后,测量体质量进行统计分析,模型组的大鼠体质量超过空白对照组大鼠体质量20%,空白对照组体质量和增质量与模型组相比较,差异均有统计学意义(P<0.05),肥胖模型成功。
1.3.5.2 实验动物的分组及受试样品的给予
造模成功后将40 只肥胖大鼠依据体质量按照随机区组法分成4 组,分别是模型组和低、中、高3 个剂量处理组,各组间大鼠的体质量差异无统计学意义(P>0.05)。模型对照组和3 个剂量处理组给予高热量饲料,空白对照组给予基础饲料。中度烘焙的云南小粒咖啡类黑精剂量按人均体质量(60 kg)、每天饮用纯咖啡30 g、中度焙烤咖啡中热水提取类黑精占咖啡干物质的24%计算。中度烘焙的云南小粒咖啡类黑精摄入量为120 mg/(kg·d mb),以人体摄入量的5 倍(0.6 g/(kg·d mb))、10 倍(1.2 g/(kg·d mb))、30 倍(3.6 g/(kg·d mb))剂量进行灌胃(0.5 mL/100 g),通过计算得到低、中、高3 个剂量处理组样品质量浓度分别为12、24、72 g/100 mL,配制后当天使用。
空白对照组和模型组给予生理盐水,灌胃剂量为0.5 mL/100 g。受试样品给予时间6 周,每周记录给食量、撒食量、剩食量,并称量体质量1 次。
实验结束时禁食不禁水16 h,称体质量,乙醚麻醉,股动脉采血,采血后尽快分离血清,测定血清总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白-胆固醇(low density lipoproteincholesterol,LDL-C)、高密度脂蛋白-胆固醇(high density lipoprotein-cholesterol,HDL-C)的水平[30]。解剖大鼠,取腹腔脂肪及各脏器并称质量,计算脂体比。大鼠肝脏、腹腔脂肪用体积分数10%甲醛溶液固定[31-32]。
1.3.5.3 观察指标及测定
体质量:每周测定1 次,反映中度烘焙的云南小粒咖啡类黑精减肥效果。
Lee’s指数测定[31]:实验终点处死前在麻醉状态下准确测量体长(鼻尖至肛门外沿的距离),按式(3)计算肥胖指数(即Lee’s指数)。
脂体比:实验终点在麻醉下立即剖腹取大鼠体脂并称质量。脂体比按式(4)计算。
生化指标:实验结束时,各组大鼠禁食16 h后取血分离血清(血液静置30 min,3 000 r/min离心15 min,取上清液),用全自动生化分析仪测定血清TC、TG、LDL-C、HDL-C水平[30-31]。
脂肪组织病理形态学观察[32]:取腹腔同一部位脂肪一块,用体积分数10%甲醛溶液固定,固定完全后,用石蜡包埋切片,苏木精-伊红(hematoxylin-eosin,HE)染色,得到脂肪组织石蜡切片,观察脂肪组织细胞形态学,盲法阅片,文件编号同病理切片编号。
肝脏病理形态学观察[32]:取大鼠肝脏同一叶,用体积分数10%甲醛溶液固定,固定完全后,用石蜡包埋切片,HE染色,得到脂肪组织石蜡切片,观察肝脏组织细胞形态学,盲法阅片,观察肝细胞形态,文件编号同病理切片编号。
用Excel 2010和SPSS 22.0软件对实验数据进行处理和分析,实验数据用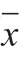 ±s表示,采用单因素方差分析对各组间差异进行比较,各组间的多重比较采用最小显著性差异(least signi fi cant difference,LSD)法。
±s表示,采用单因素方差分析对各组间差异进行比较,各组间的多重比较采用最小显著性差异(least signi fi cant difference,LSD)法。
减肥结果判定:实验组的体质量或体质量增加量低于模型对照组,体脂质量或脂体比低于模型对照组,差异有显著性,可判定该受试样品动物减肥功能实验结果阳性。
2.1.1 咖啡类黑精对DPPH自由基的清除作用

图1 中烘焙度咖啡类黑精及其分级产物对DPPH自由基清除能力
Fig.1 DPPH radical scavenging capacity of total melanoidins and fractions
如图1所示,云南小粒咖啡类黑精中分子质量<10 kDa(M3)对DPPH自由基的清除效果与未分离的云南小粒咖啡类黑精(M总)对DPPH自由基的清除效果最为相近,均呈现较强的清除能力,云南小粒咖啡类黑精中分子质量>100 kDa(M1)对DPPH自由基的清除效果较M总、M2、M3弱。总体来看,质量浓度在0.4~0.8 g/L时,DPPH自由基清除率随质量浓度增加而增加,而0.8~1.0 g/L其清除率呈下降趋势。研究报道,小分子类黑精产物呈现较强清除DPPH自由基能力,可能是因为美拉德反应中形成的色素类物质提供氢与DPPH反应,还可能因为这些小分子化合物以非共价键的形式连接在类黑精骨架上,分级之后小分子物质解离出来暴露更多的羟基,使得清除DPPH的能力增强[18]。本研究发现云南小粒咖啡小分子质量类黑精呈现较强的清除DPPH能力,同时发现未分级类黑精及分子质量为10~100 kDa的类黑精均呈现较强清除DPPH自由基能力,具体机制有待进一步研究。
2.1.2 咖啡类黑精对羟自由基的清除能力

图2 中烘焙度咖啡类黑精及其分级产物对羟自由基清除能力
Fig.2 Hydroxyl radical scavenging capacity of total melanoidins and fractions
如图2所示,可知云南小粒咖啡类黑精中分子质量<10 kDa(M3)对羟自由基的清除效果与未分离的咖啡类黑精对羟自由基的清除效果最为相近,云南小粒咖啡类黑精中分子质量>100 kDa(M1)对羟自由基的清除能力较M2、M3弱。未分离类黑精及分子质量为10~100 kDa和<10 kDa的类黑精对羟自由基的清除能力随质量浓度的增加而增强,其质量浓度在1.0~4.0 g/L内呈线性增强。Delgado-Andrade等[33]在咖啡类黑精抗氧化研究中发现,咖啡类黑精骨架上小分子复合物的抗氧化性更强。本研究发现除分子质量>100 kDa的类黑精以外,其他类黑精及其分级产物均有较强清除羟自由基的能力。提示对于云南小粒咖啡,类黑精分子质量<100 kDa的产品及功能食品也可以作为未来开发的关注点。
2.1.3 咖啡类黑精不同分子质量的总还原力
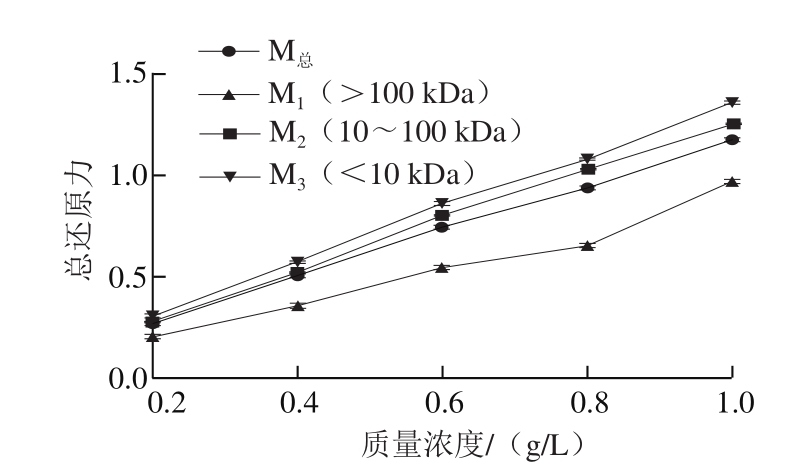
图3 中烘焙度咖啡类黑精及其分级产物的总还原力
Fig.3 Reducing power of total melanoidins and fractions
如图3所示,云南小粒咖啡类黑精各分子质量的吸光度随着样品质量浓度的增加而逐渐增大,表明其还原力逐渐增强。M3、M2还原力增长趋势与M总一致,在质量浓度0.4~1.0 g/L时其还原力为M3>M2>M总>M1。王忠合等[18]的研究表明,分子质量>10 kDa类黑精还原力较强,本研究中发现云南小粒咖啡类黑精及分级产物均呈现较强还原力,主要可能与类黑精能够络合亚铁离子有关。
2.2.1 云南小粒咖啡类黑精对SD大鼠体质量的影响
表1 云南小粒咖啡类黑精对SD大鼠体质量的影响
Table1 Effect of total melanoidins on body mass of SD rats g

注:*.与空白对照组相比,差异显著(P<0.05);#.与模型组相比,差异显著(P<0.05)。下同。
组别 初始体质量 造模结束体质量 实验终体质量空白对照组 343.33±14.78 413.33±27.69 437.14±33.82模型组 352.10±12.40 497.01±46.46* 522.81±44.40*低剂量处理组 349.02±20.00 492.10±30.81* 483.70±32.62*#中剂量处理组 357.65±19.84 499.32±16.72* 468.19±16.75#高剂量处理组 349.01±13.96 502.29±42.41* 454.30±43.71#
由表1可知,各组初始体质量无统计学差异(F=1.003,P>0.05)。饲喂高热量饲料建立肥胖模型,造模结束时,空白对照组与所有饲喂高热量饲料的组的体质量有统计学差异(F=12.069,P<0.01),模型组体质量超过空白对照组体质量的20%,且模型组与空白对照组体质量相比,差异有统计学意义(P<0.01),肥胖模型建立成功。
将造模成功的大鼠按体质量分为模型组、低剂量处理组、中剂量处理组和高剂量处理组,各组体质量无统计学差异(F=0.143,P>0.05)。实验结束时,低、中、高剂量处理组的体质量与模型组相比,差异有统计学意义(P<0.05);低剂量处理组、模型组体质量与空白对照组相比,差异有统计学意义(P<0.05),中、高剂量处理组体质量与空白对照组相比,差异无统计学意义(P>0.05),表明云南小粒咖啡类黑精有控制肥胖大鼠体质量的作用。研究发现类黑精具有类膳食纤维功能,其发挥减肥作用可能因为类黑精在肠道中不被消化吸收,能够促进肠蠕动,缩短食物在肠道中的驻留时间,发挥类膳食纤维功能[34]。云南小粒咖啡类黑精发挥减肥功能的机制应该与此相似。
2.2.2 云南小粒咖啡类黑精对SD大鼠Lee’s指数、体脂质量及脂体比的影响
表2 云南小粒咖啡类黑精对SD大鼠Lee’s指数、体脂质量及脂体比的影响
Table2 Effect of total melanoidins on Lee’s index, body fat content and body fat ratio of SD rats
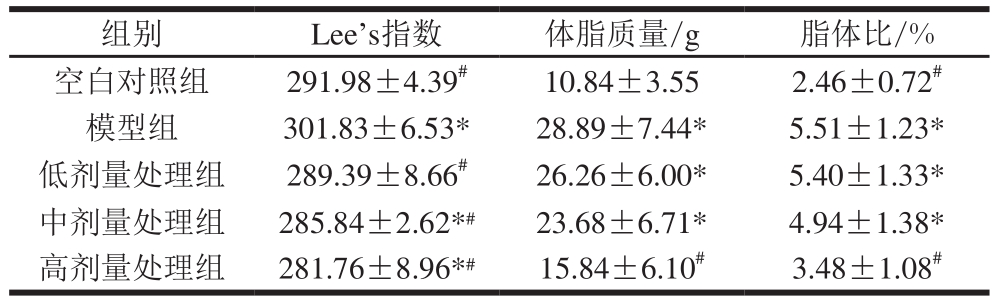
组别 Lee’s指数 体脂质量/g 脂体比/%空白对照组 291.98±4.39# 10.84±3.55 2.46±0.72#模型组 301.83±6.53* 28.89±7.44* 5.51±1.23*低剂量处理组 289.39±8.66# 26.26±6.00* 5.40±1.33*中剂量处理组 285.84±2.62*# 23.68±6.71* 4.94±1.38*高剂量处理组 281.76±8.96*# 15.84±6.10# 3.48±1.08#
由表2可知,模型组与空白对照组Lee’s指数、体脂质量和脂体比之间均有统计学差异(P<0.05)。空白对照组、低、中、高剂量处理组Lee’s指数与模型组相比,差异具有统计学意义(P<0.05)。
在体脂质量方面,模型组、低、中剂量处理组与空白对照组相比,有统计学差异(P<0.05),高剂量处理组与模型组相比,差异有统计学意义(P<0.05),低、中剂量处理组与模型组相比,差异无统计学意义(P>0.05),但体脂质量有下降的趋势。
在脂体比方面,模型组、低、中剂量处理组与空白对照组相比,差异有统计学意义(P<0.05)。高剂量处理组与模型组相比,差异有统计学意义(P<0.05)。结果表明,云南小粒咖啡类黑精能减少体脂含量,可推测云南小粒咖啡类黑精能促进脂肪代谢,减少脂肪堆积。
2.2.3 云南小粒咖啡类黑精对SD大鼠血脂水平的影响
由表3可知,各组间TC、TG、LDL-C浓度差异没有统计学意义(P>0.05),但高剂量处理组的TC、TG浓度均比模型组低。高剂量处理组的HDL-C水平比模型组水平高,且差异有统计学意义(P<0.05),表明高剂量处理组云南小粒咖啡类黑精具有提升大鼠血清HDL-C水平的作用。
表3 中烘焙度的云南小粒咖啡类黑精对SD大鼠血脂水平的影响
Table3 Effect of total melanoidins on blood lipid levels of SD rats mmol/L
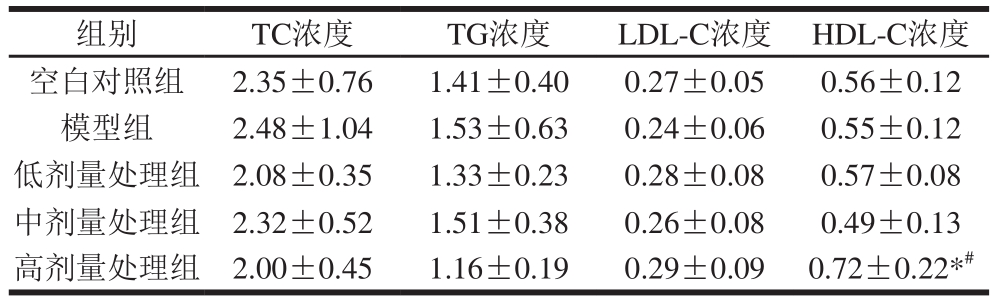
组别 TC浓度 TG浓度 LDL-C浓度 HDL-C浓度空白对照组 2.35±0.76 1.41±0.40 0.27±0.05 0.56±0.12模型组 2.48±1.04 1.53±0.63 0.24±0.06 0.55±0.12低剂量处理组 2.08±0.35 1.33±0.23 0.28±0.08 0.57±0.08中剂量处理组 2.32±0.52 1.51±0.38 0.26±0.08 0.49±0.13高剂量处理组 2.00±0.45 1.16±0.19 0.29±0.09 0.72±0.22*#
2.2.4 云南小粒咖啡类黑精对SD大鼠组织形态的影响
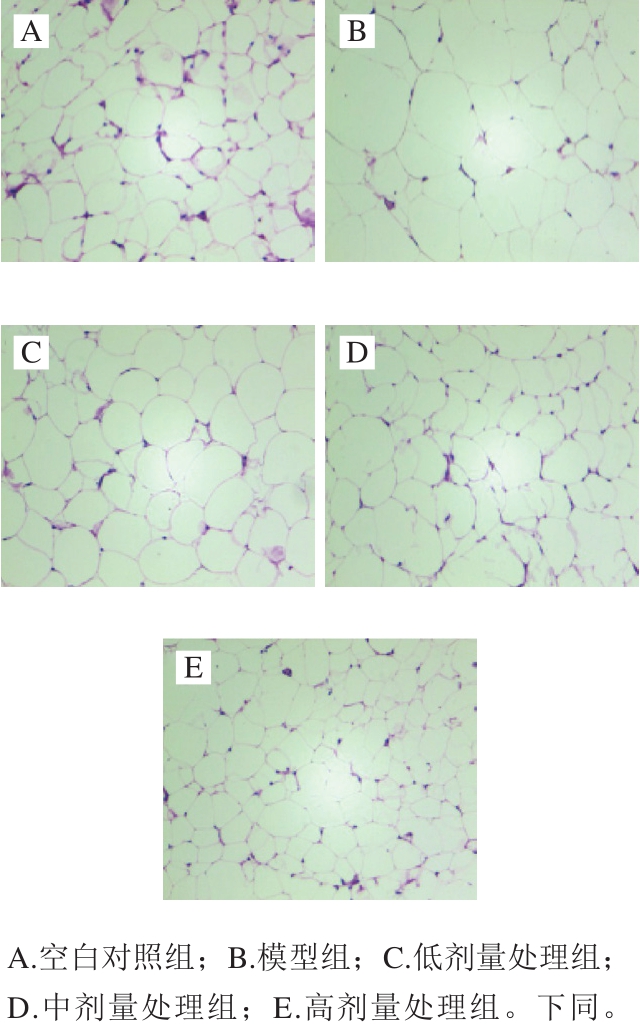
图1 SD大鼠脂肪组织形态图(100×)
Fig.1 Morphology of adipose tissue in SD rats (100 ×)
从脂肪组织切片图可见,模型组大鼠脂肪细胞膨大,细胞中脂肪充盈,单位视野细胞数目较少,细胞间质被脂肪挤压变薄(图4B)。受试物低(图4C)、中(图4D)、高(图4E)剂量处理组大鼠脂肪细胞均有所减小,且排列均匀、结构完整,细胞间隙小动脉清晰可见,与空白对照组(图4A)的相似,3 个剂量处理组相比,高剂量处理组大鼠脂肪细胞较小,形态与空白对照组的更接近,表明云南小粒咖啡类黑精能抑制脂肪细胞的膨大,减少脂肪的堆积,且高剂量处理组的效果最明显。

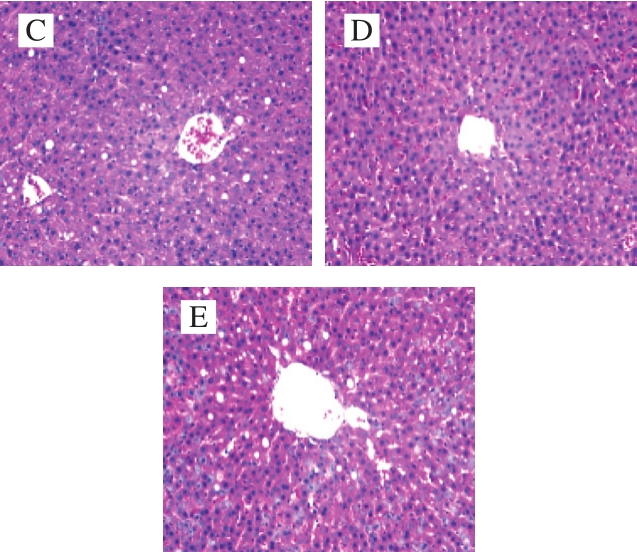
图5 SD大鼠肝脏组织形态图(40×)
Fig.5 Liver histomorphology in SD rats (40 ×)
从肝脏组织切片图可以见,空白对照组的肝小叶结构清晰,中央静脉清楚,肝细胞索呈放射状排列,肝窦正常、肝细胞大小一致、细胞核清晰、胞浆均匀(图5A);而模型组的肝细胞正常组织结构消失,肝窦缩小甚至消失,细胞边界模糊,肝索排列杂乱,较大面积肝细胞出现肿胀,部分胞浆呈空泡样(图5B);其余各实验组,细胞边界较明显,空泡面积较少,低剂量处理组(图5C)与空白对照组相比肝索排列杂乱,肝细胞面积大小相似;中剂量处理组(图5D)和高剂量处理组(图5E)的形态与空白对照组的相似。表明云南小粒咖啡类黑精对实验大鼠肝脏有较好的保护作用,中剂量处理组和高剂量处理组均有不错的效果。有研究表明类黑精中的多酚和绿原酸等物质,能够调节胰岛素敏感性和其他代谢在肝上的转录水平,通过诱导脂肪酸的分解代谢,来防止脂肪沉积和肝脏损伤[35-36]。Cho等[37]报道,类黑精中的绿原酸能够增强脂肪酸β-氧化活性促进脂肪分解。云南小粒咖啡类黑精中也存在促进脂肪酸代谢和保护肝损伤的物质,与Vitaglione等[32]的研究结果一致。
云南小粒咖啡类黑精及不同分子质量产物均有一定清除DPPH自由基和羟自由基的能力。在相同质量浓度下,对DPPH自由基的清除能力由高到低依次为:M总>M3>M2>M1,对羟自由基的清除能力由高到低依次为:M总>M3>M2>M1。采用铁氰化钾测定类黑精及不同分子质量产物的总还原力,结果表明,M总、M1、M2、M3均具备良好的抗氧化活性,总还原力由高到低依次为:M3>M2>M总>M1。
肥胖模型建立成功后,对肥胖大鼠给予受试样品,结果显示:1)云南小粒咖啡类黑精具有一定的减肥作用,能抑制大鼠体质量的增加及减少肥胖大鼠体脂含量;2)高剂量处理组云南小粒咖啡类黑精能够提高大鼠HDL-C水平,对HDL-C有较好的保护作用;3)中剂量处理组和高剂量处理组云南小粒咖啡类黑精对实验大鼠的肝脏有较好的保护作用,能促进脂肪代谢,能较好地改善肝内脂肪堆积的症状。
[1] 张箭. 咖啡的起源、发展、传播及饮料文化初探[J]. 中国农史,2006, 25(2): 22-29. doi:10.3969/j.issn.1000-4459.2006.02.003.
[2] 黄家雄, 李亚男, 杨世贵, 等. 不同产地小粒种咖啡质量比较研究[J].热带农业工程, 2010, 34(4): 7-10.
[3] 周斌, 任洪涛. 烘焙程度对云南小粒咖啡香气品质的影响[J].食品研究与开发, 2014, 35(22): 68-73. doi:10.3969/j.issn.1005-6521.2014.22.020.
[4] 刘亚玲, 谭超, 龚加顺. 云南不同地区烘焙咖啡豆主要成分分析及类黑精组成成分[J]. 食品科学, 2017, 38(2): 176-183. doi:10.7506/spkx1002-6630-201702029.
[5] WANG H Y, HE Q, YAO W R. Melanoidins produced by the Maillard reaction: structure and biological activity[J]. Food Chemistry, 2011,128(3): 573-584. doi:10.1016/j.foodchem.2011.03.075.
[6] BEKEDAM E K, SCHOLS H A, VAN BOEKEL M A, et al.High molecular weight melanoidins from coffee brew[J]. Journal of Agricultural and Food Chemistry, 2006, 54(20): 7658-7666.doi:10.1021/jf0615449.
[7] BEKEDAM E K, ROOS E, SCHOLS H A, et al. Low molecular weight melanoidins in coffee brew[J]. Journal of Agricultural and Food Chemistry, 2008, 56(11): 4060-4067. doi:10.1021/jf8001894.
[8] CÄMMERER B, KROH L W. Antioxidant activity of coffee brews[J].European Food Research and Technology, 2006, 223(4): 469-474.doi:10.1007/s00217-005-0226-4.
[9] GOYA L, DELGADO-ANDRADE C, RUFIÁN-HENARES J A, et al. Effect of coffee melanoidin on human hepatoma HepG2 cells. protection against oxidative stress induced by tertbutylhydroperoxide[J]. Molecular Nutrition & Food Research, 2007,51(5): 536-545. doi:10.1002/mnfr.200600228.
[10] RUFIÁN-HENARES J A, DE LA CUEVA S P. Antimicrobial activity of coffee melanoidins: a study of their metal-chelating properties[J].Journal of Agricultural and Food Chemistry, 2009, 57(2): 432-438.doi:10.1021/jf8027842.
[11] RUFIÁN-HENARES J A, MORALES F J. Angiotensin-I converting enzyme inhibitory activity of coffe melanoidins[J]. Journal of Agricultural and Food Chemistry, 2007, 55(4): 1480-1485.doi:10.1021/jf062604d.
[12] MOREIRA A S, NUNES F M, DOMINGUES M R, et al. Coffee melanoidins: structures, mechanisms of formation and potential health impacts[J]. Food & Function, 2012, 3(9): 903-915. doi:10.1039/C2FO30048F.
[13] 国家质量监督检验检疫总局. 实验动物 配合饲料营养成分:GB 14924.3—2010[S]. 北京: 中国标准出版社, 2011.
[14] BEKEDAM E K, LOOTS M J, SCHOLS H A, et al. Roasting effects on formation mechanisms of coffee brew melanoidins[J]. Journal of Agricultural and Food Chemistry, 2008, 56(16): 7138-7145.doi:10.1021/jf800999a.
[15] GNIECHWITZ D, REICHARDT N, RALPH J, et al. Isolation and characterisation of a coffee melanoidin fraction[J]. Journal of the Science of Food and Agriculture, 2008, 88(12): 2153-2160.doi:10.1002/jsfa.3327.
[16] 吕昱, 严敏, 刘乾坤. 液相色谱法分析茶叶中咖啡因的含量[J]. 科技创新与应用, 2013(24): 11-12.
[17] MOHSEN S M, AMMAR A S M. Total phenolic contents and antioxidant activity of corn tassel extracts[J]. Food Chemistry, 2009,112(3): 595-598. doi:10.1016/j.foodchem.2008.06.014.
[18] 王忠合, 王军, 胡慧娟. 模式类黑精及其分级产物清除自由基能力、抗氧化性及还原力分析[J]. 食品与发酵工业, 2016, 42(1): 92-96.
[19] 杨虎, 张生堂, 高国强. 玫瑰黄酮的提取及其清除DPPH自由基活性研究[J]. 食品科学, 2012, 33(24): 152-155. doi:10.7506/spkx1002-6630-201224031.
[20] 李铉军, 崔胜云. 抗坏血酸清除DPPH自由基的作用机理[J]. 食品科学, 2011, 32(1): 86-90.
[21] 张晓璐, 徐凯宏. 山楂叶总黄酮清除DPPH和超氧阴离子自由基的活性研究[J]. 林业科技, 2008, 33(5): 51-54. doi:10.3969/j.issn.1001-9499.2008.05.018.
[22] 周向军, 高义霞, 袁毅君, 等. 乌龙茶茶褐素提取工艺的优化及抗氧化研究[J]. 中国实验方剂学杂志, 2011, 17(4): 36-40. doi:10.3969/j.issn.1005-9903.2011.04.011.
[23] 刘立明, 刘丽虹, 宋功武, 等. 分光光度法测定Fenton反应产生的羟自由基[J]. 湖北大学学报(自然科学版), 2002, 24(4): 326-328.doi:10.3969/j.issn.1000-2375.2002.04.011.
[24] 冯涛, 阎婷婷, 阎国荣, 等. 红花提取物清除自由基能力的初步研究[J]. 天津农学院学报, 2010, 17(1): 6-9. doi:10.3969/j.issn.1008-5394.2010.01.002.
[25] 杨鑫嵎, 杨文宇, 叶强. 红毛五加叶水提液对羟自由基清除率的测定[J]. 安徽农业科学, 2011, 39(35): 21653-21656; 21659.
[26] 李洪亮, 周漫, 丁冶春, 等. 六月雪水提取物体外清除羟自由基活性的实验研究[J]. 赣南医学院学报, 2016, 36(1): 27-30. doi:10.3969/j.issn.1001-5779.2016.01.007.
[27] 揭国良. 普洱茶抗氧化作用及减肥作用的研究[D]. 杭州: 浙江大学,2008: 32-33.
[28] BENJAKUL S, LERTITTIKUL W, BAUER F. Antioxidant activity of Maillard reaction products from a porcine plasma protein-sugar model system[J] Food Chemistry, 2005, 93(2): 189-196. doi:10.1016/j.foodchem.2004.10.019.
[29] BURSAL E, KÖKSAL E. Evaluation of reducing power and radical scavenging activities of water and ethanol extracts from sumac(Rhuscoriaria L.)[J]. Food Research International, 2011, 44(7): 2217-2221. doi:10.1016/j.foodres.2010.11.001.
[30] 胡梦眉. 咖啡豆提取物对营养肥胖型大鼠减肥的作用及机制初探[D].杭州: 浙江工业大学, 2015: 11-13.
[31] 郭郁, 吴涛, 刘锐, 等. 红茶提取物减肥作用研究[J]. 现代食品科技,2017, 33(2): 16-20; 15.
[32] VITAGLIONE P, MORISCO F, MAZZONE G, et al. Coffee reduces liver damage in a rat model of steatohepatitis: the underlying mechanisms and the role of polyphenols and melanoidins[J].Hepatology, 2010, 52(5): 1652-1661. doi:10.1002/hep.23902.
[33] DELGADO-ANDRADE C, RUFIÁN-HENARES J A, MORALES F J.Assessing the antioxidant activity of melanoidins from coffee brews by different antioxidant methods[J]. Journal of Agricultural and Food Chemistry, 2005, 53(20): 7832-7836. doi:10.1021/jf0512353.
[34] 杨荣华, 林家莲, 周凌霄. 酱油、豆酱中褐色色素的生理功能[J]. 中国调味品, 2000, 25(5): 21-22. doi:10.3969/j.issn.1000-9973.2000.05.005.
[35] SALTIEL A R, KAHN C R. Insulin signalling and the regulation of glucose and lipid metabolism[J]. Nature, 2001, 414: 799-806.doi:10.1038/414799a.
[36] BROWNING J D, HORTON J D. Molecular mediators of hepatic steatosis and liver injury[J]. Journal of Clinical Investigation, 2004,114(2): 147-152. doi:10.1172/JCI22422.
[37] CHO A S, JEON S M, KIM M J, et al. Chlorogenic acid exhibits anti-obesity property and improves lipid metabolism in high-fat dietinduced-obese mice[J]. Food & Chemical Toxicology, 2010, 48(3):937-943. doi:10.1016/j.fct.2010.01.003.
Antioxidant and Antiobesity Effects of Melanoidins from Yunnan Grown Arabica
吴少雄(1965—)(ORCID: 0000-0002-9085-5672),男,教授,博士,研究方向为营养与食品科学。E-mail: sxwcn@sina.com
王松梅(1980—)(ORCID: 0000-0002-3399-8386),女,讲师,硕士,研究方向为营养与食品卫生学。E-mail: kmwangsongmei@126.com
WANG Yao, WANG Xiaona, ZHANG Xuehui, et al. Antioxidant and antiobesity effects of melanoidins from Yunnan grown arabica[J]. Food Science, 2019, 40(1): 183-189. (in Chinese with English abstract)doi:10.7506/spkx1002-6630-20170917-242. http://www.spkx.net.cn