动脉粥样硬化(atherosclerosis,AS)是一种非常复杂的慢性疾病[1],表现为脂质的积累、动脉血管壁的增厚以及某些炎性细胞因子的增多[2],也是心血管疾病发病率和死亡率增加的重要因素[3]。造成AS的发病原因非常复杂,其中血脂异常导致过多的脂质在血管内壁沉积[4]、体内氧化应激造成的损伤和诱发的一些炎症反应为主要因素[5]。肝脏是脂质代谢的重要器官,长期摄入高脂饮食会对肝脏造成一定的负担,进而导致肝脏脂质代谢紊乱、肝脏脂肪沉积和病变[6]。近年来,随着我国国民生活水平的提高及饮食习惯的改变,AS的患病率越来越高,并成为中国人群的主要死亡原因[7]。AS主要是胆固醇、胆固醇酯在动脉血管内、中膜大量沉积所形成的病理改变,其危险因素包括血脂异常、血糖异常、肥胖等[8]。肝脏是脂肪消化、吸收、分解、合成及运输等过程的重要场所[9]。研究结果显示,肝细胞脂肪病变及其伴随的肝脏坏死性炎症均对AS有促进作用[10]。因此研究AS发病过程中肝脏的生理状态对于预防和治疗AS具有指导意义。
原花青素是一类广泛存在于植物中的天然多酚类化合物,是以黄烷-3-醇及其衍生物为结构单元,通过C—C键聚合而形成的聚合物。原花青素对心血管系统具有保护作用,尤其是在脂质代谢中通过调整氧化低密度脂蛋白而起到抗氧化作用[11]。根据聚合度可将原花青素分为高聚原花青素和低聚原花青素,其中低聚原花青素更容易被吸收。研究表明,低聚原花青素具有抗氧化、抗炎症、缓解机体氧化应激和脂质过氧化反应,对退行性疾病具有预防作用[12]。
蔷薇红景天(Rhodiola rosea L.)为景天科(Crassulaceae)、红景天属(Rosales),主要生长在我国高海拔地区。研究表明,蔷薇红景天作为一种珍贵的药用资源,主要生物活性物质有红景天苷、酪醇和原花青素等。具有抑菌、抗病毒、抗炎、抗肿瘤、抗缺氧、保护神经细胞和增强记忆力的功效,对神经系统和心脏具有保护作用。然而,目前国内外对红景天的研究主要集中在其化学成分的分析,特别是红景天苷及其制备方法和抗炎抗氧化等活性的研究,而对红景天中原花青素的研究相对较少,更少有对红景天原花青素干预AS的研究。
课题组前期对蔷薇红景天低聚原花青素(oligomeric procyanidins from Rhodiola rosea L.,OPCRR)进行了提取、纯化,并对OPCRR的稳定性[13]、抗氧化和抗衰老等活性[14]进行了研究,结果显示OPCRR具有较强的清除1,1-二苯基-2-三硝基苯肼自由基、羟自由基和超氧阴离子自由基的能力,从而能够增强抗衰老活性。姜黄素是从姜科姜黄属植物姜黄根茎中提取的一种天然酸性酚类物质。研究表明,姜黄素具有降低高脂血症、抗内皮功能失调、抗氧化等作用,可在多个环节上影响AS的发生和发展[15],因此本实验中将其设置为阳性对照组。
本实验采用VD3辅助脂肪乳剂灌胃的方法建立大鼠AS模型,通过对大鼠肝脏病理切片的观察以及肝脏中脂质代谢、氧化应激和相关炎症细胞因子等指标的测定,初步确定OPCRR对AS模型大鼠肝脏的保护作用并探讨其作用机制。
雄性Wistar大鼠66 只,8 周龄,体质量160~180 g,由北京维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2014-0004。
OPCRR为河北农业大学食品营养安全研究室制备,参考实验室制备专利[16]的方法进行提取、纯化。
VD3、丙基硫氧嘧啶、去氧胆酸钠、胆固醇 北京索莱宝科技有限公司;总胆固醇(total cholesterol,TC)测试盒、甘油三酯(triglyceride,TG)测试盒、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-c)测试盒、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-c)测试盒、极低密度脂蛋白胆固醇(very low density lipoprotein cholesterol,VLDL-c)测试盒、丙二醛(malondialdehyde,MDA)测试盒、超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒、谷胱甘肽过氧化酶(glutathione peroxidase,GSH-Px)测定试剂盒、蛋白定量(考马斯亮蓝法)试剂盒 南京建成生物工程研究所;白细胞介素(interleukin,IL)-1β酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒、IL-6 ELISA试剂盒、IL-10 ELISA试剂盒、单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)ELISA试剂盒、细胞间黏附因子-1(intercellular cell adhesion molecule-1,ICAM-1)ELISA试剂盒、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒 武汉博士德生物工程有限公司;其他试剂均为国产分析纯。
1500-823酶标仪、Finesse石蜡切片机 美国Thermo Scientific公司;SCIENTZ-IID细胞破碎仪、SCIENTZ-48组织研磨器 宁波新芝生物科技股份有限公司;FA2204B电子天平 上海精密科学仪器有限公司;DH-250电热恒温培养箱 上海胜启仪器仪表有限公司。
1.3.1 大鼠AS模型的建立与剂量设计
大鼠饲养1 周后开始正式实验。随机分为6 组,即阴性对照组、模型对照组及OPCRR低(60 mg/kg mb)、中(120 mg/kg mb)、高(240 mg/kg mb)剂量组和姜黄素(50 mg/kg mb)对照组(阳性对照组),每组11 只。模型对照组、OPCRR3 个剂量组和姜黄素对照组用VD3辅助高脂乳剂灌胃法造模,即实验开始前连续3 d灌胃VD3 40万 IU/(kg·d),之后每天灌胃高脂乳剂,阴性对照组以蒸馏水代替,连续8 周。在造模的同时,相应组动物每天灌胃3 个剂量的OPCRR和姜黄素,阴性对照组和模型对照组灌胃蒸馏水。
1.3.2 大鼠血清制备及血脂指标测定
第56天,各组大鼠禁食12 h后,称质量、麻醉、股动脉取血,3 000 r/min离心,取血清,检测大鼠血清中TC、TG、LDL-c和HDL-c水平,并按照如下公式计算AS指数(atherosclerosis index,AI)。
式中:cTC为测定的血清中TC的浓度/(mmol/mL);cHDL-c为测定的血清中HDL-C的浓度/(mmol/mL)。
1.3.3 大鼠动脉及肝脏组织生化指标测定
取大鼠肝脏,称质量。部分肝脏按照1∶9(m/V)加入生理盐水,利用细胞破碎仪制成质量分数10%的肝脏匀浆,酶标仪检测大鼠肝组织中脂质、氧化应激和相关炎症因子等指标水平。取大鼠动脉,将动脉与剩余肝脏组织样品在体积分数10%福尔马林溶液中充分固定后,石蜡包埋,切片,苏木精-伊红(hematoxylin-eosin,HE)染色。
实验数据运用SPSS 13.0进行统计分析。首先进行正态性检验,若数据符合正态分布,采用单因素方差分析(One-way ANOVA)进行显著性分析,P<0.05表示差异显著。本实验中所有数据均以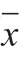 ±s表示。
±s表示。
表1 大鼠AS造模后血脂指标的变化(n=11)
Table1 Changes in blood lipid levels in rats after atherosclerosis induction (n= 11)

注:*.与阴性对照组相比差异显著(P<0.05);**.与阴性对照组相比差异极显著(P<0.01)。下同。
组别 TC浓度/(mmol/mL)TG浓度/(mmol/mL)LDL-c浓度/(mmol/mL)HDL-c浓度/(mmol/mL)AI阴性对照组 1.53±0.08 0.35±0.09 2.64±0.42 0.63±0.09 1.71±0.40模型对照组 2.95±0.31** 0.85±0.06** 5.40±1.75** 0.21±0.08**15.73±3.71**
由表1可知,与阴性对照组相比,模型对照组的大鼠TC、TG、LDL-c水平极显著升高(P<0.01),HDL-c水平极显著降低(P<0.01),AI极显著升高(P<0.01)且大于4,说明造模成功。

图1 大鼠AS造模后动脉组织病理学变化
Fig.1 Histopathological change in artery of AS rats
由图1中HE染色切片可知,阴性对照组大鼠动脉壁的各层结构均正常,细胞排列整齐,层次清晰且内膜光滑,中膜平滑肌层无萎缩;模型对照组各层结构排列紊乱,与阴性对照组相比有较多的脂质沉积,内膜细胞排列疏松,内膜增厚,说明AS造模成功。
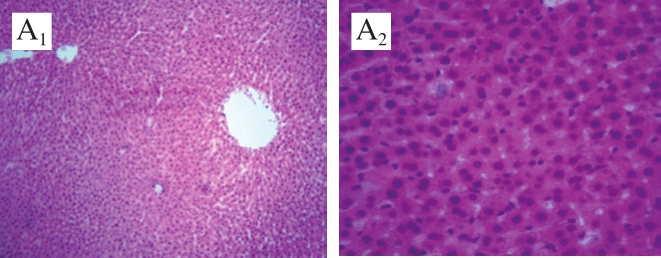

图2 AS大鼠肝脏组织病理学变化
Fig.2 Histopathological changes in liver of AS rats
如图2所示,阴性对照组大鼠肝脏组织形态结构清晰且完整,肝小叶和肝窦正常,肝细胞排列整齐,以中央静脉为轴心呈辐射状排列,肝细胞形态正常,细胞核类似圆形,位于细胞中央(图2A1、A2);模型对照组大鼠肝细胞出现肿胀,细胞核被挤到边缘,肝小叶结构紊乱,肝索排列紊乱,肝窦缩小甚至消失(图2B1、B2);OPCRR低剂量组大鼠的肝脏组织情况与模型对照组情况基本相似(图2C1、C2)。OPCRR中、高剂量组和姜黄素对照组大鼠的肝组织情况均有所好转,肝细胞排列较为清晰,肝小叶结构较为正常,汇管区有少量炎细胞浸润(图2D~F)。
由表2可知,与阴性对照组相比,模型对照组大鼠肝脏中TC、TG、LDL-c和VLDL-c的含量均极显著上升(P<0.01),HDL-c的含量极显著降低(P<0.01),即AS造模成功。与模型对照组相比,OPCRR组和姜黄素对照组各项血脂指标显著改善,OPCRR组和姜黄素对照组的TC、LDL-c和VLDL-c的含量极显著降低(P<0.01),TG的含量显著降低(P<0.05),HDL-c的含量显著升高(P<0.05),说明OPCRR对AS大鼠肝脏的脂质代谢调节具有显著改善作用,且与姜黄素效果相似。
表2 OPCRR对AS大鼠肝脏中脂质指标的影响(n=11)
Table2 Effect of OPCRR on lipid parameters in liver of AS rats (n = 11)mmol/mg

注:#.与模型对照组相比差异显著(P<0.05);##.与模型对照组相比差异极显著(P<0.01)。下同。
组别 TC含量 TG含量 LDL-c含量 HDL-c含量 VLDL-c含量阴性对照组 0.10±0.01 0.09±0.01 0.012±0.009 0.041±0.015 0.73±0.14模型对照组 0.25±0.05** 0.15±0.04**0.045±0.009**0.017±0.009**1.90±0.47**OPCRR低剂量组 0.17±0.01## 0.16±0.03# 0.014±0.004##0.038±0.017# 1.38±0.44##OPCRR中剂量组 0.14±0.02## 0.13±0.04# 0.012±0.003##0.043±0.017# 1.04±0.17##OPCRR高剂量组 0.11±0.03## 0.11±0.03# 0.011±0.005##0.039±0.017# 1.11±0.31##姜黄素对照组 0.15±0.01## 0.10±0.04# 0.014±0.008##0.038±0.021# 0.97±0.16##
表3 OPCRR对AS大鼠肝脏氧化应激指标水平的影响(n=11)
Table3 Effect of OPCRR on antioxidant parameters levels in liver of AS rats (n= 11)

GSH-Px活力/(U/mg)阴性对照组 163.2±20.0 4.99±0.40 1 032.6±109.5模型对照组 82.4±8.0** 6.75±1.44* 766.1±117.4**OPCRR低剂量组 98.3±12.1# 5.29±0.61# 845.4±76.9#OPCRR中剂量组 101.1±13.6# 5.20±0.55# 1 069.4±27.0##OPCRR高剂量组 109.4±6.8## 5.12±0.99# 968.0±82.6##姜黄素对照组 100.1±13.2# 5.73±1.01 918.3±36.4##组别 SOD活力/(U/mg)MDA含量/(nmol/mg)
由表3可知,与阴性对照组相比,模型对照组大鼠肝脏中的SOD和GSH-Px活力极显著降低(P<0.01),MDA的含量显著升高(P<0.05)。与模型对照组相比,OPCRR剂量组与姜黄素对照组均有改善的趋势,其中OPCRR各剂量组显著提高了肝脏中SOD活力(P<0.05,P<0.01),姜黄素对照组显著提高SOD活力(P<0.05);在提高肝脏中GSH-Px的活力方面,低剂量的OPCRR可以显著提高GSH-Px的活力(P<0.05),中、高剂量的OPCRR和姜黄素可以极显著提高GSH-Px的活力,说明OPCRR提高GSH-Px的效果基本与姜黄素相似;OPCRR显著降低了大鼠肝脏中MDA的含量(P<0.05),而姜黄素对照组相对于模型对照组存在降低的趋势,但基本上无显著性差异,即OPCRR降低肝脏中MDA含量的效果要优于姜黄素。
由表4可知,与阴性对照组相比,模型对照组所有炎性细胞因子的水平均极显著提高(P<0.01)。与模型对照组相比,OPCRR组和姜黄素对照组均有降低各炎症细胞因子水平的趋势,其中低剂量OPCRR可显著降低肝脏中IL-1β的水平(P<0.05),中、高剂量的OPCRR可极显著降低肝脏中IL-1β的水平(P<0.01),而姜黄素则对其没有明显影响;OPCRR各剂量和姜黄素均可极显著降低IL-6的水平(P<0.01);低、中剂量的OPCRR和姜黄素均可以显著降低IL-10的水平(P<0.05),高剂量的OPCRR可极显著降低IL-10的水平(P<0.01);低剂量的OPCRR对MCP-1和ICAM-1水平无显著性影响,中、高剂量的OPCRR可显著降低MCP-1和ICAM-1的水平(P<0.05,P<0.01);低剂量OPCRR和姜黄素均可以显著降低肝脏中TNF-α质量浓度(P<0.05),中、高剂量OPCRR可以极显著降低肝脏中TNF-α质量浓度(P<0.01),说明在降低炎症因子水平方面,OPCRR整体水平要优于姜黄素。
表1 OPCRR对AS大鼠肝脏中炎症细胞因子水平的影响(n=11)
Table1 Effect of OPCRR on in fl ammatory cytokine levels in liver of AS rats (n= 11)pg/mL
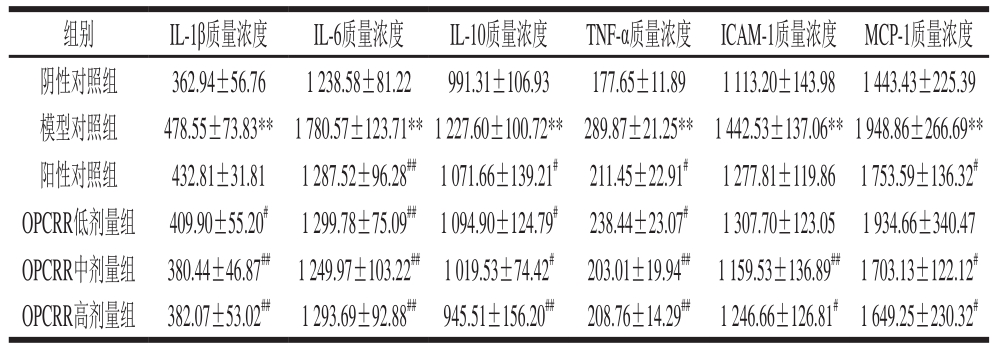
组别 IL-1β质量浓度 IL-6质量浓度 IL-10质量浓度 TNF-α质量浓度 ICAM-1质量浓度 MCP-1质量浓度阴性对照组 362.94±56.76 1 238.58±81.22 991.31±106.93 177.65±11.89 1 113.20±143.98 1 443.43±225.39模型对照组 478.55±73.83** 1 780.57±123.71**1 227.60±100.72** 289.87±21.25** 1 442.53±137.06**1 948.86±266.69**阳性对照组 432.81±31.81 1 287.52±96.28## 1 071.66±139.21# 211.45±22.91# 1 277.81±119.86 1 753.59±136.32#OPCRR低剂量组 409.90±55.20# 1 299.78±75.09## 1 094.90±124.79# 238.44±23.07# 1 307.70±123.05 1 934.66±340.47 OPCRR中剂量组 380.44±46.87## 1 249.97±103.22## 1 019.53±74.42# 203.01±19.94## 1 159.53±136.89##1 703.13±122.12#OPCRR高剂量组 382.07±53.02## 1 293.69±92.88## 945.51±156.20## 208.76±14.29## 1 246.66±126.81# 1 649.25±230.32#
AS已经成为严重影响人类生命安全的慢性疾病之一,因此成功建立动物AS模型对于研究其预防和治疗效果具有十分重要的意义。研究表明AS主要表现为动脉壁钙化和动脉壁上的脂质沉积[17],高脂乳剂主要成分为胆固醇、丙基硫氧嘧啶、去氧胆酸钠、猪油等,可以升高动物体内TC和TG含量,破坏甲状腺功能,促进胆固醇的吸收,进而诱发高脂血症;而VD3作为一种钙离子诱导剂[18],可使血钙升高,诱发高钙血症[19],两者协同使动脉管壁的完整受到破坏,引起动脉内皮通透性升高,脂蛋白及单核细胞浸润内膜,进而堆积成AS斑块[20]。本实验通过连续3 d灌胃VD3 40万 IU/(kg·d),辅助高脂乳剂(猪油20%(质量分数,下同)、丙二醇20%、吐温-80 20%、胆固醇10%、去氧胆酸钠2%、丙硫氧嘧啶1%)灌胃,经过8 周,成功获得了大鼠AS模型,为研究的开展提供了前提条件。
原花青素除具有显著的抗氧化作用外,还具有抑制LDL形成、改善脂质代谢紊乱的作用,这可能就是原花青素对血管具有保护作用的原因。许多研究表明,高脂血症是诱发AS的一个必要条件,有研究者认为,体内的TC、TG水平升高后,与LDL或VLDL结合成LDL-c或VLDL-c被运送到动脉管壁[21],脂蛋白会堆积在动脉血管壁,AS过程即开始启动,随后经过慢性炎症反应,AS过程加速发展[22];因此,改善脂质代谢水平,是缓解AS的一个关键途径。姜岩等[23]研究了葡萄籽原花青素对冠状AS的防御作用,结果表明葡萄籽原花青素可以降低Wistar雄性大鼠的TC、TG和LDL-c的水平,同时提高HDL-c的水平,从脂质代谢途径调控AS;Zhang Kexia等[24]用柿蒂类黄酮化合物对AS大鼠进行干预,结果显示大鼠体内TC、TG、LDL-c和HDL-c指标水平均有所改善,并具有增加载脂蛋白A1表达量和降低血清载脂蛋白B的作用,且主动脉切片结果证明柿类黄酮化合物确实对AS有保护作用。本实验以OPCRR为研究对象,干预AS Wistar雄性大鼠肝脏中的脂质代谢,最终结果与上述文献具有相同的趋势,说明OPCRR具有通过调节脂质代谢而缓解AS的效果。
肝脏在脂质代谢的过程中起着重要的作用,其主要功能是合成脂蛋白和促进脂质运输。发生AS时,往往伴随着脂肪肝等肝脏疾病的出现,原因是胆固醇排泄的主要途径是胆汁酸的排泄,过度摄入的脂肪会导致肝脏不能正常代谢甚至肝损伤,脂肪会堆积在肝脏,影响肝细胞的功能、造成结缔组织增生,最终导致肝硬化。AS通常会导致体内脂质代谢紊乱,甚至会导致脂肪肝。李向阳等[25]研究了金钗石斛多糖对高脂血症大鼠肝脏脂肪变性的影响,证明了高脂血症可以引发肝脏脂肪变性,且通过切片证实,金钗石斛多糖可以从肝小叶结构、肝细胞形态、变性程度等多方面对肝脏进行保护;李国娟等[26]研究也证明了过氧化物酶增值物激活受体γ激活蛋白1-α(peroxisome proliferator-activated receptor γ coactivator 1-α,PGC-1α)增加可以促进胆固醇的分解和胆汁的分泌,调节血脂代谢,所以增加AS大鼠肝脏中PGC-1α的表达可以保护心血管,抑制AS的形成。本研究的HE染色结果表明,OPCRR可以改善AS大鼠的肝细胞形态,保护肝脏结构,减少肝组织中的炎性灶,缓解肝损伤和变性的发生。
自由基引发脂质过氧化是AS形成的重要原因之一。盛冲霄等[27]发现,氧化应激是诱发颈部AS的一个重要原因,其中活性氧积聚,与血管舒张因子NO之间的平衡被打破,引起内皮功能障碍,是AS开始形成的关键。近年来,实验证明,多种炎症细胞因子的过度释放也是导致AS的一个关键原因[28],血液中的LDL-c是一种炎性诱导剂,可诱导黏附因子(ICAM-1和VCAM-1)增加聚集到AS早期病变区形成AS[29];另一种在AS的发展阶段中起关键性作用的炎症细胞因子是MCP-1,它主要是吸引其他多种炎症细胞黏附到AS病变区域,促进AS的形成[30];此外参与AS过程的还有IL-1β、IL-6、IL-10和TNF-α等促炎性因子。何忠梅等[31]利用短梗五加果多酚减少了多种炎性细胞因子的表达,并缓解了SD大鼠AS的情况,与本实验证明的OPCRR可以显著降低Wistar大鼠肝脏中各炎症因子水平的结果相似。
本实验以OPCRR为研究对象,采用VD3联合高脂乳剂方法可成功建立大鼠AS模型,研究了其对AS大鼠肝脏的保护作用及作用机制。结果显示,OPCRR可以通过改善脂质代谢、提高抗氧化能力和抑制细胞炎症因子来干预AS大鼠脂肪肝的形成,明显改善大鼠肝脏结构形态,缓解由AS造模过程产生的肝损伤。而关于OPCRR是如何通过调节相关信号通路来抑制AS的形成需进一步进行研究。
[1] 张翠连. 大鼠动脉粥样硬化模型的制备和富氢水对动脉粥样硬化防治作用的研究[D]. 石家庄: 河北医科大学, 2014: 1-7.
[2] PANG J J, XU Q H, XU X B, et al. Hexarelin suppresses high lipid diet and vitamin D3-induced atherosclerosis in the rat[J]. Peptides,2010, 31(4): 630-638. doi:10.1016/j.peptides.2009.11.007.
[3] LIU Yueli, WANG Liqun, WU Haitao, et al. Comparison of anti-atherosclerotic effects of two different extracts from leaves of Mallotus furetianus[J]. Asian Pacif i c Journal of Tropical Medicine, 2011, 4(11):878-882. doi:10.1016/S1995-7645(11)60212-5.
[4] DIAO S L, SUN J W, MA B X, et al. Influence of crocetin on high-cholesterol diet induced atherosclerosis in rats via anti-oxidant activity together with inhibition of inflammatory response and p38 MAPK signaling pathway[J]. Saudi Journal of Biological Sciences,2016, 25(3): 493-499. doi:10.1016/j.sjbs.2016.11.005.
[5] 张玥, 朱晓冉, 蔡玥, 等. 灯盏花素对动脉粥样硬化大鼠氧化应激和炎症反应的影响[J]. 贵州医科大学学报, 2017, 42(1): 71-75.doi:10.19367/j.cnki.1000-2707.2017.01.016.
[6] 魏刚. 脂血清胶囊对高脂血症豚鼠的血脂调节及肝脏保护作用研究[D]. 石家庄: 河北医科大学, 2015: 1-13.
[7] 周晓欢, 杨玉春, 张源明, 等. 高血压及高脂血症与颈动脉粥样硬化的相关性分析[J]. 西部医学, 2014, 26(12): 1645-1647.
[8] 周筱琼, 于小妹, 叶雄伟, 等. 高脂血症患者血浆致动脉粥样硬化指数与血栓形成危险因子的相关性[J]. 中国动脉硬化杂志, 2010,18(10): 799-802.
[9] 魏国华, 刘兰, 蔡晓波, 等. 高脂饮食所致动脉粥样硬化家兔肝组织学损伤评估[J]. 中国动脉硬化杂志, 2008, 16(5): 373-375.
[10] CROCE K, LIBBY P. Intertwining of thrombosis and inf l ammation in atherosclerosis[J]. Current Opinion in Hematology, 2007, 14(1): 55-61.
[11] HORT M A, STRALIOTTO M R, DUZ M S, et al. Cardioprotective effects of a proanthocyanidin-rich fraction from Croton celtidifolius Baill: focus on atherosclerosis[J]. Food and Chemical Toxicology,2012, 50(10): 3769-3775. doi:10.1016/j.fct.2012.07.050.
[12] MOHANA T, NAVIN A V, JAMUNA S, et al. Inhibition of differentiation of monocyte to macrophages in atherosclerosis by oligomeric proanthocyanidins: in-vivo and in-vitro study[J]. Food and Chemical Toxicology, 2015, 82: 96-105. doi:10.1016/j.fct.2015.04.028.
[13] 孟玉彩. 蔷薇红景天中原花青素提取、精制及稳定性研究[D].保定: 河北农业大学, 2009: 1-10.
[14] 马蕾. 蔷薇红景天原花青素对衰老的营养干预及其作用机制研究[D].保定: 河北农业大学, 2014: 1-13.
[15] 王琛, 孟哲, 马艳秋, 等. 姜黄素对血管紧张素II诱导血管平滑肌细胞增殖及氧化应激的影响[J]. 西安交通大学学报(医学版), 2016,37(3): 441-446. doi:10.7652/jdyxb201603029.
[16] 赵文. 一种蔷薇红景天原花青素的制备方法: CN2011100915740[P].2013-08-14[2017-06-30].
[17] 赵娟, 李相军, 孙波, 等. 维生素D3联合高脂饲料建立大鼠动脉粥样硬化模型[J]. 实用医学杂志, 2009, 25(21): 3569-3571.
[18] 吴开云, 高摄渊, 袁融, 等. 维生素D诱发大鼠动脉粥样硬化的实验研究[J]. 解剖学报, 1996(2): 133-135. doi:10.16098/j.issn.0529-1356.1996.02.006.
[19] 王伟, 杨滨, 王岚, 等. 丹参山楂药对大鼠动脉粥样硬化的影响[J].中国中药杂志, 2011, 36(6): 784-789.
[20] YANG P Y, RUI Y C, LI K, et al. Expression of intercellular adhesion molecule-1 in U937 foam cells and inhibitory effect of imperatorin[J].Acta Pharmacologica Sinica, 2002, 23(4): 327-330.
[21] TABAS I, WILLIAMS K J, BORÉN J. Subendothelial lipoprotein retention as the initiating process in atherosclerosis update and therapeutic implications[J]. Circulation, 2007, 116(16): 1832-1844.
[22] 唐妮, 高静, 吴晨曦, 等. 参芪鲫鱼药膳汤对大鼠早期动脉粥样硬化血脂及肝脏的影响[J]. 中国疗养医学, 2015, 24(11): 1134-1138.doi:10.13517/j.cnki.ccm.2015.11.006.
[23] 姜岩, 刘丹. 原花青素预防大鼠冠状动脉粥样硬化研究[J]. 中国医学工程, 2011(4): 104; 106.
[24] ZHANG Kexia, ZHANG Yuanyuan, ZHANG Meiyu, et al. Effects of phospholipid complexes of total flavonoids from persimmon(Diospyros kaki L.) leaves on experimental atherosclerosis rats[J].Journal of Ethnopharmacology, 2016, 191: 245-253. doi:10.1016/j.jep.2016.06.043
[25] 李向阳, 龚其海, 吴芹, 等. 金钗石斛多糖对大鼠高脂血症和肝脏脂肪变性的影响[J]. 中国药学杂志, 2010, 45(15): 1142-1144.
[26] 李国娟, 陈宏, 董艳华, 等. 利拉鲁肽对促动脉粥样硬化饮食喂养大鼠大动脉的保护作用及对肝脏PGC-1α表达的影响[J]. 华中科技大学学报(医学版), 2014, 43(6): 653-657. doi:10.3870/j.issn.1672-0741.2014.06.009.
[27] 盛冲霄, 黎红华, 崔敏, 等. 糖尿病与氧化应激在颈动脉粥样硬化大鼠内皮功能障碍中的作用研究[J]. 中国全科医学, 2016, 19(9):1015-1020. doi:10.3969 /j.issn.1007-9572.2016.09.006.
[28] MONTERO-VEGA M T. The inflammatory process underlying atherosclerosis[J]. Critical Reviews in Immunology, 2012, 32(5):373-462. doi:10.1615/CritRevImmunol.v32.i5.10.
[29] WEBER C, NOELS H. Atherosclerosis: current pathogenesis and therapeutic options[J]. Nature Medicine, 2011, 17(11): 1410-1422.doi:10.1038/nm.2538.
[30] GU L, OKADA Y, CLINTON S K, et al. Absence of monocyte chemoattractant protein-1 reduces atherosclerosis in low density lipoprotein receptor-def i cient mice[J]. Molecular Cell, 1998, 2(2): 275-281.doi:10.1016/S1097-2765(00)80139-2.
[31] 何忠梅, 李成恩, 段翠翠, 等. 短梗五加果多酚预防大鼠动脉粥样硬化作用研究[J]. 食品科学, 2018, 39(1): 200-206. doi:10.7506/spkx1002-6630-201801030.
Hepatoprotective Effect of Oligomeric Procyanidins from Rhodiola rosea L. in Atherosclerotic Rats
HAN Xue, ZHOU Qian, NIU Jiahui, et al. Hepatoprotective effect of oligomeric procyanidins from Rhodiola rosea L. in atherosclerotic rats[J]. Food Science, 2019, 40(1): 190-195. (in Chinese with English abstract)doi:10.7506/spkx1002-6630-20170719-376. http://www.spkx.net.cn