基于iTRAQ技术研究采后1-甲基环丙烯和乙烯利处理对茭白线粒体蛋白质组变化的影响
罗海波1,周 涛1,孔晓雪1,陶明煊1,姜 丽2,王利斌3,王韦华2,郁志芳2,*
(1.南京师范大学金陵女子学院,江苏 南京 210097;2.南京农业大学食品科技学院,江苏 南京 210095;3.南京农业大学园艺学院,江苏 南京 210095)
摘 要: 为探讨茭白采后衰老的分子机制,应用同位素标记相对与绝对定量蛋白质组学技术研究了茭白常温贮藏期间线粒体蛋白质表达谱的变化及1-甲基环丙烯(1-methyleyelopropene,1-MCP)和乙烯利(ethylene,ET)处理对茭白线粒体蛋白质组变化的影响。结果表明:共鉴定到肽段数大于等于2的可信蛋白1 908 个,与贮藏0 d相比,对照(CK)组、ET和1-MCP处理组茭白贮藏3 d和6 d后,共有315 个蛋白表达量变化倍数在2.0 倍以上且重复组数据统计学差异显著(P<0.05)。生物信息学分析显示代谢途径、次生代谢产物生物合成、氨基酸生物合成与代谢、核苷酸代谢、含碱基小分子代谢途径等可能与茭白采后衰老有关,三羧酸循环、氧化磷酸化、磷酸戊糖途径、C5支链二元酸代谢及氨基酸代谢途径可能在茭白采后衰老中发挥重要作用。这些差异表达蛋白的生物学功能分析表明,茭白采后碳水化合物水解加速,磷酸戊糖途径加强而糖酵解途径和氧化磷酸化减弱,导致能量合成减少,同时形成氧化胁迫,这可能激活Ca2+/MAPKs、细胞色素c和茉莉酸等信号途径,造成初级代谢紊乱和次级代谢产物(如木质素)积累,从而促进细胞凋亡或细胞坏死,最终加速衰老。
关键词:茭白;线粒体;同位素标记相对与绝对定量;生物信息学;衰老
衰老是导致茭白采后品质快速下降的重要因素,严重影响其商品品质和市场价值[1]。研究表明,抑制或延缓果蔬采后衰老可有效减少营养成分消耗损失、风味色泽改变及质地软化或木纤化,提高果蔬抗病菌能力,降低腐烂率,从而维持果蔬采后品质和贮藏寿命[2]。因此,深入研究茭白采后衰老的生物学基础,有助于为实践中进一步研发精准的采后贮运保鲜新技术提供理论支撑。
关于衰老的生物学基础研究,自19世纪末应用实验方法研究以来,科研人员曾先后提出过多种假说,目前已知的果蔬采后衰老生物学基础主要有营养亏缺假说、衰老基因调控学说、激素调控学说、自由基学说、细胞凋亡理论、死亡因子、端粒学说和差误理论等,其中影响较为深远的主要是激素调控学说、自由基学说、细胞凋亡理论和衰老基因调控学说[3-4]。目前,尽管这些学说对衰老现象的解释都有不同的理论和实验证据,但对采后衰老生物学基础的清楚认识远远不够,关于果蔬采后衰老生物学基础的研究仍需继续。
同位素标记相对与绝对定量(isobaric tags for relative and absolute quantitation,iTRAQ)技术是近几年发展起来的一种高通量定量蛋白质组学技术,与传统双向电泳和荧光差异双向电泳技术相比,具有定量准确、数据丰富、重复性好、分辨率高和自动化程度高等优势,目前已广泛应用于动物[5]、植物[6]、微生物[7]等材料的蛋白质组学研究中,结合生物信息学分析技术,获悉了许多关于生长发育、生物与非生物胁迫、细胞生理功能等相关分子机理和调控机制。因此,对茭白采后衰老期间线粒体蛋白质表达谱进行研究,能够更加全面准确地探明茭白采后衰老的生物学基础。然而,应用iTRAQ技术对茭白采后衰老期间线粒体蛋白质组学的研究鲜见报道。
乙烯利(e t h y l e n e,E T)是果蔬常用的催熟剂,可以促进多种果蔬的成熟,1-甲基环丙烯(1-methyleyelopropene,1-MCP)可延缓果蔬采后衰老进程,保持果蔬良好的品质,二者在果蔬采后成熟衰老过程中均发挥重要生理作用[8]。本实验拟采用i T R A Q结合二维液相色谱-串联质谱(two-dimensional liquid chromatographytandem mass spectrometry,2D-LC-MS/MS)技术对茭白采后常温贮藏期间以及ET和1-MCP处理后线粒体蛋白质表达谱进行比较,筛选差异表达蛋白并进行生物信息学分析,探索茭白采后衰老的生物学基础,以期为茭白贮运保鲜新技术的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
实验用茭白于6月下旬采自安徽大别山露天种植田,当天运回实验室,充分散去田间热后,挑选无感官异常、形态大小一致的茭白,自来水清洗,室温下晾干。
ET、1-甲基环丙烯、蔗糖、甘露醇、聚乙烯吡烙烷酮、乙二胺四乙酸、L-半胱氨酸、牛血清白蛋白、Percoll、iTRAQ8 plex试剂盒(AB SCIEX)、Tris-HCl(pH 6.8、pH 8.5、pH 8.8)、溴酚蓝、Bradford蛋白浓度测定试剂盒 南京寿德试验器材有限公司;尿素、硫脲、二硫苏糖醇、3-(3-(胆酰胺丙基)二甲氨基)丙磺酸内盐、碘乙酰胺、IPG Buffer、甲酸、甲酸铵美国通用电气公司;十二烷基硫酸钠、三羧基氨基甲烷、甘氨酸、三氯乙酸、过硫酸铵、碳酸钠、N,N,N’,N’-四甲基二乙胺 Amresco公司;三乙基碳酸氢铵缓冲液(triethylammonium bicarbonate buffer,TEAB)、蛋白酶抑制剂 美国Sigma公司;胰蛋白酶(Trypsin Gold)上海普洛麦格生物产品有限公司。其他试剂为国产分析纯。
1.2 仪器与设备
SPX-320智能生化培养箱 宁波江南仪器厂;KQ-300DB超声波清洗机 昆山市超声仪器有限公司;FRESCO 17微量高速冷冻离心机 美国Thermo电子公司;AJ-30i高速冷冻离心机、OptimaL-100XP超速冷冻离心机 美国Beckman公司;TGL-16M高速冷冻离心机 南京驰远生物科技有限公司;5810/5810R冷冻离心机 德国Eppendorf公司;ImageScanner扫描仪 美国Healthcare公司;FS-900N超声波细胞粉碎机 上海生析超声仪器有限公司;1200液相色谱仪 美国Agilent公司;Eksigent nanoLC-Ultra™ 2D系统、TripleTOF 5600系统、Protein Pilot 5.0软件 美国AB SCIEX公司。
1.3 方法
1.3.1 ET和1-MCP处理
将晾干的茭白分为3 组,每组取3 kg进行实验,第一组在1 000 µL/L ET溶液中浸泡30 min后密封19.5 h,第二组在10 µL/L 1-MCP环境中密封20 h,第三组(对照)直接密封20 h,实验设3 次重复,用高密度聚乙烯塑料袋敞口包装,置25 ℃下贮藏0、3 d和6 d,取样提取纯化线粒体。
1.3.2 线粒体提取与纯化
参照杜传来等[9]的方法提取纯化茭白线粒体,每个样品进行3 次生物学重复,纯化后的线粒体置于-70 ℃冰箱备用。
1.3.3 茭白线粒体蛋白iTRAQ分析
茭白线粒体蛋白iTRAQ分析委托上海鹿明生物科技有限公司进行。
1.3.4 蛋白定性和定量
质谱分析原始数据为.wiff文件,采用专用的Proteinpilot软件打开进行分析。数据处理采用含Paragon algorithm算法的Protein Pilot Software v. 5.0进行,检索的数据库为水稻数据库,数据库来源于Uniprot。采用Cutoff Applied>0.05、Global FDR from Fit≤1%且Peptide≥2为可信蛋白评判鉴定标准。
1.3.5 差异表达蛋白筛选
采用Excel软件进行差异表达蛋白筛选,以对照组贮藏0 d为比较基准,组间蛋白变化倍数大于2.0或小于0.5,且P<0.05为差异蛋白,将同一在任意比较组中为差异蛋白的蛋白均列出。
1.3.6 生物信息学分析
采用DAVID生物信息数据库(http://david.abcc.ncifcrf.gov/)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库(http://www.genome.jp/kegg/mapper.html)对差异蛋白进行基因本体(gene ontology,GO)分类注释和功能分析。
2 结果与分析
2.1 茭白线粒体蛋白质谱鉴定结果
茭白线粒体iTRAQ定量蛋白质组学分析共获得1 908 个可信蛋白,以每组贮藏0 d(CK0d)为相对定量参考标准,采用组间表达量变化倍数大于2.0 倍且重复组数据差异显著性检验满足P<0.05的蛋白进行差异表达蛋白筛选,共获得315 个差异表达蛋白(6 个比较组相同的差异蛋白仅统计1 次),详细信息结果见表1。茭白贮藏期间差异表达蛋白数量显著增多,对照组贮藏3 d和6 d后差异表达蛋白数量分别为79、121 个,其中上调表达差异蛋白分别为70、91 个,表明这些蛋白可能与茭白采后衰老密切相关。ET处理显著提高了差异表达蛋白数量,贮藏3 d和6 d后分别为116、165 个,与对照组相比,ET处理组贮藏3 d后上调和下调差异表达蛋白分别增加了3、34 个,贮藏6 d后分别增加了44、0 个,这些增加的差异表达蛋白可能与ET促进茭白采后衰老有关。1-MCP处理也显著提高了差异表达蛋白数量,贮藏3 d和6 d后分别为117、131 个;但与对照组相比,1-MCP处理组贮藏3 d和6 d后上调差异表达蛋白分别减少了40、6 个,下调差异表达蛋白分别增加了78、16 个,暗示1-MCP处理可能抑制了衰老相关蛋白的上调表达,从而延缓衰老。
表1 ET和1-MCP处理对茭白25 ℃贮藏期间线粒体蛋白表达谱的影响
Table1 Effects of ethylene and 1-MCP on mitochondrial protein pro fi le in Z. latifolia during storage at 25 ℃
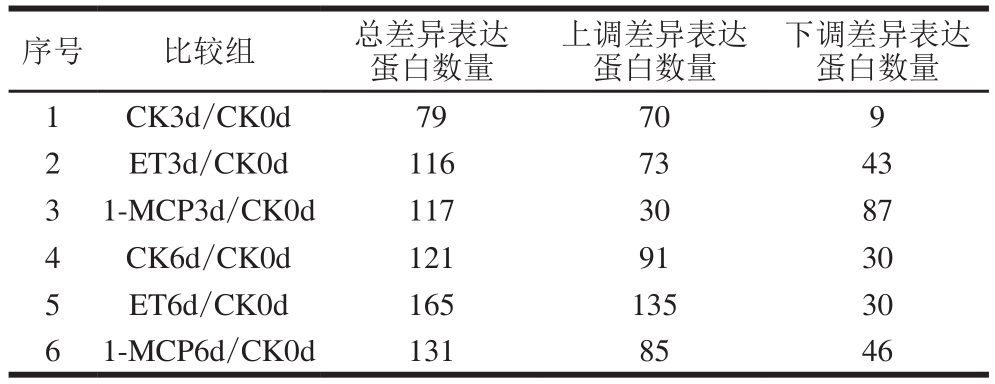
序号 比较组 总差异表达蛋白数量上调差异表达蛋白数量下调差异表达蛋白数量1 CK3d/CK0d 79 70 92 ET3d/CK0d 116 73 433 1-MCP3d/CK0d 117 30 871 CK6d/CK0d 121 91 305 ET6d/CK0d 165 135 306 1-MCP6d/CK0d 131 85 46
2.2 差异表达蛋白的生物信息学分析
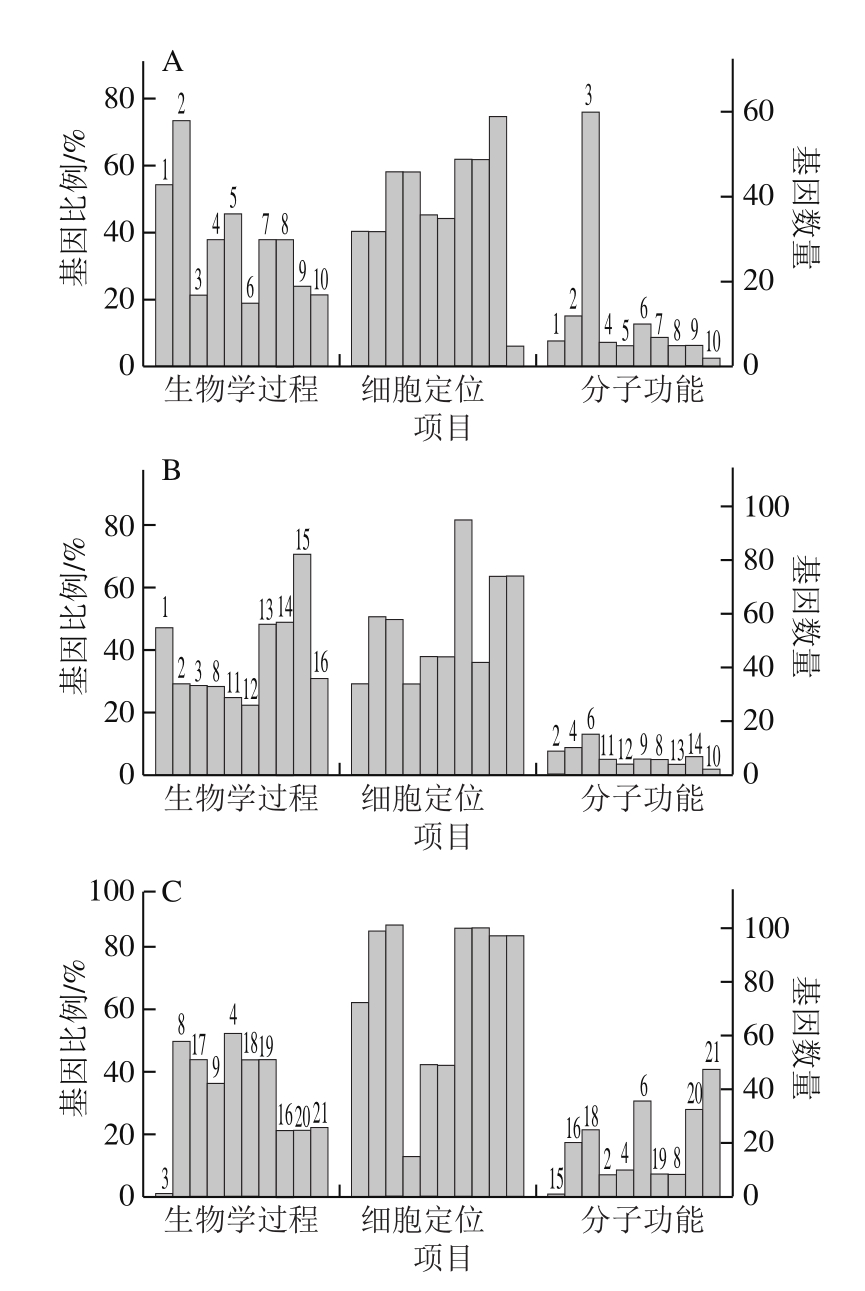
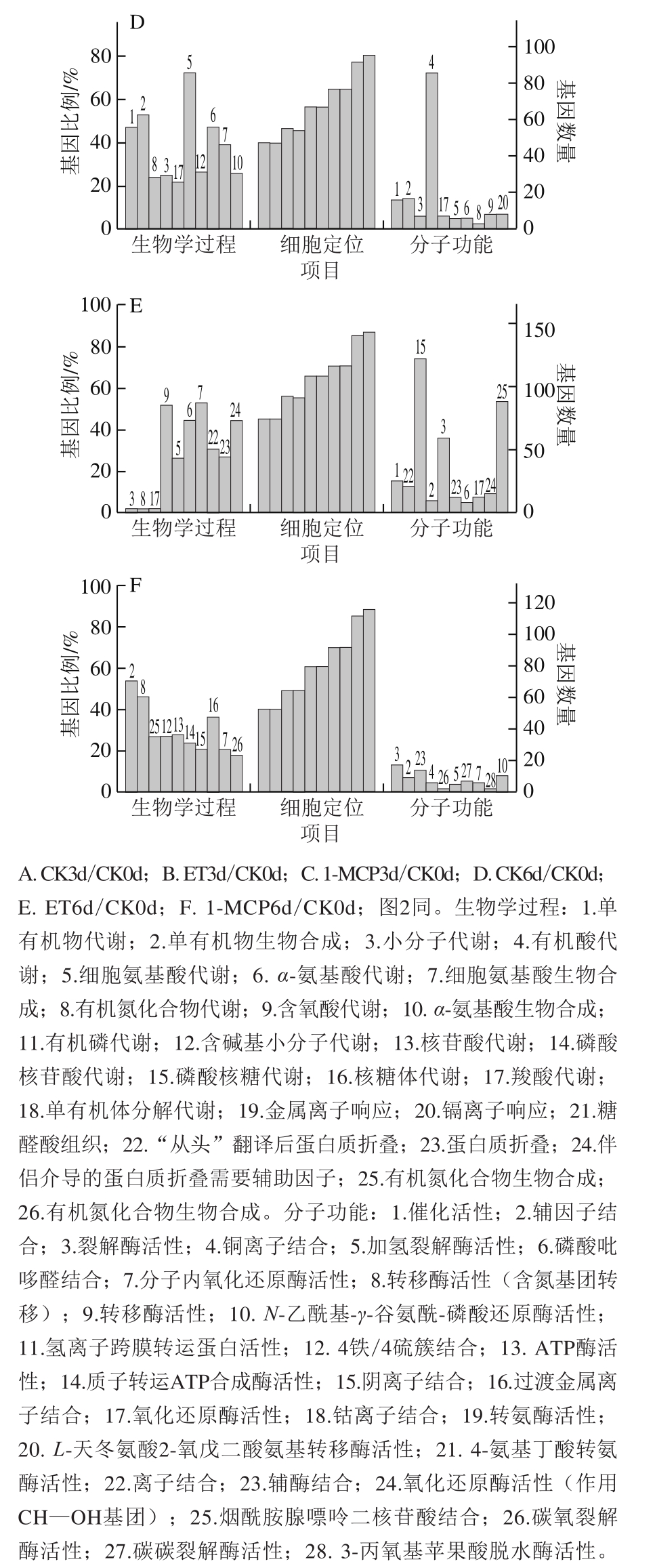
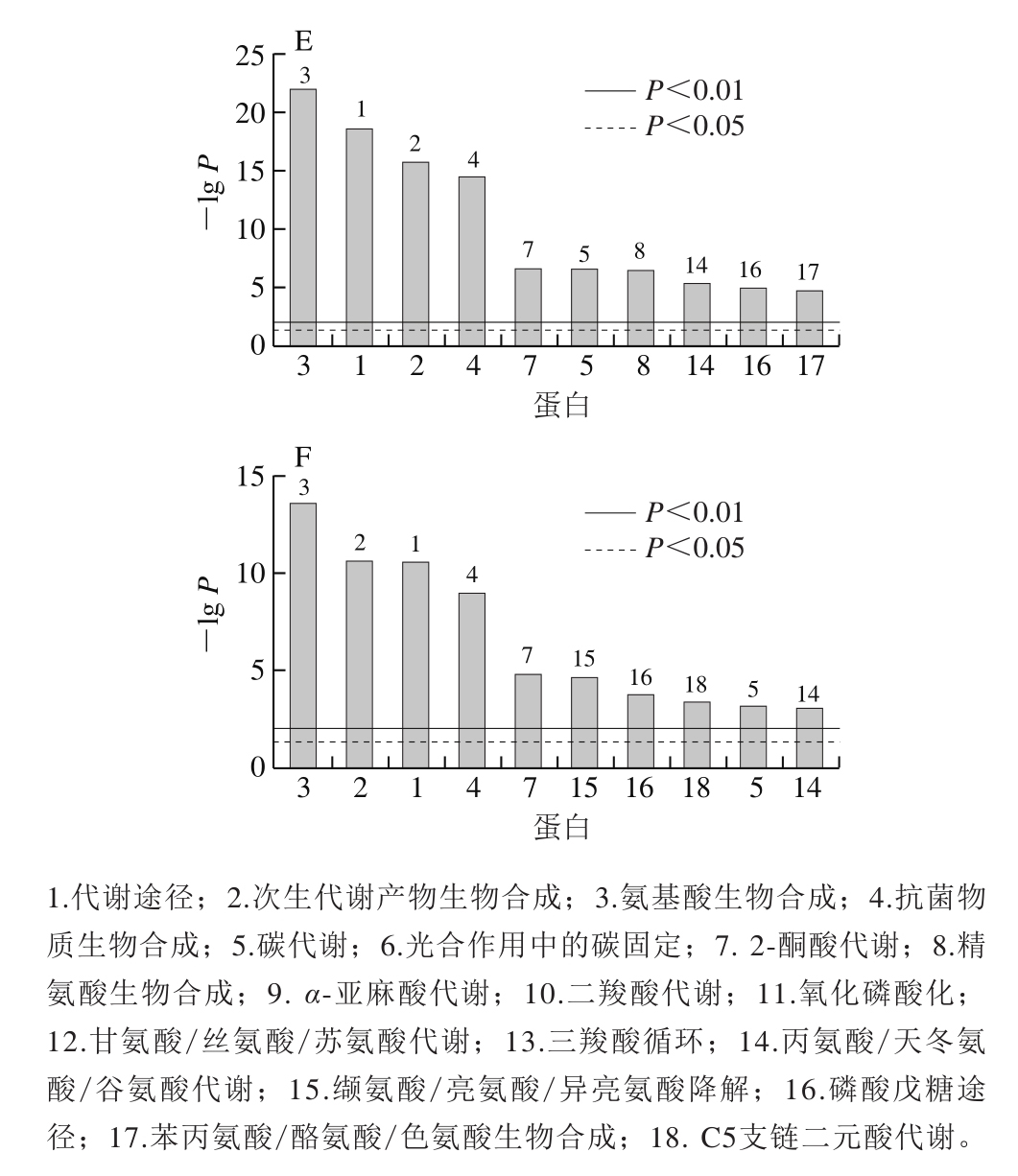
将筛选获得的差异表达蛋白进行GO富集分析和KEGG通路分析,结果见图1、2。图1A、D显示,茭白采后贮藏期间差异表达蛋白参与的生物学过程主要集中在单有机物代谢、单有机物生物合成、小分子代谢、有机酸代谢、细胞氨基酸生物合成、羧酸代谢及含碱基小分子代谢过程;参与的分子功能主要集中于催化活性、辅因子结合、裂解酶活性、磷酸吡哆醛结合、转移酶活性及氧化还原酶活性。ET处理后有机氮化合物代谢、核苷酸代谢、含碱基小分子代谢和蛋白质折叠等生物学过程相关蛋白显著富集,涉及分子功能主要包括氢离子跨膜转运蛋白活性、4铁/4硫簇结合、离子结合和阴离子结合等(图1B、E)。1-MCP处理后有机氮化合物代谢、羧酸代谢、含氧酸代谢、有机氮化合物生物合成、含碱基小分子代谢和核苷酸代谢等过程相关蛋白显著富集,涉及分子功能主要包括阴离子结合、过渡金属离子结合、氧化还原酶活性、辅酶结合和碳氧裂解酶活性等(图1C、F)。以上结果表明,茭白采后衰老响应差异表达蛋白具有多种分子功能,它们参与多类生物学过程,且主要集中在核苷酸代谢、有机酸代谢及含碱基小分子代谢等方面,ET和1-MCP处理显著促进/抑制了部分生物学过程同时诱导了其他生物学过程,这些代谢过程可能在茭白采后衰老调控中发挥重要作用。
图2 A、D显示,茭白采后常温贮藏期间代谢途径、次生代谢产物生物合成、氨基酸生物合成与代谢相关蛋白显著富集。ET和1-MCP处理对茭白采后贮藏期间KEGG通路有显著调控作用。与对照组相比,ET处理组贮藏3 d后氧化磷酸化和甘氨酸/丝氨酸/苏氨酸代谢相关蛋白显著富集(图2B),贮藏6 d后磷酸戊糖途径、丙氨酸/天冬氨酸/谷氨酸代谢、丙氨酸/天冬氨酸/谷氨酸代谢相关蛋白显著富集(图2E)。1-MCP处理组贮藏3 d后三羧酸循环、丙氨酸/天冬氨酸/谷氨酸代谢、缬氨酸/亮氨酸/异亮氨酸降解途径相关蛋白显著富集(图2 C),贮藏6 d后磷酸戊糖途径、C 5支链二元酸代谢、缬氨酸/亮氨酸/异亮氨酸降解、丙氨酸/天冬氨酸/谷氨酸代谢途径相关蛋白显著富集(图2F)。以上结果表明,ET和1-MCP处理显著诱导了茭白采后贮藏期间KEGG通路相关蛋白的改变,这些通路可能与ET和1-MCP调控茭白采后衰老有密切联系。
2.3 差异表达蛋白的生物学功能分析
蔬菜采后失去了养分供应来源,同化作用基本停止,异化作用占主导地位,成为利用自身营养物质进行生命活动的独立个体。呼吸作用是蔬菜采后贮藏过程中最主要的生理代谢活动,是在多种复杂酶系统参与下经过许多中间反应步骤进行的生物氧化还原过程,同时直接联系着其他各种生理生化代谢,从而制约着蔬菜品质变化、抗病能力和贮藏寿命[10]。植物呼吸作用在细胞质基质和线粒体中进行,且线粒体是细胞进行有氧呼吸的主要场所[10]。本实验采用iTRAQ标记结合2D-LC-MS/MS技术,以贮藏0 d(CK0d)为相对定量参考标准,研究比较了茭白采后常温贮藏期间及ET和1-MCP处理后线粒体蛋白质表达谱差异,发现6 个处理组在常温贮藏期间共有315 个蛋白(附表,未列出)表达量变化倍数在2.0 倍以上且重复组数据差异显著(P<0.05),这些差异蛋白广泛参与呼吸代谢及其伴随的物质代谢、能量代谢、活性氧代谢、细胞程序性死亡(programmed cell death,PCD)和细胞结构降解等生物学过程,与前面生物信息学分析结果基本一致。
蔬菜呼吸代谢的底物主要是单糖,淀粉和蔗糖代谢可水解为单糖。本实验中,7 个差异表达蛋白参与淀粉和蔗糖代谢,分别为4-α-葡聚糖转移酶DPE1、α-1,4葡聚糖磷酸化酶、蔗糖合酶1、蔗糖合酶7、β-葡萄糖苷酶6、β-葡萄糖苷酶26及Os03g0278000蛋白。4-α-葡聚糖转移酶可催化1,4-α-D-葡聚糖转移合成多糖、糖蛋白或糖脂的可逆反应[11];α-1,4葡聚糖磷酸化酶能够可逆催化麦芽寡糖、淀粉或糖原转化为1-磷酸葡萄糖的磷酸化反应[12];蔗糖合酶是广泛存在于植物中的一种糖基转移酶,能催化蔗糖的分解及合成反应[13];β-葡萄糖苷酶是糖苷水解酶大家族中的一大类酶,能够水解结合于末端非还原性的β-D-葡萄糖苷键,同时释放出β-D-葡萄糖和相应的配基[14]。茭白常温贮藏期间4-α-葡聚糖转移酶、α-1,4葡聚糖磷酸化酶、β-葡萄糖苷酶6、β-葡萄糖苷酶26和蔗糖合酶7表达量均显著上调表达,蔗糖合酶1和Os03g0278000蛋白显著下调表达。ET处理促进了贮藏6 d时4-α-葡聚糖转移酶、α-1,4葡聚糖磷酸化酶、β-葡萄糖苷酶6和β-葡萄糖苷酶26上调表达,1-MCP处理抑制了贮藏3 d时4-α-葡聚糖转移酶、α-1,4葡聚糖磷酸化酶、β-葡萄糖苷酶6,但促进了β-葡萄糖苷酶26和蔗糖合酶7上调表达。以上结果表明,茭白采后常温贮藏期间淀粉和蔗糖水解加速,1-MCP处理对茭白采后淀粉和蔗糖水解有一定延缓作用,ET处理则相反。
蔬菜呼吸代谢途径有多种,主要包括糖酵解、发酵途径、三羧酸循环、磷酸戊糖途径和乙醛酸循环途径[10]。本实验中,经鉴定有4 个蛋白与糖酵解有关,包括果糖激酶-2、磷酸丙糖异构酶、丙酮酸激酶和丙酮酸脱羧酶;11 个蛋白与三羧酸循环有关,包括丙酮酸脱氢酶E1组成亚基α-1、柠檬酸合酶、2 个异柠檬酸脱氢酶亚基、异柠檬酸脱氢酶、2 个顺乌头酸酶、二氢硫辛酸脱氢酶、3 个苹果酸脱氢酶;10 个蛋白与磷酸戊糖途径有关,包括2 个6-磷酸葡萄糖酸脱氢酶、果糖二磷酸醛缩酶、葡萄糖-6-磷酸异构酶、葡萄糖-6-磷酸/磷酸转运、Os01g0926300、Os05g0524400、Os06g0133800、Os07g0176900和Os08g0154300蛋白;未发现发酵途径相关差异表达蛋白。对上述呼吸代谢途径相关差异表达蛋白进一步分析发现,茭白采后贮藏期间3 个糖酵解相关蛋白显著下调表达,1 个上调表达,三羧酸循环相关蛋白均有上调表达趋势,但仅有苹果酸脱氢酶达到2.0 倍以上差异,而磷酸戊糖途径相关蛋白均显著上调表达;ET处理显著促进了贮藏第3天时糖酵解途径相关蛋白下调表达趋势,贮藏6 d时与对照组无显著差异,同时提高了整个贮藏期间三羧酸循环、磷酸戊糖途径相关蛋白上调表达趋势;1-MCP处理显著促进了整个贮藏期间糖酵解相关蛋白下调表达趋势,同时抑制了三羧酸循环和磷酸戊糖途径相关蛋白的上调表达趋势。这一结果与ET和1-MCP处理对茭白采后贮藏期间呼吸强度的影响结果一致。而有研究表明,合成代谢中多处需要呼吸作用产生的ATP供能,糖酵解和三羧酸循环是植物获得生命活动所需能量的主要途径,尽管磷酸戊糖途径的一些中间产物是许多重要有机物质(核酸、芳香族氨基酸等)生物合成的底物,但其提供的能量远比三羧酸循环少得多[15]。由此推测,茭白采后贮藏期间糖酵解减弱,三羧酸循环和磷酸戊糖途径增强导致的能量状态改变可能与茭白采后衰老有密切联系。
呼吸代谢过程中糖酵解、三羧酸循环和磷酸戊糖途径等脱下的氢被NAD+或黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FDA)所接受,它们进一步经呼吸电子传递链传递给O2生成H2O,同时偶联ADP和Pi进行氧化磷酸化生成ATP[16]。本实验中,19 个蛋白与呼吸电子传递链和氧化磷酸化有关,分别为NADH脱氢酶、电子转移黄素蛋白α亚基、电子转移黄素蛋白β亚基、NADH泛醌氧化还原酶23 kDa亚基、NADH泛醌氧化还原酶75 kDa亚基、黄素蛋白亚基琥珀酸脱氢酶、琥珀酸脱氢酶铁硫亚基1、NADH-细胞色素b5还原酶、细胞色素c、ATP合酶、ATP合酶α亚基、ATP合酶β亚基、ATP合酶γ链、无机焦磷酸酶、Os02g0816800、Os04g0656100、Os07g0645400、Os08g0478200和Os12g0638700蛋白。茭白采后常温贮藏期间仅5 个差异蛋白(黄素蛋白β亚基、ATP合酶α亚基、无机焦磷酸酶、Os04g0656100和Os12g0638700蛋白)上调表达,其余蛋白均下调表达或与贮藏第0天无显著差异;ET处理显著促进了贮藏第3天多数呼吸电子传递链和氧化磷酸化相关蛋白下调表达,贮藏第6天抑制作用减弱,其中ATP合酶α亚基和无机焦磷酸酶表达量显著高于对照组;1-MCP处理延缓了多数呼吸电子传递链和氧化磷酸化相关蛋白下调表达。以上结果表明,茭白采后常温贮藏期间呼吸电子传递和氧化磷酸化减弱,能量供应显著减少,ET处理虽然促进了糖酵解和三羧酸循环,但减弱了氧化磷酸化,从而导致能量亏损,而1-MCP处理有利于维持较高的能量水平。
呼吸电子传递链在进行电子传递过程中,大部分的电子经过末端氧化酶如细胞色素氧化酶和交替氧化酶传给O2生成H2O,但也会有少量电子“漏出”直接与O2结合形成 ·、H2O2和·OH等活性氧自由基(reactive oxygen species,ROS)[17]。在正常生命活动中,这些ROS可及时被细胞内酶类抗氧化系统和非酶类抗氧化系统清除并维持在一定的水平[18]。本实验中,6 个蛋白与酶类抗氧化系统有关,分别为[Cu-Zn]超氧化物歧化酶(superoxide dismutase,SOD)、[Mn]SOD、过氧化氢酶(catalase,CAT)同工酶B、过氧化物还原酶-2F、2 个过氧化物酶(peroxidase,POD);4 个蛋白与非酶类抗氧化系统有关,分别为L-半乳糖酸-1,4-内酯脱氢酶1、谷胱甘肽还原酶、2-半胱氨酸过氧化物还原酶BAS1和硫转移酶。酶类抗氧化系统中,茭白采后常温贮藏期间[Cu-Zn]SOD、[Mn]SOD、CAT同工酶B均显著上调表达,2个过氧化物酶在贮藏第3天上调表达,贮藏6 d时下调表达,过氧化物还原酶-2F的表达在整个贮藏期间变化不大;ET和1-MCP处理在贮藏第3天均显著抑制了[Cu-Zn]SOD、[Mn]SOD、CAT同工酶B上调表达,但促进了2 个POD上调表达,贮藏6 d时ET处理组出现相反的调控作用,这可能是ROS积累的重要原因;1-MCP处理显著促进了整个贮藏期间[Cu-Zn]SOD和2个POD上调表达,提高了ROS清除能力。非酶类抗氧化系统中,谷胱甘肽还原酶、2-半胱氨酸过氧化物还原酶BAS1和硫转移酶上调表达,L-半乳糖酸-1,4-内酯脱氢酶1下调表达。ET处理显著抑制了贮藏3 d时L-半乳糖酸-1,4-内酯脱氢酶1、谷胱甘肽还原酶、硫转移酶表达,促进了2-半胱氨酸过氧化物还原酶BAS1上调表达。上述ROS清除酶类的上调表达可能暗示线粒体受到ROS的氧化胁迫程度提高,ET和1-MCP处理对ROS代谢有调控作用。
·、H2O2和·OH等活性氧自由基(reactive oxygen species,ROS)[17]。在正常生命活动中,这些ROS可及时被细胞内酶类抗氧化系统和非酶类抗氧化系统清除并维持在一定的水平[18]。本实验中,6 个蛋白与酶类抗氧化系统有关,分别为[Cu-Zn]超氧化物歧化酶(superoxide dismutase,SOD)、[Mn]SOD、过氧化氢酶(catalase,CAT)同工酶B、过氧化物还原酶-2F、2 个过氧化物酶(peroxidase,POD);4 个蛋白与非酶类抗氧化系统有关,分别为L-半乳糖酸-1,4-内酯脱氢酶1、谷胱甘肽还原酶、2-半胱氨酸过氧化物还原酶BAS1和硫转移酶。酶类抗氧化系统中,茭白采后常温贮藏期间[Cu-Zn]SOD、[Mn]SOD、CAT同工酶B均显著上调表达,2个过氧化物酶在贮藏第3天上调表达,贮藏6 d时下调表达,过氧化物还原酶-2F的表达在整个贮藏期间变化不大;ET和1-MCP处理在贮藏第3天均显著抑制了[Cu-Zn]SOD、[Mn]SOD、CAT同工酶B上调表达,但促进了2 个POD上调表达,贮藏6 d时ET处理组出现相反的调控作用,这可能是ROS积累的重要原因;1-MCP处理显著促进了整个贮藏期间[Cu-Zn]SOD和2个POD上调表达,提高了ROS清除能力。非酶类抗氧化系统中,谷胱甘肽还原酶、2-半胱氨酸过氧化物还原酶BAS1和硫转移酶上调表达,L-半乳糖酸-1,4-内酯脱氢酶1下调表达。ET处理显著抑制了贮藏3 d时L-半乳糖酸-1,4-内酯脱氢酶1、谷胱甘肽还原酶、硫转移酶表达,促进了2-半胱氨酸过氧化物还原酶BAS1上调表达。上述ROS清除酶类的上调表达可能暗示线粒体受到ROS的氧化胁迫程度提高,ET和1-MCP处理对ROS代谢有调控作用。
研究表明,线粒体ROS代谢状态可能在PCD中占据重要地位[19]。徐建兴[20]进行细胞培养实验发现,10-9 mol/L水平的ROS促进细胞增殖,10-6 mol/L水平的ROS引起PCD,10-3 mol/L水平的ROS引起细胞的损伤死亡,表明ROS代谢状态与PCD存在紧密联系。目前关于植物线粒体内ROS的正常水平尚不清楚,但当ROS水平超出自身清除系统所及范围时会使线粒体处于氧化胁迫状态,引起线粒体呼吸链酶活性下降和膜脂过氧化水平增强以及DNA损伤,这将使呼吸电子传递链不通畅而导致漏电程度增高,造成ROS积累增多和呼吸链进一步受损,如此恶性循环使线粒体的ROS代谢状态不断恶化,进而激活PCD甚至导致细胞坏死[21]。本实验中,尽管没有直接证据证明ROS积累造成线粒体DNA损伤,但经鉴定有5 个差异表达蛋白(组蛋白H2A、H2A.1、H2A.6、H2B.10和H4)与遗传物质的载体染色质相关。线粒体与原核细胞相似,没有染色体,只有染色质[22]。染色质是间期细胞核内由DNA、组蛋白、非组蛋白及少量RNA组成的线性复合结构,是间期细胞遗传物质的载体和存在形式[23]。茭白采后常温贮藏期间5 个组蛋白均显著下调表达,1-MCP处理抑制了5 个组蛋白下调表达趋势,ET处理有相反的结果,暗示1-MCP处理可能通过降低ROS胁迫而减轻DNA损伤。同时,实验还发现1 个蛋白(膜联蛋白V)与PCD有关。膜联蛋白V是一种检测PCD的试剂,尤其在PCD早期检测中灵敏度较高[24]。茭白采后常温贮藏期间膜联蛋白V显著上调表达,贮藏3 d和6 d时分别为贮藏0 d的4.1305 倍和4.9659 倍,表明茭白采后贮藏期间PCD显著升高。1-MCP/ET处理显著抑制/促进了膜联蛋白V上调表达,推测1-MCP处理可能维持了较好的ROS代谢状态和能量供应水平,减轻了DNA损伤程度,从而抑制茭白采后贮藏期间PCD,延缓衰老。
呼吸代谢在提供生命活动所需能量的同时,还会产生许多中间产物,其中有些十分活跃,是进一步合成其他有机物如蛋白质、氨基酸、脂肪、核酸以及次生代谢产物的物质基础,并广泛参与相应的生理过程[10]。本实验中,与蛋白质代谢、氨基酸代谢、脂类代谢、核酸代谢、有机酸代谢及次生代谢相关的差异表达蛋白分别有36、58、15、8、13 个和14 个。对上述代谢相关蛋白的差异表达趋势分析发现,茭白采后常温贮藏期间23 个蛋白质合成相关蛋白中仅有6 个上调表达,而13 个蛋白降解相关蛋白中有11 个上调表达;氨基酸代谢相关差异表达蛋白涉及20 种氨基酸的合成和鸟氨酸循环,多数氨基酸合成相关蛋白在贮藏期间上调表达,鸟氨酸循环相关蛋白均显著上调表达;脂类代谢相关蛋白中3 个甘油酯代谢、2 个脂肪水解、1 个脂肪酸氧化、6 个脂肪酸生物合成、2 个鞘脂代谢相关蛋白均上调表达,1 个磷脂代谢相关蛋白下调表达;核酸代谢相关蛋白中7 个上调表达,1 个下调表达;有机酸代谢相关蛋白中10 个蛋白上调表达,3 个蛋白与贮藏0 d无显著差异;次生代谢相关蛋白中13 个上调表达,1 个下调表达。以上结果表明,茭白采后常温贮藏期间蛋白质合成减弱而降解增强,氨基酸合成和鸟氨酸循环显著提高,脂肪合成和脂质氧化反应均加速,核酸、有机酸及次生代谢也显著加快,这可能与茭白采后贮藏期间物质分解消耗增多,需要更多地合成相应物质以维持正常的生理功能有关。1-MCP处理对上述物质代谢相关蛋白表达有显著的抑制作用,ET处理有促进作用,表明1-MCP处理有利于延缓物质分解消耗。
需要特别指出的是,1-MCP处理在贮藏第3天对绝大多数物质代谢相关蛋白的上调/下调表达有抑制作用,但显著促进了次生代谢相关蛋白细胞色素P450 74A2和脂氧合酶(lipoxygenase,LOX)上调表达。细胞色素P450 74A2编码丙二烯氧合酶,该酶可以转化由LOX催化衍生的脂肪酸氢过氧化物成不稳定的重要脂类中间体丙二烯氧化物,再经丙二烯氧化物环化酶、12-氧-植物二烯酸还原酶等催化生成茉莉酸[25]。茉莉酸类是植物伤反应中的重要信号分子,在植物防御机制中发挥至关重要的作用[25]。那么这是否暗示1-MCP处理提高了茭白采后对外界不良环境的防御能力而延缓衰老,还有待进一步的实验证实。
呼吸代谢中间产物与植物细胞壁物质的合成与也有紧密联系,细胞衰老过程中伴随着细胞壁化学组成的变化[26]。本实验中,经鉴定有3 个蛋白与纤维素合成有关,3 个蛋白与木质素合成有关。茭白采后常温贮藏期间3 个纤维素合成相关蛋白(纤维素合成酶催化亚基1[UDP]、纤维素合成酶催化亚基5[UDP]、纤维素合成酶催化亚基8[UDP])均显著下调表达,而3 个木质素合成相关蛋白(3-磷酸莽草酸1-羧乙烯基转移酶、脱氢奎尼酸脱水酶、肉桂酸-4-羟化酶)均显著上调表达,1-MCP处理对纤维素合成相关蛋白无显著影响,但抑制了木质素合成相关蛋白上调表达,表明茭白采后木质化是其衰老的一个重要特征。这一结果与前期研究中发现茭白贮藏过程中酚类物质和木质素含量显著上升的结果一致。
茭白采后常温贮藏期间可能与衰老相关的其他差异表达蛋白中,信号转导相关蛋白10 个,胁迫响应与防御相关蛋白20 个,内吞作用相关蛋白8 个,吞噬体和辅助因子相关蛋白各3 个,磷酸肌醇代谢、ABC转运、同源重组、蛋白质互作、外膜结构维持和线粒体分裂相关蛋白各1 个。
细胞信号转导是细胞外因子通过与受体(膜受体或核受体)结合,引发细胞内一系列生化反应及蛋白间相互作用,从而影响细胞生物学功能的过程[27]。研究表明,蛋白激酶和蛋白磷酸酶催化的蛋白质磷酸化与去磷酸化在生物体细胞信号转导过程中扮演重要角色,涉及如光合作用、糖代谢、细胞生长发育及基因表达等几乎所有的生理及病理过程。本实验发现6 个信号转导相关蛋白(磷脂酰肌醇磷脂酶C、EF手型钙结合蛋白、类受体蛋白激酶1、MAP3K类蛋白、丝氨酸/苏氨酸蛋白激酶、2C类蛋白磷酸酶41)显著上调表达。一般认为,植物对外界刺激的反应主要是通过细胞质中Ca2+浓度的瞬间变化来传递的[28],磷脂酰肌醇磷脂酶C可诱发Ca2+从胞内储库中释放出来,瞬间增加细胞质中Ca2+浓度[29],EF手型钙结合蛋白通过与Ca2+结合成为激活态,在体内参与多种生物学功能[30]。植物类受体蛋白激酶1属于蛋白激酶的一个亚家族,通过胞外结构域识别病原信号分子,发生磷酸化或去磷酸化反应而开启或关闭下游靶蛋白,将胞外信号转换为胞质信号[31]。MAP3K类蛋白和2C类蛋白磷酸酶41均是丝氨酸/苏氨酸蛋白激酶[32]。丝氨酸/苏氨酸蛋白激酶几乎参与所有生理及病理等逆境胁迫响应和信号转导过程[32]。目前已经发现水稻抗白叶枯病基因Xa21[33]、番茄抗假单孢菌基因Pto[34]和玉米抗叶锈病基因Lr10[35]等抗病基因都编码受体样蛋白激酶,并含有丝氨酸/苏氨酸类蛋白激酶结构域。以上6 个信号转导相关蛋白显著上调表达暗示钙信号途径可能是茭白采后衰老响应的重要途径,茭白常温贮藏期间受到的生物性胁迫显著增加,造成茭白自身防御能力下降,9 个胁迫响应与防御相关蛋白的显著上调表达进一步予以证实。1-MCP处理显著抑制了上述6 个信号转导蛋白上调表达,表明1-MCP处理提高了茭白对外界不良环境的防御能力而使胁迫响应减弱。
与此同时,4 个信号转导相关蛋白(GTP结合蛋白Rab6、线粒体Rho GTP酶、腺苷酸环化酶相关蛋白、C2结构域蛋白)下调表达。G蛋白普遍存在于真核生物细胞中,其中植物细胞信号转导G蛋白主要有3 类:异三聚体G蛋白、小G蛋白和几种特殊的GTP结合蛋白[36],而小G蛋白又包括5 个亚家族,即Ras、Rho、Rab、Arf和Ran,每个亚家族在细胞中起着不同的调控作用[37]。研究表明,Rho家族成员可能参与丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)的细胞信号转导和肌动蛋白重组过程调控,Rab家族参与膜转运过程[38]。腺苷酸环化酶可催化ATP分解生成3’,5’-环磷酸腺苷(cAMP)和焦磷酸(ppi),是cAMP跨膜信号转导体系中的重要效应器[39]。C2结构域蛋白大多定位于细胞膜系统,可能参与了逆境信号转导途径或膜转运[40]。本实验中,GTP结合蛋白Rab6和Rho GTP酶均隶属于小G蛋白Ras超家族,且激活型G蛋白(Gs)可介导受体与腺苷酸环化酶之间的相互作用,从而激活腺苷酸环化酶,调节胞内第二信使cAMP水平,将细胞外信号转变为细胞内信号[41]。本实验中上述4 个蛋白均下调表达,这一结果与王韦华等[1]在研究完整茭白常温贮藏期间总蛋白表达谱差异时发现Ras相关小G蛋白和C2结构域蛋白下调表达结果一致,但与鲜切茭白贮藏期间显著上调表达相反,表明cAMP信号途径与伤胁迫响应密切相关但对衰老的响应并不明显。
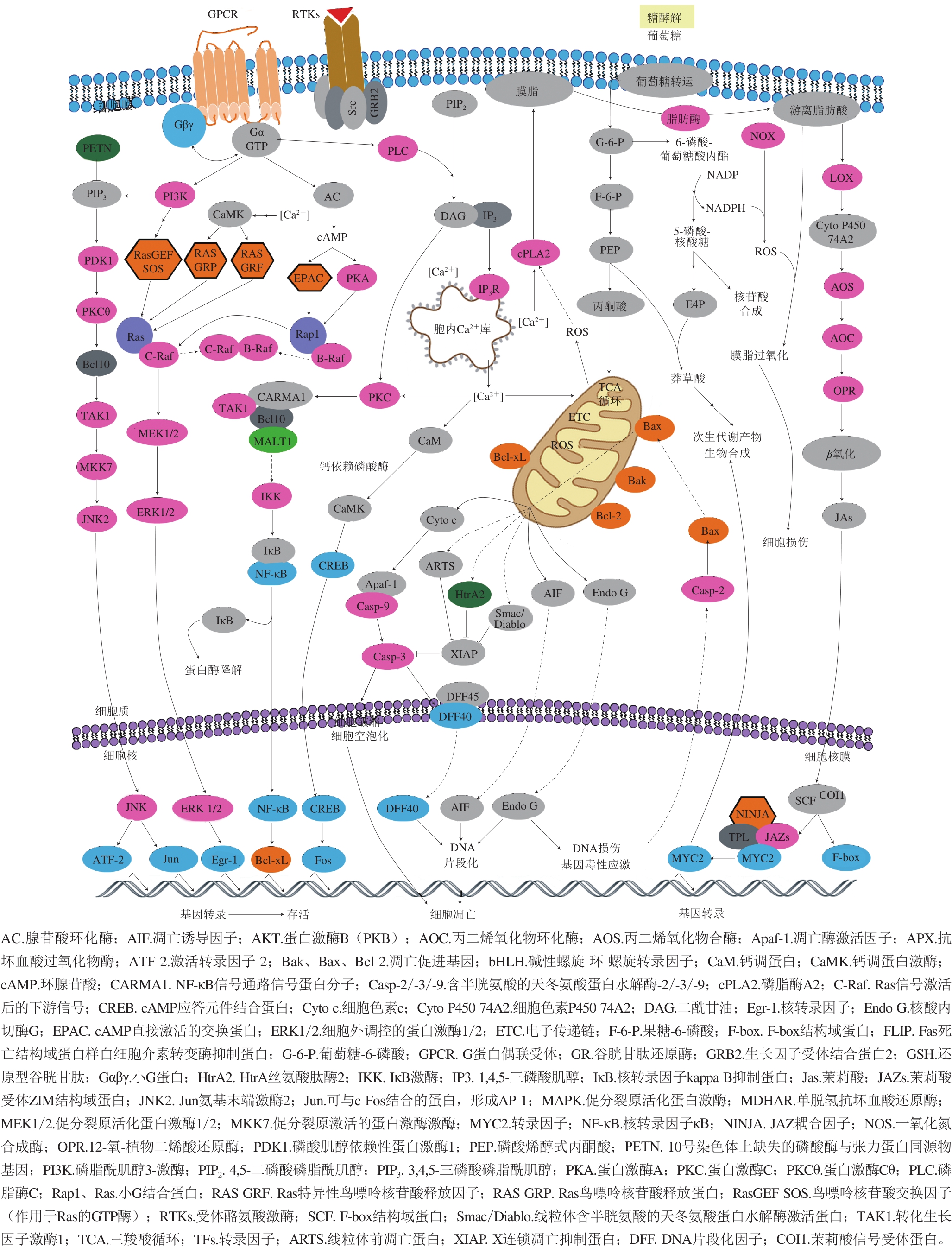
综合上述分析,参考Cell Signaling Technology, Inc.(https://www.cellsignal.com/contents/ research/science/science)所提供的已知信号转导相关通路,推测茭白采后衰老过程中可能通过ROS激活Ca2+/MAPKs、细胞色素c和茉莉酸等信号参与茭白采后衰老调控,其可能的信号转导通路见图3。
内吞作用、吞噬体、辅助因子相关蛋白、磷酸肌醇代谢、ABC转运、同源重组及蛋白质互作等相关蛋白中仅有类MDR ABC转运蛋白、发夹结构1结合蛋白和Os05g0303000蛋白显著上调表达,其余蛋白均显著下调表达,但这些蛋白与茭白采后衰老的确切关系尚不清楚,还有待进一步深入研究。
此外,39 个差异表达蛋白经鉴定既没有确切的名称,也没有相应的KEGG通路,其中22 个蛋白在茭白采后常温贮藏期间上调表达,17 个蛋白下调表达,ET处理对少数蛋白的表达趋势有促进作用,1-MCP对多数蛋白的表达趋势有抑制作用,表明它们可能与茭白采后衰老存在一定联系。
3 结 论
应用iTRAQ技术共鉴定获得茭白线粒体蛋白质1 908 个,以贮藏第0天(CK0d)为相对定量参考标准,茭白贮藏期间及ET和1-MCP处理茭白线粒体表现2.0 倍以上显著差异(P<0.05)的蛋白质共计315 个。
代谢途径、次生代谢产物生物合成、氨基酸生物合成与代谢、核苷酸代谢、含碱基小分子代谢途径等可能与茭白采后衰老有关,三羧酸循环、氧化磷酸化、磷酸戊糖途径、C5支链酸代谢及氨基酸代谢途径可能在茭白采后衰老过程中发挥重要作用。
茭白采后碳水化合物水解加速,磷酸戊糖途径加强而糖酵解途径和氧化磷酸化减弱,导致能量合成减少同时形成氧化胁迫,这可能激活Ca2+/MAPKs、细胞色素c和茉莉酸等信号途径,造成初级代谢紊乱和次级代谢产物(如木质素)积累,从而促进细胞凋亡或细胞坏死,最终加速衰老。
茭白采后衰老过程中可能通过ROS积累激活Ca2+/MAPKs、细胞色素c和茉莉酸等信号进行调控,而cAMP信号途径与伤胁迫响应密切相关但对衰老的响应并不明显,茉莉酸信号和磷酸肌醇信号可能协同钙信号在茭白采后衰老过程中发挥作用。
然而,以上差异表达蛋白的生物学功能及其相互作用仍待进一步验证,相关通路与茭白采后衰老的确切关系还需深入研究。
参考文献:
[1] 王韦华, 姜丽, 陈伟, 等. 完整和鲜切茭白常温贮藏期间的比较蛋白质组学研究[J]. 食品科学, 2018, 39(13): 7-16. doi:10.7506/spkx1002-6630-201813002.
[2] PORAT R, LICHTER A, TERRY L A, et al. Postharvest losses of fruit and vegetables during retail and in consumers’ homes:quantifications, causes, and means of prevention[J]. Postharvest Biology & Technology, 2018, 139: 135-149. doi:10.1016/j.postharvbio.2017.11.019.
[3] CAO S F, YANG Z F, ZHENG Y H, et al. Effect of 1-methylcyclopene on senescence and quality maintenance of green bell pepper fruit during storage at 20 ℃[J]. Postharvest Biology & Technology, 2012,70: 1-6. doi:10.1016/j.postharvbio.2012.03.005.
[4] XIE Q L, HU Z L, ZHU Z G, et al. Overexpression of a novel MADS-box gene SlFYFL delays senescence, fruit ripening and abscission in tomato[J]. Scientif i c Reports, 2014, 4(1): 1-10. doi:10.1038/srep04367.
[5] WANG C, CHU J J, FU L L, et al. iTRAQ-based quantitative proteomics reveals the biochemical mechanism of cold stress adaption of razor clam during controlled freezing-point storage[J]. Food Chemistry, 2018, 247: 73-80. doi:10.1016/j.foodchem.2017.12.004.
[6] MA J, SHENG H C, LI X L, et al. iTRAQ-based proteomic analysis reveals the mechanisms of silicon-mediated cadmium tolerance in rice(Oryza sativa) cells[J]. Plant Physiology and Biochemistry, 2016, 104:71-80. doi:10.1016/j.plaphy.2016.03.024.
[7] 袁建丰, 李林林, 孙敏华, 等. iTRAQ标记技术及其在微生物比较蛋白质组学中的研究进展[J]. 中国预防兽医学报, 2013, 35(10): 859-862. doi:10.3969/j.issn.1008-0589.2013.10.21.
[8] WANG Y Q, ZHANG L J, ZHU S J. 1-Methylcyclopropene (1-MCP)-induced protein expression associated with changes in Tsai Tai(Brassica chinensis) leaves during low temperature storage[J].Postharvest Biology & Technology, 2014, 87: 120-125. doi:10.1016/j.postharvbio.2013.08.016.
[9] 杜传来, 罗海波, 彭昕, 等. 茭白线粒体蛋白双向电泳体系建立[J]. 南方农业学报, 2016, 47(3): 332-336. doi:10.3969/j:issn.2095-1191.2016.03.332.
[10] AGARWAL G, CHOUDHARY D, SINGH V P, et al. Role of ethylene receptors during senescence and ripening in horticultural crops[J].Plant Signaling & Behavior, 2012, 7(7): 827-846. doi:10.4161/psb.20321.
[11] TAKAHA T, YANASE M, OKADA S, et al. Disproportionating enzyme (4-alpha-glucanotransferase; EC 2.4.1.25) of potato: purif i cation,molecular cloning, and potential role in starch metabolism[J]. Journal of Biological Chemistry, 1993, 268(2): 1391-1396.
[12] STEUP M, SCHÄCHTELE C. α-1,4-glucan phosphorylase forms from leaves of spinach (Spinacia oleracea L.): II. peptide patterns and immunological properties. a comparison with other phosphorylase forms[J]. Planta, 1986, 168(2): 222-231. doi:10.1007/BF00391219.
[13] SCHMÖLZER K, GUTMANN A, DIRICKS M, et al. Sucrose synthase: a unique glycosyltransferase for biocatalytic glycosylation process development[J]. Biotechnology Advances, 2016, 34(2): 88-111. doi:10.1016/j.biotechadv.2015.11.003.
[14] ROJAS M, TIESSEN A, ASCENCIO F, et al. Two Promoters of beta-glucosidase paralogs (ZmBGlu2 and ZmBGlu5) highly active in tropical young maize hybrid seedlings[J]. Plant Molecular Biology Reporter, 2015, 33(6): 1666-1674. doi:10.1007/s11105-015-0863-0.
[15] LI L, LV F Y, GUO Y Y, et al. Respiratory pathway metabolism and energy metabolism associated with senescence in postharvest broccoli(Brassica oleracea L. var. italica) florets in response to O2/CO2 controlled atmospheres[J]. Postharvest Biology and Technology, 2016,111: 330-336. doi:10.1016/j.postharvbio.2015.09.032.
[16] LAPUENTE-BRUN E, MORENO-LOSHUERTOS R, ACÍN-PÉREZ R, et al. Supercomplex assembly determines electron flux in the mitochondrial electron transport chain[J]. Science, 2013, 340: 1567-1570. doi:10.1126/science.1230381.
[17] MRÁČEK T, HOLZEROVÁ E, DRAHOTA Z, et al. ROS generation and multiple forms of mammalian mitochondrial glycerol-3-phosphate dehydrogenase[J]. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 2014, 1837(1): 98-111. doi:10.1016/j.bbabio.2013.08.007.
[18] ZHAO J, XIE X B, SHEN X, et al. Effect of sunlight-exposure on antioxidants and antioxidant enzyme activities in ‘d’Anjou’ pear in relation to superficial scald development[J]. Food Chemistry, 2016,210: 18-25. doi:10.1016/j.foodchem.2016.04.045.
[19] YUN L J, CHEN W L. SA and ROS are involved in methyl salicylateinduced programmed cell death in Arabidopsis thaliana[J]. Plant Cell Reports, 2011, 30(7): 1231-1239. doi:10.1007/s00299-011-1031-0.
[20] 徐建兴. 呼吸链电子漏在细胞凋亡中的作用[J].生物化学与生物物理进展, 2003, 30(4): 655-657. doi:10.3321/j.issn:1000-3282.2003.04.029.
[21] HAUER M H, SEEBER A, SINGH V, et al. Histone degradation in response to DNA damage enhances chromatin dynamics and recombination rates[J]. Nature Structural & Molecular Biology, 2017,24(2): 99-107. doi:10.1038/nsmb.3347.
[22] VENKATESH S, WORKMAN J L. Histone exchange, chromatin structure and the regulation of transcription[J]. Nature Reviews Molecular Cell Biology, 2015, 16(3): 178-189. doi:10.1038/nrm3941.
[23] BURGESS D J. Chromatin: histone influences on chromosomal translocations[J]. Nature Reviews Molecular Cell Biology, 2015,16(8): 452-453. doi:10.1038/nrm4028.
[24] DEMIDCHIK V, STRALTSOVA D, MEDVEDEV S S, et al. Stressinduced electrolyte leakage: the role of K+-permeable channels and involvement in programmed cell death and metabolic adjustment[J].Journal of Experimental Botany, 2014, 65(5): 1259-1270.doi:10.1093/jxb/eru004.
[25] LI C Y, LUO C, ZHOU Z H, et al. Gene expression and plant hormone levels in two contrasting rice genotypes responding to brown planthopper infestation[J]. BMC Plant Biology, 2017, 17(1): 57.doi:10.1186/s12870-017-1005-7.
[26] LUO H B, JIANG J, ZHANG L, et al. Effect of gibberellic acid and 6-benzylaminopurine on lignification of fresh-cut Zizania latifolia during refrigerated (1 ℃) storage[J]. Journal of Food Processing and Preservation, 2013, 37(5): 864-869. doi:10.1111/j.1745-4549.2012.00743.x.
[27] ZHANG H, ZHOU C. Signal transduction in leaf senescence[J]. Plant Molecular Biology, 2013, 82(6): 539-545. doi:10.1007/s11103-012-9980-4.
[28] 施小龙, 邢更妹, 汪丽虹, 等. 植物钙信号系统与体细胞胚发生[J]. 生命科学, 2002, 14(5): 302-304; 271. doi:10.3969/j.issn.1004-0374.2002.05.013.
[29] ZHOU C J, AKHTAR R A, ABDEL-LATIF A A. Purification and characterization of phosphoinositide-specific phospholipase C from bovine iris sphincter smooth muscle[J]. Biochemical Journal, 1993,289(2): 401-409. doi:10.1042/bj2890401.
[30] SUBPIPATTANA P, GRAMS R, VICHASRI-GRAMS S. Analysis of a calcium-binding EF-hand protein family in Fasciola gigantica[J].Experimental Parasitology, 2012, 130(4): 364-373. doi:10.1016/j.exppara.2012.02.005.
[31] OSAKABE Y, MIZUNO S, TANAKA H, et al. Overproduction of the membrane-bound receptor-like protein kinase 1, RPK1,enhances abiotic stress tolerance in Arabidopsis[J]. Journal of Biological Chemistry, 2010, 285(12): 9190-9201. doi:10.1074/jbc.M109.051938.
[32] RODRIGUEZ P L. Protein phosphatase 2C (PP2C) function in higher plants[J]. Plant Molecular Biology, 1998, 38(6): 919-927.doi:10.1023/A:1006054607850.
[33] 瓮巧云, 宋晋辉, 张爱香. 谷子丝/苏氨酸蛋白激酶类抗病基因同源序列的克隆与分析[J]. 河南农业科学, 2012, 41(6): 106-108.doi:10.3969/j.issn.1004-3268.2012.06.024.
[34] MENDES B M J, CARDOSO S C, BOSCARIOL-CAMARGO R L,et al. Reduction in susceptibility to Xanthomonas axonopodis pv. citri in transgenic Citrus sinensis expressing the rice Xa21 gene[J]. Plant Pathology, 2010, 59(1): 68-75. doi:10.1111/j.1365-3059.2009.02148.x.
[35] MARTIN G B, BROMMONSCHENKEL S H, CHUNWONGSE J,et al. Map-based cloning of a protein kinase gene conferring disease resistance in tomato[J]. Science, 1993, 262: 1432-1436. doi:10.1126/science.7902614.
[36] HUROWITZ E H, MELNYK J M, CHEN Y J, et al. Genomic characterization of the human heterotrimeric G protein alpha, beta,and gamma subunit genes[J]. DNA Research, 2000, 7(2): 111-120.doi:10.1093/dnares/7.2.111.
[37] 张之为, 赵君, 樊明寿, 等. 植物小G蛋白的研究进展[J].西北植物学报, 2009, 29(3): 622-628. doi:10.3321/j.issn:1000-4025.2009.03.031.
[38] TAKAI Y, SASAKI T, MATOZAKI T. Small GTP-binding proteins[J]. Physiology Reviews, 2001, 81(1): 153-208. doi:10.1152/physrev.2001.81.1.153.
[39] KAWAMUKAI M. Adenylyl cyclase associated protein (CAP) and their homologs[J]. The Journal of Japanese Biochemical Society, 1996,68(1): 31-35.
[40] ANTAL C E, CALLENDER J A, KORNEV A P, et al. Intramolecular C2 domain-mediated autoinhibition of protein kinase C βII[J]. Cell Reports, 2015, 12(8): 1252-1260. doi:10.1016/j.celrep.2015.07.039.
[41] GEHRING C. Adenyl cyclases and cAMP in plant signaling-past and present[J]. Cell Communication and Signaling, 2010, 8(1): 1-5.doi:10.1186/1478-811X-8-15.
Effect of 1-Methyleyelopropene and Ethylene on Mitochondrial Proteome Changes in Postharvest Zizania latifolia Analyzed Using iTRAQ Labeling Technique
LUO Haibo1, ZHOU Tao1, KONG Xiaoxue1, TAO Mingxuan1, JIANG Li2, WANG Libin3, WANG Weihua2, YU Zhifang2,*
(1. Ginling College, Nanjing Normal University, Nanjing 210097, China; 2. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China; 3. College of Horticulture, Nanjing Agricultural University, Nanjing 210095, China)
Abstract: In order to explore the molecular mechanism of postharvest senescence of Zizania latifolia, the effect of 1-methyleyelopropene (1-MCP) and ethylene (ET) treatments on mitochondrial proteome changes in postharvest Z. latifolia after storage at 25 ℃ for 0 (control),3 and6 days were investigated by using isobaric tags for relative and absolute quantif i cation (iTRAQ) labeling. The results showed that a total of 1 908 proteins were identif i ed with at least two peptides, of which 315 proteins showed an 2.0-fold change in their relative quantitation in the untreated, ET-treated, 1-MCP-treated groups at day3 and6 of storage as compared to their counterparts at day 0, with statistically signif i cant differences being observed between results from replicate experiments (P < 0.05). A bioinformatics analysis of these differentially expressed proteins revealed that metabolic pathways, the biosynthesis of secondary metabolites, the biosynthesis and metabolism of amino acids, nucleotide metabolism, and the metabolic pathways of nucleobase-containing small molecules were related to postharvest senescence of Z. latifolia and that the citrate cycle, oxidative phosphorylation (OXPHOS), the pentose phosphate pathway (PPP), C5-branched dibasic acid metabolism and amino acid metabolism may play critical roles in postharvest senescence of Z. latifolia. Based on their biological functions, postharvest senescence of Z. latifolia may be closely associated with accelerated carbohydrate hydrolysis as well as strengthened PPP and weakened glycolysis and OXPHOS, leading to reduced energy supply and aggravated oxidative damage and consequently activating Ca2+/MAPKs,cytochrome c and jasmonate signaling pathways to cause primary metabolic disturbance and an increase in the accumulation of secondary metabolites such as lignin and consequently induce cell apoptosis or necrosis and fi nally accelerate senescence.
Keywords: Zizania latifolia; mitochondria; isobaric tags for relative and absolute quantif i cation; bioinformatics; senescence
收稿日期:2018-05-31
基金项目:国家自然科学基金青年科学基金项目(31401612);浙江省自然科学基金项目(LY14C200005)
第一作者简介:罗海波(1979—)(ORCID: 0000-0001-5978-707X),男,副教授,博士,研究方向为果蔬采后生物学与处理技术。E-mail: luohaibo_1216@126.com
*通信作者简介:郁志芳(1960—)(ORCID: 0000-0003-0576-1186),男,教授,博士,研究方向为果蔬采后生物学与贮藏加工。E-mail: yuzhifang@njau.edu.cn
doi:10.7506/spkx1002-6630-20180531-447
中图分类号:Q816
文献标志码:A
文章编号:1002-6630(2019)01-0216-10
引文格式:罗海波, 周涛, 孔晓雪, 等. 基于iTRAQ技术研究采后1-甲基环丙烯和乙烯利处理对茭白线粒体蛋白质组变化的影响[J].食品科学, 2019, 40(1): 216-225. doi:10.7506/spkx1002-6630-20180531-447. http://www.spkx.net.cn
LUO Haibo, ZHOU Tao, KONG Xiaoxue, et al. Effect of 1-methyleyelopropene and ethylene on mitochondrial proteome changes in postharvest Zizania latifolia analyzed using iTRAQ labeling technique[J]. Food Science, 2019, 40(1): 216-225.(in Chinese with English abstract)doi:10.7506/spkx1002-6630-20180531-447. http://www.spkx.net.cn


 ·、H
·、H