香菇,又名香蕈、冬菇,系菌门、担子菌亚门、层菌纲、伞菌目、侧耳科、香菇属子实体。香菇为高蛋白低脂食品,具有极高的营养价值[1]和药用价值[2-7],又因其肉质脆嫩、香气独特,深受各地人们喜爱,在民间素有“山珍”美称[8]。然而,鲜香菇水分含量较高,新陈代谢较其他果蔬尤为旺盛,且表面缺少保护组织,极易受到微生物侵染和机械损伤。在常温下贮藏2~3 d,子实体便会出现褐变、老化、产生异味等劣变现象。食用菌在采后部分组织会出现纤维化现象,这主要是贮藏期间木质素积累导致发生木质化[9]。木质素是植物细胞壁结构的主要成分。木质化会导致食用菌纤维变粗、口感下降,但同时木质化在植物的生长、发育过程中起到非常重要的生理作用。所以通过研究香菇木质化转变机制,可以更好地了解香菇贮藏过程中一系列生理变化,为更好地保持香菇质地、口感提供理论依据。
亚精胺,又称三盐酸亚精胺,是一种生物合成的、具有生物活性的天然物质。近几年研究表明,亚精胺在生物机体内可起到对细胞增殖、衰老的调控作用[10]及对神经系统的保护作用[11]。在果蔬的采前研究中发现,亚精胺对植物的生长和发育有重要的调控作用[12]。在果蔬采后贮藏研究中发现,亚精胺可以抑制膜过氧化,增强膜稳定性[13];还可以清除自由基、保护细胞膜[14];也能够影响体内激素的变化,延缓衰老[15]。目前已有研究表明,亚精胺处理哈密大枣[16]、中华猕猴桃[17]和兰州大接杏[18]可以延缓其衰老并延长贮藏期,达到保鲜的目的。但是,目前对于香菇木质化过程,以及外源亚精胺处理对于香菇木质化影响的研究还较少;故本实验以香菇为实验材料,采用适合质量浓度的外源亚精胺负压渗透处理香菇子实体,分析香菇木质化转变过程中的相关生理指标变化,探讨贮藏过程中香菇木质化转变的过程,以及外源亚精胺处理对香菇木质化过程的影响。
新鲜香菇(Lentinula edodes),采购自山东省淄博市,品种为‘申香10号’,采后2 h内使用4 ℃冷藏车运回山东理工大学农业工程与食品科学学院贮藏库。挑选成熟度良好、朵形完整、个体大小均匀、无破损、无病虫害、无褐变、菌盖平滑完整、菌褶完整的香菇为实验材料。
亚精胺(生物试剂) 上海源叶生物有限公司;福林-酚 上海市荔达生物科技有限公司;3-甲基-2-苯并噻唑酮-腙-盐酸盐(3-methyl-2-benzothiazolinonehydrazone hydrochlide hydrate,MBTH) 天津市光复精细化工研究所;几丁质(试剂级) 合肥博美生物科技有限责任公司;其他试剂均为国产分析纯。
DF-101S集热式恒温加热磁力搅拌器 巩义市予华仪器有限责任有限公司;TA-XT Plus型质构仪英国Stable Micro Systems公司;TGL-20M高速台式冷冻离心机 湖南湘仪实验室仪器开发有限公司;Freezone®冷冻干燥机 美国Labconco公司;UV2550紫外-可见光分光光度计 日本岛津公司。
1.3.1 样品处理
实验分为3 个处理组(亚精胺溶液质量浓度分别为10、15、20 mg/L),以未经任何处理的香菇作为对照组。通过负压渗透(真空度0.04 MPa、处理时间20 s)的方式,将不同质量浓度的亚精胺溶液渗入子实体内。之后自然晾干,在4 ℃贮藏,贮藏期为16 d。每2 d取样1 次,每次每个重复取5 个香菇,用于测定硬度、总酚含量及苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)、过氧化物酶(peroxidase,POD)活力,同时每4 d每次每个重复再取5 个香菇,使用液氮冷冻,存于-80 ℃超低温冰箱中,用于测定木质素、纤维素、几丁质含量,每个指标重复测定3 次,每组设3 个平行。
1.3.2 指标测定
1.3.2.1 硬度的测定
硬度选用质构仪测定,使用P/2探头(直径2 mm)进行穿刺实验。测定参数为:测前速率2 mm/s;测试速率2 mm/s;测后速率5 mm/s;测定深度10 mm;触发力为5.0 g。
1.3.2.2 木质素含量的测定
根据Yang Wenjian等[19]的方法并加以修改,将0.5 g冻干样品加入到20 mL、体积分数95%乙醇溶液中,在4 ℃条件下提取10 min。并在4 ℃条件下以12 000 r/min离心15 min,沉淀在60 ℃下干燥24 h。将50 mg干燥的残余物置于10 mL离心管中,分别加入5 mL2 mol/L HCl和0.5 mL巯基乙酸,将样品在100 ℃条件下水浴加热6 h。冷却至室温,以12 000 r/min离心30 min,所得沉淀用蒸馏水洗涤3 次,再将沉淀于室温条件下用5 mL 1 mol/L NaOH浸泡18 h以提取木质素-巯基乙酸复合物,随后在4 ℃条件下以10 000 r/min离心15 min。将上清液转移至试管中,向试管中加入1 mL浓HCl,并使木质素-巯基乙酸复合物在4 ℃条件下沉淀4 h,然后在10 000 r/min离心10 min。最后,将沉淀溶于1 mL 1 mol/L NaOH溶液中。以1 mL 1 mol/L NaOH作对照,使用紫外-可见光分光光度计在280 nm波长处测定吸光度,以每克冻干样品在280 nm波长处吸光度(A280 nm)表征木质素含量。
1.3.2.3 几丁质含量的测定
参考Vetter[20]的方法测定几丁质含量。将30 mg冻干样品加入到5 mL6 mol/L HCl中,106 ℃条件下水解24 h。冷却至室温后,将400 μL质量分数2.5% NaNO2加入到水解的样品中。将混合物在室温下放置15 min,并加入200 μL质量分数12.5%氨基磺酸铵,摇匀。5 min后,再加入200 μL质量分数0.25% MBTH,并在37 ℃条件下水浴30 min。然后加入200 μL质量分数0.5% FeCl3溶液,在37 ℃条件下水浴5 min。最后将样品冷却至室温。以1 mL蒸馏水作对照,使用紫外-可见光分光光度计在650 nm波长处测定吸光度(A650 nm),并用所测得的吸光度表征几丁质含量。
1.3.2.4 纤维素含量的测定
纤维素含量的测定参考Cai Chong等[21]的方法,并作修改。将0.5 g冻干样加入到含有1 g/100 mL十二烷基硫酸钠(sodium dodecyl sulfate,SDS)的5 mL 50 mmol/L Tris-HCl溶液(pH 7.2)中提取,并用恒温振荡器振荡3 h。振荡完毕后,以12 000 r/min离心20 min,将沉淀物依次用水、体积分数95%乙醇溶液和丙酮洗涤3 次,随后用吹风机风干。待完全风干后,取50 mg样品,用5 mL2 mol/L三氟乙酸在120 ℃处理90 min,并用水和体积分数95%乙醇溶液洗涤3 次。然后将残余物在37 ℃条件下在体积分数67%硫酸中水解1 h,取出上清液,并用去离子水等比例稀释。随后,将1 mL稀释液与9 mL冷蒽酮在沸水浴中处理20 min,然后经冰浴冷却5 min、室温放置10 min后,使用紫外-可见光分光光度计在620 nm波长处测定吸光度。根据已有的葡萄糖标准曲线对纤维素含量进行定量,结果以干质量表示。
1.3.2.5 总酚含量的测定
总酚含量的测定参考李艳杰等[22]的方法。将1 g香菇加入到20 mL体积分数95%甲醇溶液中,在60 ℃条件下提取30 min,随后在4 ℃条件下10 000 r/min离心10 min,取上清液。向剩余残渣中再加入20 mL体积分数95%甲醇溶液,再次离心(10 000 r/min、10 min,4 ℃)。将2 次上清液合并,充分混匀。取混匀后的上清液0.4 mL,加入2 mL体积分数10%福林-酚试剂(现配现用),将两者混匀,在避光条件下放置5 min后再加入1.8 mL质量分数7.5% Na2CO3溶液,混匀后在常温条件下避光放置1 h,使用紫外-可见光分光光度计在765 nm波长处测定吸光度。重复测定3 次。根据已有的没食子酸标准曲线对总酚含量进行定量,结果以干质量表示。
1.3.2.6 PAL活力的测定
PAL活力的测定参照Koukol等[23]的方法,并略作修改。称取2 g香菇置于预冷研钵中,加入事先预冷的4 mL 0.2 mol/L pH 8.8的硼酸钠缓冲液,冰浴研磨。4 ℃条件下,8 000 r/min离心20 min,取上清液作为酶提取液。反应体系:2.2 mL 0.05 mol/L L-苯丙氨酸、0.8 mL酶提取液。加入酶提取液后,迅速摇匀,以硼酸钠缓冲液代替粗酶液作为空白对照,立即使用紫外-可见光分光光度计测定在290 nm波长处的吸光度(A1)作为反应的初始值。然后在37 ℃水浴中保温90 min,保温结束后滴加0.2 mL6 mol/L HCl终止反应。以硼酸钠缓冲液代替粗酶液作为空白对照,再次使用紫外-可见光分光光度计测定在290 nm波长处的吸光度(A2)作为反应的终止值。以每克鲜样每小时在290 nm处吸光度变化0.01为一个酶活力单位(U),PAL活力计算见下式。
1.3.2.7 POD活力的测定
POD活力的测定采用愈创木酚法[24]。取2 g香菇,加5 mL 0.05 mol/L的磷酸盐缓冲溶液(pH 7.0,含质量分数3%聚乙烯吡咯烷酮),冰浴研磨,匀浆离心(100 00 r/min、20 min,4 ℃),取上清液。反应体系:2 mL 0.1 mol/L pH 5.4磷酸盐缓冲液、1 mL质量分数0.25%愈创木酚溶液、0.2 mL体积分数0.75%的H2O2溶液和0.2 mL上清液。用0.05 mol/L的磷酸盐缓冲溶液(pH 7.0,含质量分数3%聚乙烯吡咯烷酮)代替酶液作空白,充分混匀,立即使用紫外-可见光分光光度计测定3 min内在470 nm波长处吸光度的变化,以每克鲜样每分钟吸光度上升0.001作为一个酶活力单位(U)。POD活力单位为U/g。
采用Excel 2016软件计算平均值、标准差,并作图,采用SPSS 20.0软件进行单因素方差分析(Oneway ANOVA),用最小显著性差异法(least significant difference,LSD)进行显著性分析(P<0.05表示差异显著),用Pearson法进行相关性分析。

图1 不同质量浓度亚精胺处理对香菇贮藏过程中硬度的影响
Fig.1 Effect of different contents spermidine treatment on hardness of shiitake mushrooms during storage
硬度是香菇品质的一个重要指标。如图1所示,不同质量浓度亚精胺处理组与对照组相比,香菇硬度没有明显差异。其中,所有处理组香菇在贮藏期的前8 d硬度出现波动上升的趋势,8~10 d明显下降,此后变化又趋于平稳。由此可说明亚精胺处理不能抑制香菇硬度的下降。

图2 不同质量浓度亚精胺处理对香菇贮藏过程中木质素含量的影响
Fig.2 Effect of different contents spermidine treatment on lignin content of shiitake mushrooms during storage
木质素作为植物次生代谢的产物,其含量高低直接影响着果蔬的品质。如图2所示,前4 d,对照组和较低质量浓度亚精胺处理组的香菇木质素含量升高,4~8 d略有降低,之后再上升,到12 d时达到最大值,随后又开始下降。16 d时,对照组的木质素含量最低。木质素含量升高是香菇木质化的表现,在贮藏过程中,对照组和10、15 mg/L的亚精胺处理组均分别在4 d和12 d出现了两次较明显的木质化高峰,而20 mg/L亚精胺处理组的木质化高峰分别在8 d和16 d,较其他处理组和对照组的木质化进程晚。这说明20 mg/L的亚精胺处理可以延缓香菇的木质化高峰的到来。
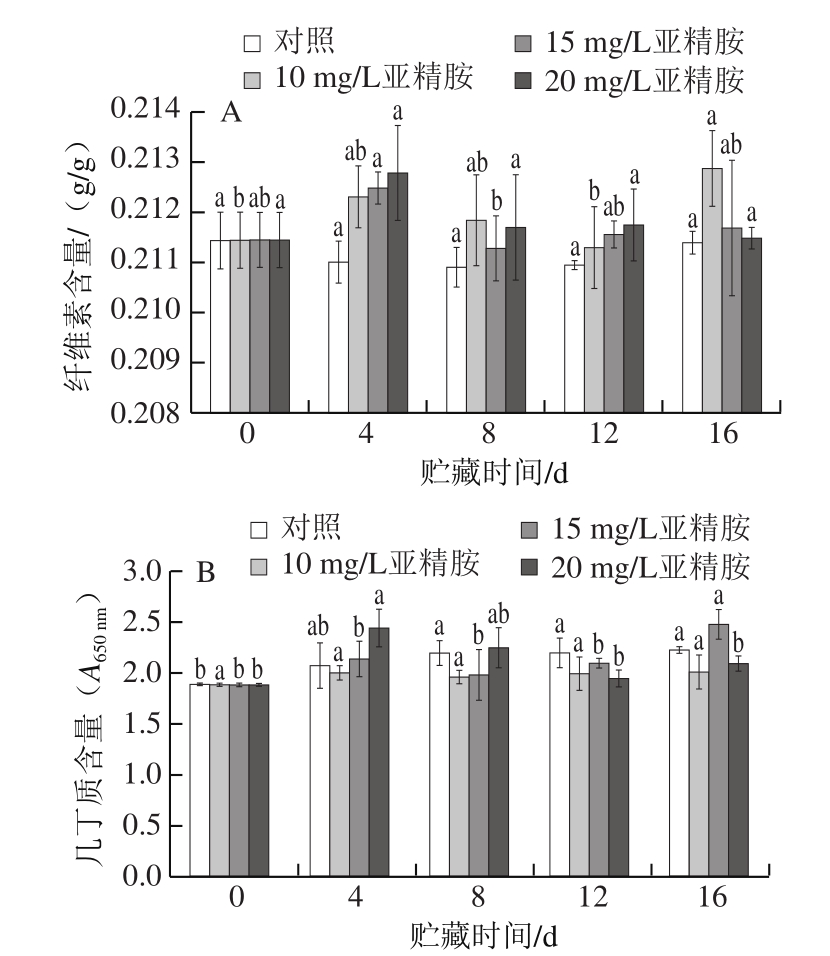
图3 不同质量浓度亚精胺处理对香菇纤维素(A)和几丁质(B)含量的影响
Fig.3 Effect of different contents spermidine treatment on the contents of cellulose (A) and chitin (B) of shiitake mushrooms during storage
纤维素是细胞壁中的结构多糖,是构成细胞壁的骨架成分。如图3A所示,贮藏期间亚精胺处理组纤维素含量呈现先上升后缓慢下降的趋势,而对照组呈现先降低后缓慢上升的趋势。其中,所有亚精胺处理组的纤维素含量在相同贮藏时间处均高于对照组,表明亚精胺处理促进了子实体中纤维素含量的升高。而纤维素含量的积累有助于蘑菇硬度的维持[25],进而证明了外源亚精胺处理对香菇质地的保护作用。
几丁质是真菌细胞壁主要组成成分,其特征是以β-1,4-N-乙酰氨基葡萄糖为单元[26-27];它对真菌细胞壁的强度和硬度具有一定的作用,其含量增加与子实体韧性呈正相关[28],可以一定程度反映果实衰老程度[29]。如图3B所示,在贮藏过程中不同组几丁质含量的变化趋势并不完全一致,在整个贮藏期内,10 mg/L亚精胺处理组的几丁质含量没有发生显著变化,对照组的几丁质含量在前8 d显著升高,15 mg/L亚精胺处理组的几丁质含量在12 d之后才开始显著上升,而20 mg/L的亚精胺处理组几丁质含量在4 d时显著高于0 d,随后略微降低。在整个贮藏过程中,所有处理组和对照组的几丁质含量均较0 d有所上升,且到16 d时,15 mg/L的亚精胺处理组香菇的几丁质含量最高,故15 mg/L的亚精胺处理能维持几丁质含量在较长时间内不发生明显下降,在一定程度上减缓果实衰老。

图1 不同质量浓度亚精胺处理对香菇总酚含量的影响
Fig.1 Effect of different contents spermidine treatment on total phenolic content of shiitake mushrooms during storage
酚类物质是主要的次生代谢产物之一,其中许多是木质素前体。而酚类物质的氧化是影响食用菌采后组织色泽的重要因素,严重时会影响采后食用菌的商品价值。如图4所示,贮藏期间所有处理组香菇的总酚含量均出现先上升后下降的现象,但峰值出现的时间有所差异。在贮藏前期,香菇总酚含量逐步上升,可能是因为在贮藏过程中酚类物质可以参与组织的愈伤过程并增强子实体对不良环境的抗逆性[30],故使得体内产生更多酚类物质。而随着贮藏期的延长,各处理组总酚含量下降。原因可能是部分酚类物质转化为木质素,为木质化提供了底物,这与Bunsiri等[31]在山竹果皮损伤中的研究结果相符。2~6 d时对照组香菇总酚含量高于其他亚精胺处理组,且6 d时10 mg/L亚精胺处理组总酚含量显著低于对照组。结果表明,2~6 d时较低质量浓度亚精胺处理能够有效地抑制酚类物质的生成,一方面能够抑制褐变现象的发生;另一方面能够减缓酚类向木质素转化的进程,抑制木质化现象。

图5 不同质量浓度亚精胺处理对香菇PAL(A)和POD(B)活力的影响
Fig.5 Effect of different contents spermidine treatment on the activity of PAL (A) and POD (B) of shiitake mushrooms during storage
PAL是植物体苯丙烷类物质代谢和木质素合成的关键酶。由图5A所示,不同处理组的香菇PAL活力表现出相似变化趋势,均在6 d出现最高峰值,且此时15、20 mg/L亚精胺处理组PAL活力低于其他处理组,表明其能够降低苯丙烷物质代谢的速率,但不同质量浓度亚精胺处理的抑制效果差异不显著。
POD是植物酶促防御系统的重要保护酶,同时在植物体内主要参加H2O2的氧化及木质素单体的氢氧化聚合反应。如图5B所示,POD活力整体呈现先降低后升高的变化趋势。贮藏2~8 d时,所有处理组和对照组的POD活力均下降,且到8 d时降到最低值,8 d后,各组的POD活力又有不同程度上升。而这种变化趋势和木质素含量的变化趋势相一致,这也进一步说明POD作为木质素合成代谢中非常重要的一种酶,一定程度上影响着香菇的木质化程度。与对照组相比,20 mg/L亚精胺处理组在4~6 d内均保持较低的POD活力,使得20 mg/L亚精胺处理组的木质化高峰来临较晚,延缓了香菇的木质化。
由表1可知,PAL活力与硬度和总酚含量呈正相关,与其他指标呈负相关;POD活力与硬度和总酚含量呈负相关;总酚含量与硬度和几丁质含量呈正相关,与其他指标呈负相关;几丁质含量与硬度呈负相关,与其他指标呈正相关;纤维素含量与木质素含量呈负相关,而与硬度呈正相关;木质素含量与POD活力和几丁质含量呈正相关,与其他指标呈负相关。其中,硬度与POD活力、总酚含量、木质素含量的相关性显著(P<0.05);总酚含量与POD活力相关性显著(P<0.05);其余相关性不显著。
表1 不同指标之间的相关性分析
Table1 Correlation analysis of all investigated parameters

注:*.显著相关(P<0.05)。
指标 PAL活力 POD活力 总酚含量几丁质含量纤维素含量木质素含量 硬度PAL活力 1.000 0 POD活力 -0.2752 1.000 0总酚含量 0.2638 -0.553 8*1.000 0几丁质含量 -0.2561 0.0837 0.1298 1.000 0纤维素含量 -0.274 0 0.110 1 -0.1239 0.1758 1.000 0木质素含量 -0.4071 0.1711 -0.1771 0.1083 -0.214 1 1.000 0硬度 0.249 3-0.512 5*0.369 8*-0.2379 0.019 7-0.550 9*1.000 0
亚精胺是一种有生物活性、分子质量较低、含脂肪的氮碱。在果蔬的采前研究中,亚精胺对植物的生长和发育有重要的调控作用。外源亚精胺在果蔬采后作用中也起到一定作用:一方面,它可以通过提高POD、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)的活力[32]以清除自由基;另一方面,它还可以抑制乙烯的生成,从而达到延缓衰老的效果[33]。本研究团队在前期预实验中发现,当亚精胺溶液质量浓度低于10 mg/L时,香菇的褐变程度较严重,并没有体现出优于对照组的特点;而当质量浓度大于20 mg/L时,香菇硬度下降较快,对香菇的保鲜效果很差,综合比较,当亚精胺溶液质量浓度在10~20 mg/L的范围内时,香菇各感官指标都优于对照组,故本实验采用质量浓度为10、15 mg/L和20 mg/L的亚精胺溶液进行处理,在保证香菇感官品质的基础上,进一步研究这3 个质量浓度的亚精胺溶液对香菇木质化转变方面的影响。
本实验中,前8 d香菇硬度出现略微上升的趋势,8~10 d时所有处理组和对照组的硬度均明显下降,此后又趋于平稳。通过相关性分析发现,硬度与木质素含量呈显著负相关,这与之前大部分研究结果[34-35]相悖。这可能是因为木质化是质地硬化的一部分,且木质化到硬化的转变需要一定的时间,造成了高低峰的错位,最终导致两者呈显著负相关。
木质素作为构成细胞壁次生结构的主要成分。在贮藏期间,木质素含量也随贮藏时间延长出现2 个峰。香菇的木质化一定程度与PAL、POD活力有关,其中和POD活力相关性最大。8 d时,各处理组的POD活力均降到最低,而此时的木质素含量也整体最低;8 d后POD活力逐渐升高,同时木质素含量整体也不同程度地上升。而据报道,POD、PAL活力的增加和木质素的积累是机体应对低温胁迫的应激防御反应[36]。第一次木质化出现的原因主要为低温胁迫产生的应激防御反应。而在贮藏的12 d前后,木质素含量出现第二个峰值,表明出现第二次木质化现象。然而此时PAL活力只是波动变化,证明PAL活力与木质素积累关系不大,且可推测导致此次木质化现象的原因不单是木质素合成相关酶活力的变化。而李伟等[37]对PAL活力、木质素代谢和植物抗逆性进行了阐述,认为在某些抗逆生理环境条件下,苯丙烷类物质代谢中的非木质素代谢与木质素代谢呈一定的相关性。因此,推测第二次木质化现象的出现是非木质素代谢与木质素合成相关酶的共同作用。作为细胞壁骨架的纤维素和几丁质,其含量均在贮藏期间缓慢波动变化,这可能是亚精胺处理和细胞壁降解酶的共同作用,这与孙涵等[27]关于高氧动态气调环境下双孢菇的细胞壁降解酶变化规律的研究结果相符。
本实验结果表明,在贮藏期间,香菇出现2 次木质化高峰;所有处理均不能抑制香菇硬度的下降和纤维素含量的升高;所有处理均促进了纤维素含量的升高;但15 mg/L的亚精胺处理能够维持贮藏末期几丁质含量不发生明显下降;总酚含量在贮藏过程中先增加后降低;15、20 mg/L亚精胺处理组可在4~6 d时保持较低的PAL活力,而20 mg/L亚精胺处理组在4~6 d内保持较低的POD活力,推迟木质化高峰的到来。
[1] 刘春如, 易诚. 香菇的营养价值和药用价值[J]. 中国林副特产,2002(1): 52-53. doi:10.3969/j.issn.1001-6902.2002.01.045.
[2] 李石军, 王凯平, 汪柳, 等. 香菇多糖LNT2的提取分离纯化、结构及体外抗肿瘤活性研究[J]. 中草药, 2014, 45(9): 1232-1237.doi:10.7501/j.issn.0253-2670.2014.09.007.
[3] 马倩, 蒲燕, 袁文清, 等. 香菇多糖对慢性应激抑郁模型小鼠的抗抑郁作用及可能机制研究[J]. 中国免疫学杂志, 2015, 31(3): 329-333.doi:10.3969/j.issn.1000-484X.2015.03.009.
[4] 王丽芹. 香菇SD-08菌株多糖及其降解产物的提取、结构及抗氧化抗衰老活性研究[D]. 泰安: 山东农业大学, 2015: 20-23.
[5] 侯爱萍, 张树海. 香菇多糖抗菌抗病毒普适性研究[J]. 药学研究,2015, 34(4): 199-201. doi:10.13506/j.cnki.jpr.2015.04.005.
[6] 宋秀玲, 王宏芳, 齐燕飞, 等. 香菇多糖对电离辐射所致小鼠损伤的保护作用[J]. 吉林大学学报(医学版), 2010, 36(3): 473-476.doi:10.13481/j.1671-587x.2010.03.012.
[7] 颜爱, 李波, 李润成, 等. 香菇多糖和黄芪多糖对免疫抑制小鼠免疫功能调节的研究[J]. 中国免疫学杂志, 2012, 28(11): 999-1001; 1005.doi:10.3969/j.issn.1000-484X.2012.11.008.
[8] 韩春然, 闫宝军, 唐均安. 香菇采后贮藏期间褐变的因素研究[J].现代食品科技, 2012, 28(11): 1441-1444. doi:10.13982/j.mfst.1673-9078.2012.11.016.
[9] 李丹青. 低温贮藏下杏鲍菇的木质化及关键酶基因的克隆与表达分析[D]. 广州: 华南农业大学, 2016: 13-14.
[10] 易星, 莫远亮, 姜冬梅, 等. 多胺的生物学功能及其调控机制[J].动物营养学报, 2014, 26(2): 348-352. doi:10.3969/j.issn.1006-267x.2014.02.009.
[11] 邓琪, 谢斌, 谢明. 亚精胺在神经系统的调节和保护功能[J]. 中国医学工程, 2018, 26(3): 32-35. doi:10.19338/j.issn.1672-2019.2018.03.009.
[12] 李建勇, 卢钢, 任彦. 多胺在果实生长发育中的作用研究进展[J]. 果树学报, 2005, 22(3): 256-260. doi:10.13925/j.cnki.gsxb.2005.03.016.
[13] AMOOAGHAIE R, MOGHYM S. Effect of polyamines on thermotolerance and membrane stability of soybean seedling[J].African Journal of Biotechnology, 2013, 10(47): 9673-9679.doi:10.5897/AJB10.2446.
[14] DUAN J J, LI J, GUO S R, et al. Exogenous spermidine affects polyamine metabolism in salinity-stressed Cucumis sativus roots and enhances short-term salinity tolerance[J]. Journal of Plant Physiology,2008, 165(15): 1620-1635. doi:10.1016/j.jplph.2007.11.006.
[15] 张海燕. 外源腐胺对油桃贮藏冷害、品质及生理变化的影响[D].杨凌: 西北农林科技大学, 2008: 37-39.
[16] 张辉, 朱新卫, 吴斌, 等. 亚精胺处理对哈密大枣贮藏品质的影响[J]. 新疆农业大学学报, 2014, 37(1): 69-72. doi:10.3969/j.issn.1007-8614.2014.01.015.
[17] 闫瑞香, 王仁才, 关文强. 不同时期亚精胺处理对猕猴桃贮藏效果的影响[J]. 保鲜与加工, 2001, 1(2): 14-16. doi:10.3969/j.issn.1009-6221.2001.01.004.
[18] 马岳岳, 李永才, 胡培芳, 等. 采后多胺处理对杏果实黑斑病的控制及贮藏品质的影响[J]. 食品科学, 2018, 39(3): 289-294.doi:10.7506/spkx1002-6630-201803043.
[19] YANG Wenjian, DU Hengjun, MARIGA A M, et al. Hot air drying process promotes lignification of Lentinus edodes[J]. LWTFood Science and Technology, 2017, 84: 726-732. doi:10.1016/j.lwt.2017.06.039.
[20] VETTER J. Chitin content of cultivated mushrooms Agaricus bisporus,Pleurotus ostreatus and Lentinula edodes[J]. Food Chemistry, 2007,102(1): 6-9. doi:10.1016/j.foodchem.2006.01.037.
[21] CAI Chong, XU ChangJie, LI Xian, et al. Accumulation of lignin in relation to change in activities of lignif i cation enzymes in loquat fruit flesh after harvest[J]. Postharvest Biology and Technology, 2005,40(2): 163-169. doi:10.1016/j.postharvbio.2005.12.009.
[22] 李艳杰, 高衍红, 王鹏, 等. 香菇热风干燥工艺优化及其对主要营养物质和抗氧化活性的影响[J]. 食品科学, 2017, 38(6): 209-214.doi:10.7506/spkx1002-6630-201706033.
[23] KOUKOL J, CONN E E. The metabolism of aromatic compounds in higher plants. IV. purif i cation and properties of the phenylalanine deaminase of Hordeum vulgare[J]. The Journal of Biological Chemistry, 1961, 236(10): 2692-2698.
[24] MOERSCHBACHER B M, NOLL U M, FLOTT B E, et al. Lignin biosynthetic enzymes in stem rust infected, resistant and susceptible near-isogenic wheat lines[J]. Physiological and Molecular Plant Pathology, 1988, 33(1): 33-46. doi:10.1016/0885-5765(88)90041-0.
[25] KHAN Z U, LI J Y, KHAN N M, et al. Suppression of cell wall degrading enzymes and their encoding genes in button mushrooms(Agaricus bisporus) by CaCl2 and citric acid[J]. Plant Foods for Human Nutrition, 2017, 72(1): 54-59. doi:10.1007/s11130-016-0588-8.
[26] NITSCHKE J, ALTENBACH H J, MALOLEPSZY T, et al. A new method for the quantification of chitin and chitosan in edible mushrooms[J]. Carbohydrate Research, 2011, 346(11): 1307-1310.doi:10.1016/j.carres.2011.03.040.
[27] 孙涵, 王相友, 李玲. 高氧动态气调对双孢蘑菇细胞壁代谢及木质化进程的影响[J]. 食品科学, 2018, 39(11): 255-262. doi:10.7506/spkx1002-6630-201811040.
[28] ZIVANOVIC S, BUSHER R W, KIM K S. Textural changes in mushrooms (Agaricus bisporus) associated with tissue ultrastructure and composition[J]. Journal of Food Science, 2010, 65(8): 1404-1408.doi:10.1111/j.1365-2621.2000.tb10621.x.
[29] 李志啸, 杨文建, 方东路, 等. 纳米包装材料对双孢菇细胞壁代谢及品质的影响[J]. 食品科学, 2016, 37(6): 248-253. doi:10.7506/spkx1002-6630-201606045.
[30] 郁志芳, 夏志华, 陆兆新. 鲜切甘薯酶促褐变机理的研究[J]. 食品科学, 2005, 26(5): 54-59. doi:10.3321/j.issn:1002-6630.2005.05.008.
[31] BUNSIRI A, KETSA S, PAULL R E. Phenolic metabolism and lignin synthesis in damaged pericarp of mangosteen fruit after impact[J].Postharvest Biology & Technology, 2003, 29(1): 61-71. doi:10.1016/S0925-5214(02)00213-2.
[32] 王倩, 吴斌, 张政, 等. 多胺对果蔬采后生理生化作用机制的研究进展[J]. 保鲜与加工, 2015, 15(4): 70-73.
[33] 李青芝, 常云霞. 采后果蔬贮藏过程中多胺与乙烯的关系[J].安徽农业科学, 2008, 36(27): 11999-12001. doi:10.3969/j.issn.0517-6611.2008.27.151.
[34] 杨晋恒, 郜海燕, 周拥军, 等. 臭氧处理对香菇采后品质与生理的影响[J]. 浙江农业学报, 2017, 29(7): 1201-1207.
[35] JIANG T J, JAHANGIR M M, WANG Q S, et al. Accumulation of lignin and malondialdehyde in relation to quality changes of button mushrooms (Agaricus bisporus) stored in modified atmosphere[J].Food Science and Technology International, 2010, 16(3): 217-224.doi:10.1177/1082013209353840.
[36] 杨敏, 于立梅, 刘朝霞, 等. 贮藏温度对山竹果皮木质化相关酶活性和果肉腐烂的影响[J]. 食品科学, 2013, 4(18): 307-311.doi:10.7506/spkx1002-6630-201318063.
[37] 李伟, 熊谨, 陈晓阳. 木质素代谢的生理意义及其遗传控制研究进展[J]. 西北植物学报, 2003, 23(4): 675-681. doi:10.3321/j.issn:1000-4025.2003.04.032.
Effect of Exogenous Spermidine Treatment on Lignif i cation and Related Enzyme Activities in Shiitake Mushrooms (Lentinula edodes)