陆生植物地上部分器官(如植物的花、叶、果实等)表面围绕着一层脂质层,具有阻止水果的非皮孔性水分损失、机械损伤和微生物及昆虫的入侵,并提供机械支撑等重要生理功能[1-2]。虽然植物表皮角质层的化学成分具有很大的差异[3],但它们都是由角质和蜡质两个主要部分组成。角质是由羟基脂肪酸和环氧脂肪酸组成的聚酯化合物,是角质层的骨架结构。蜡质层主要由特长链(C20~C34)饱和脂肪酸及其衍生物(烃、醛、醇、酯等)、萜类物质和其他微量次级代谢物(固醇及类黄酮类等)组成。植物蜡质层又可分为两层,填充于角质内的叫内蜡,覆盖在角质表面的叫外蜡。另外,外蜡在植物发育过程中可进行自组装形成各种晶体结构,如血小板状、板状、缎状、线状等[4]。
果实表皮角质层在果实发育过程中形成,并在果实采后贮藏品质变化中起着重要调控作用[1]。如李宏键等[5]发现,具有厚且均匀致密角质层的苹果品种,其采后硬度和质量损失率变化较小。郜海燕等[6]研究发现,蓝莓的外表皮蜡质受损后更容易发生软化、衰老现象。Dong Xiaoqing等[7]发现‘红富士’苹果在0 ℃贮藏过程中,总蜡含量逐渐减少,而经1-甲基环丙烯(1-methylcyclopropene,1-MCP)处理则能显著抑制总蜡含量降低。虽然关于柑橘果实表皮角质层的研究早有报道,但主要集中在‘纽荷尔’脐橙及其突变体和果实在生长过程中的蜡质变化[8-10]。如Liu Dechun等[8]对野生型和突变型‘纽荷尔’脐橙生长过程中蜡质成分、含量变化和相关基因的表达量进行了分析,发现蜡质合成和运输基因的表达下调伴随着脂肪族物质含量的减少和外蜡晶体的损失,从而导致了突变体‘纽荷尔’脐橙的光滑表型。Wang Jinqiu 等[9]对‘纽荷尔’脐橙生长和成熟中角质层的形成进行了转录组和代谢组分析,结果表明角质的积累与果实的生长同步,而蜡质的合成与果实的成熟过程同步。然而,关于柑橘果实在贮藏过程中角质层成分变化的研究却很少。
果实角质层作为病原菌侵染的最外层屏障[11],一方面,对病原菌的生长和分生孢子的萌发具有一定的抑制作用。如Li Yongcai等[12]发现不同发育阶段的苹果梨表面提取的蜡质能够抑制链格孢菌(Alternaria alternata)孢子的萌发和菌丝的生长;Martin等[13]报道蜡质能够抑制部分苹果品种病原菌如白涩病菌(Podosphaera leucotricha)分生孢子的萌发。另外,蜡质中包含有抑菌化合物并且病原菌侵染的过程受蜡质形态和厚度的影响也有报道[14]。另一方面,一些研究者报道,提取的蜡质对一些病原菌孢子的萌发和分化具有促进作用。如Podila等[15]观察到鳄梨果实的表面能够作为化学信号引发炭疽杆菌(Colletotrichum gloeosporiorides)孢子的萌发和附着胞的形成。
柑橘(Citrus reticulata Blanco.)是世界第一大类水果,我国作为柑橘第一生产大国,2016年柑橘年产量为3 764.87万 t[16]。由指状青霉(Penicillium digitatum)引起的绿霉病是柑橘采后重要病害之一。目前,柑橘青绿霉病的防治主要采用化学防治和生物防治措施[17],但由于人们对这种病害侵染过程了解不够深入,柑橘采后商品化处理过程中仍存在较大染绿霉病的风险。本实验室前期虽然对采收时温州蜜柑果实表面的角质层组分和微观结构进行了分析[18],但果实在贮藏过程中角质层组分变化特征以及这种变化是否会影响指状青霉对果实的侵染还不清楚。因此,本实验以温州蜜柑(Citrus unshiu)为材料,利用气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)技术对其贮藏过程中角质层组分及含量变化进行了分析,并采用体外实验探究了角质层在对指状青霉孢子萌发和菌丝生长的影响,旨在为温州蜜柑的采后病害调控提供参考。
以温州蜜柑为实验材料,2016年10月10日购买于湖南省石门县。
阿拉伯胶 上海阿拉丁试剂有限公司;吐温-80、三氯甲烷、丙酮、甲醇、二氯甲烷、吡啶(均为分析纯)、正构二十四烷(色谱纯) 国药集团化学试剂有限公司;体积分数14%三氟化硼甲醇溶液 德国C N W公司;N,O-双(三甲基硅烷)三氟乙酰胺(N,O-bistrimethylsilyl trifluoroacetamid,BSTFA)Sigma-Aldrich上海贸易有限公司;纤维素酶、半纤维素酶、果胶酶 上海瑞海生物科技有限公司;PDA培养基广东环凯微生物科技有限公司;指状青霉(Penicillium digitatum,GIM3.490) 广东省微生物菌种保藏中心。
Organomation氮吹仪 铭奥国际有限公司;7890A-5975C GC-MS仪 安捷伦科技有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;XSP-30光学显微镜 江西凤凰光学科技有限公司。
1.3.1 原料处理及孢子悬浮液制备
以果面光洁、无机械损伤、大小均一、新鲜成熟的温州蜜柑为实验材料。将200 个果实分为20 组,每组10 个果实,于4 ℃、相对湿度85%的环境中贮藏40 d。每隔10 d进行一次取样,每次3 组果实用于角质层分析。
取培养了7 d的指状青霉培养基,加入含体积分数0.05%吐温-80的适量无菌水,用涂布棒轻轻刮涂平板上的病原菌孢子,然后经3 层纱布过滤到三角瓶中,为了使孢子分散均匀,先在振荡器上振荡,然后镜检,由血小板计数器计数并调整孢子悬浮液浓度至1×106 个/mL。
1.3.2 指标测定
1.3.2.1 果实角质层成分提取与测定
蜡质层提取:参考Liu Dechun等[8]的方法提取外蜡和内蜡,并略作修改。提取外蜡时,将2 次获得的阿拉伯胶用蒸馏水溶解,并在室温下用3 倍体积的三氯甲烷抽提。最后分别加入200 μL 1 μg/μL的正构二十四烷为内标,在氮气下吹干,贮存于-20 ℃,待测。
蜡质层成分测定:每个样品中加入一定体积的吡啶,50 ℃于烘箱中保持30 min,加入等体积的BSTFA,60 ℃衍生40 min。氮气吹干多余的衍生化试剂后重新溶于5 mL氯仿中,用孔径0.22 µm的微孔滤膜过滤,用于GC-MS分析。采用HP-5毛细管柱(30 m×0.25 mm,0.25 µm)和MS检测器。GC条件为:进样口温度280 ℃,质谱源温度230 ℃,柱流速2 mL/min,恒定流速;Aux-2温度280 ℃,载气为氦气,无分流注样,进样量1 µL。MS条件为:电子轰击电离方式,能量70 eV,质量扫描范围50~600 amu,全扫描方式,溶剂延迟8 min。升温过程为70 ℃保持1 min,以20 ℃/min升温至200 ℃,保持2 min,再以5 ℃/min升温至320 ℃,保持20 min。各种蜡质成分经GC-MS检测后得到其离子峰,依据质谱库进行检索判定,并与内标比较进行定量分析,蜡质含量用单位面积果皮所含质量表示。
果皮角质提取与分析:用内径为1.7 cm的打孔器在去除蜡质成分的每个果实赤道部位均匀取4 个孔,参考Wang Jinqiu[9]、Pacchiano[19]等的方法,并略作修改,将获得的小圆片进行酶解。在酶解过程中,每隔1~2 d换一次液。为了防止污染,经酶解的小圆片立即进行连续提取。用甲醇浸提6 h后用二氯甲烷浸提17 h,最后用四氢呋喃提取20 h。得到的角质在体积分数14%三氟化硼甲醇溶液中于70 ℃转酯解聚16 h,冷却后过滤,加入3 倍体积的饱和NaHCO3溶液终止反应。最后加入200 µL 1 μg/μL的正构二十四烷为内标,在氮气下吹干,贮存于-20 ℃,待测。
角质成分分析:每个样品(约20 mg)加入2.5 mL的吡啶,并加入等体积的BSTFA,90 ℃衍生40 min。升温过程为50 ℃保持2 min,以10 ℃/min升温至150 ℃保持1 min,再以3 ℃/min升温至310 ℃,保持20 min。各种角质成分经GC-MS检测后得其离子峰,依据质谱库和文献进行检索判定,并与内标比较进行相对定量分析,角质的含量用单位果皮面积所含质量表示。
1.3.2.2 果实表面积测定
根据参考文献[20]的方法测定果实表面积。蜜柑表面积按下式计算。
式中:m0为果皮的总质量/g;S、m分别为打孔器获得的40 个小圆片的总面积/cm2和总质量/g。
1.3.2.3 果实角质层各组分提取物处理指状青霉的体外实验
参照Li Yongcai等[12]的方法略作修改。将400 µL角质层各组分均匀涂布于底部含有PDA培养基的培养皿中,以水和氯仿为对照。待溶剂自然风干后,分别接入200 µL 1×106 个/mL的指状青霉孢子悬浮液,在培养箱(28 ℃、24 h黑暗)中培养7 d,测菌落直径,每组3 个平行,实验重复3 次。
将用氯仿溶解的果实角质层各组分均匀涂布于盖玻片上,自然风干。同时,以氯仿和水涂布于盖玻片上作为对照。然后在上述盖玻片上接种1 滴(10 µL/滴)1×106 个/mL的孢子悬浮液,并置于底层铺有用无菌水浸湿的培养皿中。然后在28 ℃的恒温培养箱中培养12 h后,用光学显微镜观察孢子萌发的情况,记录数据并计算孢子萌发率。实验每组3 个平行,重复3 次。
采用Origin 8.0软件对数据进行整理分析和作图。数据结果以平均值±标准差表示;进行单因素方差分析,显著性分析采用t检验。P<0.05表示差异显著。
表1 温州蜜柑冷藏过程中角质层含量
Table1 Changes in the amounts of cuticle, wax, and cutin of mature Satsuma mandarin fruit during cold storage

注:同行肩标小写字母不同表示差异显著(P<0.05)。下同。
成分 0 d 10 d 20 d 30 d 40 d外蜡含量/(μg/cm2)1.11±0.18c 3.71±0.61a 3.03±0.60a 1.73±0.15b 0.79±0.12d内蜡含量/(μg/cm2)4.98±0.18b 4.54±0.39b 5.50±0.16a 4.14±0.22cb 4.71±0.19b总蜡质含量/(μg/ 6.09±0.21b 8.25±0.16a 8.53±0.13a 5.87±0.19b 5.50±0.10bc角质含量/(μg/cm2)52.50±1.79b 56.30±0.52a 47.40±1.33c 32.00±0.41e 36.00±0.89d角质层含量/(μg/ 58.59±1.76b 64.55±0.37a 55.93±0.96b 37.87±0.26d 41.50±0.11c
如表1所示,温州蜜柑冷藏过程中蜡质、角质含量整体呈先上升后下降的趋势。在冷藏第10天,温州蜜柑外蜡含量从1.11 µg/cm2(0 d)上升到3.71 µg/cm2,冷藏40 d后下降到0.79 µg/cm2。温州蜜柑内蜡含量显著高于外蜡含量,且在冷藏第20天时其含量达到最高值(5.50 μg/cm2);在冷藏第30天时其含量达到最低值(4.14 μg/cm2)。角质是角质层的主要成分,冷藏过程中,其含量的变化幅度最大,在冷藏第10天,其含量由52.50 μg/cm2(0 d)上升到56.30 μg/cm2,然后在第30天下降到32.00 μg/cm2。品种和贮藏环境的不同可能会引起角质层产生不同的响应。如Cajuste等[21]将成熟的‘Navelate’柑橘在22 ℃贮藏14 d后,发现表皮蜡质含量增多,且在乙烯处理的柑橘中更显著。

图1 温州蜜柑果实外蜡中各组分比例
Fig.1 Proportion of each component in the epicuticular wax of Satsuma mandarin fruit
如图1所示,温州蜜柑外蜡主要由脂肪酸、烷烃及少量萜类等组成。脂肪酸是温州蜜柑外蜡中含量最丰富的蜡质组分。不同柑橘品种中外蜡主要成分存在差异,如Wang Jinqiu等[22]发现脂肪酸是温州蜜柑外蜡中最丰富的组分,占外蜡含量的48%;而Sala[23]发现烷烃是‘Fortune’柑橘果实中最丰富的外蜡组分。这些研究结果不一致,一方面可能是因为生长环境以及品种的差异;另一方面可能是因为采样方法的不同,如Sala[23]报道从面北树枝上采收的‘Fortune’柑橘果实与从面南树枝上采收的果实的蜡质含量存在差异。目前已发现不同果蔬间如苹果[7,24]、葡萄[25]、柿子[26]、番茄及其突变体[27]角质层组分存在显著差异,这些差异可能与角质层相关的生理特征如失水率或机械性能等相关。在冷藏过程中,外蜡中的萜类物质比例变化最大,其比例在贮藏前期(0~10 d)显著下降,在贮藏中期(10~20 d)保持相对稳定,而在贮藏后期(30~40 d)则显著增加。外蜡中的烷烃类组分比例在冷藏过程中不断增加,这可能与温州蜜柑抵御冷害、防止外蜡结构破坏有关。Sala[23]也发现在低温条件下,‘Fortune’柑橘果实的外蜡更易裂化和损伤,而烷烃含量增加能显著延缓蜡层的裂化。由表2可见,在0 d时,在温州蜜柑外蜡中仅检测出15 种化合物,其中含有脂肪酸类化合物9 种,烷烃类化合物4 种,萜类化合物2 种。在冷藏过程中,外蜡中各类组分的变化与其主要化合物的变化一致。在冷藏前10 d,脂肪酸含量从0.73 μg/cm2增加到3.09 μg/cm2,之后下降至0.64 μg/cm2(40 d)。烷烃是形成结晶蜡所必需的化合物,在冷藏第20天其含量由0.12 μg/cm2(0 d)上升到0.42 μg/cm2,然后在第40天下降到0.13 μg/cm2。萜类物质在外蜡中的含量较低且在贮藏过程中显著下降。
表2 温州蜜柑冷藏过程中外蜡主要成分
Table2 Changes in major components of epicuticular wax in Satsuma mandarin fruit during cold storage
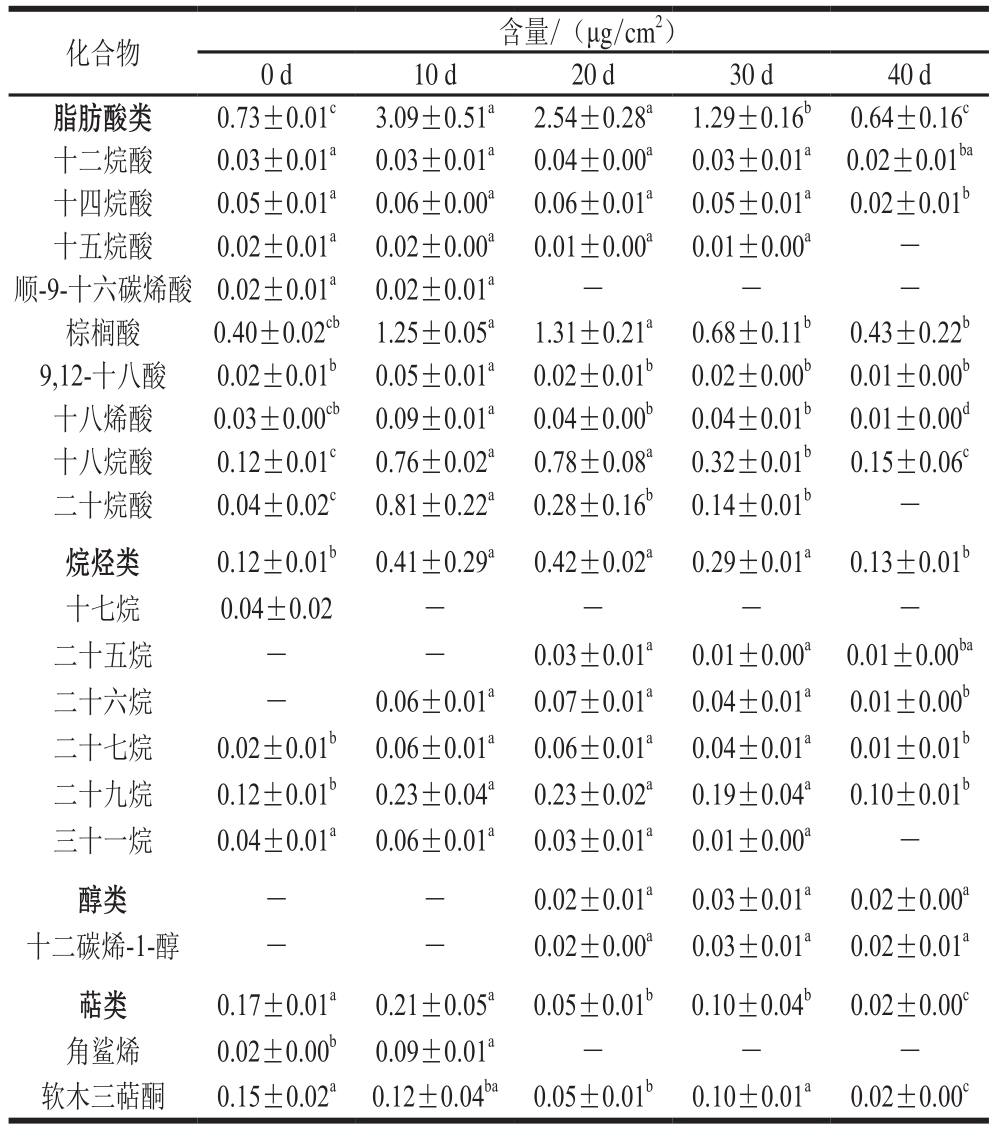
注:-.未检测到。下同。
化合物 含量/(μg/cm2)0 d 10 d 20 d 30 d 40 d脂肪酸类 0.73±0.01c 3.09±0.51a 2.54±0.28a 1.29±0.16b 0.64±0.16c十二烷酸 0.03±0.01a 0.03±0.01a 0.04±0.00a 0.03±0.01a 0.02±0.01ba十四烷酸 0.05±0.01a 0.06±0.00a 0.06±0.01a 0.05±0.01a 0.02±0.01b十五烷酸 0.02±0.01a 0.02±0.00a 0.01±0.00a 0.01±0.00a -顺-9-十六碳烯酸 0.02±0.01a 0.02±0.01a - - -棕榈酸 0.40±0.02cb 1.25±0.05a 1.31±0.21a 0.68±0.11b 0.43±0.22b 9,12-十八酸 0.02±0.01b 0.05±0.01a 0.02±0.01b 0.02±0.00b 0.01±0.00b十八烯酸 0.03±0.00cb 0.09±0.01a 0.04±0.00b 0.04±0.01b 0.01±0.00d十八烷酸 0.12±0.01c 0.76±0.02a 0.78±0.08a 0.32±0.01b 0.15±0.06c二十烷酸 0.04±0.02c 0.81±0.22a 0.28±0.16b 0.14±0.01b -烷烃类 0.12±0.01b 0.41±0.29a 0.42±0.02a 0.29±0.01a 0.13±0.01b十七烷 0.04±0.02 - - - -二十五烷 - - 0.03±0.01a 0.01±0.00a 0.01±0.00ba二十六烷 - 0.06±0.01a 0.07±0.01a 0.04±0.01a 0.01±0.00b二十七烷 0.02±0.01b 0.06±0.01a 0.06±0.01a 0.04±0.01a 0.01±0.01b二十九烷 0.12±0.01b 0.23±0.04a 0.23±0.02a 0.19±0.04a 0.10±0.01b三十一烷 0.04±0.01a 0.06±0.01a 0.03±0.01a 0.01±0.00a -醇类 - - 0.02±0.01a 0.03±0.01a 0.02±0.00a十二碳烯-1-醇 - - 0.02±0.00a 0.03±0.01a 0.02±0.01a萜类 0.17±0.01a 0.21±0.05a 0.05±0.01b 0.10±0.04b 0.02±0.00c角鲨烯 0.02±0.00b 0.09±0.01a - - -软木三萜酮 0.15±0.02a 0.12±0.04ba 0.05±0.01b 0.10±0.01a 0.02±0.00c
如图2所示,在冷藏过程中,随着脂肪酸类所占比例的减少,温州蜜柑内蜡萜类物质的比例在冷藏过程中逐渐增加。在冷藏的前30 d,烷类物质和醇类物质的比例保持相对稳定。烷烃和脂肪酸在外蜡中所占的比例高于在内蜡中所占的比例,而萜类物质主要存在于内蜡中;这是内蜡和外蜡最主要的差异[8,22,28],且这种差异在果实的成熟阶段更明显。萜类物质主要存在于角质层的内部,说明萜类可能不是涉及蜡晶形成的主要物质[8,22];这在本实验中也进一步得到了验证。不同成分内外蜡质分配存在多种假说。Buschhaus等[29]认为脂肪族物质呈线性一维结构,三萜类物质是环状,呈二维结构,凝聚状态下二者不能相容;因此,三萜类物质填充于聚酯结构的角质中。内蜡主要成分变化如表3所示,尽管温州蜜柑冷藏过程中内蜡的主要脂肪酸组分与外蜡相同,但它们的含量与外蜡有显著区别。在0 d时,在温州蜜柑内蜡中共检测到25 种化合物,其中脂肪酸组分检测出10 种,烷烃组分检测出7 种,萜类物质检测出6 种,醇类检测出2 种。不管在外蜡还是内蜡中,二十九烷都是温州蜜柑烷类组分中含量最高的化合物,这在其他水果如亚洲梨[30]、甜樱桃[31]、蔓越莓[32]中也有类似报道。萜类物质以角鲨烯、羽扇烯酮、β-香树精和软木三萜酮为主要化合物,同时在内蜡中还检测出了微量的菜油甾醇、豆甾醇、羊毛甾醇,内蜡中萜类物质含量在冷藏过程中呈先下降再上升的反复波动状态。
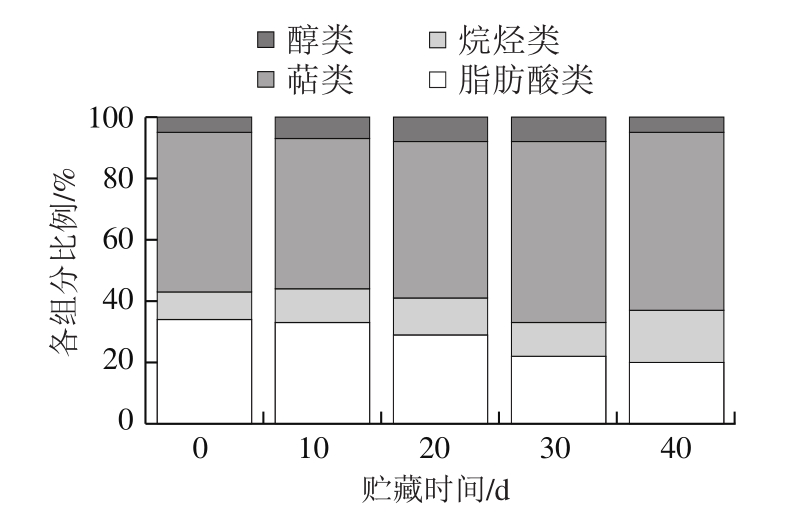
图2 温州蜜柑果实内蜡中各组分比例
Fig.2 Proportion of each component in the intracuticular wax of Satsuma mandarin fruit
表3 温州蜜柑冷藏过程中内蜡主要成分
Table3 Changes in major constituents of intracuticular wax in Satsuma mandarin fruit during cold storage
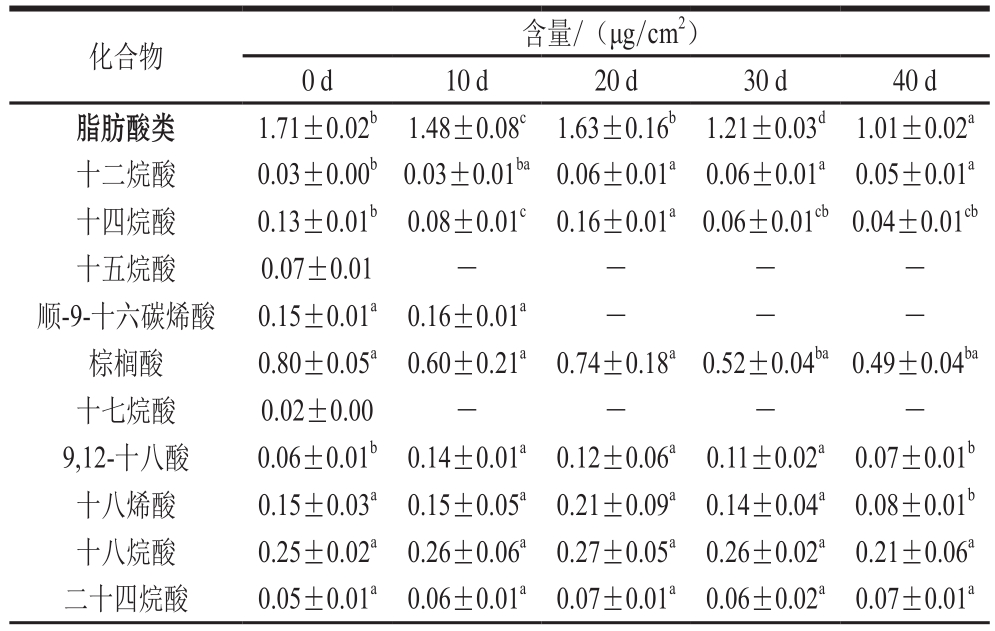
化合物 含量/(μg/cm2)0 d 10 d 20 d 30 d 40 d脂肪酸类 1.71±0.02b 1.48±0.08c 1.63±0.16b 1.21±0.03d 1.01±0.02a十二烷酸 0.03±0.00b 0.03±0.01ba 0.06±0.01a 0.06±0.01a 0.05±0.01a十四烷酸 0.13±0.01b 0.08±0.01c 0.16±0.01a 0.06±0.01cb0.04±0.01cb十五烷酸 0.07±0.01 - - - -顺-9-十六碳烯酸 0.15±0.01a 0.16±0.01a - - -棕榈酸 0.80±0.05a 0.60±0.21a 0.74±0.18a0.52±0.04ba0.49±0.04ba十七烷酸 0.02±0.00 - - - -9,12-十八酸 0.06±0.01b 0.14±0.01a 0.12±0.06a 0.11±0.02a 0.07±0.01b十八烯酸 0.15±0.03a 0.15±0.05a 0.21±0.09a 0.14±0.04a 0.08±0.01b十八烷酸 0.25±0.02a 0.26±0.06a 0.27±0.05a 0.26±0.02a 0.21±0.06a二十四烷酸 0.05±0.01a 0.06±0.01a 0.07±0.01a 0.06±0.02a 0.07±0.01a
续表3

化合物 含量/(μg/cm2)0 d 10 d 20 d 30 d 40 d烷烃类 0.45±0.01b 0.48±0.03b 0.63±0.02a 0.50±0.01b 0.51±0.05b十七烷 0.02±0.00 - - - -二十三烷 - 0.02±0.00b 0.05±0.01a 0.05±0.01a 0.04±0.01a二十五烷 0.04±0.01ba0.04±0.01ba 0.07±0.01a 0.08±0.01a 0.07±0.02a二十六烷 0.03±0.01a 0.03±0.01a 0.03±0.01a - -二十七烷 0.14±0.01ba0.14±0.01ba 0.10±0.01a 0.14±0.02ba 0.15±0.05a二十九烷 0.16±0.02b 0.19±0.01b 0.27±0.01a 0.15±0.02b 0.18±0.08ba三十烷 0.02±0.00b0.02±0.00ba 0.04±0.01a 0.03±0.01a 0.03±0.01a三十一烷 0.04±0.01b 0.04±0.02b 0.07±0.01a 0.05±0.01a 0.04±0.01ba醇类 0.27±0.04a 0.31±0.01a 0.39±0.05a 0.34±0.02a 0.40±0.10a十二碳烯-1-醇 0.25±0.05b0.28±0.01ba 0.36±0.04a 0.32±0.05a 0.37±0.07a二十四碳烯-1-醇 0.02±0.01a 0.03±0.01a 0.03±0.01a 0.02±0.00a 0.03±0.01a萜类 2.54±0.09b 2.29±0.01c2.86±0.13ab 2.10±0.07d 2.78±0.01a法尼醇 - - - 0.03±0.01a 0.02±0.01a角鲨烯 0.29±0.09a 0.30±0.02a 0.29±0.08a 0.05±0.01b 0.07±0.01b菜油甾醇 0.05±0.01a 0.05±0.01a 0.07±0.01a 0.05±0.01a 0.07±0.03a豆甾醇 0.04±0.01a 0.03±0.01a 0.03±0.01a 0.04±0.01a 0.04±0.01a羽扇烯酮 0.30±0.07b 0.32±0.13b 0.50±0.06a 0.28±0.04b 0.47±0.08a羊毛甾醇 - - - 0.05±0.01a 0.05±0.01a β-香树精 0.36±0.06b 0.37±0.09ba 0.48±0.06a 0.35±0.06b 0.51±0.11a软木三萜酮 1.50±0.12a 1.22±0.15b 1.48±0.16a1.25±0.08ba1.55±0.19a
表1 温州蜜柑冷藏过程中角质主要成分
Table1 Change in major acid composition of cutin in Satsuma mandarin fruit during cold storage
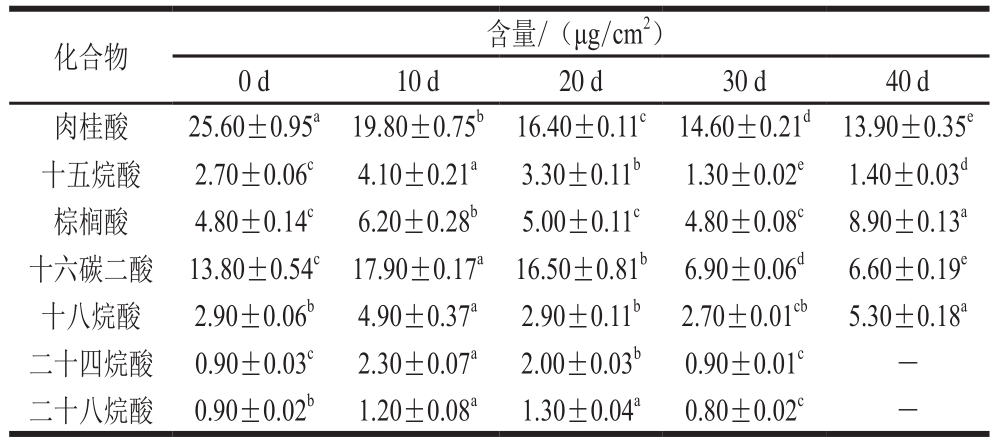
化合物 含量/(μg/cm2)0 d 10 d 20 d 30 d 40 d肉桂酸 25.60±0.95a 19.80±0.75b 16.40±0.11c 14.60±0.21d 13.90±0.35e十五烷酸 2.70±0.06c 4.10±0.21a 3.30±0.11b 1.30±0.02e 1.40±0.03d棕榈酸 4.80±0.14c 6.20±0.28b 5.00±0.11c 4.80±0.08c 8.90±0.13a十六碳二酸 13.80±0.54c 17.90±0.17a 16.50±0.81b 6.90±0.06d 6.60±0.19e十八烷酸 2.90±0.06b 4.90±0.37a 2.90±0.11b 2.70±0.01cb 5.30±0.18a二十四烷酸 0.90±0.03c 2.30±0.07a 2.00±0.03b 0.90±0.01c -二十八烷酸 0.90±0.02b 1.20±0.08a 1.30±0.04a 0.80±0.02c -
温州蜜柑在冷藏过程中角质含量显著降低(表1);贮藏过程中,果皮角质的降解可能会导致一系列活性氧簇的释放,从而提高果实对微生物侵染的抵抗力。Isaacson等[27]发现番茄果实角质的缺陷会影响其果皮的生物力学特性以及对微生物的抗性,但并不影响水分的散失速率。如表4所示,在0 d时,温州蜜柑主要角质单体成分为肉桂酸和十六碳二酸,含量分别为25.60 μg/cm2和13.80 μg/cm2。其他角质层单体成分包括十五烷酸、棕榈酸、十八烷酸、二十四烷酸、二十八烷酸。冷藏时,肉桂酸含量逐渐下降,在第40天时含量最低,为13.90 μg/cm2;十六碳二酸含量先增加到17.90 μg/cm2(10 d),然后下降到6.60 μg/cm2(40 d)。本研究结果表明冷藏时角质含量发生较大的变化,可能会进一步影响角质层的性质,从而影响果实的耐贮性和品质等。如Marga等[33]曾报道,角质单体C16/C18的比例会影响角质层的机械性能;当角质中含有较多的C16单体时会具有更高的刚性;当角质中的C16单体和C18单体含量相等时会具有较高的弹性。然而,这两种单体的比例是如何控制角质层机械性能的理化基础还不清楚。在本实验中,C16和C18单体的含量和比例在贮藏过程中不断变化,这是否与贮藏过程中果实硬度相关需要进一步的探究。

图3 外蜡(A)、内蜡(B)、角质(C)提取物对指状青霉菌落生长和孢子萌发的影响
Fig.3 Effect of epicuticular wax (A), intracuticular wax (B) and cutin (C)extracts on mycelial growth and spore germination of Penicillium digitatum
作为病原菌侵染的第一层屏障[11],果实角质层在病原真菌侵染的过程中具有双重作用。一方面,角质层覆盖在植物器官表面形成物理屏障阻止病原真菌的侵入;另一方面,角质层为病原真菌提供化学信号促进其侵入[34]。如图3所示,与水处理相比,氯仿对指状青霉菌落的生长和孢子萌发无显著影响。冷藏过程中提取的外蜡显著促进菌落的生长(P<0.05)(图3A)。除冷藏第40天,内蜡处理组指状青霉菌落直径和孢子萌发率均显著低于水处理组(P<0.05),说明提取的内蜡抑制菌落生长(图3B)。外、内蜡对指状青霉作用的差异可能是因为具有抗菌作用萜类物质主要存在内蜡中。如Naziri等[35]报道由野生型酵母菌代谢产生的角鲨烯能够作为一种安全的化学物质来清除氧自由基,推迟水果的衰亡。Liu Pu等[36]报道法尼醇的积累能够抑制柑橘病原菌的生长,保护果实抵抗生物胁迫。本实验中,法尼醇和角鲨烯主要存在于内蜡中。此外,冷藏时,内蜡中脂肪酸含量整体上呈降低趋势,而烷烃类物质含量先增加后降低。由此推测,脂肪酸能够促进病原真菌的生长,而烷类物质能够抑制病原真菌的生长。这一结果与其他研究结果类似,如Li等[37]曾报道,来自苹果梨表皮中不同碳链长度的烷烃具有抗菌性。Yin Yan等[30]也曾通过体外实验证明了蜡质中的烷烃和三萜类化合物对Alternaria alternata孢子萌发和菌丝生长上具有抑制作用。角质对指状青霉菌落的生长无显著影响,但能显著抑制指状青霉孢子的萌发(图3C);有报道指出角质能够被病原菌产生的酯酶、角质酶和其他的胞外水解酶等解聚为角质单体,能够刺激病原菌的萌发[38],本研究中与其结果的差异是否与角质所处的状态有关还需进一步研究。
冷藏过程中,温州蜜柑中蜡质、角质含量整体呈先上升后下降的趋势。烷烃和脂肪酸在外蜡中所占的比例高于在内蜡中所占的比例,而萜类物质主要存在于内蜡中;这是温州蜜柑内蜡和外蜡最主要的差异。在冷藏过程中,烷类组分在外蜡中比例不断增加,而在内蜡中比例保持相对稳定。随着脂肪酸类组分的比例在内蜡中减少,萜类物质的比例在冷藏过程中逐渐增加。不同角质层组分对指状青霉菌落生长和孢子萌发的影响不同,内蜡会显著抑制指状青霉菌落的生长和孢子的萌发;角质对指状青霉菌落的生长无显著影响,但能显著抑制指状青霉孢子的萌发;外蜡对指状青霉的生长具有促进作用。
低温时水果中的许多代谢都会增强或者重新定向,关于温州蜜柑冷藏期间果实表皮角质化学组分合成和代谢的调控机理还需进一步研究。同时,角质层中不同成分如何对病原真菌侵入响应对果实采后贮藏有重要影响,因此需要对每个特定化合物在水果中的生物作用进一步研究。
[1] LARA I, BELGE B, GOULAO L F. The fruit cuticle as a modulator of postharvest quality[J]. Postharvest Biology and Technology, 2014, 87:103-112. doi:10.1016/j.postharvbio.2013.08.012.
[2] YEATS T H, ROSE J K. The formation and function of plant cuticles[J]. Plant Physiology, 2013, 163(1): 5-20. doi:10.1104/pp.113.22 2737.
[3] YEATS T H, BUDA G J, WANG Z H, et al. The fruit cuticles of wild tomato species exhibit architectural and chemical diversity, providing a new model for studying the evolution of cuticle function[J]. The Plant Journal, 2012, 69(4): 655-666. doi:10.1111/j.1365-313X.2011.04820.x.
[4] KOCH K, ENSIKAT H J. The hydrophobic coatings of plant surfaces:epicuticular wax crystals and their morphologies, crystallinity and molecular self-assembly[J]. Micron, 2008, 39(7): 759-772.doi:10.1016/j.micron.2007.11.010.
[5] 李宏键, 刘志, 王宏, 等. 苹果果实组织结构与果实失重率和硬度变化的关系[J]. 果树学报, 2013(5): 753-758. doi:10.13925/j.cnki.gsxb.2013.05.028.
[6] 郜海燕, 杨帅, 陈杭君, 等. 蓝莓外表皮蜡质及其对果实软化的影响[J]. 中国食品学报, 2014, 14(2): 102-108. doi:10.16429/j.1009-7848.2014.02.015.
[7] DONG Xiaoqing, RAO Jingping, HUBER D J, et al. Wax composition of ‘Red Fuji’ fruit during development and during storage after 1-methylcyclopropene treatment[J]. Horticulture, Environment, and Biotechnology, 2012, 53(4): 288-297. doi:10.1007/s135 80-012-0036-0.
[8] LIU Dechun, LI Yang, ZHENG Qiong, et al. Analysis of cuticular wax constituents and genes that contribute to the formation of ‘glossy Newhall’, a spontaneous bud mutant from the wild-type a navel‘Newhall’ orange[J]. Plant Molecular Biology, 2015, 88(6): 573-590.doi:10.1007/s11103-015-0343-9.
[9] WANG Jinqiu, LI Sun, LI Xie, et al. Regulation of cuticle formation during fruit development and ripening in ‘Newhall’ navel orange(Citrus sinensis Osbeck) revealed by transcriptomic and metabolomic profiling[J]. Plant Science, 2016, 243: 131-144. doi:10.1016/j.plantsci.2015.12.010.
[10] LIU D C, ZENG Q, JI Q X, et al. A comparison of the ultrastructure and composition of fruits cuticular wax from the wild-type ‘Newhall’navel orange (Citrus sinensis [L] Osbeck cv. Newhall) and its glossy mutant[J]. Plant Cell Reports, 2012, 31(12): 2239-2246. doi:10.1007/s00299-012-133 3-x.
[11] STOCKWELL V, HANCHEY P. Effect of cuticle treatments on infection of Phaseolus vulgaris by Rhizoctonia solani[J]. Journal of Phytopathology, 1985, 114: 6-12. doi:10.1111/j.1439-0434.1985.tb04332.x.
[12] LI Yongcai, YIN Yan, CHEN Songjiang, et al. Chemical composition of cuticular waxes during fruit development of Pingguoli pear and their potential role on early events of Alternaria infection[J]. Functional Plant Biology, 2014, 41(3): 313-320. doi:10.1071/FP13184.
[13] MARTIN J T, BATT R F, BURCHILL R T. Defence mechanism of plants against fungi: fungistatic properties of apple leaf wax[J]. Nature,1957, 180: 796-797.
[14] INYANG E N, BUTT T M, BECKETT A, et al. The effect of crucifer epicuticular waxes and leaf extracts on the germination and virulence of Metarhizium anisopliae conidia[J]. Mycological Research, 1999,103(4): 419-426. doi:10.1017/ S0953756298007333.
[15] PODILA G K, ROGERS L M, KOLATTUKUDY P E. Chemical signals from avocado surface wax trigger germination and appressorium formation in Colletotrichum gloeosporioides[J]. Plant Physiology, 1993, 103(1): 267-272.
[16] 国家统计局. 2017中国统计年鉴[M/OL]. 北京: 中国统计出版社,2017. http://www.stats.gov.cn/tjsj/ndsj/2017/indexch.htm.
[17] 刘起丽, 张建新, 徐瑞富, 等. 柑橘皮内生细菌分离及柑橘青霉病菌拮抗菌筛选研究[J]. 中国农学通报, 2011, 27(28): 235-239.
[18] 张静, 丁胜华, 谢秋涛, 等. 温州蜜柑和冰糖橙果实表面角质层组分及微观结构差异分析[J]. 食品科学, 2018, 39(7): 131-138.doi:10.7506/spkx1002-6630-201807020.
[19] PACCHIANO R A, SOHN W, CHLANDA V L, et al. Isolation and spectral characterization of plant-cuticle polyesters[J]. Journal of Agricultural and Food Chemistry, 1993, 41(1): 78-83. doi:10.1021/jf00025a017.
[20] PARSONS E P, POPOPVSKY S, LOHREY G T, et al. Fruit cuticle lipid composition and water loss in a diverse collection of pepper(Capsicum)[J]. Physiologia Plantarum, 2013, 149(2): 160-174.doi:10.1111/ppl.12035.
[21] CAJUSTE J F, GONZÁLEZ-CANDELAS L, VEYRAT A, et al.Epicuticular wax content and morphology as related to ethylene and storage performance of ‘Navelate’ orange fruit[J]. Postharvest Biology and Technology, 2010, 55(1): 29-35.doi:10.1016/j.postharvbio.2009.07.005.
[22] WANG Jinqiu, HAO Haohao, LIU Runsheng, et al. Comparative analysis of surface wax in mature fruits between Satsuma mandarin(Citrus unshiu) and ‘Newhall’ navel orange (Citrus sinensis) from the perspective of crystal morphology, chemical composition and key gene expression[J]. Food Chemistry, 2014, 153(15): 177-185. doi:10.1016/j.foodchem.2013.12.021.
[23] SALA J M. Content, chemical composition and morphology of epicuticular wax of Fortune mandarin fruits in relation to peel pitting[J]. Journal of the Science of Food and Agriculture, 2000,80(13): 1887-1894. doi:10.1002/1097-0010(200010).
[24] VERAVERBEKE E A, LAMMERTYN J, SAEVELS S, et al.Changes in chemical wax composition of three different apple(Malus domestica Borkh.) cultivars during storage[J]. Postharvest Biology and Technology, 2001, 23(3): 197-208. doi:10.1016/S0925-5214(01)00128-4.
[25] RADLER F, HORN D H S. The composition of grape cuticle wax[J]. Australian Journal of Chemistry, 1965, 18(7): 1059-1069.doi:10.1071/CH9651059.
[26] TUSBAKI S, OZAKI Y, YONEMORI K, et al. Mechanical properties of fruit-cuticular membranes isolated from 27 cultivars of Diospyros kaki Thunb[J]. Food Chemistry, 2012, 132(4): 2135-2139.doi:10.1016/j.foodchem.2011.12.039.
[27] ISAACSON T, KOSMA D K, MATAS A J, et al. Cutin def i ciency in the tomato fruit cuticle consistently affects resistance to microbial infection and biomechanical properties, but not transpirational water loss[J]. The Plant Journal, 2009, 609(2): 363-377. doi:10.1111/j.1365-313X.2009.03969.x.
[28] VOGG G, FISCHER S, LEIDE J, et al. Tomato fruit cuticular waxes and their effects on transpiration barrier properties: functional characterization of a mutant deficient in avery-long-chain fatty acid beta-ketoacyl-CoA synthase[J]. Journal of Experimental Botany, 2004,55(401): 1401-1410. doi:10.1093/jxb/erh149.
[29] BUSCHHAUS C, JETTER R. Composition differences between epicuticular and intracuticular wax substructures: how do plants seal their epidermal surfaces?[J]. Journal of Experimental Botany, 2011,62(3): 841-853. doi:10.1093/jxb/erq366.
[30] YIN Yan, BI Yang, CHEN Songjiang, et al. Chemical composition and antifungal activity of cuticular wax isolated from Asian pear fruit(cv. Pingguoli)[J]. Scientia Horticulturae, 2011, 129(4): 577-582.doi:10.1016/j.scienta.2011. 04.028.
[31] PESCHEL S, FRANKE R, SCHREIBER L, et al. Composition of the cuticle of developing sweet cherry fruit[J]. Phytochemistry, 2007,68(7): 1017-1025. doi:10.1016/j.phytochem.2007.01.008.
[32] CROTEAU R, FAGERSON I S. The chemical composition of the cuticular wax of cranberry[J]. Phytochemistry, 1971, 10(12): 3239-3245. doi:10.1016/S0031-9422(00)97379-5.
[33] MARGA F, PESACRETA T C, HASENSTEIN K G. Biochemical analysis of elastic and rigid cuticles of Cirsium horridulu[J]. Planta,2001, 213: 841-848. doi:10.1007/s004250100576.
[34] ŁAZNIEWSKA J, MACIOSZEK V K, KONONOWICZ A K. Plantfungus interface: the role of surface structures in plant resistance and susceptibility to pathogenic fungi[J]. Physiological and Molecular Plant Pathology, 2012, 78: 24-30. doi:10.1016/j.pmpp.2012.01.004.
[35] NAZIRI E, MANTZOURIDOU F, TSIMIDOU M Z. Enhanced squalene production by wild-type Saccharomyces cerevisiae strains using safe chemical means[J]. Journal of Agricultural and Food Chemistry, 2011, 59(18): 9980-9989. doi:10.1021/jf201328a.
[36] LIU Pu, LUO Li, GUO Junhong, et al. Farnesol induces apoptosis and oxidative stress in the fungal pathogen Penicillium expansum[J].Mycologia, 2010, 102(2): 311-318. doi:10.3852/09-176.
[37] LI Y C, AN L Z, GE Y H, et al. Detection and isolation of preformed antifungal compounds from the peel of Pyrusbretschneideri Rehd. cv.Pingguoli at different stages of maturity[J]. Journal of Phytopathology,2008, 156: 115-119. doi:10.1111/j.1439-0434.2007.01340.x.
[38] GILBERT R D, JOHNSON A M, DEAN R A. Chemical signals responsible for appressorium formation in the rice blast fungus Magnaporthe grisea[J]. Physiological and Molecular Plant Pathology,1996, 48(5): 335-346. doi:10.1006/pmpp.1996.0027.
Change of Cuticle Components in Mature Satsuma Mandarin Fruits (Citrus unshiu) during Cold Storage and Their Effects on the Growth of Penicillium digitatum
单杨(1963—)(ORCID: 0000-0002-1954-5719),男,研究员,博士,主要从事果蔬加工技术与理论研究。E-mail: sy6302@sohu.com
丁胜华(1985—)(ORCID: 0000-0003-2383-0843),男,副研究员,博士,主要从事果蔬加工及贮藏研究。E-mail: shhding@hotmail.com
ZHANG Jing, WANG Rongrong, SHAN Yang, et al. Change of cuticle components in mature Satsuma mandarin fruits (Citrus unshiu) during cold storage and their effects on the growth of Penicillium digitatum[J]. Food Science, 2019, 40(1): 233-239.(in Chinese with English abstract)doi:10.7506/spkx1002-6630-20170928-411. http://www.spkx.net.cn