冷冻保鲜是水产品最常用的保鲜技术。冻结水产品的品质很大程度上取决于水产品在冻结过程中形成冰晶的大小和数量[1]。大多数水产品品在冻结过程中形成的冰晶越小,肌肉组织破坏越小,冻藏期间品质下降越缓慢[2],而冻结速率对晶核的形成以及冰晶的生长有至关重要的影响[3],即通过最大冰晶生成带(0~-5 ℃)的时间越短,越有利于保持食品原有的品质[4]。不冻液冻结也称为浸渍冻结,是指食品与载冷剂直接接触(或间接接触)换热后,迅速降温并冻结的过程[5]。其载冷剂为液体,大多数液体的导热系数为0.116~0.62 8 W/(m·K),是空气的5~ 1 0 倍 以 上[6]。 徐 慧 文 等[7]将金枪鱼分别使用盐水冻结和空气冻结发现,从室温到完全冻结,-25 ℃空气冻结需要249.9 min,浸渍于-25 ℃的盐水溶液中只需155.2 min。
乌鳢,俗称乌鱼、黑鱼、火头等,隶属于鳢科(Channidae),是肉食性动物,广布于我国南北水域。乌鳢骨刺少,肉味鲜美,具有去瘀生新、生肌补血、滋补调养、利尿祛风、促进伤口愈合等功效[8]。近年来随着国内养殖业的发展,乌鳢逐渐受到人们的关注和喜爱。目前的研究主要集中于乌鳢养殖技术及其组织学研究[9-10],关于乌鳢的冻藏品质鲜有研究。本研究以新鲜乌鳢为原料,利用-20、-30、-40 ℃3 种不同冻结温度的不冻液冻结乌鳢,以空气冻结方式为对照,并将冻结后的乌鳢置于-18 ℃贮藏270 d,观察冰晶的变化并结合pH值、盐溶性蛋白含量、挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量、脂肪氧化产物、持水性等理化指标,研究鱼肉品质在冻藏过程中的变化,为水产品的新型冻结技术提供理论依据。
材料:鲜活乌鳢10 条,购于浙江省杭州市下城区农贸市场,平均体质量(1 000±200)g。宰杀后去头、尾、内脏,用流动水洗去表面杂物,去皮、脊骨,取鱼背部肉顺纤维方向横切,切成约2 cm×2 cm×2 cm的鱼块;聚乙烯薄膜包裹后备用。
苏木精-伊红染液(分析纯) 上海鼎国生物技术有限公司;高氯酸、硫代巴比妥酸、三氯乙酸、氢氧化钠等(均为分析纯) 国药集团试剂公司。
不冻液组成:m(体积分数95%乙醇)∶m(乙二醇)∶m(氯化钠)∶m(水)=30∶15∶10∶45(冻结点约-48.2 ℃,所用原料均为食品级)。
Nx50半导体冷冻切片机 美国Thermo公司;D5060低温恒温反应浴 杭州大卫有限公司;BX41光学显微镜 日本Olympus公司;T25高速分散机 德国IKA公司;UV762紫外-可见分光光度计 上海仪电分析仪器有限公司;K9840自动凯氏定氮仪 济南海能仪器股份有限公司;PHS-3C型pH计 上海精密科学仪器有限公司。
1.3.1 乌鳢块的冻结冻藏处理
不冻液冻结组:将配好的不冻液分别预冷至(-20±1)、(-30±1)、(-40±1)℃后,将包裹后的鱼块置于不冻液中进行冻结;空气冻结组:另取包裹后的鱼块置于-20 ℃冰柜中冻结。当中心温度为-18 ℃时取出,将冻结后的鱼块真空包装后于(-18±2)℃中冻藏270 d,间隔15 d取样,将样品于(4.0±0.5)℃环境中解冻16 h后进行相关品质测定。
1.3.2 冻结曲线及冻结速率计算
将K型热电偶探头插入鱼块的几何中心位置,另一端连接温度记录仪,将鱼块放入-20、-30 ℃和-40 ℃不冻液中每隔30 s记录1 次温度,绘制冻结曲线。-20 ℃空气冻结组的鱼块每隔5 min记录1 次温度。冻结速率按照国际制冷协会提出的方法计算(式(1))[11]。
式中:δ为食品表面与热中心的最短距离/cm;τ为食品表面达0 ℃后食品中心温度降到比食品冻结点低10 ℃所需的时间/h。
计算时,取鱼块中心3 个温度探头中温度下降最慢的探头点为中心温度点。
1.3.3 盐溶性蛋白含量的测定
采用丁玉庭等[12]的方法,并稍作修改。具体操作如下:准确称取5.0 g解冻后鱼肉,绞碎,加入45 mL低离子强度磷酸盐缓冲溶液(0.025 mol/L NaH2PO4、0.025 mol/L Na2HPO4,pH 6.8),匀浆3 min。在4 ℃冰箱中抽提1 h后离心(12 000 r/min,30 min),得上清液即为肌浆蛋白。所得沉淀用9 倍体积高离子强度磷酸盐缓冲(0.02 5 m o l/L NaH2PO4、0.025 mol/L Na2HPO4、0.6 mol/L KCl,pH 6.8)匀浆30 s(15 000 r/min、4 ℃,要求无气泡),4 ℃条件下抽提3 h后离心(12 000 r/min,30 min),重复上述操作1 次,所得上清液为盐溶性蛋白质。蛋白质含量采用双缩脲法测定[13]。1.3.4 硫代巴比妥酸值的测定
硫代巴比妥酸(thiobarbituric acid,TBA)值的测定采用Fan Wenjiao等[14]的方法。具体操作如下:称取剪碎的鱼肉5 g,加入45 mL体积分数7.5%的三氯乙酸匀浆2 min(搅打30 s,停30 s),室温下抽提30 min后过滤。取5 mL滤液和5 mL TBA溶液(0.02 mol/L),空白组取5 mL纯三氯乙酸和5 mL TBA溶液(0.02 mol/L),于90 ℃水浴中反应40 min,再冷却至室温,然后在532 nm波长处测定吸光度。
式中:A、A0分别表示实验组、空白组吸光度;m表示样品质量/g。
1.3.5 TVB-N含量的测定
称取10 g解冻后鱼肉加90 mL 0.6 mol/L高氯酸匀浆,4 ℃下抽提30 min后过滤。取滤液,参考SC/T 3032—2007《水产品中挥发性盐基氮的测定》[15]方法测定TVB-N含量。
1.3.6 pH值的测定
称取解冻后鱼块样品10 g 左右,加入90 mL蒸馏水匀浆30 s,4 ℃离心(4 500 r/min,10 min)取上清液测其pH值,每个样品做3 次平行[16]。
1.3.7 持水性的测定
持水性用汁液流失率和蒸煮损失率表示,二者计算如式(3)、(4)所示。

1.3.8 冰晶形态分析
取冻藏时间0、30、90、150 d的鱼背部肌肉,在-15 ℃下切成长宽各1 cm、厚4~5 mm,包埋剂包埋后,进行冰冻切片,顺肌纤维切成7 μm厚度。然后在含体积分数15%甲醛和体积分数10%丙酮的混合溶液中固定30 min后进行苏木精-伊红常规染色。带有摄像功能的数码相机下的光学显微镜拍摄切片组织图像,并进行观察。利用Image J图像分析软件对冰晶所处的位置进行相对直径和面积的分析和计算,为了保证数据计算的准确性,每个处理计算的样本量需大于100。
冰晶面积采用不规则自动光学检测抓取,像素和实际尺寸之间的折算已经标定,直接可以计算出冰晶面积(S/μm2);相对直径(d/μm)定义为与研究对象具有相等面积圆的直径,按式(5)进行计算。
数据结果采用软件SPSS 12.0进行处理,结果采用平均值±标准差表示。不同处理间的比较采用最小显著差异法(least signif i cant difference,LSD),P<0.05表示差异显著。采用Origin 8.6软件进行作图。
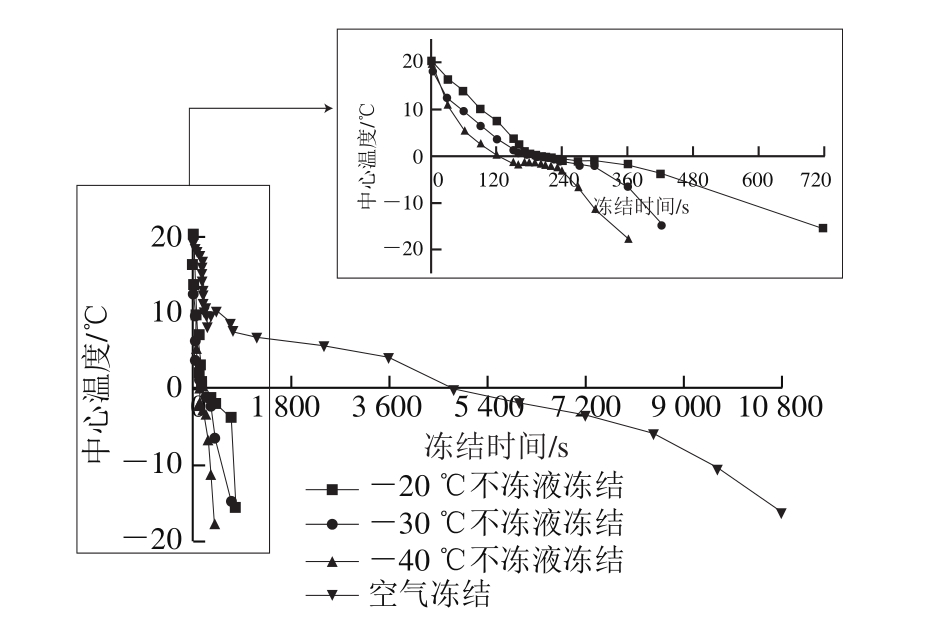
图1 不同冻结条件下乌鳢块冻结曲线
Fig.1 Freezing curves of the central part of snakehead blocks under different freezing conditions
食品的冻结点由其化学组成和自由水含量决定。由图1可知,乌鳢块的冻结点大约是-2.0 ℃左右,略高于鳕鱼等海水鱼的冻结温度(-2.2 ℃),低于淡水鱼草鱼、青鱼(-0.2~-0.7 ℃)、草鱼((-0.6±0.1)℃)的冻结温度[17]。
表1 乌鳢块在不同冻结条件下冻结时间的分布和冻结速率
Table1 Freezing time distribution at each freezing stage and freezing rate under different freezing conditions

注:同列肩标小写字母不同表示差异显著(P<0.05)。
冻结类型空气冻结 960±82a 3 412±108a 2 350±114a 6 722±260a0.38±0.02d 慢冻-20 ℃不冻液冻结 102±11b 310±16b 266±22b 678±34b 3.42±0.42c 速冻-30 ℃不冻液冻结 58±7c 226±18c 108±12c 392±20c 5.63±0.81b 速冻-40 ℃不冻液冻结 51±8c 125±4d 90±4c 266±14d 8.65±0.65a 速冻处理组 预冷阶段(4~0 ℃)时间/s冰晶形成阶段(0~-5 ℃)时间/s冻结降温阶段(-5~-18 ℃)时间/s 总时间/s 冻结速率/(cm/h)
国际制冷学会指出,当冻结速率大于0.5 cm/h时视为速冻[13]。由表1可知,当乌鳢块中心温度达-18 ℃时,空气冻结的冻结速率是0.38 cm/h ,-20、-30、-40 ℃3 种不冻液冻结速率分别为3.42、5.63、8.65 cm/h,是空气冻结的10 倍以上。这与欧阳杰等[18]采用空气冻结和浸渍冻结鲍鱼研究的结果类似。冻结过程可分为预冷、冰晶形成、冻结降温3 个阶段。通过冰晶形成阶段的时间越短,生成的冰晶越小,冰晶分布也越均匀,对食品的破坏也越少[19]。由表1可知,空气冻结和-20、-30、-40 ℃不冻液冻结的乌鳢块通过最大冰晶生成带的时间分别为3 412、310、226、125 s,不冻液冻结方式下最大冰晶形成的时间远低于空气冻结组,且不冻液温度越低,冻结速率越快,通过最大冰晶生成带的时间也越短[20]。
鱼肉中蛋白质的功能特性主要是由肌原纤维蛋白所决定,其溶解度是肌肉在冻藏过程中蛋白质冷冻变性程度的主要指标之一。肌肉的盐溶性蛋白含量越低,冷冻变性程度越高。随着冻藏时间的延长,草鱼肉中盐溶性蛋白的含量逐渐减少,造成肌原纤维蛋白溶解度下降[21]。新鲜乌鳢块的盐溶性蛋白含量为112 mg/g,冻藏过程中空气冻结和不冻液冻结组鱼肉盐溶性蛋白含量均有不同程度的下降(图2)。冻藏至270 d时,空气冻结组中鱼肉盐溶性蛋白含量为60.24 mg/g,与新鲜乌鳢相比,降低了46.2%。-20、-30、-40 ℃不冻液冻结组冻藏270 d时盐溶性蛋白含量分别为68.14、71.25、74.28 mg/g,分别下降了39.2%、36.4%、33.7%。可能是由于不冻液冻结时冻结速率较快,形成的冰晶细小、均匀,对肌原纤维造成的破坏较小,盐溶性蛋白含量下降相对缓慢。胡亚芹等[22]研究不同冻结方式对带鱼品质的影响时也指出,冻结速率越快,其盐溶性蛋白含量下降越缓慢。引起冻藏过程中盐溶性蛋白含量下降的因素有许多,如水分形成冰晶使蛋白质失去部分结合水从而析出,以及肌动球蛋白分子间形成非共价键,进而发生蛋白交联、凝集,使肌动球蛋白的溶出量减少[23]。
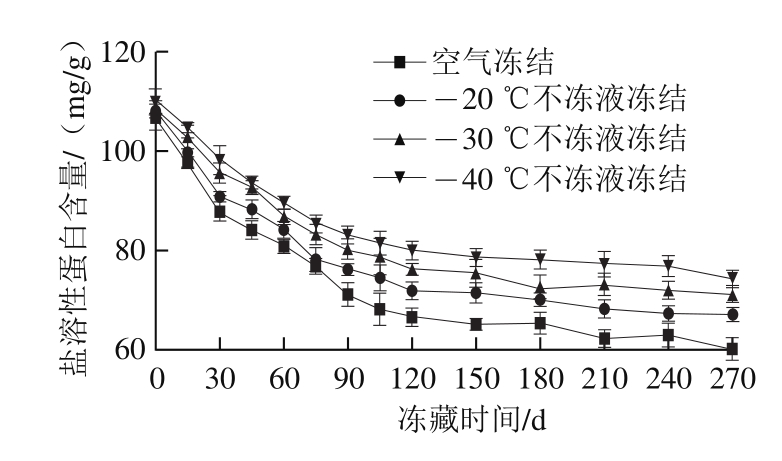
图2 不同条件冻藏期间乌鳢块盐溶性蛋白含量变化
Fig.2 Changes in salt-soluble protein content in snakehead blocks during frozen storage
鱼体在冻藏过程中会发生脂肪氧化。TBA值能反映鱼肉中脂肪氧化腐败程度,是判断脂肪氧化程度的重要指标。通过检测鱼肉中脂肪氧化降解产物丙二醛含量来评价鱼肉品质。由图3可知,冻藏期间不同冻结温度下TBA值均呈上升趋势;且空气冻结组始终高于不冻液冻结组,不冻液冻结温度越低,TBA值上升越缓慢。新鲜乌鳢的TBA值为0.16 mg/kg,冻藏前45 d,TBA值上升速率最快,不同冻结方式下均上升了50%左右。冻藏270 d时,空气冻结和-20、-30、-40 ℃不冻液冻结组TBA值分别为0.82、0.72、0.70、0.65 mg/kg,分别是新鲜样品的5.13、4.50、4.38、4.06 倍。由此可知,冻结速率越高,TBA值上升越缓慢。这可能是由于冻结速率较快时,冻结过程中形成的冰晶较小且比较均匀,对鱼肉细胞造成的损伤较少,脂肪的氧化也较缓慢。Boonsumrej等[24]认为冰晶形成时,由于体积膨胀,细胞受到挤压变形甚至破裂,氧化酶、促氧化剂等从破裂的细胞中释放出来,加速了脂肪的氧化。
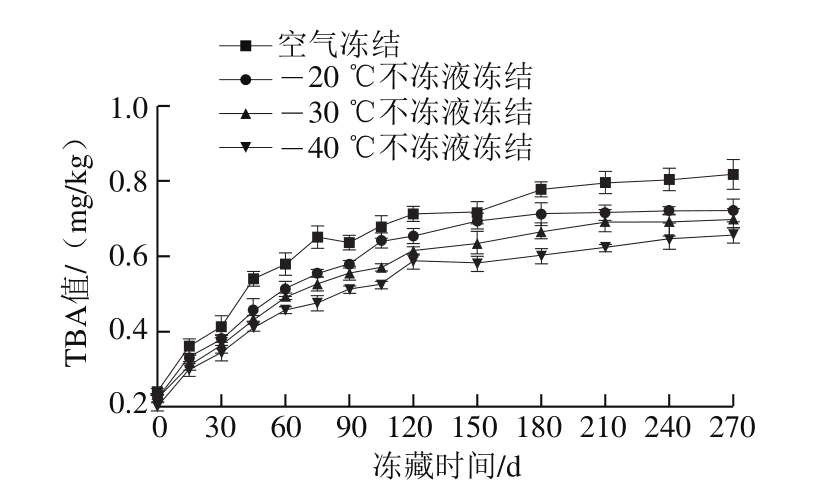
图3 不同条件冻藏期间乌鳢块TBA值变化
Fig.3 Changes in TBA value in snakehead blocks during frozen storage
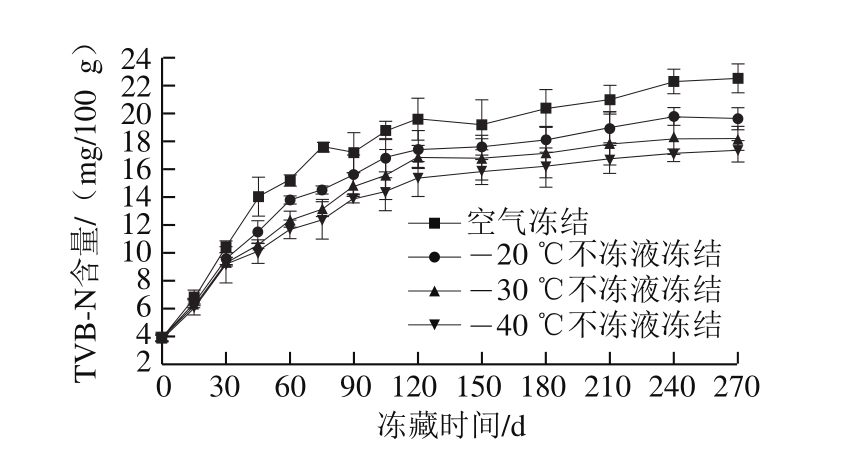
图1 不同条件冻藏期间乌鳢块TVB-N含量的变化
Fig.1 Changes in TVB-N content in snakehead blocks during frozen storage
TVB-N是指动物性食品在其肌肉中内源酶或细菌作用下,蛋白质分解产生的氨、胺类等碱性含氮挥发性物质,是评价水产品鲜度的重要指标。由图4可知,冻藏期间鱼块TVB-N含量均呈上升趋势,且空气冻结组TVB-N含量始终高于不冻液冻结组。新鲜乌鳢块的TVB-N含量为3.0 mg/100 g。冻藏前60 d,-20、-30、-40 ℃不冻液冻结鱼块的TVB-N含量无显著性差异(P>0.05)。冻藏至180 d时空气冻结组鱼肉TVB-N含量为20.4 mg/100 g,已超过淡水鱼的食品卫生标准G B2 73 3—2 0 0 5《鲜、冻动物性水产品卫生标准》限量规定(供人们食用的鱼肉TVB-N含量应不超过20 mg/100 g)。冻藏时间延长至270 d时,-20、-30、-40 ℃不冻液冻结组的TVB-N含量分别为19.6、18.2、17.3 mg/100 g,仍然低于淡水鱼的限量水平。一方面是由于不冻液冻结的冻结速度较快,生成的冰晶较小,对鱼肉组织细胞的破坏较小;另一方面可能是温度越低,酶活性越小,降低了鱼肉蛋白的分解速度,更有利于保持冻藏鱼块的品质。
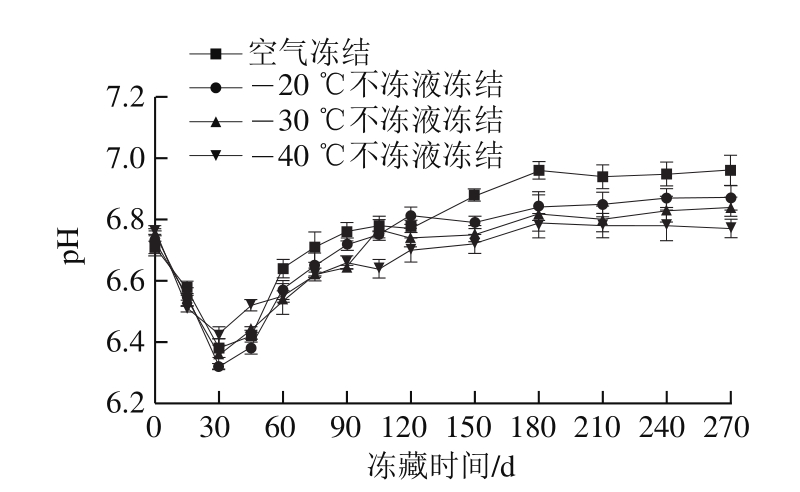
图5 不同条件冻藏期间乌鳢块pH值的变化
Fig.5 Changes in pH in snakehead blocks during frozen storage
pH值是评价鱼肉鲜度的一个主要指标。由图5可知,冻藏期间鱼肉中pH值呈先下降后上升的趋势。在冻藏初期,pH值下降主要是鱼死后体内的糖原分解产生乳酸以及脂肪水解产生游离脂肪酸所致[25],而随后pH值上升则主要是由于鱼肉中腐败细菌分解蛋白质,产生氨、三甲胺、吲哚、组胺等碱性物质,使鱼肌肉pH值不断增加,鱼肉品质下降[26]。新鲜乌鳢块的pH值为6.8。冻藏前30 d鱼肉pH值均呈下降趋势,冻藏第30天时,-20、-30、-40 ℃不冻液冻结组和空气冻结组的pH值分别为6.32、6.36、6.42、6.38。冻藏30 d后pH值开始呈上升趋势。冻藏至270 d时,-40 ℃不冻液冻结组的鱼肉pH值最小,说明鱼肌肉蛋白降解较慢,品质保存较好。
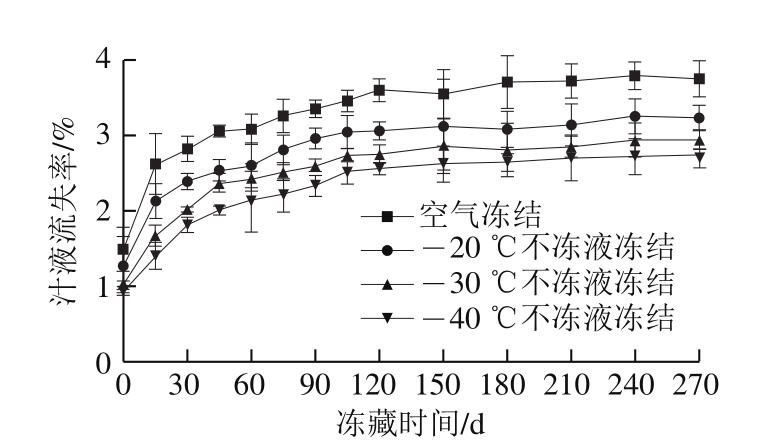
图6 冻藏期间乌鳢块汁液流失率变化
Fig.6 Changes in drip loss in snakehead blocks during frozen storage
汁液流失会带走鱼肉中部分可溶性蛋白质和其他营养物质,影响产品的质构、色泽,降低食品的营养价值。如图6所示,冻藏期间不同冻结方式鱼肉汁液流失率均随冻藏时间延长而增加。冻藏初始时,空气冻结和-20、-30、-40 ℃不冻液冻结处理的样品汁液流失率分别为1.49%、1.27%、1.02%、0.94%,冻藏至270 d时,-20、-30、-40 ℃不冻液冻结组汁液流失率分别上升到3.23%、2.95%、2.75%,均低于空气冻结组。高琪[27]采用浸渍冻结、空气冻结和鼓风冻结处理鳙鱼头,冻藏初始阶段这3 种冻结方式下汁液流失率分别为1.12%、1.99%、2.22%,冻结速率越快,鳙鱼头汁液流失率越小。原因可能是冻结速率快,形成的冰晶小、数量多,且均匀分布在细胞内和细胞间隙,蛋白冷冻变性程度低,蛋白结构稳定,持水性较好,汁液流失率低[28]。
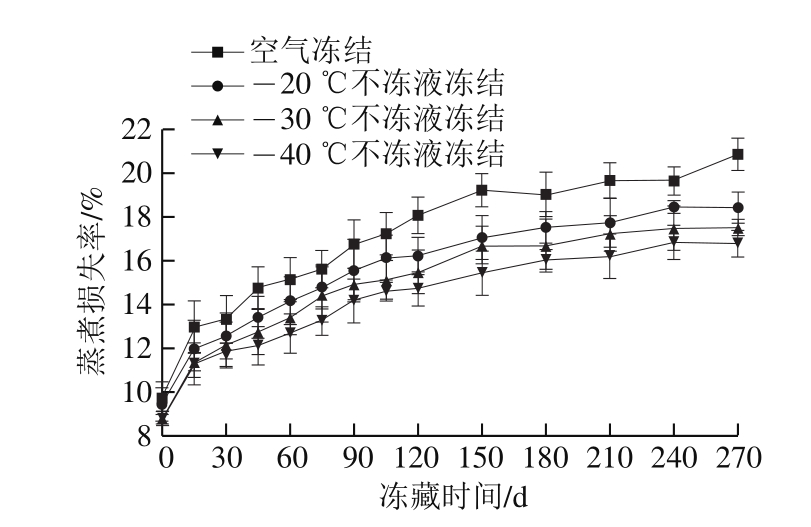
图7 冻藏期间乌鳢块蒸煮损失率变化
Fig.7 Changes in cooking loss in snakehead blocks during frozen storage
蒸煮损失率是指鱼肉从鲜肉到熟肉过程中水分的流失状况,也是衡量鱼肉持水能力的重要指标之一。高蒸煮损失率不仅使鱼肉食用品质下降,也影响鱼肉的外观。由图7可知,冻藏期间不同冻结方式乌鳢块的蒸煮损失率均有不同程度的增加。当冻藏至270 d时,空气冻结组的蒸煮损失由初始值9.72%上升到20.88%,增加了1.15 倍。-20、-30、-40 ℃不冻液冻结组乌鳢块蒸煮损失率也由初始值9.14%、8.83%、8.78%分别上升到18.42%、17.52%、16.38%,均明显低于空气冻结组。-40 ℃不冻液冻结组蒸煮损失率变化幅度最小,说明快速冻结的鱼肉持水性好,蒸煮损失率较低。
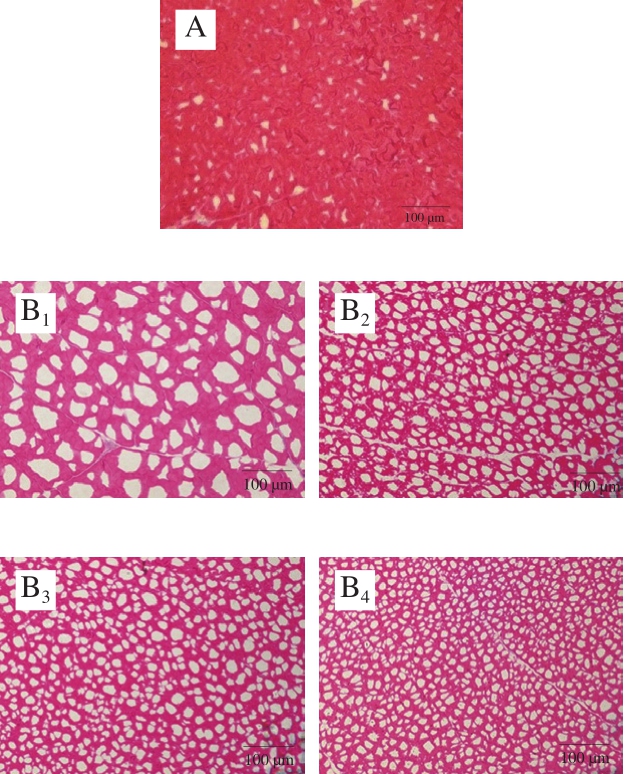

图8 乌鳢块冻藏过程中冰晶形态变化(×200)
Fig.8 Changes in ice crystal morphology in snakehead blocks during frozen storage under different conditions (× 200)
微观结构的完整性是冷冻水产品品质的重要指标,主要取决于冻结和冻藏过程中生成的冰晶大小和分布[29]。图8是冻藏期间不同冻结条件下鱼肉横切面冰晶的变化,可通过冰晶留下的间隙来间接反映冰晶的大小。由图8可知,与不冻液冻结组相比,经空气冻结的鱼肉冰晶面积最大且冰晶数量较少,冻藏过程中肌纤维逐渐断裂,细胞核逐渐减少,冰晶面积变大且分布不规则,这主要是因为空气冻结是一个慢速冻结的过程,形成冰核速率低、成核较少、导致主要在细胞外形成大的冰晶[30]。
与空气冻结组相比,经不冻液冻结的鱼肉冰晶数量多,分布较均匀,且冻结温度越低,形成的冰晶越小、分布越规则、数量越多。不冻液冻结样品冻藏150 d后,冰晶大小变化不明显,肌纤维仍能保持完整性。这可能是因为不冻液冻结组在快速冷冻过程中,不冻液对物品的传热较为迅速,细胞内液过冷产生了晶核,细胞内部和外部均形成了许多小冰晶,对细胞的机械损伤较小。Ishiguro等[31]的研究发现,细胞中冰晶的形成与冻结速率有关,高冻结速率下冰晶的数量可达低冻结速率的2 倍以上;且冰晶形成尺寸与样品大小有关,在样品较大时,冻结速率会降低,形成的冰晶尺寸会增加。
对乌鳢块冻藏过程中冰晶的形态进行定量分析,将不同条件下的冰晶面积和相对直径进行比较,结果见表2。冻藏初始时经空气冻结的鱼块冰晶面积最大,为939.6 μm2,-20、-30、-40 ℃3 种不冻液冻结温度下冰晶面积的分别为308.8、142.4 μm2和86.5 μm2。冻藏150 d时,空气冻结组和-20、-30、-40 ℃不冻液冻结组中乌鳢肉的冰晶面积分别为4 215.7、789.6、484.5、344.8 μm2,不同冻结方式下鱼肉形成冰结晶的面积有显著性差异(P<0.05)。冻结温度越低,形成的冰晶面积和相对直径越小。这可能是因为高的冻结速率有利于创造更高程度的过冷却条件,能快速消除样品在通过最大冰晶生成带中生成的潜热[32],从而降低冷冻对组织细胞的破坏作用,更有利于产品品质的保存。
表2 乌鳢块冻藏过程中冰晶大小的变化
Table2 Changes in the size of ice crystals in snakehead blocks during frozen storage under different conditions
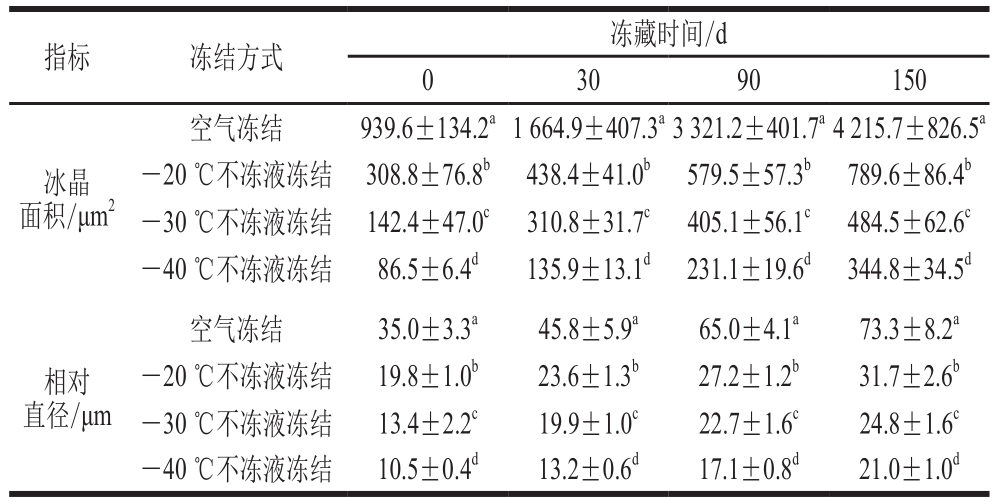
注:对于同一指标,同列肩标字母不同表示差异显著(P<0.05)。
指标 冻结方式 冻藏时间/d 0 30 90 150冰晶面积/μm2空气冻结 939.6±134.2a1 664.9±407.3a3 321.2±401.7a4 215.7±826.5a-20 ℃不冻液冻结 308.8±76.8b 438.4±41.0b 579.5±57.3b 789.6±86.4b-30 ℃不冻液冻结 142.4±47.0c 310.8±31.7c 405.1±56.1c 484.5±62.6c-40 ℃不冻液冻结 86.5±6.4d 135.9±13.1d 231.1±19.6d 344.8±34.5d相对直径/μm空气冻结 35.0±3.3a 45.8±5.9a 65.0±4.1a 73.3±8.2a-20 ℃不冻液冻结 19.8±1.0b 23.6±1.3b 27.2±1.2b 31.7±2.6b-30 ℃不冻液冻结 13.4±2.2c 19.9±1.0c 22.7±1.6c 24.8±1.6c-40 ℃不冻液冻结 10.5±0.4d 13.2±0.6d 17.1±0.8d 21.0±1.0d
本实验研究了3 种冻结温度(-20、-30、-40 ℃)不冻液冻结和空气冻结对乌鳢块冻藏期间冰晶及品质变化。结果表明,-20、-30、-40 ℃不冻液冻结和空气冻结组通过最大冰晶生成带的时间分别为310、226、125、3 412 s;不冻液冻结的速率明显高于空气冻结。冻结过程中空气冻结的乌鳢块冰晶面积明显高于不冻液冻结,3 种不同温度的不冻液冻结组形成冰晶面积较小,且比较均匀,-40 ℃不冻液冻结下形成冰晶面积最小,为86.5 μm2,明显低于其他组。在冻藏过程中,不冻液冻结乌鳢块TVB-N含量、TBA值、pH值、汁液流失率和蒸煮损失率等指标均显著低于空气冻结组;且-40 ℃不冻液冻结下乌鳢的TVB-N含量、TBA值、pH值、汁液流失率和蒸煮损失率等指标均低于-20 ℃和-30 ℃不冻液冻结组,说明冻结温度越低、冻结速率越大,越有利于产品品质的保存。主要是由于不冻液冻结速度快,形成冰晶小,对鱼微观组织结构破坏小,从而抑制冻藏过程中各种生物化学反应。结果表明,不冻液冻结比空气冻结更有利于保存乌鳢块冻藏品质,且冻结速率较快时,品质变化缓慢。
[1] 林婉玲, 杨贤庆, 王锦旭, 等. 浸渍冻结对凡纳滨对虾冻藏过程中肌肉组织的影响[J]. 现代食品科技, 2015, 31(6): 183-189.doi:10.13982/j.mfst.1673-9078.2015.6.029.
[2] ZHANG Z, SUN D W, ZHU Z W, et al. Enhancement of crystallization processes by power ultrasound: current state-of-the-art and research advances[J]. Comprehensive Reviews in Food Science and Food Safety, 2015, 14(4): 303-316. doi:10.1111/1541-4337.12132.
[3] KIANI H, SUN D W. Water crystallization and its importance to freezing of foods: a review[J]. Trends in Food Science & Technology,2011, 22(8): 407-426. doi:10.1016/j.tifs.2011.04.011.
[4] KIANI H, ZHANG Z H, SUN D W. Effect of ultrasound irradiation on ice crystal size distribution in frozen agar gel samples[J]. Innovative Food Science & Emerging Technologies, 2013, 18(2): 126-131.doi:10.1016/j.ifset.2013.02.007.
[5] ULLAH K R, SAIDUR R, PING H W, et al. A review of solar thermal refrigeration and cooling methods[J]. Renewable and Sustainable Energy Reviews, 2013, 24(10): 499-513. doi:10.1016/j.rser.2013.03.024.
[6] ZORRILLA S E, RUBIOLO A C. Mathematical modeling for immersion chilling and freezing of foods. part II. model solution[J].Journal of Food Engineering, 2005, 66(3): 339-351. doi:10.1016/j.jfoodeng.2004.03.027.
[7] 徐慧文, 谢晶, 汤元睿, 等. 金枪鱼在不同浓度CaCl2载冷剂冻结下的渗盐量及品质变化研究[J]. 食品工业科技, 2015, 36(9): 315-319;326. doi:10.13386/j.issn1002-0306.2015.09.060.
[8] 赵立, 陈军, 赵春刚, 等. 野生和养殖乌鳢肌肉的成分分析及营养评价[J]. 现代食品科技, 2015(9): 244-249. doi:10.13982/j.mfst.1673-9078.2015.9.040.
[9] 范志峰, 尚俊峰. 黑鱼养殖的关键技术[J]. 渔业致富指南, 2013,36(13): 36-37.
[10] 王鑫毅, 韩艳楠, 金珊, 等. 乌鳢产吲哚金黄杆菌的鉴定及其胞外产物特性分析[J]. 水生生物学报, 2016, 40(3): 641-646.doi:10.7541/2016.86.
[11] 曾庆孝. 食品加工与保藏原理[M]. 北京: 化学工业出版社, 2015:100-116.
[12] 丁玉庭, 何晋浙, 朱旭东, 等. 黑豚肌肉的蛋白质组成及肌原纤维蛋白质的冷藏稳定性研究[J]. 食品科学, 1999, 20(10): 12-16.
[13] 黄伟坤. 食品检验与分析[M]. 北京: 中国轻工业出版社, 1989: 71-72.
[14] FAN Wenjiao, CHI Yuanlong, ZHANG Shuo. The use of a tea polyphenol dip to extend the shelf life of silver carp(Hypophthalmicthys molitrix) during storage in ice[J]. Food Chemistry,2008, 108(1): 148-153. doi:10.1016/j.foodchem.2007.10.057.
[15] 农业部. 水产品中挥发性盐基氮的测定: SC/T 3032—2007[S]. 北京: 中国农业出版社, 2008: 1-5.
[16] 武华, 阴晓菲, 罗永康, 等. 腌制鳙鱼片在冷藏过程中品质变化规律的研究[J]. 南方水产科学, 2013, 9(4): 69-74. doi:10.3969/j.issn.2095-0780.2013.04.012.
[17] 阮征, 李汴生, 朱志伟, 等. 不同冻结速率对脆肉鲩鱼片冻结特性的影响研究[J]. 农业工程学报, 2008, 24(2): 250-254. doi:10.3321/j.issn:1002-6819.2008.02.047.
[18] 欧阳杰, 谈佳玉, 沈建, 等. 浸渍冻结大黄鱼贮藏期间品质变化研究[J]. 南方水产科学, 2013, 9(6): 72-77. doi:10.3969/j.issn.2095-0780.2013.06.012.
[19] XU B G, ZHANG M, BHANDARI B, et al. Effect of ultrasound immersion freezing on the quality attributes and water distributions of wrapped red radish[J]. Food and Bioprocess Technology, 2015, 8(6):1366-1376. doi:10.1007/s11947-015-1496-x.
[20] WIKTOR A, SCHULZ M, VOIGT E, et al. The effect of pulsed electric fi eld treatment on immersion freezing, thawing and selected properties of apple tissue[J]. Journal of Food Engineering, 2015, 146:8-16. doi:10.1016/j.jfoodeng.2014.08.013.
[21] 林婉玲, 杨贤庆, 李来好, 等. 浸渍冻结对调理草鱼冻藏过程中肌原纤维蛋白特性的影响[J]. 南方水产科学, 2016, 12(3): 67-73.doi:10.3969/j.issn.2095-0780.2016.03.009.
[22] 胡亚芹, 胡庆兰, 杨水兵, 等. 不同冻结方式对带鱼品质影响的研究[J]. 现代食品科技, 2014, 30(2): 23-30. doi:10.13982/j.mfst.1673-9078.2014.02.020.
[23] MI H B, QIAN C L, ZHAO Y Y, et al. Comparison of superchilling and freezing on the microstructure, muscle quality and protein denaturation of grass carp (Ctenopharyngodon idellus)[J]. Journal of Food Processing and Preservation, 2012, 37(5): 546-554.doi:10.1111/j.1745-4549.2012.00678.x.
[24] BOONSUMREJ S, CHAIWANICHSIRI S, TANTRATIAN S, et al.Effects of freezing and thawing on the quality changes of tiger shrimp(Penaeus monodon) frozen by air-blast and cryogenic freezing[J].Journal of Food Engineering, 2007, 80(1): 292-299. doi:10.1016/j.jfoodeng.2006.04.059.
[25] SONG Y L, LIU L, SHEN H X, et al. Effect of sodium alginatebased edible coating containing different anti-oxidants on quality and shelf life of refrigerated bream (Megalobrama amblycephala)[J]. Food Control, 2011, 22(3/4): 608-615. doi:10.1016/j.foodcont.2010.10.012.
[26] NAKAGAWA R, NOTO H, YASOKAWA D, et al. Microbiological and chemical changes during the industrial soft-drying process of“Migaki-Nishin” herring[J]. Nippon Shokuhin Kogyo Gakkaishi,2007, 54(1): 26-32. doi:10.3136/nskkk.54.26.
[27] 高琪. 鳙鱼头冷冻加工与品质改良技术的研究[D]. 无锡: 江南大学,2015: 20-21.
[28] CAI L Y, WU X S, LI X X, et al. Effects of different freezing treatments on physicochemical responses and microbial characteristics of Japanese sea bass (Lateolabrax japonicas) fi llets during refrigerated storage[J]. LWT-Food Science and Technology, 2014, 59(1): 122-129.doi:10.1016/j.lwt.2014.04.062.
[29] NERI L, HERNANDO I, PÉREZ-MUNUERA I, et al. Mechanical properties and microstructure of frozen carrots during storage as affected by blanching in water and sugar solutions[J]. Food Chemistry,2014, 144(2): 65-73. doi:10.1016/j.foodchem.2013.07.123.
[30] ZHU S M, LE BAIL A, RAMASWAMY H S. Ice crystal formation in pressure shift freezing of Atlantic salmon (Salmo salar) as compared to classical freezing methods[J]. Journal of Food Processing and Preservation, 2003, 27(6): 427-444. doi:10.1111/j.1745-4549.2003.tb00528.x.
[31] ISHIGURO H, KATAORI A, NOZAWA M. 143. three-dimensional microscopic behavior of ice crystals and cells during directional solidif i cation of muscle tissues treated with DMSO[J]. Cryobiology,2009, 59(3): 410. doi:10.1016/j.cryobiol.2009.10.157.
[32] SU G M, RAMASWAMY H S, ZHU S M, et al. Thermal characterization and ice crystal analysis in pressure shift freezing of different muscle (shrimp and porcine liver) versus conventional freezing method[J]. Innovative Food Science and Emerging Technologies, 2014, 26: 40-50. doi:10.1016/j.ifset.2014.05.006.
Effect of Immersion Freezing on Quality Changes of Snakehead Blocks during Frozen Storage
LIU Shulai, ZHANG Zhenyu, TANG Wenyan, et al. Effect of immersion freezing on quality changes of snakehead blocks during frozen storage[J]. Food Science, 2019, 40(1): 256-262. (in Chinese with English abstract)doi:10.7506/spkx1002-6630-20171026-300. http://www.spkx.net.cn