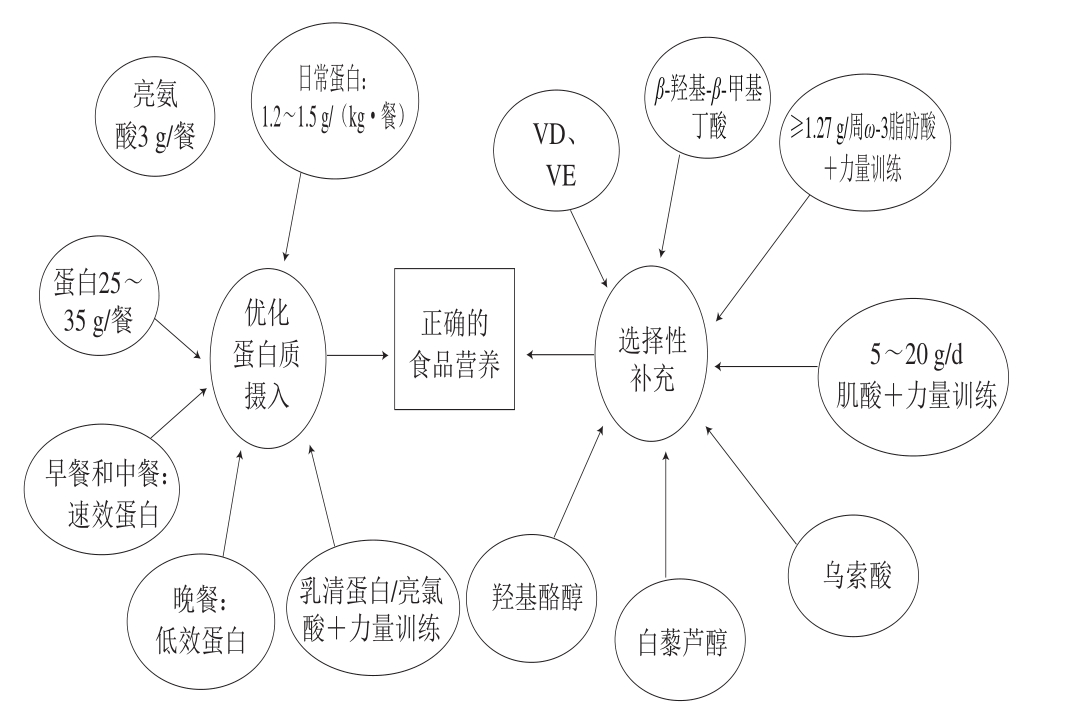
图1 改善衰老性肌萎缩的营养策略
Fig.1 Possible nutritional strategies to counteract sarcopenia
随着世界人口和社会的迅速老龄化,不同健康问题和衰老性疾病的患病率也相继增加,衰老过程中以骨骼肌质量和力量下降为特征的衰老性肌萎缩症的发生率也随着年龄的增长而不断上升[1]。衰老性肌萎缩症的发生会导致老年人身体活动能力降低[2]、生活质量下降、心肺功能受损,使不利的代谢作用[3]、跌倒[4]、残疾和死亡发生率增加[5],以及造成医疗负担的加重[6]。衰老性肌萎缩症的一个典型特征是“丢失”:即伴随着骨量的丢失,肌肉质量和强度的降低,骨的脆性和骨折的风险也相应增加[1]。实际上,骨骼肌和骨的衰退过程是两个并行的过程,而且相互影响,目前人们已认识到骨骼肌的减少会加速骨质的丢失。近年来,随着我国人口老龄化加剧,骨折的发病率逐渐增加,衰老性肌萎缩症也因此越来越受到广泛关注。
衰老性肌萎缩症的发生与营养、活动、激素、代谢、免疫等多种因素有关,其中营养和身体活动是两项重要因素[7]。分子生物学、组织学和生物化学等的研究表明,骨骼肌受自由基氧化损伤及修复受损、骨骼肌蛋白质合成减少、神经肌肉功能衰退和运动单位重组、体内激素水平变化、线粒体功能紊乱等均与衰老性肌萎缩症有关[8]。随着年龄增长,在上述诸多因素的影响下,老年人由于衰老等生理变化引发的精神和身体损伤使得分解代谢日渐增强,且由于饮食方式单一和食物摄入量下降从而大多存在热量及营养摄入不足等饮食问题,造成营养不良风险增加[9]。与年轻人相比,40~70 岁之间中老年人饥饿和口渴程度较低,吃得更慢更少,食物摄入量下降约25%[10],这会导致典型的“衰老性厌食症”[11]:包括味觉和嗅觉的丧失、对食物饱足感敏感度上升、咀嚼困难,以及胃肠道功能的受损。“衰老性厌食症”则会导致能量摄入量降低,包括进一步体质量和肌肉质量的减少[10]。而老年人肌肉力量和身体能力下降又可能增加营养不良的几率从而形成“营养相关性衰老性肌萎缩综合征”[12],加剧整体恶性循环。虽然衰老性肌萎缩症的病因和治疗方法尚未明确定义,但营养起着至关重要的作用是不容置疑的[13]。大量文献表明营养在维持和增加肌肉质量及功能中起重要作用[14]。为此,有必要为衰老性肌萎缩症补充额外的营养素,以减轻因肌肉减少导致的肌肉质量和功能相关性损失。其次,由于老年人摄食量下降,对他们来说,满足其营养的饮食和微量营养素的要求显得更高。因此,建立最佳营养指南,以确定最可行的膳食营养补充形式,从而提高衰老性肌萎缩症的营养状况。目前国内外有许多关于干预措施的研究,从提供营养支持到补充特定营养素,有关营养干预方式不断更新且结论也不尽相同。针对衰老性肌萎缩症,目前营养干预较为一致的方式包括蛋白质饮食,补充必需氨基酸补充剂、VD、肌酸、抗氧化营养素(VE等)和ω-3脂肪酸等营养素[15]。本文将总结和讨论衰老性肌萎缩症的定义和发病机制、目前营养方面对于衰老性肌萎缩症的对策、相关营养食品对衰老性肌萎缩症的作用机制,并提出保持肌肉质量和功能的新型营养策略。最后,阐述合理化饮食方式结合运动干预的协同效应,这将为衰老性肌萎缩症的预防和治疗提供更佳选择。
目前对于衰老性肌萎症的病因有许多不同观点:肌肉脂肪变性增加、肌肉代谢受损、炎性标志物(即肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素(interleukin,IL)-6)增加、氧化应激增加、线粒体功能障碍、激素失衡、毛细血管流量减少等[16-17]。其中,骨骼肌纤维数量下降、肌肉蛋白质净合成减少、细胞氧化损伤及修复受损已成为公认的发病原因[18]。从病理生理学的角度来看,肌萎缩患者表现为肌肉质量的净丢失,这是由于肌肉蛋白质合成(muscle protein synthesis,MPS)减少和肌肉蛋白质分解(muscle protein breakdown,MPB)增加造成的。相反,在健康的老年人中,肌肉蛋白质却没有改变。磷脂酰肌醇3激酶(phosphatidylinositol3 kinase,PI3-K)/蛋白激酶B(protein kinase B,Akt)/雷帕霉素敏感的哺乳动物雷帕霉素靶蛋白复合体1(mammalian target of rapamycin complex 1,mTORC1)信号通路作用于下游并且由叉头框蛋白O(FoxO)激活的泛素连接酶促进细胞凋亡,如泛素蛋白连接酶E3,其中肌肉环指蛋白(musclespecific ring finger protein 1,MuRF-1)和肌肉萎缩盒F蛋白(muscle atrophy F-box protein,atrogin-1)被认为是调控MPB的主要因子[19]。随着人体的衰老进程,胰岛素抑制蛋白质水解激活PI3K-AKT-mTORC1通路,之后出现胰岛素抵抗状态同时增加MPB[20-21]。胰岛素本身就是一种血管舒张激素,胰岛素抵抗会导致血管流量减少,从而恶化胰岛素对肌肉的影响,并限制营养物质和氧气向肌肉的流动,从而降低MPS并增加MPB[22]。同样,老年人常见的微血管和大血管病变也会影响到衰老性肌萎缩症。例如:血清胰岛素样生长因子I(insulin-like growth factor-1,IGF-1)、支链氨基酸(branched chain amino acid,BCAA)、磷脂酸(phosphatidic acid,PA)能够以不同的机制激活mTORC1;而糖皮质激素,肌肉生长抑制素(myostatin)和活性氧(reactive oxygen species,ROS)是mTORC1的负调控因子[23]。此外,慢性疾病和衰老也与促炎症状态分子如TNF-α、IL-1和IL-6的分泌增加有关。这些细胞因子有助于增加骨骼胰岛素抵抗和肌肉蛋白水解激活泛素-蛋白酶体系统,抑制Akt/mTORC1途径,拮抗IGF-1对肌肉的作用[24]。TNF-α通过激活Caspase-8和Caspase-3参与的外源性凋亡通路,从而在肌肉细胞凋亡中起关键作用[25]。ROS产生增多与衰老密切相关,伴随着抗氧化系统的损害,导致氧化还原状态的不平衡从而影响mTORC1通路并破坏脂质和蛋白质的结构。尤其是线粒体内膜的磷脂过氧化反应会损害线粒体呼吸链,从而引起线粒体的代谢功能障碍。这种功能障碍导致呼吸能力降低,ATP产生减少和ROS生成增加从而加剧恶性循环。氧化应激也是促进慢性炎症的重要因素,通过激活细胞氧化还原状态调控核转录因子-κB(nuclear factor-κB,NF-κB)进行调控;反过来,炎症又会产生ROS,导致进一步恶性循环。因此,衰老、营养不良、身体活动缺乏、炎症及氧化应激增加和线粒体功能障碍等都是衰老性肌萎缩症发生的危险因素[23]。
有效对抗衰老性肌萎缩症的营养物质应该满足于:1)提供足够的热量摄入及营养素作用于肌肉;2)确保提供适当的营养素,同时考虑到年龄、性别、代谢特征、健康状况及身体活动能力;3)在适当的时间,即有生理需要时提供足够数量的营养素。在此前提下,参考2010年衰老性肌萎缩症消耗疾病学会专家小组制定的营养建议及中国营养学会老年营养分会牵头组建的“肌肉衰减综合征营养与运动干预中国专家共识起草组”共识[15,26]。国内外共识在承认运动干预的核心作用外,还强调了配合几种营养素及足够的热量摄入的重要性,包括蛋白质和支链氨基酸、VD、抗氧化营养素、脂类脂肪酸和肌酸。下文将具体介绍对于支持这些和其他膳食因素的证据以及在衰老性肌萎缩症中的具体作用机制。
人体生理功能衰退的重要物质基础是蛋白质,随着年龄的增长,由于食欲不振、咀嚼或吞咽困难、胃排空减少、身体和精神损伤、药物与营养的相互作用、多种疾病的存在以及荷尔蒙反应的改变、蛋白质和其他营养素的摄入不足,这会导致骨骼肌中蛋白质的合成受损[9]。蛋白质是补充老年人肌肉质量损失最重要的常用营养素;然而,老年人普通日常蛋白摄入量一般不会大于(0.6 g/(kg·餐mb))。研究表明,每天至少需要1.2~1.5 g/(kg·餐mb)的蛋白质摄入量才足够达到人体所需量,并且应该调整不同的饮食和摄入量来抵消由于老年人蛋白质摄入量减少引起的合成代谢反应(图1)[27]。由于刺激肌肉蛋白质合成的剂量约为35 g,因此,建议每餐都应该摄入至少25 g优质蛋白质才能最大限度地刺激肌肉蛋白质的合成,并保持肌肉质量(图1)[28]。此外,在早餐和中餐中建议摄入速效蛋白质(如乳清蛋白),在睡前建议摄入大量低效蛋白质(如酪蛋白),以刺激生长激素的合成代谢作用,并且防止夜间因长时间禁食引起的分解代谢(图1)。总而言之,高质量的蛋白质饮食已经被证明能有效地减少与年龄有关的肌肉质量损失,从而改善衰老性肌萎缩症。

图1 改善衰老性肌萎缩的营养策略
Fig.1 Possible nutritional strategies to counteract sarcopenia
膳食蛋白质的氨基酸组成对蛋白质的肌肉合成能力同样有着显著的影响。特别是,乳清蛋白中丰富的亮氨酸被认为是肌肉蛋白质周转的主要膳食调节剂[29]。支链氨基酸不仅是蛋白质合成的底物,还可以通过活化并调节蛋白质周转的细胞信号,刺激胰岛素合成,增强胰岛素敏感性,促进体内合成代谢[30]。由于其在合成代谢性质方面的优越性,推荐富含亮氨酸的蛋白质作为衰老性肌萎缩症的最佳补充蛋白质[31]。同时,建议每餐可以摄入3 g亮氨酸作为保持肌肉质量的有效营养策略(图1)。为此,可以选择摄入含有1.4~1.7 g亮氨酸的100 g瘦肉、奶制品、牛肉或鱼类等作为有效营养来源[32]。此外,也建议老年人可以在进行力量训练前后2~3 h摄取快速蛋白质(如乳清蛋白)或如富含亮氨酸的补充剂,来进一步增强运动诱发的肌肉增大(图1)[33]。因此,亮氨酸作为支链氨基酸可以为骨骼肌提供能量底物,是全身和骨骼肌蛋白质合成的重要调控因子,可以通过活化骨骼肌哺乳动物雷帕霉素(mammalian target of rapamycin,mTOR)信号途径来激活线粒体蛋白质激酶S6刺激肌肉蛋白合成[34-35],并且抑制蛋白酶体途径(图2)[36],可作为衰老性肌萎缩症防治的一个有效营养选择。

图2 膳食营养对衰老性肌萎缩症的作用机制概述
Fig.2 Overview of the underlying mechanisms of action of relevant dietary nutrition on sarcopenia
老年人饮食摄入不足,阳光照射减少,皮肤在紫外线照射下合成VD的能力受损,以及25-羟基VD向其活性形式的肾转化率降低,血清VD水平随着年龄的增长而逐渐下降[37]。同时,血清25(OH)D<50 ng/mL与低瘦体质量、低腿部力量存在明显正相关[38];VD影响肌肉肥厚,其缺乏与衰老性肌萎缩症高患病率有关[39]。因此,有必要检测所有衰老性肌萎缩症老年人体内VD的水平,当老年人血清25(OH)D低于正常范围时,应及时予以补充(图1)。一项Meta分析显示,当VD补充剂量达到700~1 000 IU/d可使老年人跌倒风险降低19%[40]。事实上,VD已经被证明可以增加肌肉蛋白合成,也能增强亮氨酸和胰岛素对肌肉细胞蛋白质合成率的刺激作用。同时,VD可增加肌肉细胞中钙的摄取,并对钙通道具有调节作用,从而影响肌肉收缩活动。虽然毫无疑问VD会影响肌肉代谢和营养,但对骨骼肌纤维的作用仍然存有争议。传统观点为:VD以其生物活性形式1,25(OH)D与肌肉细胞内VD受体(VD receptor,VDR)相结合,快速激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路(图2)[41],从而刺激肌肉细胞的增大和生长[42]。VD的作用是通过与位于细胞表面和细胞核中的VDR结合而进行[43]。VD与膜上VDR结合触发了非基因组途径,从而调节钙向细胞质中释放,来满足肌肉收缩的需要,从而刺激蛋白质的合成(图2)[44]。无论具体的机制是什么,VD会改善肌肉骨骼功能,并对肌肉纤维的构成和形态产生积极的影响;同时增加了老年人肌肉力量,减少跌倒次数[45]。因此,建议肌萎缩老年人用富含VD的食物,例如饱含VD3(胆钙化醇)的油性鱼类;VD2丰富(麦角钙化醇)的晒干蘑菇。此外,还有VD强化的食物(包括VD2和VD3),如牛奶、面包、酸奶等。
根据衰老自由基理论可知,在生命过程中对细胞大分子的氧化损伤的积累是推动衰老过程的中心机制。随着衰老发生,肌质网摄入Ca含量减少,而细胞内和线粒体Ca含量增加,ROS生成增多,形成氧化应激。氧化应激的增强可改变线粒体DNA(mitochondrial DNA,mtDNA),阻止蛋白质合成与ATP生成,导致肌肉细胞坏死和凋亡,同时使卫星细胞减少,增殖能力下降,以致肌纤维含量减少。外源性抗氧化物的补充可增强抗氧能力,改善氧化应激,降低mtDNA损伤,调节氮平衡。一些研究已经验证可以通过增强抗氧化能力来延缓衰老过程的可能性[46]。例如:VE在上调的氧化应激和炎症在年龄相关的骨骼肌功能障碍(衰老性肌萎缩症)中起关键作用[47]。激活NF-κB与氧化还原信号和炎症密切相关(图2)[48-49]。活性氧损伤膜,包括线粒体膜和内质网,由于其疏水性,VE往往大量存在;足够的VE可以有效地修复受损的肌肉质膜并保持其活性[50]。同时,VE能抑制炎症介质的表达,包括NF-κB、TNF-α、IL-1、IL-6、IL-8(图2)。相比之下,衰老性肌萎缩症的抗氧化剂补充数据极为有限。并且,目前对于抗氧化治疗的有效性还存在争议,为此抗氧化治疗在衰老性肌萎缩症中主导的作用也有待进一步研究和探讨[51]。但仍建议老年人应多食用富含抗氧化剂的食物,例如水果和蔬菜,因为其还含有大量健康营养素(例如维生素、矿物质和纤维素),并且复合制剂优于单独补充(图1)。
ω-3脂肪酸(也被称为n-3脂肪酸)是多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs),主要包括α-亚麻酸、二十碳五烯酸(eicosapntemacnioc acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA),具有许多潜在的益处。研究显示,补充ω-3脂肪酸后老年人骨骼肌蛋白质合成代谢增强[52]。此外,在“地中海饮食”中的蓝鱼提供大量ω-3脂肪酸,它可以增强对不同刺激(运动干预、激素替代疗法、蛋白质饮食)的肌肉合成代谢反应,降低氧化应激和胰岛素抵抗[52-53]。有研究表明衰老性肌萎缩症与慢性低度炎症息息相关[54],补充ω-3脂肪酸可抵抗慢性炎症,缓解肌肉减少,有利于维护心血管和大脑细胞,从而改善衰老性肌萎缩症(图2)。已发现ω-3脂肪酸可以激活骨骼肌mTOR靶标,刺激骨骼肌蛋白质的代谢,促进肌肉增大和力量增强[55](图2)。此外,有研究得出老年妇女每天补充含有2 g EPA和DHA的鱼油,结合抗阻力量训练,在干预90 d后肌肉力量得到进一步的增强[56]。所以,每周食用不少于1.27 g的ω-3脂肪酸或不少于1 份脂肪鱼可以有效提高骨密度及腿部肌肉力量(图1)[57]。因此,建议通过每周食用至少2 份鱼类来确保足够的ω-3脂肪酸摄入量,从而改善衰老性肌萎缩症相关功能障碍。
肌酸(creatine,Cr)是一种胍基化合物,内源性肌酸在肝脏和肾脏由精氨酸、蛋氨酸和甘氨酸合成;外源性肌酸可从食物的肉和内脏中,但含量很少。随着年龄增长,肌肉内Cr水平也随之降低[58],肌酸以磷酸肌酸的形式存储在于肌肉中。磷酸肌酸向ADP提供高能磷酸键,形成ATP,为骨骼肌收缩提供能量。Cr摄入可通过调节肌肉蛋白动力学,卫星细胞活性和含量以及合成代谢激素分泌来促进肌肉合成代谢。由Cr摄入诱导的蛋白质合成代谢反应可能与mTOR途径的直接激活有关(图2)[59]。研究表明,老年人力量训练结合Cr能够增加肌肉质量,并提高肌肉力量[60]。有趣的是,补充Cr的老年人会在干预结束后依然保留长时间的剩余有益效应。事实上有研究显示,在老年男性中,12 周的Cr补充与力量训练相结合,会使肌肉质量和力量得到显着增强,而Cr停止补充12 周后依然保留部分效果[61]。此外,摄入肌酸可增加磷酸肌酸比例,从而改善细胞钙调控和体内平衡,减少ROS生成(图1)[62]。肌酸除了在增强肌力方面的作用外,对认知和心理活动、骨健康、肌肉骨骼损伤修复等功能和方面也有积极的作用[63]。水合肌酸作为一种廉价且有效的营养补充剂,服用后几乎没有副作用。当与力量训练相结合时,能够提高老年人的肌肉质量和运动功能表现。因此,对于参加力量训练的肌萎缩老年人而言,短期补充Cr(例如,5~20 g/d的水合肌酸,持续2 周)是个值得推荐的有效选择(图1)。
由于β-羟基-β-甲基丁酸(β-hydroxy-β-methylbutyrate,HMB)具有促蛋白质合成代谢和脂肪分解作用,HMB长期以来一直被用作增效助剂[64]。研究结果表明,内源性HMB与年龄呈负相关;血浆浓度与年轻和年长成人的瘦体质量和肌肉力量呈正相关[65]。HMB补充剂已经在老年人中进行了实验测试,越来越多的证据表明,HMB可能有助于减缓肌肉损失并改善肌肉力量[66]。对7 例老年人补充HMB的随机对照实验进行的荟萃分析显示,与对照组相比,干预组的肌肉质量增加更多[67]。在骨骼肌中,HMB通过下调蛋白水解途径抑制蛋白质分解,通过激活mTOR途径刺激蛋白质合成,同时可以转化为羟甲基戊二酰辅酶A改善肌纤维完整性,并增加脂肪酸氧化能力(图2)[68]。HMB及其酸形式[69]通过激活不同途径刺激来增加蛋白质合成并降低蛋白质降解;同时,加速肌肉卫星细胞激活(图2)[70]。研究表明,补充HMB可以逆转蛋白质净合成代谢的缺陷,并改善肌肉老年人的肌肉力量,特别是与力量训练相结合时作用更为明显[71]。
羟基酪醇(hydroxytyrosol,HT)是一种天然多酚类化合物,主要以酯类的形式存在于橄榄中。特级初榨橄榄油中的羟基酪醇是“地中海饮食模式”中的重要营养组成部分,并且这种饮食方式中的大数量水果和蔬菜亦能作为限制氧化应激的抗氧化物质的丰富来源。越来越多的证据表明,这种饮食方式可能对肌肉功能有一定的好处[72]。啮齿类动物和培养细胞实验研究表示:HT能够通过激活AMP依赖的蛋白激酶(AMP-activated protein kinase,AMPK),增强过氧化物酶体增殖物激活受体γ辅激活因子1α(peroxisome proliferator activated receptor γ coactivator-1α,PGC-1α)和核呼吸因子(nuclear respiration factors,Nrf)1和Nrf2表达(图2)[73]。同时,HT可以激活AMPK,并且在剧烈的体育运动中可以有效减少肌肉损伤,炎症和继发性免疫缺陷[74]。此外,HT还是一种具有多效性的线粒体抗氧化剂[75]。目前,羟基酪醇等多酚类物质作为一类储量丰富的可再生绿色资源,具有延缓机体衰老,预防心血管病、抗癌、降血糖降血脂、增强免疫功能、抗辐射等功能。但对于衰老性肌萎缩症的研究还十分有限和稀少,其强大的抗氧化及清除自由基作用在肌萎缩的食品开发方向值得进一步去探究和研发。
乌索酸是一种苹果皮中富含的亲脂性五环三萜类化合物,也存在于其他水果(例如李子、蔓越莓和蓝莓)及草药(例如迷迭香、山楂、薄荷)等。有研究表明乌索酸能减少因禁食和肌肉去神经支配明显的肌肉萎缩诱导的应激反应。同时,乌索酸可能通过抑制萎缩相关的骨骼肌基因表达来增加肌肉质量。例如对空腹或遭受脊髓损伤的小鼠及时给予乌索酸,其可通过抑制萎缩相关基因(atrogin-1和MuRF-1),上调PKB/Akt激酶、核糖体蛋白S6激酶和Insulin/IGF-1信号传导的刺激来减轻肌肉损失(图2)[76]。在相关后续研究中,给食用高脂肪饮食的小鼠补充乌索酸可增加小鼠肌肉质量和强度,改善葡萄糖耐量,降低白色脂肪组织质量和肝脂肪变性的程度[77]。最近,有研究在一种慢性肾脏病的小鼠模型中,进行乌索酸长期治疗(口服给药21 d),得出乌索酸可以通过减少肌肉萎缩抑制素(包括血清和肌肉)和炎症细胞因子(IL-6、TNF-α等)的表达来削弱了肌肉萎缩(图2)[78]。这些结果都清楚地表明乌索酸不仅具有抗炎特性,同时其作为中草药中重要的成分,具有抗氧化的作用,能激活MAPK信号通路,参与在应激条件下细胞的免疫调节、炎症反应和细胞凋亡过程,从而机体的免疫力[79]。目前,对于乌索酸的研究主要集中于抗致癌药物的研究方向。因此,乌索酸作为一种在中药中重要的营养补剂,其对于肌萎缩症中降低氧化应激和炎症因子的作用及机制值得进一步深入研究。
研究表明,水果、蔬菜、谷物、药草等植物中富含的生物活性物质,可以通过模拟信号来达到与热量限制和体育锻炼类似的衰老性肌萎缩症治疗作用[80-81]。例如,白藜芦醇和其他多酚(槲皮素和姜黄素)具有强大的抗氧化能力并刺激线粒体生物合成[82]。特别是白藜芦醇能维持由抗阻训练引起的合成代谢过程[83]。研究表明:这些植物化学物质能够激活热量限制和运动所刺激的几种途径,包括PGC-1α、sirtuin 1(SIRT1)和AMPK(图2)[84]。此外,有研究灌胃8 月龄大鼠100 mg/(kg·d)白藜芦醇12 周,发现白藜芦醇可以降低大鼠肌膜和肌原纤维内线粒体中的ROS水平,并且通过测定总超氧化物歧化酶活力发现其不仅增强了抗氧化能力,而且改善胫骨前肌中谷胱甘肽过氧化物酶和过氧化氢酶活力[85]。此外,白藜芦醇作为重要的天然产物,其抗癌作用也备受关注。据报道,白藜芦醇可以通过调节蛋白激酶B和AMPK的活性,从而抑制mTOR信号通路来诱导细胞自噬[86];而细胞自噬在衰老性肌萎缩中的清除损伤或衰老细胞器、ROS等代谢废物,维持正常水平的骨骼肌蛋白质量控制等方面作用已经得到有效证实。因此,利用白藜芦醇等天然产物预防和治疗衰老性肌萎缩症会成为未来治疗的创新营养策略。
膳食营养成分之间存在着高度相关性,补充单一营养素可能达不到衰老性肌萎缩治疗的理想效果。因此,需要了解不同营养素对衰老性肌萎缩症的影响及其相互作用。“健康”的饮食模式有助于改善衰老性肌萎缩症患者的肌肉力量,其特点是摄入丰富的水果和蔬菜,足量的全麦谷物和油性鱼类[87]。同时,在有关于男性和女性动脉粥样硬化风险研究中的也提到,对中年人而言,大量的水果和蔬菜摄入是有益处的健康饮食方式[88]。以膳食营养为基础的“食疗”干预不仅会改变一系列营养素的摄入量,并且比单一补充营养素更能有效地预防与年龄相关的肌肉萎缩程度。例如:Cr和乳清蛋白的结合可以在阻力运动期间增强2 种营养素的肌肉合成代谢作用。在为期10 周的全身力量训练中,老年男性补充水合肌酸(0.1 g/(kg·d))和乳清蛋白(0.3 g(kg·d))实验组与仅摄入Cr或等热量碳水化合物安慰剂的对照组相比,非脂肪质量和肌肉力量的增加更多[89]。这一实验表明Cr和高质量蛋白质摄入对肌肉蛋白质合成代谢有协同刺激作用。同时,力量训练已被证明是一种增加肌肉力量和改善老年人身体功能的有效干预方式[90]。饮食和运动对身体功能的协同作用,在蛋白质/氨基酸补充方面得到了广泛的研究。例如,食用高蛋白食物可以使老年人的肌肉蛋白质合成增加50%,而高蛋白饮食和力量训练相结合则能使蛋白质的合成率提高100%以上[91]。但是,高蛋白饮食可能会增加体内酸负荷,从而对肌肉骨骼系统产生不利影响。低度代谢性酸中毒会刺激蛋白水解途径,这种刺激可以通过增加糖皮质激素(如皮质醇)的产生来触发[7,92-93]。为此,可在饮食中加入适当的碱性盐用来减少尿氮排出,从而减少肌肉蛋白质分解来保护肌肉。因此,对于衰老性肌萎缩症的营养干预策略,除了强调膳食营养的保护作用,还可以考虑饮食结合运动所带来的协同效应,营养补充和运动干预相结合可能比单独营养素摄入干预更为有效。
随着年龄增长,肌肉质量和力量的丢失成为一个主要的健康问题。衰老性肌萎缩症作为一种严重的老年病综合征,具有渐进的、不可逆转的性质。为了找到可行的预防与治疗方法来对抗这种与衰老相关的疾病,需要进行广泛的研究以了解其发病机制。毫无疑问,营养与运动干预在改善衰老性肌萎缩症的肌肉质量损失方面起着核心作用;研究表明,不仅蛋白质、氨基酸、VD、抗氧化剂、ω-3脂肪酸和肌酸的具有改善衰老性肌萎缩症的肌肉质量损失作用,新型的HMB、羟基酪醇以及植物中饱含的天然产物乌索酸和蜕皮甾酮等物质都可作为治疗衰老性肌萎缩症的营养策略。营养与运动干预肌萎缩症的可能机制是:1)蛋白质和亮氨酸制剂主要通过Akt/mTOR途径来刺激蛋白质合成,同时抑制泛素-蛋白酶体系统来抑制蛋白质降解,从而促进骨骼肌蛋白质合成增加;2)VD可以促进肌营养和代谢,刺激蛋白质合成;3)抗氧化营养素能改善氧化应激,加强抗氧能力和抗炎作用;4)ω-3脂肪酸可以通过mTOR途径对肌肉合成代谢产生积极影响,同时起抗炎作用;5)肌酸可以改善细胞生物能量,减少ROS生成并调节肌肉蛋白动力学;6)HMB激活mTOR途径刺激蛋白质合成,以逆转蛋白质净合成代谢的缺陷,并激活肌肉卫星细胞;7)乌索酸也可通过Akt/mTOR途径来抑制肌肉萎缩蛋白的表达,从而缓解肌萎缩;8)羟基酪醇和白藜芦醇则通过AMPK/mTOR自噬信号通路来调控,从而减少肌肉降解和丢失,同时又可改善线粒体内的ROS水平,提高线粒体抗氧化能力。
但目前对于衰老性肌萎缩症食品营养的机制研究极为有限,深入研究每种营养物质的作用机制,可以帮助了解这些营养元素相互作用及联合效果,为肌萎缩症的食品营养研发提供一定理论参考依据。同时,为了优化营养策略对衰老性肌萎缩症的作用,在充分考虑食品营养摄入的同时可结合一定运动干预,使其产生的协同效益更利于衰老性肌萎缩症的防治。
[1] EVANS W J, CAMPBELL W W. Sarcopenia and age-related changes in body composition and functional capacity[J]. The Journal of Nutrition, 1993, 123(Suppl 2): 465-468. doi:10.1093/jn/123.suppl_2.465.
[2] SAYER A A, DENNISON E M, SYDDALL H E, et al. The developmental origins of sarcopenia: using peripheral quantitative computed tomography to assess muscle size in older people[J].Journals of Gerontology Series A: Biological Sciences and Medical Sciences, 2008, 63(8): 835-840.
[3] KARAKELIDES H, NAIR K S. Sarcopenia of aging and its metabolic impact[J]. Current Topics in Developmental Biology, 2005, 68: 123-148. doi:10.1016/s0070-2153(05)68005-2.
[4] YAMADA M, NISHIGUCHI S, FUKUTANI N, et al. Prevalence of sarcopenia in community-dwelling Japanese older adults[J]. Journal of the American Medical Directors Association, 2013, 14(12): 911-915.doi:10.1016/j.jamda.2013.08.015.
[5] CESARI M, PAHOR M, LAURETANI F, et al. Skeletal muscle and mortality results from the InCHIANTI study[J]. Journals of Gerontology Series A: Biological Sciences and Medical Sciences,2009, 64(3): 377-384. doi:10.1093/gerona/gln031.
[6] JANSSEN I, SHEPARD D S, KATZMARZYK P T, et al. The healthcare costs of sarcopenia in the United States[J]. Journal of the American Geriatrics Society, 2004, 52(1): 80-85.
[7] 赵法伋, 顾景范. 营养与老年肌肉衰减综合征[J]. 营养学报, 2011,33(5): 439-445.
[8] GILLETTE-GUYONNET S, NOURHASHEMI F, ANDRIEU S, et al.Body composition in French women 75+ years of age: the EPIDOS study[J]. Mechanisms of Ageing and Development, 2003, 124(3):311-316.
[9] DONINI L M, POGGIOGALLE E, PIREDDA M, et al. Anorexia and eating patterns in the elderly[J]. PLoS ONE, 2013, 8(5): e63539.doi:10.1371/journal.pone.0063539.
[10] NIEUWENHUIZEN W F, WEENEN H, RIGBY P, et al. Older adults and patients in need of nutritional support: review of current treatment options and factors inf l uencing nutritional intake[J]. Clinical Nutrition,2010, 29(2): 160-169. doi:10.1016/j.clnu.2009.09.003.
[11] MURPHY C. The chemical senses and nutrition in older adults[J].Journal of Nutrition for the Elderly, 2008, 27(3/4): 247-265.
[12] CRUZ-JENTOFT A J, BAEYENS J P, BAUER J M, et al. Sarcopenia:European consensus on definition and diagnosis: report of the European Working Group on Sarcopenia in older people[J]. Age and Ageing, 2010, 39(4): 412-423. doi:10.1093/ageing/afq034.
[13] SOLERTE S B, GAZZARUSO C, BONACASA R, et al. Nutritional supplements with oral amino acid mixtures increases whole-body lean mass and insulin sensitivity in elderly subjects with sarcopenia[J].American Journal of Cardiology, 2008, 101(11): 69e-77e.doi:10.1016/j.amjcard.2008.03.004.
[14] SINHA-HIKIM I, SINHA-HIKIM A P, PARVEEN M, et al. Longterm supplementation with a cystine-based antioxidant delays loss of muscle mass in aging[J]. Journals of Gerontology Series A: Biological Sciences and Medical Sciences, 2013, 68(7): 749-759. doi:10.1093/gerona/gls334.
[15] 孙建琴, 张坚, 常翠青, 等. 肌肉衰减综合征营养与运动干预中国专家共识(节录)[J]. 营养学报, 2015(4): 320-324.
[16] MILLER M S, CALLAHAN D M, TOTH M J. Skeletal muscle myof i lament adaptations to aging, disease, and disuse and their effects on whole muscle performance in older adult humans[J]. Frontiers in Physiology, 2014, 5: 369-383. doi:10.3389/fphys.2014.00369.
[17] VISSER M, PAHOR M, TAAFFE D R, et al. Relationship of interleukin-6 and tumor necrosis factor-alpha with muscle mass and muscle strength in elderly men and women: the health ABC study[J].Journals of Gerontology Series A: Biological Sciences and Medical Sciences, 2002, 57(5): 326-332.
[18] BIJLSMA A Y, MESKERS C G, LING C H, et al. Defining sarcopenia: the impact of different diagnostic criteria on the prevalence of sarcopenia in a large middle aged cohort[J]. Age, 2013, 35(3):871-881. doi:10.1007/s11357-012-9384-z.
[19] XIA Z, CHOLEWA J, ZHAO Y, et al. Targeting inflammation and downstream protein metabolism in sarcopenia: a brief up-dated description of concurrent exercise and leucine-based multimodal intervention[J]. Frontiers in Physiology, 2017, 8: 434-440.doi:10.3389/fphys.2017.00434.
[20] YOON M S. The Role of Mammalian target of rapamycin (mTOR) in insulin signaling[J]. Nutrients, 2017, 9(11): 1176-1192. doi:10.3390/nu9111176.
[21] EVERMAN S, MEYER C, TRAN L, et al. Insulin does not stimulate muscle protein synthesis during increased plasma branchedchain amino acids alone but still decreases whole body proteolysis in humans[J]. American Journal of Physiology-Endocrinology and Metabolism, 2016, 311(4): E671-E677. doi:10.1152/ajpendo.00120.2016.
[22] TIMMERMAN K L, LEE J L, FUJITA S, et al. Pharmacological vasodilation improves insulin-stimulated muscle protein anabolism but not glucose utilization in older adults[J]. Diabetes, 2010, 59(11): 2764-2771. doi:10.2337/db10-0415.
[23] YOON M S. The emerging role of branched-chain amino acids in insulin resistance and metabolism[J]. Nutrients, 2016, 8(7): 405-417.doi:10.3390/nu8070405.
[24] BUDUI S L, ROSSI A P, ZAMBONI M. The pathogenetic bases of sarcopenia[J]. Clinical Cases in Mineral and Bone Metabolism, 2015,12(1): 22-26. doi:10.11138/ccmbm/2015.12.1.022.
[25] MARZETTI E, CALVANI R, BERNABEI R, et al. Apoptosis in skeletal myocytes: a potential target for interventions against sarcopenia and physical frailty: a mini-review[J]. Gerontology, 2012,58(2): 99-106. doi:10.1159/000330064.
[26] MORLEY J E, ARGILES J M, EVANS W J, et al. Nutritional recommendations for the management of sarcopenia[J]. Journal of the American Medical Directors Association, 2010, 11(6): 391-396.doi:10.1016/j.jamda.2010.04.014.
[27] DARDEVET D, REMOND D, PEYRON M A, et al. Muscle wasting and resistance of muscle anabolism: the “anabolic threshold concept”for adapted nutritional strategies during sarcopenia[J]. The Scientif i c World Journal, 2012, 2012: 269531. doi:10.1100/2012/269531.
[28] GENARO P S, PINHEIRO M M, SZEJNFELD V L, et al. Dietary protein intake in elderly women: association with muscle and bone mass[J]. Nutrition in Clinical Practice, 2015, 30(2): 283-289.doi:10.1177/0884533614545404.
[29] ANTHONY J C, ANTHONY T G, KIMBALL S R, et al. Signaling pathways involved in translational control of protein synthesis in skeletal muscle by leucine[J]. The Journal of Nutrition, 2001, 131(3):856-860.
[30] KATSANOS C S, KOBAYASHI H, SHEFFIELDMOORE M, et al.A high proportion of leucine is required for optimal stimulation of the rate of muscle protein synthesis by essential amino acids in the elderly[J]. American Journal of Physiology-Endocrinology and Metabolism, 2006, 291(2): 381-387.
[31] BORACK M S, VOLPI E. Efficacy and safety of leucine supplementation in the elderly[J]. The Journal of Nutrition, 2016,146(12): 2625-2629.
[32] LEENDERS M, VAN LOON L J. Leucine as a pharmaconutrient to prevent and treat sarcopenia and type2 diabetes[J]. Nutrition Reviews,2011, 69(11): 675-689. doi:10.1111/j.1753-4887.2011.00443.x.
[33] TIPTON K D, RASMUSSEN B B, MILLER S L, et al. Timing of amino acid-carbohydrate ingestion alters anabolic response of muscle to resistance exercise[J]. American Journal of Physiology-Endocrinology and Metabolism, 2001, 281(2): 197-206. doi:10.1152/ajpendo.2001.281.2.E197.
[34] GUILLET C, PROD’HOMME M, BALAGE M, et al. Impaired anabolic response of muscle protein synthesis is associated with S6K1 dysregulation in elderly humans[J]. FASEB Journal, 2004, 18(13):1586-1587. doi:10.1096/fj.03-1341fje.
[35] DARDEVET D, SORNET C, BALAGE M, et al. Stimulation of in vitro rat muscle protein synthesis by leucine decreases with age[J].The Journal of Nutrition, 2000, 130(11): 2630-2635. doi:10.1093/jn/130.11.2630.
[36] NAKASHIMA K, ISHIDA A, YAMAZAKI M, et al. Leucine suppresses myofibrillar proteolysis by down-regulating ubiquitinproteasome pathway in chick skeletal muscles[J]. Biochemical and Biophysical Research Communications, 2005, 336(2): 660-666.
[37] JOHNSON M A, KIMLIN M G. Vitamin D, aging, and the 2005 dietary guidelines for Americans[J]. Nutrition Reviews, 2006, 64(9):410-421.
[38] SCOTT D, BLIZZARD L, FELL J, et al. A prospective study of the associations between 25-hydroxy-vitamin D, sarcopenia progression and physical activity in older adults[J]. Clinical Endocrinology, 2010,73(5): 581-587. doi:10.1111/j.1365-2265.2010.03858.x.
[39] CEGLIA L, NIRAMITMAHAPANYA S, DA SILVA MORAIS M, et al.A randomized study on the effect of vitamin D3 supplementation on skeletal muscle morphology and vitamin D receptor concentration in older women[J]. Journal of Clinical Endocrinology & Metabolism,2013, 98(12): 1927-1935. doi:10.1210/jc.2013-2820.
[40] BISCHOFF-FERRARI H A, DAWSON-HUGHES B, STAEHELIN H B, et al. Fall prevention with supplemental and active forms of vitamin D: a meta-analysis of randomised controlled trials[J]. BMJ, 2009, 339:843-846. doi:10.1136/bmj.b3692.
[41] WU Z, WOODRING P J, BHAKTA K S, et al. p38 and extracellular signal-regulated kinases regulate the myogenic program at multiple steps[J]. Molecular and Cellular Biology, 2000, 20(11): 3951-3964.
[42] BUITRAGO C, BOLAND R, DE BOLAND A R. The tyrosine kinase c-Src is required for 1,25(OH)2-vitamin D3 signalling to the nucleus in muscle cells[J]. Biochimica et Biophysica Acta, 2001, 1541(3):179-187.
[43] CEGLIA L. Vitamin D and skeletal muscle tissue and function[J].Molecular Aspects of Medicine, 2008, 29(6): 407-414. doi:10.1016/j.mam.2008.07.002.
[44] MONTERO-ODASSO M, DUQUE G. Vitamin D in the aging musculoskeletal system: an authentic strength preserving hormone[J].Molecular Aspects of Medicine, 2005, 26(3): 203-219.
[45] BISCHOFF H A, STÄHELIN H B, DICK W, et al. Effects of vitamin D and calcium supplementation on falls: a randomized controlled trial[J]. Journal of Bone and Mineral Research, 2003, 18(2): 343-351.
[46] BOOTS A W, HAENEN G R, BAST A. Health effects of quercetin: from antioxidant to nutraceutical[J]. European Journal of Pharmacology, 2008, 585(2/3): 325-337. doi:10.1016/j.ejphar.2008.03.008.
[47] LOURENÇO DOS SANTOS S, BARAIBAR M A, LUNDBERG S,et al. Oxidative proteome alterations during skeletal muscle ageing[J].Redox Biology, 2015, 5: 267-274. doi:10.1016/j.redox.2015.05.006.
[48] SHIRODE A, SYLVESTER P. Synergistic anticancer effects of combined gamma-tocotrienol and celecoxib treatment are associated with suppression in Akt and NF kappa B signaling[J]. Biomedicine and Pharmacotherapy, 2010, 64(5): 327-332.
[49] ALLEN R G, TRESINI M. Oxidative stress and gene regulation[J].Free Radical Biology and Medicine, 2000, 28(3): 463-499.
[50] HOWARD A C, MCNEIL A K, MCNEIL P L. Promotion of plasma membrane repair by vitamin E[J]. Nature Communications, 2011, 2:597-604. doi:10.1038/ncomms1594.
[51] BONETTO A, PENNA F, MUSCARITOLI M, et al. Are antioxidants useful for treating skeletal muscle atrophy?[J]. Free Radical Biology and Medicine, 2009, 47(7): 906-916. doi:10.1016/j.freeradbiomed.2009.07.002.
[52] SMITH G I, ATHERTON P, REEDS D N, et al. Dietary omega-3 fatty acid supplementation increases the rate of muscle protein synthesis in older adults: a randomized controlled trial[J]. The American Journal of Clinical Nutrition, 2011, 93(2): 402-412. doi:10.3945/ajcn.110.005611.
[53] LALIA A Z, DASARI S, ROBINSON M M, et al. Influence of omega-3 fatty acids on skeletal muscle protein metabolism and mitochondrial bioenergetics in older adults[J]. Aging, 2017, 9(4):1096-1129. doi:10.18632/aging.101210.
[54] BEYER I, METS T, BAUTMANS I. Chronic low-grade inf l ammation and age-related sarcopenia[J]. Current Opinion in Clinical Nutrition and Metabolic Care, 2012, 15(1): 12-22. doi:10.1097/MCO.0b013e32834dd297.
[55] SHAD B J, SMEUNINX B, ATHERTON P J, et al. The mechanistic and ergogenic effects of phosphatidic acid in skeletal muscle[J].Applied Physiology Nutrition and Metabolism, 2015, 40(12): 1233-1241. doi:10.1139/apnm-2015-0350.
[56] RODACKI C L, RODACKI A L, PEREIRA G, et al. Fish-oil supplementation enhances the effects of strength training in elderly women[J]. The American Journal of Clinical Nutrition, 2012, 95(2):428-436. doi:10.3945/ajcn.111.021915.
[57] ROUSSEAU J H, KLEPPINGER A, KENNY A M. Self-reported dietary intake of omega-3 fatty acids and association with bone and lower extremity function[J]. Journal of the American Geriatrics Society, 2009, 57(10): 1781-1788. doi:10.1111/j.1532-5415.2008.01870.x.
[58] MOLLER P, BERGSTROM J, FÜRST P, et al. Effect of aging on energy-rich phosphagens in human skeletal muscles[J]. Clinical Science, 1980, 58(6): 553-555.
[59] SAFDAR A, YARDLEY N J, SNOW R, et al. Global and targeted gene expression and protein content in skeletal muscle of young men following short-term creatine monohydrate supplementation[J].Physiological Genomics, 2008, 32(2): 219-228. doi:10.1152/physiolgenomics.00157.2007.
[60] BROSE A, PARISE G, TARNOPOLSKY M A. Creatine supplementation enhances isometric strength and body composition improvements following strength exercise training in older adults[J].Journals of Gerontology Series A: Biological Sciences and Medical Sciences, 2003, 58(1): 11-19.
[61] CANDOW D G, CHILIBECK P D, CHAD K E, et al. Effect of ceasing creatine supplementation while maintaining resistance training in older men[J]. Journal of Aging and Physical Activity, 2004, 12(3):219-231.
[62] GUESCINI M, TIANO L, GENOVA M L. The combination of physical exercise with muscle-directed antioxidants to counteract sarcopenia: a biomedical rationale for pleiotropic treatment with creatine and coenzyme Q10[J]. Oxidative Medicine and Cellular Longevity, 2017, 2017: 7083049. doi:10.1155/2017/7083049.
[63] HAVENETIDIS K. The use of creatine supplements in the military[J].Journal of the Royal Army Medical Corps, 2016, 162(4): 242-248.doi:10.1136/jramc-2014-000400.
[64] 徐磊, 李春艳, 陈宁, 等. 老年人肌少性肥胖的机制与运动营养调控研究进展[J]. 食品科学, 2017, 38(21): 279-286. doi:10.7506/spkx1002-6630-201721044.
[65] KURIYAN R, LOKESH D P, SELVAM S, et al. The relationship of endogenous plasma concentrations of beta-hydroxy betamethyl butyrate (HMB) to age and total appendicular lean mass in humans[J]. Experimental Gerontology, 2016, 81: 13-18. doi:10.1016/j.exger.2016.04.013.
[66] ARGILES J M, CAMPOS N, LOPEZ-PEDROSA J M, et al. Skeletal muscle regulates metabolism via interorgan crosstalk: roles in health and disease[J]. Journal of the American Medical Directors Association,2016, 17(9): 789-796. doi:10.1016/j.jamda.2016.04.019.
[67] WU H, XIA Y, JIANG J, et al. Effect of beta-hydroxy-betamethylbutyrate supplementation on muscle loss in older adults: a systematic review and meta-analysis[J]. Archives of Gerontology and Geriatrics, 2015, 61(2): 168-175. doi:10.1016/j.archger.2015.06.020.
[68] WILSON G J, WILSON J M, MANNINEN A H. Effects of betahydroxy-beta-methylbutyrate (HMB) on exercise performance and body composition across varying levels of age, sex, and training experience: a review[J]. Nutrition & Metabolism, 2008, 5: 1-17.doi:10.1186/1743-7075-5-1.
[69] MALAFARINA V, URIZ-OTANO F, MALAFARINA C, et al.Effectiveness of nutritional supplementation on sarcopenia and recovery in hip fracture patients. a multi-centre randomized trial[J].Maturitas, 2017, 101: 42-50. doi:10.1016/j.maturitas.2017.04.010.
[70] WILSON J M, FITSCHEN P J, CAMPBELL B, et al. International society of sports nutrition position stand: beta-hydroxy-betamethylbutyrate (HMB)[J]. Journal of the International Society of Sports Nutrition, 2013, 10(1): 6-19. doi:10.1186/1550-2783-10-6.
[71] ALLEY D E, KOSTER A, MACKEY D, et al. Hospitalization and change in body composition and strength in a population-based cohort of older persons[J]. Journal of the American Geriatrics Society, 2010,58(11): 2085-2091. doi:10.1111/j.1532-5415.2010.03144.x.
[72] PIERNO S, TRICARICO D, LIANTONIO A, et al. An olive oilderived antioxidant mixture ameliorates the age-related decline of skeletal muscle function[J]. Age, 2014, 36(1): 73-88. doi:10.1007/s11357-013-9544-9.
[73] HAO J J, SHEN W L, YU G L, et al. Hydroxytyrosol promotes mitochondrial biogenesis and mitochondrial function in 3T3-L1 adipocytes[J]. The Journal of Nutritional Biochemistry, 2010, 21(7):634-644. doi:10.1016/j.jnutbio.2009.03.012.
[74] FENG Z, BAI L, YAN J, et al. Mitochondrial dynamic remodeling in strenuous exercise-induced muscle and mitochondrial dysfunction: regulatory effects of hydroxytyrosol[J]. Free Radical Biology and Medicine, 2011, 50(10): 1437-1446. doi:10.1016/j.freeradbiomed.2011.03.001.
[75] KIM J, LEE Y, KYE S, et al. Association of vegetables and fruits consumption with sarcopenia in older adults: the Fourth Korea National Health and Nutrition Examination Survey[J]. Age and Ageing, 2015, 44(1): 96-102. doi:10.1093/ageing/afu028.
[76] KUNKEL S D, SUNEJA M, EBERT S M, et al. mRNA expression signatures of human skeletal muscle atrophy identify a natural compound that increases muscle mass[J]. Cell Metabolism, 2011,13(6): 627-638. doi:10.1016/j.cmet.2011.03.020.
[77] KUNKEL S D, ELMORE C J, BONGERS K S, et al. Ursolic acid increases skeletal muscle and brown fat and decreases diet-induced obesity, glucose intolerance and fatty liver disease[J]. PLoS ONE,2012, 7(6): e39332. doi:10.1371/journal.pone.0039332.
[78] YU R Z, CHEN J A, XU J, et al. Suppression of muscle wasting by the plant-derived compound ursolic acid in a model of chronic kidney disease[J]. Journal of Cachexia Sarcopenia and Muscle, 2017, 8(2):327-341. doi:10.1002/jcsm.12162.
[79] 顿耀山, 石月, 彭晓庐, 等. 中药运动营养补剂作用机制的研究进展[J]. 食品科学, 2013, 34(15): 415-423. doi:10.7506/spkx1002-6630-201315079.
[80] MERCKEN E M, CARBONEAU B A, KRZYSIK-WALKER S M,et al. Of mice and men: the benefits of caloric restriction, exercise,and mimetics[J]. Ageing Research Reviews, 2012, 11(3): 390-398.doi:10.1016/j.arr.2011.11.005.
[81] MARZETTI E, LAWLER J M, HIONA A, et al. Modulation of age-induced apoptotic signaling and cellular remodeling by exercise and calorie restriction in skeletal muscle[J]. Free Radical Biology and Medicine, 2008, 44(2): 160-168. doi:10.1016/j.freeradbiomed.2007.05.028.
[82] TEIXEIRA J, CHAVARRIA D, BORGES F, et al. Dietary polyphenols and mitochondrial function: role in health and disease[J]. Current Medicinal Chemistry, 2017, 24: 1-27. doi:10.2174/0929867324666170529101810.
[83] ALWAY S E, MCCRORY J L, KEARCHER K, et al. Resveratrol enhances exercise-induced cellular and functional adaptations of skeletal muscle in older men and women[J]. Journals of Gerontology Series A: Biological Sciences and Medical Sciences, 2017, 72(12):1595-1606. doi:10.1093/gerona/glx089.
[84] NARKAR V A, DOWNES M, YU R T, et al. AMPK and PPARδ agonists are exercise mimetics[J]. Cell, 2008, 134(3): 405-415.doi:10.1016/j.cell.2008.06.051.
[85] ZHENG J, CHEN L L, ZHANG H H, et al. Resveratrol improves insulin resistance of catch-up growth by increasing mitochondrial complexes and antioxidant function in skeletal muscle[J]. Metabolism,2012, 61(7): 954-965. doi:10.1016/j.metabol.2011.11.005.
[86] 张淑芳, 王玉芳, 袁红, 等. 天然产物通过细胞自噬调节抑制癌症的研究进展[J]. 食品科学, 2014, 35(23): 331-336. doi:10.7506/spkx1002-6630-201423064.
[87] ROBINSON S M, JAMESON K A, BATELAAN S F, et al. Diet and its relationship with grip strength in community-dwelling older men and women: the Hertfordshire cohort study[J]. Journal of the American Geriatrics Society, 2008, 56(1): 84-90. doi:10.1111/j.1532-5415.2007.01478.x.
[88] HOUSTON D K, STEVENS J, CAI J, et al. Dairy, fruit, and vegetable intakes and functional limitations and disability in a biracial cohort: the atherosclerosis risk in communities study[J]. The American Journal of Clinical Nutrition, 2005, 81(2): 515-522. doi:10.1093/ajcn.81.2.515.
[89] CANDOW D G, LITTLE J P, CHILIBECK P D, et al. Low-dose creatine combined with protein during resistance training in older men[J]. Medicine and Science in Sports and Exercise, 2008, 40(9):1645-1652. doi:10.1249/MSS.0b013e318176b310.
[90] CHRISTIE J. Progressive resistance strength training for improving physical function in older adults[J]. International Journal of Older People Nursing, 2011, 6(3): 244-246. doi:10.1111/j.1748-3743.2011.00291.x.
[91] SYMONS T B, SHEFFIELD-MOORE M, MAMEROW M M, et al.The anabolic response to resistance exercise and a protein-rich meal is not diminished by age[J]. The Journal of Nutrition, Health and Aging,2011, 15(5): 376-381.
[92] CARNAUBA R A, BAPTISTELLA A B, PASCHOAL V, et al. Dietinduced low-grade metabolic acidosis and clinical outcomes: a review[J]. Nutrients, 2017, 9(6):538-553. doi:10.3390/nu9060538.
[93] FRASSETTO L, MORRIS R C, SELLMEYER D E, et al. Diet,evolution and aging: the pathophysiologic effects of the postagricultural inversion of the potassium-to-sodium and base-to-chloride ratios in the human diet[J]. European Journal of Nutrition, 2001, 40(5):200-213.
Recent Progress in Regulation of Dietary Nutrition for Sarcopenia
陈宁(1972—)(ORCID: 0000-0002-8191-6744),男,教授,博士,研究方向为运动与营养干预对慢性疾病的预防与康复。E-mail: nchen510@gmail.com
王梅(1975—)(ORCID: 0000-0002-9302-9683),女,副教授,博士,研究方向为运动与营养干预对慢性疾病的预防与康复。E-mail: 1261411369@qq.com
LIANG Jiling, WANG Cenyi, CHEN Ning, et al. Recent progress in regulation of dietary nutrition for sarcopenia[J]. Food Science,2019, 40(1): 303-312. (in Chinese with English abstract)doi:10.7506/spkx1002-6630-20180814-140. http://www.spkx.net.cn