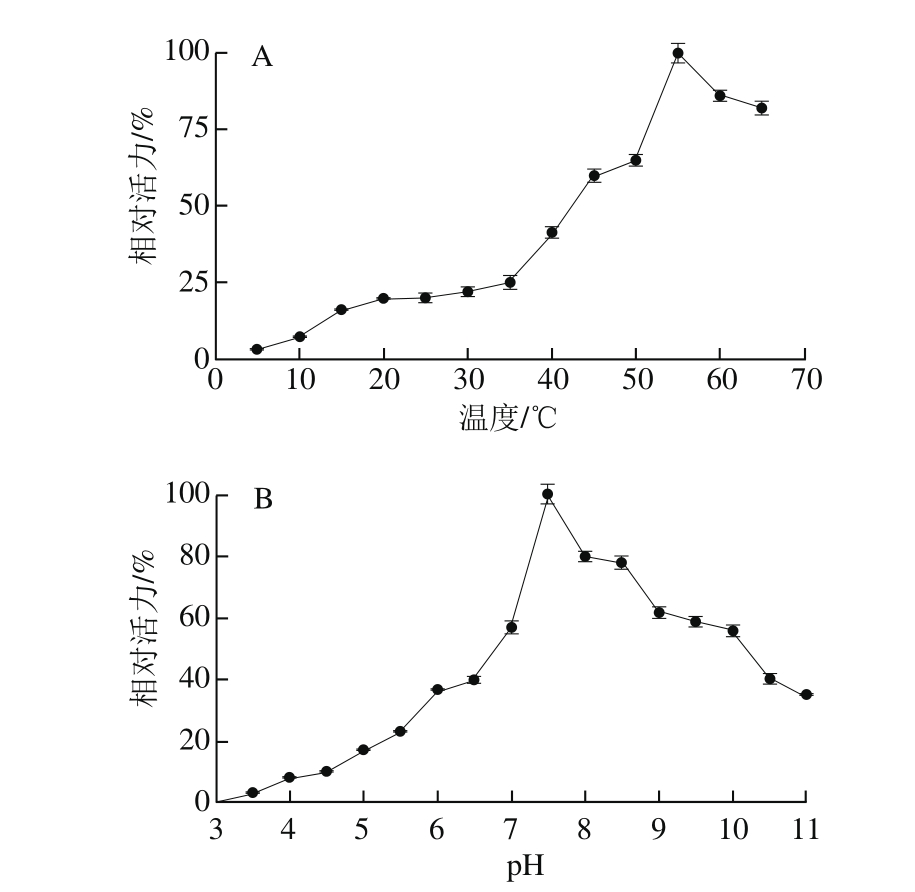
图1 南极磷虾蛋白自溶酶在不同温度(A)、pH值(B)下的相对活力
Fig. 1 Relative activity of autolytic enzymes from Antarctic krill at different temperatures (A) and pH (B)
南极磷虾是一类生活在南极海域的甲壳动物,隶属于节肢动物门(Arthropoda)、甲壳纲(Crustacea)、磷虾目(Euphausiacea)、磷虾科(Euphausiidae)、磷虾属(Euphausia),约有7~8 个种[1-3],主要包含了如南极大磷虾、长额磷虾、长额樱磷虾等在内的8 种磷虾。通常所说的和进行商业捕捞的南极磷虾指的是南极大磷虾(Euphausia superba)[4]。南极磷虾总的生物量为1.17×109~3.79×109 t[5],是目前已知的地球上数量最大、繁衍最成功的单种生物资源之一[6]。尤其在近海渔业资源日渐枯竭的今天,南极磷虾被视为一种潜力巨大的渔业资源[5]。
南极磷虾体内,尤其是头胸部的消化系统,分布着丰富且活性较强的自溶酶[7],使其极易发生自溶[8-10],主要是蛋白酶类和酯酶类,该酶系同时具有外切酶和内切酶的活性[11]。据报道南极磷虾蛋白酶主要包括8 种自溶酶:3 种丝氨酸类胰蛋白酶、1 种丝氨酸类胰凝乳蛋白酶、2 种羧肽酶A(carboxypeptidase A enzyme,CPA)(CPA I、CPA II)、2 种羧肽酶B[7,12]。Kubota等[13]研究认为对自溶起关键作用的是位于头胸部的消化管道内的蛋白酶,该类酶的最适pH值为6~8。Kimoto[14]、Konagaya[15]等经研究认为,对南极大磷虾自溶起主导作用的是类胰蛋白酶。任艳分析磷虾粗酶中主要含有3 种蛋白酶,其最适pH值分别为3.0、6.0和7.5;pH 3.0时蛋白酶有较高的分解酪蛋白的能力及热稳定性,表现为类胃蛋白酶属性;pH 6.0时蛋白酶热稳定性比较弱,能被苯甲基磺酰氟抑制,表现为CPA属性;pH 7.0时蛋白酶有较高的活性,能被大豆胰蛋白酶抑制剂抑制,表现为类胰蛋白酶属性[12]。
南极磷虾肌肉中含有约78%的蛋白质,且含有18 种常见氨基酸,其中包括8 种人体必需氨基酸,氨基酸总量为57.21%,其中必需氨基酸含量为25.88%,其构成比例符合联合国粮食及农业组织(Food and Agriculture Organization,FAO)和世界卫生组织(World Health Organization,WHO)的标准[16-17]。南极磷虾自溶后可以产生更加丰富的氨基酸、多肽等,利用它们来制备天然的鱼酱油、食源肽,可以降低由于添加商业蛋白酶而引起的高加工成本,使南极磷虾的加工过程更加经济[18]。影响自溶的主要因素有3 种:物理、化学和生物因素[19],其中物理因素包括温度、辐射和机械等;化学因素包括pH值、盐离子强度等;生物因素包括外源生物酶的使用等。不同因素对自溶酶的影响不同,因此可以通过控制内源酶的活性来抑制自溶,也可以通过控制自溶酶的活性促进自溶来制备相关的磷虾类产品。尤其在利用自溶进行工艺优化时,要根据自溶酶的特点,发挥有利因素而避免不利因素。本研究初步探索了南极磷虾自溶的最适条件,并在该条件下使南极磷虾发生自溶,研究自溶前后的氨基酸态氮、氨基酸、多肽的变化,为自溶技术在南极磷虾加工利用方面提供依据。
冷冻南极磷虾 中国水产有限公司。
测序级胰蛋白酶(比活力为18 523 U/mg) 美国Promega公司;质谱级甲酸(纯度>98%) 瑞士Fluka公司;乙腈 美国Fisher公司;二硫苏糖醇、尿素、碳酸氢铵、盐酸 国药集团化学试剂有限公司;三羟甲基氨基甲烷(tris(hydroxymethyl)methyl aminomethane,THAM) 北京索莱宝科技有限公司;N-苯甲酰基-DL-精氨酰-对硝基苯胺(N-α-benzoyl-DL-arginine p-nitroanilide,BApNA)、碘代乙酰胺 美国Sigma-Aldrich公司。
30 Ltd型氨基酸自动分析仪 英国Biochrom公司;Q-TOF®5600质谱仪 美国AB SCIEX公司;Nexera X2 30A高效液相色谱仪 日本岛津公司;MQS50001型超纯水系统 美国Millipore公司;722型可见分光光度计 上海尤尼柯仪器有限公司;HH-4型数显恒温水浴锅 常州国华电器有限公司;AB135-S型精密电子分析天平 瑞士Mettler-Toledo公司;T18 ULTRATURRAX高速分散机 德国IKA集团。
1.3.1 南极磷虾粗酶液的制备
收集冷冻南极磷虾虾头,加入2 倍质量预冷至4 ℃的0.05 mol/L pH 7.5的Tris-HCl缓冲液,高速匀浆后,匀浆液4 ℃、10 000 r/min离心30 min,收集上清液,用Waterman No.1滤纸过滤以除去脂类,得南极磷虾粗酶液。
1.3.2 不同温度、pH值条件下自溶酶相对活力的测定
参考Erlanger等[20]的方法测定自溶酶相对活力。以BApNA为底物,以410 nm波长处吸光度最高的温度所对应的酶活力为100%,测定粗酶液中自溶酶在不同温度(5~65 ℃)下的相对活力;在55 ℃反应温度下,以波长410 nm处吸光度最高的pH值所对应的酶活力为100%,测定粗酶液中自溶酶在不同pH值(3~11)下的相对活力。
1.3.3 南极磷虾自溶前后氨基酸态氮质量浓度和游离氨基酸质量分数的测定
在南极磷虾自溶酶最适反应温度和pH值下,使南极磷虾自溶3 h,测定自溶前后氨基酸态氮质量浓度和游离氨基酸质量分数的变化。氨基酸态氮质量浓度的测定:将自溶前后的溶液pH值调为4.5,冰水中静置30 min,4 000 r/min离心10 min,取上清液利用甲醛滴定法[21]测定氨基酸态氮的质量浓度。
游离氨基酸质量分数的测定采用磺基水杨酸法,具体操作为:称取5 g上清样品,加入15 mL 0.02 mol/L的盐酸溶液,充分均质后用0.02 mol/L的盐酸溶液定容至50 m L,3 000 r/min离心10 min。取上清液2 mL加入等体积8 g/100 mL的磺基水杨酸溶液,在4 ℃冰箱里静止放置30 min后,1 000 r/min离心10 min。取2 mL离心后的上清液,加入2 mL正己烷,混合后10 000 r/min下离心10 min,收集下层液体,过0.22 µm滤膜后利用氨基酸分析仪上样测定。
1.3.4 南极磷虾自溶前后胰蛋白酶降解产物的制备
参照Wiśniewski[22]、Mi Rui[23]等的方法,分别取1 g自溶前后的冻干样品,分别用10 mL蛋白提取液(含8 mol/L尿素、50 mmol/L NH4HCO3),垂直振荡30 min后,高速低温离心20 min(4 ℃、15 000 r/min)。取上清液,分成3 份,每份100 μL,分别加入2 µL 1 mol/L二硫基苏糖醇,在恒温培养箱中60 ℃反应1 h,冷却至室温后,加入5 µL 1 mol/L现配的碘代乙酰胺,室温避光反应1 h。采用10 kDa截留分子质量的超滤离心管在15 000 r/min离心20 min后,每次用200 µL 50 mmol/L NH4HCO3溶液洗涤膜上层蛋白3 次。最后在膜上层加入200 µL 50 mmol/L NH4HCO3溶液作为缓冲液,并按酶与底物质量比1∶50将胰蛋白酶溶液加入到上述蛋白溶液中,混匀并在37 ℃酶解16 h,使酶解彻底。用超滤离心管15 000 r/min离心超滤20 min,收集下层的肽段滤液。
1.3.5 肽段的高效液相色谱-质谱联用检测
色谱条件:色谱柱:AdvanceBio Peptide Map柱(150 mm×2.1 mm,130 Å,2.7 µm);柱温:40 ℃。流动相A:体积分数0.1%甲酸-乙腈,流动相B:体积分数0.1%甲酸-水;流速:0.25 mL/min;进样量:30 μL;时间:46 min;流动相梯度:0~2 min,95% B;2~17 min,95%~80% B;27~37 min,85%~65% B;37~39 min,65%~20% B;39~42 min,20%~95% B;42~46 min,95% B。
质谱条件:质谱扫描范围:350~1 500 Da,正离子反应模式,雾化气GS1:241 kPa,辅助加热器GS2:310 kPa,气帘气压241 kPa,喷雾电压5 500 eV,离子源温度500 ℃,解簇电压100 V,碰撞能量10 eV,信号强度阈值:2×104。
利用MarkerViewTM和ProteinPilotTM软件进行数据的处理和分析,选用NCBI的南极磷虾蛋白数据库(Euphausua superba. fasta)进行数据检索。MarkerView软件设置如下:最小保留时间2 min,最大保留时间40 min;设置数据的组的分类标志;进行正交偏最小二乘法判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA),选取Pareto方法。ProteinPilot软件参数设置如下:搜库方法:Paragon method;消化:Trypsin;仪器:Q-TOF 5600;物种:None;ID Focus:Amino acid Subtitutions,Biological modifications;Search Effort:Thorough ID;检测蛋白质置信度:95%;提交错误发现率分析报告。使用Origin 9.2软件作图。

图1 南极磷虾蛋白自溶酶在不同温度(A)、pH值(B)下的相对活力
Fig. 1 Relative activity of autolytic enzymes from Antarctic krill at different temperatures (A) and pH (B)
由图1A可以看出,5~35 ℃范围内,南极磷虾自溶酶的相对活力随温度升高缓慢升高,之后迅速升高,在55 ℃处达到峰值,之后又开始下降。由图1B可以看出,在pH 3.0~7.5范围内,南极磷虾自溶酶的相对活力随pH值升高逐渐升高,pH 7.5时活力达到最高值,之后又逐渐下降。因此,南极磷虾自溶的最适温度为55 ℃,最适pH值为7.5,体现了其类胰蛋白酶的属性。这一研究结果与Osnes[24]、Chen[25]等的结果相吻合。
南极磷虾在自溶酶最适温度(55 ℃)和pH值(7.5)下自溶3 h,比较自溶前后氨基酸态氮和游离氨基酸比例的变化。南极磷虾匀浆自溶前和自溶3 h后上清液中氨基酸态氮质量浓度分别为0.64 g/100 mL和0.69 g/100 mL。氨基酸态氮质量浓度反映氨基酸及小肽总体水平[26],是反映酱油品质的重要理化指标[27],酱油氨基酸态氮质量浓度≥0.8 g/100 mL时为特级,0.7g/100 mL≤氨基酸态氮含量<0.8 g/100 mL为一级[28]。由此可以得出南极磷虾自溶前后上清液中的氨基酸态氮质量浓度已达到二级接近一级酱油的标准。
表1 南极磷虾自溶前后游离氨基酸含量变化
Table 1 Contents of free amino acids before and after autolysis

游离氨基酸 呈味特性 自溶前质量分数/%自溶3 h后质量分数/%天冬氨酸(Asp) 鲜 1.13 1.02苏氨酸(Thr) 甜 2.49 2.80丝氨酸(Ser) 甜 1.65 1.75谷氨酸(Glu) 鲜 11.38 10.08甘氨酸(Gly) 鲜 21.67 16.38丙氨酸(Ala) 鲜 10.98 9.96胱氨酸(Cys) 苦/甜/硫磺 3.19 2.03缬氨酸(Val) 甜/苦 2.64 3.41蛋氨酸(Met) 苦/甜/硫磺 1.30 2.34异亮氨酸(Ile) 苦 1.93 2.17亮氨酸(Leu) 苦 3.11 5.21酪氨酸(Tyr) 苦 2.08 4.70苯丙氨酸(Phe) 苦 2.30 6.30赖氨酸(Lys) 甜/苦 6.09 6.59组氨酸(His) 苦 1.14 2.16精氨酸(Arg) 甜/苦 6.99 8.16脯氨酸(Pro) 甜/苦 19.93 14.94
由表1可以看出,甘氨酸和脯氨酸为南极磷虾的主要游离氨基酸,其次为谷氨酸和丙氨酸。南极磷虾自溶后鲜味氨基酸如谷氨酸、甘氨酸、丙氨酸质量分数降低,而苦味氨基酸含量如亮氨酸、异亮氨酸、酪氨酸和苯丙氨酸质量分数升高。因此,在利用南极磷虾自溶液制备调味品时应该慎重选择自溶条件。
南极磷虾自溶前后胰蛋白酶降解产物经高效液相色谱-质谱检测,经NCBI蛋白数据库检索,得到了蛋白、肽段、分子质量、保留时间、响应强度等信息。图2为南极磷虾自溶前后胰蛋白酶降解产物的分子质量分布,为了提高可信度,仅显示置信度大于95%以上的肽段。由图2可以看出,与自溶前相比,南极磷虾自溶后胰蛋白酶降解产物鉴定出的肽段条数明显变少,小分子质量的肽段比例明显提高,说明南极磷虾自溶酶对蛋白质起到了酶切作用。

图2 南极磷虾自溶前后胰蛋白酶降解产物肽段的分子质量分布
Fig. 2 Molecular mass distribution of tryptic peptides from Antarctic krill with and without autolysis
南极磷虾自溶前的胰蛋白酶降解产物中共鉴定到24 个蛋白、1 582 条肽段、5 169 个碎片,自溶后的胰蛋白降解产物中共鉴定到23 个蛋白、1 922 条肽段和5 890 个碎片。表2、3分别为在95%置信度下,南极磷虾自溶前后胰蛋白酶降解产物中鉴定出的蛋白、肽段数目和95%置信度下的肽段覆盖率。
表2 南极磷虾自溶前胰蛋白酶降解产物鉴定的蛋白及肽段数目
Table 2 Identification of proteins and peptides in tryptic hydrolysate of Antarctic krill without autolysis
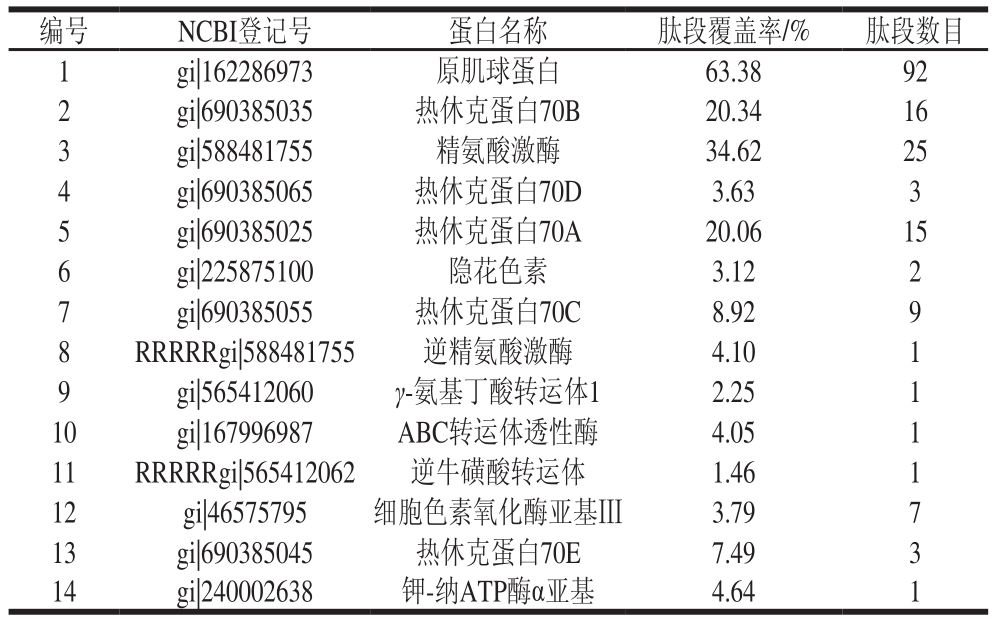
编号 NCBI登记号 蛋白名称 肽段覆盖率/% 肽段数目1 gi|162286973 原肌球蛋白 63.38 92 2 gi|690385035 热休克蛋白70B 20.34 16 3 gi|588481755 精氨酸激酶 34.62 25 4 gi|690385065 热休克蛋白70D 3.63 3 5 gi|690385025 热休克蛋白70A 20.06 15 6 gi|225875100 隐花色素 3.12 2 7 gi|690385055 热休克蛋白70C 8.92 9 8 RRRRRgi|588481755 逆精氨酸激酶 4.10 1 9 gi|565412060 γ-氨基丁酸转运体1 2.25 1 10 gi|167996987 ABC转运体透性酶 4.05 1 11 RRRRRgi|565412062 逆牛磺酸转运体 1.46 1 12 gi|46575795 细胞色素氧化酶亚基Ⅲ 3.79 7 13 gi|690385045 热休克蛋白70E 7.49 3 14 gi|240002638 钾-纳ATP酶α亚基 4.64 1
表3 南极磷虾自溶后胰蛋白酶降解产物鉴定的蛋白及肽段数目
Table 3 Identification of proteins and peptides in tryptic hydrolysate of Antarctic krill with autolysis

编号 NCBI登记号 蛋白名称 肽段覆盖率/% 肽段数目1 gi|162286973 原肌球蛋白 59.160 48 2 gi|690385065 热休克蛋白70D 2.762 2 3 gi|690385025 热休克蛋白70A 2.395 2 4 gi|690385055 热休克蛋白70C 1.565 1 5 gi|588481755 精氨酸激酶 12.820 6 6 gi|690385035 热休克蛋白70B 1.223 1
为了区分南极磷虾自溶前后胰蛋白酶降解产物,采用化学计量学进行分析。图3为南极磷虾自溶前后胰蛋白酶降解产物的OPLS-DA得分图。从图3中可以看出,自溶前和自溶后的南极磷虾样品沿X轴方向明显分开,说明OPLS-DA得分图可以很好地区分自溶前后的两个样品[29]。相比于自溶前的样品,自溶后的样品点略显分散,但从总体上可以很好地区分两个样品。为了进一步寻找导致自溶前后的差异肽段,使用SMICA软件的S-plot进行分析。
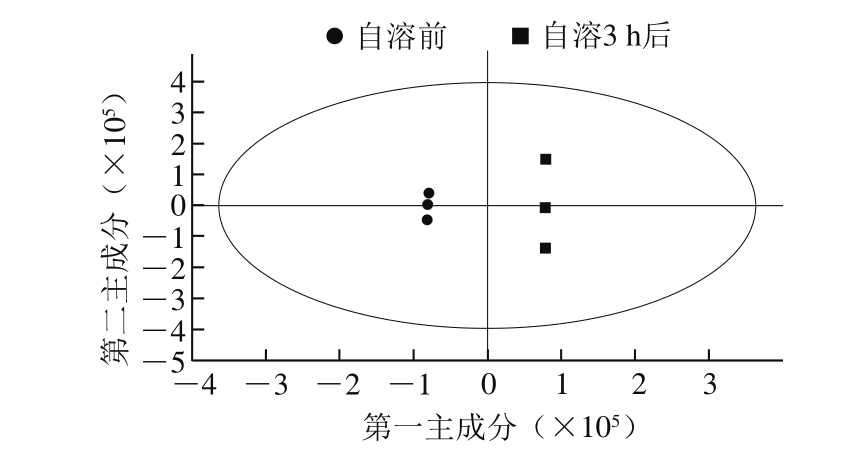
图3 南极磷虾自溶前后胰蛋白酶降解产物的OPLS-DA得分图
Fig. 3 Orthogonal partial least squares discriminant analysis score plot of tryptic hydrolysates of Antarctic krill with and without autolysis

图4 南极磷虾自溶前后胰蛋白酶降解产物的S-plot图
Fig. 4 S-plot of tryptic hydrolysates of Antarctic krill with and without autolysis
图4 为OPLS-DA模型的S-plot图,远离原点,即“S”型两端的点为导致两个样品差异的主要因素[30]。通过PeakView软件对这些导致差异的点进行分析筛选,根据质荷比m/z和保留时间提取峰,选取只在其中一个样品中出现色谱峰的点,结果共鉴定到55 个点,其中26 个点来源于自溶前的样品,29 个点来源于自溶后的样品。由于南极磷虾蛋白数据库尚未完全,并非每个点都能匹配到肽段。将这55 个点的信息与数据库检索到的信息进行比对,共匹配到10 条肽段,其中5 条来源于自溶前的样品,另外5 条来源于自溶后的样品,详细信息如表4所示。
表4 南极磷虾自溶前后的差异性肽段
Table 4 Differential peptides in tryptic hydrolysates of Antarctic krill with and without autolysis

序号 肽段标识 肽段 蛋白来源 多肽修饰 蛋白修饰1 760.4250_31.05SINPDESVAYGAAVQAAILSGDK 热休克蛋白70A 2 783.4027_35.21 VEAKNNLEALCFR 热休克蛋白70C Deamidated(N)@5、Carboxymethyl(C)@11 3 523.2781_12.73 AAVEGEANQL 逆原肌球蛋白 Carboxy(E)@6 Carboxy(E)@203 4 565.7664_30.76 DAVITVPAYFNDSQR 热休克蛋白70B 5 792.3729_29.31 ITDELDQTFNELSG 原肌球蛋白6 888.4946_35.10 TVDLGQEK 逆热休克蛋白70D 7 530.3190_31.56 AVAEDPNISK 逆热休克蛋白70C Oxidation(P)@6、Deamidated(N)@7 Oxidation(P)@290 8 544.3358_20.83 LEDELVNEK 原肌球蛋白9 680.3265_18.55 DRLEDELVNEK 原肌球蛋白10 730.3546_34.81 SLGGSSQIVVQQEK 逆热休克蛋白70D
本研究初步探索了南极磷虾自溶酶的最适温度和pH值,其最适温度为55 ℃,最适pH值为7.5,具有类胰蛋白酶属性。在南极磷虾自溶酶最适温度和pH值下对南极磷虾自溶3 h,自溶后氨基酸态氮质量浓度升高,鲜味氨基酸如谷氨酸、甘氨酸、丙氨酸质量分数降低,而苦味氨基酸如亮氨酸、异亮氨酸、酪氨酸和苯丙氨酸质量分数升高;胰蛋白酶降解产物分子质量分布向小分子质量范围偏移,本实验为研究南极磷虾自溶技术提供了一定的参考。
[1] 朱国平.南极磷虾种群生物学研究进展Ⅰ: 年龄、生长与死亡[J]. 水生生物学报, 2011, 35(5): 862-868. DOI:10.3724/SP.J.1035.2011.00862.
[2] TANEKO S, NOBUKAZU S. The utilization of Antarctic krill for human food[J]. Food Reviews International, 1990, 6(1): 119-147.DOI:10.1080/87559129009540863.
[3] 孙松, 杨光. 南极生物圈的基石: 南极磷虾[J]. 人与生物圈, 2017(增刊1): 92-95. DOI:10.3969/j.issn.1009-1661.2017.01.019.
[4] 黄洪亮, 陈雪忠, 冯春雷. 南极磷虾资源开发现状分析[J]. 渔业现代化, 2007(1): 48-51. DOI:10.3969/j.issn.1007-9580.2007.01.017.
[5] ATKINSON A, SIEGEL V, PAKHOMOV E A, et al. A re-appraisal of the total biomass and annual production of Antarctic krill[J]. Deep Sea Research Part I: Oceanographic Research Papers, 2009, 56(5):727-740. DOI:10.1016/j.dsr.2008.12.007.
[6] 高飞, 韩春然, 石彦国, 等. 南极磷虾蛋白质提取条件优化[J]. 天然产物研究与开发, 2016, 28(2): 307-312; 194. DOI:10.16333/j.1001-6880.2016.2.025.
[7] 王灵昭. 南极磷虾(Euphausia superba)蛋白质深加工新技术研究[D].青岛: 中国海洋大学, 2013: 7-8.
[8] FÄRBER-LORDA J, GAUDY R, MAYZAUD P. Elemental composition, biochemical composition and caloric value of Antarctic krill: implications in energetics and carbon balances[J].Journal of Marine Systems, 2009, 78(4): 518-524. DOI:10.1016/j.jmarsys.2008.12.021.
[9] GIGLIOTTI J C, DAVENPORT M P, BEAMER S K, et al. Extraction and characterisation of lipids from Antarctic krill (Euphausia superba)[J].Food Chemistry, 2011, 125(3): 1028-1036. DOI:10.1016/j.foodchem.2010.10.013.
[10] 王南平, 何兰, 曹俊, 等. 南极磷虾的特性和利用[J]. 水产科技情报,2012, 39(3): 128-131. DOI:10.3969/j.issn.1001-1994.2012.03.005.
[11] 杭虞杰, 李学英, 杨宪时, 等. 南极磷虾自溶酶性质的初步研究[J].食品科学, 2011, 32(13): 198-200.
[12] 任艳. 南极磷虾蛋白加工利用的初步研究[D]. 青岛: 中国海洋大学,2009: 2.
[13] KUBOTA M, SAKAI K. Autolysis of Antarctic krill protein and its inactivation by combined effects of temperature and pH[J].Transactions of the Tokyo University of Fisheries, 1978, 2: 53-63.
[14] KIMOTO K, KUSAMA S, MURAKAMI K. Purification and characterization of serine proteinases from Euphausia superba[J].Journal of the Agricultural Chemical Society of Japan, 2006, 47(3):529-534. DOI:10.1271/bbb1961.47.529.
[15] KONAGAYA S. Protease activity and autolysis of Antarctic krill[J].Bulletin of the Japanese Society of Scientific Fisheries, 1980, 46(2):175-183. DOI:10.2331/suisan.46.175.
[16] 孙雷, 周德庆, 盛晓风. 南极磷虾营养评价与安全性研究[J].海洋 水产研 究, 2008, 29(2): 57-64. DOI:10.3969/j.issn.1000-7075.2008.02.010.
[17] TAKAHASHI K T, KAWAGUCHI S, KOBAYASHI M, et al.Parasitic eugregarines change their spatial distribution within the host digestive tract of Antarctic krill, Euphausia superba[J]. Polar Biology,2003, 26(7): 468-473. DOI:10.1007/s00300-003-0511-2.
[18] 薛勇, 赵明明, 王超, 等. 响应面法优化南极磷虾蛋白自溶工艺的研究[J]. 食品工业科技, 2012, 33(4): 346-348; 373. DOI:10.13386/j.issn1002-0306.2012.04.063.
[19] 郑杰. 海参自溶过程中生化变化及抗氧化活性寡肽的研究[D].镇江: 江苏大学, 2012: 2-4.
[20] ERLANGER B F, KOKOWSKY N, COHEN W. The preparation and properties of two new chromogenic substrates of trypsin[J].Archives of Biochemistry and Biophysics, 1961, 96: 271-278.DOI:10.1016/0003-9861(61)90145-X.
[21] 徐洪军, 丁郭影, 薛秀恒, 等. 中性蛋白酶水解β-乳球蛋白的条件优化[J]. 食品工业, 2013, 34(9): 75-78.
[22] WIŚNIEWSKI J R, ZOUGMAN A, NAGARAJ N, et al. Universal sample preparation method for proteome analysis[J]. Nature Methods,2009, 6(5): 359-362. DOI:10.1038/nmeth.1322.
[23] MI Rui, SUN Yongxin, LI Jianguang, et al. Immune-related proteins detected through iTRAQ-based proteomics analysis of intestines from Apostichopus japonicus in response to tussah immunoreactive substances[J]. Fish and Shellfish Immunology, 2018, 74: 436-443.DOI:10.1016/j.fsi.2018.01.002.
[24] OSNES K K, MOHR V. Peptide hydrolases of Antarctic krill,Euphausia superba[J]. Comparative Biochemistry and Physiology,1985, 82: 599-606. DOI:10.1016/0305-0491(85)90496-1.
[25] CHEN C S, YAN T R, CHEN H Y. Purification and properties of trypsin-like enzymes and a carboxypeptidase a from Euphausia superba[J]. Journal of Food Biochemistry, 1978, 2: 349-366.
[26] 潘慧青, 曹钰, 石慧媛, 等. 黄酒酿造后酵工艺对氨基酸态氮生成的影响[J]. 食品与生物技术学报, 2016, 35(2): 144-150.
[27] 杨静. 浅谈影响酿造酱油中氨基酸态氮含量的因素[J]. 科技与生活,2010, 5: 85; 18.
[28] 甄文甫. 酱油中氨基酸态氮的检测及结果分析[J]. 中国保健, 2009,17(17): 809.
[29] 任晓磊. 基于代谢组学的慢性支气管炎发病机理及岩白菜素作用机制研究[D]. 北京: 北京中医药大学, 2016: 47-49.
[30] CHO K, KIM Y, WI S J, et al. Correction to nontargeted metabolite profiling in compatible pathogen-inoculated tobacco (Nicotiana tabacum L. cv. Wisconsin 38) using UPLC-Q-TOF/MS[J]. Journal of Agricultural and Food Chemistry, 2012, 60(46): 11647-11648.DOI:10.1021/jf304735b.
Changes in Amino Acids and Tryptic Peptides from Antarctic Krill Protein before and after Autolysis
胡玲萍, 张晓梅, 张鸿伟, 等. 南极磷虾自溶前后氨基酸和胰蛋白酶降解产物的变化[J]. 食品科学, 2019, 40(11): 1-6.DOI:10.7506/spkx1002-6630-20180606-049. http://www.spkx.net.cn
HU Lingping, ZHANG Xiaomei, ZHANG Hongwei, et al. Changes in amino acids and tryptic peptides from Antarctic krill protein before and after autolysis[J]. Food Science, 2019, 40(11): 1-6. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180606-049. http://www.spkx.net.cn