群体感应(quorum sensing,QS)是一种细菌间信息交流的通讯系统,细菌通过自身合成并释放信号分子感知环境变化,当信号分子浓度达到一定阈值时开启细胞密度依赖的特定基因表达,进而调控细菌的生物行为,如生物发光、生物被膜形成、毒力因子表达及浮游等[1-2]。微生物的生长代谢是导致水产品腐败的主要原因之一,其QS机制在水产品的腐败过程中起着至关重要的作用。本实验室从腐败大菱鲆中分离得到一株荧光假单胞菌(Pseudomonas fluorescens,PF),作为水产品低温贮藏过程中的优势腐败菌(specific spoilage organism,SSO),其腐败特性受N-酰基高丝氨酸内酯(N-acyl-homoserine lactone,AHLs)介导的QS调控[3-5]。
群体感应抑制剂(quorum sensing inhibitors,QSIs)指对细菌间信息交流具有阻碍作用,能干扰或抑制QS现象,且对细菌正常生命活动不造成破坏的物质[6]。其作用机制主要有以下3 种途径[7-9]:干扰信号分子合成,如抑制信号分子合成酶活性或消除底物等合成过程;降解信号分子,使之无法达到发挥调控作用的阈值浓度;产生信号分子类似物与受体蛋白竞争性结合。因此,利用QSI干扰细菌QS系统、降低腐败菌致腐能力成为新的研究方向。研究发现阿魏精油作为一种新型的QSI可显著抑制紫色杆菌的QS现象[10]。Chow等[11]报道了水杨酸对荧光假单胞菌QS现象具有抑制作用,可有效降低其毒力效应。目前已从药用植物、果蔬、海洋藻类中分离出具有抑制QS的天然活性物质,但其提取率低且操作繁琐,未得到广泛应用。而从现有食品添加剂中筛选QSI,具有成本低廉、便于合成、安全性较高等优点。
富马酸钠又称富马酸一钠,易溶于水,常作为食品添加剂用于配制酒、饮料、罐头和果冻等产品,是一种较安全的酸味剂。一些研究表明其具有良好的抗氧化、抑菌作用。在鱼、贝类罐头中添加富马酸钠可有效防止其黑变[12];肖尔卿等[13]发现经过富马酸钠与超高压协同处理使草莓汁中H2S含量显著减少;此外,富马酸钠对腌制蔬菜中的腐败菌具有较强的抑制作用[14]。但目前,关于富马酸钠的研究主要集中在其作为食品添加剂改善食品风味方面,而作为QSI的研究却鲜有报道。
因此,本实验以富马酸钠为研究对象,探究富马酸钠对荧光假单胞菌QS现象的抑制效果,以期拓宽富马酸钠的应用范围,为新型水产品防腐保鲜剂的研发提供新思路,丰富水产品保鲜理论。
荧光假单胞菌分离自腐败大菱鲆,由渤海大学食品科学研究院保藏。紫色杆菌CV026(Chromobacterium violaceum CV026)为C. violaceum ATCC 31532的mini-Tn5突变体,自身不产AHLs。当存在外源AHLs时,可产生特征性紫色菌素,对酰基侧链长度为C4~C8的AHLs敏感程度不同,具有卡那霉素抗性,活化时需添加20 μg/mL卡那霉素,由渤海大学食品科学研究院保藏。
富马酸钠 北京索莱宝生物科技有限公司;LB肉汤青岛高科园海博生物技术有限公司;甲醇 天津市津东天正精细化学试剂厂;乙酸乙酯、正丁醇、醋酸异戊酯、十二烷基硫酸钠 天津永晟精细化工有限公司;结晶紫 天津致远化学试剂有限公司;卡那霉素、6 种AHLs信号分子标准品(C4-HSL、C6-HSL、C8-HSL、C10-HSL、C12-HSL、C14-HSL) 美国Sigma公司。
SW-CJ-2FD超净工作台 苏净集团苏州安泰空气技术有限公司;Biofuge Stratos台式高速离心机 美国Thermo Fisher公司;MLS-3030CH立式压力灭菌锅广州三洋电机有限公司;MS105UD电子分析天平瑞士梅特勒-托利多仪器有限公司;imark酶标仪美国Bio-Rad公司;80i显微镜 日本尼康公司;7890N/5975气相色谱-质谱联用(gas chromatography-mass spectrometer,GC-MS)仪 美国Agilent公司。
1.3.1 富马酸钠的最小抑菌浓度测定及QS抑制活性的初筛
参考Diao Wenrui等[15]的方法,将报告菌株CV026和荧光假单胞菌过夜培养至对数期(106 CFU/mL),按体积比1∶100接种于LB肉汤中,28 ℃、160 r/min振荡培养至OD595 nm为1左右,用牛津杯打孔,加入不同质量浓度梯度(1.0~10.0 mg/mL)的富马酸钠,以无菌去离子水为空白对照,28 ℃静置培养24~48 h后,观察菌株生长情况。
报告菌株CV026过夜活化后,按体积比1∶100接种于LB肉汤中,28 ℃、160 r/min振荡培养至OD595 nm为1左右,与100 mL含有20 μg/mL C6-HSL信号分子的LB营养琼脂混匀,用牛津杯打孔,加入200 μL质量浓度分别为0.5、1.0、1.5 mg/mL和2.0 mg/mL的富马酸钠,以无菌去离子水为空白对照,28 ℃静置培养24~48 h,观察紫色菌素的产生情况。
1.3.2 富马酸钠对紫色菌素产生及紫色杆菌生长的影响
参照Kato等[16]方法并稍作修改,将过夜活化后的报告菌株CV026按体积比1∶100接种于LB肉汤中,加入终质量浓度为0.5、1.0、1.5 mg/mL和2.0 mg/mL的富马酸钠,并添加20 μg/mL的C6-HSL信号分子,28 ℃、160 r/min振荡培养至OD595 nm为1左右。取300 μL菌液于无菌离心管中,加入150 μL质量分数10%十二烷基硫酸钠,振荡10 s,加入600 μL正丁醇,振荡5 s,10 000 r/min离心5 min,取上清液200 μL加入96 孔板中,于595 nm波长处测定OD值,以无菌去离子水为空白对照。同时,为确定富马酸钠对CV026菌株生长能力的影响,以不加信号分子的实验组作为对照,其余步骤同上。
1.3.3 富马酸钠对荧光假单胞菌生物被膜的影响
1.3.3.1 富马酸钠对荧光假单胞菌生物被膜形成量的影响
根据Rode等[17]方法将荧光假单胞菌过夜培养至对数期(106 CFU/mL),按体积比1∶100接种于LB肉汤中,分装至无菌离心管,每管1 mL,加入富马酸钠使其终质量浓度分别为0.5、1.0、1.5 mg/mL和2.0 mg/mL,以无菌去离子水为阴性对照,以20 μg/mL C6-HSL为阳性对照,每组3 次重复,28 ℃静置培养48 h。待菌液密度测定结束后,倾倒菌液,无菌水漂洗浮游菌3~5 次,无菌风干燥35 min,0.001 g/mL结晶紫溶液染色15 min,无菌水冲洗5~7 次,加入体积分数33%冰醋酸充分溶解,取200 μL于96 孔板中,在595 nm波长处测定OD值。按下式计算生物被膜形成率。
式中:ODcontrol为阴性对照组测得生物被膜的OD595 nm;ODQSI为抑制剂处理组的OD595 nm。
1.3.3.2 富马酸钠对荧光假单胞菌生物被膜形态的影响
载玻片(25.4 mm×76.2 mm,厚度1~2 mm)预处理:将载玻片清洗干净,分别于无水乙醇中超声30 min,去离子水中超声30 min,烘干后灭菌备用。
将过夜活化后的荧光假单胞菌按体积比1∶100接种于LB肉汤中,取10 mL菌液加入无菌培养皿中,加入富马酸钠使其终质量浓度分别为0.5、1.0、1.5 mg/mL和2.0 mg/mL,将处理后的载玻片浸没其中,28 ℃培养72 h。同时,以不添加富马酸钠为阴性对照组,添加C6-HSL信号分子为阳性对照组。取出载玻片后,无菌水漂洗3~5 次,适量甲醇固定15 min,0.02 g/mL结晶紫染色5 min,无菌水冲洗5~7 次,无菌风干燥固定,光学显微镜观察并拍照记录。
1.3.4 富马酸钠对荧光假单胞菌群集和泳动的影响
参考Zhang Juanmei等[18]方法制备群集与泳动培养基,将不同质量浓度的富马酸钠经0.22 μm滤膜过滤后,加入培养基混匀使其终质量浓度为0.5、1.0、1.5 mg/mL和2.0 mg/mL。取5 μL过夜活化的荧光假单胞菌菌悬液加入平板中央,待菌液吸收后28 ℃静置培养48 h,以不添加富马酸钠为阴性对照,添加C6-HSL信号分子为阳性对照,每组3 次重复,期间观察荧光假单胞菌的迁移情况。1.3.5 富马酸钠对荧光假单胞菌胞外蛋白酶活性的影响
根据Ponnuswamy等[19]的方法并稍作修改,按1.3.3节方法制备含有不同质量浓度(0.5、1.0、1.5 mg/mL和2.0 mg/mL)富马酸钠过夜活化后的荧光假单胞菌菌悬液,制作脱脂奶琼脂平板,用牛津杯打孔,取200 μL菌液加入孔内,28 ℃静置培养18~24 h,期间观察其水解圈直径。以不添加富马酸钠为阴性对照,以添加C6-HSL信号分子为阳性对照,每组3 次重复。荧光假单胞菌在生长过程中分泌胞外蛋白酶,使孔径周围出现明显的水解圈,水解圈直径的大小表示蛋白酶活性的高低。
1.3.6 GC-MS测定富马酸钠对荧光假单胞菌分泌AHLs的影响
将过夜活化后的荧光假单胞菌按体积比1∶100接种于LB肉汤中,加入富马酸钠,使其终质量浓度分别为0.5、1.0、1.5、2.0 mg/mL,以不添加富马酸钠为阴性对照,添加C6-HSL信号分子为阳性对照,28 ℃、160 r/min振荡培养48 h。将培养后的菌液10 000 r/min离心10 min,取上清液,加入等量含体积分数0.1%冰乙酸的乙酸乙酯,得有机相,旋转蒸发蒸干溶剂,条件设置为温度35 ℃、真空度0.1 MPa,加入适量甲醇溶解,将所得AHLs粗提液于-20 ℃保存备用。
以甲醇为溶剂制备含有6 种AHLs标准品的混合标准品溶液,由GC-MS检测确定各种标准品的保留时间。参考赵爱飞等[20]的方法设置GC-MS条件。
每组实验均设有3 个平行,用SPSS 19.0软件进行数据分析处理,Origin 8.5软件进行绘图处理。
采用平板法观察富马酸钠质量浓度为1.0~10.0 mg/mL时CV026菌株的生长情况,确定了富马酸钠对CV026菌株的最小抑菌浓度为3.0 mg/mL。同时,相同质量浓度的富马酸钠对荧光假单胞菌不具有抑制作用(图1A)。因此,选取亚抑菌浓度,即3.0 mg/mL以下质量浓度的富马酸钠进行后续实验,实验质量浓度设为0.5、1.0、1.5 mg/mL和2.0 mg/mL。图1B为亚抑菌浓度下富马酸钠对CV026菌株QS活性的抑制效果,添加富马酸钠的孔径周围有乳白色、不透明的抑制圈出现,说明富马酸钠可以抑制CV026菌株特征性紫色菌素的产生。

图1 富马酸钠对荧光假单胞菌生长(A)及紫色杆菌CV026产紫色菌素能力(B)的抑制活性
Fig. 1 Inhibitory effect of sodium fumarate on growth of Pseudomonas fluorescens (A) and violacein production of CV026 strains (B)
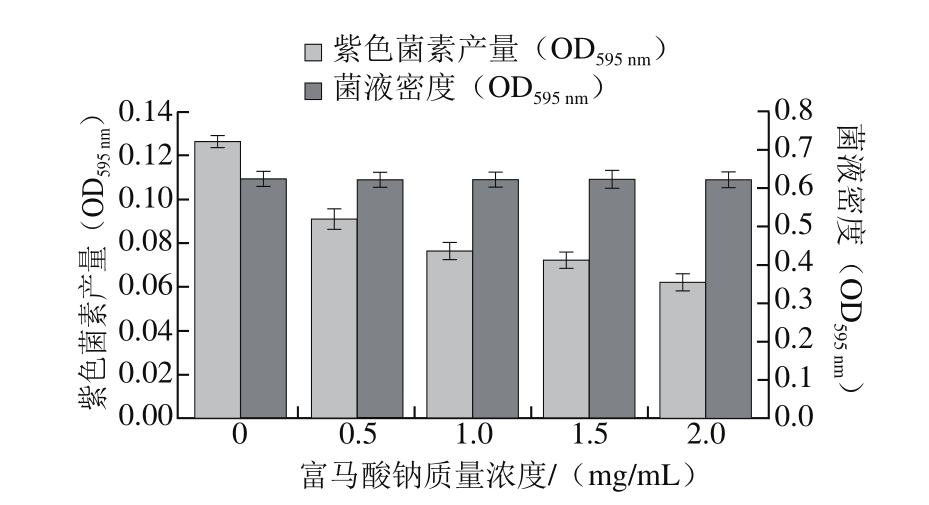
图2 不同质量浓度富马酸钠对CV026菌株紫色菌素产量和菌液密度的影响
Fig. 2 Effect of sodium fumarate on violacein production and bacterial density of CV026
由图2可见,富马酸钠对CV026菌株QS现象的抑制效果。当富马酸钠质量浓度为2.0 mg/mL时,与对照组相比其紫色菌素产量明显降低,其抑制率达50.95%;此外,随着富马酸钠质量浓度逐渐增大,CV026菌株的菌液密度呈平稳状态,说明其对CV026菌株的生长代谢能力没有影响。由此可知,不同质量浓度的富马酸钠通过干扰细菌的QS系统,使得在C6-HSL信号分子存在的情况下,其紫色菌素的产生受到不同程度的抑制,且随其质量浓度增加,这种抑制能力逐渐增强。
2.3.1 富马酸钠对荧光假单胞菌生物被膜形成量的影响
生物被膜指附着在接触物表面的细菌利用自身分泌多糖、纤维蛋白和脂蛋白等物质将菌体包裹形成的一种聚集状膜样物[21-22]。作为细菌保护自身的生长方式,其对环境变化的耐受力远高于浮游菌,一旦在食品加工设备表面形成后极易对食品造成严重污染[23]。研究表明,由AHLs介导的QS系统对假单胞菌生物膜形成、附着及固定具有重要作用[24]。Zhang Ying等[25]报道了百里酚和水杨酸对荧光假单胞菌QS现象及生物被膜形成有较好的抑制效果。因此,本实验探究不同质量浓度富马酸钠对荧光假单胞菌生物被膜的抑制作用。如图3所示,当富马酸钠质量浓度为2.0 mg/mL时,其生物被膜形成率降低至31.82%;质量浓度为0.5 mg/mL时,其生物被膜形成率为84.05%,与阴性对照组相比均能抑制该菌生物膜的形成;而添加外源C6-HSL信号分子可促进其生物被膜形成。这表明,富马酸钠可能通过干扰AHLs介导的QS系统来抑制生物被膜的形成,且不影响其生长,与Zhang Ying等[25]的研究结果相符合。
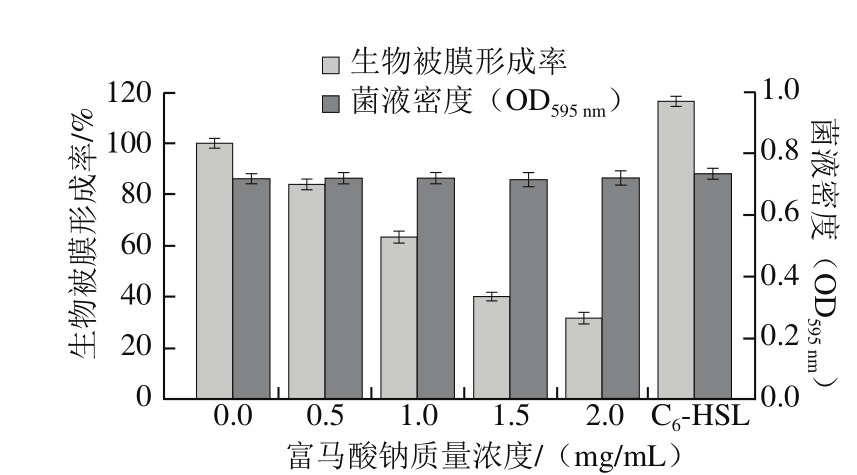
图3 不同质量浓度富马酸钠对荧光假单胞菌生物被膜形成率的影响
Fig. 3 Effect of sodium fumarate on biofilm formation rate of Pseudomonas fluorescens
2.3.2 富马酸钠对荧光假单胞菌生物被膜形态的影响
由图4可见,阴性对照组有大量菌体相连形成密集的紫色膜状结构,且阳性对照组有局部菌体聚集成具有层次感的深紫色团状结构;而处理组随富马酸钠质量浓度增加菌体数量明显减少,部分菌体相连,呈稀疏的网状结构。这说明富马酸钠对荧光假单胞菌生物被膜形成具有抑制作用,由此推测富马酸钠可能干扰了菌体聚集,从而减少细菌微菌落和生物被膜的形成。

图4 富马酸钠对荧光假单胞菌生物被膜影响的光学显微镜图(×10)
Fig. 4 Optical microscopic images showing the effect of sodium fumarate on biofilm formation of Pseudomonas fluorescens (× 10)
群集与泳动是由细菌鞭毛介导的两种迁移方式[26],其不同之处在于前者是群体行为,指细菌在液体培养基内或固体培养基表面的迁移情况,后者则是一种个体行为,指在固体培养基表面或半固体培养基上的迁移情况[27]。细菌鞭毛介导的运动特性与初期黏附至宿主表面及沿着表面的迁移相关联,并且其在后期形成生物被膜的过程中起关键作用[28]。图5为不同质量浓度富马酸钠对荧光假单胞菌群集与泳动的抑制效果,与阴性对照组相比,阳性对照组运动性显著增强,这表明外源AHLs可以促进该菌群集和泳动运动特性。随着富马酸钠质量浓度的增加,其迁移能力呈浓度依赖性下降。这与上述富马酸钠对该菌生物被膜的抑制作用呈现出一定相关性,推测富马酸钠可能干扰了荧光假单胞菌黏附至接触面的能力,从而减少生物被膜的形成。研究表明,肉桂醛能通过影响铜绿假单胞菌的群集和泳动运动性来减少生物被膜形成[29]。Lou Zaixiang等[30]也发现牛蒡叶成分可以减弱铜绿假单胞菌的群集运动能力,从而达到抑制生物被膜形成的目的,与本研究结果相似。


图5 富马酸钠对荧光假单胞菌群集、泳动运动的影响
Fig. 5 Effect of sodium fumarate on swarming and swimming motility of Pseudomonas fluorescens
荧光假单胞菌可利用自身分泌的胞外蛋白酶将水产品中蛋白质及游离氨基酸等物质降解,产生多种腐败代谢物以促进菌体生长代谢,进而使水产品风味和品质发生劣变[31]。相关研究表明,荧光假单胞菌所分泌的胞外蛋白酶受AHLs介导的QS系统调控[32]。Lokender等[33]发现姜油酮能通过干扰信号分子受体蛋白来抑制铜绿假单胞菌QS系统,从而降低蛋白酶活性。因此,本实验探究不同质量浓度富马酸钠对荧光假单胞菌胞外蛋白酶活性的抑制作用。图6、7显示了富马酸钠对荧光假单胞菌胞外蛋白酶活性的影响。结果表明,富马酸钠对该菌蛋白酶活性具有明显抑制作用,呈浓度依赖性增强;且外源C6-HSL信号分子的添加刺激该菌分泌AHLs,增强其蛋白酶活性,因此阳性对照组的水解圈直径最大,达21.09 mm,与Lokender等[33]报道的结果一致。
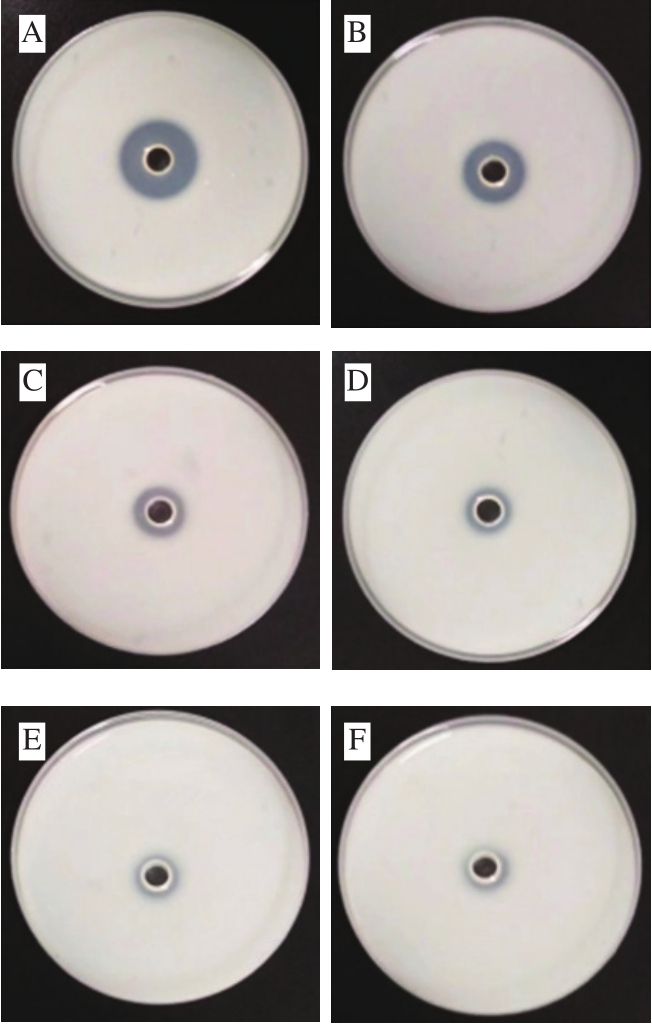
图6 富马酸钠对荧光假单胞菌胞外蛋白酶活性的影响
Fig. 6 Effect of sodium fumarate on extracellular protease activity of Pseudomonas fluorescens

图7 富马酸钠对荧光假单胞菌胞外蛋白酶活性的影响
Fig. 7 Effect of sodium fumarate on extracellular protease activity of Pseudomonas fluorescens
由图8可知,6 种AHLs(C4-HSL~C14-HSL)的混合标准品完全分离,峰形尖锐且对称,其相应的保留时间依次为4.408、6.254、8.305、10.685、13.374、16.882 min。由于菌株的生长时间不同,所分泌的信号分子含量也有所差异,0~4 h为菌株生长的迟滞期,4~24 h进入到对数增长期。如图9所示,在相同培养时间条件(12 h)下,荧光假单胞菌分泌量较高的信号分子为C4-HSL、C6-HSL和C8-HSL。随富马酸钠质量浓度逐渐增加,各AHLs的峰面积均呈现下降趋势,表明富马酸钠对荧光假单胞菌AHLs的分泌具有较好的抑制效果,推测富马酸钠可以作为QSI降低QS信号分子的活性。

图8 AHLs混合标准品的GC-MS图
Fig. 8 GC-MS graph of AHLs mixed with the standard
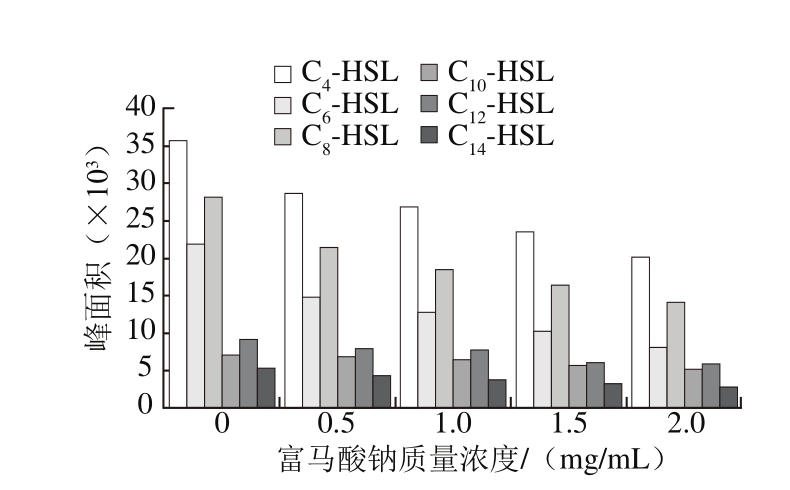
图9 富马酸钠对荧光假单胞菌产AHLs的影响
Fig. 9 Effect of sodium fumarate on the secretion of AHLs from Pseudomonas fluorescens
目前,以天然QSI或QSI类似物为靶点来干扰或阻断QS系统已成为近年来的研究热点。本研究以富马酸钠为研究对象,利用报告菌株CV026来验证亚抑菌浓度下富马酸钠的QS抑制活性,探究了富马酸钠对荧光假单胞菌QS现象及其腐败活性的抑制作用。结果表明,富马酸钠在不影响细菌生长能力条件下明显抑制了CV026菌株紫色菌素的产生,当质量浓度为2.0 mg/mL时,与对照组相比其抑制率达50.95%;且在该质量浓度下,荧光假单胞菌生物被膜形成率降低至31.82%。因此,推测富马酸钠可能通过干扰荧光假单胞菌QS系统对其生物被膜、胞外蛋白酶、群集与泳动等相关腐败特性进行抑制,且随着质量浓度增加其抑制能力增强。此外,由GC-MS检测结果可知,富马酸钠对荧光假单胞菌AHLs的分泌有较好的抑制效果。由此说明,富马酸钠具有较强的QS抑制活性,可作为新型的QSI用于延长水产品货架期。本实验主要研究了富马酸钠对荧光假单胞菌QS现象及腐败特性的影响,其作用机制未明确。下一步可利用转录组学技术,从分子层面明晰富马酸钠的抑制机理。
[1] PACKIAVATHY I A S V, AGILANDESWARI P, MUSTHAFA K S, et al.Antibiofilm and quorum sensing inhibitory potential of Cuminum cyminum and its secondary metabolite methyl eugenol against Gram negative bacterial pathogens[J]. Food Research International, 2012,45(1): 85-92. DOI:10.1016/j.foodres.2011.10.022.
[2] SOLANO C, ECHEVERZ M, LASA I. Biofilm dispersion and quorum sensing[J]. Current Opinion in Microbiology, 2014, 18(4): 96-104.DOI:10.1016/j.mib.2014.02.008.
[3] 崔方超, 李婷婷, 刘明爽, 等. 大菱鲆荧光假单胞菌的群体感应现象及不同碳源培养下的腐败特性研究[J]. 现代食品科技, 2015, 31(12):49-55. DOI:10.13982/j.mfst.1673-9078.2015.12.008.
[4] AMMOR M S, MICHAELIDIS C, NYCHAS G E. Insights into the role of quorum sensing in food spoilage[J]. Journal of Food Protection,2008, 71(7): 1510-1525. DOI:10.4315/0362-028X-71.7.1510.
[5] BANERJEE G, RAY A K. The talking language in some major Gramnegative bacteria[J]. Archives of Microbiology, 2016, 198(6): 489-499.DOI:10.1007/s00203-016-1220-x.
[6] 王鸿, 平夏婷, 陈苏, 等. 革兰氏阴性菌群体感应抑制剂的研究进展[J]. 浙江化工, 2016, 47(11): 15-21. DOI:10.3969/j.issn.1006-4184.2016.11.005.
[7] CHEN F, GAO Y X, CHEN X Y, et al. Quorum quenching enzymes and their application in degrading signal molecules to block quorum sensing-dependent infection[J]. International Journal of Molecular Sciences, 2013, 14(9): 17477-17500. DOI:10.3390/ijms140917477.
[8] DU Y F, LI T, WAN Y F, et al. Signal molecule-dependent quorumsensing and quorum-quenching enzymes in bacteria[J]. Critical Reviews in Eukaryotic Gene Expression, 2014, 24(2): 117-132.DOI:10.1615/CritRevEukaryotGeneExpr.2014008034.
[9] KALIA V C, PUROHIT H J. Quenching the quorum sensing system: potential antibacterial drug targets[J]. Critical Reviews in Microbiology, 2011, 37(2): 121-140. DOI:10.3109/104084 1X.2010.532479.
[10] 王锦利, 周爱莲, 林其洋, 等. 阿魏植物精油对紫色杆菌群体感应的影响[J]. 现代食品科技, 2016, 32(10): 90-95. DOI:10.13982/j.mfst.1673-9078.2016.10.015.
[11] CHOW S, GU K, JIANG L, et al. Salicylic acid affects swimming,twitching and swarming motility in Pseudomonas aeruginosa,resulting in decreased biofilm formation[J]. Mccarthy, 2011, 15: 22-29.
[12] 周秀琴. 日本开发防止鱼贝类罐头食品黑变的添加剂[J]. 水产科技情报, 2001, 28(6): 267. DOI:10.3969/j.issn.1001-1994.2001.06.027.
[13] 肖尔卿, 潘见, 孟飞龙, 等. 富马酸钠协同超高压抑制冻藏草莓果汁中H2S研究[J]. 食品工业科技, 2014, 35(17): 80-83. DOI:10.13386/j.issn1002-0306.2014.17.008.
[14] 孙磊. 腌制蔬菜中复合防腐剂的开发和应用研究[D]. 合肥: 合肥工业大学, 2010: 28-29. DOI:10.7666/d.y1700498.
[15] DIAO Wenrui, ZHANG Liangliang, FENG Saisai, et al. Chemical composition, antibacterial activity, and mechanism of action of the essential oil from Amomum kravanh[J]. Journal of Food Protection,2014, 77(10): 1740-1746. DOI:10.4315/0362-028X.JFP-14-014.
[16] KATO N, TANAKA T, NAKAGAWA S, et al. Control of virulence factor expression in opportunistic pathogens using cyclodextrin immobilized gel[J]. Journal of Inclusion Phenomena & Macrocyclic Chemistry, 2007, 57(1/2/3/4): 419-423. DOI:10.1007/s10847-006-9228-5.
[17] RODE T, LANGSRUD S, HOLCK A, et al. Different patterns of biofilm formation in Staphylococcus aureus under food-related stress conditions[J]. International Journal of Food Microbiology, 2007,116(3): 372-383. DOI:10.1016/j.ijfoodmicro.2007.02.017.
[18] ZHANG Juanmei, RUI Xin, WANG Li, et al. Polyphenolic extract from Rosa rugosa tea inhibits bacterial quorum sensing and biofilm formation[J]. Food Control, 2014, 42(2): 125-131. DOI:10.1016/j.foodcont.2014.02.001.
[19] PONNUSWAMY V. A simple method for the detection of protease activity on agar plates using bromocresolgreen dye[J]. Journal of Biochemical Technology, 2013, 4(3): 628-630.
[20] 赵爱飞, 黄旭镇, 叶晓锋, 等. 气相色谱-质谱定量检测水产品腐败菌群体感应DKPs信号分子[J]. 微生物学通报, 2016, 43(2): 343-350.DOI:10.13344/j.microbiol.china.150385.
[23] BLANCHETTE K A, PRABHAKARA R, SHIRTLIFF M E, et al.Inhibition of fracture healing in the presence of contamination by Staphylococcus aureus: effects of growth state and immune response[J]. Journal of Orthopaedic Research, 2017, 35(9): 1845-1854.DOI:10.1002/jor.23573.
[22] MA L Y, WANG J, WANG S W, et al. Synthesis of multiple Pseudomonas aeruginosa biofilm matrix exopolysaccharides is posttranscriptionally regulated[J]. Environmental Microbiology, 2012,14(8): 1995-2005. DOI:10.1111/j.1462-2920.2012.02753.x.
[23] HOUDT R V, MICHIELS C W. Biofilm formation and the food industry, a focus on the bacterial outer surface[J]. Journal of Applied Microbiology, 2010, 109(4): 1117-1131. DOI:10.1111/j.1365-2672.2010.04756.x.
[24] YUNOS N Y M, TAN W S, KOH C L, et al. Pseudomonas cremoricolorata strain ND07 produces N-acyl homoserine lactones as quorum sensing molecules[J]. Sensors, 2014, 14(7): 11595-11604.DOI:10.3390/s140711595.
[25] ZHANG Ying, KONG Jie, XIE Yunfei, et al. Essential oil components inhibit biofilm formation in Erwinia carotovora, and Pseudomonas fluorescens, via anti-quorum sensing activity[J]. LWT-Food Science and Technology, 2018, 92: 133-139. DOI:10.1016/j.lwt.2018.02.027.
[26] SWIECICKI J M, SLIUSARENKO O, WEIBEL D B. From swimming to swarming: Escherichia coli cell motility in two-dimensions[J].Integrative Biology, 2013, 5(12): 1490-1494. DOI:10.1039/c3ib40130h.
[27] SERVANT A, QIU F, MAZZA M, et al. Controlled in vivo swimming of a swarm of bacteria-like microrobotic flagella[J]. Advanced Materials, 2015, 27(19): 2981-2988. DOI:10.1002/adma.201404444.
[28] PRATT L A, KOLTER R. Genetic analysis of Escherichia coli biofilm formation: roles of flagella, motility, chemotaxis and type I pili[J].Molecular Microbiology, 1998, 30(2): 285-293. DOI:10.1046/j.1365-2958.1998.01061.x.
[29] LI T T, WANG D F, LIU N, et al. Inhibition of quorum sensing-controlled virulence factors and biofilm formation in Pseudomonas fluorescens, by cinnamaldehyde[J]. International Journal of Food Microbiology, 2018,269: 98-106. DOI:10.1016/j.ijfoodmicro.2018.01.023.
[30] LOU Zaixiang, WANG Hongxin, TANG Yuxia. The effect of burdock leaf fraction on adhesion, biofilm formation, quorum sensing and virulence factors of P. aeruginosa[J]. Journal of Applied Microbiology,2017, 122(3): 615-624. DOI:10.1111/jam.13348.
[31] MYSZKA K, SCHMIDT M T, MAJCHER M, et al. Inhibition of quorum sensing-related biofilm of Pseudomonas fluorescens, KM121 by Thymus vulgare, essential oil and its major bioactive compounds[J].International Biodeterioration & Biodegradation, 2016, 114: 252-259.
[32] 崔方超, 李婷婷, 刘明爽, 等. 大菱鲆荧光假单胞菌的群体感应现象及不同碳源培养下的腐败特性研究[J]. 现代食品科技, 2015, 31(12):49-55. DOI:10.13982/j.mfst.1673-9078.2015.12.008.
[33] LOKENDER K, SANJAY C, RAJNISH K, et al. Zingerone silences quorum sensing and attenuates virulence of Pseudomonas aeruginosa[J]. Fitoterapia, 2015, 102: 84-95. DOI:10.1016/j.fitote.2015.02.002.
Inhibitory Effect of Sodium Fumarate on Quorum Sensing and Spoilage Capacity of Pseudomonas fluorescens
孙晓佳, 李婷婷, 赫彬彬, 等. 富马酸钠对荧光假单胞菌群体感应现象及其腐败活性的抑制作用[J]. 食品科学, 2019,40(11): 7-13. DOI:10.7506/spkx1002-6630-20180510-163. http://www.spkx.net.cn
SUN Xiaojia, LI Tingting, HE Binbin, et al. Inhibitory effect of sodium fumarate on quorum sensing and spoilage capacity of Pseudomonas fluorescens[J]. Food Science, 2019, 40(11): 7-13. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180510-163. http://www.spkx.net.cn