
干酪是以乳为原料,加入适量发酵剂和凝乳酶,经凝乳并分离乳清而制得的乳制品,除了含有丰富的蛋白质、脂肪等有机成分外,还具有降低血清胆固醇、预防心血管疾病、维持肠道菌群的平衡和稳定、防止腹泻和便泌等生理功能[1]。马苏里拉干酪源于意大利[2],随着披萨的流行而闻名于世,制作中的热烫拉伸工序赋予了马苏里拉干酪特有的纤维状结构,使其具有良好的融化性和拉伸性[3]。
微生物凝乳酶在干酪中应用前景广阔,普遍具有高凝乳活性和高蛋白水解活性[4-8]。干酪在成熟过程中会发生一系列生化反应,主要包括蛋白质水解、脂肪水解和糖酵解等[9],其中,蛋白质水解可以通过释放氨基酸和肽产生风味物质[10],并通过NH3的生成影响pH值和微生物数量[11]。这有利于形成丰富的风味物质,但会因蛋白过度水解而形成苦味肽,影响干酪的品质和口感。
本实验室前期通过甲醇芽孢杆菌(Bacillus methanolicus)获得了凝乳酶,经测定其凝乳活力为5.97×105 SU/g、蛋白水解活力为9.47×103 U/g[12],与商品酶(凝乳活力3.60×105 SU/g、蛋白水解活力1.21×103 U/g)有较大差异。为了探究该凝乳酶是否具有代替商品酶或部分代替商品酶应用于马苏里拉干酪中的潜力,本研究前期预实验以商品酶作为对照,比较了不同组别(甲醇芽孢杆菌凝乳酶质量分数分别为10%、20%、30%)混合凝乳酶的凝乳活力和蛋白水解活力,最终选择蛋白水解活力相对较低的质量分数10%甲醇芽孢杆菌凝乳酶、商品凝乳酶混合酶(凝乳活力4.34×105 SU/g、蛋白水解活力3.42×103 U/g)制作马苏里拉干酪,并对不同组别干酪成熟过程中的理化特性、蛋白水解、质构、风味特性和感官指标进行测定。
新鲜生牛乳 北京半截河奶牛场;发酵剂(乳酸乳球菌) 法国丹尼斯克公司;商品凝乳酶 科汉森有限公司;牛肉膏、蛋白胨、胰蛋白胨、硫酸镁、酵母提取物、葡萄糖、氯化钠、柠檬酸钠、琼脂 北京半夏生物科技有限公司;甲醇芽孢杆菌凝乳酶由北京工商大学乳制品实验室分离提取。
冷冻干燥机 北京五洲东方科技发展有限公司;超低温冰柜 美国Thermo Fisher Scientific公司;TexturePro CTV1.8 Build31质构仪 美国Brookfield公司;T25 Ultra-Turrax匀浆器 德国IKA公司;U-3900紫外分光光度计、CR21Ⅲ高速冷冻离心机、S-480扫描电子显微镜 日本日立公司;Kjeltec8100凯氏定氮仪丹麦FOSS公司;7890A-7000气相色谱-质谱联用美国Agilent公司;高效液相色谱(high performance liquid chromatography,HPLC)仪 日本岛津公司;全自动凝胶成像系统 美国Bio-Rad公司;API3200 HPLC-四极杆-离子阱-串联质谱仪 美国AB公司;FE20实验室pH计 上海梅特勒-托利多仪器有限公司。
1.3.1 马苏里拉干酪的制作工艺流程

在预实验的基础上,分别使用甲醇芽孢杆菌凝乳酶、混合酶制剂(质量分数10%甲醇芽孢杆菌凝乳酶和90%商品凝乳酶)制作的马苏里拉干酪作为实验组,以商品凝乳酶制作的干酪作为对照组。
1.3.2 理化指标的测定
在制作马苏里拉干酪的过程中,准确称取并记录原料乳、发酵剂、NaCl和干酪成品的质量,干酪得率按下式计算。
根据GB 5009.3—2016《食品安全国家标准 食品中水分的测定》测定干酪水分质量分数;根据AOAC 920.123(2001)凯氏定氮(Kjeldahl)法测定干酪蛋白质量分数;脂肪质量分数测定采用Röse-Gottlieb法;根据AOAC 975.20(2001)银量(Volhard)法测定干酪中NaCl质量分数。
1.3.3 成熟过程中pH值的测定
分别取马苏里拉干酪样品10 g,加入12 mL 50 ℃温浴的蒸馏水中,用Ultra-Turrax匀浆器处理1 min将样品充分匀浆,放置在50 ℃水浴中保温30 min后于5 000×g、20 ℃离心15 min,倒掉脂肪层,取下层溶液使用pH计测定pH值。
1.3.4 成熟过程中乳酸乳球菌数量的测定
分别在干酪成熟0、1、2、3、4 周时采用平板计数法测定样品中的活菌数。取11 g样品加入40 ℃的100 mL 0.02g/mL柠檬酸钠溶液中,用Ultra-Turrax匀浆器处理2 min将样品充分匀浆,用质量分数0.9%生理盐水逐级稀释到适当倍数的体积。准确吸取50 μL稀释后样品涂布于M17琼脂平板上,培养2~3 d后对乳酸乳球菌进行计数。
1.3.5 蛋白水解特性分析
1.3.5.1 pH 4.6时可溶性蛋白的HPLC分析
样品处理:分别取干酪样品20 g,加入40 mL 50 ℃温浴的蒸馏水中充分匀浆,于40 ℃水浴中保温1 h后3 000×g、20 ℃离心15 min,过滤除去脂肪,用乙酸调节至pH 4.6,离心后取上清液冷冻干燥成粉末,备用。
溶液配制:A液:以蒸馏水为溶剂配制体积分数0.1%三氟乙酸溶液;B液:以乙腈为溶剂配制体积分数0.1%的三氟乙酸溶液。以A液为溶剂,将上述样品配制成10 mg/mL溶液,经0.45 μm的滤膜过滤后于HPLC进样。进样量为50 μL,流速为0.75 mL/min,柱温为45 ℃。
洗脱程序:55 min内B液由0%(体积分数,下同)升至45%;45% B液维持6 min;3 min内B液由45%上升至54%;1 min内B液由54%上升至85%;85% B液冲洗10 min;1 min内B液由85%下降至0%;A液冲洗15 min。全程共91 min,洗脱峰在214 nm波长处进行检测。以峰面积表示可溶性蛋白的水解程度。
1.3.5.2 酪蛋白水解分析
尿素缓冲液:将7.5 g Tris和480 g尿素加入20 mL巯基乙醇定容至1 L,调节至pH 7.6。
上样缓冲液:将7.5 g Tris、480 g尿素和痕量溴酚蓝加入10 mL巯基乙醇定容至1 L,调节至pH 7.6。
电极缓冲液:将15 g Tris和73 g甘氨酸加入5 L去离子水充分溶解。
样品制备:分别取干酪样品1 g磨碎溶于5 mL尿素缓冲液中,在40 ℃水浴中保温处理30 min,3 000×g、4 ℃离心10 min,量取100 μL上清液与300 μL上样缓冲液混合,取5 μL上样,采用尿素-聚丙烯酰胺凝胶电泳检测。
1.3.5.3 游离氨基酸分析
样品前处理:称适量干酪样品,加6 mL HCl溶液,充氮气保护,密封110 ℃消化21 h,取消化液过水系滤膜,取滤液100 μL,真空干燥后于1 000 μL蒸馏水中复溶。
衍生化:取混合标准品(氨基酸混合物)和加入50 μL蛋白沉淀剂(含正缬氨酸)的待测样品,混匀后13 200 r/min 4 ℃离心4 min,取上清液10 μL,加入50 μL标记缓冲液混匀,4 ℃、1 000 r/min离心10 s。再加20 μL衍生液混匀,4 ℃、1 000 r/min离心10 s后置于55 ℃恒温衍生15 min。衍生后样品置于冰箱冷却后混匀,4 ℃、1 000 r/min离心10 s,取50 μL采用HPLC-四极杆-离子阱-串联质谱仪检测,对比标准品定性,通过建立标准曲线定量。
HPLC条件:色谱柱:MSLab50AA-C18(150 mm×4.6 mm,5 μm),柱温:50 ℃,流速:1 mL/min,流动相A:水(含体积分数1‰甲酸),流动相B:乙腈(含体积分数1‰甲酸),进样量:5 μL。
质谱条件:电喷雾离子源,喷雾电压5 500 V,雾化气压力3.45×105 Pa,辅助气压力4.14×105 Pa,扫描方式为多反应监测,碰撞气CAD参数设置为中等,雾化温度500 ℃,气帘气压力1.38×105 Pa,碰撞室射出电压2.0 V,射入电压10 V。
1.3.6 质构特性测定
将干酪样品切成1.5 cm×1.5 cm×1.5 cm的小块,在室温(25 ℃)下平衡30 min后用质构分析仪对样品进行全质地剖面分析。测试参数设定如下:预测试速率2.0 mm/s、测试速率0.4 mm/s、返回速率0.4 mm/s、循环2 次、数据频率20 点/秒、触发点负载5 g、压缩比50%、探头型号TA11/1000。每个样品至少3 次平行,取平均值。
1.3.7 微观结构观察
分别取干酪内部样品,用锋利的灭菌刀片准确切割成4~5 mm3的小块,加入质量分数2.5%、pH 6.8的戊二醛溶液进行固定。将上述样品置于液氮中冷冻,取出后用刀片切断横截面,并用pH 6.8磷酸盐缓冲液冲洗3 次,每次约10 min。用乙醇进行梯度脱水,每次10~15 min,其中无水乙醇冲洗3 次,其他体积分数各冲洗1 次。用氯仿脱脂2 h,脱脂的同时间隔振荡,用叔丁醇置换其中的乙醇,经过冷冻干燥后选择要观察的面进行固定。采用离子溅射的方法镀金,使用扫描电子显微镜进行观察。
1.3.8 风味分析
采用固相微萃取的方法对干酪样品进行风味物质测定,称取10 g样品,磨碎后加入30 mL萃取瓶中,并加入1 g NaCl和1 μL 0.816 mg/mL庚酮作为内标,加盖密封,置于40 ℃水浴锅中平衡30 min,用固相微萃取头于40 ℃吸附30 min后插入气相色谱进样口,250 ℃解吸5 min。
气相色谱条件:程序升温:初始温度为40 ℃,保持3 min;以5 ℃/min升温到200 ℃,保持0 min;再以10 ℃/min升温到250 ℃,保持3 min;后运行3 min。载气(He)恒定流速为1.2 mL/min,进样口温度250 ℃,分流比5∶1。
质谱条件:电子轰击离子源,电子能量70 eV,传输线温度280 ℃,离子源温度为230 ℃,四极杆温度为150 ℃,扫描范围m/z 40~250。
经过气相色谱-质谱分析后,利用仪器自带的NIST14质谱库对干酪中成分进行自动检索,通过软件求出各成分保留指数,将软件计算得到的保留指数与数据库比对进行定性分析,采用峰面积归一化法计算各化学成分的相对含量。
1.3.9 干酪的感官评价
分别对成熟4 周的干酪样品进行感官评定。评定方法参照RHB 507—2015《披萨用拉丝性干酪感官评鉴细则》[13]稍有改动,分别对样品拉丝性、出油性、风味、质构、保形性进行评分。其中感官评鉴人数为10 人,均经过专门培训与考核,具备乳制品方面的专业知识,熟悉评鉴样品的色、香、味、质地、类型、特征、风格及检测所需要的方法,评定标准如表1所示。
表1 马苏里拉干酪感官评定标准
Table 1 Criteria for sensory evaluation of Mozzarella cheese

拉丝性(25 分) 出油性(10 分) 风味(15 分) 质构(15 分) 保形性(35 分)拉丝长200~300 mm,拉丝数超过4 根:20~25 分表面出现少量油斑:8~10 分风味良好,无异味:12~15 分光滑咀嚼口感:12~15 分≥80%:31~35 分拉丝长100~200 mm,拉丝数2~3 根:14~19 分表面出现数个油斑:6~7 分轻微异味:8~11 分轻微粗糙口感:8~11 分60%~80%:21~30 分拉丝长25~100 mm,拉丝数1~2 根:8~13 分有较多油斑,但不严重:4~5 分稍明显异味:4~7 分中等粗糙口感:3~7 分40%~60%:11~20 分无拉丝性:0~7 分 出油严重:0~3 分严重异味:0~3 分严重粗糙口感,有颗粒感:0~2 分<40%:0~10 分
每个样品至少测定3 次,结果以平均值±标准差表示。实验数据采用SPSS 17.0软件进行单因素方差分析,P<0.05表示差异显著。
表2 干酪理化特性分析
Table 2 Physicochemical properties of cheeses
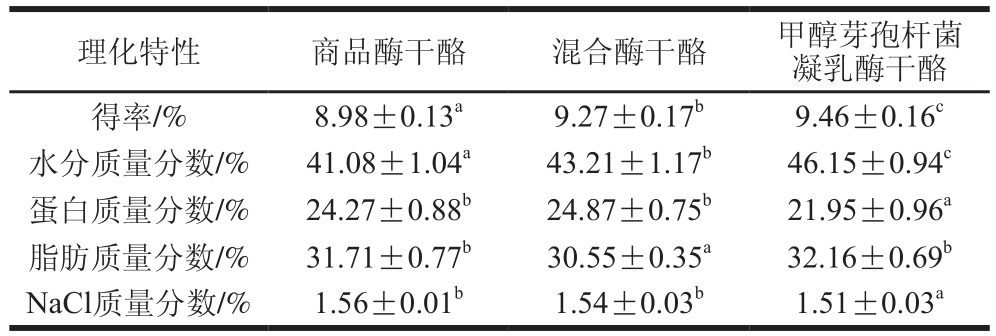
注:同行肩标小写字母不同表示差异显著(P<0.05)。
理化特性 商品酶干酪 混合酶干酪 甲醇芽孢杆菌凝乳酶干酪得率/% 8.98±0.13a 9.27±0.17b 9.46±0.16c水分质量分数/% 41.08±1.04a 43.21±1.17b 46.15±0.94c蛋白质量分数/% 24.27±0.88b 24.87±0.75b 21.95±0.96a脂肪质量分数/% 31.71±0.77b 30.55±0.35a 32.16±0.69b NaCl质量分数/% 1.56±0.01b 1.54±0.03b 1.51±0.03a
由表2可以看出,实验组干酪的水分质量分数和得率显著高于对照组(P<0.05)。甲醇芽孢杆菌凝乳酶水解作用强,可能会在干酪成熟初期产生大量游离水结合在干酪中,形成较软的质地,使干酪保形性差[14],但表现为得率提高;水分质量分数还会影响干酪微观结构[15],可通过判断其微观结构的差异确定微生物凝乳酶水解作用对干酪品质的影响。3 组干酪的其余理化指标整体差异不大,且均在生产要求范围内[16]。
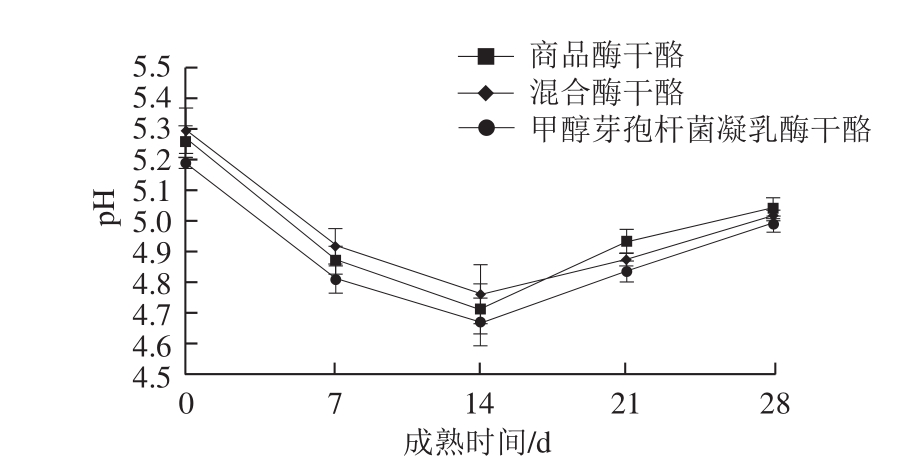
图1 干酪成熟过程中pH值变化
Fig. 1 Changes in pH during the ripening process of cheeses
在整个成熟过程中,干酪样品的pH值均呈现先下降后上升的趋势(图1),其原因可能是成熟前期干酪中微生物和残存凝乳酶会分解乳糖生成乳酸,分解脂肪生成脂肪酸,从而导致干酪pH值的下降;随着成熟时间的延长,干酪处于较低pH值的体系中,不利于微生物的分解代谢,且乳糖会随着干酪成熟逐渐消耗殆尽,残余的乳酸会和蛋白水解出的NH3发生中和,使得pH值小幅上升[17]。在成熟的第14天,甲醇芽孢杆菌凝乳酶干酪的pH值下降达到最小值,说明残余凝乳酶活力对干酪成熟期间的pH值产生影响,但三者pH值变化均在4.6~5.3范围内。

图2 干酪成熟过程中乳酸乳球菌存活情况
Fig. 2 Survival of Lactococcus lactis during the ripening process of cheeses
乳酸乳球菌对干酪成熟过程中的质构和风味产生影响[18]。干酪样品中的乳酸乳球菌数量在干酪成熟期间均呈现先上升后下降的趋势,如图2所示。在干酪成熟初期,牛乳中大量乳糖被乳酸乳球菌分解用于生长繁殖,乳酸乳球菌数量增加。随着乳糖含量的减少,乳酸乳球菌逐渐死亡或自溶[19],其死亡后释放出的各种酶类能够降解蛋白质、脂肪等大分子有机物,赋予干酪良好的品质和风味[20]。尽管干酪中乳酸乳球菌数量均达到了8.80~9.68(lg(CFU/g)),但在成熟后期,甲醇芽孢杆菌凝乳酶干酪中的乳酸乳球菌数量要稍低于混合酶干酪和对照组干酪。整体来看,乳酸乳球菌在干酪成熟过程中能较好地存活,受凝乳酶的影响不大。
2.4.1 pH 4.6时可溶性蛋白的HPLC分析结果
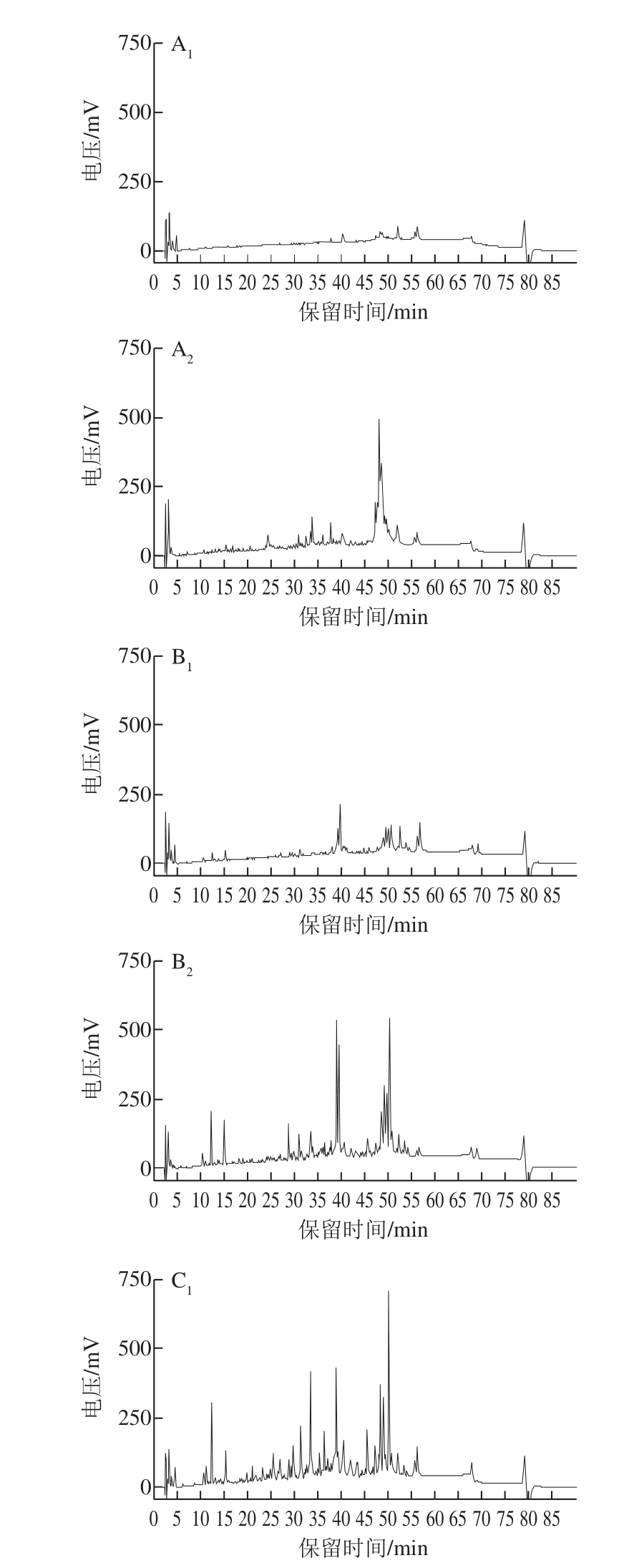

图3 干酪成熟过程中pH 4.6时可溶性蛋白的HPLC分析
Fig. 3 High performance liquid chromatograms of pH 4.6 soluble protein during the ripening process of cheeses
pH 4.6是酪蛋白的等电点,在此条件下干酪中酪蛋白沉淀,其中可溶性蛋白主要是对干酪成熟过程中蛋白质水解出的肽段进行分离而获得的产物,用以表征蛋白水解程度的大小,也是干酪成熟的标志[21]。在干酪成熟过程中,添加的大部分凝乳酶会随乳清一起排出,残存在干酪中的凝乳酶会继续水解酪蛋白生成多肽。如图3所示,甲醇芽孢杆菌凝乳酶干酪在成熟0 周就有明显的蛋白水解肽生成,这是由于甲醇芽孢杆菌凝乳酶的高蛋白水解活性发挥了作用;而干酪中的凝乳酶一般要求凝乳活力强,蛋白水解活力弱,否则会导致干酪得率下降和苦味肽的生成,影响其品质。对照组干酪在成熟前期几乎没有蛋白水解肽段的出现,随着干酪的逐渐成熟,少许肽段才被水解出来,说明商品酶蛋白水解活性低,干酪成熟时间也相应延长。混合酶干酪与其余两组相比表现出了适度的蛋白水解活性,水解出的肽还可形成风味物质[22]。
2.4.2 干酪成熟过程中酪蛋白水解分析结果

图4 干酪成熟过程中酪蛋白水解的尿素-聚丙烯酰胺凝胶电泳结果
Fig. 4 Electrophoretic analysis of casein hydrolysis during the ripening process of cheeses
随着成熟时间的延长,蛋白质均有一定程度的降解[23],尿素-聚丙烯酰胺凝胶电泳结果中表现为蛋白条带变窄或消失(图4)。与成熟前相比,甲醇芽孢杆菌凝乳酶干酪成熟4 周后αs1-酪蛋白条带变窄,β-酪蛋白和κ-酪蛋白条带消失,说明蛋白质降解程度较大;混合酶干酪中β-酪蛋白条带消失,αs1-酪蛋白和κ-酪蛋白条带变窄,说明蛋白质也发生了降解;而对照组各蛋白条带无明显变化。结果表明,实验组干酪中添加的甲醇芽孢杆菌凝乳酶导致其蛋白水解程度均高于对照组。蛋白质降解会生成肽类和氨基酸,过度的降解可能伴随有苦味肽的生成,影响干酪口感[24]。
2.4.3 游离氨基酸的分析结果
表3 干酪在成熟期的游离氨基酸组成
Table 3 Free amino acid composition of cheeses during ripening

注:—.未检出;表4同。
丝氨酸 105.09 1.068 1 1.397 8 0.926 6 1.213 7 0.943 6 1.280 5甘氨酸 75.07 0.571 1 0.644 2 0.453 2 0.552 4 0.491 7 0.722 1组氨酸 155.15 0.580 5 0.590 8 0.683 0 0.665 6 0.662 3 0.883 5苏氨酸 119.13 0.729 4 0.699 6 0.788 7 0.817 8 0.807 7 0.960 7谷氨酸 147.13 4.024 7 4.542 6 4.461 6 4.892 1 4.575 0 4.094 2谷氨酰胺 146.15 — — — — — —天冬氨酸 133.10 1.305 9 1.790 2 1.665 3 1.870 2 1.444 9 2.199 7天冬酰胺 132.12 — — — — — —丙氨酸 89.09 0.675 9 0.703 3 0.473 2 0.702 3 0.654 0 0.625 7精氨酸 174.20 0.974 3 1.173 9 0.954 8 1.197 7 0.746 8 1.414 7脯氨酸 115.14 1.230 6 1.318 0 1.194 8 1.432 6 1.430 0 1.941 2半胱氨酸 121.16 0.137 5 0.145 6 0.137 3 0.135 2 0.131 5 0.133 9赖氨酸 146.19 2.052 5 2.082 5 1.923 9 2.101 1 1.869 4 2.194 7甲硫氨酸 149.20 0.738 4 0.733 6 0.455 3 0.684 9 0.621 8 0.786 3缬氨酸 117.15 1.093 7 1.016 4 0.928 0 1.198 7 1.072 3 1.200 3酪氨酸 181.19 1.221 0 1.348 6 1.278 6 1.354 6 1.555 1 1.660 2异亮氨酸 131.18 0.894 7 0.921 9 0.700 8 0.832 9 0.777 2 0.983 8亮氨酸 131.17 1.443 6 1.501 0 1.280 3 1.575 7 1.592 9 1.812 5苯丙氨酸 165.19 1.437 4 1.516 8 0.902 9 1.141 0 1.226 4 1.597 3色氨酸 204.23 — — — — — —磷酸丝胺酸 185.07 0.009 3 0.022 6 0.005 8 0.025 0 0.004 5 0.014 3磷酸乙醇胺 141.06 — — — — — 0.001 9牛磺酸 125.25 — 0.000 5 — 0.000 2 0.000 2 0.000 1羟基脯氨酸 131.13 0.000 1 0.000 1 0.000 1 0.000 1 0.000 1 0.000 1乙醇胺 61.08 0.004 2 0.004 9 0.002 6 0.003 6 0.003 1 0.000 3瓜氨酸 175.19 0.022 9 0.027 2 0.013 3 0.025 6 0.017 1 0.029 9同型瓜氨酸 189.20 — — — — — —鸟氨酸 132.16 0.000 9 0.002 7 0.000 9 0.001 2 0.000 8 0.001 8精氨基琥珀酸 290.27 — — — — — —肌氨酸 89.09 — — — — — —β-丙氨酸 89.09 0.000 3 0.000 3 0.000 2 0.000 3 0.000 3 0.000 3肌肽226.23— — — — — —鹅肌肽 303.27 — — — — — —α氨基已二酸 161.16 — — — — — —γ-氨基丁酸 103.12 — — — — — —3-氨基异丁酸 103.12 — — — — — 0.000 2 2-氨基异丁酸 103.12 — — — — — —2-氨基正丁酸 103.12 0.000 4 0.000 5 0.000 4 0.000 5 0.000 4 0.000 4 5-羟基赖氨酸 162.20 — — — — — —5-氨基戊酸 117.15 0.000 2 0.000 3 0.000 1 0.000 2 0.000 2 0.000 2 6-氨基已酸 131.17 — — — — — —同型半胱氨酸 135.18 — — — — — —胱硫醚 222.26 — — — — — —5-羟色胺 176.20 — — — — — —5-羟色氨酸 220.22 — — — — — —犬尿氨酸 208.10 0.000 8 0.000 7 0.000 6 0.000 8 0.000 5 0.000 6 3-甲基组氨酸 169.18 — 0.001 3 — — — —同型精氨酸 188.20 — — — — — —同型脯氨酸 129.16 — — — — — —同型丝氨酸 119.10 — — — — — —总计 20.218 2 22.187 8 19.232 1 22.429 6 20.229 9 24.544 4
游离氨基酸是由干酪在成熟过程中残存的凝乳酶水解生成的,是蛋白质深度水解的标志,可作为产生风味的前体物质[25],表3是添加不同凝乳酶的干酪在成熟过程中游离氨基酸含量的变化情况。实验组甲醇芽孢杆菌凝乳酶干酪中蛋白水解作用强,成熟4 周后甘氨酸、组氨酸、丝氨酸、苏氨酸、精氨酸和脯氨酸质量分数均高于对照组和混合酶干酪,且水解形成了特有的磷酸乙醇胺和氨基异丁酸。干酪成熟过程还伴随着菌体的死亡和自溶,使得肽酶活力增强[26],说明甲醇芽孢杆菌凝乳酶干酪比混合酶干酪和对照组干酪具有更强的肽酶活力。有研究表明,游离氨基酸有助于干酪形成独特的风味,对干酪的滋味和香味都有促进作用[27]。
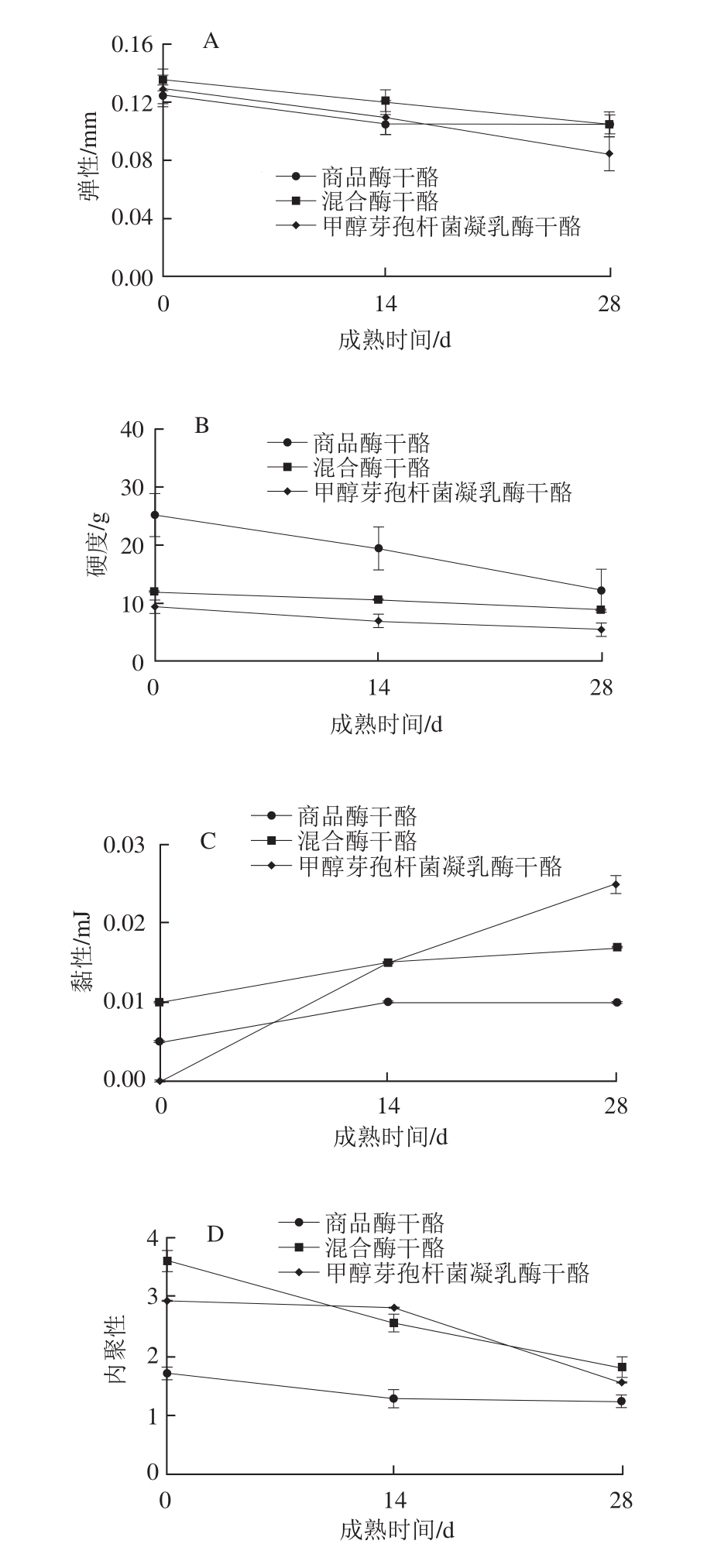
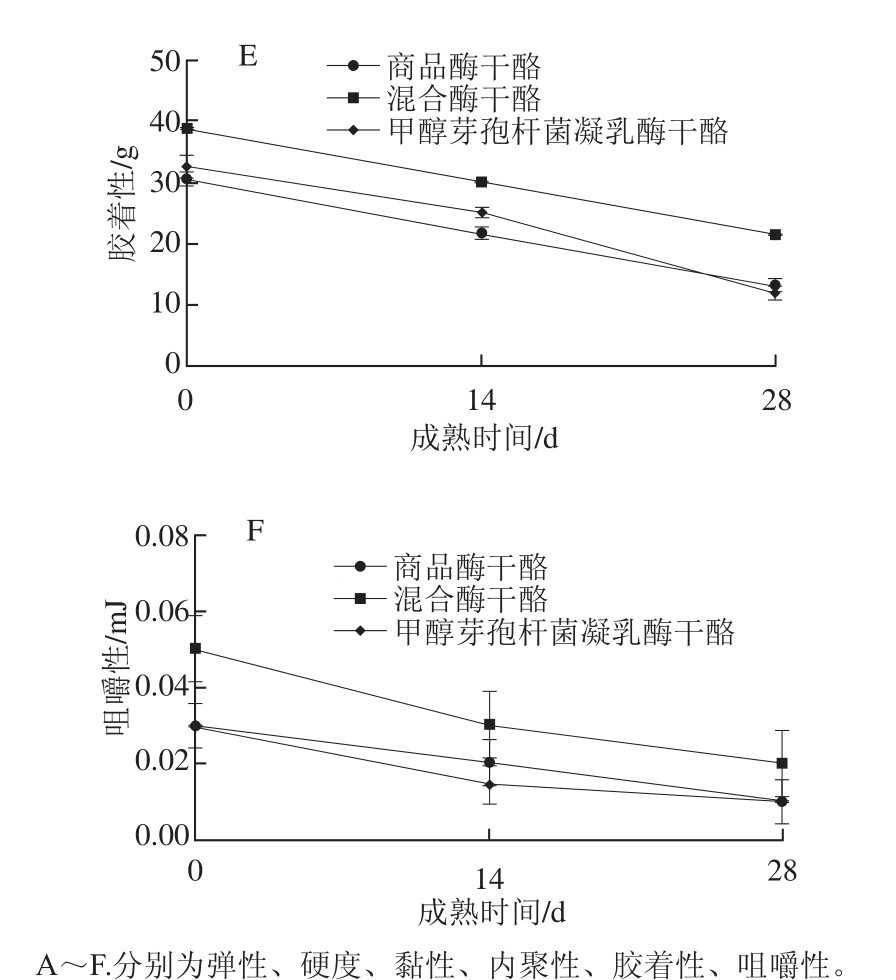
图5 干酪成熟后的质构特性分析
Fig. 5 Texture analysis of ripened cheeses
有研究报道,αs1-酪蛋白的分解是引起干酪的组织结构和质构不同的主要原因[28],图5A显示,3 组干酪弹性随着干酪的成熟均表现出下降趋势。干酪成熟后期甲醇芽孢杆菌凝乳酶干酪的弹性最低,其原因可能是由于甲醇芽孢杆菌凝乳酶的蛋白水解作用,使其与对照组和混合酶干酪相比形成较软的质地,从而导致干酪的硬度下降(图5B)、黏性增加(图5C)。内聚性(图5D)是干酪弹性的表现形式,胶着性(图5E)是干酪黏性的表现形式。新鲜干酪蛋白链完整,三维空间网络上高度交联的蛋白分子表现出较高的抗变形性[2],因此其内聚性和胶着性较高;随着干酪的不断成熟,酪蛋白网络结构逐渐塌陷,抗变形性下降,使得内聚性和胶着性降低。咀嚼性(图5F)与硬度呈正相关关系[29],因而变化趋势也和硬度相似。随着干酪的成熟,其蛋白网络结构被破坏,使其形成质地易碎的结构,咀嚼性下降。甲醇芽孢杆菌凝乳酶干酪中微生物凝乳酶的高蛋白水解活性使其保形性下降,表现为硬度低、黏性大、咀嚼性较差,而混合酶干酪质构特性与对照组相似。
干酪成熟前期,在发酵剂中的微生物和残存凝乳酶的共同作用下,蛋白结构形成大小不均一的孔洞,以一个类似海绵的相对松散的结构分布在干酪体系中[30];随着成熟期的延长,酪蛋白网络结构逐渐塌陷,孔洞被蛋白和脂肪的水解产物所填充,随着水分的蒸发,较大的孔洞慢慢消失,凝胶结构变得连续而紧密[31]。从图6中可以看出,实验组甲醇芽孢杆菌凝乳酶干酪在成熟过程中的蛋白水解使得干酪结构完全降解,脂肪球聚集体积较大,孔洞由水分和脂肪球填充,失去了干酪应有的结构特性。混合酶干酪的微观结构随着成熟过程逐渐变得紧实,孔洞变小,说明混合酶的蛋白水解作用没有破坏干酪应有的微观结构。

图6 干酪成熟过程中的微观结构变化(×50)
Fig. 6 Microstructure changes of cheeses during ripening (× 50)
表4 干酪成熟后挥发性风味物质相对含量
Table 4 Relative contents of volatile flavor compounds identified in ripened cheeses
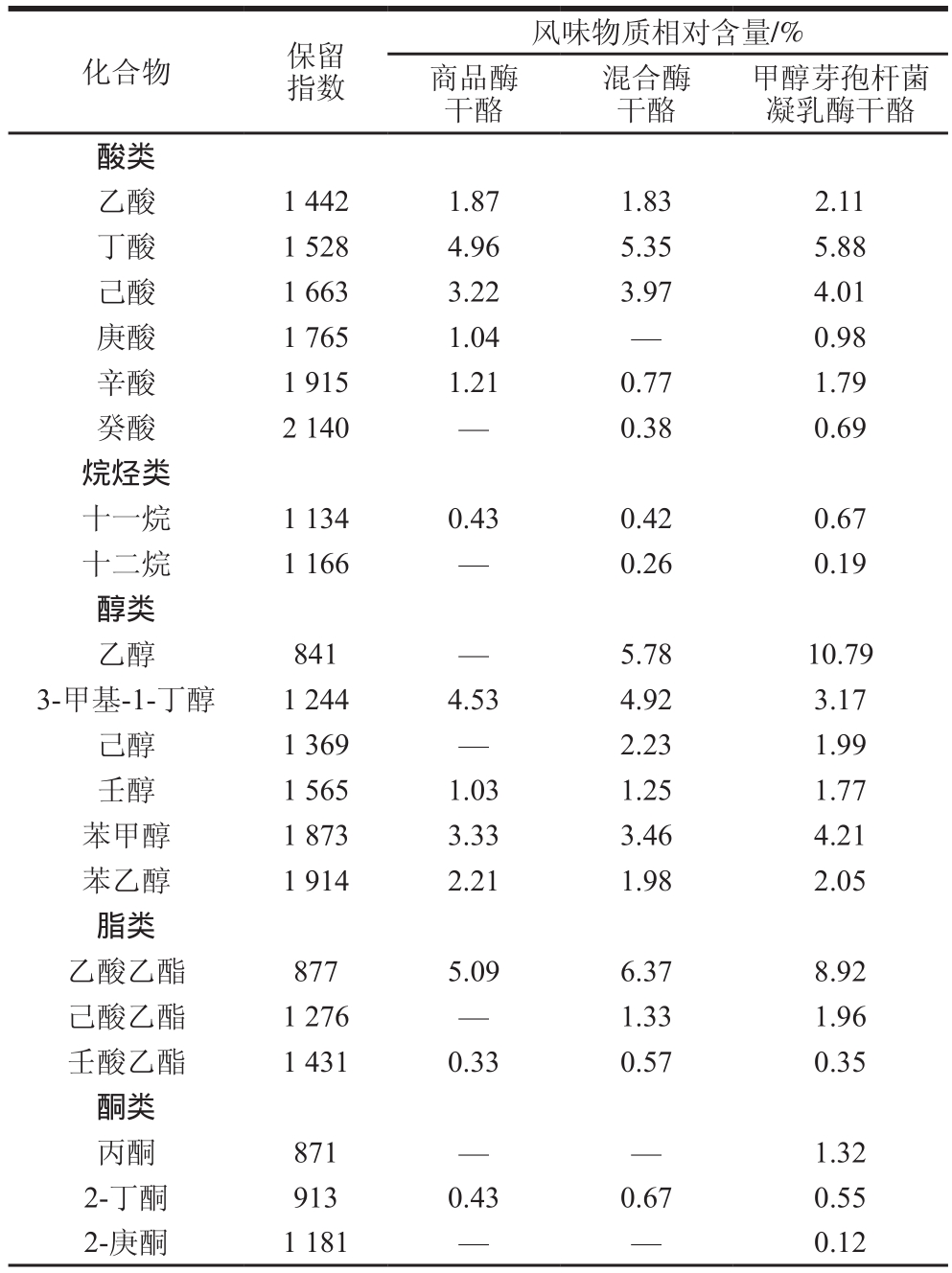
化合物 保留指数风味物质相对含量/%商品酶干酪混合酶干酪甲醇芽孢杆菌凝乳酶干酪酸类乙酸 1 442 1.87 1.83 2.11丁酸 1 528 4.96 5.35 5.88己酸 1 663 3.22 3.97 4.01庚酸 1 765 1.04 — 0.98辛酸 1 915 1.21 0.77 1.79癸酸 2 140 — 0.38 0.69烷烃类十一烷 1 134 0.43 0.42 0.67十二烷 1 166 — 0.26 0.19醇类乙醇 841 — 5.78 10.79 3-甲基-1-丁醇 1 244 4.53 4.92 3.17己醇 1 369 — 2.23 1.99壬醇 1 565 1.03 1.25 1.77苯甲醇 1 873 3.33 3.46 4.21苯乙醇 1 914 2.21 1.98 2.05脂类乙酸乙酯 877 5.09 6.37 8.92己酸乙酯 1 276 — 1.33 1.96壬酸乙酯 1 431 0.33 0.57 0.35酮类丙酮 871 — — 1.32 2-丁酮 913 0.43 0.67 0.55 2-庚酮 1 181 — — 0.12
续表4
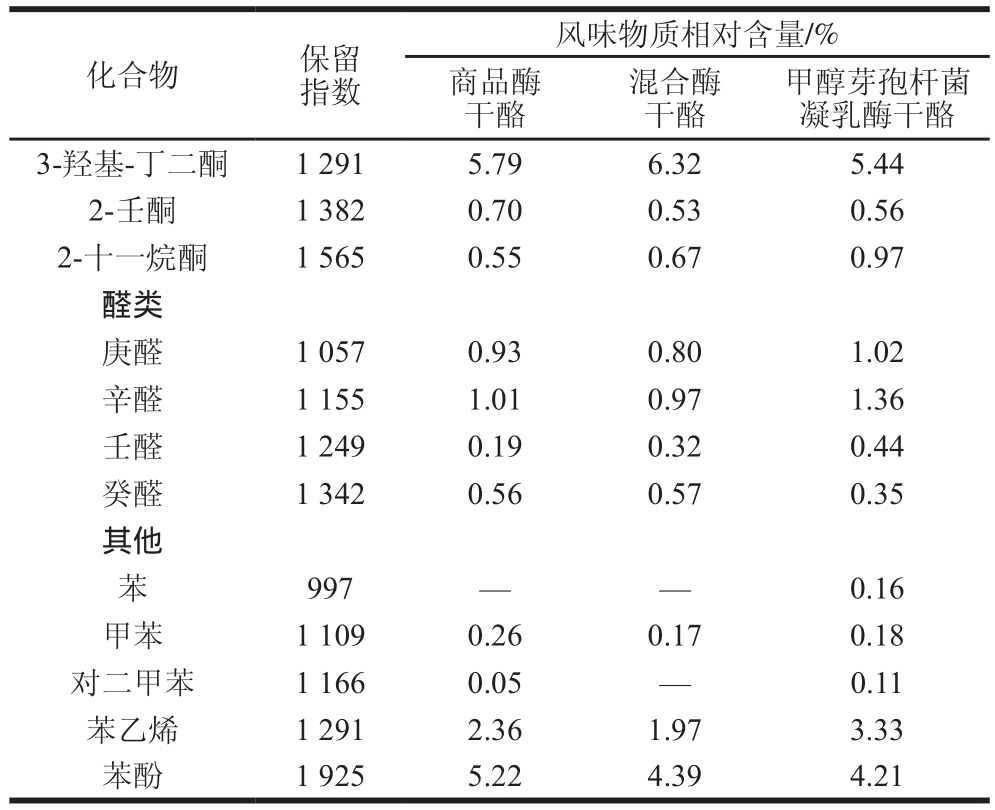
化合物 保留指数风味物质相对含量/%商品酶干酪混合酶干酪甲醇芽孢杆菌凝乳酶干酪3-羟基-丁二酮 1 291 5.79 6.32 5.44 2-壬酮 1 382 0.70 0.53 0.56 2-十一烷酮 1 565 0.55 0.67 0.97醛类庚醛 1 057 0.93 0.80 1.02辛醛 1 155 1.01 0.97 1.36壬醛 1 249 0.19 0.32 0.44癸醛 1 342 0.56 0.57 0.35其他苯997— — 0.16甲苯 1 109 0.26 0.17 0.18对二甲苯 1 166 0.05 — 0.11苯乙烯 1 291 2.36 1.97 3.33苯酚 1 925 5.22 4.39 4.21
由表4可知,添加不同凝乳酶的马苏里拉干酪在成熟过程中共产生了32 种风味物质,包括烷烃类2 种、酸类6 种、酮类6 种、醛类4 种、醇类6 种、脂类3 种、其他化合物5 种,其中相对含量较高的是酸类、醇类和脂类化合物,这与前人关于马苏里拉干酪中风味物质的研究结果[32]吻合。甲醇芽孢杆菌凝乳酶干酪和混合酶干酪在成熟过程中比对照组干酪多生成了癸酸、十二烷、己酸乙酯等风味物质,且其他风味物质含量也普遍高于对照组,这与甲醇芽孢杆菌凝乳酶具有高蛋白水解活性的研究结果一致。甲醇芽孢杆菌凝乳酶蛋白水解活力高,使实验组干酪成熟后pH 4.6时可溶性蛋白水解程度、游离氨基酸种类和风味物质相对含量等与水解活性相关的指标均高于对照组,说明高水解活力促进了干酪风味的形成,成熟后实验组干酪的风味和口感要好于对照组,在不生成苦味肽和干酪结构保持完整的前提下,这是甲醇芽孢杆菌凝乳酶代替或部分代替商品酶制作干酪的优势。
表5 干酪的感官评定结果
Table 5 Sensory evaluation results of cheese
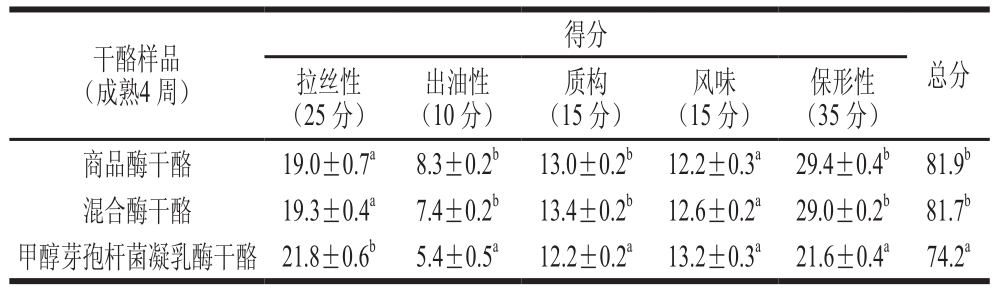
注:同列肩标小写字母不同表示差异显著(P<0.05)。
干酪样品(成熟4 周)得分总分拉丝性(25 分)出油性(10 分)质构(15 分)风味(15 分)保形性(35 分)商品酶干酪 19.0±0.7a 8.3±0.2b 13.0±0.2b 12.2±0.3a 29.4±0.4b 81.9b混合酶干酪 19.3±0.4a 7.4±0.2b 13.4±0.2b 12.6±0.2a 29.0±0.2b 81.7b甲醇芽孢杆菌凝乳酶干酪 21.8±0.6b 5.4±0.5a 12.2±0.2a 13.2±0.3a 21.6±0.4a 74.2a
如表5所示,混合酶干酪各评定指标得分及总分与对照组相比差异不显著(P>0.05),但甲醇芽孢杆菌凝乳酶干酪除风味与其他两组干酪无显著差异外,其余指标均有显著差异,且得分及总分均低于对照组。总体来看,甲醇芽孢杆菌凝乳酶能作为商品酶的部分代替品应用于马苏里拉干酪的生产。
通过与对照组干酪相比,对甲醇芽孢杆菌凝乳酶干酪和混合酶干酪成熟过程中的蛋白水解特性、质构、微观结构和风味的分析发现,甲醇芽孢杆菌凝乳酶干酪中因存在的甲醇芽孢杆菌凝乳酶具有高蛋白水解活性,虽然水解生成的肽段和氨基酸赋予了干酪更多的风味物质,但由此导致干酪结构塌陷、保形性差,与对照组干酪整体评分差异显著(P<0.05)。而混合酶干酪中存在的部分甲醇芽孢杆菌凝乳酶的蛋白水解不仅形成了丰富的风味物质,所制成干酪的质构、微观结构和整体评分与对照组也无显著差异(P>0.05)。综上所述,甲醇芽孢杆菌凝乳酶可以部分代替商品凝乳酶应用于干酪的生产中。
[1] 罗洁, 任发政, 王紫薇, 等. 干酪质构与风味控制技术研究进展[J]. 农业机械学报, 2016, 47(1): 190-201; 208. DOI:10.6041/j.issn.1000-1298.2016.01.025.
[2] NGUYEN H, ONG L, LOPEZ C, et al. Microstructure and physicochemical properties reveal differences between high moisture buffalo and bovine Mozzarella cheeses[J]. Food Research International, 2017, 102: 458-467. DOI:10.1016/j.foodres.2017.09.032.
[3] BERTA M, MUSKENS E, SCHUSTER E, et al. Rheology of natural and imitation Mozzarella cheese at conditions relevant to pizza baking[J]. International Dairy Journal, 2016, 57: 34-38. DOI:10.1016/j.idairyj.2016.02.038.
[4] MCSWEENEY P L H. Biochemistry of cheese ripening[J].International Journal of Dairy Technology, 2010, 57(2/3): 127-144.DOI:10.1016/b978-0-12-374407-4.00080-7.
[5] 腾军伟, 赵笑, 杨亚威, 等. 酒曲中产凝乳酶微生物菌株的分离筛选及鉴定[J]. 食品科学, 2017, 38(16): 23-28. DOI:10.7506/spkx1002-6630-201716004.
[6] HE X L, ZHANG W B, REN F Z, et al. Screening fermentation parameters of the milk-clotting enzyme produced by newly isolated Bacillus amyloliquefaciens D4 from the Tibetan Plateau in China[J].Annals of Microbiology, 2012, 62(1): 357-365. DOI:10.1007/s13213-011-0270-1.
[7] NARWAL R K, BHUSHAN B, PAL A, et al. Optimization of upstream process parameters for enhanced production of thermostable milk clotting enzyme from Bacillus subtilis MTCC 10422[J]. Journal of Food Process Engineering, 2016, 40(2): 1-11. DOI:10.1111/jfpe.12356.
[8] 高维东, 甘伯中, 丁福军, 等. 微生物凝乳酶的研究进展[J].中国乳品工业, 2009, 37(5): 34-36; 47. DOI:10.3969/j.issn.1001-2230.2009.05.010.
[9] DING Z Y, WANG B F, OUYANG A, et al. Production and characterization of milk-clotting enzyme from Bacillus amyloliquefaciens JNU002 by submerged fermentation[J]. European Food Research and Technology, 2012, 234(3): 415-421. DOI:10.1007/s00217-011-1650-2.
[10] AHMED S A, WEHAIDY H R, IBRAHIM O A, et al. Novel milkclotting enzyme from Bacillus stearothermophilus as a coagulant in UF-white soft cheese[J]. Biocatalysis & Agricultural Biotechnology,2016, 7: 241-249. DOI:10.1016/j.bcab.2016.06.011.
[11] 郑远荣, 刘振民, 莫蓓红, 等. 切达奶酪成熟过程中微观结构变化及其对质构的影响[J]. 中国农业科学, 2012, 45(3): 503-508.DOI:10.3864/j.issn.0578-1752.2012.03.012.
[12] 李柳, 郑喆, 赵笑, 等. 黄酒麦曲中产凝乳酶菌株的分离鉴定[J]. 中国乳品工业, 2017, 45(11): 4-10; 18. DOI:10.3969/j.issn.1001-2230.2017.11.001.
[13] 小文. 《乳制品感官质量评鉴细则》正式发布[J]. 食品科学, 2005,31(1): 210. DOI:10.3321/j.issn:0253-990X.2005.03.040.
[14] JANA A H, TAGALPALLEWAR G P. Functional properties of Mozzarella cheese for its end use application[J]. Journal of Food Science & Technology, 2017, 54(12): 3766-3778. DOI:10.1007/s13197-017-2886-z.
[15] 郝晓娜, 张健, 杨亚威, 等. 益生性植物乳杆菌对切达干酪挥发性风味形成的影响[J]. 食品科学, 2018, 39(4): 49-58. DOI:10.7506/spkx1002-6630-201804009.
[16] VOIGT D D, CHEVALIER F, QIAN M C, et al. Effect of highpressure treatment on microbiology, proteolysis, lipolysis and levels of flavour compounds in mature blue-veined cheese[J]. Innovative Food Science and Emerging Technologies, 2010, 11(1): 68-77. DOI:10.1016/j.ifset.2009.10.009.
[17] 梅俊. 西藏开菲尔干酪的风味变化及可食膜包装研究[D]. 上海: 上海交通大学, 2015: 1-129.
[18] 陈俊亮, 田芬, 霍贵成, 等. 乳酸乳球菌对切达干酪成熟过程中质构和风味的影响[J]. 食品科学, 2013, 34(21): 163-167. DOI:10.7506/spkx1002-6630-201321034.
[19] FORTIN M H, CHAMPAGNE C P, ST-GELAIS D, et al. Effect of time of inoculation, starter addition, oxygen level and salting on the viability of probiotic cultures during Cheddar cheese production[J].International Dairy Journal, 2011, 21(2): 75-82. DOI:10.1016/j.idairyj.2010.09.007.
[20] VINDEROLA G, PROSELLO W, MOLINARI F, et al. Growth of Lactobacillus paracasei A13 in Argentinian probiotic cheese and its impact on the characteristics of the product[J]. International Journal of Food Microbiology, 2009, 135(2): 171-174. DOI:10.1016/j.ijfoodmicro.2009.08.021.
[21] SULEJMANI E, HAYALOGLU A A. Influence of curd heating on proteolysis and volatiles of Kashkaval cheese[J]. Food Chemistry,2016, 211: 160-170. DOI:10.1016/j.foodchem.2016.05.054.
[22] 刘坚, 牟光庆. 奶酪风味物质形成机理的研究[J]. 食品研究与开发,2007, 28(11): 158-161. DOI:10.3969/j.issn.1005-6521.2007.11.049.
[23] GARCÍA V, ROVIRA S, BOUTOIAL K, et al. Physicochemical,microbiological, textural and sensory changes during the ripening of pasteurised goat milk cheese made with plant coagulant[J].International Journal of Dairy Technology, 2016, 69(1): 96-102.DOI:10.1111/1471-0307.12225.
[24] 徐辉艳. 木瓜蛋白酶对Mozzarella干酪成熟过程中蛋白降解及微观结构的影响[J]. 应用化工, 2017, 46(5): 1020-1023. DOI:10.16581/j.cnki.issn1671-3206.2017.05.045.
[25] RADELJEVI B, NATA M, ANTUNAC N, et al. Influence of starter culture on total free aminoacids concentration during ripening of Krk cheese[J]. Mljekarstvo, 2013, 63(1): 533-538. DOI:10.7205/MILMED-D-14-00212.
[26] BERESFORD T, WILLIAMS A. The microbiology of cheese ripening[J]. Cheese Chemistry Physics & Microbiology, 2004, 1(4):287-317. DOI:10.1016/S1874-558X(04)80071-X.
[27] BØRSTING M W, QVIST K B, RASMUSSEN M, et al. Impact of selected coagulants and starters on primary proteolysis and amino acid release related to bitterness and structure of reduced-fat Cheddar cheese[J]. Dairy Science and Technology, 2012, 92(5): 593-612.DOI:10.1007/s13594-012-0080-7.
[28] O MAHONY J A, LUCEY J A, MCSWEENEY P L H. Chymosinmediated proteolysis, calcium solubilization, and texture development during the ripening of Cheddar cheese[J]. Journal of Dairy Science,2005, 88(9): 3101-3114. DOI:10.3168/jds.S0022-0302(05)72992-1.
[29] ZHENG Y R, LIU Z M, BEI-HONG M O, et al. Effects of microstructure change on the texture of Cheddar cheese during ripening[J]. Scientia Agricultura Sinica, 2012, 45(3): 503-508.
[30] OLUK A C, GÜVEN M, HAYALOGLU A A. Proteolysis texture and microstructure of low-fat Tulum cheese affected by exopolysaccharideproducing cultures during ripening[J]. International Journal of Food Science & Technology, 2014, 49(2): 435-443. DOI:10.1111/ijfs.12320.
[31] 陈臣, 段建平. 原辅料对再制马苏里拉干酪品质特性的影响[J].食品科学, 2017, 38(1): 182-187. DOI:10.7506/spkx1002-6630-201701030.
[32] ANDERSEN L, ANDERSEN L T. Flavour compounds and sensory characteristics of cheese powders made from matured cheeses[J].International Dairy Journal, 2013, 30(1): 19-28. DOI:10.1016/j.idairyj.2012.11.002.
Effect of Milk Clotting Enzyme from Bacillus methanolicus on the Processing Properties of Mozzarella Cheese
李柳, 郑喆, 赵笑, 等. 甲醇芽孢杆菌凝乳酶对马苏里拉干酪加工特性的影响[J]. 食品科学, 2019, 40(11): 14-22.DOI:10.7506/spkx1002-6630-20180507-089. http://www.spkx.net.cn
LI Liu, ZHENG Zhe, ZHAO Xiao, et al. Effect of milk clotting enzyme from Bacillus methanolicus on the processing properties of Mozzarella cheese[J]. Food Science, 2019, 40(11): 14-22. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180507-089. http://www.spkx.net.cn