酿酒葡萄新品系‘黑珍珠’果实品质分析
彭文婷1,2,王雯染1,2,杨航宇1,2,陈为凯1,2,杨 哲1,2,何 非1,2,王 军1,2,*
(1.中国农业大学食品科学与营养工程学院,葡萄与葡萄酒研究中心,北京 100083;2.农业农村部葡萄酒加工重点实验室,北京 100083)
摘 要:为了研究‘黑珍珠’葡萄果实的酿酒特性,探究其亲本信息,分别利用高效液相色谱-质谱(high performance liquid chromatography-mass spectrometry,HPLC-MS)和气相色谱-质谱(gas chromatography-mass spectrometer,GC-MS)技术分析了‘黑珍珠’葡萄果实的花色苷和香气化合物的组成及含量。HPLC-MS分析结果表明,‘黑珍珠’葡萄果皮中花色苷总量为2 774.76 mg/kg mf,以花色素双葡萄糖苷为主(71.2%),推测其含有非欧亚种葡萄的血缘。GC-MS分析结果表明,‘黑珍珠’葡萄果实香气化合物以游离态与糖苷结合态形式存在,共检测到123 种化合物。简单序列重复分析结果表明,在供试品种(‘贝达’、‘烟73’和‘Kolor’)中未发现‘黑珍珠’的亲本。由于‘黑珍珠’果皮花色苷的种类与含量丰富,且其单品种葡萄酒颜色深,未来可以作为酿造具有地区特色红葡萄酒的新品种或调色新品种。
关键词:酿酒葡萄‘黑珍珠’;花色苷;挥发性香气物质;简单序列重复标记
‘黑珍珠’(Pearl Noir,暂定名)是杜喜山在2008年于‘贝达’砧木园中发现的植物学性状明显区别于‘贝达’的葡萄新品系(代号为DXS-08),其亲本信息未知。该品系早熟、抗病性强,其单品种葡萄酒颜色深。
酿酒葡萄果实的品质(包括浆果质量、体积、糖和酸的质量分数等)在很大程度上决定了葡萄酒的质量。而酚类物质与葡萄酒的色泽、澄清度、风味直接相关,花色苷作为葡萄果实中普遍存在的类黄酮化合物之一,能够为葡萄及葡萄酒提供轻微的涩味,而且还能与一些香气化合物相互作用。花色苷由具有C6-C3-C6骨架的类黄酮花色素和糖配体组成[1],其中B环上R1和R2的取代基不同,则所形成的花色素不同,各类花色苷会呈现不同色调,这对葡萄和葡萄酒的颜色起到至关重要的作用[2]。比较常见的花色素有花葵素、花青素、花翠素、甲基花青素、甲基花翠素和二甲基花翠素。研究发现,欧亚种葡萄(Vitis vinifera)一般都只含有单糖苷化的花青素、花翠素、甲基花青素、甲基花翠素和二甲基花翠素的3-葡萄糖苷、3-乙酰化葡萄糖苷、3-p-香豆酰葡萄糖苷和3-p-咖啡酰化葡萄糖苷衍生物,其中二甲基花翠素类花色苷含量较高,一般不含有花葵素类花色苷[3]。葡萄果实作为葡萄酒香气的重要来源之一,对葡萄酒的品种典型性和产地风格起决定性作用。在葡萄果实中,香气物质以游离态和糖苷结合态两种形式存在。游离态的香气物质能挥发从而被人感知,对构成葡萄果实和葡萄酒香气有重要的作用;而糖苷结合态香气物质是没有气味、不挥发的香气前体物,但在葡萄酒的酿造过程中能经过酶促或非酶促反应将其变成相应的游离态物质进而影响葡萄酒的香气[4]。简单序列重复(simple sequence repeats,SSR)由于具有含量丰富、多态性高、共显性遗传、技术操作简单等特点,被广泛应用于葡萄品种的鉴定、亲缘关系及起源分析和遗传图谱的构建中。SSR广泛分布于整个植物基因组内,表现出丰富的多态性,且亲缘关系越近,SSR片段长度差异越小,因此SSR标记可应用于亲缘关系分析。
为了研究‘黑珍珠’葡萄果实的酿酒特性,探究其亲本信息,本实验利用高效液相色谱-质谱联用(high performance liquid chromatography-mass spectrometry,HPLC-MS)和气相色谱-质谱联用(gas chromatographymass spectrometer,GC-MS)技术分析‘黑珍珠’葡萄果实的果皮花色苷和香气化合物的组成及含量,并利用SSR标记分析其遗传信息,以期为‘黑珍珠’作为调色品种的进一步开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
‘黑珍珠’葡萄果实于2015年采自北京市大兴区采育镇‘喜山葡萄合作社’(39°39′ N、116°42′ E),葡萄园栽植密度为2.5 m×1.0 m,叶幕形为改良的垂直叶幕形[5],南北行向,留梢量为12~15 支/延长米(行)。在葡萄采收期,随机采集葡萄果穗的顶端、中间和底部的各2~3 粒浆果,每次重复采集300 粒浆果,重复3 次,装入冰盒运回实验室。运回实验室的葡萄浆果液氮速冻后保存于-40 ℃冰箱中,用于理化指标、花色苷和香气化合物分析。采集5~10 片生长良好的幼叶装入冰盒中运回实验室,液氮速冻后置于-80 ℃冰箱中保存,用于基因组DNA提取。同时,在中国农业大学上庄实验站葡萄资源圃(40°08′ N、116°10′ E)采集‘贝达’、‘Kolor’和‘烟73’的幼叶5~10 片,作为参考品种,用于SSR指纹分析。
氢氧化钠(分析纯)、邻苯二甲酸氢钾(分析纯)北京化工厂;酚酞 天津市科密欧化学试剂有限公司;花色苷标准品、二甲花翠素-3-O-葡萄糖苷 美国Sigma公司;乙腈、甲酸和甲醇(均为色谱纯) 美国Thermo Fisher公司。
1.2 仪器与设备
PAL-1手持糖度计 日本Atago公司;PB-10 pH计德国Sartorius公司;FD-1C-50冷冻干燥机 北京博医康实验仪器有限公司;RE-52AA旋转蒸发器 上海亚荣生化仪器厂;SHK-99-II台式空气恒温摇床 北京北方同正生物技术发展有限公司;GL-20G-Ⅱ离心机 上海安亭科学仪器厂;1100系列配有二极管阵列检测器的LC/MSD Trap-VL HPLC-离子阱MS仪、1200系列LC/MSD Trap-VL HPLC-三重四极杆MS仪、6890 GC仪、5975 MS仪 美国Agilent公司;Prime G02聚合酶链式反应(polymeras chain reaction,PCR)仪 英国Bibby Scientific公司。
1.3 方法
1.3.1 ‘黑珍珠’植物学性状和果实性状观测
根据国际葡萄与葡萄酒组织(International Organisation of Vine and Wine,OIV)标准,对新梢、幼叶、成龄叶和果实的部分性状进行描述[6-7]。取10 片成龄叶分别测量主脉长(即叶长)、叶宽、叶缘锯齿长、叶缘锯齿宽和叶柄长,并计算成龄叶的长宽比和锯齿的长宽比。随机取10 个果穗,分别称量其质量并计算果穗平均质量。取100 粒浆果称质量,解冻24 h后破碎取汁,取上清液用于pH值、可溶性固形物含量以及可滴定酸质量浓度的测定。pH值用pH计测定,果汁可溶性固形物含量用手持糖度仪测定[8],果汁可滴定酸质量浓度用NaOH滴定法测定[9],并以每升葡萄酒中酒石酸质量计。
1.3.2 ‘黑珍珠’葡萄果皮花色苷提取和测定
花色苷提取参照He Jianjun等[10]的方法,准确称取0.499 5~0.500 5 g冷冻干燥后的葡萄果皮粉,加入含体积分数2%甲酸的甲醇溶液10 mL,溶液在室温下避光超声10 min,在摇床萃取30 min(25 ℃下140 r/min避光)后,4 ℃下8 000 r/min离心10 min,将上清液转移至100 mL圆底烧瓶中,以上步骤重复提取5 次后,合并上清液至烧瓶中。上清液于25 ℃下旋转蒸发至干,用花色苷定容剂(体积分数2%(后同)甲酸、10.8%乙腈水溶液)定容至10 mL后,0.22 μm水系膜过滤,用于HPLC-MS检测,每个样品重复提取2 次。花色苷含量根据二甲花翠素标准曲线进行半定量,表示为mg/kg mf。
HPLC-MS条件:使用带有二极管阵列检测器的1100 LC/MSD Trap-VL HPLC-离子阱MS,色谱柱为Kromasil 100-5-C18(250 mm×4.6 mm,5 μm),柱温为50 ℃,进样量为30 μL,检测波长为525 nm,流速为1 mL/min。流动相A:V(水)∶V(甲酸)∶V(乙腈)=92∶2∶6;流动相B:V(水)∶V(甲酸)∶V(乙腈)=44∶2∶54。洗脱程序:0~1 min,0~10% B;1~18 min,10%~25% B;18~20 min,25% B;20~30 min,25%~40% B;30~35 min,40%~70% B;35~40 min,70%~100% B。离子阱MS检测器的采集参数为电喷雾离子源,正离子模式,离子扫描范围为m/z 100~1 500,雾化器压力为207 kPa,干燥气流速为10 L/min,干燥气温度为325 ℃。
1.3.3 ‘黑珍珠’葡萄香气化合物的提取和测定
取保存于低温(-40 ℃)冰箱的葡萄果实50 g,去除果柄和种子,依次加入抑制内源糖苷酶活性的0.5 g D-葡萄糖酸内酯和1 g交联聚乙烯吡咯烷酮(防止氧化),并且破碎至粉末状;在4 ℃条件下静置浸渍 4 h;在4 ℃、12 000 r/min条件下离心10 min,并且收集上层澄清葡萄汁,参照Lan Yibin等[11]的顶空固相微萃取(head space-solid phase microextraction,HS-SPME)条件萃取游离态香气物质。
结合态香气物质的提取参照Lan Yibin等[11]的方法:在活化后的SPME柱中加入2 mL葡萄汁,然后依次加入2 mL能够去除低分子质量糖、酸等极性化合物的水和5 mL去除游离态非极性香味化合物的二氯甲烷,最后糖苷态香气物质用20 mL甲醇溶液洗脱。收集洗脱后的甲醇溶液,在30 ℃真空条件下用旋转蒸发仪蒸干,使用含0.1 g糖苷酶AR2000 的柠檬酸/磷酸氢二钾缓冲液(0.2 mol/L、pH 5)10 mL重新溶解,随后转移至密闭离心管,37 ℃恒温酶解16 h,每个样品重复提取2 次。释放的结合态香气物质经HS-SPME后进样至GC-MS检测。
HS-SPME条件:CTC CombiPAL自动进样器自动萃取样品中香气化合物,自动进样器配备2 cm聚二甲基硅氧烷/碳筛/二乙烯苯萃取头,萃取头使用前先在250 ℃条件下活化60 min。称取1.0 g NaCl放入15 mL进样小瓶,加入5 mL葡萄汁或糖苷水解液和10 µL作为内标的4-甲基-2-戊醇(1.038 8 g/L),迅速将进样小瓶用带有聚四氟乙烯隔垫的盖子密封。样品瓶在加热搅拌设备中在40 ℃条件下加热搅拌30 min,然后将萃取头插入样品瓶顶空部分,40 ℃继续加热搅拌30 min,加热搅拌设备的转速为500 r/min。萃取头在GC进样口(250 ℃)解吸8 min完成进样。
GC-MS条件参考Wu Yuwen等[12]的方法。香气化合物定性采用自动解卷积技术对GC-MS全扫描数据文件进行解卷积分析,根据各物质的保留时间以及C7~C24正构烷烃在相同GC条件下的保留时间计算其相应的保留指数,与标准品保留指数、MS谱图以及NIST Chemical WebBook中收录的极性柱条件下所测保留指数比较,差值绝对值小于50的组分可定性为该化合物。定量方法参考Wu Yuwen等[12]的方法,利用标准品香气物质在模拟葡萄汁溶液中的标准曲线对已有标准品的物质定量;利用化学结构和官能团相似、碳原子数相近的标准品的标准曲线对没有标准品的物质进行半定量。样品及标准曲线均通过相同浓度的4-甲基-2-戊醇作为内标对仪器的响应状态进行校正。香气物质的含量表示为μg/kg mf。
1.3.4 ‘黑珍珠’SSR指纹分析
葡萄叶片样品基因组DNA提取采用王军等[13]改良的十六烷基三甲基溴化铵法。选用6 对(VVS2、VVMD5、VVMD7、VVMD27、Vrzag62、Vrzag79)葡萄种植资源数据库(http://www.vitis-vea.de/)提供的引物用于SSR扩增,引物序列见表1。PCR体系为20 μL,包括2 μL 10×PCR buffer、1 U Taq酶、0.2 mmol/L dNTP、1.5 mmol/L Mg2+、0.4 μmol/L引物、DNA模板50 ng,其余为dd H2O。PCR扩增程序为:94 ℃预变性5 min;94 ℃变性30 s,50~60 ℃退火30 s,72 ℃延伸40 s,35 个循环;72 ℃延伸10 min。相同模板重复扩增两次,以保证结果的准确性。扩增后产物送至苏州金唯智生物科技有限公司进行毛细管电泳,利用Genemapper V3.2软件进行条带分析,确定每个位点的片段长度。
表1 6 对SSR引物序列、退火温度和目标片段长度
Table 1 Six pairs of SSR primer sequence, annealing temperature and target size

引物名称 序列(5’→3’) 退火温度/℃ 目标片段长度/bp VVS2 F:CAGCCCGTAAATGTATCCATC R:AAATTCAAAATTCTAATTCAACTGG 56 121~149 VVMD5 F:CTAGAGCTACGCCAATCCAA R:CTAGAGCTACGCCAATCCAA 54 224~264 VVMD7 F:AGAGTTGCGGAGAACAGGAT R:CGAACCTTCACACGCTTGAT 54 229~263 VVMD27 F:ACGGGTATAGAGCAAACGGTGT R:GTACCAGATCTGAATACATCCGTAAGT 54 172~214 Vrzag62 F:GGTGAAATGGGCACCGAACACACGC R:CCATGTCTCTCCTCAGCTTCTCAGC 54 172~220 Vrzag79 F:AGATTGTGGAGGAGGGAACAAACCG R:TGCCCCCATTTTCAAACTCCCTTCC 54 235~265
1.4 数据处理与分析
实验结果测定3 次,使用Excel 2010、SPSS 19.0和Origin 8.0软件进行数据处理和作图。
2 结果与分析
2.1 ‘黑珍珠’的植物形态学与果实性状
‘黑珍珠’嫩梢为浅绿色,稍尖绒毛着色极浅,幼叶为绿色,上表皮颜色为浅红棕色(图1)。成龄叶为绿色,近五角形,全缘。叶表面有光泽,微具泡状突起,叶背光滑无绒毛。主脉无花青素着色。叶缘锯齿双侧直,叶柄洼半开张,呈V形。叶长11.23 cm、宽13.58 cm、长宽比0.83。锯齿长1.25 cm、宽1.73 cm、长宽比为0.72、叶柄长5.67 cm。‘黑珍珠’果穗上所有浆果成熟度相对一致,果穗紧、呈圆锥形、有歧肩,每新稍果穗数为1.73。浆果呈圆形,果皮为紫黑色(图1)。植株形态学和果实性状描述如表2所示。
表2 ‘黑珍珠’植株形态学和果实性状描述
Table 2 Descriptive morphological and biological traits of‘Pearl Noir’ grapes

OIV编号 性状 描述符1嫩梢:梢尖开张度 5 3嫩梢:梢尖绒毛上花色素着色程度 1 6新稍:姿态 3 17 新稍:卷须长度 3 51 嫩叶:上表皮颜色(第4节位) 4 67 成龄叶:形状 3
续表2
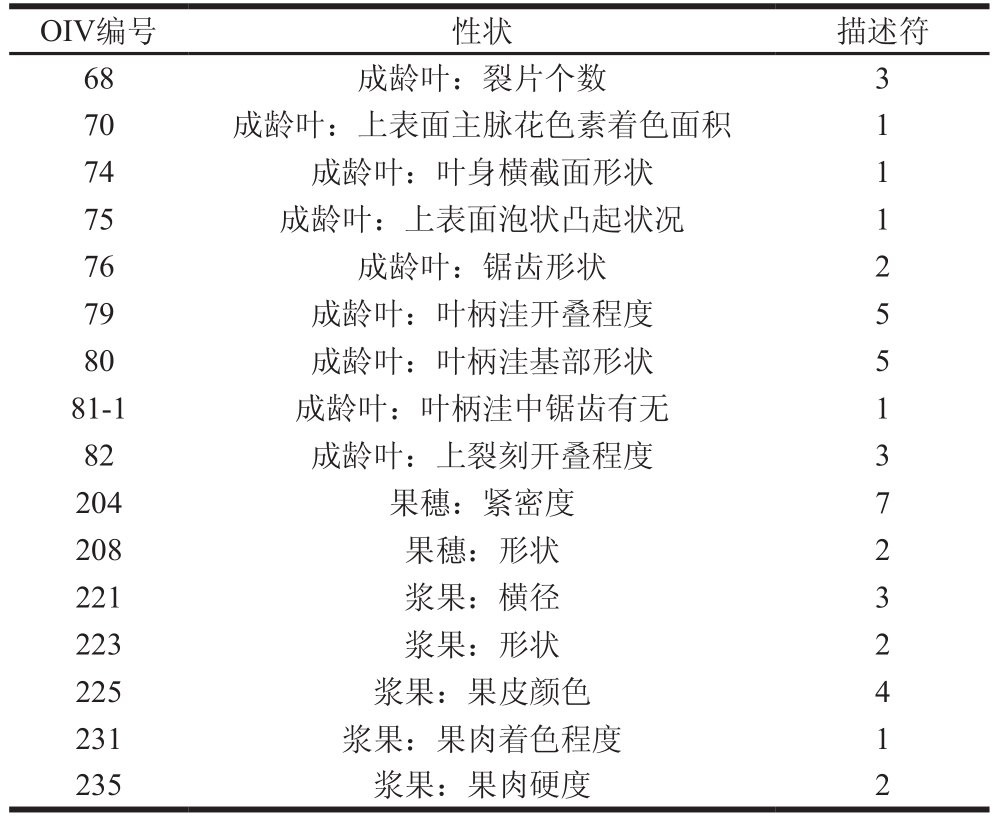
OIV编号 性状 描述符68 成龄叶:裂片个数 3 70 成龄叶:上表面主脉花色素着色面积 1 74 成龄叶:叶身横截面形状 1 75 成龄叶:上表面泡状凸起状况 1 76 成龄叶:锯齿形状 2 79 成龄叶:叶柄洼开叠程度 5 80 成龄叶:叶柄洼基部形状 5 81-1 成龄叶:叶柄洼中锯齿有无 1 82 成龄叶:上裂刻开叠程度 3 204 果穗:紧密度 7 208 果穗:形状 2 221 浆果:横径 3 223 浆果:形状 2 225 浆果:果皮颜色 4 231 浆果:果肉着色程度 1 235 浆果:果肉硬度 2
2.2 ‘黑珍珠’的果实品质分析
酿酒葡萄理化指标是决定葡萄酒品质的关键因素[14],其最适的可溶性固形物含量因酒类型的要求而异,一般为20~25 °Brix[15]。pH值是与酸密切相关的一个指标,成熟期适宜的葡萄其果汁pH值应在3.00~3.60之间[15]。可滴定酸质量浓度能够反映溶液中H+的总量,其在6.5~8.5 g/L被认为是生产协调性好的葡萄酒的最佳质量浓度[16]。‘黑珍珠’葡萄汁的糖酸比为20.10±0.11,葡萄品质较好。‘黑珍珠’葡萄汁的可溶性固形物含量、pH值均在适宜的酿酒葡萄理化指标要求范围内,而可滴定酸质量浓度偏高(表3)。其单品种酒颜色深,同时期颜色明显优于‘美乐’与‘赤霞珠’等酿造的葡萄酒,适合用于颜色较浅葡萄酒的调色[17-18]。
表3 ‘黑珍珠’葡萄果实理化指标
Table 3 Physiochemical parameters of ‘Pearl Noir’ grapes

百粒浆果质量/g总可溶性固形物含量/°BrixpH可滴定酸质量浓度/(g/L)果穗平均质量/g 66.8±1.02 22.07±0.50 3.52±0.01 10.58±0.19 44.58±13.92
2.3 ‘黑珍珠’葡萄果皮中花色苷组成分析
花色苷组成及其含量是评价葡萄品质的一个重要指标[1],而且‘黑珍珠’葡萄果皮颜色较深,花色苷含量较高。在‘黑珍珠’葡萄果皮中共检测到14 种花色苷(表4),其中花色素双葡萄糖苷9 种,分别是二甲花翠素-3,5-双葡萄糖苷、甲基花翠素-3,5-双葡萄糖苷、花翠素-3,5-双葡萄糖苷、花翠素-3-乙酰化葡萄糖苷-5-葡萄糖苷、甲基花青素-3,5-双葡萄糖苷、花翠素-3-香豆酰化葡萄糖苷-5-葡萄糖苷、二甲花翠素-3-乙酰化葡萄糖苷-5-葡萄糖苷、二甲花翠素-3-香豆酰化葡萄糖苷-5-葡萄糖苷、甲基花翠素-3-香豆酰化葡萄糖苷-5-葡萄糖苷。这9 种花色素双葡萄糖苷的含量依次降低。‘黑珍珠’葡萄果皮中检测到5 种花色素单葡萄糖苷,分别是花翠素-3-香豆酰化葡萄糖苷、甲基花翠素-3-葡萄糖苷、二甲花翠素-3-葡萄糖苷、二甲花翠素-3-香豆酰化葡萄糖苷、甲基花翠素-3-香豆酰化葡萄糖苷。‘黑珍珠’葡萄果皮中的14 种花色苷按化学结构可以分为二甲花翠素衍生物(5 种)、花翠素衍生物(3 种)、甲基花翠素衍生物(5 种)、甲基花青素衍生物(1 种),其中不含有花青素衍生物。‘黑珍珠’葡萄的花色苷以二甲花翠素衍生物的含量最高,占花色苷总量的52.7%,其中以二甲花翠素-3,5-双葡萄糖苷的含量最高,其次是甲基花翠素-3-葡萄糖苷。花翠素、甲基花翠素和甲基花青素分别占花色苷总量的17.7%、25.9%、3.6%(图2),而甲基花青素衍生物只以双葡萄糖苷形式存在。
表4 ‘黑珍珠’葡萄果皮花色苷组成和含量
Table 4 Profile and content of anthocyanins in the skin of‘Pearl Noir’ grapes

编号 分子离子(m/z)碎片离子(m/z)保留时间/min 英文名称 中文名称 含量/(mg/kg mf)1 627 303、465 3.1 Delphinidin-3,5-O-bisglucoside 花翠素-3,5-双葡萄糖苷 223.59±15.18 2 641 317、479 4.1 Petunidin-3,5-O-bisglucoside 甲基花翠素-3,5-双葡萄糖苷 379.29±23.72 3 625 301、463 4.3 Peonidin-3,5-O-bisglucoside 甲基花青素-3,5-双葡萄糖苷 101.15±1.80 4 655 331、493 5.4 Malvidin-3,5-O-bisiglucoside 二甲花翠素-3,5-双葡萄糖苷 1 271.26±91.50 5 479 317 6.8 Petunidin-3-O-monoglucoside 甲基花翠素-3-葡萄糖苷 123.55±16.23 6 683 331、521 8.7 Petunidin-3-O-acetylglucoside-5-O-glucoside花翠素-3-乙酰葡萄糖苷-5-葡萄糖苷 187.88±2.10 7 493 331 9.8 Malvidin-3-O-monoglucoside 二甲花翠素-3-葡萄糖苷 114.80±5.00 8 697 331、535 10.5 Malvidin-3-O-acetylglucoside-5-O-glucoside二甲花翠素-3-乙酰葡萄糖苷-5-葡萄糖苷 24.87±25.39 9 773 303、611 12.6 Delphinidin-3-O-coumaroylglucoside-5-O-glucoside花翠素-3-香豆酰葡萄糖苷-5-葡萄糖苷 34.10±36.13 10 787 317、625 17.5 Petunidin-3-O-coumaroylglucoside-5-O-glucoside甲基花翠素-3-香豆酰葡萄糖苷-5-葡萄糖苷 18.28±0.33 11 611 303 18.7 Delphinidin-3-O-coumaroylglucoside 花翠素-3-香豆酰葡萄糖苷 233.71±4.10 12 801 331、639 20.9 Malvidin-3-O-coumaroylglucoside-5-O-glucoside二甲花翠素-3-香豆酰葡萄糖苷-5-葡萄糖苷 18.26±0.53 13 625 317 21.8 Petunidin-3-O-coumaroylglucoside 甲基花翠素-3-香豆酰葡萄糖苷 10.83±0.46 14 639 331 24.6 Malvidin-3-O-coumaroylglucoside 二甲花翠素-3-香豆酰葡萄糖苷 33.17±0.26总花色苷 2 774.76±60.06
研究表明,单糖苷化的花青素、花翠素、甲基花翠素、甲基花青素和二甲花翠素的3-葡萄糖苷衍生物是欧亚种葡萄(Vitis vinifera)常见的花色苷种类[19-24],花色苷的主要成分是二甲花翠素-3-葡萄糖苷。而含有花色素双糖苷是非欧亚种葡萄的重要特征,有报道称非欧亚种葡萄花色苷的主要成分是二甲花翠素-3,5-双葡萄糖苷[25]。典型的非欧亚种葡萄如中国野生葡萄种均含有花色素双糖苷[26],圆叶葡萄(Vitis rotundifolia)既含有花色素单葡萄糖苷也含有双葡萄糖苷,但其种类和含量均较花色素双葡萄糖苷少,少数圆叶葡萄可能不含有单葡萄糖苷[27]。在本研究中,‘黑珍珠’葡萄果皮的花色苷组成均是非欧亚种葡萄中常见的花色苷,主要以双糖苷为主。此外,‘黑珍珠’葡萄果皮花色苷含量明显高于‘赤霞珠’(526.93 mg/kg mf)和‘美乐’(277.33 mg/kg mf)等欧亚种葡萄[28]。因此,推测‘黑珍珠’葡萄含有非欧亚种葡萄的血缘。‘黑珍珠’花色苷含量高,但与‘烟73’和‘紫北塞’等染色葡萄不同[10,29-30],‘黑珍珠’主要以双糖苷为主,而‘烟73’和‘紫北塞’的花色苷主要为单糖苷,仅存在一种双糖苷,故而‘黑珍珠’可能不是染色葡萄。
2.4 ‘黑珍珠’葡萄果实中香气成分分析
‘黑珍珠’葡萄果实中共检测到123 种香气化合物,这些香气化合物根据化学结构可分为C6/C9类(13 种)、醇类(40 种)、羰基化合物(16 种)、酸类(3 种)、挥发酚类(5 种)、酯类(5 种)、降异戊二烯类(12 种)、苯类(14 种)、萜烯(13 种)(表5)。
表5 ‘黑珍珠’葡萄果实中香气物质组成及含量
Table 5 Volatile aroma composition of ‘Pearl Noir’ grapes
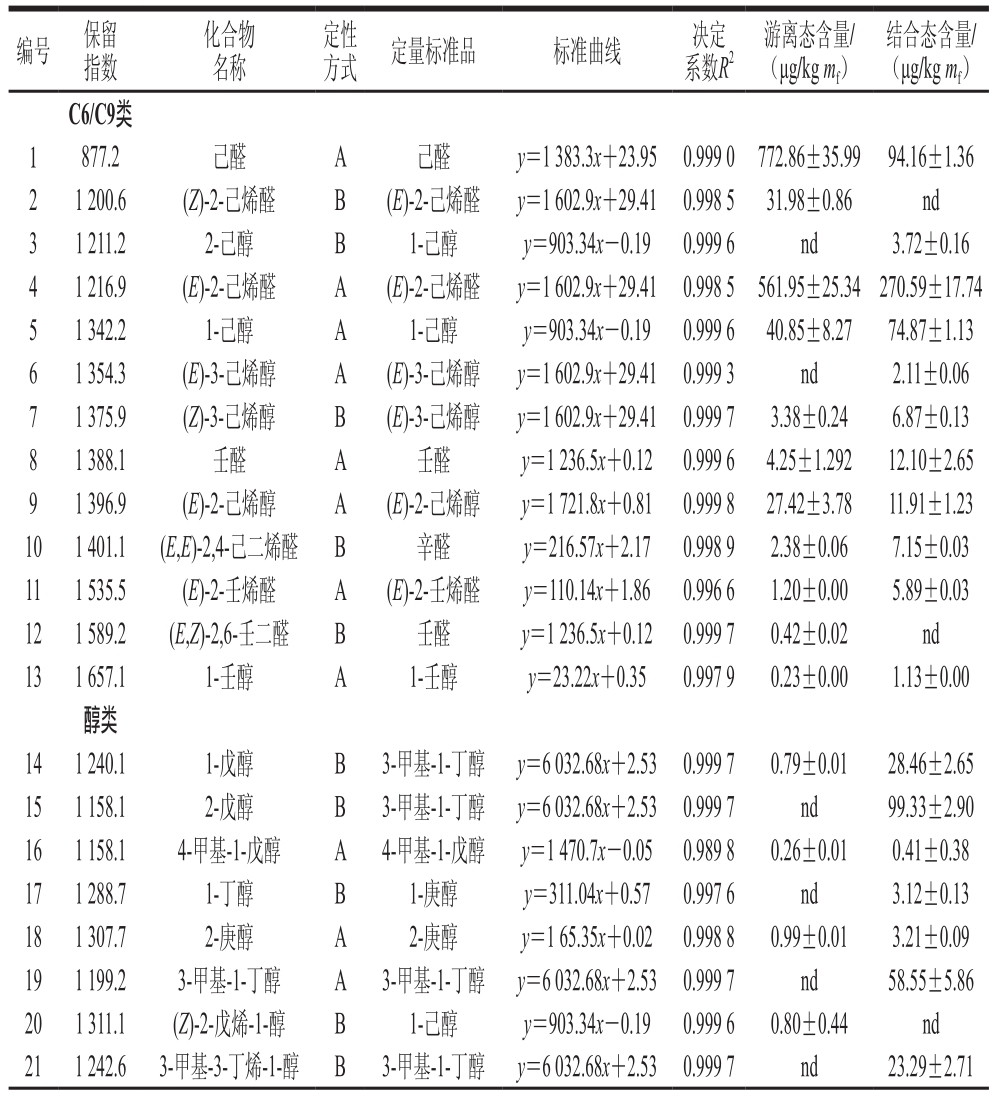
编号 保留指数化合物名称定性方式 定量标准品 标准曲线 决定系数R2游离态含量/(μg/kg mf)结合态含量/(μg/kg mf)C6/C9类1 877.2 己醛 A 己醛 y=1 383.3x+23.95 0.999 0 772.86±35.99 94.16±1.36 2 1 200.6 (Z)-2-己烯醛 B (E)-2-己烯醛 y=1 602.9x+29.41 0.998 5 31.98±0.86 nd 3 1 211.2 2-己醇 B 1-己醇 y=903.34x-0.19 0.999 6 nd 3.72±0.16 4 1 216.9 (E)-2-己烯醛 A (E)-2-己烯醛 y=1 602.9x+29.41 0.998 5 561.95±25.34270.59±17.74 5 1 342.2 1-己醇 A 1-己醇 y=903.34x-0.19 0.999 6 40.85±8.27 74.87±1.13 6 1 354.3 (E)-3-己烯醇 A (E)-3-己烯醇 y=1 602.9x+29.41 0.999 3 nd 2.11±0.06 7 1 375.9 (Z)-3-己烯醇 B (E)-3-己烯醇 y=1 602.9x+29.41 0.999 7 3.38±0.24 6.87±0.13 8 1 388.1 壬醛 A 壬醛 y=1 236.5x+0.12 0.999 6 4.25±1.292 12.10±2.65 9 1 396.9 (E)-2-己烯醇 A (E)-2-己烯醇 y=1 721.8x+0.81 0.999 8 27.42±3.78 11.91±1.23 10 1 401.1 (E,E)-2,4-己二烯醛 B 辛醛 y=216.57x+2.17 0.998 9 2.38±0.06 7.15±0.03 11 1 535.5 (E)-2-壬烯醛 A (E)-2-壬烯醛 y=110.14x+1.86 0.996 6 1.20±0.00 5.89±0.03 12 1 589.2 (E,Z)-2,6-壬二醛 B 壬醛 y=1 236.5x+0.12 0.999 7 0.42±0.02 nd 13 1 657.1 1-壬醇 A 1-壬醇 y=23.22x+0.35 0.997 9 0.23±0.00 1.13±0.00醇类14 1 240.1 1-戊醇 B 3-甲基-1-丁醇 y=6 032.68x+2.53 0.999 7 0.79±0.01 28.46±2.65 15 1 158.1 2-戊醇 B 3-甲基-1-丁醇 y=6 032.68x+2.53 0.999 7 nd 99.33±2.90 16 1 158.1 4-甲基-1-戊醇 A 4-甲基-1-戊醇 y=1 470.7x-0.05 0.989 8 0.26±0.01 0.41±0.38 17 1 288.7 1-丁醇 B 1-庚醇 y=311.04x+0.57 0.997 6 nd 3.12±0.13 18 1 307.7 2-庚醇 A 2-庚醇 y=1 65.35x+0.02 0.998 8 0.99±0.01 3.21±0.09 19 1 199.2 3-甲基-1-丁醇 A 3-甲基-1-丁醇 y=6 032.68x+2.53 0.999 7 nd 58.55±5.86 20 1 311.1 (Z)-2-戊烯-1-醇 B 1-己醇 y=903.34x-0.19 0.999 6 0.80±0.44 nd 21 1 242.6 3-甲基-3-丁烯-1-醇 B 3-甲基-1-丁醇 y=6 032.68x+2.53 0.999 7 nd 23.29±2.71
续表5

编号 保留指数化合物名称定性方式 定量标准品 标准曲线 决定系数R2游离态含量/(μg/kg mf)结合态含量/(μg/kg mf)22 1 312.2 3-甲基-2-丁烯-1-醇 B 3-甲基-1-丁醇 y=6 032.68x+2.53 0.999 7 16.25±3.78 45.5±0.63 23 1 271.1 4-庚醇 B 2-庚醇 y=165.35x+0.02 0.998 8 nd 0.16±0.00 24 1 316.6 3-甲基-1-戊醇 B 1-己醇 y=903.34x-0.19 0.999 6 0.35±0.57 0.44±0.06 25 1 380.3 4-甲基-3-戊烯-1-醇 B 1-己醇 y=903.34x-0.19 0.999 6 0.66±0.04 0.66±0.06 26 1 156.8 2-甲基-1-戊醇 B 4-甲基-1-戊醇 y=1 470.7x-0.05 0.989 8 nd 5.58±0.22 27 1 407.2 2-辛醇 B 1-辛醇 y=23.22x+0.35 0.993 4 1.42±0.00 7.06±0.00 28 1 439.2 1-辛烯-3-醇 A 1-辛烯-3-醇 y=86.83x+0.16 0.995 2 0.55±0.04 1.23±0.03 29 1 445.5 1-庚醇 A 1-庚醇 y=311.04x+0.57 0.997 6 1.12±0.08 4.13±0.06 30 1 481.1 2-乙基-1-己醇 A 2-乙基-1-己醇 y=64.8x+0.11 0.996 7 0.46±0.01 12.6±0.47 31 1 501.3 5-甲基-5-辛烯-2-醇 B 1-辛醇 y=23.22x+0.35 0.993 4 0.66±0.01 2.80±0.22 32 1 337.9 2,6-二甲基-4-庚醇 B 1-庚醇 y=311.04x+0.57 0.997 6 nd 0.22±0.00 33 1 503.3 (E)-2-庚烯-1-醇 B 1-庚醇 y=311.04x+0.57 0.997 6 0.42±0.01 nd 34 1 347.2 4-甲基-2-庚醇 B 1-庚醇 y=311.04x+0.57 0.997 6 nd 11.34±0.25 35 1 361.6 6-甲基-2-庚醇 B 1-庚醇 y=311.04x+0.57 0.997 6 nd 0.47±0.03 36 1 378.1 5-甲基-2-庚醇 B 1-庚醇 y=311.04x+0.57 0.997 6 nd 1.23±0.03 37 1 551.1 1-辛醇 A 1-辛醛 y=125.3x+0.82 0.993 4 0.86±0.03 4.19±0.88 38 1 580.2 (E)-3-辛烯-1-醇 A (E)-3-辛烯-1-醇 y=86.83x+0.16 0.995 2 0.13±0.01 0.63±0.00 39 1 554.6 (Z)-3-辛烯-1-醇 B (E)-3-辛烯-1-醇 y=86.83x+0.16 0.995 2 0.11±0.00 nd 40 1 440.8 (E)-2-辛烯-1-醇 A (E)-2-辛烯-1-醇 y=86.83x+0.16 0.992 0 0.49±0.01 nd 41 1 613.4 (Z)-5-辛烯-1-醇 B (E)-3-辛烯-1-醇 y=86.83x+0.16 0.995 2 0.16±0.01 0.66±0.00 42 1 554.6 (Z)-3-癸烯-1-醇 B 1-癸醇 y=32.3x+1.52 0.992 3 0.96±0.00 nd 43 1 927.9 1-苯乙醇 B 苯乙醇 y=3 526.3x+52.67 0.967 6 34.47±0.08 174.07±1.01 44 1 892.1 苯甲醇 A 苯甲醇 y=7 966.6x+10.3 0.963 1 106.13±5.63 267.32±29.68 45 1 928.0 苯乙醇 A 苯乙醇 y=3 526.3x+52.67 0.967 6 169.99±10.83353.03±26.63 46 1 988.0 4-甲基-苯甲醇 B 苯甲醇 y=7 966.6x+10.3 0.963 1 7.30±0.09 nd 47 1 468.5 3,4-二乙基-3-己醇 B 2-乙基-1-己醇 y=64.8x+0.11 0.996 7 nd 0.66±0.00 48 1 468.3 3-乙基-4-甲基-3-庚醇 B 1-庚醇 y=7 966.6x+10.3 0.997 6 nd 3.34±0.09 49 1 539.0 2,4-二甲基-1庚醇 B 1-庚醇 y=7 966.6x+10.3 0.997 6 nd 2.14±0.06 50 1 762.7 1-癸醇 A 1-癸醇 y=32.3x+1.52 0.992 3 nd 5.10±0.44 51 1 820.2 2-月桂醇 B 1-月桂醇 y=129.08x+4.58 0.962 1 nd 15.22±1.01 52 1 972.1 1-月桂醇 A 1-月桂醇 y=129.08x+4.58 0.962 1 nd 15.98±1.95 53 2 005.3 1-十四醇 B 1-月桂醇 y=129.08x+4.58 0.962 1 nd 14.50±0.03羰基化合物54 1 179.5 庚醛 B 辛醛 y=216.57x+2.17 0.998 9 1.63±0.01 6.96±0.06 55 1 201.9 4-甲基-2-庚酮 B 辛醛 y=216.57x+2.17 0.998 9 nd 8.79±0.69 56 1 285.0 辛醛 A 辛醛 y=216.57x+2.17 0.998 9 1.50±0.01 7.15±0.06 57 1 321.0 (E)-2-庚烯醛 B 辛醛 y=216.57x+2.17 0.998 9 1.42±0.01 nd 58 1 427.4 (E)-2-辛醛 B 辛醛 y=216.57x+2.17 0.998 9 1.57±0.02 nd 59 1 427.4 (E)-2-辛烯醛 B 辛醛 y=216.57x+2.17 0.998 9 nd 7.18±0.19 60 1 278.5 辛酮 B 辛醛 y=216.57x+2.17 0.998 9 nd 7.00±0.13 61 1 494.8 癸醛 A 癸醛 y=1 006.5x+58.68 0.982 5 nd 189.10±1.07 62 1 464.0 (E,Z)-2,4-庚二烯醛 B 辛醛 y=216.57x+2.17 0.998 9 18.95±0.03 nd 63 1 493.5 (E,E)-2,4-庚二烯醛 B 辛醛 y=216.57x+2.17 0.998 9 1.81±0.04 nd 64 1 530.0 苯甲醛 A 苯甲醛 y=7 966.6x+10.3 0.991 7 9.29±0.10 42.98±0.44 65 1 659.5 3-甲基-苯甲醛 B 苯甲醛 y=7 966.6x+10.3 0.963 1 8.24±0.01 nd 66 1 643.2 丁内酯 B 辛醛 y=216.57x+2.17 0.963 1 18.87±0.03 nd 67 1 655.0 苯乙醛 A 苯乙醛 y=3 526.3x+52.67 0.993 4 6.20±0.14 25.90±0.09 68 1 659.5 2-甲基-苯甲醛 B 苯甲醛 y=7 966.6x+10.3 0.963 1 8.52±0.10 nd 69 1 830.7 3,4-二甲基-苯甲醛 B 苯甲醛 y=7 966.6x+10.3 0.963 1 8.36±0.16 285.62±47.58酸类70 1 452.4 乙酸 A 乙酸 y=115.67x+4.22 0.988 8 3.00±0.07 14.24±0.16 71 1 855.8 己酸 A 己酸 y=1 899.39x+7.25 0.998 0 10.58±0.66 29.02±2.14 72 1 981.5 2-己酸 A 2-己酸 y=5 237.32x+112.710.996 7 76.08±0.81 nd挥发酚类73 1 877.1 2-甲氧基-苯酚 B 苯酚 y=19 650x-1.25 0.998 1 15.83±1.84 14.12±2.24 74 2 022.8 邻甲酚 B 对甲酚 y=69 304.09x+0.65 0.996 2 44.37±6.33 29.78±1.23
续表5
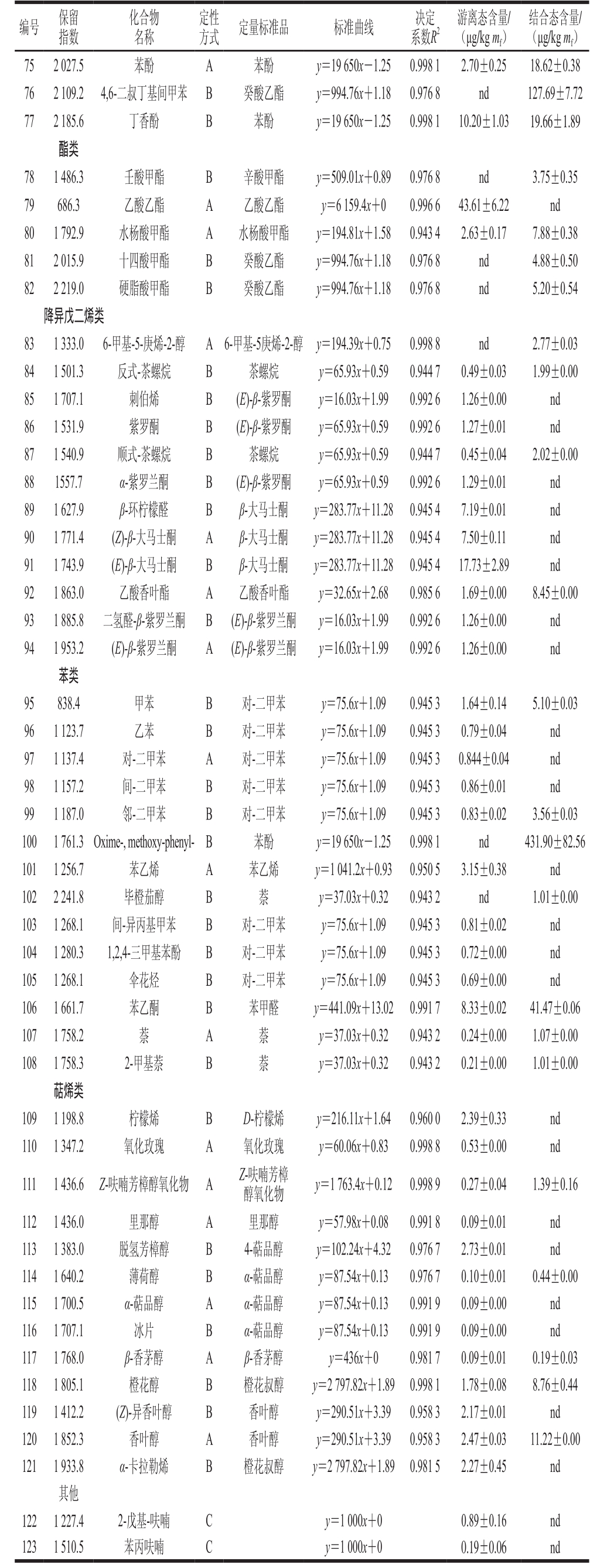
注:A.由标准品进行定性;B.通过比对NIST谱库中结构相似的标准品进行定性;C.由保留指数和NIST谱库比对进行定性;nd.未检测到。
编号 保留指数化合物名称定性方式 定量标准品 标准曲线 决定系数R2游离态含量/(μg/kg mf)结合态含量/(μg/kg mf)75 2 027.5 苯酚 A 苯酚 y=19 650x-1.25 0.998 1 2.70±0.25 18.62±0.38 76 2 109.2 4,6-二叔丁基间甲苯 B 癸酸乙酯 y=994.76x+1.18 0.976 8 nd 127.69±7.72 77 2 185.6 丁香酚 B 苯酚 y=19 650x-1.25 0.998 1 10.20±1.03 19.66±1.89酯类78 1 486.3 壬酸甲酯 B 辛酸甲酯 y=509.01x+0.89 0.976 8 nd 3.75±0.35 79 686.3 乙酸乙酯 A 乙酸乙酯 y=6 159.4x+0 0.996 6 43.61±6.22 nd 80 1 792.9 水杨酸甲酯 A 水杨酸甲酯 y=194.81x+1.58 0.943 4 2.63±0.17 7.88±0.38 81 2 015.9 十四酸甲酯 B 癸酸乙酯 y=994.76x+1.18 0.976 8 nd 4.88±0.50 82 2 219.0 硬脂酸甲酯 B 癸酸乙酯 y=994.76x+1.18 0.976 8 nd 5.20±0.54降异戊二烯类83 1 333.0 6-甲基-5-庚烯-2-醇 A 6-甲基-5庚烯-2-醇 y=194.39x+0.75 0.998 8 nd 2.77±0.03 84 1 501.3 反式-茶螺烷 B 茶螺烷 y=65.93x+0.59 0.944 7 0.49±0.03 1.99±0.00 85 1 707.1 刺伯烯 B (E)-β-紫罗酮 y=16.03x+1.99 0.992 6 1.26±0.00 nd 86 1 531.9 紫罗酮 B (E)-β-紫罗酮 y=65.93x+0.59 0.992 6 1.27±0.01 nd 87 1 540.9 顺式-茶螺烷 B 茶螺烷 y=65.93x+0.59 0.944 7 0.45±0.04 2.02±0.00 88 1557.7 α-紫罗兰酮 B (E)-β-紫罗酮 y=65.93x+0.59 0.992 6 1.29±0.01 nd 89 1 627.9 β-环柠檬醛 B β-大马士酮 y=283.77x+11.28 0.945 4 7.19±0.01 nd 90 1 771.4 (Z)-β-大马士酮 A β-大马士酮 y=283.77x+11.28 0.945 4 7.50±0.11 nd 91 1 743.9 (E)-β-大马士酮 B β-大马士酮 y=283.77x+11.28 0.945 4 17.73±2.89 nd 92 1 863.0 乙酸香叶酯 A 乙酸香叶酯 y=32.65x+2.68 0.985 6 1.69±0.00 8.45±0.00 93 1 885.8 二氢醛-β-紫罗兰酮 B (E)-β-紫罗兰酮 y=16.03x+1.99 0.992 6 1.26±0.00 nd 94 1 953.2 (E)-β-紫罗兰酮 A (E)-β-紫罗兰酮 y=16.03x+1.99 0.992 6 1.26±0.00 nd苯类95 838.4 甲苯 B 对-二甲苯 y=75.6x+1.09 0.945 3 1.64±0.14 5.10±0.03 96 1 123.7 乙苯 B 对-二甲苯 y=75.6x+1.09 0.945 3 0.79±0.04 nd 97 1 137.4 对-二甲苯 A 对-二甲苯 y=75.6x+1.09 0.945 3 0.844±0.04 nd 98 1 157.2 间-二甲苯 B 对-二甲苯 y=75.6x+1.09 0.945 3 0.86±0.01 nd 99 1 187.0 邻-二甲苯 B 对-二甲苯 y=75.6x+1.09 0.945 3 0.83±0.02 3.56±0.03 100 1 761.3 Oxime-, methoxy-phenyl-B 苯酚 y=19 650x-1.25 0.998 1 nd 431.90±82.56 101 1 256.7 苯乙烯 A 苯乙烯 y=1 041.2x+0.93 0.950 5 3.15±0.38 nd 102 2 241.8 毕橙茄醇 B 萘 y=37.03x+0.32 0.943 2 nd 1.01±0.00 103 1 268.1 间-异丙基甲苯 B 对-二甲苯 y=75.6x+1.09 0.945 3 0.81±0.02 nd 104 1 280.3 1,2,4-三甲基苯酚 B 对-二甲苯 y=75.6x+1.09 0.945 3 0.72±0.00 nd 105 1 268.1 伞花烃 B 对-二甲苯 y=75.6x+1.09 0.945 3 0.69±0.00 nd 106 1 661.7 苯乙酮 B 苯甲醛 y=441.09x+13.02 0.991 7 8.33±0.02 41.47±0.06 107 1 758.2 萘 A 萘 y=37.03x+0.32 0.943 2 0.24±0.00 1.07±0.00 108 1 758.3 2-甲基萘 B 萘 y=37.03x+0.32 0.943 2 0.21±0.00 1.01±0.00萜烯类109 1 198.8 柠檬烯 B D-柠檬烯 y=216.11x+1.64 0.960 0 2.39±0.33 nd 110 1 347.2 氧化玫瑰 A 氧化玫瑰 y=60.06x+0.83 0.998 8 0.53±0.00 nd 111 1 436.6 Z-呋喃芳樟醇氧化物 A Z-呋喃芳樟醇氧化物 y=1 763.4x+0.12 0.998 9 0.27±0.04 1.39±0.16 112 1 436.0 里那醇 A 里那醇 y=57.98x+0.08 0.991 8 0.09±0.01 nd 113 1 383.0 脱氢芳樟醇 B 4-萜品醇 y=102.24x+4.32 0.976 7 2.73±0.01 nd 114 1 640.2 薄荷醇 B α-萜品醇 y=87.54x+0.13 0.976 7 0.10±0.01 0.44±0.00 115 1 700.5 α-萜品醇 A α-萜品醇 y=87.54x+0.13 0.991 9 0.09±0.00 nd 116 1 707.1 冰片 B α-萜品醇 y=87.54x+0.13 0.991 9 0.09±0.00 nd 117 1 768.0 β-香茅醇 A β-香茅醇 y=436x+0 0.981 7 0.09±0.01 0.19±0.03 118 1 805.1 橙花醇 B 橙花叔醇 y=2 797.82x+1.89 0.998 1 1.78±0.08 8.76±0.44 119 1 412.2 (Z)-异香叶醇 B 香叶醇 y=290.51x+3.39 0.958 3 2.17±0.01 nd 120 1 852.3 香叶醇 A 香叶醇 y=290.51x+3.39 0.958 3 2.47±0.03 11.22±0.00 121 1 933.8 α-卡拉勒烯 B 橙花叔醇 y=2 797.82x+1.89 0.981 5 2.27±0.45 nd其他122 1 227.4 2-戊基-呋喃 C y=1 000x+0 0.89±0.16 nd 123 1 510.5 苯丙呋喃 C y=1 000x+0 0.19±0.06 nd
挥发性香气成分在葡萄风味物质中有举足轻重的地位,种类繁多。这些成分的种类、含量、感觉阈值及相互作用决定着葡萄的风味,同时也决定着所酿葡萄酒的风味和典型性。‘黑珍珠’葡萄果实中共检测到93 种游离态挥发性香气化合物,其中C6/C9类是第一大类游离态香气化合物,占游离态挥发性香气物质总量的66.85%,其中己醛、(E)-2-己烯醛的含量较高,这两种化合物决定了‘黑珍珠’葡萄果实游离态C6/C9类香气物质的含量,也对‘黑珍珠’葡萄果实总游离态挥发性香气化合物起决定的作用。C6/C9类化合物能够提供青草香,对酒的香气有重要的作用。醇类是第二大类游离态香气化合物,占总游离态挥发性香气化合物的15.95%,其中苯乙醇、苯甲醇的含量较高,而酯类、酸类、挥发酚类以及其他含量低,所占比例在0.049 7%~4.07%之间。
‘黑珍珠’葡萄果实中共检测到81 种结合态挥发性香气化合物,醇类是最主要的结合态香气化合物,占总结合态挥发性香气化合物的38.44%,其中苯乙醇、苯甲醇、1-苯乙醇的含量较高,占结合态醇类香气化合物的68.09%,并且醇类的结合态香气化合物多达34 种。羰基化合物是第二大类结合态挥发性化合物,其中3,4-二甲基-苯甲醛、癸醛的含量占羰基化合物的81.75%,而酯类、萜烯的含量低,所占比例在0.49%~0.70%之间。
由此可以看出,己醛和(E)-2-己烯醛在游离态的香气物质中含量较高,决定了‘黑珍珠’葡萄青草味浓重,苯甲醇、苯乙醇含量也为葡萄果实提供了花香的气味。结合态香气物质中,苯乙醇和己烯醛含量较高,也赋予葡萄花香和青草味。
2.5 ‘黑珍珠’的SSR指纹分析
表6 6 对SSR引物对‘贝达’、‘烟73’、‘Kolor’和‘黑珍珠’的扩增结果
Table 6 Amplification results of ‘Beta’, ‘Yan 73’, ‘Kolor’ and‘Pearl Noir’ with 6 different pairs of SSR primers

注:√.该品种在标准数据库中收录;―.该品种在标准数据库中未收录。
品种 VVS2 VVMD5 VVMD7 VVMD27 Vrzag62 Vrzag79 与标准数据库对比结果‘贝达’ 131∶131 234∶260 233∶251 202∶206 186∶200 255∶257 √‘烟73’ 131∶135 224∶236 241∶245 178∶186 188∶204 243∶257 —‘Kolor’ 149∶149 236∶236 237∶241 176∶182 188∶194 237∶253 √‘黑珍珠’ 131∶135 232∶262 237∶251 186∶241 192∶206 243∶255 ―
检索发现,未知亲本信息的葡萄新品系‘黑珍珠’的SSR指纹不存在于葡萄标准数据库中(http://www.vitisvea.de/)。比较SSR指纹发现,‘黑珍珠’和‘贝达’在引物VVS2、VVMD7和Vrzag79各有一个等位基因相同,‘黑珍珠’与‘烟73’在引物VVS2和Vrzag79各有一个等位基因相同,‘黑珍珠’与‘Kolor’在引物VVMD7有一个等位基因相同(表6)。杂交后代在每个SSR位点的两个等位基因一个来自父本,而另一个来自母本[31-34]。因为本实验用于SSR标记的葡萄品种较少,根据6 对SSR引物的扩增的结果尚不能确定‘黑珍珠’的亲本信息,其亲本信息有待进一步研究。
3 结 论
有研究表明,葡萄花色苷的组成及比例受到许多因素的影响,而遗传因素是影响葡萄品种花色苷组成的决定性因素,特定的品种花色苷组成稳定,决定其品种的颜色[35],而有无花色素双糖苷是区别欧亚种葡萄与其他种葡萄的重要特征[36]。‘黑珍珠’葡萄果皮紫黑色,花色苷含量丰富,且以双葡萄糖苷为主,占花色苷总量的71.2%,推测其含有非欧亚种葡萄的血缘。‘黑珍珠’葡萄香气化合物组成复杂,这些香气化合物以游离态与糖苷结合态形式存在,共检测到123 种挥发性香气化合物,主要以游离态为主。由于供试品种较少,本研究并未找到其亲本。因为‘黑珍珠’葡萄果皮花色苷的种类与含量丰富,且单品种酒颜色深,未来可以作为酿造具有地区特色的红葡萄酒的新品种或调色新品种。
参考文献:
[1] 房经贵, 刘崇怀. 葡萄分子生物学[M]. 北京: 科学出版社, 2014: 46-73.
[2] POMAR F, NOVO M, MASA A. Varietal differences among the anthocyanin profiles of 50 red table grape cultivars studied by high performance liquid chromatography[J]. Journal of Chromatography A,2005, 1094(1/2): 34-41. DOI:10.1016/j.chroma.2005.07.096.
[3] AGEORGES A, FERNANDEZ L, MERDINOGLU D, et al.Four specific isogenes of the anthocyanin metabolic pathway are systematically co-expressed with the red colour of grape berries[J]. Plant Science, 2006, 170(2): 372-383. DOI:10.1016/j.plantsci.2005.09.007.
[4] ROBINSON A L, BOSS P K, SOLOMON P S, et al. Origins of grape and wine aroma. part 1. chemical components and viticultural impacts[J]. American Journal of Enology & Viticulture, 2014, 65(1):1-24. DOI:10.1016/j.chroma.2005.07.096.
[5] CHENG G, HE Y N, YUE T X, et al. Effects of climatic conditions and soil properties on Cabernet Sauvignon berry growth and anthocyanin profiles[J]. Molecules, 2014, 19(9): 13683-13703. DOI:10.3390/Molecules190913683.
[6] 孔庆山. 中国葡萄志[M]. 北京: 中国农业科学技术出版社, 2004:520-536.
[7] MAUL E, SUDHARMA K N, KECKE S, et al. The European Vitis Database (www.eu-vitis.de): a technical innovation through an online uploading and interactive modification system[J]. Vitis, 2012, 51(2):79-85.
[8] 李记明. 葡萄汁的糖度表示方法[J]. 中外葡萄与葡萄酒, 2000(4):47-48. DOI:10.13414/j.cnki.zwpp.2000.04.018.
[9] 国家质量监督检验检疫总局. 食品中总酸的测定: GB/T 12456—2008[S]. 北京: 中国标准出版社, 2008: 1-5.
[10] HE Jianjun, LIU Yanxia, PAN Qiuhong, et al. Different anthocyanin profiles of the skin and the pulp of Yan73 (Muscat Hamburg × Alicante Bouschet) grape berries[J]. Molecules, 2010, 15(3): 1141-1153.DOI:10.3390/molecules15031141.
[11] LAN Yibin, QIAN Xu, YANG Zhongjun, et al. Striking changes in volatile profiles at sub-zero temperatures during over-ripening of‘Beibinghong’ grapes in Northeastern China[J]. Food Chemistry, 2016,212: 172-182. DOI:10.1016/j.foodchem.2016.05.143.
[12] WU Yuwen, ZHU Baoqing, TU Cui, et al. Generation of volatile compounds in litchi wine during winemaking and short-term bottle storage[J]. Journal of Agricultural and Food Chemistry, 2011, 59(9):4923-4931. DOI:10.1021/jf2001876.
[13] 王军, 杨传平, 刘桂丰. 木本植物基因组DNA提取及鉴定[J]. 植物研究, 2006, 26(5): 589-594. DOI:10.3969/j.issn.1673-5102.2006.05.016.
[14] 李文超, 孙盼, 王振平. 不同土壤条件对酿酒葡萄生理及果实品质的影响[J]. 果树学报, 2012(5): 837-842. DOI:10.13925/j.cnki.gsxb.2012.05.025.
[15] 李记明. 关于葡萄品质的评价指标[J]. 中外葡萄与葡萄酒, 1999(1):54-57. DOI:10.13414/j.cnki.zwpp.1999.01.021.
[16] CONDE C, SILVA P, FONTES N, et al. Biochemical changes throughout grape berry development and fruit and wine quality[J].Food, 2007, 1: 1-22. DOI:10.1093/jxb/ert395.
[17] BALIK J, KUMSTA M. Evaluation of colour content in grapes originating from South Moravia[J]. Czech Journal of Food Sciences,2008, 26: S18-S24. DOI:10.17221/240/2008-CJFS.
[18] SHOZO K, NAMI G, HIROCHIKO H. Association of VvmybA1 gene expression with anthocyanin production in grape (Vitis vinifera) skincolor mutants[J]. Journal of the Japanese Society for Horticultural Science, 2005, 74(3): 196-203. DOI:10.2503/jjshs.74.196.
[19] 赵宇瑛, 张汉锋. 花青素的研究现状及发展趋势[J]. 安徽农业科学, 2005, 33(5): 904-905; 907. DOI:10.13989/j.cnki.0517-6611.2005.05.093.
[20] AGEORGES A, FERNANDEZ L, VIALET S, et al. Four specific isogenes of the anthocyanin metabolic pathway are systematically coexpressed with the red colour of grape berries[J]. Plant Science, 2006,170(2): 372-383. DOI:10.1016/j.plantsci.2005.09.007.
[21] 刘洪海, 张晓丽, 杜平, 等. pH示差法测定烟73葡萄中花青素含量[J]. 中国调味品, 2009, 34(4): 110-111; 117. DOI:10.3969/j.issn.1000-9973.2009.04.027.
[22] 孙建霞, 张燕, 胡小松, 等. 花色苷的结构稳定性与降解机制研究进展[J]. 中国农业科学, 2009, 42(3): 996-1008. DOI:10.3864/j.issn.0578-1752.2009.03.031.
[23] 程建徽, 雷鸣, 杨夫臣, 等. 欧亚种葡萄花色素苷的积累及UFGT基因的RT-PCR表达分析[J]. 果树学报, 2009, 26(6): 808-812.
[24] REVILLA E, GARCÍA-BENEYTEZ E, CABELLO F, et al. Value of high-performance liquid chromatographic analysis of anthocyanins in the differentiation of red grape cultivars and red wines made from them[J]. Journal of Chromatography A, 2001, 915(1/2): 53-60.DOI:10.1016/S0021-9673(01)00635-5.
[25] CASTILLO-MUÑOZ N, WINTERHALTER P, WEBER F. Structure elucidation of peonidin 3,7-O-β-diglucoside isolated from Garnacha Tintorera (Vitis vinifera L.) grapes[J]. Journal of Agricultural and Food Chemistry, 2010, 58(20): 11105-11111. DOI:10.1021/jf102578u.
[26] 赵权, 王军, 韩富亮. 不同品种山葡萄酒中花色苷的成分分析[J].西北农林科技大学学报(自然科学版), 2013, 41(6):195-201.DOI:10.13207/j.cnki.jnwafu.2013.06.007.
[27] CASTILLO-MUÑOZ N, FERNÁNDEZ-GONZÁLEZ M, GÓMEZALONSO S, et al. Red-color related phenolic composition of Garnacha Tintorera (Vitis vinifera L.) grapes and red wines[J]. Journal of Agricultural and Food Chemistry, 2009, 57(17): 7883-7891.DOI:10.1021/jf9002736.
[28] 杨晓慧, 陈为凯, 何非, 等. 5 个红色酿酒葡萄品种花色苷组成差异分析[J]. 西北农业学报, 2017, 26(11): 1648-1654. DOI:10.7606/j.issn.1004-1389.2017.11.011.
[29] GUAN L, LI J H, FAN P G, et al. Anthocyanin accumulation in various organs of a Teinturier cultivar (Vitis vinifera L.) during the growing season[J]. American Journal of Enology and Viticulture,2012, 63(2): 177-184. DOI:10.5344/ajev.2011.11063. DOI:10.7606/j.issn.1004-1389.2017.11.011.
[30] CARIMI F, MERCATI F, DE MICHELE R, et al. Intra-varietal genetic diversity of the grapevine (Vitis vinifera L.) cultivar ‘Nero d’Avola’as revealed by microsatellite markers[J]. Genetic Resources and Crop Evolution, 2011, 58(7): 967-975. DOI:10.1007/s10722-011-9731-4.
[31] LIN H, WALKER M A. Identifying grape rootstocks with simple sequence repeat (SSR) DNA markers[J]. American Journal of Enology and Viticulture, 1998, 49(4): 403-407.
[32] GRASSI F, LABRA M, IMAZIO S, et al. Evidence of a secondary grapevine domestication centre detected by SSR analysis[J].Theoretical and Applied Genetics, 2003, 107(7): 1315-1320.DOI:10.1007/s00122-003-1321-1.
[33] RIAHI L, LAUCOU V, LE CUNFF L L, et al. Highly polymorphic nSSR markers: a useful tool to assess origin of North African cultivars and to provide additional proofs of secondary grapevine domestication events[J]. Scientia Horticulturae, 2012, 141: 53-60. DOI:10.1016/j.scienta.2012.04.023.
[34] EMANUELLI F, LORENZI S, GRZESKOWIAK L, et al. Genetic diversity and population structure assessed by SSR and SNP markers in a large germplasm collection of grape[J]. BMC Plant Biology, 2013,13(1): 1-17. DOI:10.1186/1471-2229-13-39.
[35] REVILLA E, GARCÍA-BENEYTEZ E, CABELLO F. Anthocyanin fingerprint of clones of Tempranillo grapes and wines made with them[J]. Australian Journal of Grape & Wine Research, 2009, 15(1):70-78. DOI:10.1111/j.1755-0238.2008.00037.x.
[36] 段长青, 贺普超, 康靖全. 中国葡萄野生种花色素双糖苷的研究[J].西北农林科技大学学报(自然科学版), 1997(5): 23-28.
Fruit Quality Analysis of the New Wine Grape Variety ‘Pearl Noir’
PENG Wenting1,2, WANG Wenran1,2, YANG Hangyu1,2, CHEN Weikai1,2, YANG Zhe1,2, HE Fei1,2, WANG Jun1,2,*
(1. Center for Viticulture and Enology, College of Food Science and Nutritional Engineering, China Agricultural University,Beijing 100083, China; 2. Key Laboratory of Viticulture and Enology, Ministry of Agriculture and Rural Affairs, Beijing 100083, China)
Abstract: In order to study the wine-making characteristics of ‘Pearl Noir’ grape and its parental information, the compositions and the contents of anthocyanins and volatile compounds in ‘Pearl Noir’ grapes were analyzed using high performance liquid chromatography-mass spectrometry (HPLC-MS) and gas chromatography-mass spectrometry (GC-MS),respectively. HPLC-MS results showed that the content of total anthocyanins in ‘Pearl Noir’ skin was 2 774.76 mg/kg mf and the high proportion of diglucoside anthocyanin (71.2%) indicated that ‘Pearl Noir’ may have a potential genetic relationship with non-vinifera grapes. GC-MS results showed that a total of 123 volatile compounds in free and/or glycosidically-bound forms were detected in ‘Pearl Noir’ grapes. Simple sequence repeats (SSR) analysis showed that no parents of ‘Pearl Noir’were found in all tested cultivars (‘Beta’, ‘Yan 73’ and ‘Kolor’). In the future, ‘Pearl Noir’ grapes can be used as a new variety to make wine with regional characteristics or to enhance wine color by blending with pale red wines due to the high content of anthocyanins in its skin and the deep color possessed by its varietal wines.
Keywords: wine grape ‘Pearl Noir’; anthocyanins; volatile compounds; simple sequence repeats markers
收稿日期:2018-05-18
基金项目:现代农业产业技术体系建设专项(CARS-29)
第一作者简介:彭文婷(1994—)(ORCID: 0000-0001-7857-1880),女,硕士研究生,研究方向为葡萄花色苷。E-mail: 190846907@qq.com
*通信作者简介:王军(1966—)(ORCID: 0000-0001-8303-5716),男,教授,博士,研究方向为葡萄花色苷生物合成的分子生物学。E-mail: jun_wang@cau.edu.cn
DOI:10.7506/spkx1002-6630-20180518-255
中图分类号:S663.1
文献标志码:A
文章编号:1002-6630(2019)11-0062-08
引文格式:
彭文婷, 王雯染, 杨航宇, 等. 酿酒葡萄新品系‘黑珍珠’果实品质分析[J]. 食品科学, 2019, 40(11): 62-69. DOI:10.7506/spkx1002-6630-20180518-255. http://www.spkx.net.cn
PENG Wenting, WANG Wenran, YANG Hangyu, et al. Fruit quality analysis of the new wine grape variety ‘Pearl Noir’[J].Food Science, 2019, 40(11): 62-69. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180518-255.http://www.spkx.net.cn









