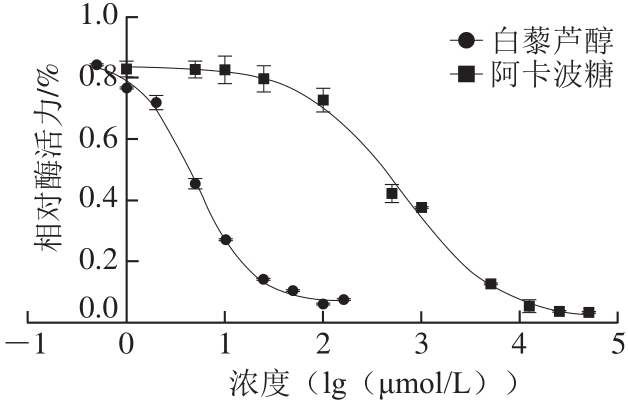
图1 白藜芦醇和阿卡波糖对α-葡萄糖苷酶活力的影响
Fig. 1 Effect of resveratrol and acarbose on the activity of α-glucosidase
多酚类化合物是人类饮食中含量丰富的抗氧化剂,也是植物中常见的成分[1]。近年来,多种膳食多酚,如绿茶中的儿茶素没食子酸[2]、西兰花中的木犀草素、芹菜中的芹菜素[3-4]等被证明有抑制小肠内α-葡萄糖苷酶活性和缓解II型糖尿病的作用。白藜芦醇是一种典型的酚类化合物,在葡萄、苹果、李子和花生等多种植物中广泛存在[5]。由于其具有抗炎、抗氧化、抗癌等[6-7]多种生物活性被深度开发为膳食补充剂。
已有多项关于白藜芦醇治疗、改善II型糖尿病的临床研究[8]。Liu Kai等[9]对11 项临床实验的荟萃分析表明,白藜芦醇显著改善了糖尿病患者的血糖调控能力和胰岛素敏感性。在一项随机对照实验中,对照组患者仅口服降糖药(格列苯脲或者二甲双胍),干预组患者每天口服250 mg白藜芦醇和降糖药。3 个月后,干预组患者的收缩压、平均糖化血红蛋白、总胆固醇含量等指标得到了显著改善,表明白藜芦醇可有效改善血糖调控能力,可作为治疗II型糖尿病的辅助药物[10]。Rasouli等[11]通过分子对接和虚拟筛选的方法,推测咖啡酸、姜黄素和白藜芦醇等多种酚类化合物可强烈抑制α-葡萄糖苷酶的活性。在一些研究中,白藜芦醇表现出了优于阿卡波糖的α-葡萄糖苷酶抑制作用[12-13]。因此,白藜芦醇对α-葡萄糖苷酶的抑制动力学和抑制机制的研究具有一定意义。本研究通过酶动力学分析和计算模拟方法阐明白藜芦醇结合α-葡萄糖苷酶的机制,以期讨论其被开发为新型糖尿病药物或作为膳食补充剂以降低血糖含量的可能性。
α-葡萄糖苷酶(酿酒酵母)、白藜芦醇、阿卡波糖、4-硝基苯基-α-D-吡喃葡萄糖苷(4-nitrophenyl-α-D-glucopyranoside,pNPG) 美国Sigma-Aldrich公司;对硝基苯酚 上海阿拉丁生化科技股份有限公司。
Synergy H1全波长多功能酶标仪 德国Bio-Tek公司;电子天平 北京赛多利斯仪器系统有限公司。
1.3.1 α-葡萄糖苷酶活力的检测
参照文献[14-15],釆用分光光度法测定α-葡萄糖苷酶活力。将α-葡萄糖苷酶溶解于0.1 mol/L pH 6.8磷酸盐缓冲液中,加入配制好的不同浓度的底物(pNPG溶液),与白藜芦醇溶液混匀后置于全波长多功能酶标仪中37 ℃下振荡3 min,恒温孵育15 min。反应体系由pNPG、10 μL α-葡萄糖苷酶溶液、0.1 mol/L pH 6.8磷酸盐缓冲液和各浓度的白藜芦醇组成,总体积为100 μL。α-葡萄糖苷酶活力表示为pNPG在37 ℃每分钟由α-葡萄糖苷酶水解生成的对硝基苯酚在405 nm波长处的吸光度。
1.3.2 酶反应动力学方程的建立
由于1.3.1节测得前15 min每分钟生成对硝基苯酚的吸光度相同,即反应速率相同,因此取15 min时生成对硝基苯酚的吸光度除以时间作为反应初速度。按照1.3.1节方法分别测定底物浓度为0.02、0.05、0.1、0.2、0.5、1、2、5 mmol/L时反应的初速度,α-葡萄糖苷酶终浓度为0.4 U/mL,每个浓度做3 个平行,通过GraphPad软件拟合酶反应的动力学曲线,求出米氏常数(Km)和最大反应速率(vmax)。
1.3.3 白藜芦醇对α-葡萄糖苷酶IC50的测定
将不同浓度(终浓度0~160 μmol/L)的白藜芦醇和不同浓度(0~62.5 mmol/L)的阳性对照阿卡波糖分别与终浓度0.6 mmol/L pNPG溶液混匀,加入10 μL 4 U/mL α-葡萄糖苷酶酶液,按1.3.1节方法测定α-葡萄糖苷酶活力。相对酶活力由实验组与空白组(不加抑制剂)反应初速度的比值表示。绘制相对酶活力与白藜芦醇浓度的关系图,并求出相应的半抑制浓度(half maximal inhibitory concentration,IC50)。
1.3.4 抑制动力学分析
将不同终浓度(1.0、2.5、5.0、7.5、10.0 μmol/L)的白藜芦醇与终浓度分别为0.2、0.4、0.6、1.0、1.5 mmol/L的底物溶液混匀,加入终浓度0.4 U/mL α-葡萄糖苷酶溶液,按1.3.1节方法测定α-葡萄糖苷酶活力。根据Lineweave-Burk方程,以1/[S]为横坐标,1/v为纵坐标作图,其中[S]是底物浓度,v是反应速度,并绘制抑制作用动力学曲线以确定抑制类型。
1.3.5 α-葡萄糖苷酶的同源建模
由于大多数α-葡萄糖苷酶抑制剂的生物测试采用酿酒酵母中α-葡萄糖苷酶[16-18],因此选择酿酒酵母α-葡萄糖苷酶进行模拟对接。由于酿酒酵母α-葡萄糖苷酶的三维晶体结构尚未解析出来,本研究采用同源模建的方法[19]构建α-葡萄糖苷酶的三维结构。首先,从美国国立生物技术信息中心蛋白数据库(https://www.ncbi.nlm.nih.gov/protein/)检索获得酿酒酵母α-葡萄糖苷酶的序列信息(序列号:GAX66902.1)。将序列提交至SWISS-MODEL工作站[20]进行序列比对,并根据序列一致性和模板蛋白解析度等参数手动选择模板蛋白进行模建。SWISS-MODEL服务器会基于OpenMM分子机制[21]对蛋白模型进行能量最小化,保证蛋白模型的合理性。用SAVES网站(http://services.mbi.ucla.edu/SAVES/)的PROCHECK[22]、ERRAT[23]等程序对构建好的模型进行验证。
1.3.6 分子对接模拟
本研究用BIOVIA Discovery Studio 2016程序中的CDOCKER模块进行分子对接处理。有多项研究已经探索了α-葡萄糖苷酶活性位点的位置,并指出了其关键残基[24-26]。常用的α-葡萄糖苷酶抑制剂阿卡波糖竞争性抑制α-葡萄糖苷酶的活性,即其结合位点为酶的活性位点[27-28]。因此,本研究以阿卡波糖为探针,指出α-葡萄糖苷酶的活性位点。为了获得白藜芦醇和α-葡萄糖苷酶最可能的结合位点,搜索受体蛋白的整个三维空间,包括活性位点和非活性位点区域。根据对接打分和计算获得的结合自由能确定白藜芦醇可能的结合位点。
使用GraphPad Prism 7软件进行非线性回归分析,计算IC50和抑制常数(Ki),通过线性拟合作Lineweaver-Burk图。
不同浓度的白藜芦醇和阿卡波糖在与α-葡萄糖苷酶孵育后以剂量依赖性方式抑制酶活性。在白藜芦醇浓度大于100 μmol/L时α-葡萄糖苷酶活力较低,对其抑制效果较强,IC50为5.047 μmol/L,明显强于阳性对照阿卡波糖(632.6 μmol/L),表明白藜芦醇可以强烈抑制α-葡萄糖苷酶活力(图1)。

图1 白藜芦醇和阿卡波糖对α-葡萄糖苷酶活力的影响
Fig. 1 Effect of resveratrol and acarbose on the activity of α-glucosidase
如图2所示,白藜芦醇浓度越大斜率越大,即vmax减小,而所有直线与x轴几乎相交于一点,即Km基本不变,表明白藜芦醇介导的α-葡萄糖苷酶抑制遵循非竞争性抑制机制。以抑制剂浓度为横坐标,双倒数图中不同直线的斜率(vmax/Km)为纵坐标,则直线与x轴相交于Ki,非线性拟合结果显示Ki为5.743 μmol/L。因此,白藜芦醇可以直接与α-葡萄糖苷酶活性位点附近的区域结合,导致vmax改变,而Km不变。
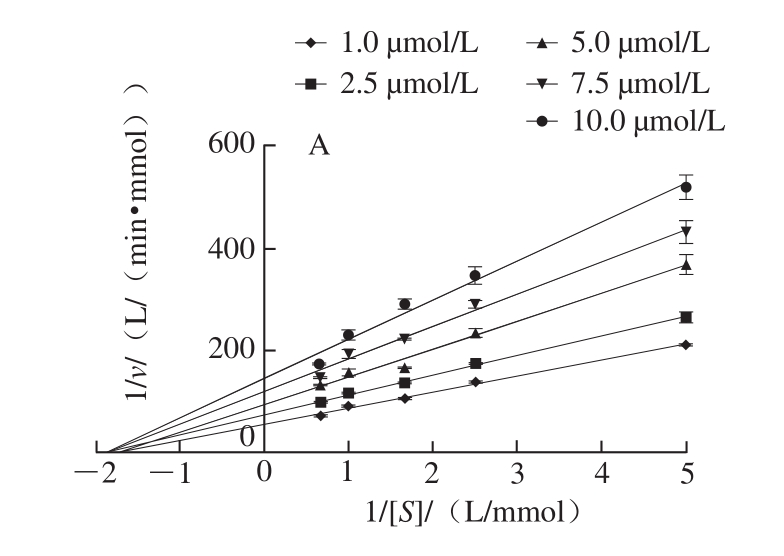
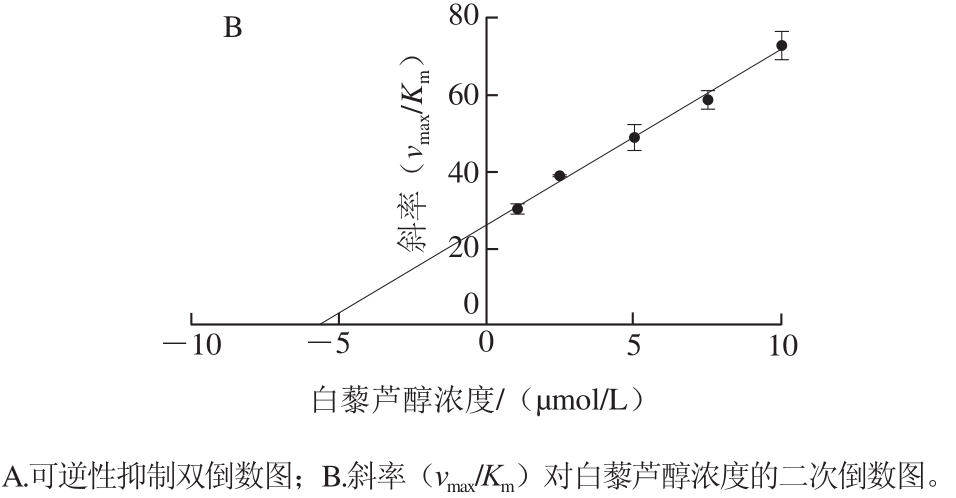
图2 白藜芦醇对α-葡萄糖苷酶的抑制动力学
Fig. 2 Inhibition kinetics of resveratrol on α-glucosidase
序列比对完成后,选择一致性程度较高(72.51%)、蛋白解析精度也较高的寡聚-1,6-葡萄糖苷酶(蜡样芽孢杆菌)作为模板蛋白,蛋白数据库编号为3aj7。PROCHECK是一种蛋白质结构验证的程序,通过绘制拉氏图判断蛋白结构的合理性。如图3所示,98.8%的氨基酸落于合理区,因此所构建模型质量较高,可以用于分子对接模拟。
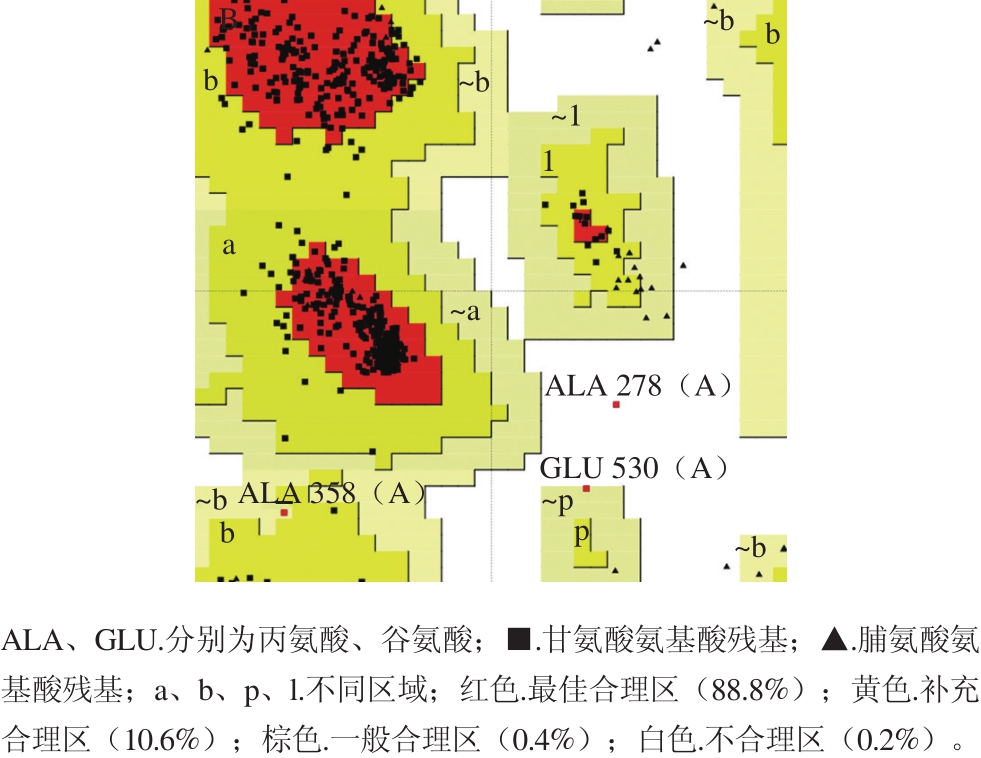
图3 α-葡萄糖苷酶模型的拉氏图
Fig. 3 Ramachandran plot of α-glucosidase model
图4 为阿卡波糖与α-葡萄糖苷酶的对接结果,表明其结合位点的位置。半透明区域表明阿卡波糖及其与α-葡萄糖苷酶相互作用残基的溶剂可及表面,表面颜色由距离表面最近的原子电荷性质决定,表示阿卡波糖与α-葡萄糖苷酶的结合位点,即酶的活性位点。和一些研究结果[18]类似,对接结果表明His111、Phe177、Arg212、Asp214、Glu276、His348、Asp349和Arg439等氨基酸残基和阿卡波糖相互作用形成氢键、范德华力等作用力,对于阿卡波糖的抑制活性有着重要的作用。
将白藜芦醇与α-葡萄糖苷酶的所有空腔进行对接并计算结合能。由于白藜芦醇结构比较简单,可以对接结合的位点很多,但许多位点的得分和结合能较低。因此选择3 个得分和结合能都较高的位点进行研究(表1)。
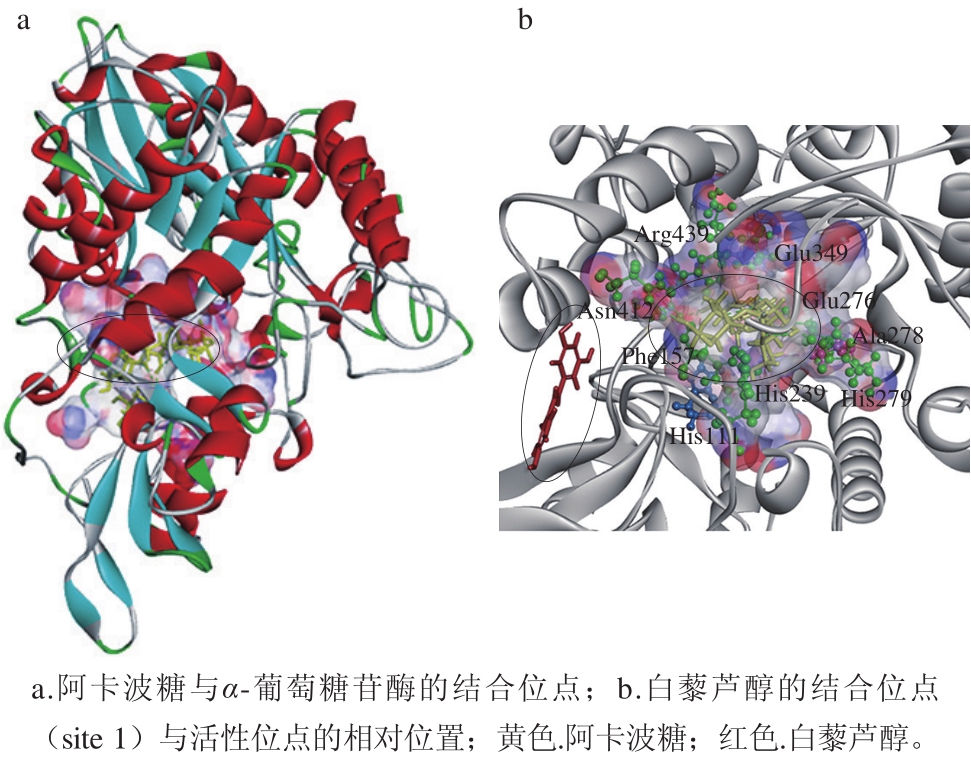
图4 α-葡萄糖苷酶的结合模式
Fig. 4 Binding modes of α-glucosidase
表1 白藜芦醇与α-葡萄糖苷酶的对接得分及其结合能
Table 1 Docking scores and binding energy of resveratrol with α-glucosidase
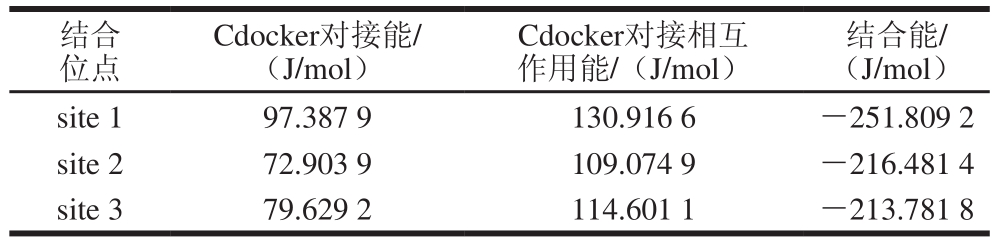
结合位点Cdocker对接能/(J/mol)Cdocker对接相互作用能/(J/mol)结合能/(J/mol)site 1 97.387 9 130.916 6 -251.809 2 site 2 72.903 9 109.074 9 -216.481 4 site 3 79.629 2 114.601 1 -213.781 8
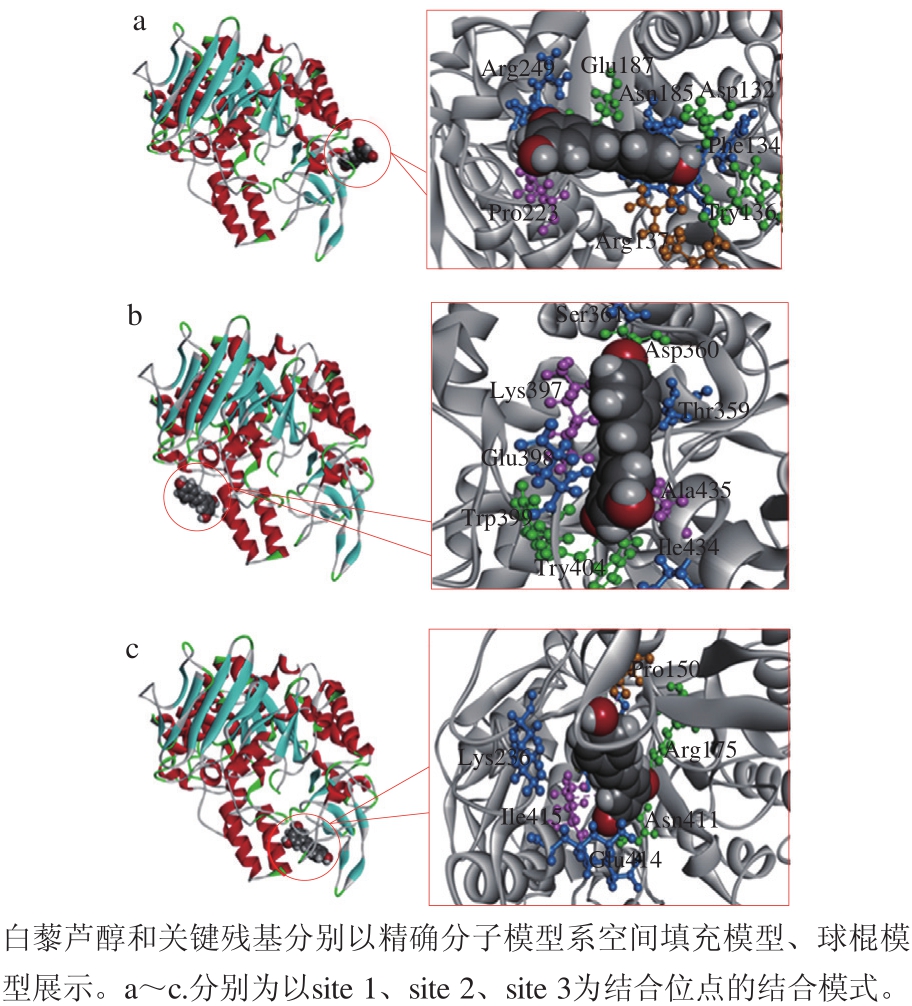
图5 3 种白藜芦醇与α-葡萄糖苷酶可能的结合模式
Fig. 5 Three probable binding modes of resveratrol with α-glucosidase
如图5所示,所有结合位点都位于α-葡萄糖苷酶的非竞争性结构域,而不是活性位点上。因此,白藜芦醇是α-葡萄糖苷酶的非竞争性抑制剂,对接结果符合抑制动力学实验结果。3 个结合位点都远离活性位点,其中site 1距离活性位点最近(图4b),但活性位点的关键残基均不参与其结合模式,表明白藜芦醇不会与底物(pNPG)竞争结合活性位点。
白藜芦醇作为多羟基芪类化合物,其羟基与酶的氨基酸残基发生氢键相互作用,这在3 种结合模式中均有体现(图5)。例如,在结合位点site 1中白藜芦醇的羟基与关键残基Asp132、Try136、Glu187形成氢键,在site 2中与关键残基Asp360、Try399、Try404形成氢键,在site 3中与关键残基Arg175、Asn411形成氢键。其中,本研究中site 1的关键残基与Liu Yan等[29]关于α-葡萄糖苷酶非竞争结合域的研究中指出的多个关键残基相同。无论是得分还是结合能,3 个位点的结果都非常相近,因此都不能完全排除。
本实验中酶动力学的研究表明白藜芦醇对α-葡萄糖苷酶有较强的抑制作用,遵循典型的非竞争性抑制机制,使得vmax减小,而Km不变。这表明白藜芦醇与酶的结合位点处于非竞争结构域而不在活性位点。之前的一些研究表明,非竞争性抑制剂与竞争性抑制剂之间,甚至非竞争性抑制剂之间[29-30]存在着协同抑制α-葡萄糖苷酶活性的作用。目前,作为II型糖尿病的一线药物,阿卡波糖、伏格列波糖等都是α-葡萄糖苷酶的竞争性抑制剂。因此,作为非竞争性抑制剂,白藜芦醇也具有与阿卡波糖等一线药物联用的潜力。
计算模拟研究中获得了白藜芦醇与α-葡萄糖苷酶3 种可能的结合模式。和之前对多羟基化合物的研究相同,在所有结合模式中氢键相互作用都扮演了十分重要的角色[31]。3 个非竞争性结构域均远离酶活性位点,不含有与阿卡波糖结合的残基。因此,其有很大可能与阿卡波糖产生协同作用。
综上所述,本研究通过酶动力学和计算模拟方法对白藜芦醇与α-葡萄糖苷酶的相互作用进行研究,揭示其可能的结合机制。白藜芦醇具有很强的酶抑制能力,属于非竞争性抑制。从机理上说,白藜芦醇并不会影响阿卡波糖的降血糖效果。相反,其与阿卡波糖联合使用可能会展现更好的效果。今后的研究将重点关注利用基因定点突变、体外酶表达和分离等分子技术结合酶动力学方法,更深入地探究白藜芦醇和α-葡萄糖苷酶的相互作用,从而改造和开发相关α-葡萄糖苷酶抑制剂。
[1] HUA Z, RONG T. Dietary polyphenols, oxidative stress and antioxidant and anti-inflammatory effects[J]. Current Opinion in Food Science, 2016, 8: 33-42. DOI:10.1016/j.cofs.2016.02.002.
[2] YANG X P, KONG F B. Evaluation of the in vitro alpha-glucosidase inhibitory activity of green tea polyphenols and different tea types[J].Journal of the Science of Food and Agriculture, 2016, 96(3): 777-782.DOI:10.1002/jsfa.7147.
[3] HA T J, LEE J H, LEE M H, et al. Isolation and identification of phenolic compounds from the seeds of Perilla frutescens (L.) and their inhibitory activities against alpha-glucosidase and aldose reductase[J]. Food Chemistry, 2012, 135(3): 1397-1403. DOI:10.1016/j.foodchem.2012.05.104.
[4] GAO J J, XU P, WANG Y F, et al. Combined effects of green tea extracts, green tea polyphenols or epigallocatechin gallate with acarbose on inhibition against α-amylase and α-glucosidase in vitro[J]. Molecules, 2013, 18(9): 11614-11623. DOI:10.3390/molecules180911614.
[5] WEISKIRCHEN S, WEISKIRCHEN R. Resveratrol: how much wine do you have to drink to stay healthy?[J]. Advances in Nutrition, 2016,7(4): 706-718. DOI:10.3945/an.115.011627.
[6] PORRO C, CIANCIULLI A, CALVELLO R, et al. Reviewing the role of resveratrol as a natural modulator of microglial activities[J]. Current Pharmaceutical Design, 2015, 21(36): 5277-5291. DOI:10.2174/1381612821666150928155612.
[7] WANG K H, LAI Y H, CHANG J C, et al. Germination of peanut kernels to enhance resveratrol biosynthesis and prepare sprouts as a functional vegetable[J]. Journal of Agricultural and Food Chemistry,2005, 53(2): 242-246. DOI:10.1021/jf048804b.
[8] ÖZTÜRK E, ARSLAN A K K, YERER M B, et al. Resveratrol and diabetes: a critical review of clinical studies[J]. Biomedicine &Pharmacotherapy, 2017, 95: 230-234. DOI:10.1016/j.biopha.2017.08.070.
[9] LIU Kai, ZHOU Rui, WANG Bin, et al. Effect of resveratrol on glucose control and insulin sensitivity: a meta-analysis of 11 randomized controlled trials[J]. American Journal of Clinical Nutrition, 2014, 99(6): 1510-1519. DOI:10.3945/ajcn.113.082024.
[10] BHATT J K, THOMAS S, NANJAN M J. Resveratrol supplementation improves glycemic control in type 2 diabetes mellitus[J]. Nutrition Research, 2012, 32(7): 537-541. DOI:10.1016/j.nutres.2012.06.003.
[11] RASOULI H, HOSSEINIGHAZVINI S M, ADIBI H, et al.Differential α-amylase/α-glucosidase inhibitory activities of plantderived phenolic compounds: a virtual screening perspective for the treatment of obesity and diabetes[J]. Food & Function, 2017, 8(5):1942-1954. DOI:10.1039/c7fo00220c.
[12] ZHANG A J, RIMANDO A M, MIZUNO C S, et al. α-Glucosidase inhibitory effect of resveratrol and piceatannol[J]. The Journal of Nutritional Biochemistry, 2017, 47: 86-93. DOI:10.1016/j.jnutbio.2017.05.008.
[13] KEREM Z, BILKIS I, FLAISHMAN M A, et al. Antioxidant activity and inhibition of α-glucosidase by trans-resveratrol, piceid, and a novel trans-stilbene from the roots of Israeli Rumex bucephalophorus L.[J].Journal of Agricultural and Food Chemistry, 2006, 54(4): 1243-1247.DOI:10.1021/jf052436+.
[14] SCHMIDT J S, LAURIDSEN M B, DRAGSTED L O, et al.Development of a bioassay-coupled HPLC-SPE-ttNMR platform for identification of α-glucosidase inhibitors in apple peel (Malus ×domestica Borkh.)[J]. Food Chemistry, 2012, 135(3): 1692-1699.DOI:10.1016/j.foodchem.2012.05.075.
[15] 费群勤, 秦一禾, 杨孟伽, 等. 乌龙茶粗多酚、EGCG和EGCG3’’Me体外抑制α-葡萄糖苷酶活性[J]. 食品科学, 2014, 35(21): 10-15.DOI:10.7506/spkx1002-6630-201421003.
[16] XUAN L, LÜ Z R, WEI W, et al. Effect of Ba2+ on the activity and structure of α-glucosidase: inhibition kinetics and molecular dynamics simulation[J]. Process Biochemistry, 2015, 50(4): 582-588.DOI:10.1016/j.procbio.2015.01.014.
[17] ZHANG X, SHI L, LI X, et al. Effect of Ca2+ on the activity and structure of α-glucosidase: inhibition kinetics and molecular dynamics simulations[J]. Journal of Bioscience & Bioengineering, 2014, 117(6):696-705. DOI:10.1016/j.jbiosc.2013.12.003.
[18] GONG Y, QIN X Y, ZHAI Y Y, et al. Inhibitory effect of hesperetin on α-glucosidase: molecular dynamics simulation integrating inhibition kinetics[J]. International Journal of Biological Macromolecules, 2017,101: 32-39. DOI:10.1016/j.ijbiomac.2017.03.072.
[19] LI X, LÜ Z R, SHEN D, et al. The inhibitory role of Co2+ on α-glucosidase: inhibition kinetics and molecular dynamics simulation integration study[J]. Process Biochemistry, 2014, 49(11): 1913-1919.DOI:10.1016/j.procbio.2014.08.002.
[20] ARNOLD K, BORDOLI L, KOPP J, et al. The SWISS-MODEL workspace: a web-based environment for protein structure homology modelling[J]. Bioinformatics, 2006, 22(2): 195-201. DOI:10.1093/bioinformatics/bti770.
[21] EASTMAN P, SWAILS J, CHODERA J D, et al. OpenMM 7:rapid development of high performance algorithms for molecular dynamics[J]. PLoS Computational Biology, 2017, 13(7): e1005659.DOI:10.1371/journal.pcbi.1005659.
[22] LASKOWSKI R A, MACARTHUR M W, THORNTON J M.Procheck: validation of protein structure coordinates[M]. Kluwer Academic Publishers, 2001: 722-725. DOI:10.1107/978095536020 60000882.
[23] COLOVOS C, YEATES T O. Verification of protein structures:patterns of nonbonded atomic interactions[J]. Protein Science, 1993,2(9): 1511-1519. DOI:10.1002/pro.5560020916.
[24] YUE L M, LEE J, ZHENG L, et al. Computational prediction integrating the inhibition kinetics of gallotannin on α-glucosidase[J].International Journal of Biological Macromolecules, 2017, 103: 829-838. DOI:10.1016/j.ijbiomac.2017.05.106.
[25] PARK H, HWANG K Y, OH K H, et al. Discovery of novel α-glucosidase inhibitors based on the virtual screening with the homology-modeled protein structure[J]. Bioorganic & Medicinal Chemistry, 2008, 16(1): 284-292. DOI:10.1016/j.bmc.2007.09.036.
[26] PARK H, HWANG K Y, KIM Y H, et al. Discovery and biological evaluation of novel α-glucosidase inhibitors with in vivo antidiabetic effect[J]. Bioorganic & Medicinal Chemistry Letters, 2008, 18(13):3711-3715. DOI:10.1016/j.bmcl.2008.05.056.
[27] 朱娟娟, 尹忠平, 陈继光, 等. 微量α-葡萄糖苷酶抑制剂筛选模型及抑制类型的判断方法[J]. 现代食品科技, 2016, 32(12): 164-170; 157.DOI:10.13982/j.mfst.1673-9078.2016.12.026.
[28] VAN DE LAAR F A, LUCASSEN P L B J, AKKERMANS R P, et al. α-Glucosidase inhibitors for type 2 diabetes mellitus[J].The Cochrane Database of Systematic Reviews, 2005(2): D3639.DOI:10.1002/14651858.CD003639.pub2.
[29] LIU Yan, MA Lin, CHEN Wenhua, et al. Binding mechanism and synergetic effects of xanthone derivatives as noncompetitive α-glucosidase inhibitors: a theoretical and experimental study[J].The Journal of Physical Chemistry B, 2013, 117(43): 13464-13471.DOI:10.1021/jp4067235.
[30] ZHANG B W, LI X, SUN W L, et al. Dietary flavonoids and acarbose synergistically inhibit α-glucosidase and lower postprandial blood glucose[J]. Journal of Agricultural and Food Chemistry, 2017, 65(38):8319-8330. DOI:10.1021/acs.jafc.7b02531.
[31] CAI C Y, RAO L, RAO Y, et al. Analogues of xanthones: chalcones and bis-chalcones as α-glucosidase inhibitors and anti-diabetes candidates[J]. European Journal of Medicinal Chemistry, 2017, 130:51-59. DOI:10.1016/j.ejmech.2017.02.007.
Inhibition Kinetics and Mechanisms of Resveratrol on α-Glucosidase
姜丽丽, 张中民, 陈道玉, 等. 白藜芦醇对α-葡萄糖苷酶的抑制动力学及抑制机制[J]. 食品科学, 2019, 40(11): 70-74.DOI:10.7506/spkx1002-6630-20180503-031. http://www.spkx.net.cn
JIANG Lili, ZHANG Zhongmin, CHEN Daoyu, et al. Inhibition kinetics and mechanisms of resveratrol on α-glucosidase[J].Food Science, 2019, 40(11): 70-74. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180503-031.http://www.spkx.net.cn