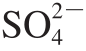 )质量分数。
)质量分数。泡叶藻(Ascophyllum nodosum)是生长在潮间带的大型海洋褐藻,分布广泛,易于收获[1]。泡叶藻用途较为广泛,除了工业上用于大规模生产褐藻胶、甘露醇和碘外,还被广泛应用于制备食品营养补充剂、饲料和肥料等[2]。泡叶藻除了富含大量的褐藻胶外,泡叶藻聚糖(ascophyllan,As)和岩藻聚糖也是泡叶藻藻体中主要的多糖组成成分,分别约占藻体总糖的13%和8%[3]。As是挪威学者Larsen等[4]从泡叶藻中分离出的区别于褐藻胶和岩藻聚糖的一种多糖硫酸酯,其主要化学组成为:岩藻糖(fucose,Fuc)(约25%)、木糖(xylose,Xyl)(约26%)、糖醛酸(约19%)、硫酸基团(约13%)、蛋白质(约12%)等[5]。通过研究泡叶藻多糖的部分酸水解片段,推测As的主链主要由β-D-甘露糖醛酸通过1,4-糖苷键链接构成,支链主要由Fuc、Xyl和硫酸基团组成[6-8]。近年来的研究指出,泡叶藻多糖具有多种优良的生物活性,如免疫诱导[9-12]、抗氧化[13-14]、抗肿瘤[15-16]、抗炎[17]活性等,使其在功能食品和生物医药领域有一定的开发和应用前景。
天然As具有多种有益的生物活性,但其单糖组成较复杂且分子质量(390 kDa)较大[18],限制了对其精细结构的解析和构效关系的研究,这也是海藻多糖开发应用中的基础科学问题之一。另外,高分子天然海藻多糖的生物利用度较低,这从另一方面限制了其在食品领域的进一步开发和应用。近年来相关研究表明,将高分子质量的海藻多糖降解成低分子质量的多糖或寡糖可有效保留原有的活性或产生新的活性[19-23],同时也使其更容易被机体吸收,提高生物利用度[22]。因此,对天然As进行有效降解,制备其高活性的低分子质量降解片段,分析其基本组成特征,可有效解决限制其在食品领域进一步开发和应用的关键科学问题,也可为其精细结构的解析和构效关系的研究提供科学依据。目前,关于As降解的研究以及降解产物中低分子质量多糖的组成特征和生物活性尚鲜有报道。本研究利用经典的多糖酸水解法和氧化降解法制备As降解产物,通过超滤法结合凝胶过滤柱层析法对降解产物进行分离和纯化,获得不同的As低分子质量降解片段,分析其基本组成特征,并利用小鼠巨噬细胞RAW264.7分析其体外免疫诱导活性,为As低分子质量降解片段的制备提供理论依据,也为As在食品领域的进一步开发和应用提供科学依据。
泡叶藻 青岛明月海藻集团;RAW264.7细胞中国科学院细胞库(上海);Sephadex G-50葡聚糖凝胶 瑞典GE公司;纤维素酶(来源于黑曲霉(Aspergillus niger))、牛血清白蛋白、葡聚糖分子质量标准品、单糖标准品(包括Fuc、Xyl、D-半乳糖(galactose,Gal)、D-甘露糖(mannose,Man)、D-葡萄糖(glucose,Glc)) 美国Sigma-Aldrich公司;对氨基苯甲酸乙酯(ethyl-p-aminobenzoate,ABEE)(纯度≥98.0%) 日本和光纯药工业株式会社;Mouse TNF-α Colorimetric ELISA kit 艾博抗(上海)贸易有限公司;超滤膜(10 kDa分子质量截留) 中国安得膜分离技术工程(北京)有限公司;其余试剂均为国产分析纯。
Avanti J26XP高速冷冻离心机 德国贝克曼公司;Free Zone 6 plus真空冷冻干燥机 美国Labconco公司;PUMP 1525高效液相色谱仪 美国沃特世公司;TSK gel G4000 PWXL液相色谱分析柱 日本东曹株式会社;BioTek Cytation-5细胞成像多功能检测系统 美国伯腾仪器有限公司;1360 Infinity超高压高效液相色谱仪(配有可变波长紫外检测器) 美国安捷伦科技有限公司;GlyScope Honenpak C18色谱柱 日本J-Oil Mills株式会社;iS50 FT-IR傅里叶变换红外光谱仪 美国赛默飞世尔科技有限公司。
1.3.1 As的提取
泡叶藻经洗净、干燥、粉碎后,过60 目标准筛,按质量比1:30将泡叶藻粉与水混匀,加入200 U/mL纤维素酶,于50 ℃水浴中酶解2 h。酶解结束后置于100 ℃水浴浸提2 h,冷却至室温,5 000×g离心20 min除去藻渣。抽提上清液用HCl溶液调至pH 1.3,于4 ℃下过夜放置,10 000×g冷冻离心20 min,去除褐藻胶沉淀。上清液用NaOH溶液调至中性后于4 ℃下用体积分数50%乙醇沉淀过夜,冷冻离心后收集沉淀,用适量蒸馏水复溶,经3 500 Da分子质量截留的透析袋透析48 h后冷冻干燥获得As[24]。
1.3.2 As低分子质量降解产物的制备
1.3.2.1 酸水解法制备低分子质量降解产物
采用1.0 mol/L HCl将As配成25.0 mg/mL多糖溶液,置于80 ℃水浴锅水解4 h(体系1),冷却至室温后,加入过量硼氢化钠进行还原。降解产物经0.45 μm滤膜过滤后,使用10 kDa分子质量截留的超滤膜进行超滤分离,收集分子质量小于10 kDa的滤液,蒸发浓缩后,用1 000 Da分子质量截留的透析袋纯水透析48 h,冷冻干燥后得到As低分子质量降解产物。
1.3.2.2 氧化降解法制备低分子质量降解产物
采用体积分数15.0% H2O2将As配成25.0 mg/mL的多糖溶液,分别置于70 ℃(体系2)和80 ℃(体系3)水浴中降解6 h,冷却至室温。分别参照1.3.2.1节中超滤法制备As的低分子质量降解产物。
1.3.3 As低分子质量降解片段的分离纯化
分别将上述3 个体系制备的As低分子质量降解产物溶于超纯水,制成3.0 mg/mL多糖溶液,经0.22 μm滤膜过滤后,取5.0 mL上Sephadex-50凝胶层析柱(1.6 cm×100 cm),利用分子质量不同对各降解产物中的低分子质量多糖片段进行分离纯化。采用超纯水进行洗脱,控制流速为0.2 mL/min。利用自动样品收集器按3.0 mL/管进行收集,连续收集80 管,并采用苯酚-硫酸法[25]在490 nm波长处对吸光度(A490 nm)进行跟踪检测,以洗脱体积为横坐标,A490 nm为纵坐标作图,绘制洗脱曲线。重复多次后,收集重复较好的洗脱峰处洗脱液,经48 h超纯水透析、冷冻干燥后获得纯化的低分子质量降解片段。
1.3.4 As低分子质量降解片段分子质量的测定
采用高效分子排阻色谱法[26]测定各降解片段的重均分子质量。分别将100 μL 2 mg/mL各样品溶液用0.22 μm滤膜过滤除杂后,上样于高效液相色谱仪。检测柱为TSK gel G4000 PWXL(7.8 mm×300 mm),流动相为0.1 mol/L硫酸钠溶液,柱温为25 ℃,流速为1.0 mL/min。以不同重均分子质量的葡聚糖(分别为1 270、5 220、11 600、23 800 Da和48 600 Da)作为标准品,以保留时间为横坐标,标准品的重均分子质量对数值为纵坐标绘制标准曲线,计算各降解片段的分子质量范围和重均分子质量。
1.3.5 As低分子质量降解片段的基本组成分析
1.3.5.1 低分子质量降解片段的酸水解
用超纯水将样品配成3.0 mg/mL多糖溶液,取2.0 mL样品溶液与2.0 mL 4.0 mol/L三氟乙酸混匀,置于100 ℃水浴中水解4 h,冷却至室温。然后加入4.0 mL甲醇,混匀,使用旋转蒸发仪将混合溶液蒸干,重复此步骤3 次。将蒸干后的水解样品溶解于2.0 mL超纯水中,4 ℃保存备用。
1.3.5.2 单糖组成分析
采用ABEE柱前衍生法[27]衍生单糖标准品和低分子质量降解片段的水解产物。分别配制一定浓度的单糖标准品溶液(Fuc、Xyl、Gal、Man、Glu),取100 μL置于具塞试管中,各加入400 μL ABEE试剂(含4.95 g ABEE、1.05 g氰基硼氢化钠、1.23 mL冰醋酸、10.5 mL温热甲醇),混匀后置于80 ℃水浴中加热1 h,取出冷却至室温。加2.0 mL超纯水和2.0 mL三氯甲烷,漩涡混匀,静置,弃去三氯甲烷相后重新加2.0 mL三氯甲烷,如此萃取3 次。取上层水相过0.22 μm微孔膜后进行高效液相色谱分析[28]。低分子质量降解片段的水解样品同样以上述方法进行分析,用单糖标准品的出峰时间和峰面积分别对样品进行定性和定量分析。
1.3.5.3 糖醛酸质量分数分析
采用咔唑-硫酸法[29],以葡萄糖醛酸为标准品,测定低分子质量降解片段的糖醛酸质量分数。
1.3.5.4 硫酸基团质量分数分析
采用氯化钡明胶比浊法[30],以K2SO4为标准品,测定低分子质量降解片段的硫酸根(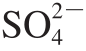 )质量分数。
)质量分数。
1.3.6 As低分子质量降解片段的傅里叶变换红外光谱分析
将As低分子质量降解片段烘干至恒质量,与KBr充分混匀、压片。使用iS50 FT-IR傅里叶变换红外光谱仪,于4 000~400 cm-1范围内扫描,记录As低分子质量降解片段的傅里叶变换红外光谱图。
1.3.7 As低分子质量降解片段体外免疫诱导活性分析1.3.7.1 RAW264.7细胞培养
RAW264.7细胞采用含质量分数10%胎牛血清、1%双抗(100 IU/mL青霉素和100 μg/mL链霉素)的DMEM培养基,在37 ℃、5.0% CO2的细胞培养箱中传代培养。
1.3.7.2 低分子质量降解片段诱导RAW264.7细胞活化释放免疫因子NO和肿瘤坏死因子能力测定
采用Griess法[31]测定NO浓度。将处于对数生长期的RAW264.7细胞以3×104 个/孔的浓度接种于96 孔细胞培养板中,于37 ℃、5% CO2的细胞培养箱中孵育24 h后,分别加入100 μL不同质量浓度(0~200 μg/mL)的As和低分子质量降解片段(HCl-F1、HCl-F2、H2O2-F1和H2O2-F2)溶液。设置DMEM培养基作为空白对照,于37 ℃、5.0% CO2细胞培养箱中培养24 h后,每孔取出50 μL上清液置于新96 孔细胞培养板中,然后向上清液中加入100 μL Griess试剂(含3 mmol/L磺胺酸、30 mg/L N-1-(萘基)乙二胺二盐酸盐、质量分数25%冰醋酸),室温避光孵育20 min,于540 nm波长处测定OD值(OD540 nm)。同时,用不同浓度的NaNO2标准溶液绘制标准曲线,计算培养基上清液中NO浓度。
肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)质量浓度测定采用酶联免疫吸附法[9]。细胞接种方法参照NO浓度测定中的方法,分别用不同质量浓度(0~200 μg/mL)的As、HCl-F1、HCl-F2、H2O2-F1和H2O2-F2溶液处理在37 ℃、5% CO2条件下贴壁培养的RAW264.7细胞24 h后,用含质量分数4%牛血清白蛋白的磷酸盐缓冲液将每孔取出的4 μL培养基上清液稀释50 倍,然后根据Mouse TNF-α Colorimetric ELISA kit说明手册中的操作步骤对稀释后培养基上清液中TNF-α进行定量测定。同时,根据不同质量浓度的TNF-α标准溶液绘制标准曲线,计算培养基上清液中TNF-α的质量浓度。
设置3 个平行实验,实验数据利用Excel 2016及Graphpad prism 5软件处理后作图,用SPSS 18.0软件单因素方差分析检验数据差异显著性,P<0.05表示差异显著,P<0.01表示差异极显著。
2.1.1 酸水解法降解片段分离纯化结果
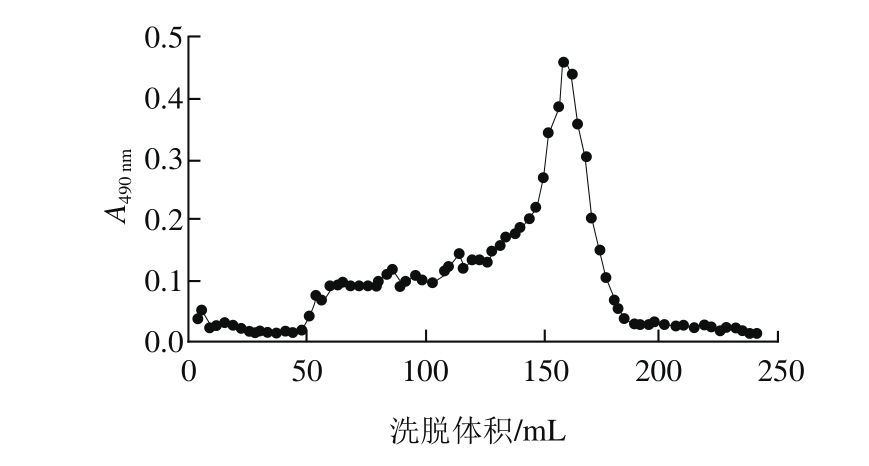
图1 As酸水解法降解片段经Sephadex G-50凝胶柱分离洗脱
Fig. 1 Elution profile of low-molecular-mass fractions of hydrochloric acid degraded ascophyllan by Sephadex G-50 gel filtration chromatography
如图1所示,得到分子质量组成较单一的峰,表明所获得的As低分子质量片段已经得到较好纯化。体系1降解产物主峰的上升段(洗脱体积为50~150 mL)分离出一个组分,命名为HCl-F1;主峰(洗脱体积为150 mL之后的峰)命名为HCl-F2。
2.1.2 氧化法降解片段分离纯化结果
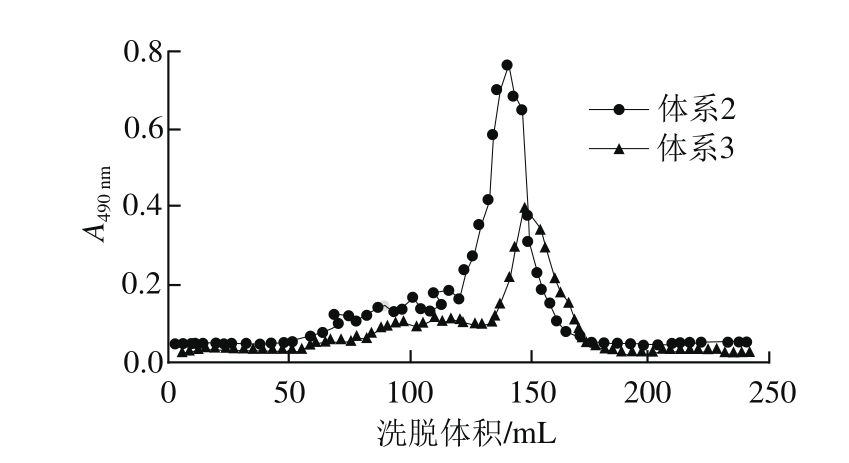
图2 As氧化法降解片段经Sephadex G-50凝胶柱分离洗脱
Fig. 2 Elution profiles of low-molecular-mass fractions of hydrogen peroxide degraded ascophyllan by Sephadex G-50 gel filtration chromatography
如图2所示,得到组成较单一峰,表明所获得As低分子质量片段已经得到较好纯化。两个体系降解产物都会出现一段缓峰,选取体系2和体系3的降解产物进行Sephadex G-50凝胶柱纯化,合并相同组分,由于上升段缓峰组分极少,收集困难,所以本研究以主峰为主要目标物进行收集。将体系2的主峰命名为H2O2-F1,将体系3的主峰命名为H2O2-F2。
As的分子质量为390 kDa[18]。酸水解法和双氧水氧化降解法均可有效降解As,降解产物经分离和纯化后获得低分子质量的片段HCl-F1、HCl-F2、H2O2-F1和H2O2-F2分子质量分布范围分别为3.70~7.00、3.40~8.90、4.00~7.50、1.60~4.20 kDa,重均分子量分别为4.80、4.20、5.30、2.30 kDa。由表1可知,低分子质量降解产物HCl-F1、HCl-F2、H2O2-F1和H2O2-F2均为杂多糖;其化学组成及单糖组成表明,酸水解法降解体系和氧化法降解体系使样品中的Fuc、Xyl、Gal、Man、硫酸根和糖醛酸质量分数发生很大的改变。HCl-F1主要由Fuc、Xyl、Gal、Man组成,其物质的量比为1.00:2.32:1.63:1.14;HCl-F2主要由Fuc、Xyl、Gal、Man组成,其物质的量比为1.00:0.20:0.30:0.28;H2O2-F1主要由Fuc和Gal组成,并含有少量Xyl,不含Man,其物质的量比为1.00:0.29:0.09;H2O2-F2主要由Fuc组成,并含有少量Xyl、Gal和Man,其物质的量比为1.00:0.06:0.03:0.04。HCl-F1、HCl-F2、H2O2-F1、H2O2-F2的糖醛酸质量分数分别为47.8%、31.3%、5.6%和27.6%,SO42-质量分数分别为0.3%、3.5%、12.2%和3.2%。
表1 HCl-F1、HCl-F2、H2O2-F1和H2O2-F2的单糖、糖醛酸和硫酸基团组成
Table 1 Monosaccharide compositions, glyconic acid and sulfation levels of HCl-F1, HCl-F2, H2O2-F1 and H2O2-F2

注:-.样品中未检测到该成分;下同。以Fuc的物质的量作为1.00。
样品 中性单糖质量分数/%(相对物质的量) 糖醛酸质量分数/%SO4 2-质量分数/%Fuc Xyl Gal Man Glc HCl-F1 5.6(1.00) 11.9(2.32)10.0(1.63) 7.0(1.14) - 47.8 0.3±0.1 HCl-F2 31.7(1.00) 5.7(0.20) 10.5(0.30) 9.7(0.28) - 31.3 3.5±0.2 H2O2-F1 56.1(1.00) 4.5(0.09) 17.9(0.29) - - 5.6 12.2±0.2 H2O2-F2 22.7(1.00) 1.3(0.06) 0.8(0.03) 0.9(0.04) - 27.6 3.2±0.1
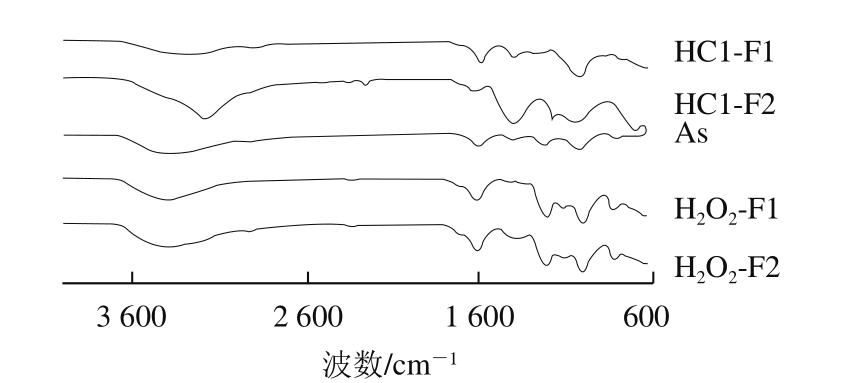
图3 As、HCl-F1、HCl-F2、H2O2-F1和H2O2-F2的傅里叶变换红外光谱图
Fig. 3 Fourier transform infrared spectra of As, HCl-F1, HCl-F2,H2O2-F1 and H2O2-F2
如图3所示,虽然有一定变化,但降解前后样品的傅里叶变换红外光谱图都具备了多糖类化合物特有的吸收峰。在3 400 cm-1附近的吸收峰为O—H伸缩振动峰,由于分子内羟基间形成氢键而使吸收峰变宽[32];在3 000~2 900 cm-1区较弱的吸收峰是C—H伸缩振动吸收,1 600 cm-1及1 400 cm-1附近的吸收峰分别是COO—的非对称伸缩振动和对称伸缩振动带,这几个区域的吸收峰是糖类的特征吸收峰[33]。HCl-F1、HCl-F2在1 200 cm-1附近的吸收峰很弱甚至没有,而H2O2-F1、H2O2-F2和As在1 200 cm-1附近有较强的吸收峰,该吸收峰是硫酸基S=O的伸缩振动吸收[34-35]。由此表明,As酸水解法降解后硫酸基团含量明显减少,证明酸水解法降解过程对硫酸根的破坏作用很大,而氧化法降解前后都含有硫酸基团,在降解过程中不存在对硫酸根的破坏,这与上述硫酸基团质量分数的测定结果基本一致。在1 000~1 200 cm-1附近的吸收峰分别是C—O—C、C—O—H的伸缩振动[36],As降解前后都存在强吸收峰。在880 cm-1附近HCl-F1、HCl-F2都存在吸收峰,其端基碳构型可能是β-D-吡喃糖;As在820 cm-1附近有吸收峰,其端基碳构型可能是α-型吡喃糖;HCl-F2在550~700 cm-1附近的吸收峰是硫酸基团的O=S=O对称和不对称变形振动所致[2]。
2.4.1 低分子质量降解片段诱导RAW264.7细胞活化释放NO的分析
表2 不同质量浓度的As、HCl-F1、HCl-F2、H2O2-F1和H2O2-F2诱导RAW264.7细胞活化产生的NO浓度
Table 2 NO levels in RAW264.7 cells induced by various concentrations of As, HCl-F1, HCl-F2, H2O2-F1 and H2O2-F2
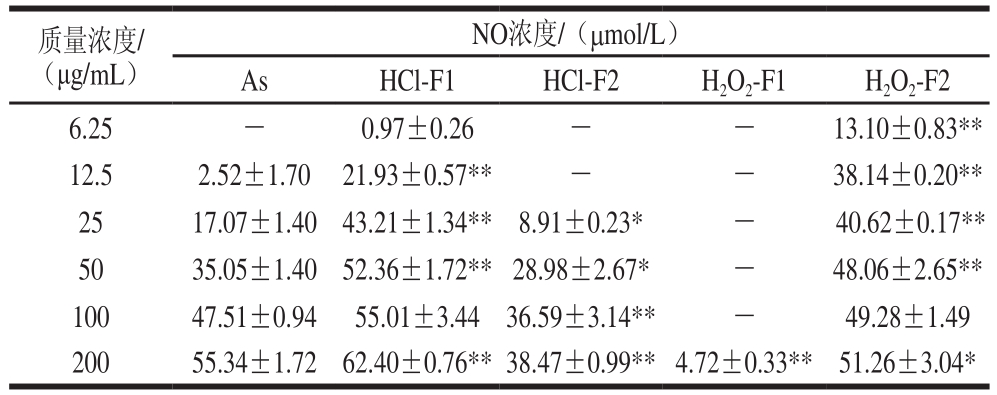
注:*.较同质量浓度的As组有显著差异(P<0.05);**.较同质量浓度的As组有极显著差异(P<0.01),下同。
质量浓度/(μg/mL)NO浓度/(μmol/L)As HCl-F1 HCl-F2 H2O2-F1 H2O2-F2 6.25 - 0.97±0.26 - - 13.10±0.83**12.5 2.52±1.70 21.93±0.57** - - 38.14±0.20**25 17.07±1.40 43.21±1.34** 8.91±0.23* - 40.62±0.17**50 35.05±1.40 52.36±1.72**28.98±2.67* - 48.06±2.65**100 47.51±0.94 55.01±3.44 36.59±3.14** - 49.28±1.49 200 55.34±1.72 62.40±0.76**38.47±0.99**4.72±0.33** 51.26±3.04*
表2结果表明,As、HCl-F1、HCl-F2、H2O2-F2在所测定质量浓度范围(0~200 μg/mL)内明显诱导RAW264.7细胞活化释放NO,且RAW264.7细胞释放NO的浓度随着其质量浓度增加而增加,呈质量浓度依赖性,表明As经过降解后获得的低分子质量降解片段仍可有效活化RAW264.7细胞释放NO。HCl-F1和H2O2-F2诱导RAW264.7细胞产生NO的作用比As强,并且存在显著性差异;HCl-F2诱导细胞产生NO的作用比As弱;而H2O2-F1诱导RAW264.7细胞产生NO的作用明显低于HCl-F1、HCl-F2和H2O2-F2。
2.4.2 低分子质量降解片段诱导RAW264.7细胞活化分泌TNF-α质量浓度
表3结果表明,在所测定的质量浓度范围(0~200 μg/mL)内,As、HCl-F1、HCl-F2和H2O2-F2能明显诱导RAW264.7细胞活化分泌TNF-α,且呈浓度依赖性。表明As经过降解后获得的低分子质量降解片段仍可有效诱导RAW264.7细胞活化分泌TNF-α。H2O2-F2和HCl-F1诱导RAW264.7细胞分泌TNF-α的作用最强,且极显著强于As;HCl-F2促进TNF-α分泌的活性作用弱于As;而As经过氧化降解获得的组分H2O2-F1活化RAW264.7细胞分泌TNF-α的活性低于HCl-F1、HCl-F2和H2O2-F2。
表3 不同质量浓度的As、HCl-F1、HCl-F2、H2O2-F1和H2O2-F2诱导RAW264.7细胞活化产生TNF-α质量浓度
Table 3 TNF-α levels in RAW264.7 cells induced by various concentrations of As, HCl-F1, HCl-F2, H2O2-F1 and H2O2-F2
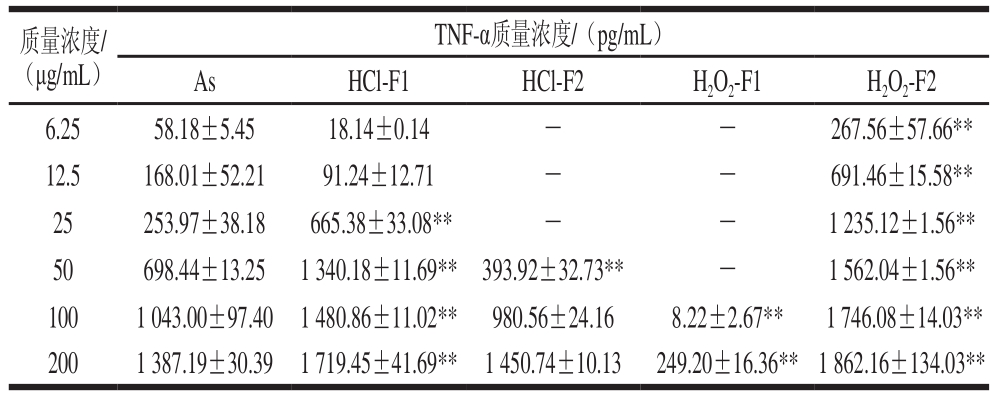
质量浓度/(μg/mL)TNF-α质量浓度/(pg/mL)As HCl-F1 HCl-F2 H2O2-F1 H2O2-F2 6.25 58.18±5.45 18.14±0.14 - - 267.56±57.66**12.5 168.01±52.21 91.24±12.71 - - 691.46±15.58**25 253.97±38.18 665.38±33.08** - - 1 235.12±1.56**50 698.44±13.25 1 340.18±11.69** 393.92±32.73** - 1 562.04±1.56**100 1 043.00±97.40 1 480.86±11.02** 980.56±24.16 8.22±2.67** 1 746.08±14.03**200 1 387.19±30.39 1 719.45±41.69** 1 450.74±10.13 249.20±16.36**1 862.16±134.03**
本研究采用酸水解法和氧化降解法降解As,通过超滤法结合凝胶过滤柱层析法对降解产物进行分离和纯化,得到了4 个As低分子质量降解片段:HCl-F1、HCl-F2、H2O2-F1和H2O2-F2。基本组成分析结果表明HCl-F1、HCl-F2、H2O2-F1、H2O2-F2均为杂多糖且单糖和硫酸基团组成存在较大差异,但其重均分子质量相近。体外免疫诱导活性分析结果表明As、HCl-F1、HCl-F2和H2O2-F2均具有明显的免疫诱导活性,并且由As降解得到的HCl-F1和H2O2-F2的免疫诱导活性较As均有明显提高,而H2O2-F1免疫诱导活性较弱。结合化学组成和活性研究综合分析表明,As低分子质量片段的免疫诱导活性是由单糖组成和硫酸根质量分数共同决定的。本研究不仅可为As及其他海藻多糖低分子质量降解片段的制备提供参考,也为As在食品和医药领域的进一步开发和应用提供依据。
[1] KADAM S U, ALVAREZ C, TIWARI B K, et al. Extraction and characterization of protein from Irish brown seaweed Ascophyllum nodosum[J]. Food Research International, 2017, 99: 1021-1027.DOI:10.1016/j.foodres.2016.07.018.
[2] 曲桂燕. 五种褐藻岩藻聚糖硫酸酯提取纯化及其功能活性的比较研究[D]. 青岛: 中国海洋大学, 2013: 3-5. DOI:10.7666/d.D326849.
[3] NAKAYASU S, SOEGIMA R, YAMAGUCHI K, et al. Biological activities of fucose-containing polysaccharide ascophyllan isolated from the brown aalga Ascophyllum nodosum[J]. Bioscience Biotechnology & Biochemistry, 2009, 73(4): 961-964. DOI:10.1271/bbb.80845.
[4] LARSEN B, HAUG A, PAINTER T, et al. Sulphated polysaccharides in brown algae. I. isolation and preliminary characterisation of three sulphated polysaccharides from Ascophyllum nodosum (L.) Le Jol[J].Acta Chemica Scandinavica, 1966, 20: 219-230. DOI:10.3891/acta.chem.scand.20-0219.
[5] 王晶. 海带褐藻多糖硫酸酯的结构、化学修饰与生物活性研究[D].青岛: 中国科学院研究生院(海洋研究所), 2010: 15.
[6] LARSEN B, HAUG A, PAINTER T J. Sulphated polysaccharides in brown algae. 3. the native state of dfucoidan in Ascophyllum nodosum and fucus vesiculosus[J]. Acta Chemica Scandinavica, 1970, 24(9):3339-3352. DOI:10.3891/acta.chem.scand.24-3339.
[7] KLOAREG B, DEMARTY M, MABEAU S. Polyanionic characteristics of purified sulphated homofucans from brown algae[J].International Journal of Biological Macromolecules, 1986, 8(6):380-386. DOI:10.1016/0141-8130(86)90060-7.
[8] MEDCALF D G, LARSEN B. Structural studies on ascophyllan and the fucose-containing complexes from the brown alga Ascophyllum nodosum[J]. Carbohydrate Research, 1977, 59(2): 539-546.DOI:10.1016/S0008-6215(00)83191-2.
[9] JIANG Z D, OKIMURA T, KENICH Y, et al. The potent activity of sulfated polysaccharide, ascophyllan, isolated from Ascophyllum nodosum to induce nitric oxide and cytokine production from mouse macrophage RAW264.7 cells: comparison between ascophyllan and fucoidan[J]. Nitric Oxide Biology & Chemistry, 2011, 25(4): 407-415.DOI:10.1016/j.niox.2011.10.001.
[10] NAKANO K, KIM D, JIANG Z D, et al. Immunostimulatory activities of the sulfated polysaccharide ascophyllan from Ascophyllum nodosum in in vivo and in vitro systems[J]. Bioscience Biotechnology and Biochemistry, 2012, 76(8): 1573-1576. DOI:10.1271/bbb.120232.
[11] WANG Y, JIANG Z, KIM D, et al. Stimulatory effect of the sulfated polysaccharide ascophyllan on the respiratory burst in RAW264.7 macrophages[J]. International Journal of Biological Macromolecules,2012, 52(1): 164-169. DOI:10.1016/j.ijbiomac.2012.09.008.
[12] ZHANG W, DU J Y, JIANG Z, et al. Ascophyllan purified from Ascophyllum nodosum induces Th1 and Tc1 immune responses by promoting dendritic cell maturation[J]. Marine Drugs, 2014, 12(7):4148-4164. DOI:10.1016/j.ijbiomac.2012.09.008.
[13] 刘旭, 曲桂燕, 周裔彬, 等. 泡叶藻及海带藻渣中岩藻聚糖硫酸酯的提取及其抗氧化活性[J]. 海洋科学, 2013, 37(12): 34-39.
[14] ABU R, JIANG Z, UENO M, et al. In vitro antioxidant activities of sulfated polysaccharide ascophyllan isolated from Ascophyllum nodosum[J]. International Journal of Biological Macromolecules,2013, 59(4): 305-312. DOI:10.1016/j.ijbiomac.2013.04.035.
[15] ABU R, JIANG Z, UENO M, et al. Anti-metastatic effects of the sulfated polysaccharide ascophyllan isolated from Ascophyllum nodosum on B16 melanoma[J]. Biochemical & Biophysical Research Communications, 2015, 458(4): 727-732. DOI:10.1016/j.bbrc.2015.01.061.
[16] JIANG Z, ABU R, ISAKA S, et al. Inhibitory effect of orallyadministered sulfated polysaccharide ascophyllan isolated from Ascophyllum nodosum on the growth of sarcoma-180 solid tumor in mice[J]. Anticancer Research, 2014, 34(4): 1663-1672. DOI:10.1245/s10434-014-3495-y.
[17] MOHSIN S, KURUP G M, MAHADEVAN R. Effect of ascophyllan from brown algae Padina tetrastromaticaon inflammation and oxidative stress in carrageenan-induced rats[J]. Inflammation, 2013,36(6): 1268-1278. DOI:10.1007/s10753-013-9665-4.
[18] JIANG Z, UENO M, NISHIGUCHI T, et al. Importance of sulfate groups for the macrophage-stimulating activities of ascophyllan isolated from the brown alga Ascophyllum nodosum[J]. Carbohydrate Research, 2013, 380: 124-129. DOI:10.1016/j.carres.2013.05.018.
[19] DEUX J F, MEDDIAHIPELLE A, LE B A, et al. Low molecular weight fucoidan prevents neointimal hyperplasia in rabbit iliac artery in-stent restenosis model[J]. Arteriosclerosis, Thrombosis,and Vascular Biology, 2002, 22(10): 1604-1609. DOI:10.1161/01.ATV.0000032034.91020.0A.
[20] YE J, LI Y P, TERUYA K, et al. Enzyme-digested fucoidan extracts derived from seaweed Mozuku of Cladosiphon novae-caledoniae kylin inhibit invasion and angiogenesis of tumor cells[J]. Cytotechnology,2005, 47(1/2/3): 117-126. DOI:10.1007/s10616-005-3761-8.
[21] ZHAO T T, ZHANG Q B, QI H M, et al. Degradation of porphyran from Porphyra haitanensis and the antioxidant activities of the degraded porphyrans with different molecular weight[J]. International Journal of Biological Macromolecules, 2006, 38(1): 45-50.DOI:10.1016/j.ijbiomac.2005.12.018.
[22] ZHAO X, GUO F J, HU J. et al. Antithrombotic activity of oral administered low molecular weight fucoidan from Laminaria japonica[J]. Thrombosis Research, 2016, 144: 46-52. DOI:10.1016/j.thromres.2016.03.008.
[23] LI B, LIUS, XING R, et al. Degradation of sulfated polysaccharides from Enteromorpha prolifera and their antioxidant activities[J].Carbohydrate Polymers, 2013, 92(2): 1991-1996. DOI:10.1016/j.carbpol.2012.11.088.
[24] 韦敬柳乙, 陈艳红, 杜希萍, 等. 泡叶藻聚糖脱色工艺的研究[J].集美大学学报(自然科学版), 2017, 22(6): 24-33. DOI:10.3969/j.issn.1007-7405.2017.06.004.
[25] 杨贤庆, 刘名求, 戚勃, 等. 龙须菜中多糖含量测定方法的比较研究[J]. 食品工业科技, 2013, 34(22): 54-57. DOI:10.13386/j.issn1002-0306.2013.22.017.
[26] 李楠, 李卓, 张燕, 等. 高效分子排阻色谱法同时测定白及多糖分子量和含量[J]. 药物分析杂志, 2012, 32(10): 1801-1803.DOI:10.16155/j.0254-1793.2012.10.013.
[27] YASUNO S, KOKUBO K, KAMEI M. New method for determining the sugar composition of glycoproteins, glycolipids, and oligosaccharides by high-performance liquid chromatography[J].Bioscience Biotechnology & Biochemistry, 1999, 63(8): 1353-1359.DOI:10.1271/bbb.63.1353.
[28] YASUNO S, MURATA T, KOKUBO K, et al. Two-mode analysis by high-performance liquidchromatography of ρ-aminobenzoic ethyl ester-derivatized monosaccharides[J]. Bioscience Biotechnology &Biochemistry, 1997, 61(11): 1944-1946. DOI:10.1271/bbb.61.1944.
[29] BITTER T, MUIR H M. A modified uronic acid carbazole reaction[J].Analytical Biochemistry, 1962, 4(4): 330-334. DOI:10.1016/0003-2697(62)90095-7.
[30] KAWAI Y, SENO N, ANNO K. A modified method for chondrosulfatase assay[J]. Analytical Biochemistry, 1969, 32(2):314-321. DOI:10.1016/0003-2697(69)90091-8.
[31] KIM D, YAMASAKI Y, JIANG Z D, et al. Comparative study on modeccin- and phytohemagglutinin (PHA) -induced secretion of cytokines and nitric oxide (NO) in RAW264.7 cells[J]. Acta Biochimica et Biophysica Sinica, 2011, 43(1): 52-60. DOI:10.1093/abbs/gmq105.
[32] AKANDA M R, PARK B Y. Involvement of MAPK/NF-κB signal transduction pathways: Camellia japonica mitigates inflammation and gastric ulcer[J]. Biomedicine & Pharmacotherapy, 2017, 95: 1139-1146. DOI:10.1016/j.biopha.2017.09.031.
[33] LIAO X. The hypoglycemic effect of a polysaccharide (GLP) from Gracilaria lemaneiformis and its degradation products in diabetic mice[J]. Food & Function, 2015, 6(8): 2542-2549. DOI:10.1039/c4fo01185f.
[34] SOUZA B W S, CERQUEIRA M A, BOURBON A I, et al. Chemical characterization and antioxidant activity of sulfated polysaccharide from the red seaweed Gracilaria birdiae[J]. Food Hydrocolloids, 2012,27(2): 287-292. DOI:10.1016/j.foodhyd.2011.10.005.
[35] SUDHARSAN S. Antioxidant and anticoagulant activity of sulfated polysaccharide from Gracilaria debilis (Forsskal)[J]. International Journal of Biological Macromolecules, 2015, 81(1): 1031-1038.DOI:10.1016/j.ijbiomac.20.15.09.046.
[36] ZHAN Y Z. Functional groups and antioxidant activities of polysaccharides from five categories of tea[J]. Industrial Crops &Products, 2014, 58(1): 31-35. DOI:10.1016/j.indcrop.2014.04.004.
Composition and in Vitro Immunostimulatory Activity of Low-Molecular-Mass Fractions of Chemically Degraded Ascophyllan from Ascophyllum nodosum
何萍萍, 韦敬柳乙, 姜泽东, 等. 泡叶藻聚糖低分子质量降解片段组成特征及其体外免疫诱导活性[J]. 食品科学, 2019,40(11): 139-145. DOI:10.7506/spkx1002-6630-20180610-122. http://www.spkx.net.cn
HE Pingping, WEI Jingliuyi, JIANG Zedong, et al. Composition and in vitro immunostimulatory activity of low-molecularmass fractions of chemically degraded ascophyllan from Ascophyllum nodosum[J]. Food Science, 2019, 40(11): 139-145. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180610-122. http://www.spkx.net.cn