蜂花粉是指蜜蜂采集显花植物的花粉,并向其中加入花蜜和自身分泌物混合而成的不规则扁圆形团状物[1]。由于其含有丰富的蛋白质、不饱和脂肪酸、多糖、维生素、酚类等,被誉为“天然营养库”。这些对健康有益的生物活性物质使得蜂花粉有抗氧化、抗癌、降低胆固醇和增强免疫等生理保健功能,近年来对其抗氧化、保肝、抗癌等作用的研究已成为热潮[2-6]。
五味子(Schisandra chinensis)是一种药用植物,在各国药典中被广泛使用,其作为一种传统中药已有数千年临床诊疗历史[7-8]。五味子蜂花粉产量大、分布广、抗氧化活性强,因此有一定的研究价值。本课题组前期研究发现,五味子蜂花粉粗提物含有丰富的酚类化合物,对四氯化碳引起的小鼠肝损伤有显著的保护作用。为了探究五味子蜂花粉酚类物质组成,明确其中高抗氧化活性酚类物质的分布,本研究采用不同极性的溶剂对其粗提物进行萃取,测定不同萃取物的总酚、总黄酮含量和Fe2+络合能力、还原力及清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的能力,探讨其对小鼠肝脏脂质过氧化的抑制作用及对质粒DNA氧化损伤的保护作用,旨在为五味子蜂花粉高抗氧化活性酚类物质的分离纯化提供依据。
五味子蜂花粉由陕西老蜂农生物科技有限责任公司提供。C57BL6小鼠:雄性,体质量18~22 g,由西安交通大学医学院提供。实验动物生产许可证号:SCXK(陕)2018-001;使用许可证号:SYXK(陕)2015-002。
没食子酸、芦丁、DPPH、乙二胺四乙酸二钠(ethylene diamine tetraacetic acid based sodium salt,Na2EDTA)、水溶性VE(Trolox)、三吡啶基三嗪(2,4,6-tri(2-pyridyl)-S-triazine,TPTZ)、牛血清白蛋白、铁试剂(FerroZine) 美国Sigma公司;pBR322质粒DNA 日本Takara生物医药公司;琼脂糖 美国Bio-Rad公司;甲醇(色谱级) 德国Merck公司;其他试剂均为国产分析纯。
U3000高效液相色谱(high performance liquid chromatography,HPLC)仪 美国Thermo Fisher公司;R-1050Ex旋转蒸发仪 郑州长城科工贸有限公司;CP224C电子分析天平 奥豪斯仪器(上海)有限公司;L5S紫外-可见分光光度计 上海仪电分析仪器有限公司;DYY-8D电泳仪 北京六一生物科技有限公司;UVP Gelstudio touch凝胶成像仪 德国耶拿分析仪器股份公司;HH-501超级恒温水浴锅 天津市鑫博得仪器有限公司。
1.3.1 五味子蜂花粉不同萃取物的提取与分离
将5 kg五味子蜂花粉粉碎后加入30 倍体积的体积分数75%乙醇溶液浸泡24 h,取上清液,剩余残渣重复以上操作1 次,合并两次提取液进行过滤,40 ℃旋转蒸发浓缩至无醇味。提取物中加入适量蒸馏水进行分散,形成均一悬浊液,依次加入石油醚、乙酸乙酯、正丁醇进行萃取。将得到的不同极性萃取液40 ℃浓缩至浸膏,置于-4 ℃冰箱中保存备用。分别得到石油醚层萃取物228.41 g,乙酸乙酯层萃取物12.0 g,正丁醇层萃取物175.2 g。
1.3.2 HPLC分析五味子蜂花粉不同萃取物活性成分
ZORBAX SB-C18硅烷色谱柱(250 mm×4.6 mm,5 μm);流动相A:甲醇、流动相B:0.1%(体积分数,下同)甲酸;梯度洗脱程序为:0 min,5%流动相A;10 min,15%流动相A;20 min,15%流动相A;25 min,17%流动相A;30 min,30%流动相A;50 min,40%流动相A;60 min,55%流动相A;70 min,80%流动相A;75 min,85%流动相A;78 min,10%流动相A;85 min,5%流动相A;流速为1.0 mL/min;二极管阵列检测器;检测波长分别为254、280、290、324 nm;柱温为30 ℃。
1.3.3 总酚含量的测定
参照Zhou Juan等[9]的方法,使用Folin-Ciocalteu法测定五味子蜂花粉不同萃取物的总酚含量。将已分离的五味子蜂花粉正丁醇萃取物、乙酸乙酯萃取物、石油醚萃取物分别配制成质量浓度为1.0 mg/mL的待测样液,准确移取0.2 mL不同萃取物待测液,加入1 mL Folin-Ciocalteu显色剂,混匀后加入5 mL 1 mol/L Na2CO3溶液,用蒸馏水定容至10 mL,混合均匀,在室温条件下避光放置1 h,于760 nm波长处测吸光度。总酚含量表示为每100 g浸膏相当于没食子酸的质量。
1.3.4 总黄酮含量的测定
参照Blasa等[10]的方法并稍作修改。准确移取质量浓度为1.0 mg/mL不同萃取物待测液1.0 mL,分别加入5%(质量分数,下同)NaNO2溶液0.4 mL,摇匀,室温放置6 min。加入10% Al(NO3)3溶液0.4 mL,摇匀放置6 min。加入4% NaOH溶液4 mL,再用80%甲醇溶液定容至10 mL,摇匀,室温下静置15 min,于510 nm波长处测定吸光度。总黄酮含量表示为每100 g浸膏相当于芦丁的质量。
1.3.5 对Fe2+络合能力的测定
在Singh等[11]的方法上加以改进。准确移取质量浓度为1.0 mg/mL的不同萃取物待测液0.2 mL,加入1 mmol/L FeSO4溶液0.1 mL和1 mmol/L铁试剂0.3 mL,并用甲醇定容至3.0 mL,混匀,反应10 min后在562 nm波长处测吸光度。以不加样品溶液为参比,Na2EDTA为阳性对照,Fe2+络合能力表示为每克浸膏相当于Na2EDTA的质量。
1.3.6 还原力的测定
参照Benzie等[12]的方法。将正丁醇、乙酸乙酯、石油醚萃取物分别配制成质量浓度为0.01、0.1、1.0 mg/mL的待测样液,分别向试管中加入1.0 mL待测样液,再加入TPTZ工作液(包括300 mmol/L pH 3.6醋酸盐缓冲液25.0 mL、10 mmol/L TPTZ溶液2.5 mL、20 mmol/L FeCl3溶液2.5 mL)4.0 mL,混匀,于37 ℃恒温水浴10 min后在593 nm波长处测定吸光度。以Trolox为标准品,还原力表示为每毫克浸膏相当于Trolox的质量。
1.3.7 DPPH自由基清除能力的测定
对Rodrigo等[13]的方法进行改进。将DPPH标准品配制成0.04 mg/mL甲醇溶液,于棕色具塞试管中分别加入不同质量浓度待测样液0.6 mL,再加入上述DPPH溶液5.0 mL,混匀,避光反应1 h,于517 nm波长处测吸光度。根据公式(1)计算DPPH自由基清除率。
式中:A空白为以甲醇代替样品吸光度;A样品为样品组吸光度。
分别计算不同萃取物溶液半抑制浓度(half maximal inhibitory concentration,IC50)。
1.3.8 对·OH诱导的pBR322质粒DNA氧化损伤保护作用的测定
参考Yeung等[14]的方法进行测定。实验组加入1 μL DNA、1 μL 1.0 mmol/L FeSO4(诱导剂)、1 μL体积分数1% H2O2、4 μL 1 mg/mL样品溶液、50 mmol/L pH 7.0磷酸盐缓冲液定容至15 μL,模型组不加样品溶液,正常组不加FeSO4和H2O2。混匀,37 ℃温育30 min,加入1 μL Goldenview染色,采用琼脂糖凝胶电泳分离法检测DNA条带。电泳时间90 min,电压50 V。结果采用凝胶呈像仪拍照,用Quantity One软件分析电泳各条带的OD值,软件自动计算对应条带曲线下面积,从而计算DNA双链与开链的比例。
1.3.9 抑制小鼠肝脏脂质过氧化能力的测定
颈椎脱臼法处死小鼠,取出肝脏用冰生理盐水洗去血渍并沥干,制成质量分数10%肝匀浆。3 000 r/min离心15 min,取上清液稀释10 倍体积得质量分数1%肝匀浆待用。
参考曹炜等[15]的方法并稍加改进。样品管取1.0 mL 1%肝匀浆上清液,再加入不同体积的样品溶液,混匀,加入200 μL 6 mmol/L FeSO4溶液和80 μL 60 mmol/L H2O2溶液作为诱导剂,以磷酸盐缓冲液补足2.0 mL。模型管不加样品溶液,空白管不加诱导剂,然后将空白管、模型管和样品管一同置于37 ℃温浴1 h,每10 min振摇一次。温浴完成后冰浴10 min以终止反应。向各管加入质量分数1%三氯乙酸1.0 mL和0.8%硫代巴比妥酸1 mL,混匀,置于100 ℃沸水浴15 min,立即用自来水冷却,6 000 r/min离心10 min,取上清液于532 nm波长处测吸光度。按公式(2)计算抑制率。
式中:A模型、A空白、A样品分别为模型管、空白管、样品管吸光度。
实验结果均表示为3 次测定的 ±s。利用SAS 8.1软件对实验数据进行方差分析,P<0.05为差异显著。采用Origin 8.0软件作图。
HPLC法可以定性评价混合物中抗氧化成分的相对强弱[16-17],Almaraz-Abarca等[18]通过HPLC分析了不同植物源花粉的酚类成分,而对于五味子蜂花粉不同萃取物酚类分布的研究较少。由图1可知,不同萃取物峰数量、保留时间、响应值存在极大差异。正丁醇萃取物峰数量较少,各峰的保留时间主要在50~60 min,响应值高;主要为极性较强的物质,虽种类较少,但含量较高。乙酸乙酯萃取物峰数量多,在各时间段都有大量的峰,40 min和60 min左右峰数量最多且有较高响应值,但明显小于正丁醇萃取物,表明乙酸乙酯萃取物所含物质种类很多,但含量不高。石油醚萃取物的峰数量较少且响应值极小,大多出现在15~25 min。比较3 种萃取物,正丁醇萃取物的峰保留时间主要为60 min左右,且响应值明显高于乙酸乙酯和石油醚萃取物。
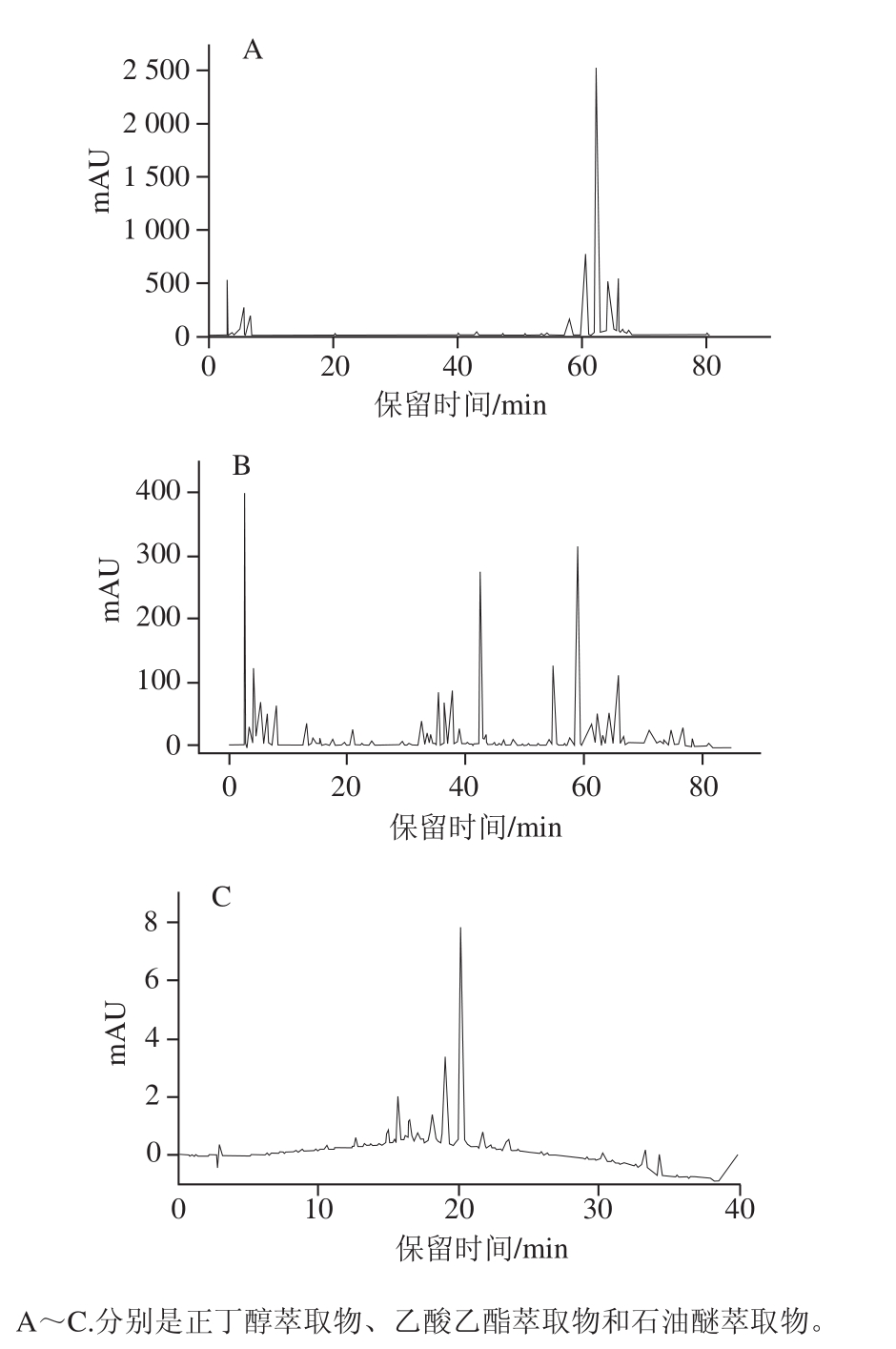
图1 五味子蜂花粉不同萃取物HPLC图
Fig. 1 HPLC of different solvent extracts from S. chinensis bee pollen
表1 五味子蜂花粉不同萃取物总酚、总黄酮含量、Fe2+络合能力及抗氧化能力
Table 1 Contents of total phenols and total flavonoids and Fe2+-chelating capacity as well as antioxidant activity of different solvent extracts from S. chinensis bee pollen
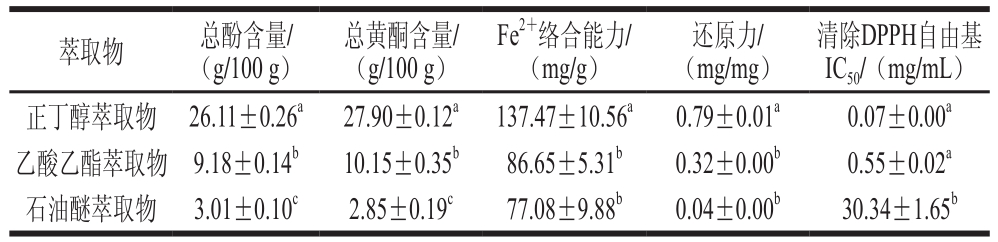
注:同列肩标小写字母不同代表差异显著(P<0.05)。
萃取物 总酚含量/(g/100 g)总黄酮含量/(g/100 g)Fe2+络合能力/(mg/g)还原力/(mg/mg)清除DPPH自由基IC50/(mg/mL)正丁醇萃取物 26.11±0.26a 27.90±0.12a 137.47±10.56a 0.79±0.01a 0.07±0.00a乙酸乙酯萃取物 9.18±0.14b 10.15±0.35b 86.65±5.31b 0.32±0.00b 0.55±0.02a石油醚萃取物 3.01±0.10c 2.85±0.19c 77.08±9.88b 0.04±0.00b 30.34±1.65b
如表1所示,五味子蜂花粉不同萃取物总酚含量存在显著差异(P<0.05),正丁醇萃取物中总酚含量最高,达到26.11 g/100 g,乙酸乙酯萃取物次之,石油醚萃取物总酚含量最低,只有3.01 g/100 g,不足正丁醇萃取物的12%。Huang Haibo等[19]测得五味子蜂花粉粗提物总酚含量为5.29 g/100 g,远低于本研究中正丁醇萃取物,可见五味子蜂花粉中的酚类物质集中分布于正丁醇萃取物中,在乙酸乙酯和石油醚萃取物中只有少量分布。
如表1所示,正丁醇萃取物中总黄酮含量最高,达到27.90 g/100 g,石油醚萃取物中总黄酮含量最低,只有2.85 g/100 g;不同萃取物中总黄酮含量存在显著差异(P<0.05),正丁醇萃取物约是乙酸乙酯萃取物的3 倍、石油醚萃取物的10 倍。Huang Haibo等[19]在研究五味子蜂花粉保肝护肾作用时测得其粗提物中总黄酮含量为3.03 g/100 g,介于本研究正丁醇萃取物和石油醚萃取物之间。在五味子蜂花粉不同萃取物中总黄酮含量排序为:正丁醇萃取物>乙酸乙酯萃取物>石油醚萃取物,与其总酚含量排序相同。
Fe2+能够催化Fenton反应的进行,生成·OH,对机体产生氧化应激。酚类物质能与Fe2+络合,阻止Fenton反应的发生,实现抗氧化作用[20]。如表1所示,每克正丁醇萃取物的络合能力相当于137.47 mg Na2EDTA;各萃取物均有较高的络合能力,其中正丁醇萃取物的络合能力显著高于乙酸乙酯和石油醚萃取物(P<0.05),约是其2 倍;而乙酸乙酯萃取物与石油醚萃取物无显著性差异,可见在正丁醇萃取物中大量存在的酚类化合物可以络合Fe2+,有较强的抗氧化作用。
还原力是指某种物质提供电子与活泼自由基反应后转化为较为稳定的物质,能够不再让自由基链式反应继续进行,从而阻止自由基对人体的伤害[21-22]。样品的还原力越强,其抗氧化性就越强,表示其越能供应电子,将Fe3+还原为Fe2+,并与自由基反应生成更稳定的物质。如表1所示,正丁醇萃取物的还原力最高,每毫克该提取物的还原力相当于0.79 mg Trolox,约是乙酸乙酯萃取物(相当于0.32 mg Trolox)的2.5 倍,石油醚萃取物最低。可见总酚和总黄酮含量越高,还原力就越强。已有多项研究证实还原力与总酚酸含量有较强相关性[23]。
DPPH自由基是一种稳定的有机自由基,其溶液呈深紫色,在517 nm波长处有强吸收,当与抗氧化剂共存时,DPPH自由基与抗氧化剂提供的氢离子相结合,使体系颜色由紫色变为淡黄色,吸光度降低并达到稳定(AH+DPPH自由基→DPPH-H+A·(A为抗氧化剂))[24]。在质量浓度为0.01~100 mg/mL时,正丁醇萃取物DPPH自由基清除率从3.66%增加至94.16%,乙酸乙酯萃取物最高,达56.30%,而石油醚萃取物增长缓慢。如表1所示,正丁醇和乙酸乙酯萃取物清除DPPH自由基的IC50较低(分别为0.07 mg/mL和0.55 mg/mL),即二者清除DPPH自由基能力相近,显著低于IC50为30.34 mg/mL的石油醚萃取物,尤其是正丁醇萃取物,其DPPH自由基清除能力是石油醚萃取物的400多倍。
当氧化应激的诱导剂Fe2+和H2O2混合后,Fenton反应(Fe2++H2O2→Fe3++·OH+-OH)立即发生。其产物·OH能够对DNA产生攻击作用,导致超螺旋结构断裂[25-26]。样品中的酚类物质能够通过络合Fe2+或者清除H2O2,阻止Fenton反应的发生,从而避免DNA损伤。此外酚类物质也能通过直接清除Fenton反应的产物·OH保护DNA。由图2和表2可见,五味子蜂花粉不同萃取物对·OH引起的质粒DNA氧化损伤均有保护作用。正常质粒DNA在电泳条件下有92.12%是完整的双链DNA,模型组在诱导剂的作用下96.69%的双链DNA被损伤为开链状态。而在最终质量浓度0.27 mg/mL不同蜂花粉萃取物的作用下,开链DNA的比例分别降至8.04%、35.56%、47.93%,表明0.27 mg/mL正丁醇萃取物能够完全保护DNA,防止其受到氧化损伤。乙酸乙酯和石油醚萃取物对DNA氧化损伤均具有一定的保护作用。已有研究证实花粉提取物对DNA氧化应激损伤具有保护作用,Cheng Ni等[27]研究的山里红蜂花粉粗提物在质量浓度为2.67 mg/mL时质粒DNA损伤比例降至40%左右,可见3 个不同五味子蜂花粉萃取物对·OH引起的质粒DNA损伤的保护作用明显优于山里红蜂花粉粗提物。

图2 五味子蜂花粉不同萃取物对·OH引起pBR322质粒DNA断裂的保护作用
Fig. 2 Protective effects of different solvent extracts from S. chinensis bee pollen on hydroxyl radical-mediated pBR322 DNA damage
表2 五味子蜂花粉不同萃取物对·OH引起pBR322质粒DNA断裂的保护作用
Table 2 Protective effects of different solvent extracts from S. chinensis bee pollen on hydroxyl radical-mediated pBR322 DNA damage

注:泳道1. 1 μL pBR322质粒DNA(对照组);泳道2. 1 μL pBR322质粒DNA+1 μL 1 mmol/L FeSO4+1 μL 1% H2O2(模型组);泳道3~5.1 μL pBR322 质粒DNA+1 μL 1 mmol/L FeSO4+1 μL 1% H2O2+4 μL 1 mg/mL不同萃取物(分别为石油醚、乙酸乙酯、正丁醇萃取物)。
指标 泳道1 泳道2 泳道3 泳道4 泳道5开链比例/% 7.88±0.46 96.69±0.73 47.93±1.96 35.56±2.16 8.04±0.61双链比例/% 92.12±0.46 3.31±0.73 53.27±1.96 64.35±2.16 91.96±0.61
在自由基和一些氧化引发剂的作用下,不饱和脂肪酸生成自由基中间产物,进一步形成脂质过氧化物,脂质过氧化反应的终产物是丙二醛,与硫代巴比妥酸反应产生红色物质,并可通过比色法进行定量分析。因此,丙二醛的含量可以作为脂质过氧化的指标[28-30]。五味子蜂花粉中含有丰富的酚类化合物,其提取物有较强的抗氧化活性,对急性肝毒性具有显著的保护作用。其保肝作用可能与其自由基清除、增加抗氧化活性和抑制脂质过氧化有关[31]。由图3可知,不同萃取物对丙二醛的生成均有抑制作用,随着质量浓度的增加,抑制率也相应升高。正丁醇和乙酸乙酯萃取物的抑制作用较明显,在质量浓度为0.2 mg/mL时二者分别达到85.5%和80.1%,石油醚萃取物的抑制率随质量浓度增加而迅速增大,在0.2 mg/mL时接近60%。3 个部位对小鼠肝组织脂质过氧化的抑制率排序为:正丁醇萃取物>乙酸乙酯萃取物>石油醚萃取物。
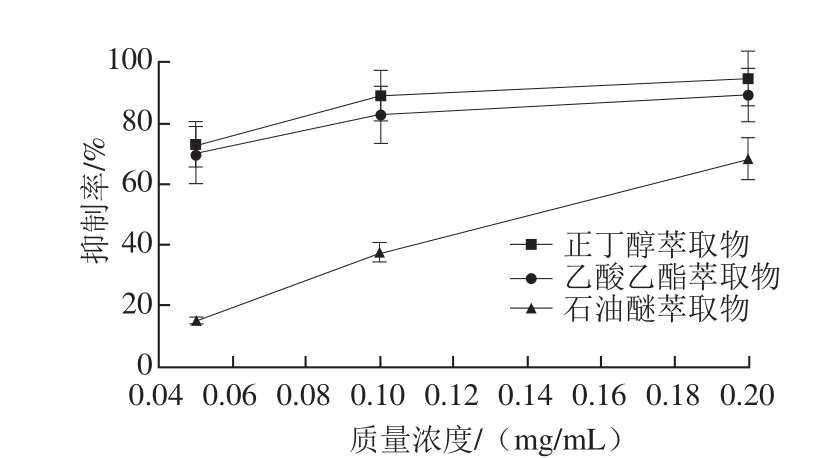
图3 五味子花粉不同萃取物对脂质过氧化的抑制率
Fig. 3 Inhibition percentage of lipid peroxidation by different solvent extracts from S. chinensis bee pollen
本实验研究了五味子蜂花粉不同萃取物体外抗氧化活性及对小鼠肝脏脂质过氧化的抑制作用和对·OH引起的质粒DNA氧化损伤的保护作用。结果表明,五味子蜂花粉不同极性萃取物的抗氧化活性存在显著差异,正丁醇萃取物的总酚、总黄酮含量最高,体外抗氧化活性最强,其对小鼠肝脏脂质过氧化的抑制效果及对·OH介导的质粒DNA氧化损伤的保护作用也最强,乙酸乙酯萃取物次之,石油醚萃取物最弱。HPLC分析结果表明,虽然正丁醇萃取物中活性物质种类较少,但含量极高。虽然石油醚层的萃取率最高,但其抗氧化活性最差;正丁醇层的萃取率低于石油醚层,高于乙酸乙酯层。因此,正丁醇萃取物可以作为五味子蜂花粉高抗氧化活性酚类化合物分离纯化的基础。本研究可为新资源食品和新型抗氧化功能食品的开发提供参考依据。
[1] 周望庭, 米佳, 禄璐, 等. 枸杞蜂花粉主要化学成分与抗氧化作用[J].食品科学, 2018, 39(4): 219-224. DOI:10.7506/spkx1002-6630-201804033.
[2] ARES A M, VALVERDE S, BEMAL J L, et al. Extraction and determination of bioactive compounds from bee pollen[J]. Journal of Pharmaceutical and Biomedical Analysis, 2018, 147: 110-124.DOI:10.1016/j.jpba.2017.08.009.
[3] MARGHITAS L A, STANCIU O G, DEZMIREAN D S, et al. In vitro antioxidant capacity of honeybee-collected pollen of selected floral origin harvested from Romania[J]. Food Chemistry, 2009, 115(3):878-883. DOI:10.1016/j.foodchem.2009.01.014.
[4] PASSCOAL A, RODRIGUES S, TEIXEIRA A, et al. Biological activities of commercial bee pollens: antimicrobial, antimutagenic,antioxidant and anti-inflammatory[J]. Food and Chemical Toxicology,2014, 63: 233-239. DOI:10.1016/j.fct.2013.11.010.
[5] JIN T Y, SARAVANKUMAR K, WANG M H, et al. In vitro and in vivo antioxidant properties of water and methanol extracts of linden bee pollen[J]. Biocatalysis and Agricultural Biotechnology, 2018, 13:186-189. DOI:10.1016/j.bcab.2017.12.010.
[6] ALMEIDA J D F, REIS A S D, HEIDT L F S, et al. Lyophilized bee pollen extract: a natural antioxidant source to prevent lipid oxidation in refrigerated sausages[J]. LWT-Food Science and Technology, 2017,76: 299-305. DOI:10.1016/j.lwt.2016.06.017.
[7] SOWNDHARARAJAN K, DEEPA P, PARK S J, et al. An overview of neuroprotective and cognitiveenhancement properties of lignans from Schisandra chinensis[J]. Biomedicine & Pharmacotherapy, 2018, 97:958-968. DOI:10.1016/j.biopha.2017.10.145.
[8] YUAN R S, TAO X, LIANG S, et al. Protective effect of acidic polysaccharide from Schisandra chinensis on acute ethanol-induced liver injury through reducing CYP2E1-dependent oxidative stress[J].Biomedicine & Pharmacotherapy, 2018, 99: 537-542. DOI:10.1016/j.biopha.2018.01.079.
[9] ZHOU Juan, LI Peng, CHENG Ni, et al. Protective effects of buckwheat honey on DNA damage induced by hydroxyl radicals[J].Food and Chemical, Toxicology, 2012, 50(8): 2766-2773.DOI:10.1016/j.fct.2012.05.046.
[10] BLASA M, CANDIRACCI M, ACCORSI A, et al. Raw Millefiori honey is packed full of antioxidants[J]. Food Chemistry, 2006, 97(2):217-222. DOI:10.1016/j.foodchem.2005.03.039.
[11] SINGH N, RAJINI P S. Free radical scavenging activity of an aqueous extract of potato peel[J]. Food Chemistry, 2004, 85(4): 611-616.DOI:10.1016/j.foodchem.2003.07.003.
[12] BENZIE I F F J, STRAIN J J. The ferric reducing ability of plasma(FRAP) as a measure of “antioxidant power”: the FRAP assay[J].Analytical Biochemistry, 1996, 239(1): 70-76. DOI:10.1006/abio.1996.0292.
[13] RODRIGO S, HELENA T G. Antioxidant activity index (AAI) by the 2,2-diphenyl-1-picrylhydrazyl method[J]. Food Chemistry, 2008,112(3): 654-658. DOI:10.1016/j.foodchem.2008.06.026.
[14] YEUNG S Y, LAN W H, HUANG C S, et al. Scavenging property of three cresol isomers against H2O2, hypochlorite, superoxide and hydroxyl radicals[J]. Food and Chemical Toxicology, 2002, 40(10):1403-1413. DOI:10.1016/S0278-6915(02)00102-3.
[15] 曹炜, 陈卫军, 宋纪蓉. 不同种类蜂蜜总酚酸含量测定和抗氧化作用的研究[J]. 食品科学, 2005, 26(1): 48-51. DOI:10.3321/j.issn:1002-6630.2005.01.005.
[16] 黄晖. 蜂花粉提取物抗氧化成分的HPLC分析[J]. 广州化工, 2013,41(13): 142-144. DOI:10.3969/j.issn.1001-9677.2013.13.054.
[17] NEGRI G, TEIXEIRA E W, ALVES M L, et al. Hydroxycinnamic acid amide derivatives, phenolic compounds and antioxidant activities of extracts of pollen samples from Southeast Brazil[J]. Journal of Agricultural and Food Chemistry, 2011, 59(10): 5516-5522. DOI:10.1021/jf200602k.
[18] ALMARAZ-ABARCA N, DA GRAÇA CAMPOS M, ÁVILAREYES J A, et al. Antioxidant activity of polyphenolic extract of monofloral honeybee-collected pollen from mesquite (Prosopis juliflora, Leguminosae)[J]. Journal of Food Composition and Analysis,2007, 20(2): 119-124. DOI:10.1016/j.jfca.2006.08.001.
[19] HUANG Haibo, SHEN Zhenghuang, GENG Qianqian, et al. Protective effect of Schisandra chinensis bee pollen extract on liver and kidney injury induced by cisplatin in rats[J]. Biomedicine & Pharmacotherapy,2017, 95: 1765-1776. DOI:10.1016/j.biopha.2017.09.083.
[20] 程妮, 高慧, 王毕妮, 等. 松花粉提取物抗氧化活性及其酚类化合物的研究[J]. 食品与发酵工业, 2011, 37(5): 118-122. DOI:10.13995/j.cnki.11-1802/ts.2011.05.008.
[21] 吕佳宁, 李影, 韩立杰, 等. 蜂花粉3 种溶剂提取物的抗氧化性研究[J]. 食品科学技术学报, 2015, 33(2): 54-57. DOI:10.3969/j.issn.2095-6002.2015.02.010.
[22] ULUSOY E, KOLAYLI S. Phenolics composition and antioxidant properties of anzer bee pollen[J]. Journal of Food Biochemistry, 2014,38(1): 73-82. DOI:10.1111/jfbc.12027.
[23] VELA L, LORENZO C D, PEREZ R A, et al. Antioxidant capacity of Spanish honeys and itscorrelation with polyphenol content and other physicochemical properties[J]. Journal of the Science of Food and Agriculture, 2007, 87(6): 1069-1075. DOI:10.1002/jsfa.2813.
[24] 胡喜兰, 韩照祥, 陈燕, 等. 冬青叶中黄酮化合物的提取和活性测定[J]. 食品科学, 2006, 27(12): 423-426. DOI:10.3321/j.issn:1002-6630.2006.12.102.
[25] 程妮. 蜂蜜植物源鉴别新方法及其保肝活性研究[D]. 西安: 西北大学, 2015: 56-57.
[26] YEN G C, DUH P D, SU H J. Antioxidant properties of lotus seed and its effect on DNA damage in human lymphocytes[J]. Food Chemistry,2005, 89(3): 379-385. DOI:10.1016/j.foodchem.2004.02.045.
[27] CHENG Ni, WANG Yuan, GAO Hui, et al. Protective effect of extract of Crataegus pinnatifida pollen on DNA damage response to oxidative stress[J]. Food and Chemical Toxicology, 2013, 59: 709-714.DOI:10.1016/j.fct.2013.07.015.
[28] 纪俊敏, 谢文磊. 生物体系中脂质过氧化及抗氧化剂抗氧化活性的检测与评价[J]. 中国油脂, 2004(7): 33-37. DOI:10.3321/j.issn:1003-7969.2004.07.008.
[29] 朱丽娟, 葛平珍, 韦诚, 等. 粳米鲊海椒的抗氧化活性及其对小鼠肝脏脂质过氧化作用的影响[J]. 食品科学, 2017, 38(13): 229-237.DOI:10.7506/spkx1002-6630-201713038.
[30] YANG J, LI Y, WANG F, et al. Hepatoprotective effects of apple polyphenols on CCl4-induced acute liver damage in mice[J]. Food Chemistry, 2010, 58(10): 6525-6531. DOI:10.1021/jf903070a.
[31] CHENG N, REN N, GAO H, et al. Antioxidant and hepatoprotective effects of Schisandra chinensis pollen extract on CCl4-induced acute liver damage in mice[J]. Food and Chemical Toxicology, 2013, 55:234-240. DOI:10.1016/j.fct.2012.11.022.
Effects of Different Solvent Extracts from Schisandra chinensis Bee Pollen on Hepatic Lipid Peroxidation and DNA Oxidative Damage
陈思南, 王心怡, 李梦婷, 等. 五味子蜂花粉不同萃取物对小鼠肝脏脂质过氧化及DNA氧化损伤的作用[J]. 食品科学,2019, 40(11): 146-151. DOI:10.7506/spkx1002-6630-20180423-285. http://www.spkx.net.cn
CHEN Sinan, WANG Xinyi, LI Mengting, et al. Effects of different solvent extracts from Schisandra chinensis bee pollen on hepatic lipid peroxidation and DNA oxidative damage[J]. Food Science, 2019, 40(11): 146-151. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180423-285. http://www.spkx.net.cn