大豆蛋白是一种含有人体所需9 种必需氨基酸且不含胆固醇的植物蛋白,它是补充优质蛋白的良好来源。然而,大豆蛋白具有抗原性和溶解度低等缺陷,大大限制了其应用范围[1-2]。大豆低聚肽是以大豆粕或大豆蛋白等为主要原料,用酶解或微生物发酵法处理,再经过分离和精制等特殊处理得到的低聚肽混合物,大部分由3~6 个氨基酸组成[3-4]。大豆低聚肽的氨基酸组成与大豆蛋白基本相同,必需氨基酸种类平衡且含量丰富,还具有降低胆固醇、抗疲劳、提高免疫力等诸多功能,广泛应用于食品中[5-8]。
近年来,随着人们生活水平的提高和饮食结构的改变,高血压患者数量逐年攀升。目前,高血压病人普遍使用药物治疗,虽然降压效果较好,但是化学合成的药物副作用较大,可以引起皮肤、肝脏、肾脏等器官的损害[9-10]。食源性降血压肽与化学合成的降血压药物相比具有无副作用、易吸收、仅对病理性高血压患者有降压效果等优点,因此,寻找合适的降血压肽成为研究热点[11-12]。目前,大部分的降压药物和降压食品都是通过抑制血管紧张素I转换酶(angiotensin I converting enzyme,ACE)的活性来发挥降压作用的,它们紧密结合ACE的活性位点,与血管紧张素I竞争,导致ACE不能将血管紧张素I转化为血管紧张素II,从而降低血压[13-15]。
很多学者已经证明大豆蛋白是良好的食源性降血压肽来源[16-17],并且目前已经有一些蛋白酶应用于大豆蛋白ACE活性抑制肽的制备。范远景等[18]使用5 种不同的蛋白酶对大豆分离蛋白进行单酶水解,并测定不同大豆蛋白酶解物的ACE活性抑制效果,最终选定碱性蛋白酶作为生产大豆ACE抑制肽的最适酶。王升光等[19]采用两种酶水解大豆分离蛋白,最终发现复合酶酶解液的ACE活性抑制效果最好。但是,在体外实验中活性很高的降血压肽,经过消化道内酶的分解后,一些物质可能会被降解而失去活性。因此,进行体内实验评价降血压肽的作用效果是必要的,而目前将体外酶解产物筛选和体内实验相结合验证降压机制的研究少有报道。
本实验采用不同蛋白酶对大豆蛋白进行酶解,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)及分子质量分布实验确定酶解产物分子质量,通过体外ACE活性抑制实验确定最佳酶解条件,选取ACE活性抑制率最高的大豆低聚肽进行体内实验,用等量大豆低聚肽替换饲料中的蛋白,采用饲喂的方式更好地模拟人体摄入大豆低聚肽的过程。实验期间测定大鼠血压、心率、尿蛋白质量及血管紧张素II质量浓度等指标,探究大豆低聚肽对正常血压大鼠(WKY大鼠)和自发性高血压大鼠(SHR大鼠)的影响及其降血压功能与机制。
SPF级雄性SHR大鼠和WKY大鼠(11 周龄)由北京维通利华实验动物技术有限公司提供,生产许可证号:SCXK(京)2009-0012。啮齿类动物维持饲料、含卡托普利(质量分数为0.01%)及大豆低聚肽(质量分数分别为0.90%、1.80%和4.50%)的维持饲料由北京科奥协力饲料有限公司提供。
大豆蛋白 山东御馨生物科技有限公司;中性蛋白酶、碱性蛋白酶、胰蛋白酶、马尿酸(hippuric acid,HA)、马尿酰-组氨酰-亮氨酸(N-hippuryl-His-Leu hydrate,HHL)、甘氨酸、甘氨酸-甘氨酸-甘氨酸、杆菌肽、胰岛素 上海源叶生物科技有限公司;ACE美国Sigma公司;总蛋白测定试剂盒、碘[125I]血管紧张素II放射免疫分析药盒 美国赛默飞世尔科技公司。
EX623ZH千分之一天平、NVL5100B电子天平上海奥豪斯仪器有限公司;恒温水浴锅 金坛市科析仪器有限公司;小型垂直电泳系统、凝胶成像分析系统美国伯乐公司;真空冷冻干燥机 博劢行仪器有限公司;1260 Infinity高效液相色谱仪 美国安捷伦科技有限公司;Infinite 200 Pro Nanoquant酶标仪 瑞士Tecan公司;植入式生理信号遥测系统 美国DSI公司;7020全自动生化分析仪 日本日立公司;DFM-96型放射免疫γ计数器 众诚机电技术公司。
1.3.1 大豆蛋白的酶解
准确称取一定质量的大豆蛋白粉末,使其充分溶解于蒸馏水中,配制成质量分数为8%的大豆蛋白溶液,调节至pH 7.0。配制6 份大豆蛋白溶液,分别加入碱性蛋白酶0.2%(质量分数,下同)、中性蛋白酶0.2%、胰蛋白酶0.2%、碱性蛋白酶和中性蛋白酶(复合酶1)各0.1%、中性蛋白酶和胰蛋白酶(复合酶2)各0.1%、碱性蛋白酶和胰蛋白酶(复合酶3)各0.1%进行水解,50 ℃恒温水浴4 h,随后将温度提高至85 ℃进行灭酶,15 min后得到多肽酶解液。将酶解液于-42 ℃下真空冷冻干燥30 h,得到不同大豆蛋白酶解物粉末。
1.3.2 大豆蛋白与不同大豆蛋白酶解物的SDS-PAGE分析
参考Boye等[20]的方法,配制质量分数30%丙烯酰胺溶液、1.5 mol/L Tris-HCl、1 mol/L Tris-HCl、10% SDS溶液、10%过硫酸铵溶液,混合配制质量分数为12%的分离胶和5%浓缩胶。蛋白上样量为15 μg左右,与上样缓冲液混合,95 ℃水浴5 min使样品中的蛋白质变性,随后每孔上样10 μL,调整电压为80 V进行SDS-PAGE,以三色预染蛋白分子(分子质量范围为10~180 kDa)为蛋白分子质量标准品。SDS-PAGE结束后,经考马斯亮蓝染色,脱色后于凝胶成像系统照相分析。
1.3.3 大豆蛋白与不同大豆蛋白酶解物ACE活性抑制率的测定
参考Boschin[21]和Wu Jianping[22]等的方法并加以改进,分别配制1 mmol/L HHL溶液、10 mg/mL大豆蛋白溶液、6 种10 mg/mL大豆蛋白酶解物溶液,溶于缓冲液1(100 mmol/L Tris-HCOOH、300 mmol/L NaCl,pH 8.3);配制1 mU ACE溶液溶于缓冲液2(100 mmol/L Tris-HCOOH、300 nmol/L NaCl、10 mol/L ZnCl2,pH 8.3)。将100 μL HHL溶液和30 μL样品溶液混合,在37 ℃下预反应15 min,加入15 μL ACE溶液,反应60 min后用125 μL 0.1 mol/L HCl停止反应,再经乙酸乙酯萃取两次后在高效液相色谱-二极管阵列检测器(high performance liquid chromatography-diode array detector,HPLC-DAD)系统中过Eclipse Plus C18柱(150 mm×4.6 mm,5 μm)进行分析。以水和乙腈作为流动相,洗脱条件为:0 min,5%(体积分数,下同)乙腈;10 min,60%乙腈;12 min,60%乙腈;15 min,5%乙腈。进样体积为10 μL,流速为0.5 mL/min,于228 nm波长处检测HA的峰面积。抑制剂空白样品不添加大豆蛋白酶解物,不同抑制剂样品添加不同大豆蛋白酶解物,反应空白样品添加不同大豆蛋白酶解物但不添加ACE。ACE活性抑制率按式(1)计算。
式中:A1为抑制剂空白样品中HA峰面积;A2为不同抑制剂样品中HA峰面积;A3为反应空白样品中HA峰面积。
1.3.4 大豆低聚肽分子质量分布的测定
参考GB/T 22492—2008《大豆肽粉》[4]的方法并加以改进,选取酶解后所得肽段分子质量小以及ACE活性抑制效果最佳的酶解物进行分析,进一步确定其分子质量分布。将标准品和酶解物冻干粉配制成1 mg/mL溶液,过0.22 μm滤膜,随后在HPLC-DAD系统中过TSK gel G2000SWXL色谱柱(300 mm×7.8 mm,5 μm)进行检测分析。流动相为乙腈、水、三氟乙酸(45:55:0.1,V/V),进样体积为10 μL,流速为0.5 mL/min,于220 nm波长处检测得到标准品及样品色谱图,根据标准品的出峰时间及其分子质量计算标准曲线,由标准曲线得到大豆低聚肽的分子质量分布,用峰面积归一化法得到不同肽段相对分子质量分布。
1.3.5 动物分组及处理
实验动物共48 只,其中SHR大鼠40 只,WKY大鼠8 只。在实验开始前,对动物进行1 周适应性饲养,在适应期内对受试动物进行多次血压测量,使其适应测压环境[23]。适应期结束后,将SHR大鼠按体质量随机分为5 组,每组8 只,分别为阴性对照组(饲喂啮齿类动物维持饲料)、阳性对照组(饲喂添加0.0l g/kg卡托普利的啮齿类动物维持饲料)、大豆低聚肽低剂量组(0.90 g/kg大豆低聚肽)、中剂量组(1.80 g/kg大豆低聚肽)和高剂量组(4.50 g/kg大豆低聚肽),其中3 个大豆低聚肽剂量组将大豆低聚肽替换啮齿类动物维持饲料中等量蛋白,大鼠每日摄食量按体质量的10%计算,饲料中大豆低聚肽相应的质量分数分别为0.90%、1.80%和4.50%,分别相当于人体推荐摄入量的1、2、5 倍;卡托普利质量分数为0.01%。正常对照组为8 只WKY大鼠,与大豆低聚肽高剂量组饲喂相同的饲料。各组动物自由进食、饮水,饲养30 d[24]。
1.3.6 大鼠血压和心率的测定
实验期间每周记录大鼠给食量、撒食量、剩食量,并称体质量1 次,同时用植入式生理信号遥测系统测定其血压(包括收缩压、平均压和舒张压)和心率一次[25-26]。平均动脉压(平均压)是指心脏在整个心动周期中给予血流的平均推动力,相较于收缩压和舒张压而言,它既能表示心动周期中动脉血压的平均变化,又能反映心、脑、肾的血流状态,其数值增高则表示心脏和动脉的负荷增高。平均压的计算公式如式(2)所示。
1.3.7 大鼠24 h尿中总蛋白质量的测定
实验结束前1 d,用大鼠代谢笼收集所有大鼠24 h尿液,记录尿量,按总蛋白测定试剂盒(Doumas法)说明书,采用全自动生化分析仪测定尿中总蛋白质量[27-28]。
1.3.8 大鼠血清的制备
实验结束当天,将所有大鼠称体质量,用质量分数1%戊巴比妥钠(0.5 mL/100 g)将动物麻醉,经腹主动脉取血5 mL注入含抗凝剂的试管中混匀,在4 ℃下3 000 r/min离心15 min,分离上清液收集于灭菌离心管中,于-70 ℃保存。
1.3.9 大鼠血管紧张素II质量浓度的测定
按碘[125I]血管紧张素II放射免疫分析药盒说明书,采用DFM-96型放射免疫γ计数器测定各组大鼠血浆中血管紧张素II质量浓度[29]。
使用SPSS 13.0软件对数据进行单因素方差分析。先进行方差齐性检验,若方差齐,则计算F值,F<F0.05表示各组平均数间差异不显著;若F≥F0.05、P≤0.05,则用最小显著性差异法进行各剂量组和阴性对照组间平均数的两两比较,P<0.05表示差异显著;对方差不齐的数据使用Dunnett’s T3法进行各剂量组和阴性对照组间平均数的两两比较,P<0.05表示差异显著。

图1 大豆蛋白与不同大豆蛋白酶解物的SDS-PAGE谱图
Fig. 1 SDS-PAGE of soy protein and its hydrolysates
由图1可知,大豆蛋白经酶解后变为小分子肽,且酶解物分子质量均低于35 kDa,碱性蛋白酶、复合酶1和复合酶3的水解效果较好,将大豆蛋白分解为15 kDa以下的肽段,其中复合酶1的酶解效果最好,大部分肽段分子质量集中在10 kDa以下。
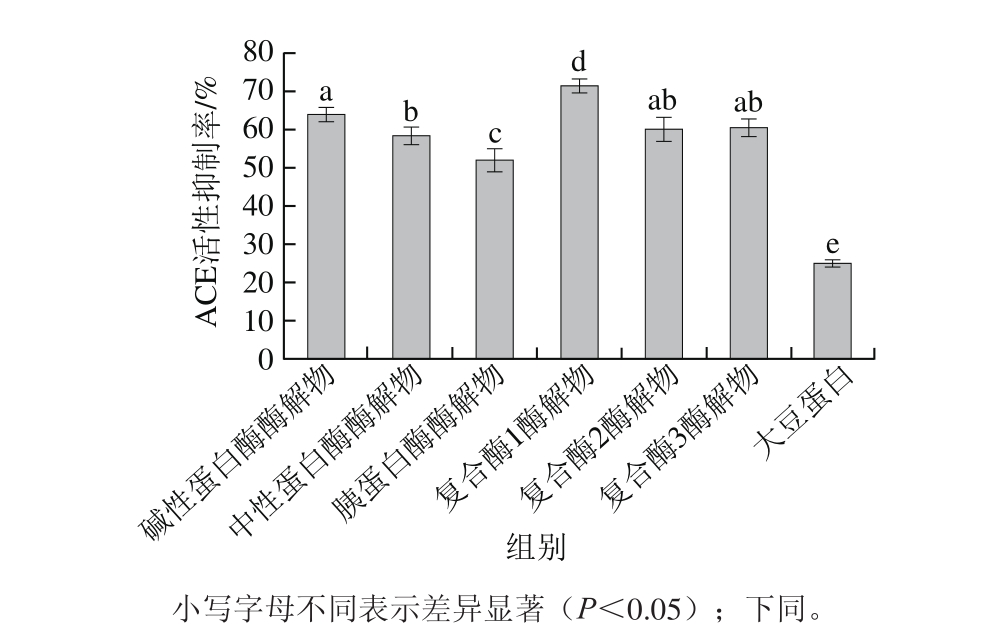
图2 大豆蛋白及其不同酶解物的ACE活性抑制率
Fig. 2 Percentage inhibition of ACE activity by soy protein and its hydrolysates
如图2所示,与大豆蛋白相比,大豆蛋白酶解物ACE活性抑制率显著提高(P<0.05),这表明大豆蛋白酶解为小分子肽后对于ACE活性的抑制作用更强,可能具有更好的降血压效果。复合酶1酶解物的ACE活性抑制率最好,达到71.2%;其次为碱性蛋白酶酶解物,其ACE活性抑制率为63.7%;ACE活性抑制率最差的是胰蛋白酶酶解物,仅为51.9%。结合图1结果分析,复合酶1的酶解效果最好,大豆蛋白大部分被酶解为小分子肽,对于ACE活性的抑制效果更明显。就单一酶酶解而言,本实验结果与韩飞等[1]研究一致,他们采用4 种酶对大豆分离蛋白进行水解,测定其对ACE活性的抑制效果,结果表明碱性蛋白酶酶解物的抑制效果好于中性蛋白酶酶解物。本研究发现,相较于单一酶酶解,碱性蛋白酶与中性蛋白酶复合酶解后对ACE活性的抑制效果得到了提升。
综合图1、2可知,复合酶1酶解物肽段分子质量小,且对ACE活性的抑制效果最好,但图1中低于10 kDa的肽段没有得到明显的分离。为了进一步确定其成分,进行分子质量分布分析。由表1可知,酶解物有82.4%分子质量分布在1 000 Da以下,即低聚肽比例约为82.4%。
表1 大豆低聚肽的分子质量分布
Table 1 Molecular mass distribution of soybean oligopeptides
分子质量范围/Da >3 000 1 500~3 0001 000~1 500500~1 000 <500积分面积/% 1.9 7.8 7.9 28.8 53.6
表2 大豆低聚肽饲喂30 d对大鼠体质量的影响
Table 2 Effects of soybean oligopeptides on body mass in rats after 30 days of feeding
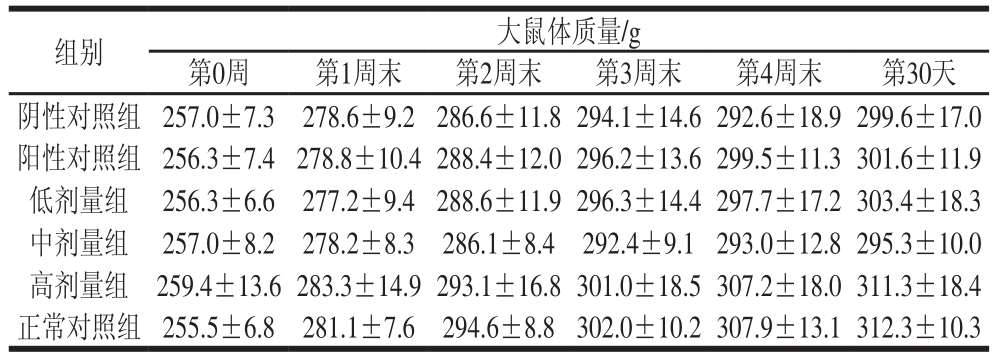
组别 大鼠体质量/g第0周 第1周末 第2周末 第3周末 第4周末 第30天阴性对照组 257.0±7.3 278.6±9.2286.6±11.8294.1±14.6292.6±18.9299.6±17.0阳性对照组 256.3±7.4278.8±10.4288.4±12.0296.2±13.6299.5±11.3301.6±11.9低剂量组 256.3±6.6 277.2±9.4288.6±11.9296.3±14.4297.7±17.2303.4±18.3中剂量组 257.0±8.2 278.2±8.3 286.1±8.4 292.4±9.1293.0±12.8295.3±10.0高剂量组 259.4±13.6283.3±14.9293.1±16.8301.0±18.5307.2±18.0311.3±18.4正常对照组 255.5±6.8 281.1±7.6 294.6±8.8302.0±10.2307.9±13.1312.3±10.3
由表2可知,以大豆低聚肽饲喂大鼠30 d,各组大鼠体质量均呈增长趋势,大豆低聚肽各剂量组及阳性对照组大鼠的体质量增长趋势与阴性对照组及正常对照组比较均无显著性差异(P>0.05),表明大豆低聚肽对于大鼠体质量无显著影响。
表3 饲喂大豆低聚肽30 d对WKY大鼠血压的影响
Table 3 Effects of soybean oligopeptides on blood pressure of WKY rats after 30 days of feeding

时间 收缩压/mmHg 平均压/mmHg 舒张压/mmHg第1周 122.1±6.7 74.3±5.9 50.3±5.8第2周 118.4±7.1 77.5±6.2 54.3±7.3第3周 112.9±11.9 72.2±6.8 50.6±5.1第4周 117.3±7.4 76.1±6.5 56.7±8.7
由表3可知,以大豆低聚肽饲喂大鼠30 d,正常对照组大鼠的收缩压、平均压和舒张压在整个实验过程中均无显著差异(P>0.05),表明大豆低聚肽对于正常大鼠血压、心脏和动脉的负荷无影响。
表4 饲喂大豆低聚肽30 d对SHR大鼠收缩压的影响
Table 4 Effects of soybean oligopeptides on systolic blood pressure of SHR rats after 30 days of feeding
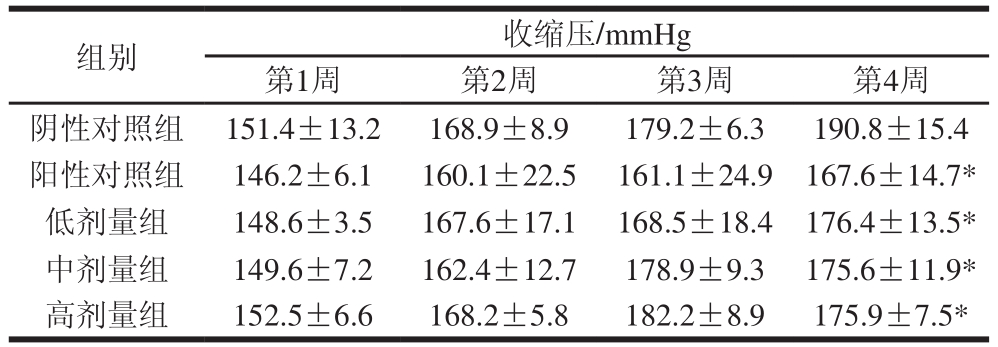
注:*.与阴性对照组比较差异显著(P<0.05)。下同。
组别 收缩压/mmHg第1周 第2周 第3周 第4周阴性对照组 151.4±13.2 168.9±8.9 179.2±6.3 190.8±15.4阳性对照组 146.2±6.1 160.1±22.5 161.1±24.9 167.6±14.7*低剂量组 148.6±3.5 167.6±17.1 168.5±18.4 176.4±13.5*中剂量组 149.6±7.2 162.4±12.7 178.9±9.3 175.6±11.9*高剂量组 152.5±6.6 168.2±5.8 182.2±8.9 175.9±7.5*
表5 饲喂大豆低聚肽30 d对SHR大鼠平均压的影响
Table 5 Effects of soybean oligopeptides on mean arterial pressure of SHR rats after 30 days of feeding
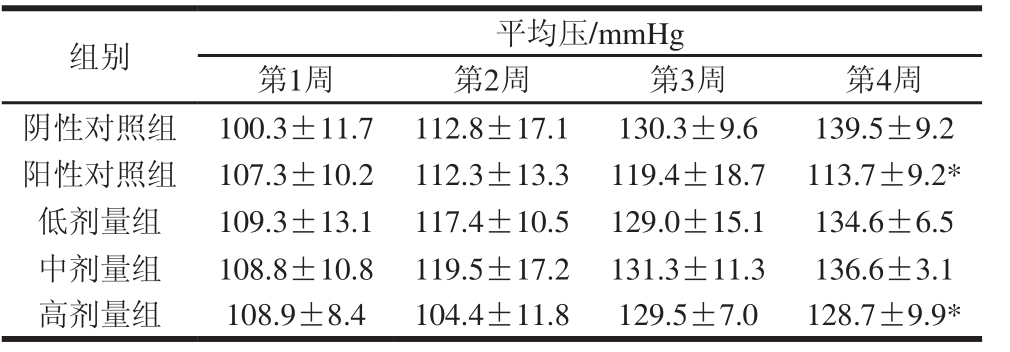
组别 平均压/mmHg第1周 第2周 第3周 第4周阴性对照组 100.3±11.7 112.8±17.1 130.3±9.6 139.5±9.2阳性对照组 107.3±10.2 112.3±13.3 119.4±18.7 113.7±9.2*低剂量组 109.3±13.1 117.4±10.5 129.0±15.1 134.6±6.5中剂量组 108.8±10.8 119.5±17.2 131.3±11.3 136.6±3.1高剂量组 108.9±8.4 104.4±11.8 129.5±7.0 128.7±9.9*
表6 饲喂大豆低聚肽30 d对SHR大鼠舒张压的影响
Table 6 Effects of soybean oligopeptides on diastolic blood pressure of SHR rats after 30 days of feeding

组别 舒张压/mmHg第1周 第2周 第3周 第4周阴性对照组 82.6±7.6 98.5±20.5 113.4±4.5 117.3±10.1阳性对照组 83.9±10.1 97.9±24.4 93.7±18.0* 86.2±8.7*低剂量组 87.6±11.9 86.3±10.7 111.9±13.4 111.0±9.1中剂量组 85.2±10.3 102.2±19.4 109.4±19.6 113.9±5.3高剂量组 81.5±6.6 88.6±12.0 107.9±14.3 102.9±9.5*
由表4~6可知,随着饲养时间延长,SHR大鼠血压逐渐升高。与阴性对照组相比,阳性对照组大鼠的收缩压和平均压自第3周起有所下降,到第4周时有显著差异(P<0.05);而舒张压在第3、4周时均显著降低(P<0.05),表明卡托普利可以降低SHR大鼠血压,减轻心脏和动脉的负荷。杨雯晴等[30]对SHR大鼠灌胃25 mg/kg卡托普利,1 周后与给药前相比血压显著下降(P<0.05),随着干预时间的延长,降压效果逐渐增强。本实验中由于卡托普利的质量分数低,并且采取混入饲料的方式,造成其发挥降血压作用存在一定的时间窗。大豆低聚肽各剂量组大鼠的收缩压在第4周时与阴性对照组相比显著降低(P<0.05);大豆低聚肽低、中剂量组大鼠的平均压和舒张压到第4周时有下降的趋势,但差异不显著(P>0.05);大豆低聚肽高剂量组大鼠的平均压和舒张压自第2周起至实验结束均略低于阴性对照组,血压逐渐稳定并有降低的趋势,心脏和动脉的负荷减轻,到第4周时有显著性差异(P<0.05)。Wu Jianping等[31]通过口服给予SHR大鼠1 g/kg大豆肽1 个月后,发现其收缩压显著降低。卢静等[32]通过造模急性肾性高血压大鼠,并在短时间内静脉给予其大豆肽,发现大豆肽对正常大鼠血压无影响,但能够显著降低高血压大鼠收缩压和舒张压。这与本研究在大豆肽发挥降血压效果的作用剂量和时间上有所差异,这可能是由于选取的动物模型有所不同,并且大豆蛋白使用不同的酶解方案,其酶解位点、形成的肽段不同。
心率是直接反映心脏功能状态和交感神经活性的指标,心率的变化与心血管疾病发生率紧密相关。高血压通常会导致心律失常。通过测定SHR大鼠心率可以评估大豆低聚肽辅助降血压的效果[33-34]。
表7 饲喂大豆低聚肽30 d对SHR大鼠心率的影响
Table 7 Effects of soybean oligopeptides on heart rate of SHR rats after 30 days of feeding
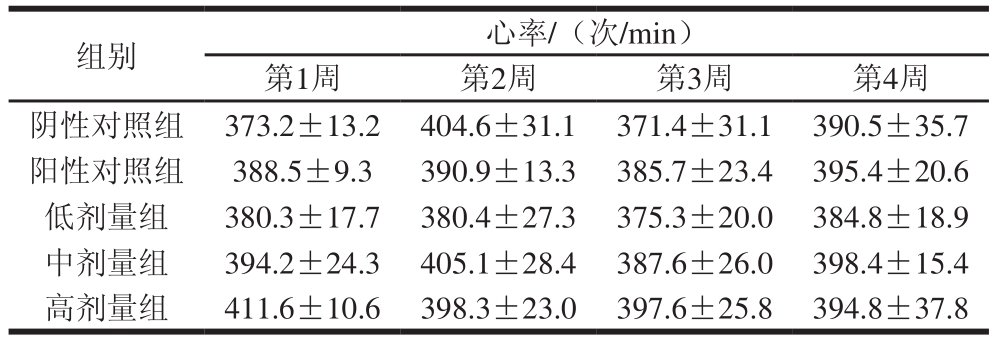
组别 心率/(次/min)第1周 第2周 第3周 第4周阴性对照组 373.2±13.2 404.6±31.1 371.4±31.1 390.5±35.7阳性对照组 388.5±9.3 390.9±13.3 385.7±23.4 395.4±20.6低剂量组 380.3±17.7 380.4±27.3 375.3±20.0 384.8±18.9中剂量组 394.2±24.3 405.1±28.4 387.6±26.0 398.4±15.4高剂量组 411.6±10.6 398.3±23.0 397.6±25.8 394.8±37.8
由表7可知,以大豆低聚肽饲喂大鼠30 d,与阴性对照组相比,阳性对照组和大豆低聚肽各剂量组大鼠的心率在整个实验过程中均无显著性差异(P>0.05)。这表明大豆低聚肽对于大鼠心率没有显著影响。
肾脏既是血压的重要调节器官,也是高血压损伤的靶器官之一。当血压升高时,人体肾脏发生病变,导致蛋白质进入尿液,从而形成了蛋白尿[35-36]。通过测定大鼠尿蛋白质量可以评估大豆低聚肽辅助降血压的效果。
表8 大豆低聚肽饲喂30 d对SHR大鼠24 h尿蛋白质量的影响
Table 8 Effects of soybean oligopeptides on 24-hour urine protein content in SHR rats after 30 days of feeding
组别 阴性对照组 阳性对照组 低剂量组 中剂量组 高剂量组24 h尿蛋白质量/mg 41.2±14.4 42.0±18.3 32.8±23.8 30.2±10.9 56.4±20.1
由表8可知,以大豆低聚肽饲喂大鼠30 d,大豆低聚肽各剂量组及阴性对照组、阳性对照组大鼠的24 h尿蛋白质量之间均无显著性差异(P>0.05),表明大豆低聚肽对于尿蛋白质量无显著影响。

图3 大豆低聚肽饲喂30 d对SHR大鼠血管紧张素II质量浓度的影响
Fig. 3 Effects of soybean oligopeptides on plasma levels of angiotensin II in rats after 30 days of feeding
由图3可知,SHR大鼠饲喂大豆低聚肽30 d后,与阴性对照组相比,阳性对照组大鼠血管紧张素II质量浓度显著降低(P<0.05),大豆低聚肽各剂量组大鼠血管紧张素II质量浓度均有下降趋势,其中低、中剂量组无显著性差异(P>0.05),而高剂量组显著下降(P<0.05),其血管紧张素II质量浓度为174.2 pg/mL。卢静等[32]通过静脉给予正常大鼠及急性肾性高血压大鼠低、中、高剂量的大豆肽,结果显示3 组大鼠的血管紧张素II质量浓度均显著降低(P<0.05)。结合血压结果分析,本研究中大豆低聚肽低、中剂量组大鼠的收缩压在第4周时与阴性对照组相比显著降低(P<0.05),而血管紧张素II质量浓度没有显著性差异(P>0.05),可能是因为在血压调控系统中存在另一种激肽-激肽生成酶系统,ACE作用于激肽使其失活,导致血压升高[37]。推测大豆低聚肽通过抑制ACE活性,一方面使血管紧张素I无法转换为血管紧张素II,导致血管紧张素II质量浓度降低;另一方面提高激肽的活性。两方面联合作用降低血压,具体机制还需要进一步研究证明。
本研究采用碱性蛋白酶、中性蛋白酶、胰蛋白酶、碱性蛋白酶+中性蛋白酶复合、中性蛋白酶+胰蛋白酶复合、碱性蛋白酶+胰蛋白酶复合酶解大豆蛋白,得到6 种不同酶解产物,通过SDS-PAGE实验和ACE活性抑制实验确定最佳酶解条件为:碱性蛋白酶和中性蛋白酶质量分数各0.1%,50 ℃酶解4 h。通过分子质量分布实验确定其分子质量,最终得到分子质量小于1 000 Da比例为82.4%的大豆低聚肽。选取此大豆低聚肽进行体内实验,饲喂30 d后,WKY大鼠血压无显著性变化,SHR大鼠血压有降低的趋势。与阴性对照组相比,大豆低聚肽高剂量组大鼠的收缩压、平均压、舒张压和血管紧张素II质量浓度在第4周时显著降低(P<0.05);大鼠体质量、心率与尿蛋白质量无显著性变化(P>0.05)。结果表明:体外实验中大豆低聚肽较大豆蛋白的ACE活性抑制效果更好;体内实验证明,大豆低聚肽可以降低SHR大鼠的血压和血管紧张素II质量浓度,且对正常血压大鼠无明显影响;推测大豆低聚肽通过抑制ACE活性的方式发挥降压功效。
[1] 韩飞, 于婷婷, 周孟良. 酶法生产大豆蛋白ACE抑制肽的研究[J]. 食品科学, 2008, 29(11): 369-374. DOI:10.3321/j.issn:1002-6630.2008.11.084.
[2] EBERT A W, CHANG C H, YAN M R, et al. Nutritional composition of mungbean and soybean sprouts compared to their adult growth stage[J]. Food Chemistry, 2017, 237: 15-22. DOI:10.3321/j.issn:1002-6630.2008.11.084.
[3] 吕育新, 梁金钟. 大豆低聚肽的研究进展[J]. 大豆科技, 2013(2): 37-39.DOI:10.3969/j.issn.1674-3547.2013.02.013.
[4] 国家质量监督检验检疫总局. 大豆肽粉: GB/T 22492—2008[S]. 北京: 中国标准出版社, 2009: 1-3.
[5] 郭玉华, 李钰金, 吴新颖. 大豆多肽的应用进展及前景[J]. 粮食加工,2010, 35(5): 60-63. DOI:10.3969/j.issn.1007-6395.2010.05.018.
[6] 王立博, 陈复生. 大豆活性肽生理保健功能研究进展[J].食 品 与 机 械 , 2016, 32(2): 198-201. DOI:10.13652/j.issn.1003-5788.2016.02.047.
[7] 张连慧, 贺寅, 刘新旗. 大豆肽制备研究进展及其在食品中的应用[J]. 食品工业科技, 2012, 33(24): 423-425; 429. DOI:10.13386/j.issn1002-0306.2012.24.063.
[8] 张连慧, 贺寅, 刘新旗. 大豆肽的研究进展及其发展前景[J].食品工业科技, 2012, 33(22): 406-408; 413. DOI:10.13386/j.issn1002-0306.2012.22.093.
[9] HANAFI M A, HASHIM S N, CHAY S Y, et al. High angiotensin-I converting enzyme (ACE) inhibitory activity of alcalase-digested green soybean hydrolysates[J]. Food Research International, 2018,106: 589-597. DOI:10.1016/j.foodres.2018.01.030.
[10] JIMSHEENA V K, GOWDA L R. Angiotensin I-converting enzyme(ACE) inhibitory peptides derived from arachin by simulated gastric digestion[J]. Food Chemistry, 2011, 125(2): 561-569. DOI:10.1016/j.foodchem.2010.09.048.
[11] 杨湘华, 李江. 食源性降血压肽构效关系与制备研究进展[J].食品研究与开发, 2016, 37(3): 217-220. DOI:10.3969/j.issn.1005-6521.2016.03.054.
[12] 刘新旗, 涂丛慧, 张连慧, 等. 大豆蛋白的营养保健功能研究现状[J].北京工商大学学报(自然科学版), 2012, 30(2): 1-6. DOI:10.3969/j.issn.1671-1513.2012.02.001.
[13] 崔和平, 郭兴凤. 食源性降血压肽制备研究进展[J]. 粮食与油脂,2013, 26(2): 5-8. DOI:10.3969/j.issn.1008-9578.2013.02.004.
[14] MAMILLA R K, MISHRA V K. Effect of germination on antioxidant and ACE inhibitory activities of legumes[J]. LWT-Food Science and Technology, 2017, 75: 51-58. DOI:10.1016/j.lwt.2016.08.036.
[15] SANJUKTA S, RAI A K. Production of bioactive peptides during soybean fermentation and their potential health benefits[J]. Trends in Food Science & Technology, 2016, 50: 1-10. DOI:10.1016/j.tifs.2016.01.010.
[16] KUBA M, TANA C, TAWATA S, et al. Production of angiotensin I-converting enzyme inhibitory peptides from soybean protein with Monascus purpureus acid proteinase[J]. Process Biochemistry, 2005,40(6): 2191-2196. DOI:10.1016/j.procbio.2004.08.010.
[17] ALUKO R E. Structure and function of plant protein-derived antihypertensive peptides[J]. Current Opinion in Food Science, 2015,4: 44-50. DOI:10.1016/j.cofs.2015.05.002.
[18] 范远景, 姬莹莹, 张焱. 大豆蛋白酶解肽的分子量分布及抑制ACE活性关系研究[J]. 食品科学, 2007, 28(10): 57-61. DOI:10.3321/j.issn:1002-6630.2007.10.008.
[19] 王升光, 于帅, 孟凡刚, 等. 酶法制备大豆肽的相对分子量分布及降压作用研究[J]. 食品工业科技, 2018, 39(1): 46-51. DOI:10.13386/j.issn.1002-0306.2018.01.009.
[20] BOYE J I, ROUFIK S, PESTA N, et al. Angiotensin I-converting enzyme inhibitory properties and SDS-PAGE of red lentil protein hydrolysates[J]. LWT-Food Science and Technology, 2010, 43(6):987-991. DOI:10.1016/j.lwt.2010.01.014.
[21] BOSCHIN G, SCIGLIUOLO G M, RESTA D, et al. ACE-inhibitory activity of enzymatic protein hydrolysates from lupin and other legumes[J]. Food Chemistry, 2014, 145(7): 34-40. DOI:10.1016/j.foodchem.2013.07.076.
[22] WU Jianping, ALUKO R E, MUIR A D. Improved method for direct high-performance liquid chromatography assay of angiotensinconverting enzyme-catalyzed reactions[J]. Journal of Chromatography A,2002, 950(1/2): 125-130. DOI:10.1016/S0021-9673(02)00052-3.
[23] KIVIMÄKI A S, SILTARI A, EHLERS P I, et al. Lingonberry juice lowers blood pressure of spontaneously hypertensive rats (SHR)[J].Journal of Functional Foods, 2013, 5(3): 1432-1440. DOI:10.1016/j.jff.2013.05.012.
[24] 徐叔云, 卞如濂, 陈修. 药理实验方法学[M]. 北京: 人民卫生出版社,2010: 1535.
[25] 李晓红, 宋福印. 丹参多糖对SHR高血压模型大鼠血压和COX-2基因表达的影响[J]. 北京中医药, 2017, 36(8): 706-709. DOI:10.16025/j.1674-1307.2017.08.012.
[26] 李超民, 罗薇, 李慧, 等. 人参皂苷Rg2对SHR大鼠血压及肾脏MMP2、MMP9表达的影响[J]. 心脏杂志, 2017, 29(1): 44-47.DOI:10.13191/j.chj.2017.0012.
[27] 邓九零, 陈亮, 寿旗扬, 等. 益气活血方对糖尿病GK大鼠肾脏保护作用的研究[J]. 中国中药杂志, 2018, 43(11): 2372-2377.DOI:10.19540/j.cnki.cjcmm.20180327.004.
[28] DE ALMEIDA C L B, CECHINEL-FILHO V, BOEING T, et al.Prolonged diuretic and saluretic effect of nothofagin isolated from Leandra dasytricha (A. Gray) Cogn. leaves in normotensive and hypertensive rats: role of antioxidant system and renal protection[J].Chemico-Biological Interactions, 2018, 279: 227-233. DOI:10.1016/j.cbi.2017.11.021.
[29] CAIN M D, COGHLAN J P, CATT K J. Measurement of angiotensin II in blood by radioimmunoassay[J]. Clinica Chimica Acta, 1972,39(1): 21-34. DOI:10.1016/0009-8981(72)90295-1.
[30] 杨雯晴, 蒋海强, 李运伦, 等. 卡托普利干预自发性高血压大鼠血清代谢组学研究[J]. 中国药理学通报, 2016, 32(7): 998-1003.DOI:10.3969/j.issn.1001-1978.2016.07.022.
[31] WU Jianping, DING Xiaolin. Hypotensive and physiological effect of angiotensin converting enzyme inhibitory peptides derived from soy protein on spontaneously hypertensive rats[J]. Journal of Agricultural and Food Chemistry, 2001, 49(1): 501-506. DOI:10.1021/jf000695n.
[32] 卢静, 赵春燕, 张学新, 等. 大豆肽对大鼠血压及血浆血管紧张素的影响[J]. 营养学报, 2008, 30(5): 508-511. DOI:10.13325/j.cnki.acta.nutr.sin.2008.05.020.
[33] 孙宁玲, 霍勇, 黄峻. 中国高血压患者心率现状调查[J]. 中华高血压杂志, 2015, 23(10): 934-939. DOI:10.16439/j.cnki.1673-7245.2015.10.013.
[34] JAHANDIDEH F, CHAKRABARTI S, MAJUMDER K, et al. Egg white protein hydrolysate reduces blood pressure, improves vascular relaxation and modifies aortic angiotensin II receptors expression in spontaneously hypertensive rats[J]. Journal of Functional Foods, 2016,27: 667-673. DOI:10.1016/j.jff.2016.10.019.
[35] 于海荣, 曲正阳, 王一帆, 等. 决明子蒽醌苷对高血压大鼠血压、尿白蛋白及β2-微球蛋白的影响[J]. 中国老年学杂志, 2015, 35(21):6041-6042. DOI:10.3969/j.issn.1005-9202.2015.21.016.
[36] 王晓玲, 张先杰, 黄霜枝, 等. 葡萄籽原花青素对自发性高血压大鼠肾损伤的保护作用[J]. 中药药理与临床, 2017, 33(5): 43-47.DOI:10.13412/j.cnki.zyyl.2017.05.012.
[37] 孟月, 饶欢, 陶莎, 等. 豆源降血压肽制备及活性评价方法的研究进展[J]. 粮食与油脂, 2016, 29(7): 5-9. DOI:10.3969/j.issn.1008-9578.2016.07.002.
Effect of Soybean Oligopeptides on Blood Pressure and Plasma Angiotensin in Spontaneously Hypertensive Rats
李雯晖, 张健, 应欣, 等. 大豆低聚肽对自发性高血压大鼠血压及血浆血管紧张素的影响[J]. 食品科学, 2019, 40(11):152-158. DOI:10.7506/spkx1002-6630-20181017-184. http://www.spkx.net.cn
LI Wenhui, ZHANG Jian, YING Xin, et al. Effect of soybean oligopeptides on blood pressure and plasma angiotensin in spontaneously hypertensive rats[J]. Food Science, 2019, 40(11): 152-158. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20181017-184. http://www.spkx.net.cn