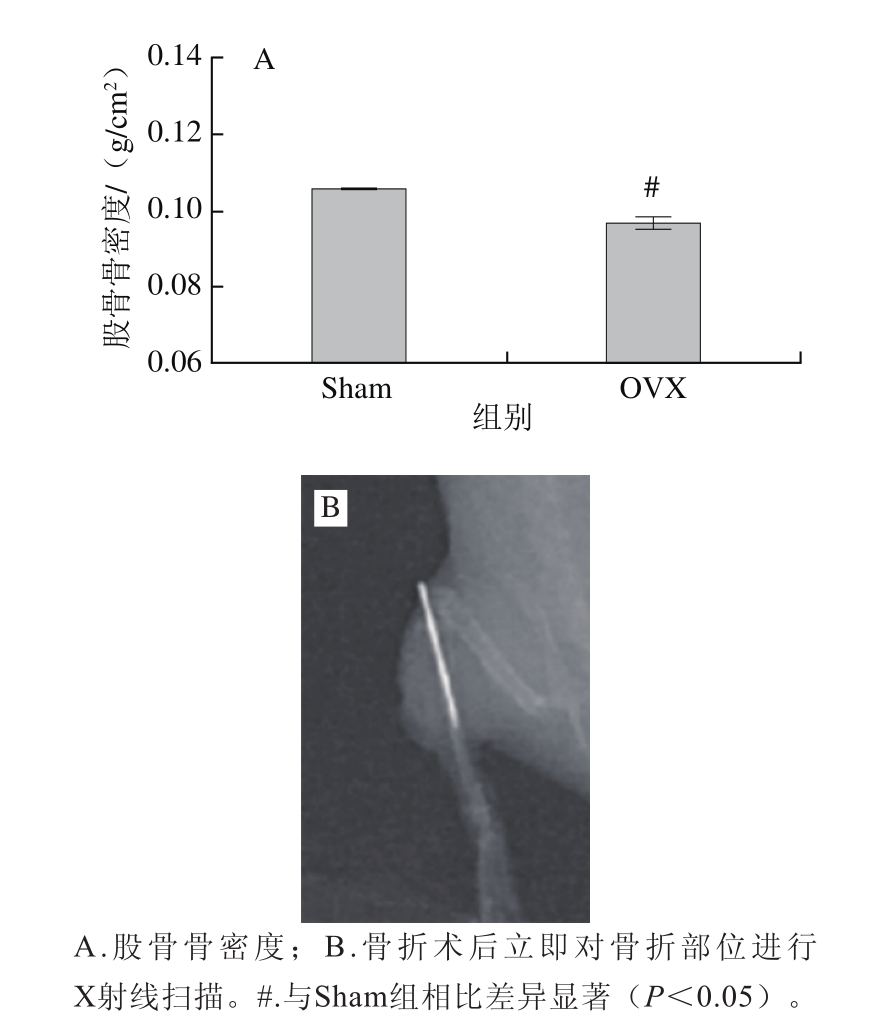
图1 小鼠骨质疏松性骨折模型的建立
Fig. 1 Establishment of the osteoporotic fracture model
骨质疏松症是绝经后妇女和老年人最普遍、复杂的骨骼代谢疾病,会引起骨组织内单位体积骨量减少、骨微结构遭到破坏,正常荷载性能下降,骨脆性增加,以致骨组织受到低能量创伤即会引发骨折[1-2]。骨质疏松性骨折(osteoporosis fracture,OPF)是骨质疏松症最常见、最严重的并发症[3]。OPF的特点之一是发病率高:国际骨质疏松基金会调研发现,全球范围内每3 s就会出现一起OPF病例;50 岁之后,1/2的女性和1/5的男性会遭遇一次骨折[4]。OPF特点二为致残率高:与一般创伤性骨折相比,OPF愈合过程中骨内、外膜表面骨形成不足,骨矿化沉积速率减慢,骨痂形成量减少;此外,骨重塑出现延迟,骨折区新生皮质骨厚度变薄,最终延长了骨折愈合周期[5-7],甚至会导致骨不连,新骨机械性能下降[8-9],大大增加了发生二次骨折的风险[10-11]。因此具有高发病率、高致残率特点的OPF对老年人尤其是绝经后妇女的身心健康构成了巨大的威胁[12],其漫长的恢复过程给患者的日常生活带来了极大的不便,高昂的医疗费用还给家庭乃至社会带来了沉重的经济负担[13],OPF已俨然成为新的全球威胁。现在临床上OPF的治疗方式多为物理、基因和药物治疗,但是这些治疗手段价格昂贵,且或多或少存在副作用,所以寻找安全有效的辅助治疗措施成为了研究热点。
以南极磷虾为原料提取的南极磷虾油(Antarctic krill oil,AKO)富含磷脂型二十碳五烯酸(eicosapentaenoic acid,EPA)、二十二碳六烯酸(docosapentenoic acid,DHA)以及少量的虾青素等多种活性因子[14-15],研究发现AKO具有抗氧化[16]、强健大脑[17]、降血脂[18-19]、抗疲劳[20]等多种生物功能[21]。此外,近期研究发现,EPA、DHA可促进骨生成、改善软骨细胞代谢[22],而骨折愈合过程经历的软骨内骨化则与此有着密切的关系,因此本研究以富含磷脂型EPA和DHA的AKO为受试物,以软骨内成骨为切入点,系统地研究AKO对骨质疏松骨折愈合的作用,以期为南极磷虾油功能性食品开发提供理论参考,为OPF的辅助性治疗提供新思路。
8 周龄雌性C57BL/6J小鼠,SPF级,体质量(18.50±2.56)g,由北京维通利华实验动物技术有限公司提供,生产许可证号:SCXK(京)2012-0001,饲养温度为22~24 ℃,相对湿度为52%~58%。
南极磷虾油由中国海洋大学食品科学与人类健康实验室赠予。AKO组成成分分析结果显示其含有约57.4%(质量分数,下同)磷脂、14.2%甘油三酯、15.3%游离脂肪酸、2.1%胆固醇和0.594‰虾青素。EPA和DHA分别占总脂肪酸质量的25.13%和19.24%。
阿仑膦酸钠片 澳大利亚默沙东公司;血清中血管内皮生长因子(vascular endothelial growth factor,VEGF)、骨碱性磷酸酶(bone alkaline phosphatase,BALP)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒 美国R & D公司;通用型组织固定液(中性) 武汉赛维尔生物科技有限公司;UNIQ-10柱式TRIzol总RNA抽提试剂盒及随机引物 生工生物工程(上海)股份有限公司;TRIzol试剂 Ambion生物科技有限公司;RiboLock RNA酶抑制剂 美国Thermo Fisher Scientific公司;M-MLV逆转录酶 美国Promega公司;dNTP Mixture宝日医生物技术(北京)有限公司;Aggrecan、Col10a、MMP-13、PDGF-BB、Ang1、Col1a、OCN β-actin引物 苏州金唯智生物科技有限公司;SYBR Green荧光染料 美国Novoprotein 公司;其他试剂均为国产分析纯。
Neofuge 13R 型高速冷冻离心机 力康生物医疗科技控股有限公司;Model680型酶标仪 美国Bio-Rad公司;LightCycler480实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪 瑞士Roche公司;RM2125RTS石蜡切片机 德国Leica公司;BH14光学显微镜 日本Olympus公司;YLS-16A小动物骨骼强度测定仪 济南益延科技发展有限公司;GK99-UNIGAMMA X-RAY PLUS双能X射线骨密度仪意大利I’can公司;SCANCO微型计算机断层扫描(micro computed tomography,μCT)仪 瑞士Scanco Medical AG公司;100型高效液相色谱仪 美国Aglient公司;ICS2000型离子色谱仪 美国Dionex公司;Ultra Trurrax T18 basic型高速匀浆机 德国IKA公司。
1.3.1 动物分组及模型建立
C57BL/6J小鼠随机分为假手术组(Sham组,36 只)和去卵巢组(OVX组,90 只),腹腔注射水合氯醛(400 mg/kg mb)进行麻醉,Sham组切除卵巢周围少量脂肪组织,OVX组行双侧去卵巢手术。术后3 个月,每组取4 只小鼠进行安乐死,取股骨进行骨密度分析,结果显示,与Sham组相比,OVX组小鼠股骨骨密度显著降低(P<0.05),证明骨质疏松模型建立成功(图1A)。

图1 小鼠骨质疏松性骨折模型的建立
Fig. 1 Establishment of the osteoporotic fracture model
随后小鼠于右胫骨中上1/3处行开放性骨折手术(图1B)。将手术成功的小鼠进行分组:Sham组小鼠骨折后作为一般骨折对照组(Control组),去卵巢小鼠骨折后随机分为骨质疏松性骨折模型组(Model组)、阳性对照组(ALN组)、AKO组,每组27 只。骨折后立即灌胃受试物,其中Control组、Model组小鼠灌胃生理盐水,ALN组小鼠灌胃阿伦磷酸钠(质量浓度为0.1 mg/mL),AKO组小鼠灌胃南极磷虾油(质量浓度为30 mg/mL),灌胃剂量均为10 mL/kg mb。骨折术后第5天,每组取5 只小鼠禁食不禁水8 h,行尾静脉取血,常规分离血清用于生化指标检测。术后11、24 d每组取8 只小鼠禁食不禁水8 h,摘眼球取血,收集血清用于生化指标检测;小鼠脱颈椎处死后,迅速分离右胫骨痂组织,用于组织形态学观察(11、24、35 d,每组4 只)、2D μCT分析(24 d,每组3 只)、生物力学分析(56 d,每组4 只)及骨折愈合相关基因检测(11、24 d,每组4 只)。
1.3.2 血清生化指标测定
参照ELISA试剂盒方法测定血清VEGF质量浓度和BALP活力。
1.3.3 股骨组织骨密度测定
小鼠去卵巢术后3 个月,取股骨组织,采用双能X射线骨密度测试仪检测骨密度。
1.3.4 骨痂组织形态学观察
小鼠右胫骨痂于组织固定液固定24 h,质量分数8%乙二胺四乙酸二钠(pH 7.3)脱钙 2~3 周石蜡包埋切片(5 μm厚),进行苏木精-伊红(hematoxylin-eosin,HE)染色,光学显微镜下观察骨痂组织学特点并成像。
1.3.5 骨痂2D μCT分析
小鼠骨折术后第24天取材骨痂组织,采用2D μCT扫描仪进行扫描,并使用配套软件分析骨折区形态学参数。用ImageJ软件分析2D μCT图像获得的愈伤组织横切面,计算横切面的最大长度和最小长度以评估愈伤组织的大小。
1.3.6 骨痂生物力学测定
在骨折后第56天取材骨痂组织,通过小鼠骨骼强度测试仪的3点弯曲测试来确定胫骨骨折区的最大弯曲刚度。
1.3.7 qPCR分析
取小鼠骨折后第11、24天骨痂组织,检测骨折愈合相关基因mRNA相对表达量。采用总RNA抽提试剂盒法提取骨痂组织总RNA,取1 μg骨痂总RNA在反转录酶M-MLV的催化下逆转录成cDNA。随后进行荧光实时定量PCR(quantitative real-time PCR,qPCR)扩增,各反应物用量参照Maxima SYBR Green qPCR Mastermix说明书要求。反应条件为:95 ℃预变性5 min;95 ℃变性15 s,60 ℃退火20 s,72 ℃延伸30 s,共45 个循环。相关目的基因的引物序列如表1所示,以β-actin作为内参校正目的基因mRNA表达量。
表1 小鼠骨折愈合相关基因的引物序列
Table 1 Primer sequences used for qPCR amplification of fracture healing related genes

基因 上游引物(5’-3’) 下游引物(5’-3’)Aggrecan TTGCAGACCAGGAGCAATGT CGGTCATGAAAGTGGCGGTA Col10a AGGTATGGCTCCAATTGCCC AGGACGAGTGGACGTACTCA MMP-13 GACCCCAACCCTAAGCATCC CCTCGGAGACTGGTAATGGC PDGF-BB TCCACCAGCAGCGATTCCTCAG GTGCCATCAGAGTTCCTCCAGTCT Ang1 ATTCGCCATCCCAACAGGAA ATCAAGAACAACGGGCCTGG Col1a AGCACGTCTGGTTTGGAGAG GACATTAGGCGCAGGAAGGT OCN GCCCTGAGTCTGACAAAGCCTTCCGGTCTTCAAGCCATACTGGTCTG β-actin TGTCCACCTTCCAGCAGATGT AGCTCAGTAACAGTCCGCCTAGA
采用SPSS 17.0软件对实验数据进行单因素方差分析,并进行最小显著性差异法和SNK(Student-Newman-Keuls)法组间比较分析,P<0.05为差异显著。

图2 AKO对小鼠血清生化指标的影响
Fig. 2 Effect of AKO on serum biochemical indicators
由图2A可知,各组VEGF表达高峰期集中在骨折后第5、11天,说明新血管的生成及入侵主要发生在骨折愈合的早中期。骨折后第5、11天,Model组血清VEGF质量浓度较Control组均显著降低,经AKO干预后VEGF质量浓度分别上升了6.39%和8.05%(P<0.05),提示AKO在骨折愈合早中期促进血管新生与入侵。图2B显示,各组BALP在骨折术后第24天呈现高表达,表明这个时期是活跃的新骨形成阶段。此外,骨折后第11天,与Control组相比,Model组血清BALP活力显著降低,而AKO组极显著升高(P<0.01)。提示在骨折愈合期间,AKO可增强成骨细胞活性、促进新骨形成。

图3 AKO对小鼠骨折后11 d骨痂组织形态学的影响
Fig. 3 Effect of AKO on callus histomorphology at 11 days post-fracture
对不同时间点的骨痂组织切片进行HE染色,动态观察骨痂形态学变化,从而反映软骨内骨化进程。如图3所示,骨折手术后11 d,Control组骨折区愈伤组织由大量编织骨组织和少量软骨组织组成。然而,Model组主要充斥大量软骨愈伤组织,且多数处于增殖期。模型小鼠经AKO干预后,骨痂中大量软骨细胞变得肥厚,并伴有软骨基质降解和矿化新骨替代软骨现象,表明AKO促进软骨细胞肥大、凋亡及新骨矿化,使小鼠提前完成软骨痂期过渡至硬骨痂期。

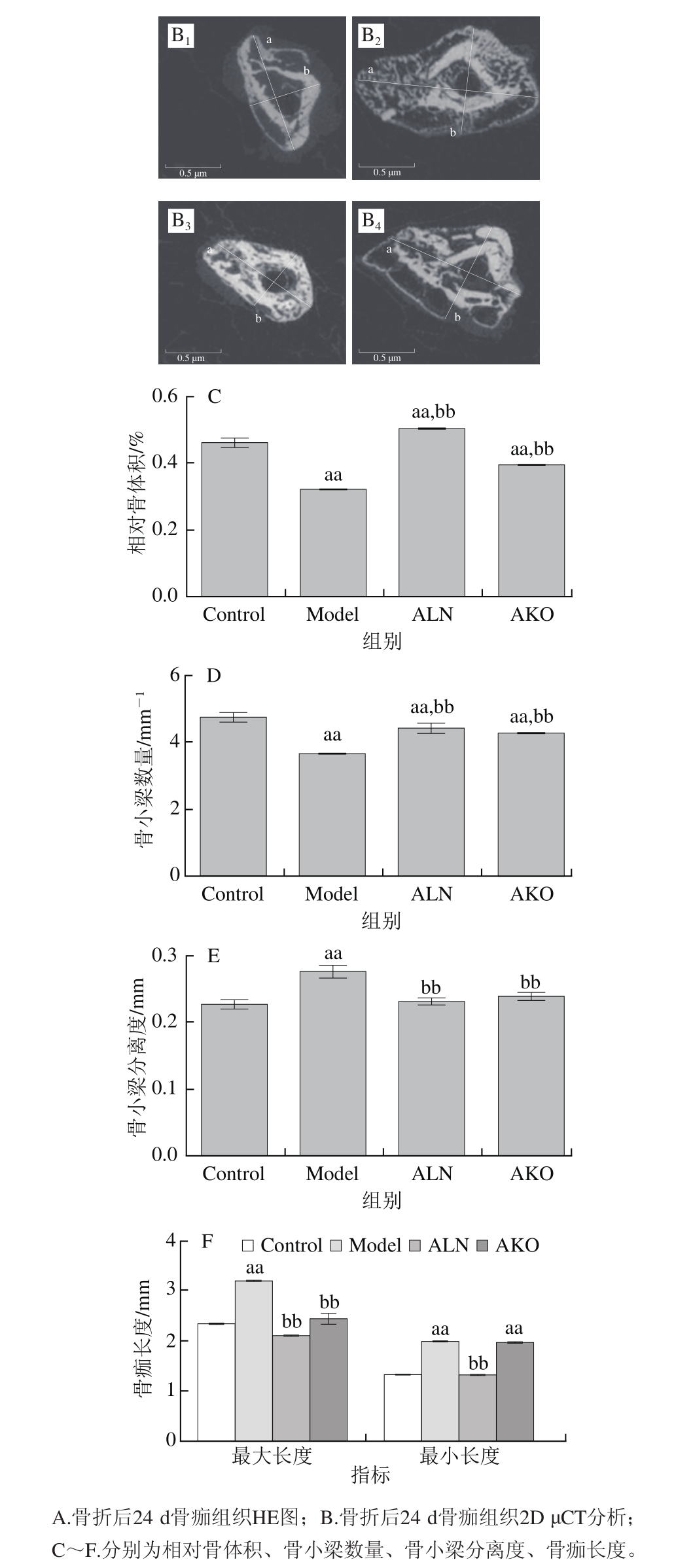
图4 AKO对小鼠骨折后24 d骨痂组织形态学及微结构的影响
Fig. 4 Effect of AKO on histomorphology and microstructure of callus at 24 days post-fracture
图4 A表明,骨折后24 d软骨性骨痂已经转化为硬骨骨痂,且逐渐丰富聚集演变成致密的板层骨桥接骨折断端。结果显示,Control组骨痂由致密的编织骨填充,且向成熟的板层骨转变;而Model组编织骨含量较少,且疏松散乱。补给AKO后,小鼠骨痂内编织骨的数量增加,且聚合呈片状骨。结果提示AKO可以促进骨性骨痂的形成与成熟。此外,第24天愈伤组织的2D μCT分析(图4C~E)表明,AKO通过增加相对骨体积(增加16.97%)、骨小梁数量(增加14.77%),降低骨小梁分离度(降低18.53%),使模型小鼠骨性骨痂微结构得到显著改善。2D μCT结果显示,AKO组较Model组骨痂横截面最大长度减少了23.51%(P<0.01)(图4B、F),在一定程度上反映了AKO在骨折手术后第24天显著降低了愈合组织的大小,加速后期骨重塑。
综上表明,AKO通过加速软骨细胞肥大和矿化、促进硬骨痂的形成与完善,增加愈伤组织的成熟,从而促进骨折愈合。
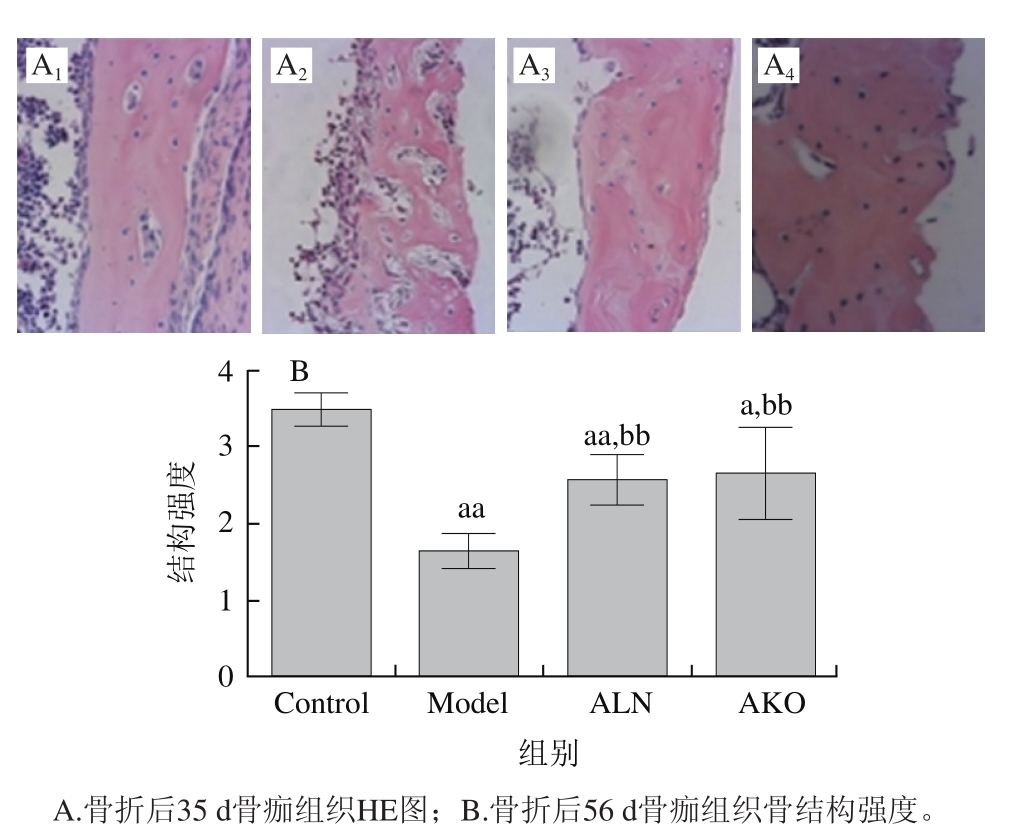
图5 AKO对小鼠骨折后35 d骨痂组织形态学及56 d骨痂生物力学性能的影响
Fig. 5 Effect of AKO on callus histomorphology at 35 days post-fracture and biomechanical properties of callus on at 56 days post-fracture
图5 A显示,骨折后35 d,Control组骨痂在将形成皮质骨的区域观察到致密的板层骨,而Model组骨折处的板层骨塑型不完全,间隙较大;灌胃AKO后,板层骨痂致密成熟,骨重塑能力显著增强。骨折后56 d骨痂的弯曲刚度测试结果(图5B)显示,Model组骨痂结构强度较Control组显著降低,说明骨质疏松症损害了OPF愈合质量;经AKO治疗后,骨痂结构强度极显著升高59.28%(P<0.01)。以上结果提示,AKO可促进骨重塑的完成,使新骨快速恢复正常的机械强度,提高新骨的内在质量和抗外力性能。
骨折愈合过程中软骨内成骨相关关键因子的mRNA相对表达量检测结果显示(图6),骨折术后第11天,与Control组相比,Model组Aggrecan、Col10a表达量显著升高;而MMP-13、PDGF-BB、Ang1、Col1a及OCN相对表达量显著降低,直到术后第24天表达量才上升。提示Model组小鼠骨折后第11天愈合过程仍处于软骨痂优势阶段,直至第24天才集中发生软骨矿化及骨性骨痂的重塑。说明由于骨质疏松症的影响,软骨痂的成熟及矿化被严重推迟。模型小鼠灌胃AKO后,骨痂Aggrecan、Col10a表达量在术后第11天显著下调,分别下降53.43%、20.47%;而MMP-13、PDGF-BB、Ang1、Col1a及OCN相对表达量在骨折后第11天显著上调,分别升高85.53%、187.83%、115.5%、35.15%、134.74%。另外,图6B、C显示,骨折后第24天,AKO组小鼠MMP-13、PDGF-BB、Ang1表达量降低,而Col1a及OCN表达量显著升高(P<0.05)。以上结果提示,AKO可通过调控软骨内骨化相关基因的表达,促进血管入侵,加速OPF小鼠软骨痂向钙化软骨痂转变,从而加速骨折愈合。
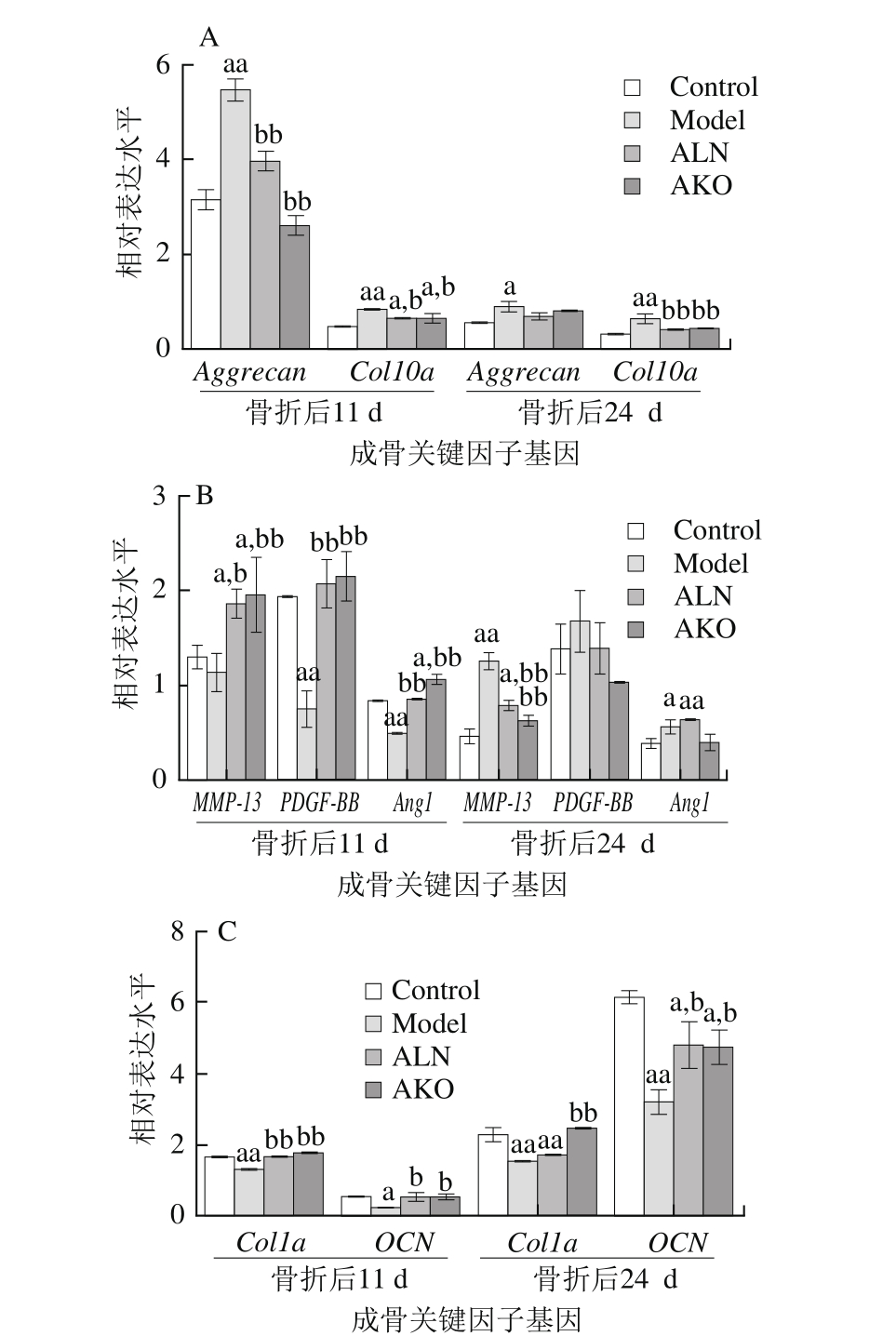
图6 AKO对小鼠软骨内成骨相关基因mRNA表达的影响
Fig. 6 Effect of AKO on mRNA expression of key genes related to endochondral ossification
本实验采用OVX手术及单侧胫骨开放性骨折手术建立OPF模型,通过检测OPF愈合过程中软骨内成骨时期和骨痂重塑期相关的各项指标,探究AKO对骨质疏松模型小鼠骨折愈合的作用。结果表明,AKO可促进OPF愈合过程中的成软骨分化、软骨成熟肥大、软骨基质降解、新血管生成和新骨形成,加速软骨内骨化进程;促进硬骨痂塑型,增强新骨机械强度,提高愈合质量。
骨折愈合是一个响应骨损伤而发生的复杂多阶段的骨修复过程,其最终目标是使受损的骨返回到功能和生物力学健全的状态。骨质疏松性骨折愈合主要经历以下3 个紧密连接的阶段:1)骨折断端形成血肿、募集间充质干细胞的炎症期;2)骨膜反应为特征的膜内成骨,以及经历软骨骨痂-矿化软骨痂-编织骨样骨性骨痂的逐步过渡的软骨内骨化阶段;3)包括骨再吸收和骨形成的骨痂重塑阶段,使骨恢复原始形态和质量[23-24]。
软骨内成骨阶段是发生在骨质疏松性骨折愈合早中期的重要阶段:在此过程中,大量具有多向分化潜能的MSCs被募集到骨折断端,在转化生长因子-β(transforming growth factor-β,TGF-β)等生长因子作用下分化为软骨细胞;软骨细胞大量增殖,分泌软骨蛋白聚糖;软骨细胞成熟肥大,分泌X型胶原,形成软骨骨痂[25]。随后,由于软骨痂机械强度无法满足机体需求,它将被编织骨由外向内逐渐替代:软骨愈伤组织分泌MMP-13等因子进行软骨基质降解,最终软骨细胞凋亡[26];成骨细胞入侵增殖分化、分泌骨基质并矿化成小梁骨,并逐渐汇聚成致密的板层骨,形成骨性骨痂连接骨折断端[27]。骨折后第11、24天的骨痂HE、2D μCT结果显示,相比于Model组小鼠,AKO组小鼠骨折区提前出现大量肥大软骨细胞并伴有软骨基质降解,部分软骨被矿化新骨代替,形成松散的小梁骨;随后更快地转变成了致密、骨微结构优良的成熟板层骨。提示AKO通过促进软骨内骨化进程,改善骨质疏松引起的骨折愈合延迟现象。
软骨内骨化进程受多种生长因子调控:其中Aggrecan、Col10a、MMP-13是软骨细胞增殖、肥大、基质降解的标志物[28-30];VEGF、PDGF-BB、Ang是血管生成及入侵相关的关键调控因子[31],促进氧分压的改善及营养、成骨细胞和破骨细胞的运输;BALP、Col1a、OCN表达量反映成骨细胞活性[32],是重要的骨生成标志物,可以反应硬骨痂形成及重塑情况。血清及基因检测结果显示,模型小鼠灌胃AKO后,骨折后第11天的骨痂Aggrecan、Col10a表达量显著降低,而MMP-13、VEGF、PDGF-BB、Ang1、ALP、Col1a及OCN的mRNA相对表达量显著上调,表明AKO促进软骨细胞增殖、肥大、凋亡及矿化。同时骨折后第24天,骨痂MMP-13、PDGF-BB、Ang1 mRNA相对表达量降低,而Col1a及OCN mRNA相对表达量显著升高,说明AKO组已提前完成血管入侵,且加速了新骨的形成,进一步证明了AKO加速软骨内骨化,促进骨折愈合。
骨折愈合后期以骨重塑为主:为了恢复骨的原有模式,骨性骨痂进行骨塑形与改建,髓腔中多余的愈伤组织被吸收、清除,髄腔重新沟通,皮质骨区演变出生物力学性能优良的板层骨,恢复正常骨结构。此阶段主要经历破骨细胞对松散的编织骨进行重吸收,并伴随成骨细胞形成新的成熟板层骨的爬行替代过程,使原始骨痂的形状和大小被重塑[33],生物力学性能得到改善[34-35]。骨折后第35天,组织学观察结果显示AKO组较Model组具有更强的骨重塑能力,形成致密的新骨桥接骨折断端。骨折后第56天,AKO组骨痂最大弯曲刚度较Model组显著增加,说明骨折愈合质量更优。综上结果表明,AKO能够在骨折愈合末期促进骨性骨痂重塑,优化骨痂力学结构。
综上所述,AKO通过调控血管生成因子、软骨内成骨相关因子的表达以及成骨细胞活性来增强血管入侵、软骨内成骨以及骨重塑,改善因骨质疏松导致的骨折愈合延迟与损伤,提高愈合质量。
[1] KANIS J A, MCCLOSKEY E V, JOHANSSON H, et al. European guidance for the diagnosis and management of osteoporosis in postmenopausal women[J]. Osteoporosis International, 2013, 24(1):23-57. DOI:10.1007/s00198-012-2074-y.
[2] 于利, 李长洲, 王腾飞, 等. 唑来膦酸在骨质疏松骨折术后应用的临床疗效分析[J]. 中华关节外科杂志(电子版), 2015, 9(5): 676-679.DOI:10.3877/cma.j.issn.1674-134X.2015.05.026.
[3] STROM O, BORGSTROM F, KANIS J A, et al. Osteoporosis: burden,health care provision and opportunities in the EU: a report prepared in collaboration with the International Osteoporosis Foundation (IOF)and the European Federation of Pharmaceutical Industry Associations(EFPIA)[J]. Archives of Osteoporosis, 2011, 6(1/2): 59-155.DOI:10.1007/s11657-011-0060-1.
[4] VAN STARR T P, DENNISON E M, LEUFKENS H G, et al.Epidemiology of fractures in England and Wales[J]. Bone, 2001,29(6): 517-522.
[5] MCCANN R M, COLLEARY G, GEDDIS C, et al. Effect of osteoporosis on bone mineral density and fracture repair in a rat femoral fracture model[J]. Journal of Orthopaedic Research, 2008,26(3): 384-393. DOI:10.1002/jor.20505.
[6] VON RÜDEN C, AUGAT P. Failure of fracture fixation in osteoporotic bone[J]. Injury, 2016, 47(Suppl 2): 3-10. DOI:10.1016/S0020-1383(16)47002-6.
[7] 杨丹, 栗平, 赵平. 探讨骨质疏松性骨折的相关影响因素及预防[J].中国骨质疏松杂志, 2014, 20(2): 152-155.
[8] BAHNEY C S, HU D P, MICLAU T, et al. The multifaceted role of the vasculature in endochondral fracture repair[J]. Frontiers in Endocrinology, 2015, 6: 4. DOI:10.3389/fendo.2015.00004.
[9] PISANI P, RENNA M D, CONVERSANO F, et al. Major osteoporotic fragility fractures: risk factor updates and societal impact[J]. World Journal of Orthopedics, 2016, 7(3): 171-181. DOI:10.5312/wjo.v7.i3.171.
[10] KIM S M, KANG K C, KIM J W, et al. Current role and application of teriparatide in fracture healing of osteoporotic patients: a systematic review[J]. Journal of Bone and Mineral Metabolism, 2017, 24(1): 65-73. DOI:10.11005/jbm.2017.24.1.65.
[11] MACKERT G A, SCHULTE M, HIRCHE C, et al. Low-energy extracorporeal shockwave therapy (ESWT) improves metaphyseal fracture healing in an osteoporotic rat model[J]. PLoS ONE, 2017,12(12): e0189356. DOI:10.1371/journal.pone.0189356.
[12] LI W, WANG K, LIU Z, et al. HIF-1alpha change in serum and callus during fracture healing in ovariectomized mice[J]. International Journal of Clinical and Experimental Pathology, 2015, 8(1): 117-126.
[13] 张钢. 阿伦膦酸钠对大鼠股骨骨质疏松性骨折愈合过程的影响[D].重庆: 重庆医科大学, 2014: 13-16.
[14] 施佳慧, 吕桂善, 徐同成, 等. 磷虾油的脂肪酸成分及其降血脂功能研究[J]. 营养学报, 2008, 30(1): 115-116. DOI:10.3321/j.issn:0512-7955.2008.01.029.
[15] PHLEGER C F, NELSON M M, MOONEY B D, et al. Interannual and between species comparison of the lipids, fatty acids and sterols of Antarctic krill from the US AMLR Elephant Island survey area[J].Comparative Biochemistry and Physiology B-Biochemistry &Molecular Biology, 2002, 131(4): 733-747. DOI:10.1016/S1096-4959(02)00021-0.
[16] 王亚恩, 姜国良, 徐恺, 等. 南极磷虾油对高脂血症大鼠血脂和抗氧化力的影响[J]. 中国海洋药物, 2011, 30(3): 56-59. DOI:10.13400/j.cjmd.2011.03.011.
[17] WIBRAND K, BERGE K, MESSAOUDI M, et al. Enhanced cognitive function and antidepressant-like effects after krill oil supplementation in rats[J]. Lipids in Health and Disease, 2013, 12(1):6-19. DOI:10.1186/1476-511X-12-6.
[18] 刘忠华, 刘文杰. 葡萄皮提取物与磷虾油对肥胖高脂血症大鼠血脂的影响[J]. 山东化工, 2016, 45(21): 42-43; 46. DOI:10.3969/j.issn.1008-021X.2016.21.017.2.
[19] 黄婧. 磷虾油防治脂肪肝的实验研究进展[J]. 精细与专用化学品,2014, 22(9): 20-22. DOI:10.3969/j.issn.1008-1100.2014.09.005.
[20] 郑琳, 刘潇阳, 周新, 等. 南极磷虾油对负重游泳小鼠的抗疲劳作用[J]. 大连工业大学学报, 2015, 34(2): 108-110. DOI:10.19670/j.dlgydxxb.2015.02.007.
[21] 冯迪娜, 袁玥, 朱晓丽.南极磷虾油生理功能的研究进展[J].食品研究与开发, 2015, 36(7): 115-117. DOI:10.3969/j.issn.1005-6521.2015.07.031.
[22] 喜文天. 多不饱和脂肪酸对软骨基质金属蛋白酶-13分泌的影响及其机制的探究[D]. 北京: 首都医科大学, 2014: 1-17.
[23] KATES S L, ACKERT-BICKNELL C L. How do bisphosphonates affect fracture healing?[J]. Injury, 2017, 47(1): S65-S68. DOI:10.1016/S0020-1383(16)30015-8.
[24] BAO Q, CHEN S, QIN H, et al. An appropriate Wnt/β-catenin expression level during the remodeling phase is required for improved bone fracture healing in mice[J]. Scientific Reports, 2017, 7(1):2695-2706. DOI:10.1038/s41598-017-02705-0.
[25] MEYER E G, BUCKLEY C T, THORPE S D, et al. Low oxygen tension is a more potent promoter of chondrogenic differentiation than dynamic compression[J]. Journal of Biomechanics, 2010, 43(13):2516-2523. DOI:10.1016/j.jbiomech.2010.05.020.
[26] GERSTENFELD L C, CHO T J, KON T, et al. Impaired fracture healing in the absence of TNF-alpha signaling: the role of TNF-alpha in endochondral cartilage resorption[J]. Journal of Bone and Mineral Research, 2003, 18(9): 1584-1592. DOI:10.1359/jbmr.2003.18.9.1584.
[27] BURKE D P, KELLY D J. Substrate stiffness and oxygen as regulators of stem cell differentiation during skeletal tissue regeneration:a mechanobiological model[J]. PLoS ONE, 2012, 7(7): e40737.DOI:10.1371/journal.pone.0040737.
[28] WANG P, ZHANG F, HE Q, et al. Flavonoid compound icariin activates hypoxia inducible factor-1 alpha in chondrocytes and promotes articular cartilage repair[J]. PLoS ONE, 2016, 11(2):e0148372. DOI:10.1371/journal.pone.0148372.
[29] ZHANG X, PRASADAM I, FANG W, et al. Chondromodulin-1 ameliorates osteoarthritis progression by inhibiting HIF-2a activity[J].Osteoarthritis Cartilage, 2016, 24(11): 1970-1980. DOI:10.1016/j.joca.2016.06.005.
[30] RAY S, THORMANN U, SOMMER U, et al. Effects of macroporous,strontium loaded xerogel-scaffolds on new bone formation in criticalsize metaphyseal fracture defects in ovariectomized rats[J]. Injury,2016, 4: 52-61. DOI:10.1016/S0020-1383(16)30013-4.
[31] BENEST A V, SALMON A H, WANG W Y, et al. VEGF and angiopoietin-1 stimulate different angiogenic phenotypes that combine to enhance functional neovascularization in adult tissue[J]. Microcirculation, 2006, 13(6): 423-437.DOI:10.1080/10739680600775940.
[32] LIU Q, WAN Q L, YANG R T, et al. Effects of intermittent versus continuous parathyroid hormone administration on condylar chondrocyte proliferation and differentiation[J]. Biochemical and Biophysical Research Communications, 2012, 424(1): 182-188.DOI:10.1016/j.bbrc.2012.06.106.
[33] MARSELL R, EINHORN T A. The biology of fracture healing[J].Injury, 2011, 42(6): 551-555. DOI:1016/j.injury.2011.03.031.
[34] ZHAN Q, GUI X, WANG F, et al. Sialoglycoprotein isolated from the eggs of gadus morhua enhances fracture healing in osteoporotic mice[J]. Food & Function, 2017, 8(3): 1094-1104. DOI:10.1039/c6fo01346e.
[35] BUTEZLOFF M M, ZAMARIOLI A, LEONI G B, et al. Wholebody vibration improves fracture healing and bone quality in rats with ovariectomy-induced osteoporosis[J]. Acta Cirurgica Brasileira, 2015,30(11): 727-735. DOI:10.1590/S0102-865020150110000002.
Antarctic Krill Oil Enhances Fracture Healing in Osteoporotic Mouse Model
李媛媛, 毛相朝, 唐彭皓, 等. 南极磷虾油对骨质疏松模型小鼠骨折愈合的促进作用[J]. 食品科学, 2019, 40(11):159-166. DOI:10.7506/spkx1002-6630-20180223-182. http://www.spkx.net.cn
LI Yuanyuan, MAO Xiangzhao, TANG Penghao, et al. Antarctic krill oil enhances fracture healing in osteoporotic mouse model[J]. Food Science, 2019, 40(11): 159-166. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180223-182.http://www.spkx.net.cn