核桃对东莨菪碱诱导的小鼠记忆障碍的预防作用
佴逸凡,冯 莉,廖剑桥,马 琦,伯继芳,李 梅*,徐怀德*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
摘 要:用东莨菪碱(scopolamine,SCOP)诱导小鼠记忆障碍模型,探究饲料中添加核桃对小鼠学习记忆能力的影响。实验组喂食含有质量分数9%核桃(核桃高剂量组和高剂量预防组)或6%核桃(核桃低剂量组和低剂量预防组)的饲料,而对照组(空白组、模型组和阳性对照组)喂食普通饲料。在第8周时,通过Morris水迷宫(Morris water maze,MWM)和小鼠脑组织丙二醛(malondialdehyde,MDA)、谷胱甘肽(glutathione,GSH)含量和总超氧化物歧化酶(total superoxide dismutase,T-SOD)、乙酰胆碱酯酶(acetylcholinesterase,AChE)活力测定,评估小鼠的学习记忆表现。结果表明:与模型组相比,在MWM实验中,高剂量核桃预防组的逃避潜伏期在第4天极显著缩短(P<0.01),穿台次数显著增加(P<0.05),目标象限停留时间及路程占比分别显著延长和提高(P<0.05),同时,脑组织中AChE活力((0.94±0.08)U/mg)、MDA含量((11.64±0.58)nmol/mg)显著降低(P<0.05),GSH含量((69.53±2.11)mg/g)、T-SOD活力((93.36±4.94)U/mg)显著提高(P<0.05)。结论:饲料中添加核桃可以抑制小鼠大脑氧化损伤,增强胆碱能功能,预防SCOP诱导的小鼠记忆障碍,提高小鼠的学习记忆能力。
关键词:核桃;小鼠记忆障碍模型;Morris水迷宫;抗氧化作用;学习记忆
随着人们生活水平的提高,人的寿命逐渐延长,但人口老龄化带来的老年性疾病越来越多,慢性神经退行性疾病发病率也逐渐增加,其中阿尔茨海默病(Alzheimer’s disease,AD)是一种影响认知和行为的神经退行性疾病,临床持续时间长,记忆障碍是其最常见的症状[1],常用胆碱能损伤学说来解释。AD与胆碱能系统中的酶有关,特别是乙酰胆碱酯酶(acetylcholinesterase,AChE)过度分解乙酰胆碱成为乙酸和胆碱[2],并导致乙酰胆碱缺陷和认知功能障碍。国内外用于治疗AD的药物有胆碱酯酶抑制剂[3]和谷氨酸受体拮抗剂[4],但药物具有副作用,且维持时间短[5]。植物性食物安全性高且具有多种营养因子,将其添加到饮食中可以作为预防AD的一种有效方式[6]。植物多酚、黄酮类物质具有营养神经功能,可以用于预防和治疗AD[7-10],Luchtman等的研究表明n-3多不饱和脂肪酸通过促进神经元生长从而恢复认知障碍或神经元缺陷[11]。
中国传统饮食观念认为核桃益智健脑。中国是世界上最大的核桃生产和消费国,核桃种植面积达5 000万 km2,总产量超过300万 t,而且核桃含质量分数17%的蛋白质和近70%的脂质[12],其中主要的脂肪酸是油酸、亚油酸和亚麻酸等不饱和脂肪酸,且比例合适[13]。核桃中还含有许多其他神经保护成分,包括VE、叶酸、褪黑素[14]和高含量的抗氧化多酚[15]。Calcabrini等认为核桃仁提取物作为膳食补充剂可以促进健康,预防以及治疗与生活方式有关的氧化疾病[16]。以往的研究表明,在食物中添加核桃可以提高动物的记忆、认知和运动功能[17-19]。
东莨菪碱可通过拮抗毒蕈碱乙酰胆碱受体阻断中枢神经系统的胆碱能功能[20],是常用的小鼠学习和记忆能力损伤建模方法[21]。腹腔内注射东莨菪碱不仅可引起记忆障碍,造成海马中总超氧化物歧化酶(total superoxide dismutase,T-SOD)和谷胱甘肽过氧化物酶的活性降低,脂质过氧化指标丙二醛(malondialdehyde,MDA)含量升高,而且可以引起大脑中活性氧簇(reactive oxygen species,ROS)的产生[22],大脑中产生过量的ROS将导致神经元功能障碍,进一步导致神经退行性疾病甚至死亡[23]。邓海峰等用行为学和电生理学等方法证明褪黑素能够增强乙酰化转移酶的活性,改善中枢胆碱能系统,对东莨菪碱诱导的大鼠学习记忆障碍有明显的改善作用[24]。但核桃对东莨菪碱诱导的小鼠学习和记忆能力损伤是否有预防作用仍不清楚。因此,本研究用东莨菪碱建立小鼠记忆障碍模型,将核桃添加到小鼠饲料中,探究核桃对小鼠学习和记忆能力损伤的预防作用。
1 材料与方法
1.1 动物、材料与试剂
SPF级昆明雄性小鼠,体质量28~32 g,由西安交通大学实验动物中心提供(生产许可证号:SCXK(陕)2012-003)。饲养条件:温度22~26 ℃、湿度50%~70%,采用12 h昼夜间断照明。动物自由进食、饮水,适应性饲养1 周。
核桃仁 宜君县益智源有机核桃开发有限公司;动物饲料 西安交通大学实验动物中心;吡拉西坦片宜昌人福药业有限责任公司;氢溴酸东莨菪碱注射液上海禾丰制药有限公司;蛋白定量试剂盒、谷胱甘肽(glutathione,GSH)试剂盒、MDA试剂盒、T-SOD试剂盒、AChE试剂盒 南京建成生物工程研究所。
1.2 仪器与设备
Morris水迷宫视频分析系统 北京众实迪创科技发展有限责任公司;T10 basic ULTRA-TURRAX®小型分散机 德国IKA集团;UV-1780紫外-可见分光光度计日本岛津公司;HC-3018R高速冷冻离心机 安徽中科中佳科学仪器有限公司;超低温保存箱 中国澳柯玛股份有限公司。
1.3 方法
1.3.1 动物分组与给药
将动物饲料与核桃分别磨成粉末,然后以核桃质量分数6%或9%的比例混匀,加入适量的纯净水搅拌均匀,挤压成型、烘干,制成核桃质量分数分别为6%和9%的低剂量、高剂量核桃饲料。
将昆明小鼠随机分为7 组,每组10 只,分别为空白组、核桃高剂量组和低剂量组、模型组、阳性对照组、高剂量核桃预防组和低剂量核桃预防组。阳性对照组灌胃0.01 mL/g(以体质量计)800 mg/kg吡拉西坦[25],其余组给予等量的纯净水;同时,核桃高剂量组和高剂量预防组、核桃低剂量组和低剂量预防组分别喂食含质量分数9%或6%核桃的饲料。连续喂养8 周,于第8周进行Morris水迷宫行为学测试,在测试前30 min,模型组、阳性对照组、核桃高剂量预防组和低剂量预防组分别腹腔注射0.01 mL/g(以体质量计)3 mg/kg东莨菪碱[26],建立记忆障碍模型,其余组腹腔注射等量的生理盐水。
1.3.2 Morris水迷宫行为学测试
Morris水迷宫为直径120 cm、高50 cm的圆形水池,水温保持在21~23 ℃,迷宫上方安装摄像机,记录小鼠运动轨迹。将水池等分为4 个象限,平台置于第4象限的中间位置。实验前,将小鼠放入水迷宫中自由游泳1 min,以适应水温、熟悉环境。
定位航行实验:第1天训练时,将平台置于高出水面1 cm处,小鼠分别从平台之外的另外3 个不同的象限入水,每次入水之前在平台上停留30 s,找到平台后再停留30 s;对于超过60 s找不到平台的小鼠,将其引导至平台后停留30 s。第2~5天,将平台置于低于水面1 cm处,水中添加黑色素。实验时将小鼠从不同象限面向池壁放入水中,记录小鼠找到平台并停留3 s以上的时间,此为逃避潜伏期。超过60 s找不到平台的小鼠逃避潜伏期记为60 s,并将其引导至平台停留30 s。记录小鼠在训练期间的逃避潜伏期和找到平台的游泳总路程。
空间探索实验:实验第6天将平台撤去,其他条件同上,测定小鼠60 s内在平台所在象限停留的时间、穿越平台所在空间的次数(穿台次数),其在平台所在空间的游泳路程与其游泳总路程的百分比为目标象限路程占比。
1.3.3 生化指标测定
行为学测试后的第2天,所有小鼠禁食不禁水12 h后称体质量并记录。断头处死小鼠,准确称取脑组织质量,按料液比1:9加入生理盐水,冰水浴条件下机械匀浆,4 000 r/min离心10 min,取上清液,-80 ℃保存备用。根据试剂盒说明书进行操作,分别检测各组小鼠脑组织中MDA含量、GSH含量、T-SOD活力和AChE活力。
1.4 数据统计与分析
所有数据均以 ±s表示。使用SPSS 20.0软件进行单因素方差分析和t检验,P<0.05为差异显著,P<0.01为差异极显著。用Excel软件作图。
2 结果与分析
2.1 核桃对小鼠Morris水迷宫空间记忆影响
2.1.1 定位航行实验结果
如表1所示,随着训练时间的延长,小鼠的运动表现得到改善,所有组小鼠的逃避潜伏期均缩短。方差分析结果显示,各组小鼠训练期间的平均潜伏期有显著差异(P<0.05),但是没有观察到训练时间和处理方式间的相互作用(P>0.05)(未在表中显示)。在整个训练期间,与空白组小鼠相比,模型组小鼠需要花费更长的时间找到平台。结果显示,东莨菪碱处理会对小鼠造成明显的认知功能障碍。训练第3~4天,与空白组相比,喂食两种质量分数的核桃饲料均显著缩短了小鼠的逃避潜伏期(P<0.05)。与模型组相比,摄入核桃饲料和吡拉西坦的记忆障碍小鼠的逃避潜伏期在第4天显著缩短(P<0.05)。
表1 低剂量和高剂量的核桃饮食对小鼠水迷宫实验逃避潜伏期的影响
Table 1 Effects of low-dose and high-dose walnut kernel on escape latency in water maze test

注:a.与空白组相比有显著差异(P<0.05);b.与模型组相比有显著差异(P<0.05)。下同。
组别 逃避潜伏期/s第1天 第2天 第3天 第4天空白组 45.87±9.78 40.94±8.74 36.78±10.11 29.80±6.13低剂量核桃组 41.63±11.08 31.24±6.27a 25.68±11.41a 22.25±4.40a高剂量核桃组 44.34±3.76 29.33±6.12a 24.00±6.29a 19.50±5.66a模型组 51.54±5.50 49.40±7.79 44.27±5.92 43.15±7.25a阳性对照组 45.19±7.92 39.48±7.53b 37.59±8.26 32.22±7.14b低剂量核桃预防组 47.05±8.39 41.43±2.84 38.69±4.70 33.00±6.73b高剂量核桃预防组 45.72±6.39 43.26±9.98 39.24±8.90 32.71±7.17b
表2 低剂量和高剂量的核桃饮食对小鼠水迷宫实验游泳总路程的影响Table 2 Effects of low-dose and high-dose walnut kernel on total distance traveled in water maze test

组别 游泳总路程/cm第1天 第2天 第3天 第4天空白组 2 630.9±1 628.9 1 019.5±183.6 747.9±102.4 604.3±166.7低剂量核桃组 1 383.5±98.0 849.5±63.0a 657.7±211.0 517.8±22.2高剂量核桃组 1 147.2±174.0 744.5±182.8a 575.8±164.7 515.1±36.4模型组 1 634.2±75.4 1 605.4±239.5a 1 233.2±477.9a 1 003.1±38.3a阳性对照组 1 259.3±102.3 1 032.9±56.8b 906.1±76.0b 658.7±55.0b低剂量核桃预防组 1 328.9±68.7 1 169.9±63.8b 1 052.8±73.1 713.6±57.5b高剂量核桃预防组 1 238.1±47.4 1 199.5±99.4b 923.7±106.1b 671.0±85.9b
如表2所示,随着训练时间的延长,各组小鼠的游泳总路程逐渐减少。与空白组小鼠相比,在训练第2天,摄入核桃饲料小鼠的游泳总路程显著减少(P<0.05);模型组小鼠的游泳总路程从第2天起显著多于空白组(P<0.05)。喂食核桃饲料后,高剂量核桃预防组小鼠与模型组相比训练第2~4天游泳总路程显著减少。
2.1.2 空间探索实验结果
表3 低剂量和高剂量的核桃饮食对小鼠水迷宫实验目标象限停留时间、穿台次数及目标象限路程占比的影响
Table 3 Effects of low-dose and high-dose walnut kernel on time spent in target quadrant, number of punctures, and percentage distance traveled in target quadrant

组别 目标象限停留时间/s 穿台次数 目标象限路程占比/%
在空间探索实验中,与空白组相比,摄入高剂量核桃饮食的小鼠在目标象限停留的时间由12.08 s延长至17.79 s(表3),目标象限路程所占比显著增加至28.38%(P<0.05);东莨菪碱处理后的小鼠在目标象限停留的时间缩短至7.03 s(P<0.05),穿台次数显著减少(P<0.05),且目标象限路程占比显著减少到14%(P<0.05)。摄入高剂量核桃饲料的记忆障碍小鼠在目标象限停留的时间为10.48 s,显著长于模型组(P<0.05),穿台次数及目标象限路程占比显著增加(P<0.05)。吡拉西坦饲喂也显著延长了记忆障碍小鼠在目标象限的停留时间,并增加穿台次数及目标象限路程占比(P<0.05)。
Morris水迷宫实验结果表明,喂食核桃饲料可以改善小鼠的学习能力,摄入高剂量核桃饲料的小鼠表现出更好的学习记忆能力。东莨菪碱可以造成空间学习和记忆功能方面的损伤,而核桃可以预防东莨菪碱造成的学习记忆障碍。
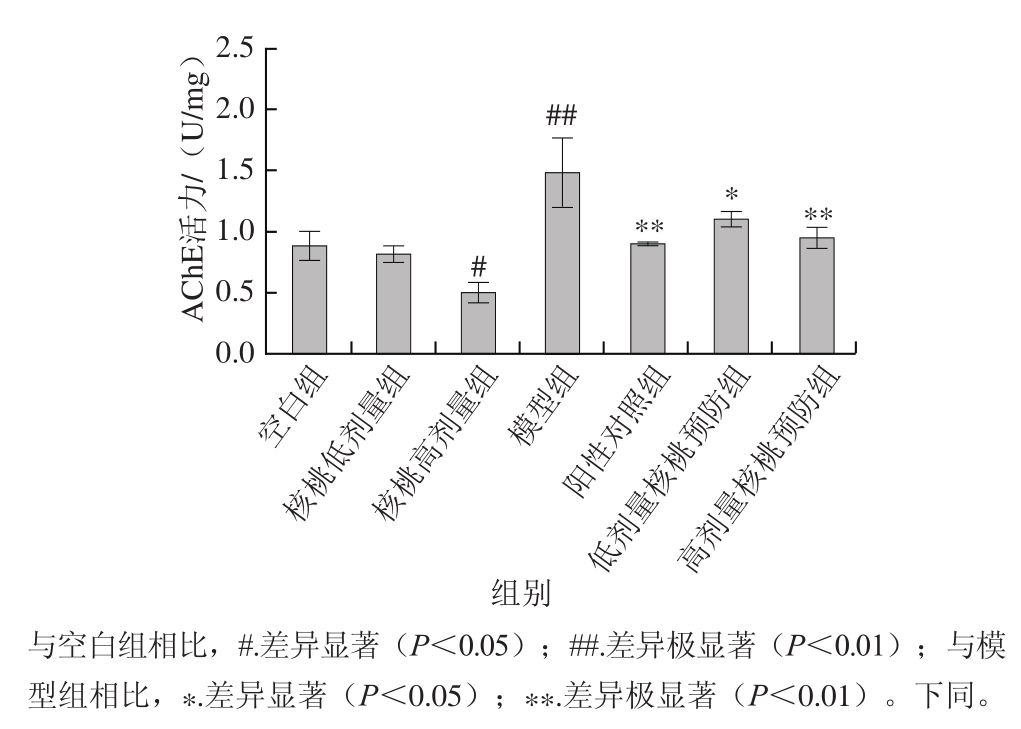
2.2 核桃对小鼠脑组织中AChE活力的影响
如图1所示,与空白组相比,摄入高剂量核桃饲料小鼠的AChE活力显著降低(P<0.05),而东莨菪碱可引起小鼠脑组织中AChE活力极显著升高(P<0.01)。与模型组相比,喂食吡拉西坦、高剂量及低剂量的核桃饲料可显著降低记忆障碍小鼠脑组织中的AChE活力(P<0.05),预防东莨菪碱造成的记忆损伤。其中,高剂量核桃预防组的AChE活力较模型组由1.48 U/mg降低至0.95 U/mg。
中枢胆碱能系统与学习记忆密切相关,乙酰胆碱是重要的神经递质之一,在学习记忆中起重要作用[27]。AChE作为胆碱能神经元的生理活性特异性标记物的蛋白质,在神经元乙酰胆碱的稳态中发挥重要作用[2],因此常将AChE活力的变化作为判断AD的生物标志物。研究结果显示,腹腔注射东莨菪碱后,小鼠脑组织中的AChE活力升高,表明东莨菪碱不仅可以损伤小鼠的空间学习和记忆功能,还能引起小鼠脑组织中的胆碱能系统功能障碍。高剂量的核桃饮食可以显著抑制AChE的活力,该结果与小鼠行为数据一致,表明核桃可以通过维持胆碱能系统的稳定来提供神经保护作用。
2.3 核桃对小鼠脑组织中MDA、GSH含量和T-SOD活力的影响
如图2所示,与空白组相比,高剂量的核桃饮食可显著降低小鼠MDA含量,提高GSH含量(P<0.05);模型组小鼠脑组织中MDA含量显著升高(P<0.05),T-SOD活力及GSH含量显著降低(P<0.05)。阳性对照组和高剂量核桃预防组小鼠的MDA含量(分别为11.59、11.65 nmol/mg)显著低于模型组(P<0.05),同时T-SOD活力(分别为96.05、93.36 U/mg)和GSH含量(分别为71.29、69.53 mg/g)较模型组显著升高(P<0.05)。
氧化应激是AD发病和加重的主要因素之一[28]。SOD、GSH和MDA是氧化应激的3 个主要生物标志物。SOD和GSH是抑制自由基产生的重要的抗氧化剂[29],MDA是生物膜脂质过氧化的产物,通常被认为是脂质过氧化的标志物[30]。哺乳动物的大脑中,以磷脂为主的脂质约占大脑干质量的60%,且n-3和n-6多不饱和脂肪酸含量丰富,占大脑脂肪酸总量的30%~35%[11],适当补充二十碳五烯酸或二十二碳六烯酸可改善老年啮齿动物认知障碍[31],长期摄入α-亚麻酸可以调节自然衰老大鼠脑组织中的脂肪酸含量,降低氧化应激反应,保护神经元,改善其学习记忆能力[32]。由于饮食中的n-6/n-3脂肪酸比例过高可引起智力发育迟缓、神经退行性疾病等大脑功能损伤的风险[33],降低n-6/n-3脂肪酸比例可以调节大脑先天性免疫系统活性,抵抗脂多糖诱导的促炎细胞因子产生和随后的空间记忆改变[34]。因此保持n-6/n-3脂肪酸比例平衡对大脑发育尤为重要。核桃以约1:4的比例提供的α-亚麻酸和亚油酸,可能对改善记忆障碍小鼠大脑抗氧化能力发挥重要作用[35-36]。
核桃中的多不饱和脂肪酸在改善小鼠记忆及认知能力方面发挥重要作用,其他化学成分也通过改善大脑的抗氧化能力提供了一定的神经保护作用[37]。Aydin等的研究表明核桃中的维生素、类黄酮对脑组织中脂质过氧化物的形成具有保护作用[38]。在山核桃、榛子、核桃、花生、杏仁、腰果、开心果、松子仁等多种坚果中,山核桃中的酚类物质含量最高,总酚含量约为19.4 mg/g[39],其中主要的酚类化合物为可水解的单宁,约占总酚含量的60.8%,其次是黄烷醇,核桃中还含有没食子酸、鞣花酸等[40-41]。多酚作为食品中的一种强抗氧化剂可以降低AD的患病风险,预防因年龄增长引起的认知能力下降[42-43]。核桃中的酚类物质显著降低高胆固醇血症小鼠脑组织中MDA含量,增加SOD活性,改善小鼠学习和记忆能力[44]。核桃内种皮中的多酚可减轻D-半乳糖导致的氧化损伤,具有一定的抗氧化能力[45],因此,核桃多酚在减少大脑的氧化应激中可能起到重要作用。
核桃中的褪黑素可以通过直接清除ROS及减少ROS的产生,降低自由基对蛋白质和细胞膜的损害,对大脑中产生的氧化应激具有一定的保护作用[46-48]。同时,褪黑素的神经保护作用与其对细胞凋亡的调节和胆碱能系统的保护有关[49]。长期进行褪黑素处理可以降低大脑的氧化应激水平,提高海马区SOD活性,降低MDA含量[50-51],改善认知障碍患者的认知能力,对神经退行性疾病患者具有神经保护作用[52]。
本研究结果显示,模型组中GSH含量和T-SOD活力显著低于空白组,MDA含量显著高于空白组,经喂食核桃饲料干预后,GSH含量和T-SOD活力显著增加,MDA含量显著降低。因此,核桃可以改善氧化应激相关因素的变化,保护神经系统免受氧化损伤,可能与其中含有的大量多不饱和脂肪酸、多酚类化合物、褪黑素等其他植物化学物质的协同作用有关。
以上结果表明,东莨菪碱处理可以在学习和记忆功能方面造成损伤,引起小鼠脑组织中胆碱能系统障碍。核桃饮食可以通过提高T-SOD活力、抑制AChE活力,预防由东莨菪碱诱导的认知障碍。
3 结 论
用东莨菪碱建立小鼠记忆障碍模型,通过Morris水迷宫评估小鼠学习和记忆表现,并对其脑组织中的相关指标进行检测。与模型组相比,在Morris水迷宫实验中,核桃高剂量预防组的逃避潜伏期在第4天极显著缩短(P<0.01),穿台次数显著增加(P<0.05),目标象限停留时间及路程占比分别显著延长和提高(P<0.05)。同时,小鼠脑组织中AChE活力((0.94±0.08)U/mg)、MDA含量((11.64±0.58)nmol/mg)显著降低(P<0.05),GSH含量((69.53±2.11)mg/g)、T-SOD活力((93.36±4.94)U/mg)显著提高(P<0.05)。结果表明,摄入核桃可以提高小鼠的学习记忆能力,并通过抑制其大脑氧化损伤和增强胆碱能功能,对东莨菪碱诱导的AD模型小鼠的学习记忆损伤发挥保护作用。
根据人与动物等效剂量换算比例,小鼠摄入的质量分数9%的核桃饲料大约相当于成人食用42 g核桃,约4~5 个。因此,核桃可以作为延缓大脑衰老、预防AD发生及延缓其恶化的一种有效方式,然而其中对学习和记忆能力具有保护作用的组分及其作用机制还有待进一步研究。
参考文献:
[1] MESULAM M. The cholinergic lesion of Alzheimer’s disease: pivotal factor or side show?[J]. Learning & Memory, 2004, 11(1): 43-49.DOI:10.1101/lm.69204.
[2] ORTA-SALAZAR E, CUELLAR-LEMUS C A, DÍAZ-CINTRA S, et al.Cholinergic markers in the cortex and hippocampus of some animal species and their correlation to Alzheimer’s disease[J]. Neurología,2014, 29(8): 497-503. DOI:10.1016/j.nrl.2012.10.007.
[3] SMALL G, BULLOCK R. Defining optimal treatment with cholinesterase inhibitors in Alzheimer’s disease[J]. Alzheimers &Dementia, 2011, 7(2): 177-184. DOI:10.1016/j.jalz.2010.03.016.
[4] 王怀伟, 廖祥萍, 刘南海. 阿尔茨海默病的防治研究进展综述[J]. 实用妇科内分泌杂志(电子版), 2017, 4(23): 6-7. DOI:10.16484/j.cnki.issn2095-8803.2017.23.004.
[5] ORHAN I E, SENOL F S, ERCETIN T, et al. Assessment of anticholinesterase and antioxidant properties of selected sage(Salvia) species with their total phenol and flavonoid contents[J].Industrial Crops & Products, 2013, 41(1): 21-30. DOI:10.1016/j.indcrop.2012.04.002.
[6] KLIMOVA B, KUCA K. Multi-nutrient dietary intervention approach to the management of Alzheimer’s disease: a mini-review[J]. Current Alzheimer Research, 2016, 13(12): 1312-1318. DOI:10.2174/1567205 013666160603000623.
[7] PASINETTI G M, WANG J, HO L, et al. Roles of resveratrol and other grape-derived polyphenols in Alzheimer’s disease prevention and treatment[J]. BBA-Molecular Basis of Disease, 2015, 1852(6):1202-1208. DOI:10.1016/j.bbadis.2014.10.006.
[8] SINGH M, ARSENEAULT M, SANDERSON T, et al. Challenges for research on polyphenols from foods in Alzheimer’s disease:bioavailability, metabolism, and cellular and molecular mechanisms[J].Journal of Agricultural and Food Chemistry, 2008, 56(13): 4855-4873.DOI:10.1021/jf0735073.
[9] BRAIDY N, BEHZAD S, HABTEMARIAM S, et al. Neuroprotective effects of citrus fruit-derived flavonoids, nobiletin and tangeretin in Alzheimer’s and Parkinson’s disease[J]. CNS & Neurological Disorders-Drug Targets, 2017, 16(4): 387-397. DOI:10.2174/1871527 316666170328113309.
[10] BAKHTIARI M, PANAHI Y, AMELI J, et al. Protective effects of flavonoids against Alzheimer’s disease-related neural dysfunctions[J].Biomedicine & Pharmacotherapy, 2017, 93: 218-229. DOI:10.1016/j.biopha.2017.06.010.
[11] LUCHTMAN D W, SONG C. Cognitive enhancement by omega-3 fatty acids from child-hood to old age: findings from animal and clinical studies[J]. Neuropharmacology, 2013, 64: 550-565.DOI:10.1016/j.neuropharm.2012.07.019.
[12] SZE-TAO K W C, SATHE S K. Walnuts (Juglans regia L): proximate composition, protein solubility, protein amino acid composition and protein in vitro digestibility[J]. Journal of the Science of Food and Agriculture, 2000, 80(9): 1393-1401. DOI:10.1002/1097-0010(200007)80:9<1393::AID-JSFA653>3.0.CO;2-F.
[13] SAVAGE G P, DUTTA P C, MCNEIL D L. Fatty acid and tocopherol contents and oxidative stability of walnut oils[J]. Journal of the American Oil Chemists’ Society, 1999, 76(9): 1059-1063.DOI:10.1007/s11746-999-0204-2.
[14] POULOSE S M, MILLER M G, SHUKITTHALE B. Role of walnuts in maintaining brain health with age 1-3[J]. Journal of Nutrition, 2014,144(Suppl 4): 561-562; 566. DOI:10.3945/jn.113.184838.
[15] MARIN D, CHEDEA V, ROPOTA M, et al. A comparative analysis of polyphenols and fatty acids contents in methanol and acetone extracts from walnut and pumpkin meals[J]. Journal of International Society of Antioxidants in Nutrition & Health, 2016, 3(4): 1-7.
[16] CALCABRINI C, BELLIS R D, MANCINI U, et al. Protective effect of Juglans regia L. walnut extract against oxidative DNA damage[J]. Plant Foods for Human Nutrition, 2017, 72(26): 192-197.DOI:10.1007/s11130-017-0609-2.
[17] WILLIS L M, SHUKITT-HALE B, CHENG V, et al. Dose-dependent effects of walnuts on motor and cognitive function in aged rats[J].British Journal of Nutrition, 2009, 101(8): 1140-1144. DOI:10.1017/S0007114508059369.
[18] ASADI-SHEKAARI M, KARIMI A, SHABANI M, et al. Maternal feeding with walnuts (Juglans regia) improves learning and memory in their adult pups[J]. Avicenna Journal of Phytomedicine, 2013, 3(4):341-346. DOI:10.1042/bj2840237.
[19] MUTHAIYAH B, ESSA M M, LEE M, et al. Dietary supplementation of walnuts improves memory deficits and learning skills in transgenic mouse model of Alzheimer’s disease[J]. Journal of Alzheimers Disease, 2014, 42(4): 1397-1405. DOI:10.3233/JAD-140675.
[20] JING L, GAO L, SUN K, et al. Benzoate fraction from Gentiana rigescens, Franch alleviates scopolamine-induced impaired memory in mice model in vivo[J]. Journal of Ethnopharmacology, 2016, 193: 107-116. DOI:10.1016/j.jep.2016.08.001.
[21] KLINKENBERG I, BLOKLAND A. The validity of scopolamine as a pharmacological model for cognitive impairment: a review of animal behavioral studies[J]. Neuroscience and Biobehavioral Reviews, 2010,34(8): 1307-1350. DOI:10.1016/j.neubiorev.2010.04.001.
[22] LI T, XIE J, WANG Y, et al. Protective effects of aloe-emodin on scopolamine-induced memory impairment in mice and H2O2 -induced cytotoxicity in PC12 cells[J]. Bioorganic & Medicinal Chemistry Letters, 2014, 24(23): 5385-5389. DOI:10.1016/j.bmcl.2014.10.049.
[23] ZOU J, CAI P S, XIONG C M, et al. Neuroprotective effect of peptides extracted from walnut (Juglans sigilata Dode) proteins on Aβ25-35-induced memory impairment in mice[J]. 华中科技大学学报(医学英德文版), 2016, 36(1): 21-30. DOI:10.1007/s11596-016-1536-4.
[24] 邓海峰, 孙缦利, 杨伟, 等. 褪黑素对阿尔茨海默病大鼠学习记忆障碍的影响及作用机制[J]. 中国老年学杂志, 2017, 37(2): 286-288.DOI:10.3969/j.issn.1005-9202.2017.02.012.
[25] 李粤闽. 益脑素改善学习记忆功能的作用及机制的实验研究[D]. 广州: 广州中医药大学, 2015: 36-37.
[26] 高莉, 彭晓明, 张富春, 等. 不同剂量东莨菪碱对小鼠学习记忆功能的影响[J]. 医药导报, 2013, 32(5): 573-576. DOI:10.3870/yydb.2013.05.006.
[27] NAVARRO N M, KRAWCZYK M C, BOCCIA M M, et al.Extinction and recovery of an avoidance memory impaired by scopolamine[J]. Physiology & Behavior, 2017, 171: 192-198.DOI:10.1016/j.physbeh.2016.12.042.
[28] FERREIRA M E, DE VASCONCELOS A S, DA C V T, et al.Oxidative stress in Alzheimer’s disease: should we keep trying antioxidant therapies?[J]. Cellular & Molecular Neurobiology, 2015,35(5): 595-614. DOI:10.1007/s10571-015-0157-y.
[29] KSIĄŻEK-WINIAREK D, GŁĄBIŃSKI A. The role of oxidative stress in neurodegenerative diseases[J]. Experimental Neurobiology,2015, 24(4): 325-340. DOI:10.5607/en.2015.24.4.325.
[30] 樊永波, 陶兴无, 马琳, 等. 核桃饼粕对大鼠学习、记忆和抗氧化功能的影响[J]. 食品科学, 2013, 34(17): 323-326. DOI:10.7506/spkx1002-6630-201317068.
[31] LABROUSSE V F, NADJAR A, JOFFRE C, et al. Short-term long chain omega3 diet protects from neuroinflammatory processes and memory impairment in aged mice[J]. PLoS ONE, 2012, 7(5): e36861.DOI:10.1371/journal.pone.0036861.
[32] 高慧. 长期摄入α-亚麻酸对自然衰老大鼠学习记忆能力和阿尔茨海默病样改变的保护作用及机制[D]. 武汉: 华中科技大学, 2016: 4-7.
[33] 刘志国, 王丽梅, 王华林, 等. 多不饱和脂肪酸对大脑功能影响研究进展[J]. 食品科学, 2015, 36(21): 284-290. DOI:10.7506/spkx1002-6630-201521053.
[34] DELPECH J C, MADORE C, JOFFRE C, et al. Transgenic increase in n-3/n-6 fatty acid ratio protects against cognitive deficits induced by an immune challenge through decrease of neuroinflammation[J].Neuropsychopharmacology Official Publication of the American College of Neuropsychopharmacology, 2015, 40(3): 525-536.DOI:10.1038/npp.2014.196.
[35] PATEL G. Essential fats in walnuts are good for the heart and diabetes[J]. Journal of the American Dietetic Association, 2005,105(7): 1096-1097. DOI:10.1016/j.jada.2005.05.193.
[36] 陈亮. 核桃油、紫苏油、α-亚麻酸、亚油酸对大鼠学习记忆的影响研究[D]. 武汉: 武汉工业学院, 2010: 33-37.
[37] 罗会婷, 贾晓东, 翟敏, 等. 薄壳山核桃营养成分的研究进展[J]. 中国农学通报, 2017, 33(8): 39-46.
[38] AYDIN S, GÖKÇE Z, ÖKKEŞ Y. The effects of Juglans regia L.(walnut) extract on certain biochemical paramaters and in the prevention of tissue damage in brain, kidney, and liver in CCl4 applied Wistar rats[J]. Turkish Journal of Biochemistry, 2015, 40(3): 241-250.DOI:10.1515/tjb-2015-0009.
[39] TAŞ N G, GÖKMEN V. Phenolic compounds in natural and roasted nuts and their skins: a brief review[J]. Current Opinion in Food Science, 2017, 14: 103-109. DOI:10.1016/j.cofs.2017.03.001.
[40] SLATNAR A, MIKULIC-PETKOVSEK M, STAMPAR F, et al.Identification and quantification of phenolic compounds in kernels,oil and bagasse pellets of common walnut (Juglans regia L.)[J].Food Research International, 2015, 67: 255-263. DOI:10.1016/j.foodres.2014.11.016.
[41] TRANDAFIR I, COSMULESCU S, BOTU M, et al. Antioxidant activity, and phenolic and mineral contents of the walnut kernel(Juglans regia L.) as a function of the pellicle color[J]. Fruits, 2016,71(3): 177-184. DOI:10.1051/fruits/2016006.
[42] NOWAK D. Antioxidant plant polyphenols and cognitive disorders[M]//DIETRICH-MUSZALSKA A, CHAUHAN V,GRIGNON S. Studies on psychiatric disorders. New York: Springer,2015: 521-552.
[43] BENSALEM J, SERVANT L, ALFOS S, et al. Dietary polyphenol supplementation prevents alterations of spatial navigation in middleaged mice[J]. Frontiers in Behavioral Neuroscience, 2016, 10: 9-25.DOI:10.3389/fnbeh.2016.00009.
[44] SHI D, CHEN C, ZHAO S, et al. Effects of walnut polyphenol on learning and memory functions in hypercholesterolemia mice[J].Dimensions of Critical Care Nursing, 2014, 2(8): 450-456.DOI:10.12691/jfnr-2-8-4.
[45] 张泽生, 王霄然, 王田心, 等. 核桃内种皮提取物的体内抗氧化活性研究[J]. 中国食品添加剂, 2017(1): 110-114. DOI:10.3969/j.issn.1006-2513.2017.01.010.
[46] REITER R J, MANCHESTER L C, TAN D X. Melatonin in walnuts: influence on levels of melatonin and total antioxidant capacity of blood[J]. Nutrition, 2005, 21(9): 920-924. DOI:10.1016/j.nut.2005.02.005.
[47] HARDELAND R. Brain inflammaging: roles of melatonin, circadian clocks and sirtuins[J]. Journal of Clinical & Cellular Immunology,2018, 9(1): 1-6. DOI:10.4172/2155-9899.1000543.
[48] HARDELAND R, CARDINALI D P, BROWN G M, et al. Melatonin and brain inflammaging[J]. Progress in Neurobiology, 2015, 127/128:46-63. DOI:10.1016/j.pneurobio.2015.02.001.
[49] FENG Z, CHANG Y, CHENG Y, et al. Melatonin alleviates behavioral deficits associated with apoptosis and cholinergic system dysfunction in the APP 695 transgenic mouse model of Alzheimer’s disease[J]. Journal of Pineal Research, 2004, 37(2): 129-136.DOI:10.1111/j.1600-079X.2004.00144.x.
[50] O’NEAL-MOFFITT G, DELIC V, BRADSHAW P C, et al.Prophylactic melatonin significantly reduces Alzheimer’s neuropathology and associated cognitive deficits independent of antioxidant pathways in AβPPswe/PS1 mice[J]. Molecular Neurodegeneration, 2015, 10(1): 27-47. DOI:10.1186/s13024-015-0027-6.
[51] XIE G Q, SUN X L, SU T P, et al. Preventive effects of rhodosin and melatonin from damage induced by β-amyloid1-40 in senile rats[J].Journal of Nanjing Medical University, 2004, 18(4): 203-206; 214.
[52] CARDINALI D P, VIGO D E, OLIVAR N, et al. Therapeutical implications of melatonin in Alzheimer’s and Parkinson’s diseases[M]//ENGIN A, ENGIN A B. Tryptophan metabolism:implications for biological processes, health and disease. New York:Springer International Publishing, 2015: 197-238.
Walnut (Juglans regia) Kernel Can Prevent Scopolamine-Induced Memory Impairment in Mice
NAI Yifan, FENG Li, LIAO Jianqiao, MA Qi, BO Jifang, LI Mei*, XU Huaide*
(College of Food Science and Engineering, Northwest A & F University, Yangling 712100, China)
Abstract: We undertook this study in order to investigate the effect of dietary supplementation of walnut (Juglans regia)kernel on learning and memory capacity in a mouse model of memory impairment induced by scopolamine (SCOP). The experimental mice were fed a diet containing 9% ( high-dose treatment and prevention groups) or 6% walnut kernel (low-dose and low-dose prevention groups) while those in the other groups (control, model and positive control) were fed a normal diet. After 8 weeks of feeding, the Morris water maze (MWM) was used to evaluate the learning and memory capacity of mice. Meanwhile, brain tissues were harvested to measure the levels of malondialdehyde (MDA) and glutathione (GSH),and the activities of total superoxide dismutase (T-SOD) and acetylcholinesterase (AChE). Results showed that in the MWM trial, the escape latency of the mice in the high-dose prevention group was significantly shortened on the fourth day(P < 0.01) while the number of punctures increased (P < 0.05) and the time spent and percentage distance traveled in the target quadrant were increased (P < 0.05) when compared with the model group. Besides, AChE activity and MDA content were decreased to (0.94 ± 0.08) U/mg and (11.64 ± 0.58) nmol/mg, respectively (P < 0.05); in contrast, GSH content and T-SOD activity were increased (69.53 ± 2.11) mg/g and (93.36 ± 4.94) U/mg, respectively (P < 0.05) in brain tissue. These findings suggest that dietary supplementation of walnut kernel could inhibit oxidative damage in the brain mice, enhance cholinergic function, prevent SCOP-induced memory impairment and improve learning and memory capacity.
Keywords: walnut kernel; mouse model of memory impairment; Morris water maze; antioxidant effect; learning and memory
收稿日期:2018-04-24
基金项目:陕西省核桃精深加工及其产品开发研究项目(2016KTCQ02-22)
第一作者简介:佴逸凡(1996—)(ORCID: 0000-0002-9162-0621),女,硕士研究生,研究方向为果蔬加工与贮藏。E-mail: 389333598@qq.com
*通信作者简介:李梅(1987—)(ORCID: 0000-0002-6769-4663),女,讲师,博士,研究方向为食品营养与功能。E-mail: plum.p@163.com徐怀德(1964—)(ORCID: 0000-0002-1766-1265),男,教授,学士,研究方向为饮料加工、果品蔬菜贮藏与加工、天然产物提取。E-mail: xuhuaide@aliyun.com
DOI:10.7506/spkx1002-6630-20180424-321
中图分类号:TS255.1
文献标志码:A
文章编号:1002-6630(2019)11-0188-07
引文格式:
佴逸凡, 冯莉, 廖剑桥, 等. 核桃对东莨菪碱诱导的小鼠记忆障碍的预防作用[J]. 食品科学, 2019, 40(11): 188-194.DOI:10.7506/spkx1002-6630-20180424-321. http://www.spkx.net.cn
NAI Yifan, FENG Li, LIAO Jianqiao, et al. Walnut (Juglans regia) kernel can prevent scopolamine-induced memory impairment in mice[J]. Food Science, 2019, 40(11): 188-194. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180424-321. http://www.spkx.net.cn