
图1 皮肤结构[4]
Fig. 1 Skin structure[4]
近年来,紫外线导致的各种皮肤病发病率逐渐提高,中国的西部地区以及海南地区人群遭受皮肤光损伤现象非常普遍。造成各种光损伤的主要原因是高原地区大气层稀薄以及低纬度地区紫外线辐射强烈。皮肤光损伤症状主要表现为:红斑、水肿、晒黑晒伤、皮肤粗糙增厚,皮肤松弛、干燥,有粗深皱纹以及皮革样外观,局部有过度色素沉着或毛细血管扩张,甚至可能出现恶性肿瘤。关于各类癌症的统计数据显示,美国2017年新增皮肤癌的人数占所有新增癌症人数的5.65%[1],平均每年有超过100万的皮肤癌新发病例,美国每年治疗黑色素瘤和非黑色素瘤皮肤癌的费用高达29亿 美元[2-3]。最近,人们发现,食物中黄酮类物质的干预可以有效地改善皮肤光损伤。本文综述了黄酮类物质对皮肤光损伤的防护及其机制。皮肤结构如图1[4]所示。

图1 皮肤结构[4]
Fig. 1 Skin structure[4]
过度暴露于紫外线下会导致皮肤急性炎症的发生,表现为暴露部位的皮肤出现红斑、水肿、增生,有灼烧刺痛感,严重时可能导致水疱、糜烂等,之后可能伴有脱皮和炎症后色素沉着等现象发生[5-6]。由于中波紫外线(ultraviolet radiation B,UVB)主要作用于表皮内的色基,急性炎症的组织病理表现为明显的角质形成细胞凋亡、水肿,严重者可影响表皮全层,且伴有中性粒细胞向表皮聚集、真皮毛细血管扩张和血管周围淋巴组织细胞浸润[7]。表皮角质形成细胞经UVB辐射之后,会释放大量炎性介质以及趋化因子,如白细胞介素(interleukin,IL)-1、IL-6、IL-8、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、一氧化氮(nitric oxide,NO)等,进而使毛细血管扩张,整体上表现为皮肤红斑;随后血管通透性增加导致液体渗出,表现为水肿;紧接着各种白细胞穿过血管壁渗出到血管外,并且在趋化因子的作用下进入组织间隙,表现出炎细胞浸润,炎症后期还会出现炎症细胞增生现象[8]。
正常情况下,角质形成细胞和成纤维细胞不断产生活性氧簇(reactive oxygen species,ROS),如超氧阴离子自由基、过氧化物、单线态氧、羟自由基,并且被非酶抗氧化剂如抗坏血酸,以及酶抗氧化剂如过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)所清除,从而维持细胞和组织的稳定[9]。然而,紫外线光子能与皮肤中的内源性光敏剂反应产生过量的ROS,从而产生氧化应激[10],导致烟酰胺腺嘌呤二核苷酸耗尽,从而使得细胞能量损失[11]。ROS会对膜脂质造成氧化性损伤,形成脂质过氧化物;还可以共价结合生物膜,使膜功能受损,干扰正常的信号级联,从而激活多种致癌物质,诱导细胞凋亡[12]。此外,ROS也会造成DNA的氧化性损伤,导致DNA突变[13]。因此,氧化应激易导致皮肤红斑、水肿等炎症反应以及晒伤、光老化甚至肿瘤的发生[14]。
紫外线不仅能通过诱导ROS间接造成DNA氧化损伤,还可以直接对皮肤角质形成细胞DNA造成损伤,DNA碱基直接吸收来自UVB的光子,导致核苷酸结构重排;吸收了能量的DNA碱基嘧啶与相邻嘧啶结合可形成环丁烷嘧啶二聚体(cyclobutane pyrimidine dimers,CPDs)和6-4光产物,这两种物质是DNA光损伤的主要产物。DNA损伤通常表现为脱皮[12],DNA损伤后会激活检查点蛋白p53和毛细血管扩张性共济失调突变蛋白,并引发细胞周期停滞信号传导以进行适当的DNA修复[15]。当紫外线诱导DNA发生不可逆损伤时,DNA损伤物会激活p53信号通路,其可以诱导线粒体中的Bcl-2 Associated X蛋白质、Noxa以及p53上调凋亡调控因子蛋白质表达,并触发死亡受体Fas表达,最终导致细胞凋亡[16]。DNA损伤的积累最终可能导致非黑色素瘤皮肤癌的发生[13]。
弹性纤维、胶原蛋白和糖胺聚糖是构成皮肤细胞外基质的主要成分,皮肤细胞外基质的破坏主要是由于胶原蛋白生物合成减少以及基质金属蛋白酶(matrix metalloproteinases,MMPs)的表达增加。此外,抑制组织金属蛋白酶抑制剂的活性也会引起胶原蛋白碎裂和降解增加,最终导致光老化[17]。在光老化的过程中,真皮层会明显增厚,形成大量无功能的弹性纤维;胶原蛋白被降解成碎片,数量减少,因而使皮肤失去弹性、粗糙增厚;糖胺聚糖骨架被破坏,导致皮肤干燥,并加快皮肤皱缩[18-19]。其中长波紫外线(ultraviolet radiation A,UVA)导致光老化的机制是通过诱导ROS,进一步激活丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信号传导通路,促进MMPs的表达,从而降解胶原蛋白和弹性纤维,最终导致光老化[20-21]。UVB导致光老化的机制包括基质异常降解、自由基及线粒体突变、免疫抑制等[22]。
黄酮类化合物是一类以2-苯基色原酮为基本结构的植物次级代谢产物,它通常与糖基结合成苷类,小部分以游离形式存在于果蔬、豆类、茶叶以及草药等植物中[23]。根据中央三碳链(即C3部分)的氧化程度、是否成环以及B环连接位置(2-或3-位)等特点,可将黄酮类化合物分为以下11 类:黄酮类、黄酮醇类、二氢黄酮类、二氢黄酮醇类、异黄酮类、二氢异黄酮类、查耳酮类、二氢查耳酮类、黄烷类、花色素类、双黄酮类[24](表1)。黄酮类化合物具有保护心脑血管、抗菌、抗病毒、抗肿瘤、抗氧化自由基、抗炎、镇痛、抗动脉粥样硬化、保肝、抑制胶原蛋白降解等生物活性[25-28]。多项研究表明,黄酮类化合物可以通过抑制炎症、清除自由基、抗氧化、防止DNA损伤等多种机制来减轻皮肤光损伤[29-31]。
表1 黄酮类化合物的分类和分子结构[23]
Table 1 Classification and molecular structures of flavonoids[23]

黄酮类化合物分类 主要来源 分子结构 具体物质黄酮类 芹菜、黄芩、辣椒、紫苏O O黄芩素、黄芩苷、芹菜素、木犀草素黄酮醇类 荞麦、芦笋OH O O槲皮素、芦丁二氢黄酮类 柠檬、柑橘O O 陈皮素、甘草苷、橙皮苷、柚皮素异黄酮类 大豆O O大豆素、葛根素二氢异黄酮类 鱼藤O O鱼藤酮查耳酮类 甘草、补骨脂OH O异甘草素、补骨脂乙素黄烷类 茶叶O 儿茶素花色素类 蓝莓、葡萄、血橙Oimages/BZ_256_806_2504_817_2515.png飞燕草素、矢车菊素双黄酮类 银杏2 O O 银杏素、异银杏素
2.2.1 黄酮类化合物与皮肤炎症相关细胞
黄酮类化合物可以有效减少UVB诱导的皮肤炎症的发生。研究表明,给小鼠涂抹查耳酮、黄芩苷以及矢车菊素-3-O-葡萄糖苷(cyanidin-3-O-glucoside,C3G)均可抑制UVB诱导的皮肤水肿[29,32-33]。同样地,给无毛小鼠背部涂抹C3G、芦丁、非瑟酮可以减少UVB诱导的表皮增生,与仅用UVB照射的小鼠相比,随着C3G剂量(250、500 μmol/L)的增加,小鼠皮肤厚度逐渐变薄[33-35];给无毛小鼠口服橙皮苷也能显著抑制UVB诱导的小鼠表皮厚度增加[36]。Pratheeshkumar等给SKH-1无毛小鼠背部涂抹含有C3G的丙酮,通过观察小鼠背部皮肤切片可以发现,C3G可以抑制UVB介导的白细胞浸润[33]。通过给SKH-1无毛小鼠喂食葡萄籽原花青素(grape seed proanthocyanidins,GSP),发现GSP也可以抑制UVB诱导的炎症性白细胞浸润[37]。Pal等发现非瑟酮也可以减少UVB诱导的小鼠皮肤中巨噬细胞和中性粒细胞的浸润,当非瑟酮的剂量从1.25 mol/L增加到2.5 mol/L时,炎症细胞的浸润逐渐减少[35]。
2.2.2 黄酮类化合物与皮肤炎症因子
环氧合酶-2(cyclooxygenase-2,COX-2)是分解花生四烯酸生成各种内源性前列腺素(prostaglandins,PGs)的关键限速酶,研究表明,UVB照射会导致COX-2在表皮中过表达,进而引起受损部位PGs的聚集;PGs可协同促进其他炎症介质的增加,造成周围组织炎症、破坏及增生等,促进炎症反应和组织损伤[38]。在UVB辐射前给SKH-1无毛小鼠背部涂抹含有C3G的丙酮,发现C3G可以显著降低UVB诱导的TNF-α、IL-6和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)的产生,从而降低了UVB诱导的COX-2的水平,进而减弱UVB诱导的炎症反应[33]。通过给SKH-1无毛小鼠喂食GSP,发现GSP也可以抑制UVB诱导的促炎性细胞因子如TNF-α、IL-1β和IL-6的水平,然后进一步抑制髓过氧化物酶、COX-2、PGE2的水平[37]。
2.2.3 黄酮类化合物与炎症相关信号转导途径
研究发现,柚皮素和木犀草素作用于人角质形成细胞HaCaT都可以通过抑制MAPK信号通路来抑制UVB诱导的COX-2和PGE2的产生,随着柚皮素浓度(50、100、150 μmol/L)的增加,HaCaT细胞中COX-2水平逐渐降低,从而减少急性炎症的发生[31,39]。此外,通过给SKH-1无毛小鼠背部涂抹非瑟酮,发现其可以通过抑制胞内磷脂酰肌醇激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)/核因子-κB(nuclear factor-κB,NF-κB)通路来抑制炎症细胞因子TNF-α、IL-1β和IL-6的水平,并减少COX-2的表达,从而降低PGE2,进而抑制UVB诱导的炎症[35]。通过飞燕草素对JB6 P1小鼠表皮细胞的研究,发现飞燕草素以与ATP竞争的方式直接与PI3K结合,显著抑制PI3K的活性[40]。He Yong等使用C3G对HaCaT细胞进行培养,发现C3G通过抑制ROS的生成间接干扰MAPK和Akt信号通路的相互作用,从而抑制UVB诱导的COX-2的表达[41]。使用非瑟酮对受到紫外线辐射的成纤维细胞Hs68进行干预,实验结果表明非瑟酮通过抑制MAPK的活化来增加NF-κB抑制剂(inhibitor κB,I-κB)的表达,从而抑制NF-κB易位进入细胞核,协同降低PI3K/Akt/cAMP反应原件结合蛋白(cAMP response element-binding protein,CREB)途径中的p-CREB Ser-133的水平,减少NF-κB的激活,来达到抑制COX-2的作用,进而降低PGE2的水平,从而减少紫外线诱导的炎症反应[42]。此外,夏济平等发现用表没食子儿茶酚没食子酸酯(epigallocatechin gallate,EGCG)干预UVB辐射的角质形成细胞,能够通过抑制NF-κB易位进核,从而抑制IL-6的分泌,表明EGCG可以抑制UVB诱导的炎症[43]。Choi等在UVB辐射前在无毛小鼠背部涂抹芦丁,结果发现芦丁通过抑制ROS的形成来减弱UVB诱导的p38 MAPK和c-Jun-N末端激酶(c-Jun-N-terminal kinase,JNK)的磷酸化,从而抑制了小鼠皮肤中激活蛋白-1(activator protein-1,AP-1)的DNA结合,同时抑制转录激活子-3的磷酸化,这两种作用协同抑制了UVB诱导的皮肤中COX-2和iNOS的表达[34]。通过使用山柰酚-3-鼠李糖苷(Afzelin)对HaCaT细胞进行干预,发现其可以通过减少ROS的生成来干扰或者直接抑制p38 MAPK途径来抑制UVB诱导的促炎介质如IL-6、TNF-α、PGE2以及COX-2的释放[44]。对JB6 P1小鼠表皮细胞的研究表明,飞燕草素可以直接与丝裂原活化蛋白激酶4(mitogenactivated protein kinase kinase 4,MAPKK4)结合,抑制MAPKK4的活性,导致AP-1激活被抑制,从而抑制了COX-2的过表达;且随着飞燕草素的浓度从5 μmol/L增加到10 μmol/L再增加到20 μmol/L,小鼠表皮细胞中的COX-2的表达量依次减少[40]。总地来说,通过这些黄酮类化合物对紫外线辐射的动物或者细胞进行营养干预,表明黄酮类物质可以通过多种途径抑制紫外线诱导的炎症反应。黄酮类化合物的抗炎症机制如图2所示。

图2 黄酮类化合物的抗炎症机制
Fig. 2 Anti-inflammatory mechanism of flavonoids
皮肤自身的抗氧化系统可清除ROS,使其维持在一个较低的水平,然而过度暴露于紫外线条件下会导致ROS大量产生,从而造成氧化应激。过量的ROS会对DNA、蛋白质、脂质等造成一系列的损伤,最终可能会导致细胞凋亡甚至产生皮肤癌[45]。诸多研究表明黄酮类化合物有较好的抗氧化效果[34,44,46]。研究发现,在受UVB辐射的无毛小鼠背部涂抹芦丁和柚皮素可以减少UVB诱导的ROS和脂质过氧化物的产生[34,47]。槲皮素、槲皮苷和C3G的细胞实验表明黄酮类化合物可以降低细胞内ROS水平,从而可以减少DNA损伤;也可以阻止细胞膜和线粒体受ROS的攻击,并抑制细胞膜流动性降低和线粒体膜去极化,从而抑制细胞色素c的流出,进而可以抑制细胞凋亡[48-50]。此外,飞燕草素、Afzelin以及橙皮苷的细胞实验表明,黄酮类化合物可以通过吸收紫外线来抑制UVB诱导的脂质过氧化增加,并且降低丙二醛的生成,表明黄酮类物质减少了紫外线诱导的氧化应激[44,51-52]。分别给大鼠、豚鼠以及昆明小鼠涂抹儿茶素纳米凝胶乳剂、水飞蓟宾以及枸杞叶总黄酮乳膏可以提高其SOD、GPx、CAT等抗氧化酶的水平,并且随着枸杞叶总黄酮剂量(5、10、20 mg/g)的增加而提高SOD和CAT的水平[53-55]。给SKH-1无毛小鼠涂抹C3G和反式查耳酮可以分别抑制UVB诱导的小鼠皮肤中的谷胱甘肽消耗,提高皮肤中还原型谷胱甘肽(reduced glutathione,GSH)含量,随着C3G浓度从250 μmol/L增加到500 μmol/L,GSH含量逐渐增加[29,33]。给SKH-1无毛小鼠喂食GSP,也发现它可以抑制GPx、CAT和谷胱甘肽的消耗[56]。槲皮苷、坛紫菜多酚和橙皮苷的细胞实验也证实黄酮类化合物可以恢复GSH和抗氧化酶CAT、GPx的表达,增加SOD水平和总抗氧化能力[49,52,57]。给豚鼠涂抹含水飞蓟宾的乳膏可以上调血红素氧合酶(heme oxygenase-1,HO-1)的水平,从而减少UVB诱导的氧化应激[54]。此外,将柚皮素涂抹到无毛小鼠皮肤上,发现其可以增加核因子红细胞2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)mRNA表达,转移至核上的Nrf2和抗氧化反应元件结合,从而诱导HO-1 mRNA表达,发挥抗氧化作用[48,58]。研究表明,芹菜素以剂量依赖(浓度从1.56 μmol/L增加到6.25 μmol/L)的方式在JB6 P1小鼠表皮细胞中有效地逆转了Nrf2启动子中15CpG位点的高甲基化状态,且增强了Nrf2的核转移,并增加了Nrf2和Nrf2下游靶基因还原型烟酰胺腺嘌呤二核苷酸磷酸醌氧化还原酶1(NAD(P)H quinone oxidoreductase-1,NQ-O1)的mRNA和蛋白质表达,从而达到抑制氧化应激的作用[45]。用黄芩处理受UVB辐照后的HaCaT细胞,发现其可以通过促进Nrf2转移至细胞核内增加细胞内抗氧化剂HO-1和NQ-O1的表达,从而显示出优异的抗氧化活性[59]。以上研究均表明黄酮类化合物可以通过吸收紫外线、清除自由基、恢复抗氧化酶活性以及通过调节Nrf2/HO-1/NQ-O1来达到抗紫外线诱导的氧化应激的作用。黄酮类化合物抗氧化的机制如图3所示。

图3 黄酮类化合物的抗氧化机制
Fig. 3 Antioxidant mechanism of flavonoids
过度紫外线照射可直接损伤皮肤细胞DNA生成CPDs,其对DNA造成的氧化性损伤会导致DNA突变,当DNA遭受不可逆的损伤时会导致细胞凋亡,最终可能诱发非黑色素瘤皮肤癌。一些研究已经证实黄酮类化合物可以抑制紫外线诱导的DNA的损伤。研究表明,在无毛小鼠背部涂抹飞燕草素、水飞蓟宾和非瑟酮都可以减少UVB诱导的DNA损伤标记物CPDs的产生[35,51,60]。水飞蓟宾、Afzelin、芹菜素以及黄芩苷的细胞实验表明,黄酮类化合物可以通过吸收紫外线来减少细胞内的CPDs,随着Afzelin质量浓度(50、100、150、200 μg/mL)的升高,细胞内产生的CPDs逐渐减少[44,61-63]。花色素类物质如C3G以及飞燕草素都可以减少UVB诱导的小鼠皮肤内8-O-7,8-二氢-2’-脱氧鸟苷(8-O-7,8-dihydro-2’-deoxyguanosine,8-OHdG)的表达[33,51]。同时,也有研究表明黄芩苷和飞燕草素都可以减少细胞内的8-OHdG的产生,表明黄酮类物质可以减少紫外线诱导的DNA损伤[51,63]。研究表明黄酮类物质可以通过增加p53和p21蛋白的表达,逆转UVB诱导的DNA在S期停滞,使细胞更长时间地停留在G1期,减少活性DNA的合成,以便进行适当的DNA修复,从而减少了对DNA的损伤[35,61]。Roy等对SKH-1无毛小鼠局部施用水飞蓟宾,发现其可以持续增加p53和生长抑制,DNA损伤诱导基因45α(growth arrest and DNA damage-inducible genes 45α,GADD45α)的水平;同时他们还使用水飞蓟宾对JB6细胞进行干预,发现水飞蓟宾也可以显著上调细胞中的p53的水平,从而增加GADD45α的表达,加速对损伤的DNA进行修复[61]。Rigby等在UVB辐射前或后给p53+/+无毛小鼠背部涂抹水飞蓟宾,显著增加了GADD45α的水平,并且通过与p53+/-小鼠的对比实验证实了p53是发挥光保护作用的重要基因[60]。Guillermo-Lagae等用水飞蓟宾对正常人真皮成纤维细胞NHDFs进行干预,结果表明水飞蓟宾通过增加p53和GADD45α的表达来增加着色性干皮病补充组(xeroderma pigmentosum complementation group,XP)家族,包括XPA、XPB、XPC、XPG的表达,从而激活核苷酸切除修复(nucleotide excision repair,NER)途径,加速损伤DNA的修复,并且证实了XPA和XPB在水飞蓟宾介导的DNA损伤修复中起关键作用[64]。林向飞等使用EGCG对HaCaT细胞进行干预,发现EGCG可以显著降低细胞内的XPA和切除修复互补交叉蛋白1的表达,表明EGCG减少了UVB导致的DNA损伤,从而表现出较弱的NER修复过程[65]。使用芹菜素对HDF细胞进行干预,结果表明芹菜素可以恢复UVB诱导的HDF细胞中NER蛋白的损失,从而起到修复DNA的作用[62]。总地来说,黄酮类化合物可以通过吸收紫外线、加速去除CPDs和抑制8-OHdG的形成,提高p53的表达,以激活NER途径以及增加GADD45α的表达,进而对损伤的DNA进行修复,从而减少紫外线对DNA的损伤。黄酮类化合物对皮肤DNA的保护机制如图4所示。
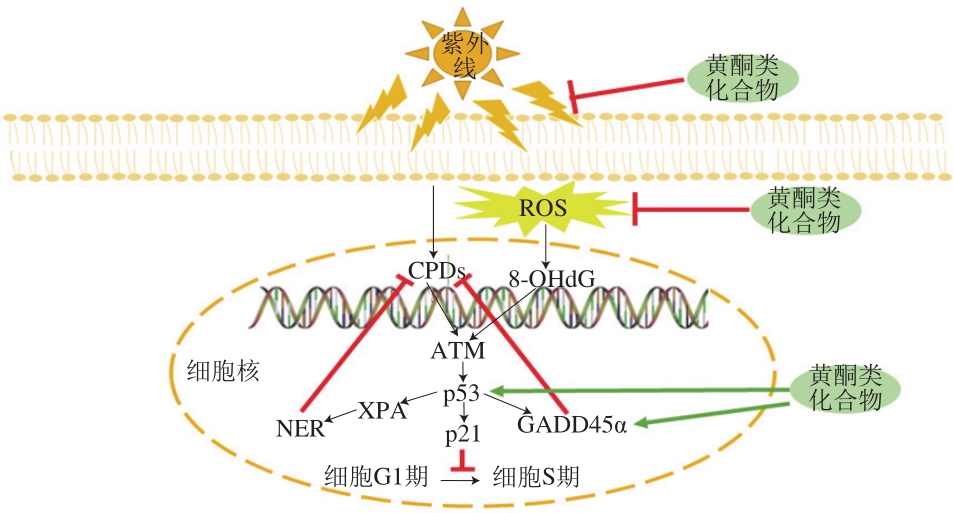
图4 黄酮类化合物对皮肤DNA的保护机制
Fig. 4 Protective mechanism of flavonoids on skin DNA
2.5.1 黄酮类化合物与光老化相关指标
过多的紫外线辐射可以诱导皮肤细胞外基质中胶原蛋白合成减少,还可以通过多种途径加速MMPs的分泌,从而降解皮肤细胞外基质,最终导致光老化。研究发现,在无毛小鼠背部涂抹非瑟酮、杨梅酮、柚皮素可以减少小鼠背部皮肤的皱纹[66-68]。此外,无毛小鼠口服橙皮苷也可以减少皱纹的形成[36]。柚皮素和橙皮苷可以减少小鼠皮肤的水分流失[36,68]。Wu Poyuan等给晒后的无毛小鼠背部涂抹非瑟酮物质,发现与未涂抹非瑟酮的小鼠相比,其皮肤中MMP-1和MMP-2的表达减少[66]。Pervin等分别用1、2、5、10 μmol/L的木犀草素对HDF细胞进行干预,发现木犀草素呈剂量依赖性地抑制UVA和UVB暴露的HDF细胞中MMP-1和MMP-9基因的表达[69]。
2.5.2 黄酮类化合物与光老化相关的信号转导途径
在晒前给SKH-1无毛小鼠背部涂抹含有杨梅酮的丙酮制剂,结果发现杨梅酮可以与ATP以非竞争性方式和迅速加速性纤维肉瘤(rapidly accelerated fibrosarcoma,Raf)结合来抑制Raf激酶的活性,从而抑制UVB诱导的MAPK激酶(mitogen-activated protein kinase kinase,MEK)和细胞外信号调节激酶(extracellular signalregulated kinase 2,ERK)的磷酸化,进而减少MMP-9的表达,最终减少紫外线诱导的细胞外基质的降解[67]。此外,有研究表明,给无毛小鼠口服橙皮苷也可以通过抑制MAPK信号通路中MEK/ERK的磷酸化来降低UVB诱导的MMP-9的表达,从而达到预防光老化的效果[36]。用柚皮素涂抹SKH-1无毛小鼠背部,发现柚皮素可以显著抑制UVB诱导的ERK2活性,通过竞争性结合ATP减弱UVB诱导的p90RSK的磷酸化,降低即刻早期基因Fos相关抗原-1稳定性,下调AP-1的活性,进而减少MMP-1的表达,从而发挥有效的抗光老化作用[68]。用木犀草素对HaCaT细胞进行干预,发现其抗光老化效果也是通过抑制JNK1和P90RSK2来抑制c-Fos和c-Jun,从而减少AP-1的形成,使MMP-1的表达减少[70]。用从某种柑橘中提取出的类黄酮物质HMF(3,5,6,7,8,3’,4’-heptameth oxyflavone)培养HDF细胞,发现其可以通过抑制ERK和JNK的磷酸化来抑制c-Jun和c-Fos的磷酸化,从而降低MMP-1的表达;HMF还可以通过调节转化生长因子β(transforming growth factor β,TGF-β)/Smad信号通路,抑制Smad7的表达,上调Smad3的表达,从而上调TGF-β调节基因的转录,增加I型前胶原相关基因的表达,表明黄酮类物质具有抗皮肤光老化的效果[71]。康元等也发现适当浓度的GSP能显著上调HDF细胞中TGF-β RII蛋白的水平并下调Smad7的表达,从而减轻UVA诱导的细胞外基质的降解[72]。Chiang等发现非瑟酮可以降低紫外线诱导的MAPK途径中的ERK、JNK和p38磷酸化的表达,减少I-κB的降解并增加细胞质中NF-κB的主要亚基p65的数量;它还抑制NF-κB易位至核并抑制PI3K/Akt/CREB途径中的CREB Ser-133磷酸化水平,从而抑制了MMP-1、MMP-3、MMP-9的表达,表明非瑟酮可以抑制紫外线诱导的细胞外基质的降解[42]。还有研究表明用黄芩苷处理HDF可以恢复TIMP-1的活性,从而减少细胞外基质的降解[73]。此外,用黄芩处理HaCaT细胞可通过抑制MAPK/AP-1和NF-κB/I-κB-α信号通路来抑制UVB诱导的MMP-1的上调,以及通过激活TGF-β/Smad途径来抑制UVB诱导的I型前胶原的减少[56]。这些动物实验和细胞实验均表明,黄酮类化合物可以通过调节MAPK/AP-1、TGF-β/Smad、NF-κB/I-κB等信号通路来抑制MMPs的表达和增加I型前胶原的含量,从而维持正常的细胞外基质的合成和降解,进而达到抗光老化的效果。黄酮类化合物对皮肤光老化的保护机制如图5所示。

图5 黄酮类化合物对皮肤光老化的保护机制
Fig. 5 Protective mechanism of flavonoids on skin photoaging
综上,针对动物和细胞的研究均显示,黄酮类物质可通过抗炎、抗氧化、抗DNA损伤、维持细胞外基质合成和降解平衡来防护紫外线诱导的光老化及非黑色素瘤皮肤癌。此外,黄酮类化合物还可以通过吸收紫外线,竞争性或非竞争性结合某些分子来达到光保护作用。诸多研究表明,黄酮类化合物对紫外线诱导的光损伤的干预作用呈剂量依赖性。动物实验表明,口服或者涂抹黄酮类化合物可以对皮肤提供有效地保护,细胞实验也表明黄酮类物质可以减少紫外线对皮肤细胞的损伤。目前,对黄酮类化合物干预皮肤光损伤的具体作用机制了解得不够深入,因而需要更多的动物及细胞实验来进一步探索。另外,黄酮类物质的推荐剂量尚不清楚,因此,各种黄酮类物质的代谢动力学及构效关系的对比可能是未来的研究方向。此外,目前关于黄酮类化合物干预皮肤光损伤的流行病学调查和临床实验非常少,可能成为未来研究的热点。
[1] SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2017[J].A Cancer Journal for Clinicians, 2017, 67(1): 7-30. DOI:10.3322/caac.21387.
[2] KATIYAR S K. UV-induced immune suppression and photocarcinogenesis: chemoprevention by dietary botanical agents[J].Cancer Letters, 2007, 255(1): 1-11. DOI:10.1016/j.canlet.2007.02.010.
[3] KATIYAR S, ELMETS C A, KATIYAR S K. Green tea and skin cancer: photoimmunology, angiogenesis and DNA repair[J]. Journal of Nutritional Biochemistry, 2007, 18(5): 287-296. DOI:10.1016/j.jnutbio.2006.08.004.
[4] FARAGE M A, MILLER K W, SHERMAN S N, et al. Assessing quality of life in older adult patients with skin disorders[M]. Berlin:Springer Berlin Heidelberg, 2017, 4(2): 119-131. DOI:10.1007/978-3-540-89656-2-73.
[5] MCKEE, PHILIP H. Pathology of the skin with clinical correlations[J]. Plastic & Reconstructive Surgery, 1991, 87(2): 378.DOI:10.1097/00006534-199102000-00027.
[6] THUNE P O, SOLBERG Y J. Photosensitivity and allergy to aromatic lichen acids, Compositae oleoresins and other plant substances[J].Contact Dermatitis, 1980, 6(1): 64-71. DOI:10.1111/j.1600-0536.1980.tb03907.x.
[7] 张学军. 皮肤性病学[M]. 8版. 北京: 人民卫生出版社, 2013: 60.
[8] ZUO Z, OUYANG W, LI J, et al. Cyclooxygenase-2 (COX-2)mediates arsenite inhibition of UVB-induced cellular apoptosis in mouse epidermal Cl41 cells[J]. Current Cancer Drug Targets, 2012,12(6): 607-616. DOI:10.2174/156800912801784802.
[9] SANDER C S, CHANG H, HAMM F, et al. Role of oxidative stress and the antioxidant network in cutaneous carcinogenesis[J].International Journal of Dermatology, 2004, 43(5): 326-335.DOI:10.1111/j.1365-4632.2004.02222.x.
[10] HECK D E, GERECKE D R, VETRANO A M, et al. Solar ultraviolet radiation as a trigger of cell signal transduction[J]. Toxicology and Applied Pharmacology, 2004, 195(3): 288-297. DOI:10.1016/j.taap.2003.09.028.
[11] HALLIDAY G M. Inflammation, gene mutation and photoimmunosuppression in response to UVR-induced oxidative damage contributes to photocarcinogenesis[J]. Mutatiom Research,2005, 571(1/2): 107-120. DOI:10.1016/j.mrfmmm.2004.09.013.
[12] PANICH U, SITTITHUMCHAREE G, RATHVIBOON N, et al.Ultraviolet radiation-induced skin aging: the role of DNA damage and oxidative stress in epidermal stem cell damage mediated skin aging[J]. Stem Cells International, 2016, 2016: 7370642.DOI:10.1155/2016/7370642.
[13] RAVANAT J L, DOUKI T, CADET J. Direct and indirect effects of UV radiation on DNA and its components[J]. Journal of Photochemistry and Photobiology B: Biology, 2001, 63(1/2/3): 88-102. DOI:10.1016/S1011-1344(01)00206-8.
[14] 何咏. 矢车菊素-3-葡萄糖苷干预UVB损伤HaCaT细胞ROS/COX-2通路的初步研究[D]. 广州: 暨南大学, 2015: 2.
[15] CRAIG A L, HOLCAKOVA J, FINLAN L E, et al. ΔNp63 transcriptionally regulates ATM to control p53 Serine-15 phosphorylation[J]. Molecular Cancer, 2010, 9(1): 1-13.DOI:10.1186/1476-4598-9-195.
[16] KIM S G, RAVI G, HOFFMANN C, et al. p53-Independent induction of Fas and apoptosis in leukemic cells by an adenosine derivative,Cl-IB-MECA[J]. Biochemical Pharmacology, 2002, 63(5): 871-880.DOI:10.1016/S0006-2952(02)00839-0.
[17] BOSCH R, PHILIPS N, SUAREZ-PEREZ J A, et al. Mechanisms of photoaging and cutaneous photocarcinogenesis, and photoprotective strategies with phytochemicals[J]. Antioxidants (Basel), 2015, 4(2):248-268. DOI:10.3390/antiox4020248.
[18] WATSON R E, GIBBS N K, GRIFFITHS C E, et al. Damage to skin extracellular matrix induced by UV exposure[J]. Antioxidants & Redox Signaling, 2014, 21(7): 1063-1077. DOI:10.1089/ars.2013.5653.
[19] STERN R, MAIBACH H I. Hyaluronan in skin: aspects of aging and its pharmacologic modulation[J]. American Journal of Clinical Dermatology, 2008, 26(2): 106-122. DOI:10.1016/j.clindermatol.2007.09.013.
[20] WENK J, BRENNEISEN P, MEEWES C, et al. UV-induced oxidative stress and photoaging[J]. Current Problems in Dermatology, 2001, 29:83-94. DOI:10.1159/000060656.
[21] FISHER G J, TALWAR H S, LIN J, et al. Retinoic acid inhibits induction of c-Jun protein by ultraviolet radiation that occurs subsequent to activation of mitogen-activated protein kinase pathways in human skin in vivo[J]. Journal of Clinical Investigation, 1998,101(6): 1432-1440. DOI:10.1172/JCI2153.
[22] JENSEN J D, WING G J, DELLAVALLE R P. Nutrition and melanoma prevention[J]. American Journal of Clinical Dermatology,2010, 28(6): 644-649. DOI:10.1016/j.clindermatol.2010.03.026.
[23] LI X, JIANG X W, SUN J X, et al. Cytoprotective effects of dietary flavonoids against cadmium-induced toxicity[J]. Annals of the New York Academy of Science, 2017, 1398(1): 5-19. DOI:10.1111/nyas.13344.
[24] 孔令义. 天然药物化学[M]. 北京: 中国医药科技出版社, 2015: 266-268.
[25] 白卫滨, 李夏, 朱翠娟, 等. 黄酮类化合物对镉毒性营养干预分子机制的研究进展[J]. 食品科学, 2017, 38(3): 245-253. DOI:10.7506/spkx1002-6630-201703040.
[26] WEN L N, JIANG X W, SUN J X, et al. Cyanidin-3-O-glucoside promotes the biosynthesis of progesterone through the protection of mitochondrial function in Pb-exposed rat leydig cells[J]. Food & Chemical Toxicology, 2018, 112: 427-434. DOI:10.1016/j.fct.2017.10.008.
[27] BAI W B, SUN J X, XU W, et al. Cyanidin-3-O-glucoside protects against 1,3-dichloro-2-propanol-induced reduction of progesterone by upregulation of steroidogenic enzymes and cAMP level in leydig cells[J].Frontiers in Pharmacology, 2016, 7: 399. DOI:10.3389/fphar.2016.00399.
[28] 蔡夏夏, 李雪, 鲍雷, 等. 葡萄籽原花青素对II型糖尿病大鼠皮肤胶原代谢的影响[J]. 食品科学, 2013, 34(15): 213-218. DOI:10.7506/spkx1002-6630-201315044.
[29] MARTINEZ R M, PINHO-RIBEIRO F A, VALE D L, et al. Transchalcone added in topical formulation inhibits skin inflammation and oxidative stress in a model of ultraviolet B radiation skin damage in hairless mice[J]. Journal of Photochemistry & Photobiology B:Biology, 2017, 171: 139-146. DOI:10.1016/j.jphotobiol.2017.05.002.
[30] GARCIA-BORES A M, ESPINOSA-GONZALEZ A M, REYNACAMPOS A, et al. Lippia graveolens photochemopreventive effect against UVB radiation-induced skin carcinogenesis[J]. Journal of Photochemistry & Photobiology B Biology, 2017, 167: 72-81.DOI:10.1016/j.jphotobiol.2016.12.014.
[31] WOLFLE U, ESSER P R, SIMON-HAARHAUS B, et al. UVB-induced DNA damage, generation of reactive oxygen species, and inflammation are effectively attenuated by the flavonoid luteolin in vitro and in vivo[J]. Free Radical Biology Medicine, 2011, 50(9):1081-1093. DOI:10.1016/j.freeradbiomed.2011.01.027.
[32] ZHOU B R, LIU W L, LUO D. Protective effect of baicalin against multiple ultraviolet B exposure-mediated injuries in C57BL/6 mouse skin[J]. Archives of Pharmacal Research, 2011, 34(2): 261-268.DOI:10.1007/s12272-011-0212-2.
[33] PRATHEESHKUMAR P, SON Y O, WANG X, et al. Cyanidin-3-glucoside inhibits UVB-induced oxidative damage and inflammation by regulating MAP kinase and NF-κB signaling pathways in SKH-1 hairless mice skin[J]. Toxicology and Applied Pharmacology, 2014,280(1): 127-137. DOI:10.1016/j.taap.2014.06.028.
[34] CHOI K S, KUNDU J K, CHUN K S, et al. Rutin inhibits UVB radiation-induced expression of COX-2 and iNOS in hairless mouse skin: p38 MAP kinase and JNK as potential targets[J]. Archives of Biochemistry Biophysics, 2014, 559: 38-45. DOI:10.1016/j.abb.2014.05.016.
[35] PAL H C, ATHAR M, ELMETS C A, et al. Fisetin inhibits UVB-induced cutaneous inflammation and activation of PI3K/AKT/NFκB signaling pathways in SKH-1 hairless mice[J]. Photochemistry and Photobiology, 2015, 91(1): 225-234. DOI:10.1111/php.12337.
[36] LEE H J, IM A R, KIM S M, et al. The flavonoid hesperidin exerts anti-photoaging effect by downregulating matrix metalloproteinase(MMP)-9 expression via mitogen activated protein kinase (MAPK)-dependent signaling pathways[J]. BMC Complementary and Alternative Medicine, 2018, 18(1): 39. DOI:10.1186/s12906-017-2058-8.
[37] SHARMA S D, KATIYAR S K. Dietary grape seed proanthocyanidins inhibit UVB-induced cyclooxygenase-2 expression and other inflammatory mediators in UVB-exposed skin and skin tumors of SKH-1 hairless mice[J]. Pharmaceutical Research, 2010, 27(6): 1092-1102. DOI:10.1007/s11095-010-0050-9.
[38] 何咏. 矢车菊素-3-葡萄糖苷干预UVB损伤HaCaT细胞ROS/COX-2通路的初步研究[D]. 广州: 暨南大学, 2015: 3.
[39] REN X, SHI Y, ZHAO D, et al. Naringin protects ultraviolet B-induced skin damage by regulating p38 MAPK signal pathway[J]. Journal of Dermatological Science, 2016, 82(2): 106-114. DOI:10.1016/j.jdermsci.2015.12.008.
[40] KWON J Y, LEE K W, KIM J E, et al. Delphinidin suppresses ultraviolet B-induced cyclooxygenases-2 expression through inhibition of MAPKK4 and PI-3 kinase[J]. Carcinogenesis, 2009, 30(11): 1932-1940. DOI:10.1093/carcin/bgp216.
[41] HE Yong, HU Yunfeng, JIANG Xinwei, et al. Cyanidin-3-O-glucoside inhibits the UVB-induced ROS/COX-2 pathway in HaCaT cells[J].Journal of Photochemistry & Photobiology B Biology, 2017, 177: 24-31. DOI:10.1016/j.jphotobiol.2017.10.006.
[42] CHIANG H M, CHAN S Y, CHU Y, et al. Fisetin ameliorated photodamage by suppressing the mitogen-activated protein kinase/matrix metalloproteinase pathway and nuclear factor-κB pathways[J].Journal of Agricultural and Food Chemistry, 2015, 63(18): 4551-4560.DOI:10.1021/jf502500t.
[43] 夏济平, 宋秀祖, 孙蔚凌, 等. 表没食子儿茶酚没食子酸酯对紫外线辐射诱导角质形成细胞产生IL-6和NF-κB的影响[J]. 中国皮肤性病学杂志, 2006, 20(12): 705-707; 729. DOI:10.3969/j.issn.1001-7089.2006.12.001.
[44] SHIN S W, JUNG E, KIM S, et al. Antagonizing effects and mechanisms of afzelin against UVB-induced cell damage[J]. PLoS ONE, 2013, 8(4): e61971. DOI:10.1371/journal.pone.0061971.
[45] DUBOIS R N, ABRAMSON S B, CROFFORD L, et al.Cyclooxygenase in biology and disease[J]. FASEB Journal, 1998,12(12): 1063-1073. DOI:10.1096/fasebj.12.12.1063.
[46] PAREDES-GONZALEZ X, FUENTES F, SU Z Y, et al. Apigenin reactivates Nrf2 anti-oxidative stress signaling in mouse skin epidermal JB6 P+ cells through epigenetics modifications[J]. The AAPS Journal, 2014, 16(4): 727-735. DOI:10.1208/s12248-014-9613-8.
[47] MARTINEZ R M, PINHO-RIBEIRO F A, STEFFEN V S, et al.Topical formulation containing naringenin: efficacy against ultraviolet B irradiation-induced skin inflammation and oxidative stress in mice[J]. PLoS ONE, 2016, 11(1): e0146296. DOI:10.1371/journal.pone.0146296.
[48] ZHU X, LI N, WANG Y, et al. Protective effects of quercetin on UVB irradiationinduced cytotoxicity through ROS clearance in keratinocyte cells[J]. Oncology Reports, 2017, 37(1): 209-218. DOI:10.3892/or.2016.5217.
[49] YIN Y, LI W, SON Y O, et al. Quercitrin protects skin from UVB-induced oxidative damage[J]. Toxicology and Applied Pharmacology,2013, 269(2): 89-99. DOI:10.1016/j.taap.2013.03.015.
[50] HU Y F, MA Y T, WU S, et al. Protective effect of cyanidin-3-O-glucoside against ultraviolet B radiation-induced cell damage in human HaCaT keratinocytes[J]. Frontiers in Pharmacology, 2016, 7:301. DOI:10.3389/fphar.2016.00301.
[51] AFAQ F, SYED D N, MALIK A, et al. Delphinidin, an anthocyanidin in pigmented fruits and vegetables, protects human HaCaT keratinocytes and mouse skin against UVB-mediated oxidative stress and apoptosis[J]. Journal of Investigative Dermatology, 2007, 127(1):222-232. DOI:10.1038/sj.jid.5700510.
[52] LI M, LIN X F, LU J, et al. Hesperidin ameliorates UV radiationinduced skin damage by abrogation of oxidative stress and inflammatory in HaCaT cells[J]. Journal of Photochemistry &Photobiology B Biology, 2016, 165: 240-245. DOI:10.1016/j.jphotobiol.2016.10.037.
[53] HARWANSH R K, MUKHERJEE P K, KAR A, et al. Enhancement of photoprotection potential of catechin loaded nanoemulsion gel against UVA induced oxidative stress[J]. Journal of Photochemistry &Photobiology B Biology, 2016, 160: 318-329. DOI:10.1016/j.jphotobiol.2016.03.026.
[54] FEHÉR P, UJHELYI Z, VÁRADI J, et al. Efficacy of pre- and posttreatment by topical formulations containing dissolved and suspended Silybum marianum against UVB-induced oxidative stress in guinea pig and on HaCaT keratinocytes[J]. Molecules, 2016, 21(10): 1269.DOI:10.3390/molecules21101269.
[55] 吕燕红. 枸杞叶总黄酮对UVB照射致无毛小鼠皮肤光损伤的防护作用研究[D]. 兰州: 兰州大学, 2016: 21-24.
[56] SHARMA S D, MEERAN S M, KATIYAR S K. Dietary grape seed proanthocyanidins inhibit UVB-induced oxidative stress and activation of mitogen-activated protein kinases and nuclear factor-κB signaling in in vivo SKH-1 hairless mice[J]. Molecular Cancer Therapeutics, 2007,6(3): 995-1005. DOI:10.1158/1535-7163.MCT-06-0661.
[57] 李锋, 李清仙, 程志远, 等. 坛紫菜多酚抗氧化及抑制UVB致HSF细胞氧化损伤作用[J]. 食品科学, 2017, 38(17): 190-197. DOI:10.7506/spkx1002-6630-201717031.
[58] KIM K M, IM A R, LEE S, et al. Dual protective effects of flavonoids from Petasites japonicus against UVB-induced apoptosis mediated via HSF-1 activated heat shock proteins and Nrf2-activated heme oxygenase-1 pathways[J]. Biological & Pharmaceutical Bulletin, 2017,40(6): 765-773. DOI:10.1248/bpb.b16-00691.
[59] WANG Y S, CHO J G, HWANG E S, et al. Enhancement of protective effects of radix scutellariae on UVB-induced photo damage in human HaCaT keratinocytes[J]. Applied Biochemistry and Biotechnology,2018, 184(4): 1073-1093. DOI:10.1007/s12010-017-2611-4.
[60] RIGBY C M, ROY S, DEEP G, et al. Role of p53 in silibininmediated inhibition of ultraviolet B radiation-induced DNA damage,inflammation and skin carcinogenesis[J]. Carcinogenesis, 2017, 38(1):40-50. DOI:10.1093/carcin/bgw106.
[61] ROY S, DEEP G, AGARWAL C, et al. Silibinin prevents ultraviolet B radiation-induced epidermal damages in JB6 cells and mouse skin in a p53-GADD45alpha-dependent manner[J]. Carcinogenesis, 2012,33(3): 629-636. DOI:10.1093/carcin/bgr299.
[62] BRITTO S M, SHANTHAKUMARI D, AGILAN B, et al. Apigenin prevents ultraviolet-B radiation induced cyclobutane pyrimidine dimers formation in human dermal fibroblasts[J]. Mutation Research,2017, 821: 28-35. DOI:10.1016/j.mrgentox.2017.06.002.
[63] MIN W, AHMAD I, CHANG M E, et al. Baicalin protects keratinocytes from Toll-like receptor-4 mediated DNA damage and inflammation following ultraviolet irradiation[J]. Photochemistry and Photobiology, 2015, 91(6): 1435-1443. DOI:10.1111/php.12505.
[64] GUILLERMO-LAGAE R, DEEP G, TING H, et al. Silibinin enhances the repair of ultraviolet B-induced DNA damage by activating p53-dependent nucleotide excision repair mechanism in human dermal fibroblasts[J].Oncotarget, 2015, 6(37): 39594-39606. DOI:10.18632/oncotarget.5519.
[65] 林向飞, 闵玮, 朱晓芳, 等. 绿茶多酚对表皮HaCaT细胞光损伤的干预作用研究[J]. 中国美容医学杂志, 2014, 23(17): 1401-1403.
[66] WU Poyuan, LYU Jialing, LIU Yijung, et al. Fisetin regulates Nrf2 expression and the inflammation-related signaling pathway to prevent UVB-induced skin damage in hairless mice[J]. International Journal of Molecular Science, 2017, 18(10): 2118. DOI:10.3390/ijms18102118.
[67] JUNG S K, LEE K W, KIM H Y, et al. Myricetin suppresses UVB-induced wrinkle formation and MMP-9 expression by inhibiting Raf[J]. Biochemical Pharmacology, 2010, 79(10): 1455-1461.DOI:10.1016/j.bcp.2010.01.004.
[68] JUNG S K, HA S J, JUNG C H, et al. Naringenin targets ERK2 and suppresses UVB-induced photoaging[J]. Journal of Cellular and Molecular Medicine, 2016, 20(5): 909-919. DOI:10.1111/jcmm.12780.[69] PERVIN M, UNNO K, YORIYUKI N, et al. Luteolin suppresses ultraviolet A- and B-induced matrix metalloproteinase 1- and 9 expression in human dermal fibroblast cells[J]. Journal of Nutrition &Food Sciences, 2016, 6(6): 1-6. DOI:10.4172/2155-9600.1000560.
[70] LIM S H, JUNG S K, BYUN S, et al. Luteolin suppresses UVB-induced photoageing by targeting JNK1 and p90 RSK2[J]. Journal of Cellular and Molecular Medicine, 2013, 17(5): 672-680. DOI:10.1111/jcmm.12050.
[71] KIM H I, JEONG Y U, KIM J H, et al. 3,5,6,7,8,3’,4’-Heptamethox yflavone, a citrus flavonoid, inhibits collagenase activity and induces type I procollagen synthesis in HDFn cells[J]. International Journal of Molecular Science, 2018, 19(2): 620. DOI:10.3390/ijms19020620.
[72] 康元, 张峻岭, 史先花, 等. 葡萄籽提取物原花青素对长波紫外线诱导皮肤成纤维细胞表达TGF-β RII与Smad7的影响[J]. 中国中西医结合皮肤性病学杂志, 2015, 14(6): 341-343. DOI:10.3969/j.issn.1672-0709.2015.06.001.
[73] MIN W, LIU X, QIAN Q, et al. Effects of baicalin against UVA-induced photoaging in skin fibroblasts[J]. American Journal of Chinese Medicine, 2014, 42(3): 709-727. DOI:10.1142/S0192415X14500463.
Recent Progress in Protective Effect of Flavonoids against Skin Photodamage
彭子瑶, 蒋鑫炜, 孙建霞, 等. 黄酮类物质对皮肤光损伤保护的研究进展[J]. 食品科学, 2019, 40(11): 246-253.DOI:10.7506/spkx1002-6630-20180504-057. http://www.spkx.net.cn
PENG Ziyao, JIANG Xinwei, SUN Jianxia, et al. Recent progress in protective effect of flavonoids against skin photodamage[J]. Food Science, 2019, 40(11): 246-253. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180504-057. http://www.spkx.net.cn