表1 转基因植物商业化与研发情况
Table 1 Commercialization, research and development of transgenic plants

分类 品种四大传统转基因品种 大豆、玉米、棉花、油菜已上市品种 甜菜、木瓜、茄子、马铃薯、苹果进入评估末期品种 水稻、香蕉、小麦、鹰嘴豆、木豆、芥菜、甘蔗
转基因植物商业化种植已超过20 年,截至到2016年,全球种植面积达1.851亿 hm2,比1996年的170万 hm2,增长了100多倍。转基因植物为农民乃至全社会带来了巨大的农业、经济和社会效益[1-3]。我国是少数几个拥有转基因植物自主研发能力的国家,目前我国转基因植物种植面积排在全球第8位,主要种植品种为抗虫棉花与抗病番木瓜,转基因水稻、玉米仍未商业化种植,由于公众对转基因食品安全性的担忧,虽然我国的转基因植物研发水平位于世界前列,但转基因植物产业化速度较慢,逐步被巴西与阿根廷等发展中国家所超越[3-5]。
转基因技术是一种育种手段,与近年来兴起的基因编辑技术并称为精准育种技术,在育种史上做到了基因序列、蛋白序列、功能位点、插入位点的四精准[6]。传统育种如杂交育种、诱变育种并没有办法做到精准,不过基本原理是相同的,都是发现、创造变异,选择、利用变异,使植物性状更加符合人类需求[7]。已有多家权威机构发布报告证明,转基因技术育种与传统育种比,并没有特别的风险与增加风险的可能性[8-10],转基因植物大规模商业化至今,也未出现对人类与动物健康有负面影响的报告[11-12]。
转基因技术可将来源于任何种类的植物、动物、微生物的遗传物质引入到植物中,其打破了生物种属间的自然有性繁殖,故而人们增加了对其食用安全性的疑虑,转基因植物食用安全性评估是消除人们对转基因食品安全性疑虑最有效的方法[13-14]。风险评估指在特定条件下的风险源暴露时,对人体健康产生的潜在危害大小与可能出现的概率[15]。风险评估更强调对其潜在后果或可能的不利影响进行评价,从而回答关于健康风险的具体问题。因此对转基因植物在商业化种植前进行科学评估,对于消除公众对转基因食品的疑虑具有重要意义。本文就转基因植物的产业现状、风险评估原则与内容、国内外评估与监管情况等方面进行总结,并综述转基因植物的食用安全性评估、国内外监管研究进展。
截至到2016年,共有26 个国家与地区种植转基因植物,其中发过国家7 个、发展中国家17 个,而在1996年实现商业化种植的国家仅有美国与加拿大。转基因植物品种为消费者提供了更多的选择,如表1所示,四大传统转基因植物大豆、玉米、棉花、油菜的种植面积占全球总种植面积的一半,复合性状转基因作物发展迅速,占全球转基因种植面积的41%[1-3]。
表1 转基因植物商业化与研发情况
Table 1 Commercialization, research and development of transgenic plants

分类 品种四大传统转基因品种 大豆、玉米、棉花、油菜已上市品种 甜菜、木瓜、茄子、马铃薯、苹果进入评估末期品种 水稻、香蕉、小麦、鹰嘴豆、木豆、芥菜、甘蔗
按生物技术产业情况分类,转基因植物划分成3 代:第一代转基因植物以农艺性状的改进为主,如耐除草剂、抗虫,还有抗病、抗旱、抗盐碱、延缓成熟等;第二代转基因植物主要以提高品质性状;第三代转基因植物主要作为生物反应器应用于生物医药与工业领域。
第一代转基因植物解决的是作物产出问题,与传统作物在外观、风味、营养价值上实质等同[3]。自1996年商业化以来,抗除草剂和抗虫一直是转基因植物最具优势的两个性状,也是产业化速度与规模化最快的转基因植物,从1994年到2016年,共有40 个国家和地区批准了转基因植物用于粮食和/或饲料中,释放到环境中的共涉及到26 种转基因植物与363 个转化体,主要转化体批准情况如表2所示。第二代转基因植物以改善人体健康为重点,不但对农民有利,还对普通消费者有直接的好处,更加关注消费者的营养与健康,可改善消费者的营养状况,有利于营养平衡,例如科研人员正在培育高异黄酮大豆与高不饱和脂肪酸大豆,很快将会商业化种植[4];还包括提高必需脂肪酸、必需氨基酸含量、多种微量元素和其他植物功能性成分等营养素的含量,所开发产品有高植酸酶、高赖氨酸和铁蛋白的玉米[16-18],富含亚麻酸的亚麻籽[19],富集β-胡萝卜素的大米[20-21],富含白藜芦醇、绿原酸、类黄酮的番茄[22],富含高蛋氨酸的土豆[23]。第三代转基因植物主要以药用、工业用为主,已成为研究最活跃、产业发展最迅速、效益最显著的热点之一,例如疫苗、人血清蛋白、抗体、工业酶及生物燃料等[24]。
表2 主要转化体获批情况[1]
Table 2 Approval of major transformants[1]
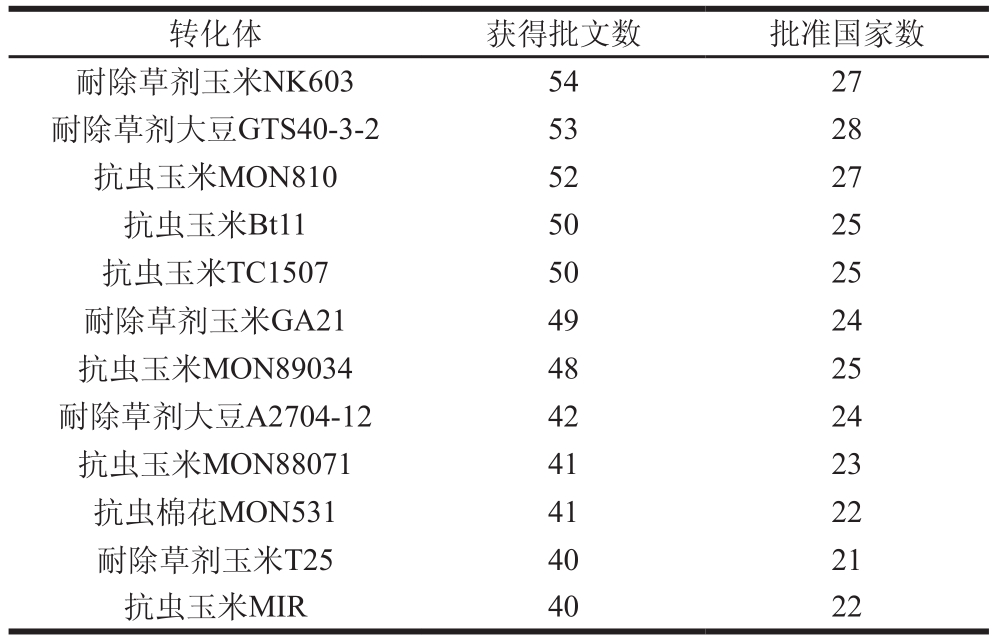
转化体 获得批文数 批准国家数耐除草剂玉米NK603 54 27耐除草剂大豆GTS40-3-2 53 28抗虫玉米MON810 52 27抗虫玉米Bt11 50 25抗虫玉米TC1507 50 25耐除草剂玉米GA21 49 24抗虫玉米MON89034 48 25耐除草剂大豆A2704-12 42 24抗虫玉米MON88071 41 23抗虫棉花MON531 41 22耐除草剂玉米T25 40 21抗虫玉米MIR 40 22
包含两种与多种特征的复合性状转基因植物扩展了转基因植物功能,如一种转基因植物有多种抗虫性状,扩展了杀虫图谱,可对多种害虫有效,同时含有耐除草剂性状或改善植物营养价值等多种性状,既提高了作物的种植效率,又满足了种植者多元化的种植需求[25],复合性状转基因植物发展非常迅速,据国际农业生物技术应用服务组织统计,2016年全球复合性状转基因植物种植面积为7 540万 hm2,占转基因植物总种植面积(1.851亿 hm2)的41%,2015、2014年这一比例分别为33%、28%[1]。
转基因植物的食用安全性从转基因技术诞生之日起就是科学界、消费者以及政府关注的焦点问题。质疑者认为转基因植物打破了生物种属间的自然隔离屏障,食用安全性对人类健康存在不确定的影响。公众对转基因植物食用安全性的疑虑主要体现在:一是转基因植物营养成分是否与非转基因植物一样,可以为人类提供必要的营养物质;二是转基因植物对人体是否具有毒性,质疑者认为虫子吃了抗虫转基因植物会死,人吃了会不会中毒,实际上,人体不存在苏云金杆菌(Bacillus thuringiensis,Bt)蛋白的受体,其对人不会产生作用,而且Bt蛋白只有在昆虫的碱性肠道内才有活性,在人体酸性环境的胃里会失去活性;三是转基因植物与传统植物相比是否增加新的过敏性;四是转基因植物是否存在非预期效应;五是食用转基因植物后是否会发生基因转移,转基因植物与普通植物一样,人们每天食用的果蔬粮食里都含有大量的基因,基因在胃肠中被降解、失活,这也是人类至今没有被转基因的原因[26]。
为了消除消费者对转基因植物食用安全性的疑虑并保证其健康,从促进转基因产业健康发展的角度出发,对转基因植物食用安全性进行评估非常必要。国际权威机构如世界卫生组织(World Health Organization,WHO)、联合国粮食及农业组织(Food and Agriculture Organization,FAO)、国际生命科学学会(International Life Sciences Institute,ILSI)、国际食品法典委员会(Codex Alimentarius Commission,CAC)、世界经济合作与发展组织(Organization for Economic Co-operation and Development,OECD)等多次召集专家召开会议,出台了多部指导转基因植物食用安全性评估的相关条例[20],已经形成一套较为科学、完善的转基因植物食用安全性评估体系[27]。1993年OECD提出了“实质等同”的概念,并得到了WHO、FAO、CAC的认可,转基因食品食用安全性评估的最重要原则之一就是实质等同原则[28-29]。关键成分分析、营养学评估、毒理学评估与致敏性评估等是转基因食品食用安全性评估的主要内容。
对转基因植物进行关键成分分析是基于“实质等同”原则的基本评估方法。即分析转基因植物与对应非转基因对照的表型以及营养成分的差异,得出两者是否实质等同[22-23]。关键成分分析是转基因植物食用安全性评估的起点与重要内容。进行主成分分析最重要地是选择好与转基因植物对照的非转基因植物品种,选取样品时,如选取同一种植地点,需选取3 个以上不同季节种植的样品,或3 个以上不同种植地点的非转基因样品。
对转基因植物进行营养成分分析是关键成分分析的重要内容,也是消除公众对转基因植物与普通植物营养成分是否相同疑虑的方法所在。由于传统育种方式如杂交育种、诱变育种培育植物新品种的营养成分也可能会存在显著性差异,因此转基因植物与其非转基因对照之间进行营养成分的差异分析很有必要[30],由于每种转基因植物的营养成分不同,对需要检测与对比的成分并没有作出统一的规定,OECD已制定了针对不同转基因植物需要检测对比的成分,并提供了参考数据范围[31],大体上主要对营养成分,比如碳水化合物、脂肪、蛋白质,以及膳食纤维、维生素、矿物质、灰分与水分等进行分析比对,特定的品种还可能需要分析蛋白质含量及氨基酸组成比例,脂肪中的饱和、单不饱和、多不饱和脂肪酸的比例与含量。分析转基因植物是否与对应非转基因对照一样能为人类提供必要的营养成分,当转基因植物与其对照亲本植物营养成分含量有差异时,应考察此种差异是否包含在这类食品的含量参考范围内,多位学者对转基因抗虫大豆[32]、水稻[33-34]、耐除草剂玉米[35]、抗虫木豆[36]等转基因植物中主要营养成分与其非转基因亲本中的含量进行分析,结果表明各成分含量基本一致。而对于改良营养组成的转基因食品,如为了补充VA,有学者对黄金大米进行了评估,全面分析对比了其营养成分,结果表明转基因黄金大米除了β-胡萝卜素显著高于对照外,必需脂肪酸、半乳糖含量也有较大地提高,显著提高了转基因植物的营养价值[37]。
同时需对抗营养因子进行对比分析,比如植酸、胰蛋白酶抑制剂、凝聚素以及单宁等。另外,不同的植物中可能含有不同的天然有害物质,会影响人体健康,如棉籽中的棉酚、油菜籽中的硫代葡萄糖苷和芥酸,在主成分分析中应分析转基因操作是否增加了植物中天然有害物质的含量。另外,对因转入外源基因产生的新抗营养因子或过敏原引起的非预期效应也应进行安全评估。有研究表明新转入的Cry1Ac基因都没有以抗营养因子、过敏原的形式产生非预期效应[34]。
营养学评估是转基因植物食用安全性评估的重要方法之一,其建立在对营养成分分析的基础上,对转基因植物的营养学评估应遵从个案分析原则,把转基因植物制作的饲料以全食品的方式饲喂动物,通过与非转基因对照组对比,观察转基因植物对动物采食量、消化率以及健康状态的影响,并测定实验动物的血液学与脏器质量等指标,评价转基因植物与普通对照植物在营养学方面的变化,为转基因产品是否适合人类食用提供参考。如转基因植物营养学评价时营养、生理指标有变化,需进一步提供营养素的吸收率、利用率,人群营养素推荐摄入量、最大可能摄入量等营养学资料[26,38]。张同童等[39]用转抗胰蛋白酶水稻饲喂SD大鼠90 d,结果表明大鼠生长发育情况、食物利用率、体质量、脏体比、血液学指标以及病理组织学观察等指标与普通植物对照组相比没有显著性差异。Papineni等[40]通过45 d小鸡实验证明了转基因大豆与非转基因大豆的营养等同性。转基因抗病玉米饲喂Wistar大鼠28 d,结果表明,与对照组大鼠相比,生活状况无明显差异,没有中毒症状出现,大鼠体质量、谷草转氨酶活力等血常规指标均无显著性差异[41]。
抗营养因子的营养学评估也是重要内容之一,张宇等[42]对转AO基因高植酸酶玉米进行了营养学评价分析,认为这种转基因大玉米中转入的高植酸酶没有抑制蛋白质的吸收,从营养学角度分析该类型玉米是安全的。对于改善品质的第二代转基因植物的营养学评价,除了营养成分分析外,通过动物实验观察营养特性改变造成的影响也是不可少的。人类饮食习惯一般是将食物经过煮熟或其他加工方式处理后食用,很少生食,转基因植物加工方式也是“实质等同”考虑的一个重要方面;因此,有必要考虑生产加工对转基因植物食用安全性的影响。有研究发现高压灭菌和紫外辐射对转基因食品中DNA的降解作用较强[43];还有研究发现发酵与烘烤处理都会导致转基因玉米DNA的降解[44];干热与湿热处理对内外源基因都具有显著的降解作用[45-46]。因此,热加工、紫外辐照、发酵等烹饪加工都会对转基因植物内源性基因与外源性基因有不同程度的降解作用,从而降低了水平转移完整功能基因的风险,提高了转基因植物的安全性。
毒理学评估是转基因植物食用安全性评估的重要内容,主要包括对外源基因表达产物的毒理学评估与全食品毒理学评估。
对外源基因表达的新蛋白的评估,应充分考察分子与生化特性等信息,包括新表达蛋白与已知毒性蛋白或抗营养因子(植物凝集素、胰蛋白酶抑制剂)的核酸、氨基酸序列对比是否同源。热稳定性实验、模拟消化实验可确定新蛋白质的耐热性与抗消化能力。新蛋白在没有安全食用历史的情况下或安全性资料不足时,需要经急性毒性实验与28 d重复剂量暴露实验[47-49],对非蛋白类表达产物,需提供相关理化特性及生物学功能数据[5]。对转入基因表达产物的评估是对预期效应的评价,在植物转基因的操作过程中,会伴随着非预期效应,因此,对全食品的毒理学评价即对非预期效应的评估,更加保证了转基因植物的安全性。全食品毒理学评估主要包括90 d动物喂养实验,分析判断转基因植物对人类健康的长期影响,90 d动物喂养实验也是FAO/WHO针对转基因植物食用安全性评估的推荐方法[50]。如果转基因植物的90 d亚慢性毒性实验没有异常反应,就认为此种转基因植物长期食用不会对人体健康产生危害,如果实验有异常反应,则需进行慢性毒性、生殖毒性动物实验。
国内学者通过体外表达获取了Cry1Ab/Ac新蛋白,分析表明,该蛋白与转基因水稻源Cry1Ab/Ac蛋白的分子大小、糖基化、结构与功能等具有实质等同性,且该新蛋白热稳定性好,经100 ℃加热处理60 min后,蛋白质没有降解并保持免疫活性,但体外消化实验表明该蛋白在消化液中容易被降解;通过生物信息学分析,Cry1Ab/Ac新蛋白与已知毒素或过敏原没有氨基酸序列同源性;剂量为5 g/kg mb经口动物急性毒性实验表明,Cry1Ab/Ac蛋白质没有毒性[27,51-52]。
多位学者对转基因植物的全食品毒理学进行评价,结果都表明转基因植物与其亲本对照具有同样的安全性。有学者用高直链淀粉转基因大米喂食大鼠,90 d动物实验结果表明高直链转基因大米与亲本对照有同等的食用安全性[53];有学者对转DMO基因水稻[54]、转BT基因水稻[55-56]、转Cry2A基因水稻[57]、转基因耐草甘膦除草剂玉米[58]、转Cry1Ab基因大米[59]、转CV127基因大豆[60]进行了90 d大鼠实验,比较了喂养转基因大米大鼠的进食量、体质量、血常规和血生化、脏体比以及骨密度等指标与对照大米大鼠的差异,证明转基因大米与对照大米具有同等安全性。芦春斌等[61-62]研究了转基因大豆对雌性大鼠胚胎发育、受精能力以及对雄性大鼠生殖系统的影响,结果表明转基因大豆对雌性大鼠的生殖能力没有影响。
致敏性不是转基因植物所独有,普通食物也存在致敏性,大多数食物致敏是由蛋白质引起的,并不需要进行致敏性评价,而转基因技术打破了自然界中物种之间的遗传物质不能转移屏障,为预防转基因技术引起的过敏基因物种间转移,需要对转基因植物产生的新蛋白进行致敏性评估。目前,世界各国采用的2001年FAO/WHO颁布的过敏原评价决定树[63]过敏性评估法,其在2003年被CAC采纳[64]。外源基因供体是否包含过敏原遗传物质、新表达的蛋白质与已知蛋白质的氨基酸序列是否同源、外源蛋白质的热稳定性、体外模拟蛋白消化能力以及动物模型实验等方面是致敏性评估的主要内容。
氨基酸序列比较是致敏性评价的便捷方法,有学者利用计算机分析蛋白质的结构、功能及进化情况[65];北京大学建立的转基因食品过敏原数据库可以对新转入蛋白与已知过敏蛋白进行氨基酸序列比对[66];郭明璋等[67]建立了中国食物过敏原数据库(http://175.102.8.19:8001/site/index)。目前规定新蛋白与已知过敏原蛋白的相同氨基酸数目大于35%,并且6 个连续氨基酸相同,就认为氨基酸序列有相似性。此外还可能需要利用致敏性动物模型进行综合评估,判断外源蛋白是否有潜在的致敏性[68-70]。
FAO、WHO、OECD、ILSI及CAC负责制定转基因植物安全性评估指南[71],OECD于1993年提出评价转基因产品安全性的“实质等同”原则,即如果转基因产品成分与其非转基因对照大体相同,它们就是同等安全的[22];ILSI发展了一种评估转基因食品过敏性的“树型判断法”策略;《现代生物技术食品风险评估原则》(CAC/GL 44-2003)及《转基因植物及其食品的安全性评价指南》(CAC/GL 45-2003)在2003年由CAC发布,成为各国制定转基因植物安全性评估与管理的指导性文件。
美国农业部(United States Department of Agriculture,USDA)、环境保护署、食品与药物监管局(Food and Drug Administration,FDA)以及FDA下属的动植物检验检疫处负责环境与食用安全两方面的评估与审批,USDA建立了基于不同风险类型的食用安全评估方法,对低风险类型实施通知程序,对高风险类型实施许可程序。加拿大负责环境与食用安全性评估的机构是加拿大食品检验服务站与加拿大卫生组织。美国与加拿大对转基因植物的管理相对宽松,转基因植物安全性评估是以转化体为基础的,即只要一个转化体在某个品种中获得解除管制批准,任何该转化体在其他品种中的应用都有同等批准。美国与加拿大采取的是“可靠科学原则”与“实质等同”原则,即针对科学问题,通过科学的理论、路径与方法,得出科学的判断,而不是以其他关切与消费者疑虑为判断基础[72-73],以科学与风险为基础进行的评估与决策,监管对象是转基因产品,而不是转基因技术本身,所以该地区转基因植物产业化速度发展较快。欧盟对转基因植物监管较为严格,虽然对转基因技术进行了深入的研究,但极力主张对转基因产品采取“科学预防原则”与“个案处理原则”,由欧盟食品安全机构负责转基因食品的风险评估;此外,欧盟还坚持对转基因产品从农田到餐桌各环节进行标识,以保证可追溯性,因此欧盟国家转基因植物推广面积很小。
目前我国已批准转基因棉花与木瓜两个品种的商业化种植;已批准转基因大豆、玉米、甜菜、油菜及棉花等品种的进口,但进口的产品只可用于加工的食品原料[71]。我国对转基因植物的评估以产品为基础,即无论转化体是否相同,每个新品种都要重新评估与审批。
我国政府非常重视转基因植物安全管理工作,现已建立起了较为完善的法规体系、管理体系与技术支撑体系[3]。
为了防范转基因生物风险与加强在我国境内从事转基因生物研究、实验、生产、加工、经营及进出口等环节的监管,国务院在2001年5月颁布并实施《农业转基因生物安全管理条例》(以下简称《条例》),《条例》赋予农业部对农业转基因生物进行安全性评价与监督管理。随后相关部门根据《条例》规定出台一系列配套规章,进一步完善了转基因评价与监管制度。虽然我国已经建立了较为完善的监管体系,但《条例》与配套规章还存在实际实施不到位的现象。武维华[74]认为科学监管是转基因技术发展的保证,应尽快推进、完善转基因生物安全监管法律法规体系、科学评估体系与监管体系。
农业部于2010年10月颁布《转基因植物安全评价指南》(以下简称《指南》)。《指南》介绍了分子特征、食用安全性、遗传稳定性等内容在内的转基因植物评估体系[75],并就食用安全性评估进行了详细的阐述。我国对转基因植物评估较为严格,评估以品种为基础,实行分级与分阶段管理。按照风险大小类型,转基因生物分为4 个安全等级。转基因产品的申请需经历实验研究等5 个阶段[3]。
为强化各部门协调配合,依据《条例》规定,农业、环保、卫生、食品、检验检疫等11 个部门共同组建部际联席会议,协商转基因重大事宜。农业转基因生物安全管理办公室设置在农业部,监管食用安全性评估在内的农业转基因生物安全。为了在科学评估基础上做好农业转基因生物的科学执法管理,成立了国家农业转基因生物安全委员会,专门负责转基因生物安全评估。另外,全国农业转基因生物安全管理标准化技术委员会由国家标准委组建,由农业部管理,负责开展农业转基因生物的安全管理、监测与技术检测的标准化工作。并建设了一批转基因生物检测机构,为转基因安全评估与管理提供技术支撑。
转基因技术极大地推动了农业的发展,但人们对转基因植物及其产品的食用安全性问题的关注越来越多,且还未从根本上消除人们对转基因产品安全性的疑虑,因此,如何进行转基因植物的安全性评估,确保转基因植物的食用安全,同时又能促进转基因产业的健康发展,是关系到人类健康与转基因植物产业发展的重大问题。
应大力开展转基因植物安全性评估研究,除了传统的成分分析、毒理学、营养学、致敏性评估外,应完善转基因食用安全评估体系,提供更先进的评估、检测手段。应开展研究现代分子生物学手段在转基因植物安全性评估中的应用,如“非靶分析”、生物芯片、分子毒理学与细胞毒理学等。检测是监管的基础,现代生物技术等检测手段的发展必将为转基因产品安全监管提供更高效的技术支撑;应研究转基因新技术带来的社学心理学变化,鼓励、引导相关领域科学家加强转基因技术科普工作,及时回应社会关切、质疑与谣言,凝聚社会各方力量,加强转基因的科学传播,减少公众对转基因的恐慌,正确引导公众对转基因的科学认识。
基因编辑技术作为一种新型育种技术,使植物基因修改的构建方法更为准确与便利,Nature Method于2014年把基因编辑技术列为过去10 年最有影响力的生物学研究方法,基因编辑技术可对植物基因组本身进行插入、突变与修饰等操作,可在不引入外源基因的情况下获得新的性状,这是与常规转基因技术最大的区别[76]。因此,基因编辑技术获得的转基因产品品质将更有保障。应加大新一代基因技术如基因编辑在转基因植物中的研发力度,增加科研投入,使我国在转基因新艺术研发领域占领制高点。现有食用安全性评估体系与监管体系是基于最初的转基因技术水平与产业水平发展起来的,随着基因编辑技术等高新生物技术的发展及转基因产业的发展,现有的安全性评估体系与监管体制已无法满足需要,应加快研究利用基因编辑技术获得转基因产品的食用安全性评估方法与监管体制,使评估方法与监管体制更加安全与符合基因编辑技术的需要,加大对基因编辑植物的检测、研发力度,为基因编辑植物的食用安全性评估提供技术支撑。
转基因食品的食用安全性评判根据可靠的科学性原则,逻辑上也叫不完全归纳法,即只要没有科学证据证明转基因食品有害,就认为转基因食品对人类无害,实际上,我们祖祖辈辈食用的常见食物也是根据不完全归纳法判断其安全性。基因克隆技术、遗传转化技术以及基因编辑技术等生物技术的不断进步会强化转基因植物食用安全性,应不断加大转基因技术与生物技术的研发力度,依据科学性评估与风险管理原则,对转基因植物的安全评估与监管实行风险分级管理制度。
[1] 国际农业生物技术应用服务组织. 2016年全球生物技术/转基因作物商业化发展态势[J]. 中国生物工程杂志, 2017, 37(4): 1-8.DOI:10.13523/j.cb.20170401.
[2] BROOKES G, BARFOOT P. The global income and production effects of genetically modified (GM) crops 1996-2011[J]. GM Crops &Food, 2013, 4(1): 74-83. DOI:10.4161/gmcr.24176.
[3] 罗云波, 贺晓云. 中国转基因作物产业发展概述[J]. 中国食品学报,2014, 14(8): 10-15. DOI:10.16429/j.1009-7848.2014.08.031.
[4] 罗云波. 转基因作物热点问题之见解[J]. 中国食品学报, 2013,13(11): 1-5. DOI:10.16429/j.1009-7848.2013.11.001.
[5] 盛耀, 许文涛, 罗云波. 转基因生物产业化情况[J]. 农业生物技术学报, 2013, 21(12): 1479-1487. DOI:10.3969/j.issn.1674-7968.2003.12.010.
[6] 贾士荣. 基因工程作物的安全评估与监管: 历史回顾与改革思考[J]. 中国农业科学, 2018, 51(4): 601-612. DOI:10.3864/j.issn.0578-1752.2018.04.001.
[7] HAJJAR R, HODGKIN T. The use of wild relatives in crop improvement: a survey of developments over the last 20 years[J].Euphytica, 2007, 156(1/2): 1-13. DOI:10.1007/s10681-007-9363-0.
[8] OECD. Recommendation of the council on regulatory policy and governance[R]. Paris: OECD, 2012.
[9] ACRE. Why a modern understanding of genomes demonstrates the need for a new regulatory system for GMOs[EB/OL]. (2013-08-27)[2018-04-29]. http://www.defra.gov.uk/acre/files/Report-2.pdf.
[10] SCHELL J, STEELE M, BEAN J, et al. A comparative analysis of insertional effects in genetically engineered plants: considerations for pre-market assessments[J]. Transgenic Research, 2015, 24: 1-17.DOI:10.1007/s11248-014-9843-7.
[11] NICOLIA A, MANZO A, VERONESI F, et al. An overview of the last 10 years of genetically engineered crop safety research[J]. Critical Review Biotechnology, 2014, 34(1): 77-88. DOI:10.3109/07388551.2 013.823595.
[12] VAN EENENNAAM A L, YOUNG A E. Prevalence and impacts of genetically engineered feedstuffs on livestock populations[J]. Journal of Animal Science, 2014, 92(10): 4255-4278. DOI:10.2527/jas.2014-8124.
[13] 王国英. 转基因植物的安全性评价[J]. 农业生物技术学报, 2001,9(3): 205-207. DOI:10.3969/j.issn.1674-7968.2001.03.001.
[14] MAGANA-GOMEZ J A, BARCA A M. Risk assessment of genetically modified crops for nutrition and health[J]. Nutrition Reviews, 2009,67(1): 1-16. DOI:10.1111/j.1753-4887.2008.00130.x.
[15] 陈君石. 食品安全风险评估概述[J]. 中国食品卫生杂志, 2011, 23(1):4-7. DOI:10.13590/j.cjfh.2011.01.004.
[16] MCGLOUGHLIN M N. Modifying agricultural crops for improved nutrition[J]. New Biotechnology, 2011, 27(5): 494-504. DOI:10.1016/j.nbt.2010.07.013.
[17] 吕庆雪, 宋广树, 孟令聪, 等. 玉米赖氨酸合成相关基因Mucronate载体的构建及功能验证[J]. 基因组学与应用生物学, 2015, 34(12):2690-2694. DOI:10.13417/j.gab.034.002690.
[18] DRAKAKAKI G, MARCEL S, GLAHN R P, et al. Endospermspecific co-expression of recombinant soybean ferritin and Aspergillus phytase in maize results in significant increases in the levels of bioavailable iron[J]. Plant Molecular Biology, 2005, 59(6): 869-880.DOI:10.1007/s11103-005-1537-3.
[19] ABBADI A, DOMERGUE F, BAUER J, et al. Biosynthesis of very-long-chain polyunsaturated fatty acids in transgenic oilseeds:constraints on their accumulation[J]. Plant Cell, 2004, 16(10): 2734-2748. DOI:10.1105/tpc.104.026070.
[20] 杜丽缺, 赵明超, 林拥军, 等. β-胡萝卜素加强的转基因水稻培育[J]. 华中农业大学学报, 2014, 33(5): 1-7. DOI:10.13300/j.cnki.hnlkxb.2014.05.025.
[21] AL-BABILI S, BEYER P. Golden rice-five years on the road: five years to go[J]. Trends in Plant Science, 2005, 10(12): 565-573.DOI:10.1016/j.tplants.2005.10.006.
[22] GIOVINAZZO G, AMICO L D, PARADISO A, et al. Antioxidant metabolite profiles in tomato fruit constitutively expressing the grapevine stilbene synthase gene[J]. Plant Biotechnology Journal,2005, 3(1): 57-69. DOI:10.1111/j.1467-7652.2004.00099.x.
[23] SCHMIDT M A, PARROTT W A, HILDEBRAND D F, et al.Transgenic soya bean seeds accumulating β-carotene exhibit the collateral enhancements of oleate and protein content traits[J]. Plant Biotechnology Journal, 2015, 13(4): 590-600. DOI:10.1111/pbi.12286.
[24] 庞俊峰, 黄东光, 吴燕民. 植物生物反应器研究进展[J]. 生物技术通报, 2011(1): 21-25. DOI:10.13560/j.cnki.biotech.bull.1985.2011.01.003.
[25] 梅晓宏, 许文涛, 贺晓云, 等. 新型转基因植物及其食用安全性评价对策研究进展[J]. 食品科学, 2013, 34(5): 308-312.
[26] 许文涛, 贺晓云 黄昆仑, 等. 转基因植物的食品安全性问题及评价策略[J]. 生命科学, 2011, 23(2): 179-185. DOI:10.13376/j.cbls/2011.02.002.
[27] 许文涛, 黄昆仑, 刘海燕, 等. 转基因食品安全检测与控制技术[J].生物技术产业, 2009(6): 43-46.
[28] CODEX A. guideline for the conduct of food safety assessment of foods derived from recombinant-DNA plants: CAC/GL 45-2003[S].Rome: FAO/WHO Food Standards Program, 2003.
[29] 杨昌举, 举黄灿, 高原. 实质等同性: 转基因食品安全性评估的基本原则[J]. 食品科学, 2001, 22(9): 95-98. DOI:10.3321/j.issn:1002-6630.2001.09.029.
[30] FLACHOWSKY G, CHESSON A, AULRICH K. Animal nutrition with feeds from genetically modified plants[J]. Archives of Animal Nutrition, 2005, 59(1): 1-40. DOI:10.1080/17450390512331342368.
[31] OECD. Consensus document on compositional considerations for new varieties of rice (Oryza sativa): key food and feed nutrients and antinutrients[R]. Paris: OECD, 2004.
[32] FAST B J, SCHAFER A C, JOHNSON T Y, et al. Insect-protected event DAS-81419-2 Soybean (Glycine max L.) grown in the United States and Brazil is compositionally equivalentto nontransgenic soybean[J]. Journal of Agricultural and Food Chemistry, 2014, 62(19):4475-4479. DOI:10.1021/jf505015y.
[33] GAYEN D, PAUL S, SARKAR P S, et al. Comparative nutritional compositions and proteomics analysis of transgenic Xa21 rice seeds compared to conventional rice[J]. Food Chemistry, 2016, 203: 301-307. DOI:10.1016/j.foodchem.2016.02.058.
[34] LI X, HUANG K, HE X, et al. Comparison of nutritional quality between Chinese indica rice with sck and cry1Ac genes and its nontransgenic counterpart[J]. Journal of Food Science, 2007, 72(6):420-424. DOI:10.1111/j.1750-3841.2007.00416.x.
[35] ZHU Y X, HE X Y, LUO Y B, et al. A 90-day feeding study of glyphosate-tolerant maize with the G2-aroA gene in Sprague-Dawley rats[J]. Food and Chemical Toxicology, 2013, 51(1): 280-287.DOI:10.1016/j.fct.2012.09.008.
[36] MISHRA P, SINGH S, RATHINAM M, et al. Comparative proteomic and nutritional composition analysis of independent transgenic pigeon pea seeds harboring cry1AcF and cry2Aa genes and their nontransgenic counterparts[J]. Journal of Agricultural and Food Chemistry, 2017,65(7): 1395-1400. DOI:10.1021/acs.jafc.6b05301.
[37] GAYEN D, GHOSH S, PAUL S, et al. Metabolic regulation of carotenoid-enriched golden rice line[J]. Frontiers in Plant Science,2016, 7: 1622. DOI:10.3389/fpls.2016.01622.
[38] FLACHOWSKY G, AULRICH K, BOHME H, et al. Studies on feeds from genetically modifi ed plants (GMP): contributions to nutritional and safety assessment[J]. Animal Feed Science and Technology, 2007,133(1/2): 2-30. DOI:10.1016/j.anifeedsci.2006.08.002.
[39] 张同童, 梅晓宏. 转抗胰蛋白酶基因水稻90 天喂养SD大鼠实验[J].农业生物技术学报, 2017, 25(11): 1770-1780. DOI:10.3969/j.issn.1674-7968.2017.11.004.
[40] PAPINENI S, FLETCHER D W, CROMWELL G L, et al. Comparative performance of broilers fed diets containing DAS-44406-6 and non-transgenic soybean meal[J]. Poultry Science, 2017, 96(5):384. DOI:10.3382/ps/pew384.
[41] 刘明, 李宝健, 仇玉兰, 等. 转基因抗病玉米饲喂Wistar大鼠食用安全性评价[J]. 中国食物与营养, 2016, 22(10): 13-17. DOI:10.3969/j.issn.1006-9577.2016.10.003.
[42] 张宇, 令狐丽琴, 胡贻椿, 等. 转AO基因高植酸酶玉米营养学评价分析[J]. 中国食物与营养, 2017, 23(5): 50-54. DOI:10.3969/j.issn.1006-9577.2017.05.012.
[43] BALLARI R V, MARTIN A. Assessment of DNA degradation induced by thermal and UV radiation processing: implications for quantification of genetically modified organisms[J]. Food Chemistry,2013, 141(3): 2130-2136. DOI:10.1016/j.foodchem.2013.05.032.
[44] FERNANDES T J, OLIVEIRA M, MAFRA I. Tracing transgenic maize as affected by bread making process and raw material for the production of a traditional maize bread, broa[J]. Food Chemistry,2013, 138(1): 687-692. DOI:10.1016/j.foodchem.2012.10.068.
[45] 王林, 韩飞, 李爱科, 等. 不同加工工艺对大豆转基因成分及调控元件的影响[J]. 大豆科学, 2011, 30(1): 136-140.
[46] 王林, 韩飞, 李爱科, 等. 干热加工工艺对大豆转基因成分及调控元件的影响[J]. 食品科学, 2011, 32(13): 229-233.
[47] CAC. Joint FAO/WHO food standards programme. foods derived from modern biotechnology[S]. Rome: FAO/WHO Food Standards Programme, 2009.
[48] DELANEY B, ASTWOOD J D, CUNNY H, et al. Evaluation of protein safety in the context of agricultural biotechnology[J]. Food and Chemical Toxicology, 2008, 46: S71-S97. DOI:10.1016/j.fct.2008.01.045.
[49] HAMMOND B G. Food safety of proteins in agricultural biotechnology[M]. New York: CRC Press, 2008: 237-258.
[50] FAO/WHO. Safety aspects of genetically modified foods of plant origin. report of a joint FAO/WHO expert consultation on foods derived from biotechnology[R]. Geneva: FAO/WHO, 2000: 3-5.
[51] WANG Y, XU W T, ZHAO W W, et al. Comparative analysis of the proteomic and nutritional composition of transgenic rice seeds with Cry1Ab/Ac genes and their non-transgenic counterparts[J]. Journal of Cereal Science, 2012, 55(2): 226-233. DOI:10.1016/j.jcs.2011.12.004.
[52] CAO S S, XU W T, LUO Y B, et al. Expression, purification and refolding of recombinant Cry1Ab/Ac obtained in Escherichia coli as inclusion bodies[J]. Journal of the Science of Food and Agriculture,2009, 89(5): 796-801. DOI:10.1002/jsfa.3515.
[53] ZHOU X H, DONG Y, XIAO X, et al. A 90-day toxicology study of high-amylose transgenic rice grain in Sprague-Dawley rats[J]. Food and Chemical Toxicology, 2011, 49(12): 3112-3118. DOI:10.1016/j.fct.2011.09.024.
[54] WANG X Y, HE X Y, ZOU S Y, et al. Subchronic feeding study of dicamba-tolerant soybean with the DMO gene in Sprague-Dawley rats[J]. Regulatory Toxicology and Pharmacology, 2016, 77: 134-137.DOI:10.1016/j.yrtph.2016.02.001.
[55] WANG Z H, WANG Y, CUI H R, et al. Toxicological evaluation of transgenic rice flour with a synthetic cry1Ab gene from Bacillus thuringiensis[J]. Journal of the Science of Food and Agriculture, 2002,82: 738-744. DOI:10.1002/jsfa.1105.
[56] 元延芳, 许文涛, 贺晓云, 等. 喂养转基因T2A-1水稻90 天对大鼠肠道健康的影响[J]. 农业生物技术学报, 2013, 21(12): 1552.DOI:10.1038/srep01962.
[57] CAO S S, XU W T, LUO Y B, et al. Metabonomics study of transgenic Bacillus thuringiensis rice (T2A-1) meal in a 90-day dietary toxicity study in rats[J]. Molecular Bio-Systems, 2011, 7(7): 2304-2310.DOI:10.1039/c1mb05076a.
[58] 陈德龙, 张莳眉, 邹世颖, 等. 转基因耐草甘膦除草剂玉米CC-2喂养SD大鼠90 天亚慢性毒性研究[J]. 农业生物技术学报, 2013, 21(12):1448-1457. DOI:10.3969/j.issn.1674-7968.2013.12.006.
[59] SONG H, HE X, ZOU S, et al. A 90-day subchronic feeding study of genetically modified rice expressing Cry1Ab protein in Sprague-Dawley rats[J]. Transgenic Research, 2015, 24(2): 295-308.DOI:10.1016/j.yrtph.2016.02.001.
[60] HE X, BRUM P A R, CHUKWUDEBE A, et al. Rat and poultry feeding studies with soybean meal produced from imidazolinonetolerant (CV127) soybeans[J]. Food and Chemical Toxicology, 2016,88: 48-56. DOI:10.1016/j.fct.2015.12.012.
[61] 芦春斌, 郑建新, 蔡娟, 等. 转基因大豆对雌鼠胚胎发育及受精能力的影响[J]. 大豆科学, 2014, 33(4): 578-582. DOI:10.11861/j.issn.1000-9841.2014.04.0578.
[62] 芦春斌, 周文, 刘标, 等. 喂食转基因大豆对子代雄鼠生殖系统的影响[J]. 大豆科学, 2013, 32(1): 119-123. DOI:10.3969/j.issn.1000-9841.2013.01.028.
[63] FAO/WHO. Evaluation of allergenicity of genetically modified foods:report of a joint FAO/WHO expert consultation on allergenicity of foods derived from biotechnology[R]. Rome, Italy: FAO/WHO, 2001.
[64] HAUSDING M, SAUER K, MAXEINER J H, et al. Transgenic models in allergic responses[J]. Current Drug Targets, 2008, 9(6): 503-510. DOI:10.2174/138945008784533570.
[65] 李荔, 吴曾闵, 刘志刚. 紫红笛鲷过敏原小清蛋白基因克隆及序列分析[J]. 中国公共卫生, 2008, 24(9): 1078-1080. DOI:10.3321/j.issn:1001-0580.2008.09.029.
[66] 林忠平, 倪挺. 转基因食品的过敏特性评估: 食物过敏原数据库的建立[J]. 生物技术通报, 2001(6): 46-47. DOI:10.13560/j.cnki.biotech.bull.1985.2001.06.010.
[67] 郭明璋, 许文涛, 罗云波, 等. 中国食物过敏原数据库的建立与应用[J].食品安全质量检测学报, 2014, 5(9): 2948-2952.
[68] CAO S S, HE X Y, XU W T, et al. Safety assessment of CrylC protein from genetically modified rice according to the national standards of PR China for a new food resource[J]. Regulatory Toxicology and Pharmacology, 2010, 58(3): 474-481. DOI:10.1016/j.yrtph.2010.08.018.
[69] ZHOU C, SUN N, WANG J, et al. Allergenicity assessment of a genetically modified protein-recombinant human lactoferrin[J]. Journal of Allergy Therapy, 2013, 3: 1-6. DOI:10.4172/2155-6121.S3-002.
[70] 孙拿拿, 张馨, 崔文明, 等. 食品致敏性评价啮齿类动物模型研究-C3H/HeJ小鼠动物模型[J]. 卫生研究, 2010, 39(3): 310-312.
[71] 盛耀, 贺晓云, 祁潇哲, 等. 转基因植物食用安全性评价[J]. 保险与加工, 2015, 15(4): 1-7. DOI:10.3969/j.issn.1009-6221.2015.04.001.
[72] GOODMAN R E. 生物安全: 美国转基因作物的评价与管理[J].华中农业大学学报, 2014, 33(6): 83-109. DOI:10.13300/j.cnki.hnlkxb.2014.06.011.
[73] 刘银良. 美国转基因生物技术治理路径探析及其启示[J]. 法学,2015(9): 139-149.
[74] 武维华. 科学监管是转基因技术的保障[J]. 民主与科学, 2015(5): 19-20.
[75] 农业部农业转基因生物安全管理办公室. 农业转基因生物知识100问[M]. 北京: 中国农业出版社, 2011: 35-40.
[76] 付伟, 魏霜, 王晨光, 等. 基因编辑技术的发展与检测监管现状[J].植物检疫, 2016, 30(3): 1-8. DOI:10.19662/j.cnki.issn1005-2755.2016.03.001.
Recent Progress in Food Safety Assessment and Regulation of Genetically Modified Plants
王国义, 贺晓云, 许文涛, 等. 转基因植物食用安全性评估与监管研究进展[J]. 食品科学, 2019, 40(11): 343-350.DOI:10.7506/spkx1002-6630-20180507-092. http://www.spkx.net.cn
WANG Guoyi, HE Xiaoyun, XU Wentao, et al. Recent progress in food safety assessment and regulation of genetically modified plants[J]. Food Science, 2019, 40(11): 343-350. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180507-092. http://www.spkx.net.cn