
图1 食品中花色苷元的基本结构[13]
Fig. 1 Structure of anthocyanidins most commonly found in foods[13]
花色苷是植物的主要呈色物质,是植物世界分布最广的一类色素,它能使植物呈现红、蓝等色泽,并具有独特的生理活性功能。研究表明,花色苷具有抗氧化[1-2]、抗衰老[3]、调节血糖[4]、抑制肿瘤[5-6]、修复和保护肝损伤[7]、修复辐射损伤、保护心血管和降血脂等多种生理功效[8-10],应用前景广阔。但由于花色苷本身的活性,在食品加工中稳定性较差[11],易受pH值、温度、光、O2、花色苷种类、金属离子和酶等因素的影响[12-13],限制了花色苷在食品及其加工领域中的应用。因此,扩大天然色素资源花色苷的应用需解决两方面的问题:一是寻找和开发花色苷含量丰富的植物资源;二是研发合适的花色苷结构修饰技术,以提高花色苷的稳定性并保持其生物活性。分子结构修饰可以提高花色苷在外界环境、食品添加剂和食品加工中的稳定性,使其在较大pH值范围内表现出良好的色泽,对于拓展花色苷在食品加工、营养和保健品行业中的应用具有重要的现实意义。然而,对花色苷结构修饰改性方面目前研究报道较少,国外学者对葡萄酒中的吡喃花色苷研究较多,而国内学者则偏向于花色苷的酯基化和酰基化,但研究也处于起步阶段,效果不是很理想。本文就不同类型(酰基修饰、酯基修饰、形成吡喃类衍生物)花色苷结构修饰的原料来源、结构特征及其生理活性进行了综述,为进一步研究花色苷的结构稳定性、生理活性及其在食品加工、食品营养和保健品工业的应用提供借鉴。
花色苷是自然界最重要的水溶性色素之一,广泛存在于27 个科、73 个属的数万种植物中,因其具有典型的C6-C3-C6骨架结构,所以,一般把花色苷归为黄酮类化合物。花色苷具有多种生理活性,因而国内外公认花色苷是资源最为丰富的替代苯胺类煤焦合成色素的优良天然色素[14]。目前,从植物中分离得到的花色苷种类超过500 种[15]。花色苷是花青素以糖苷键与糖基结合形成的化合物,花青素又称糖苷配基,基本结构为2-苯基-苯并吡喃,自然条件下游离状态的花青素极少见,一般与各种糖基结合以花色苷的形式存在。由于A环和B环各碳位上取代基(羟基或甲氧基)的不同而导致花色苷结构千差万别[16-17],如图1和表1所示。

图1 食品中花色苷元的基本结构[13]
Fig. 1 Structure of anthocyanidins most commonly found in foods[13]
表1 天然花青素糖苷配基的结构及呈色特征[18]
Table 1 Structures and chromatic features of natural anthocyanin aglycones[18]
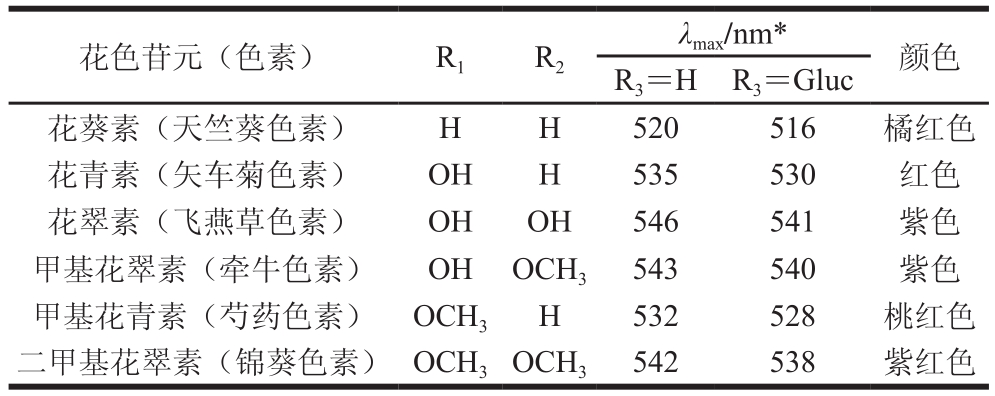
注:*.在体积分数0.01% HCl-甲醇溶液中。
花色苷元(色素) R1 R2 λmax/nm* 颜色R3=H R3=Gluc花葵素(天竺葵色素) H H 520 516 橘红色花青素(矢车菊色素) OH H 535 530 红色花翠素(飞燕草色素) OH OH 546 541 紫色甲基花翠素(牵牛色素) OH OCH3 543 540 紫色甲基花青素(芍药色素) OCH3 H 532 528 桃红色二甲基花翠素(锦葵色素) OCH3OCH3 542 538 紫红色
色素在食品工业中一直有着广泛的应用,但由于合成色素对人体健康存在威胁,因此天然色素越来越受到人们的重视。其中,花色苷作为一种天然可溶性色素,由植物的花瓣和果实中提取,可以满足食品工业的需求。但其色泽不稳定,在受到诸如温度、pH值、光照、金属离子、氧化还原剂等因素影响后,容易产生颜色的变化。且花色苷脂溶性低,不易透过磷脂双分子层生物膜,从而导致利用率不高[19-20];因此通过修饰改性的方式优化花色苷的结构,可以增加脂溶性,提高其稳定性,是促进花色苷发展和应用的关键。目前,部分学者对花色苷的结构修饰研究主要集中于母环结构的羟基化、甲氧基化、酰基化和酯基化。羟基化使花色苷活性更强,但会降低其稳定性。其中花色苷稳定性的降低与羟基化的位置有关,C3或C5位置可增强花色苷的稳定性;甲氧基化、酯基化和酰基化也能增强其稳定性。在溶液介质中,花色苷会随pH值的变化进行结构转变,从紫红色到无色。有研究表明两个以上酰基可使花色苷在较大pH值范围内呈现良好的色泽稳定性[21]。
经过酰基化后的花色苷结构如图2所示。Clydesdale等[22]报道苯乙稀酸残基可与花青素在结构上具有核平行堆积的效果,因此能够保护发色团,阻碍水的攻击。对萝卜色素进行二维核磁共振(nuclear magnetic resonance,NMR)分析发现,花色苷母环与酰基氧原子空间折叠成“三明治”结构[23]。当花色苷中存在酰基时,酰基可阻止花色苷遭受水的亲核攻击,使其不能转变为无色的查耳酮或蓝色的醌酮,因此能保持溶液原有的颜色。Dangles等[24]发现锦葵色素-3-槐糖苷-5-糖苷与咖啡酸酰基化后,稳定性增强,且具有量效关系。张晓圆等[25]也证实了花色苷酰基化使其结构更加稳定,颜色也更深。Odake等[26]发现紫薯色素比红甘蓝、紫苏等提取的色素在热加工和紫外线照射方面能更好地保持本身的颜色,原因是紫薯色素中大部分是酰基化的花色苷,稳定性与酰基化程度有关。以上研究表明花色苷酰基化后在对pH值、温度、光照及添加剂等的稳定性方面优于未酰基化的花色苷。目前酰基化的方法主要有化学酰基化、酶促酰基化和植物组织培养3 种。
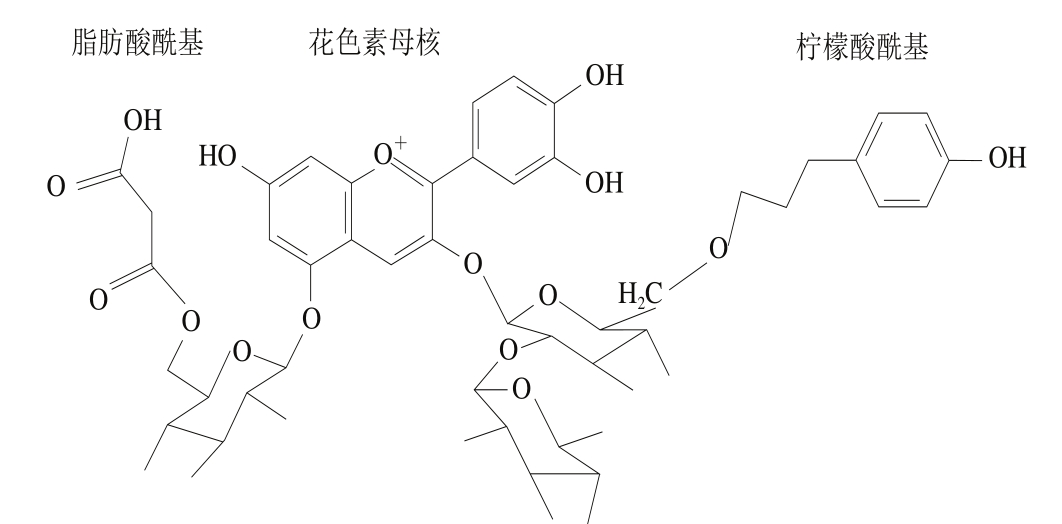
图2 酰基化花青素结构[27]
Fig. 2 Structure of acylated anthocyanins[27]
2.1.1 化学酰基化
化学修饰主要是基于有机合成,选择适当的酰化剂和催化剂是化学修饰研究的重点。李颖畅等[28]将花青素和乙酸进行酰基化反应,并釆用紫外和红外光谱对酰基化产物进行测定,结果表明,酰基化后的花青素稳定性明显提高。Giusti等[29]用月桂酸和丙二酸对花青素进行酰基化修饰,以温度、pH值和光照作为实验变量探索了酰基化修饰对花青素稳定性的影响,结果表明,酰基化后的花青素稳定性较高。陈学红等[30]将纯化后的紫甘蓝色素溶液与等浓度的阿魏酸、水杨酸混合,反应时间2 h,发现在510 nm波长处除了初始峰外,还产生了新的峰。推测紫甘蓝色素与阿魏酸或水杨酸反应后形成了新的花色苷酰化物。赵立仪等[31]用月桂酸酰氯酰基化蓝莓花青素后,其对抗光、热和强氧化剂的稳定性显著提高。传统化学酰基化方法在处理花色苷的过程中存在反应激烈、选择性低,且不能确定酰基化产物结构等一系列问题。而釆用月桂酸为酰化剂的方法反应温和、选择性高。以N,N-二甲基甲酰胺作为溶剂、1-羟基苯并三唑和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐反应生成缩合剂后,先生成月桂酸活化酯(月桂酸为酰化供体),对矢车菊素-3-O-葡萄糖苷酰基化修饰,得到月桂酸酰基化矢车菊素-3-O-葡萄糖苷的转化率为30.78%,是目前所报道文献中化学酰基化花色苷转化率最高的方法。结合傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)和液相色谱-质谱(liquid chromatograph-mass spectrometer,LC-MS)分析,确定酰基化产物相对分子质量为631,为单酰化合物,酰基化位点为糖苷键的伯醇羟基,研究表明酰基化后的矢车菊素-3-O-葡萄糖苷在温度、光照和氧化还原剂等条件下稳定性更好。且酰基化后矢车菊素-3-O-葡萄糖苷的油、水分配系数为7.98,明显高于酰基化前的0.24[32]。吴浩亮等[33]通过酰基化反应对十大功劳果花色苷进行分子修饰,发现酰基化后的花色苷的光热降解动力学符合一级动力学反应规律,酰基化修饰后对光、热的稳定性明显提高,尤其以丁二酸为酰化供体的酰基化效果极显著。
另外,也有学者发现高压处理能使果汁中的花色苷酰基化,Engmann[34]以桑葚果汁为实验对象,通过施加200 MPa的高压处理后,桑葚果汁内的花色苷发生了酰基化的现象,生成了天竺葵素-3-O-香豆酸酰葡萄糖苷和飞燕草素-3-O-香豆酸酰葡萄糖苷两种新的花色苷,含量分别为0.46%和5.8%;当施加的压力增大到400 MPa时,生成一种新的花色苷,飞燕草素-3-O-香豆酸酰葡萄糖苷含量为5.38%,可见高压也会使果汁中发生酰基化反应。
2.1.2 酶法酰基化
酰基化反应可以提升花色苷的稳定性,但由于酰基化的过程不具有良好的方向性和选择性,无法对特定位置的羟基进行酰基化反应,容易结合或者屏蔽一些花色苷的主要活性酚羟基,降低其氧化能力[35]。酶法酰基化因酶对底物有良好的专一性和选择性,且反应条件温和,可以针对花色苷中某些部位的羟基进行酰基化反应,因此酶法酰基化应用发展较快。目前,主要有植物体内原有的酰基转移酶和novozyme 435脂肪酶两类酶应用到花色苷酰基化反应中,有学者研究证明,这两种酶对酰基供体具有选择性[36]。其中,植物体内原有的酰基转移酶在对羟基进行酰基化反应的过程中需要使用激活的酰基供体,并且对可能产生的衍生物提供适宜的环境,如ATP、pH值等。而435脂肪酶是固定化的南极假丝酵母酶B,反应所需的酰基供体主要有脂肪酸、芳香酸及其相应的酯,可在非水环境的有机溶剂中进行。
赵立仪[27]采用435脂肪酶促酰基化矢车菊素-3-O-葡萄糖苷,发现通过生物酶法得到的酰化产物用MS检测未发现目标产物,而原料中却依然存在,即435脂肪酶促酰基化矢车菊素-3-O-葡萄糖苷的过程中不起催化作用,证明生物酶法不适用于矢车菊素-3-O-葡萄糖苷的酰基化反应。原因可能是矢车菊素-3-O-葡萄糖苷等花色苷的苯并吡喃环上含有一个氧正离子,氧正离子的极性很强,会破坏酶的结构;添加的435脂肪酶活性被破坏,不能发挥作用,无法用生物酶法酰基化矢车菊素-3-O-葡萄糖苷等极性很强的花色苷类物质。Castro等[37]采用软脂酸作为转化供体,435脂肪酶催化反应,LC-MS检测发现生成矢车菊素-3-葡萄糖单酯(m/z 687 [M-H]+)和飞燕草素-3-葡萄糖单酯(m/z 704 [M-H]+),但对转化率并未测定。
2.1.3 植物组织培养
细胞组织中的花色苷在合成酰基化的过程中,酰基化转移酶起着催化反应的重要作用。Luo Jie等[38]研究确定了3 种花色苷合成中的酰基化转移酶编码基因,在一定程度上扩大了该酶的应用范围。有学者发现在MS培养基中添加p-香豆酸后可使未酰基化的YGM-oa以及YGM-ob转化为单、双酰化产物,稳定性提高显著;同时,色素的总量也增加了两倍[39]。为合成花色苷,Dougalld等[40]向胡萝卜细胞培养液中加入苯乙烯酸和芳香酸,得到14 种新的单酰花色苷,利用氢质子磁共振波谱(1H magnetic resonance spectrocopy,1H MR)和MS分析发现,酰基化花色苷在pH 2.0和pH 6.0时,在接近中性环境下稳定性较好。Conn等[41]用花色苷液泡包含物培养液生产矢车菊素-葡萄糖苷和芍药素-葡萄糖苷,中等浓度和高浓度下得到酰基化花色苷与非酰基化花色苷的比例分别为6.2∶1和4.9∶1,并鉴定了酰基化花色苷的种类。Ji Hua等[42]用含有蔗糖、茉莉酸的葡萄细胞培养液对花色苷液泡包含物进行培养,得到了酰基化花色苷。另外,王振宇等[43]通过微生物降解提取法在提取大花葵花色苷的同时形成酰基化结构,通过结合花色苷的红外光谱、1H MR和MS,推断出了乙酸与大花葵花色苷结合形成酰基化的分子结构,但未对其进行具体命名。
目前,花色苷酰基化修饰的类型、来源及转化率见表2,可知除组织培养外(转化率为30.9%),其他花色苷酰基化的转化率较低,且大部分结构和命名不明确。
表2 花色苷酰基化修饰的类型、来源及转化率
Table 2 Types, sources and transformation efficiency of acylated anthocyanins

注:HPLC.高效液相色谱(high performance liquid chromatography);ESI.电喷雾电离(electrospray ionization);UV-Vis.紫外-可见光谱;IR.红外光谱(infrared spectroscopy)。a.含量;b.转化率。表4同。
酰基化新物质名称 处理方法 鉴定方法 原料 转化率/含量 参考文献天竺葵素-3-O-香豆酸酰葡萄糖苷和飞燕草素-3-O-香豆酸酰葡萄糖苷 200 MPa处理20 min HPLC-ESI-MS 桑葚果汁 0.46%、5.8%a [34]飞燕草素-3-O-香豆酸酰葡萄糖苷 400 MPa处理20 min HPLC-ESI-MS 桑葚果汁 5.38%a [34]蓝靛果花色苷对氢基苯甲酸酰化物对羟基苯甲酸、脂肪酶促反应 UV-Vis、IR 蓝靛果花色苷 未测定 [44]矢车菊素-3-葡萄糖苷月桂酸酰化物乙酸和月桂酸为供体的酶促反应 UV-Vis、IR 玫瑰花色苷 19.34%、25.22% [35]黑豆皮花色苷酰化物 酰化剂(乙酸、丙二酸和丁二酸) UV-Vis、IR 黑豆皮色素 未测定 [45]没食子酰化花青素 酰化剂(三乙酰没食子酰氯),酰化改性 UV-Vis、IR 蓝莓花青素 未测定 [46]锦葵花色苷乙酸酰化物 半乳糖与乙酸形成酰基 IR、NMR 大花葵花色苷 未测定 [43]矢车菊素-3-葡萄糖单酰、飞燕草素-3-葡萄糖单酰酰基供体(软脂酸) LC-MS 神木果花色苷 未测定 [37]矢车菊素-3-p-葡萄糖酰苷、芍药素-3-p-葡萄糖酰苷、锦葵素-3-p-葡萄糖酰苷葡萄细胞花色苷包含物悬浮液 HPLC矢车菊素-3-葡萄糖苷、芍药素-3-葡萄糖苷、锦葵素-3-葡萄糖苷30.9%b [40-41]月桂酸酰化矢车菊素-3-O-葡萄糖苷酰化供体(月桂酸) LC-MS 蓝莓花青素 30.78%b [32]
花色苷的酯化修饰不仅提高花色苷的稳定性,而且酯化率较酰化率高,花色苷酯化修饰的类型、来源及转化率见表3,可知酯化修饰的转化率要高于酰基化修饰,但转化后的具体结构未完全明确。朱宏明等[45]通过对黑豆皮花色苷酯化修饰,使酯化物对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的清除能力显著提高,分子修饰花色苷其体外抗氧化能力明显增强。分子修饰后的黑豆皮花色苷稳定性实验表明:K+、Ca2+、Mg2+、Zn2+、Cu2+等金属离子对抗氧化稳定性均有促进作用,其中K+、Zn2+最明显。对酯化后的黑豆皮花色苷研究发现,酯化修饰后可见光区最大吸收波长变大,发生红移,这是由于丁二酸酐连至花色苷后,分子间相互作用减弱,花色苷分子π-π电子对减少,导致吸光度降低。张媛媛等[47]通过对萝卜红色素进行乙酰水杨酸酯化修饰,结果表明,修饰后的色素在pH 3~5范围内保持鲜红色;修饰后的色素在100 ℃具有较强的稳定性;在室外自然光照射5 d后,损失率仅为21.69%。修饰后的色素提高了pH值、温度和光的稳定性,这可能与乙酰水杨酸和萝卜红色素形成的酯键有关。卢晓蕊等[48]用丁二酸酐对胡萝卜色素进行酯化修饰得到了酯化色素回收率及其光稳定性最好的条件。孙华铃[49]研究发现黑米色素酯化修饰后水溶解性变差,但易溶于极性低的有机溶剂,如丙酮、氯仿和乙酸乙酯。但黑米色素酯化产物的稳定性较原黑米色素显著提高。
表3 花色苷酯化修饰的类型、来源及转化率
Table 3 Types, sources and conversion rates of esterified anthocyanins
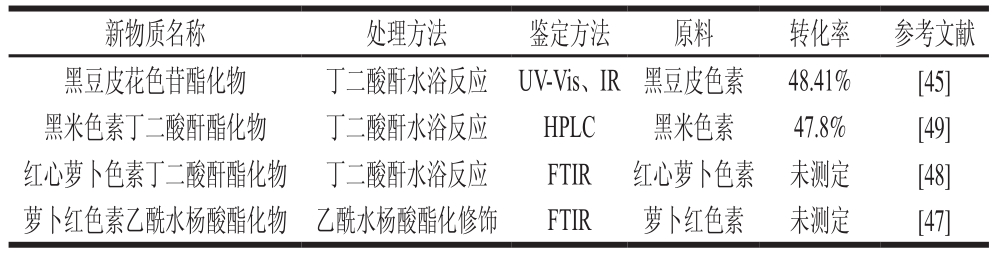
新物质名称 处理方法 鉴定方法 原料 转化率 参考文献黑豆皮花色苷酯化物 丁二酸酐水浴反应 UV-Vis、IR 黑豆皮色素 48.41% [45]黑米色素丁二酸酐酯化物 丁二酸酐水浴反应 HPLC 黑米色素 47.8% [49]红心萝卜色素丁二酸酐酯化物 丁二酸酐水浴反应 FTIR 红心萝卜色素 未测定 [48]萝卜红色素乙酰水杨酸酯化物 乙酰水杨酸酯化修饰 FTIR 萝卜红色素 未测定 [47]
吡喃花色苷是由花色苷在发酵和陈酿过程中形成的一系列天然花色苷衍生物,是目前学者研究较多的一种花色苷新型衍生物[50],其基本结构见图3。通过环加合反应在花色苷的C4位与C5位的羟基之间形成另外的第4个吡喃环D[51]。目前,许多吡喃花色苷类化合物在发酵果酒或果汁饮料中已经进行了分离和鉴定,主要有甲基吡喃花色苷、Vitisins型吡喃花色苷、酚基吡喃花色苷、Portisins型吡喃花色苷、黄烷醇-吡喃花色苷等。花色苷吡喃化修饰虽然反应时间较长,但转化率较高。吡喃花色苷与花色苷在许多理化性质上有所不同,与酸性偏红的花色苷相比,羧基吡喃花色苷、酚基吡喃花色苷等发生最大吸收波长部分蓝移[52],显橙红色,其中甲基吡喃花色苷吸收波长为487 nm,黄色偏移较大[53]。通过研究吡喃花色苷衍生物的结构特征可知,它们比原花色苷更稳定。在很多研究和文献中也已经证明了这点。He Jingren等[54]研究了酸性条件下黄烷醇-吡喃花色苷的稳定性,结果表明,pH值为3.6左右时黄烷醇-吡喃花色苷具有最大的吸收光谱,比pH 1.0时高30%~50%。在相同pH值、SO2浓度和贮藏时间下,黄烷醇-吡喃花色苷稳定性高于原花色苷,且对SO2具有很强的抗性,贮藏6 个月后,吡喃花色苷比原花色苷具有更强的稳定性。Bakker等[55]在实验中也发现了Vitisins型吡喃花色苷衍生物对强氧化剂SO2具备一定的抵抗能力,在这一点上要强于花色苷。将其所处环境变为中性和弱酸性后,相较于花色苷颜色更深。此外,Oliveira等[56]针对pH值和SO2等因素对Portisins型吡喃花色苷的影响进行了研究,与锦葵花色苷相比,其具有很强的抵抗水和酸性亚硫酸盐亲核攻击的能力,吡喃花色苷能抵抗水的亲核攻击,避免形成无色的半缩醛结构,因此在不同pH值溶液中具有更强的色泽稳定性。
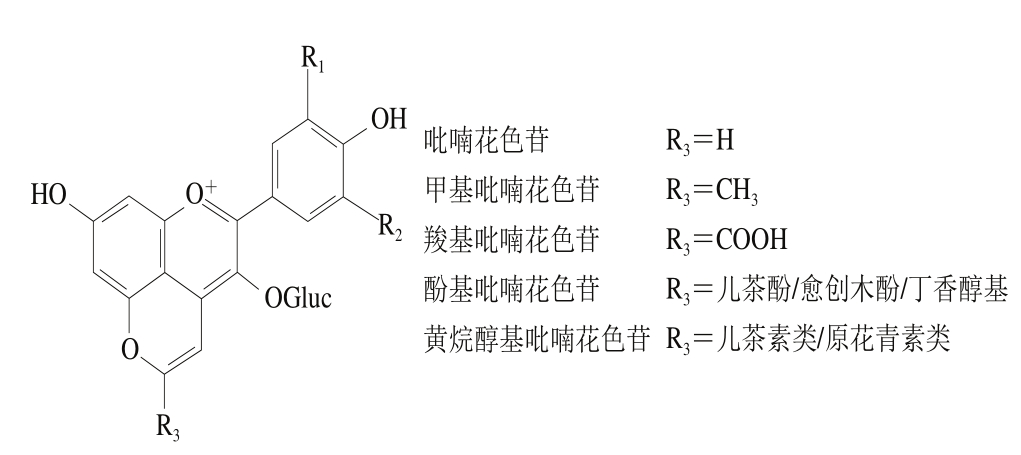
图3 不同类型吡喃花色苷[13]
Fig. 3 Different types of pyranoanthocyanins[13]
邝敏杰[18]对葡萄皮红色素进行了甲基吡喃花色苷的合成,经纯化后纯度达98.31%,在pH 3.0柠檬酸缓冲液中色价为219,最大吸收波长为487 nm,在pH值小于7.0范围内色泽变化较小,稳定性显著高于锦葵花色苷且抵御SO2漂白的能力很强。在乙醇和水溶液体系中甲基吡喃花色苷贮藏稳定性高于锦葵花色苷;在室温条件下其在乙醇和水溶液中半衰期分别为257 d和144 d,远长于锦葵花色苷(分别为131 d和71 d)。范龚健[57]认为有机酸的种类及其陈酿时间与紫玉米花色苷吡喃衍生物的形成有关。添加阿魏酸的花色苷组分降解明显,在50 d时检测到吡喃型花色苷,证明阿魏酸比咖啡酸(80 d)更易和花色苷反应形成吡喃型花色苷。
另外,有研究表明植物花色苷在高压下会有新的种类以及衍生物出现。Margarita等[58]研究了矢车菊素-3-O-葡萄糖苷和丙酮酸在高压和加热下的缩合反应,在600 MPa、70 ℃时持续30 min,矢车菊素-3-O-葡萄糖苷降解25%。与此同时,花色苷Vitisin A类衍生物生成,可能是由于缩合反应使花色苷的共价键和果汁中其他黄酮类物质通过环化加成反应形成新的吡喃环。然而缩合率仅有5%,其抗氧化活性也随之降低,原因可能是花色苷损失量大于合成量。这些反应使红酒的色泽从棕色变为橘色,色泽变亮。Santos等[59]在实验中发现当对红酒进行高压处理后,红酒内的总酚含量有了一定的增长,3~10 个聚合度的原花青素含量增加,这可能与酚类物质的缩合反应增加有关。但在9~12 个月的贮藏期中,单体酚含量降低,pH值升高,这可能是由于红酒花色苷主体成分锦葵素-3-葡萄糖苷含量降低,经缩合反应形成花色苷Vitisin A类衍生物所致,其形成机制见图4。花色苷结构修饰的类型、来源及转化率已在表2中给出,其中酰基化花色苷在人工反应中研究较多,但也普遍存在转化率低的情况。多数研究并未测定酰基化后的花色苷结构,对其理化特性研究较少。花色苷在酯化作用下的转化率相对较高,能达到50%左右,但其水溶解性较差,多数研究也未测定酯化后的花色苷结构。吡喃型花色苷多数在发酵的果酒中自然形成,其稳定性在醇溶液中较水溶液好,是陈酿果酒的主要呈色物质,但合成时间较长。

图4 Vitisins型吡喃花色苷的形成机制[13]
Fig. 4 Proposed formation mechanism of Vitisins-like pyranoanthocyanins[13]
常见花色苷吡喃化修饰的类型、来源及转化率如表4所示。
表4 花色苷吡喃化修饰的类型、来源及转化率
Table 4 Types, sources and conversion rates of pyranoanthocyanins

注:DAD.二极管阵列检测器(diode array detector)。
新物质名称 处理方法 鉴定方法 原料 转化率/含量参考文献Vitisin A类衍生物 600 MPa、70 ℃处理30 min HPLC-MS 矢车菊素-3-O-葡萄糖苷和丙酮酸,葡萄酒 5%b [58]3~10 个聚合度的原花青素,Vitisin A类衍生物500 MPa、在20 ℃和425 ℃处理5 min 红酒 未检测 [59]矢车菊素-3-葡萄糖苷-乙烯基愈创木酚、天竺葵素-3-葡萄糖苷-乙烯基愈创木酚和芍药素-3-葡萄糖苷-乙烯基愈创木酚紫玉米酒添加阿魏酸后陈酿HPLC-DAD、HPLC-MS 紫玉米酒 69.70%a[57]矢车菊素-3-葡萄糖苷-乙烯基儿茶酚、天竺葵素-3葡萄糖苷-乙烯基儿茶酚和芍药素-3-葡萄糖苷-乙烯基儿茶酚紫玉米酒添咖啡酸后陈酿HPLC-DAD、HPLC-MS 紫玉米酒 70.43%a[57]甲基吡喃锦葵花色苷 丙酮介质中反应 HPLC-DADEI-MS/MS 葡萄皮红色素提取物 49.4%b [18]
随着对花色苷结构修饰及稳定性研究的深入,关于其生理活性研究也随之受到了更多的关注。花色苷的酯化物和酰化物的结构不明确,且生理活性方面也研究较少,多数进行了简单的体外抗氧化研究(DPPH法等),对体内动物实验研究较少,因此在酯化物和酰化物的生理活性方面还有待进一步研究。
酰基化除了能够提高花色苷的稳定性,有些学者还对其生理活性进行了研究。张智等[44]对蓝靛果花色苷进行酰基化修饰,并研究了蓝靛果花色苷衍生物对DPPH自由基、·OH、O2-·、H2O2的清除能力,抗脂质过氧化能力,总抗氧化以及总还原能力,与VC对照相比,蓝靛果花色苷衍生物具有很强的体外抗氧化活性并且与浓度呈明显的量效关系。李路宁[46]研究发现,没食子酰化花青素在DPPH自由基、2,2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基、O2-·的清除实验中有较强的抗氧化性。且没食子酰化花青素抑制脂质过氧化的半抑制浓度为171.7 ng/mol,高于对照21.8%。没食子酰化花青素对Hep G2、Caco-2两种肿瘤细胞均有增殖抑制效果,但对于人肝癌Hep G2细胞的增殖抑制效果更好。李颖畅等[28]通过酰基化反应对蓝莓花色苷进行分子修饰,用紫外-可见光谱和红外光谱检测酰基化蓝莓花色苷,酰基化修饰后的蓝莓花色苷与未修饰前相比,清除·OH、O2-·的能力略有下降,原因可能是在酰基化过程中花色苷损失较多,且酰化率不高[60]。
张媛媛等[47]通过对萝卜红色素进行乙酰水杨酸酯化修饰,抗氧化活性实验表明,修饰后的色素仍保持了原有的抗氧化活性。将其与VC的ABTS阳离子自由基清除能力相比较,结果表明,萝卜红色素具有更强的的清除能力,且清除率与浓度呈正相关。当萝卜红色素和VC质量浓度皆为0.01 mg/mL时,萝卜红色素的清除率是98.49%,而VC的清除率仅为79.50%。原因可能是乙酰水杨酸的羧基与色素苯环上的羟基发生了酯化反应,使得苯环上羟基的数量有所减少,导致萝卜红色素清除自由基的能力下降。但随着质量浓度的增加,色素对羟自由基的清除率迅速增大,因此修饰后的色素保持了对羟自由基良好的清除能力。朱宏明等[45]通过分子修饰使黑豆皮花色苷的分子结构发生改变。黑豆皮花色苷酰化物和酯化物对DPPH自由基的清除能力分别达到97.3%和95.4%,且经分子修饰花色苷其体外抗氧化能力明显增强。
Goupy等[61]在酚基吡喃花色苷和Vitisin A类衍生物对DPPH自由基的清除能力及抑制亚铁血红素诱导亚油酸过氧化反应的研究中发现:Vitisin A类衍生物和由锦葵花色苷形成的酚基吡喃花色苷对DPPH自由基的清除能力都高于原锦葵花色苷。邝敏杰[18]在合成的甲基吡喃花色苷的抗氧化性研究中也有同样的发现。而Goupy等认为由矢车菊花色苷形成的酚基吡喃花色苷则有相反的表现,酚基吡喃花色苷较于原花色苷对亚油酸过氧化反应具有更强的抑制作用,而Vitisin A类衍生物没有更好的表现。但也有学者提出相反的观点,认为Vitisin A类衍生物除了对羟自由基不起作用外,采用铁离子还原能力(ferric reducing antioxidant power,FRAP)法、总抗氧化能力(trolox equivalent antioxidantcapacity,TEAC)法、氧自由基吸收能力(oxygenradical absorbance capacity,ORAC)法、电子自旋共振波谱法等对Vitisin A类衍生物的抗氧化活性测定结果表明其抗氧化能力很强[62-64]。另外,Garcia-Alonso等[65]采用酶联免疫吸附测定法证实Vitisin A类衍生物对肿瘤坏死因子有一定的抑制作用。对Portisins型吡喃花色苷采用DPPH法、FRAP法及对大豆脂质过氧化的抑制作用进行测定,发现其具有很强的DPPH自由基清除能力,且抗氧化能力强,甚至能还原铁离子,但不同花青素形成的Portisins型吡喃花色苷活性不同,如飞燕草花色苷形成Portisins型吡喃花色苷的抗氧化能力降低,而由锦葵花色苷形成的Portisins型吡喃花色苷的铁离子还原能力最强。有其他研究表明Portisins型吡喃花色苷具有很强的抗氧化能力[66-68]和抵抗人乳腺癌细胞增殖的能力[69]。邝敏杰[18]研究发现随着甲基吡喃花色苷浓度增加,甲基吡喃花色苷清除自由基能力和氧化还原能力也增强,对·OH的清除能力与VC相当,显著高于锦葵花色苷(P<0.05);而清除DPPH自由基能力和对氧化物的还原能力则较弱,但二者差异不显著(P>0.05);其对H2O2引起的衰老模型细胞损伤具有明显的保护作用;毒理学实验表明,甲基吡喃花色苷对雌性和雄性小鼠均无毒害作用。范龚健[57]在对紫玉米酒的咖啡酸和阿魏酸辅色的研究中发现,花色苷阿魏酸衍生物和咖啡酸衍生物总抗氧化能力分别为15.01 U/g和13.90 U/g,清除O2-·能力分别为80.65 U/g和87.56 U/g,两者和锦葵素-3-葡萄糖苷之间无显著性差异(P>0.05),表明花色苷辅色后其生理活性没有下降,达到预期目标;而两种有机酸衍生物DPPH自由基的清除率分别为66.95%和60.33%,活性大幅度提高,与原有花色苷相比有显著差异(P<0.05)。对阿魏酸衍生物和咖啡酸衍生物的还原力、清除DPPH自由基能力、抑制脂质过氧化能力和清除·OH能力进行比较,其中咖啡酸衍生物的清除能力和还原力都要强于阿魏酸衍生物,而阿魏酸衍生物的抗氧化力要强于咖啡酸衍生物。采用噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT)法检验两种有机酸衍生物对人胃癌细胞MGC-823和人肠癌细胞HCT-ll6的抑制肿瘤活性,结果表明,5 种花色苷组分对肿瘤细胞均有抑制作用,且其抗肿瘤活性与花色苷及其衍生物浓度呈线性关系。
不同花色苷结构修饰后功能活性的测定方法及实验对象如表5所示。
表5 不同花色苷结构修饰后功能活性的测定方法及实验对象
Table 5 Methods and test objects for functional activity assay of different anthocyanins of structural modifications

花色苷类型 方法 活性 实验对象 参考文献Vitisin A类衍生物DPPH法、FRAP法、TEAC法、ORAC法 抗氧化 Vitisin A类衍生物水溶液 [61-62]脂质抗氧化测定 抗氧化 亚油酸 [61-62]ELISA法 抗肿瘤 人内皮细胞 [65]酚基吡喃花色苷DPPH法 抗氧化 酚基吡喃花色苷水溶液 [61]脂质抗氧化测定 抗氧化 亚油酸 [61-62]DPPH法、FRAP法 抗氧化 紫玉米酒花色苷衍生物水溶液 [57]羟自由基法、DPPH法 抗氧化 紫玉米酒花色苷衍生物水溶液 [57]MTT法、免疫荧光测定 抗肿瘤 人胃癌细胞,人肠癌细胞 [57]Portisins型吡喃花色苷耗氧量测定法 抗氧化 大豆脂质 [67-68]电子顺磁共振光谱 Portisins型吡喃花色苷水溶液 [67-68]免疫荧光测定 抗乳腺癌 人乳腺癌细胞 [67]甲基吡喃锦葵花色苷 DPPH法、H2O2氧化法 抗氧化 甲基吡喃花色苷水溶液,衰老模型细胞 [18]蓝靛果花色苷对羟基苯甲酸酰化物 羟自由基法、DPPH法 抗氧化 蓝靛果花色苷对羟基苯甲酸酰化物水溶液 [44]黑豆皮花色苷酰化物 DPPH法 抗氧化 黑豆皮花色苷酰化物乙醇溶液 [45]萝卜红色素乙酰水杨酸酯化物 邻二氮菲法、ABTS法 抗氧化 萝卜红色素乙酰水杨酸酯化物水溶液 [47]没食子酰化花青素MTT法 抗肿瘤 Hep G2和Caco-2细胞 [46]DPPH、ABTS阳离子、羟基自由基清除,脂质体过氧化 抗氧化 没食子酰化花青素水溶液 [46]黑豆皮花色苷酯化物 DPPH法 抗氧化 黑豆皮花色苷酯化物乙醇溶液 [44]
目前,对花青素及花色苷的基础应用研究取得了很大进展,但其在实际食品中的应用依然存在花色苷稳定性差、色泽不牢、易受外界环境影响和加工分解等问题。由于脂溶性差、不易透过磷脂双分子层的细胞膜、难以到达靶向作用点等问题使得其生理价值大幅度降低,因此对花色苷结构进行分子修饰是当前的研究热点。在一般化学修饰方法中存在着定向性差的问题,而酶法修饰对花青素酰基化是否可行还有待研究。酰基化花色苷在人工反应中研究较多,其中酰基化后的花色苷稳定性高、抗氧化性强,能更好地保持溶液本身的颜色,但普遍存在转化率低的问题。多数研究并未测定酰基化后的花色苷结构,同时对于其理化特性研究也很少,但若能克服其转化率低的问题,将使其具有广阔的发展潜力。花色苷的酯化作用转化率相对较高,能达到50%左右,但其水溶性较差,多数研究也未测定酯化后的花色苷结构。吡喃型花色苷在发酵的果酒中自然形成,其稳定性在醇溶液中较水溶液好,而且是陈酿果酒的主要呈色物质,但人工合成时间较长。另外,花色苷的酯化物和酰化物的结构不明确,在生理活性方面研究较少。且研究中大都只进行了简单的体外抗氧化研究(DPPH法等),而对体内动物实验研究较少,获得的结构修饰物的急慢性毒性和其在体内吸收代谢途径等生理活性方面还有待进一步研究。如能解决以上问题,花色苷作为新型抗氧化剂和天然色素在医药和食品等领域会有更广阔的应用前景。
[1] KENT K, CHARLTON K E, NETZEL M, et al. Food-based anthocyanin intake and cognitive outcomes in human intervention trials: a systematic review[J]. Journal of Human Nutrition and Dietetics, 2017, 30(3): 260-274. DOI:10.1111/jhn.12431.
[2] 梁敏, 包怡红. 花色苷生物学功能的研究进展[J]. 天然产物研究与开发, 2017, 29(10): 1785-1790. DOI:10.16333/j.1001-6880.2017.10.025.
[3] 魏杰, 张国坤. 花色苷类物质化学成分及抗衰老机制研究进展[J].辽宁大学学报(自然科学版), 2016, 43(1): 68-73. DOI:10.16197/j.cnki.lnunse.2016.01.014.
[4] 王亚云. 紫色马铃薯花色苷提取工艺及其降血糖活性的研究[D].武汉: 武汉工程大学, 2016: 1-65.
[5] 许胜, 屈达才, 黄慧明, 等. 花色素及其花色苷单体抗肿瘤活性研究进展[J]. 食品工业科技, 2016, 37(14): 379-384. DOI:10.13386/j.issn1002-0306.2016.14.067.
[6] 许胜. 桑椹花色苷提取物抗氧化与抗肿瘤生物学活性研究[D]. 南宁: 广西大学, 2016: 1-68.
[7] THOMPSON K, PEDERICK W, SANTHAKUMAR A B.Anthocyanins in obesity-associated thrombogenesis: a review of the potential mechanism of action[J]. Food & Function, 2016, 7(5): 2169-2178. DOI:10.1039/c6fo00154h.
[8] THOMPSON K, PEDERICK W, SINGH I, et al. Anthocyanin supplementation in alleviating thrombogenesis in overweight and obese population: a randomized, double-blind, placebo-controlled study[J].Journal of Functional Foods, 2017, 32: 131-138. DOI:10.1016/j.jff.2017.02.031.
[9] STRATHEARN K E, YOUSET G G, GRACE M H, et al.Neuroprotective effects of anthocyanin-and proanthocyanidin-rich extracts in cellular models of Parkinson’s disease[J]. Brain Research,2014, 1555: 60-77. DOI:10.1016/j.brainres.2014.01.047.
[10] 郭红辉, 凌文华. 花色苷类植物化学物对心血管系统的保护作用[J].生命科学, 2015, 27(4): 495-503. DOI:10.13376/j.cbls/2015064.
[11] YOUSUF B, GUL K, WANI A A, et al. Health benefits of anthocyanins and their encapsulation for potential use in food systems:a review[J]. Critical Reviews in Food Science and Nutrition, 2016,56(13): 2223-2230. DOI:10.1080/10408398 2013.805316.
[12] HE B, GE J, YUE P X, et al. Loading of anthocyanins on chitosan nanoparticles influences anthocyanin degradation in gastrointestinal fluids and stability in a beverage[J]. Food Chemistry, 2017, 221: 1671-1677. DOI:10.1016/j.foodchem.2016.10.120.
[13] 何静仁, 邝敏杰, 邓莉, 等. 膳食花色苷衍生物家族的结构及其形成机制[J]. 中国农业科学, 2013, 46(2): 343-355. DOI:10.3864/j.issn.0578-1752.2013.02.014.
[14] 刘素稳. 蓝靛果花色苷提取物调节胆固醇代谢机理研究[D]. 沈阳:沈阳农业大学, 2017: 1-135.
[15] 张地林, 刘催萍, 吕静茹, 等. 植物花色苷的提取和鉴定研究[J]. 杭州师范大学学报(自然科学版), 2014, 13(4): 391-395. DOI:10.3969/j.issn.1674-232X.2014.04.012.
[16] LILA M A, BURTTONFREEMAN B, GRACE M, et al. Unraveling anthocyanin bioavailability for human health[J]. Annual Review of Food Science and Technology, 2016, 7(1): 375-393. DOI:10.1146/annurev-food-041715-033346.
[17] NOVOTNY J A, CLEVIDENCE B A, KURILICH A C. Anthocyanin kinetics are dependent on anthocyanin structure[J]. The British Journal of Nutrition, 2012, 107(4): 504-509. DOI:10.1017/S000711451100314X.
[18] 邝敏杰. 甲基吡喃花色苷的制备及功能性质研究[D]. 武汉: 武汉轻工业大学, 2014: 1-60.
[19] ESPADA-BELLIDO E, FERREIRO-GONZALEZ M, CARRERA C, et al. Optimization of the ultrasound-assisted extraction of anthocyanins and total phenolic compounds in mulberry (Morus nigra) pulp[J]. Food Chemistry, 2017, 219: 23-32. DOI:10.1016/j.foodchem.2016.09.122.
[20] NIE Q X, FENG L, HU J L, et al. Effect of fermentation and sterilization on anthocyanins in blueberry[J]. Journal of the Science of Food and Agriculture, 2017, 97(5): 1459-1466. DOI:10.1002/jsfa.7885.
[21] 彭非, 邓洁红, 于桐, 等. 花色苷酶促酰化反应研究进展[J]. 包装与食品机械, 2018, 36(1): 44-50. DOI:10.3969/j.issn.1005-1295.2018.01.010.
[22] CLYDESDALE F M, MAIN J H, FRANCIS F J. Roselle (Hibiscus sabdariffa L.) anthocyanins as colorants for beverages and gelatin desserts[J]. Journal of Food Protection, 1979, 42(3): 204-207.DOI:10.4315/0362-028X-42.3.204.
[23] ZHAO C L, YU Y Q, CHEN Z J, et al. Stability-increasing effects of anthocyanin glycosyl acylation[J]. Food Chemistry, 2017, 214:119-128. DOI:10.1016/j.foodchem.2016.07.073.
[24] DANGLES O, SAITO N, BROUILLARD R. Anthocyanin intramolecular copigment effect[J]. Phytochemistry, 1993, 34(1):119-124. DOI:10.1016/S0031-9422(00)90792-1.
[25] 张晓圆, 汪旭, 陈玥, 等. 黑豆红花色苷的分子修饰和稳定性研究[J]. 食品研究与开发, 2017, 38(11): 26-31. DOI:10.3969/j.issn.1005-6521.2017.11.007.
[26] ODAKE K, NORIHIKO T, SAITO N, et al. Chemical structures of two anthocyanins from purple sweet potato, Ipomoea batatas[J].Phytochemistry, 1992, 31(6): 2127-2130. DOI:10.1016/0031-9422(92)80378-R.
[27] 赵立仪. 矢车菊素-3-O-葡萄糖苷的月桂酸酰化、结构分析及性质评价[D]. 北京: 北京林业大学, 2015: 1-67.
[28] 李颖畅, 李冰心, 吕春茂, 等. 酰基化蓝莓花色苷的稳定性和对氧自由基的清除能力[J]. 食品工业科技, 2012, 33(6): 212-214; 257.DOI:10.13386/j.issn1002-0306.2012.06.065.
[29] GIUSTI M M, WROLSTAD R E. Acylated anthocyanins from edible sources and their applications in food systems[J]. Journal of Biochemistry Engineering, 2003, 14(3): 217-225. DOI:10.1016/S1369-703X(02)00221-8.
[30] 陈学红, 贺菊萍, 秦卫东, 等. 酰化处理提高天然色素的稳定化研究[J]. 食品科技, 2008, 33(3): 151-153. DOI:10.13684/j.cnki.spkj.2008.03.037.
[31] 赵立仪, 李路宁, 申芮萌, 等. 酰基化蓝莓花青素的稳定性研究[J].食品工业科技, 2014, 35(22): 299-303; 312. DOI:10.13386/j.issn1002-0306.2014.22.057.
[32] ZHAO L Y, CHEN J, WANG Z Q, et al. Direct acylation of cyanidin-3-glucoside with lauric acid in blueberry and its stability analysis[J].International Journal of Food Properties, 2016, 19(1): 1-12. DOI:10.1080/10942912.2015.1016577.
[33] 吴浩亮, 马清华, 蒋益花. 酰基化十大功劳果花色苷的光热降解动力学分析[J]. 浙江树人大学学报(自然科学版), 2014, 14(2): 40-44.
[34] ENGMANN F N. Study on the effects of high hydrostatic pressure,ultrasonication and heat on mulberry (Morus moraceae) juice quality characteristics[D]. 镇江: 江苏大学, 2013: 1-188.
[35] 赵垒. 平阴玫瑰花色苷纯化工艺优化、分子修饰及应用研究[D].济南: 山东师范大学, 2011: 1-99.
[36] STEVENSON D E, HUBL U. Optimization of β-D-glucuronide synthesis using UDP-glucuronyl transferase[J]. Enzyme and Microbial Technology, 1999, 24(7): 388-396. DOI:10.1016/S0141-0229(98)00137-9.
[37] CASTRO V C D, DESOBRY S, HUMEAU C, et al. Extraction,Identification and enzymatic synthesis of acylated derivatives of anthocyanins from jaboticaba (Myrciaria cauliflora) fruits[J].International Journal of Food Science and Technology, 2014, 49(1):196-204. DOI:10.1111/ ijfs.12298.
[38] LUO Jie, NISHIYAMA Y, FUELL C, et al. Convergent evolution in the BAHD family of acyl transferases: identification and characterization of anthocyanin acyl transferases from Arabidopsis thaliana[J]. The Plant Journal, 2007, 50(4): 678-695. DOI:10.1111/j.1365-313X.2007.03079.x.
[39] 闫征. 黑米花色苷的酶法酰基化及产物稳定性研究[D]. 南京: 南京农业大学, 2016: 1-105.
[40] DOUGALLD D K, BAKER D C, GAKH E G, et al. Anthocyanins from wild carrot suspension cultures acylated with supplied carboxylic acids[J]. Carbohydrate Research, 1998, 310(3): 177-189. DOI:10.1016/S0008-6215(98)00124-4.
[41] CONN S Z W, ZHANG W, FRANCO C. Anthocyanic vacuolar inclusions (AVIs) selectively bind acylated anthocyanins in Vitis vinifera L. (grapevine) suspension culture[J]. Biotechnology Letters,2003, 25(11): 835-839. DOI:10.1023/A:1024028603089.
[42] JI Hua, ZHANG Haixin, LI Hongtao, et al. Analysis on the nutrition composition and antioxidant activity of different types of sweet potato cultivars[J]. Food and Nutrition Sciences, 2015, 6(1): 161-167.DOI:10.4236/fns.2015.61017.
[43] 王振宇, 赵鑫. 微生物降解法提取大花葵花色苷及其分子修饰的研究[J]. 食品工业科技, 2005, 26(6): 62-65. DOI:10.13386/j.issn1002-0306.2005.06.011.
[44] 张智, 臧云, 王群. 酰基化蓝靛果花色苷的抗氧化性研究[J].现代食品科技, 2013, 29(3): 534-538; 486. DOI:10.13982/j.mfst.1673-9078.2013.03.043.
[45] 朱宏明, 蒋天龙, 高橙, 等. 黑豆皮花色苷的分子修饰及抗氧化性研究[J]. 浙江树人大学学报(自然科学版), 2015, 15(1): 24-28.
[46] 李路宁. 蓝莓花青素的没食子酰化及其活性研究[D]. 北京: 北京林业大学, 2014: 1-77.
[47] 张媛媛, 韦庆益, 袁尔东, 等. 萝卜红色素的酯化修饰及性质研究[J]. 食品工业科技, 2012. 33(10): 313-316. DOI:10.13386/j.issn1002-0306.2012.10.029.
[48] 卢晓蕊, 路金丽, 武彦文, 等. 红外光谱法研究花色苷色素的酯化修饰[J]. 光谱学与光谱分析, 2010, 30(1): 38-41. DOI:10.3964/j.issn.1000-0593(2010)01-0038-04.
[49] 孙华铃. 黑米色素酯化修饰及稳定性研究[D]. 天津: 天津科技大学,2010: 1-56.
[50] FREITAS A A, SILVA C P, SILVA G T M, et al. From vine to wine: photophysics of a pyranoflavylium analog of red wine pyranoanthocyanins[J]. Pure and Applied Chemistry, 2017, 89(12):1761-1767. DOI:10.1515/pac-2017-0411.
[51] QUAGLIERI C, JOURDES M, WAFFO-TEGUO P, et al. Updated knowledge about pyranoanthocyanins: impact of oxygen on their contents, and contribution in the winemaking process to overall wine color[J]. Trends in Food Science and Technology, 2017, 67: 139-149.DOI:10.1016/j.tifs.2017.07.005.
[52] 何英霞, 李霁昕, 米兰, 等. 响应面分析pH值、温度、SO2对干红葡萄酒中吡喃花色苷Vitisins的影响[J]. 食品与发酵工业, 2016, 42(8):115-120. DOI:10.13995/j.cnki.11-1802/ts.201608021.
[53] ZHU Z, WU N, KUANG M, et al. Preparation and toxicological evaluation of methyl pyranoanthocyanin[J]. Food and Chemical Toxicology, 2015, 83: 125-132. DOI:10.1016/j.fct.2015.05.004.
[54] HE Jingren, CARVALHO A R F, MATEUS N, et al. Spectral features and stability of oligomeric pyranoanthocyanin-flavanol pigments isolated from red wines[J]. Journal of Agricultural and Food Chemistry, 2010, 58(16): 9249-9258. DOI:10.1021/jf102085e.
[55] BAKKER J, TIMBERLAKE C F. Isolation, identification and characterization of new color-stable anthocyanins occurring in some red wines[J]. Journal of Agricultural and Food Chemistry, 1997, 45(1):35-43. DOI:10.1021/jf960252c.
[56] OLIVEIRA J, AZEVEDO J, SILVA A M S, et al. Pyranoanthocyanin dimers: a new family of turquoise blue anthocyanin-derived pigments found in port wine[J]. Journal of Agricultural and Food Chemistry,2010, 58(8): 5154-5159. DOI:10.1021/jf9044414.
[57] 范龚健. 紫玉米酒花色苷衍生物形成机理及其抗氧化与抗肿瘤活性研究[D]. 南京: 南京农业大学, 2009: 1-127.
[58] MARGARITA C, PETER B, BERNHARD T. Anthocyanin condensation reactions under high hydrostatic pressure[J].Food Chemistry, 2008, 110(3): 627-635. DOI:10.1016/j.foodchem.2008.02.055.
[59] SANTOS M C, NUNES C, CAPPELLE J, et al. Effect of high pressure treatments on the physicochemical properties of a sulphur dioxide-free red wine[J]. Food Chemistry, 2013, 141(3): 2558-2566. DOI:10.1016/j.foodchem.2013.05.022.
[60] SAGO T, NAOMI K, ISAO ODA, et al. Comparative assessment of anthocyanin content in blueberry fruit[J]. The Bulletin of National Institute of Technology, 2017, 50: 62-65. DOI:10.19025/bnitk.50.0_62.
[61] GOUPY P, BAUTISTA-ORTIN A B, FULCRAND H, et al.Antioxidant activity of wine pigments derived from anthocyanins:hydrogen transfer reactions to the DPPH radical and inhibition of the heme-induced peroxidation of linoleic acid[J]. Journal of Agricultural and Food Chemistry, 2009, 57(13): 5762-5770. DOI:10.1021/jf900841b.
[62] CASTELO-BRANCO V N, SANTANA I, DI-SARLI V O, et al.Antioxidant capacity is a surrogate measure of the quality and stability of vegetable oils[J]. European Journal of Lipid Science and Technology, 2016, 118(2): 224-235. DOI:10.1002/ejlt.201400299.
[63] 何静仁, 邝敏杰, 齐敏玉, 等. 吡喃花色苷类衍生物家族的研究进展[J]. 食品科学, 2015, 36(7): 228-234. DOI:10.7506/spkx1002-6630-201507042.
[64] CARVALHO A R F, OLIVEIRA J, FREITAS V D, et al. A theoretical interpretation of the color of two classes of pyranoanthocyanins[J].Journal of Molecular Structure, 2010, 948(1/2/3): 61-64. DOI:10.1016/j.theochem.2010.02.020.
[65] GARCIA-ALONSO M, RIMBACH G, SASAI M, et al. Electron spin resonance spectroscopy studies on the free radical scavenging activity of wine anthocyanins and pyranoanthocyanins[J]. Molecular Nutrition & Food Research, 2005, 49(12): 1112-1119. DOI:10.1002/mnfr.200500100.
[66] GABRIELSKA J, OSZMIASKI J. Antioxidant activity of anthocyanin glycoside derivatives evaluated by the inhibition of liposome oxidation[J]. Zeitschrift für Naturforschung C, 2015, 60(5/6): 399-407.DOI:10.1515/znc-2005-5-606.
[67] JOANA A, IVA F, ANA F, et al. Antioxidant properties of anthocyanidins, anthocyanidin-3-glucosides and respective portisins[J]. Food Chemistry, 2009, 119(2): 518-523. DOI:10.1016/j.foodchem.2009.06.050.
[68] PIRKER K F, OLIVEIRA J, DE FREITAS V, et al. Antiradical properties of red wine portisins[J]. Journal of Agricultural and Food Chemistry, 2011, 59(21): 11833-11837. DOI:10.1021/jf2033126.
[69] FERNADES I, FARIA A, AZEVEDO J, et al. Influence of anthocyanins, derivative pigments and other catechol and pyrogalloltype phenolics on breast cancer cell proliferation[J].Journal of Agricultural and Food Chemistry, 2010, 58(6): 3785-3792.DOI:10.1021/jf903714z.
Recent Progress in Structural Modification and Physiological Activity of Anthocyanins
由璐, 隋茜茜, 赵艳雪, 等. 花色苷分子结构修饰及其生理活性研究进展[J]. 食品科学, 2019, 40(11): 351-359.DOI:10.7506/spkx1002-6630-20180423-289. http://www.spkx.net.cn
YOU Lu, SUI Qianqian, ZHAO Yanxue, et al. Recent progress in structural modification and physiological activity of anthocyanins[J]. Food Science, 2019, 40(11): 351-359. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180423-289. http://www.spkx.net.cn