红茶菌也被称为康普茶、“海宝”,是一种味道酸甜可口的纯天然保健饮品[1],对于多种胃病具有一定保健作用,在亚洲已有2 000多年的食用历史。传统红茶菌制备方法为以茶糖水为基质,添加红茶菌菌液及菌膜经自然发酵而成。最新研究表明,红茶菌菌膜是一种液面生物膜,其中包含醋酸菌、酵母菌和少量的乳酸菌。红茶菌的功能特性主要取决于发酵液中含有的茶叶浸出物、活的微生物及其代谢产物。由于菌种的差异性和培养方法的不同,红茶菌的代谢途径复杂,所得到菌液中功能成分的种类、含量也有所不同,其功能特性主要归因于在发酵过程中产生的有机酸和酚类等抗氧化物质[2]。
黄浆水是豆腐生产过程中所产生的副产品,其中含有大量的低聚糖、大豆异黄酮及少量的蛋白质等营养物质[3]。随着豆制品在世界范围内产量的增加,黄浆水的排放所造成的资源浪费和环境污染备受关注。已有研究表明,经过益生菌发酵黄浆水的营养价值和功能活性有所提高,尤其是经过微生物发酵后,糖苷型的异黄酮转化为苷元型的异黄酮,其体外抗氧化能力有所提高,微生物发酵有可能为黄浆水的利用提供新的途径[4-6],实现黄浆水资源的利用,减少排污,为豆制品企业带来良好的经济效益。
黄浆水 南京市豆果果豆制品有限公司;红茶菌发酵母液由南京农业大学食品微生物研究室保存;红茶茶包、白砂糖 南京市苏果超市。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid),ABTS)、三吡啶基三嗪(tripyridyltriazine,TPTZ)、抗坏血酸 南京双领化玻有限公司;大豆异黄酮标准品(色谱级) 上海源叶生物科技有限公司;乙腈、三氟乙酸(色谱级) 南京大光明器化玻及供应部;其他试剂均为国产分析纯。
LDZX-40AI型立式电热压力灭菌锅 上海申安医疗器械厂;64RL高速冷冻离心机 美国Beckman公司;SYG-1220数显恒温水浴锅 美国Crystal有限公司;AUY-120分析天平、UV-2450紫外分光光度计 日本岛津公司;IS128 pH计 上海仪迈仪器科技有限公司;Synergy-2酶标仪 美国Biotek公司;UP-250-HE数控超声波清洗器 南京垒君达超声电子仪器设备有限公司;1100型高效液相色谱仪 美国安捷伦公司。
1.3.1 红茶菌发酵液的制备
将红茶以5 g/L添加到沸水中,煮沸5 min,加入质量分数10%白砂糖,充分溶解后过滤,待茶糖水冷却至室温后,按质量分数10%接入红茶菌发酵母液,28 ℃恒温静置培养8 d,发酵好的红茶菌用于后续黄浆水的发酵。
1.3.2 红茶菌发酵黄浆水的制备
黄浆水于108 ℃灭菌15 min后冷却至室温。参照谢惠青[7]、Vitas[8]等的方法,在无菌环境下,按质量分数10%接入红茶菌,28 ℃恒温静置培养8 d,每隔1 d无菌操作取样,样品经12 000 r/min离心10 min后放置于4 ℃冰箱,用于后续实验测定。
1.3.3 pH值和总酸浓度的测定
用pH计测定发酵过程中pH值的变化;用0.1 mol/L NaOH溶液滴定发酵黄浆水,总酸浓度的计算如式(1)所示。
式中:c2为发酵黄浆水总酸浓度/(mol/L);c1为NaOH溶液浓度/(mol/L);V1为NaOH滴定发酵液后的体积/mL;V2为NaOH滴定发酵液前的体积/mL;V3为待测发酵液体积/mL。
1.3.4 还原糖质量浓度的测定
参照Sengupta等[9]的方法,采用3,5-二硝基水杨酸比色法测定黄浆水发酵过程中还原糖质量浓度。
1.3.5 样品提取
参照Fei Yongtao等[10]的方法,采用体积分数80%甲醇溶液提取样品,其中一部分提取液经0.45 μm无菌微孔滤膜过滤后用于高效液相色谱测定大豆异黄酮质量浓度;另一部分提取液经旋转蒸发浓缩后冷冻干燥,并按实验需要用体积分数80%甲醇溶液复溶,稀释至不同质量浓度,用于体外抗氧化活性测定。
1.3.6 总酚和总黄酮质量浓度的测定
参照Chakravorty等[11]的方法,采用福林-酚比色法测定总酚质量浓度,以没食子酸质量计,根据标准曲线计算。总黄酮质量浓度的测定参照Jia Zhishen等[12]的方法,以芦丁质量计,根据标准曲线计算。
1.3.7 大豆异黄酮组分的测定
采用高相液相色谱法测定黄浆水中大豆异黄酮质量浓度。参考Xiao Yu等[4]的实验方法。实验条件为:色谱柱为C18柱(250 mm×4.6 mm,5 μm);流动相A为体积分数0.1%三氟乙酸水溶液,流动相B为乙腈;流速:0.7 mL/min;柱温:25 ℃;检测器:紫外检测器;检测波长:254 nm;进样量:20 μL。梯度洗脱条件为:0~10 min,体积分数90%~75%流动相A;10~12 min,体积分数75%~70%流动相A;12~25 min,体积分数70%~45%流动相A;25~30 min,体积分数45%~90%流动相A。
大豆异黄酮的种类通过将未知峰与标准品在完全相同条件下的保留时间进行对比而确定。通过大豆异黄酮标准品的标准曲线计算发酵黄浆水中各大豆异黄酮的质量浓度。
1.3.8 体外抗氧化能力测定
1.3.8.1 DPPH自由基清除能力测定
参照丁艳如等[13]的方法,配制不同质量浓度的样品及生育酚,向2 mL样品中加入2 mL DPPH溶液(0.5 mmol/L),振荡摇匀,在室温下避光反应30 min,于517 nm波长处测定吸光度。DPPH自由基清除率如式(2)所示计算。
式中:ADPPH为DPPH和甲醇溶液的吸光度;Asample为DPPH和样品溶液的吸光度;Ablank为样品和甲醇溶液的吸光度。
1.3.8.2 ABTS阳离子自由基清除能力测定
参考Xiao Yu等[4]的方法,配制7 mmol/L ABTS溶液和2.45 mmol/L过硫酸钾溶液,按体积比1∶2混匀后置于黑暗环境16 h。使用前用乙醇稀释ABTS溶液,使其在734 nm波长处的吸光度为0.70±0.02。配制不同质量浓度的样品和生育酚溶液0.3 mL,加入1.2 mL ABTS溶液,在室温下反应6 min,测定734 nm波长处的吸光度。ABTS阳离子自由基清除率如式(3)所示计算。
式中:Asample为ABTS和样品溶液的吸光度;Acontrol为ABTS和甲醇溶液的吸光度。
1.3.8.3 亚铁离子还原力测定
参照Xiao Yu等[14]方法,配制0.3 mol/L醋酸缓冲液(pH 3.6),用40 mmol/L HCl溶液配制浓度为10 mmol/L的TPTZ溶液和20 mmol/L FeCl3·6H2O溶液,按体积比10∶1∶1将上述溶液混匀制得亚铁离子还原力溶液。配制不同质量浓度的样品和生育酚溶液0.2 mL,加入1 mL亚铁离子还原力溶液,在37 ℃下放置20 min,测定593 nm波长处的吸光度。配制梯度FeSO4标准溶液(100~1 400 μmol/L),于593 nm波长处测定吸光度,绘制标准曲线:y=0.002 1x+0.202 5(R²=0.999),通过标准曲线计算亚铁离子浓度以表示亚铁离子还原力。
1.3.8.4 还原力测定
参照朱晓庆等[15]方法,将0.2 mL样品、1 mL 0.2 mol/L磷酸盐缓冲液(pH 6.6)和1 mL质量分数1%铁氰化钾溶液混匀,于50 ℃反应30 min。冷却后加入体积分数10%三氯乙酸溶液1 mL,混匀,3 000 r/min离心10 min。取1 mL上清液加入0.2 mL质量分数1%三氯化铁溶液,混匀,静置10 min。以蒸馏水为空白对照,于700 nm波长处测定吸光度。以样品溶液与空白对照吸光度的差表示还原力。
实验数据为3 次重复的平均值,结果均以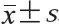 表示。采用SPSS 16.0软件进行统计分析,采用Duncan’s法进行多重比较,采用Origin Pro 8.0软件作图。半最大效应浓度(concentration for half of maximal effect,EC50)的计算采用SPSS 16.0软件拟合S曲线得到。
表示。采用SPSS 16.0软件进行统计分析,采用Duncan’s法进行多重比较,采用Origin Pro 8.0软件作图。半最大效应浓度(concentration for half of maximal effect,EC50)的计算采用SPSS 16.0软件拟合S曲线得到。

图1 黄浆水发酵过程中pH值和总酸浓度的变化
Fig. 1 Changes in pH and titratable acidity during soy whey fermentation
如图1所示,pH值下降伴随着总酸浓度的增加。8 d发酵期间出现两个明显的转折点。第1个转折点出现在第1天,pH值由为初始的4.89降至4.16,其后pH值稳定在4.15左右。第3天,pH值再次下降到3.28,此后pH值稳定在3.24~3.30之间。与此相反,总酸浓度持续增加至第6天,在第3~6天之间增加幅度最明显,从0.049 mol/L增加至0.121 mol/L,在第8天略下降至0.093 mol/L。pH值下降是由于发酵过程中产生的酸所致。有研究发现,红茶菌发酵过程中存在两个阶段,即乙醇发酵阶段和醋酸发酵阶段[16]。在发酵初期为乙醇发酵阶段,主要由酵母发挥重要作用,酵解果糖产生乙醇和二氧化碳;此后为醋酸发酵阶段,其间醋酸菌利用葡萄糖产生葡萄糖酸或葡萄糖醛酸等活性物质,并利用乙醇产生乙酸等多种有机酸,其中乙酸被公认为红茶菌发酵过程中产生的最主要的有机酸。Jayabalan等[17]证明红茶菌发酵液具有缓冲作用,因其产生的二氧化碳溶于水中产生HCO3-,与有机酸释放的H+反应,导致即使在醋酸发酵阶段产生大量有机酸时pH值仍然保持稳定。
如图2所示,第1天还原糖质量浓度略增加,第1~3天还原糖质量浓度从9.68 mg/mL急速下降至1.37 mg/mL,此后在1.24~1.83 mg/mL之间波动。结合2.1节pH值和总酸浓度在发酵过程中的变化情况,可推断前3 d为乙醇发酵阶段,其间酵母菌为主要生长代谢的菌种,消耗了大量还原糖,并将其转化为乙醇和二氧化碳,所产生的乙醇在发酵后期被醋酸菌迅速氧化为乙酸及其他有机酸,导致发酵液中H+浓度升高,在酸性环境中加速蔗糖水解产生葡萄糖和果糖;同时,醋酸菌消耗水解产生还原糖,进而使发酵体系中还原糖的产生和代谢维持平衡,表现为发酵第3天之后还原糖质量浓度保持稳定。

图2 黄浆水发酵过程中还原糖质量浓度的变化
Fig. 2 Changes in reducing sugar content during soy whey fermentation
表1 发酵前后黄浆水体积分数80%甲醇溶液提取物中总酚和总黄酮质量浓度
Table 1 Contents of total phenols and total flavonoids in 80% methanol extracts from unfermented and fermented soy whey
注:同行肩标小写字母不同表示存在显著性差异(P<0.05)。下同。
指标 发酵前 第2天 第4天 第6天 第8天总酚质量浓度/(mg/L) 387.50±5.10d 417.44±3.91c 432.98±3.47b 580.00±3.63a 584.80±4.63a总黄酮质量浓度/(mg/L) 111.61±2.94d 116.75±2.42d 147.19±1.96c 268.45±2.20a 264.44±1.10b
如表1所示,发酵黄浆水中总酚和总黄酮质量浓度都有显著提升。黄浆水提取物中总酚质量浓度从(387.50±5.10)mg/L提高至发酵第8天的(584.80±4.63)mg/L,总黄酮质量浓度由(111.61±2.94)mg/L持续增加至发酵第6天的(268.45±2.20)mg/L。结果表明,发酵后黄浆水中新生成了酚类、黄酮类物质。许多研究表明酚类物质(包括黄酮类物质)多与蛋白、脂肪等物质相结合,以复杂且不可溶的形式存在于植物中[18],在发酵过程中由于微生物分泌的各种酶或发酵环境酸碱度的变化等,结合酚被释放出来[19-20];另一方面,微生物的代谢活动也可以作用于某些生物活性物质,改变其性质,从而产生新的酚类和黄酮类化合物[21]。
表2 4 种大豆异黄酮标准品的线性方程
Table 2 Standard curves for various soybean isoflavonoids

大豆异黄酮 出峰时间/min 线性方程 R2黄豆黄苷 11.112 Y=110.67X-46.608 0.999染料木苷 12.778 Y=83.996X-15.782 0.994黄豆黄素 19.988 Y=122.64X-15.728 0.999染料木素 23.102 Y=178.01X-71.204 0.995
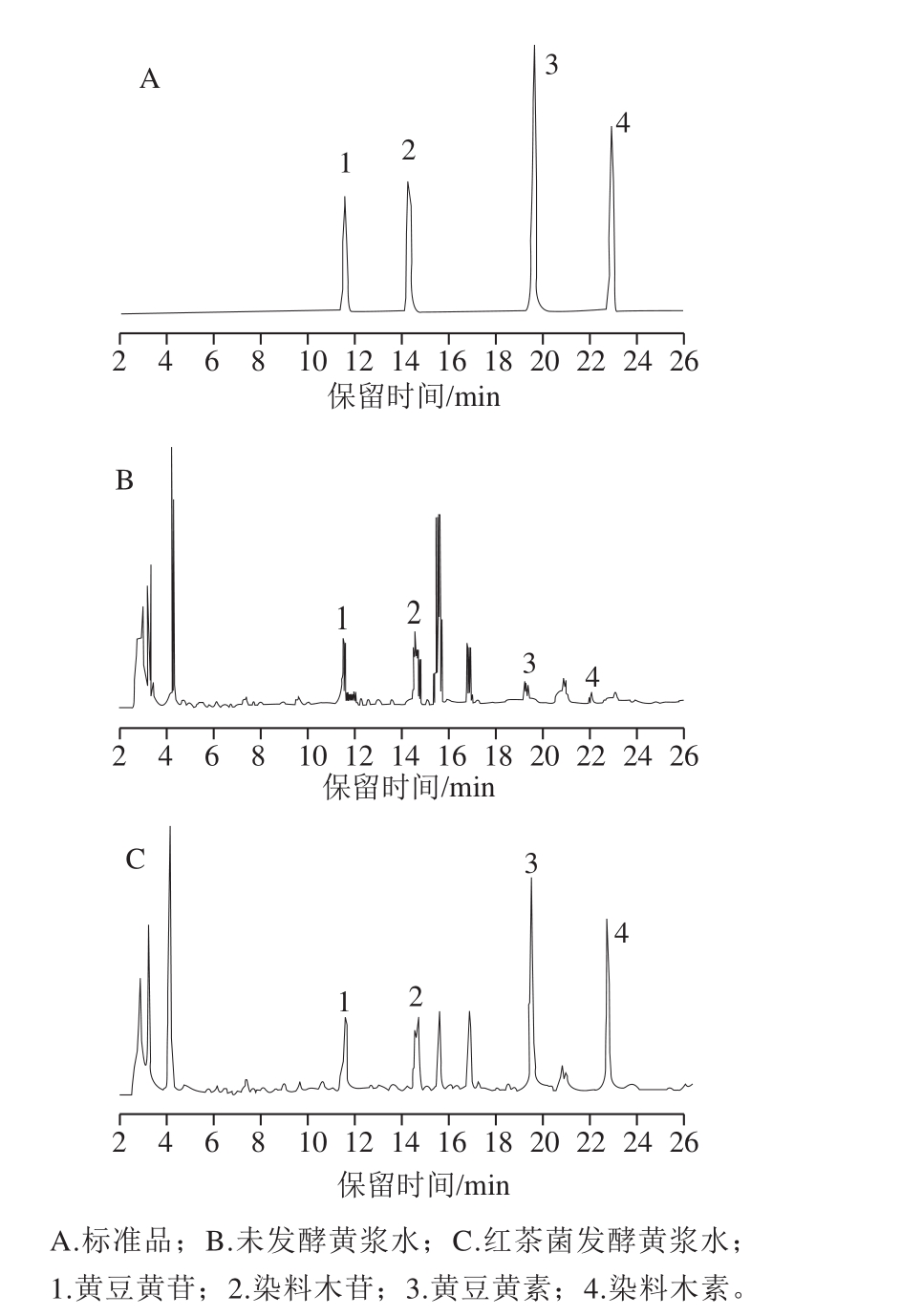
图3 大豆异黄酮的高效液相色谱图
Fig. 3 HPLC chromatogram of extracts rich in soybean isoflavonoids
如图3、表2所示,本实验测定了4 种主要的大豆异黄酮,其中黄豆黄苷和染料木苷属于结合型的糖苷,黄豆黄素和染料木素属于游离型的苷元。如表3所示,总体而言,在红茶菌发酵黄浆水过程中,糖苷型异黄酮总质量浓度逐渐降低,从(86.49±1.61)mg/L减少至(47.65±3.74)mg/L,苷元型异黄酮总质量浓度提高,从(28.17±2.96)mg/L增加至(150.11±2.50)mg/L,发酵至第6天时大豆异黄酮总质量浓度比接种第0天增加约86.05 mg/L。综合上述实验结果,发酵至第6天的黄浆水中大豆异黄酮质量浓度达到最大值,因此确定发酵终点为第6天。
表3 发酵前后黄浆水体积分数80%甲醇溶液提取物中大豆异黄酮的质量浓度
Table 3 Soybean isoflavonoids composition of 80% methanol extracts from unfermented and fermented soy whey

大豆异黄酮 质量浓度/(mg/L)发酵前 第2天 第4天 第6天 第8天黄豆黄苷 37.21±1.54a 31.94±1.68b 27.70±2.11bc 23.53±3.05cd 22.63±1.69d染料木苷 49.28±0.33a 35.74±2.68b 27.70±1.06c 26.22±2.40c 27.02±2.96c糖苷型异黄酮 86.49±1.61a 67.68±3.58b 55.39±1.12c 49.76±1.13d 47.65±3.74d黄豆黄素 9.69±1.32c 10.98±0.87c 31.24±0.86b 77.61±1.72a 77.37±0.62a染料木素 18.49±1.67d 30.51±2.29c 52.72±1.62b 73.34±1.46a 72.74±2.02a苷元型异黄酮 28.17±2.96d 41.49±2.89c 83.95±1.93b 150.95±0.79a 150.11±2.50a总量 114.66±4.42c 109.28±1.93c 139.35±2.82b 200.71±1.67a 197.77±3.37a
表3结果表明,苷元型的物质是由发酵前糖苷型的物质转化而来。已有很多研究表明,在微生物发酵后,大豆制品中苷元型物质的含量显著提高,这可能是由于微生物在发酵过程中产生的β-葡萄糖苷酶或是酸水解的作用,导致了苷元型物质含量的增加[22-24];另一方面,与蛋白、脂肪等物质相结合的黄酮类物质可能在发酵前无法被检测出,在发酵过程中逐渐被释放,转化成游离型的异黄酮,从而导致异黄酮总质量浓度增加[25]。由于游离型的苷元已被证实具有更高的生物活性,且更易被人体小肠吸收利用[26]。因此,黄浆水可作为红茶菌的一种新型发酵基质,从而为其赋予更高的营养价值。
如图4A所示,与未发酵黄浆水相比,发酵黄浆水对DPPH自由基的清除能力明显提高,在样品质量浓度为0.25~10 mg/mL时,未发酵黄浆水的DPPH自由基清除率从5.22%提高至58.25%,而发酵黄浆水则从15.19%提高至93.19%。结果表明,发酵过程对提高DPPH自由基清除能力起着重要作用。Marazza等[27]利用鼠李糖乳杆菌发酵豆浆,发现发酵豆浆内苷元型异黄酮质量浓度增加,导致DPPH自由基清除率也随之增加;苷元型异黄酮相较于其对应的β-葡萄糖苷型前体具有更高的抗氧化活性。因此,推测苷元型大豆异黄酮质量浓度的提高是DPPH自由基清除率提高的重要原因。
如图4B所示,未发酵黄浆水和发酵黄浆水的ABTS阳离子自由基清除能力在0.25~4 mg/mL之间明显提高。当质量浓度超过4 mg/mL时,两者对ABTS阳离子自由基的清除能力分别维持在55%和80%左右。Dani等[28]认为酚类化合物的抗氧化能力具有浓度饱和上限,这意味着当浓度超过饱和上限的时候,酚类化合物对ABTS阳离子自由基的清除能力不再增加。
如图4C所示,未发酵黄浆水和发酵黄浆水的亚铁离子还原力与样品质量浓度成正比。发酵黄浆水的亚铁离子浓度从7.70 μmol/L增加至681.03 μmol/L,而未发酵黄浆水仅从15.37 μmol/L增加至253.24 μmol/L,可以看出经过发酵的黄浆水明显增强了亚铁离子还原力。
从图4D可知,随着质量浓度的增加,未发酵黄浆水和发酵黄浆水的还原力均增强。4~10 mg/mL时,发酵黄浆水的还原力明显强于未发酵黄浆水。在6 mg/mL下,未发酵黄浆水的还原力为0.08,而发酵黄浆水为0.27,是未发酵黄浆水的3.4 倍。研究表明,发酵过程中微生物产生的一些还原酮物质可以向自由基提供电子而使其更加稳定,进而有利于终止自由基链式反应的进行[29],因此发酵后的黄浆水具有更强的还原力。

图4 发酵前后黄浆水体积分数80%甲醇溶液提取物体外抗氧化活性
Fig. 4 In vitro antioxidant activity of 80% methanol extracts from unfermented and fermented soy whey
事实上,红茶菌发酵体系复杂,发酵液抗氧化活性的提高取决于多种因素,在发酵过程中,存在多种次级代谢产物,包括葡萄糖酸和葡萄糖醛酸。已有研究证明这些物质具有钙离子和铁离子螯合剂的特性[30]。除此之外,发酵过程中的一些物理化学变化也会给黄浆水发酵产物的抗氧化活性带来一定的影响[31-32]。
黄浆水的抗氧化活性与其EC50成反比。发酵黄浆水的DPPH自由基清除力、ABTS阳离子自由基清除力和还原力的EC50分别为1.660、1.306、11.339 mg/mL,显著低于未发酵黄浆水(分别为9.108、4.584、821.722 mg/mL)(P<0.05)。上述结果表明,利用红茶菌发酵黄浆水可明显提高其抗氧化活性。
本研究以红茶菌为菌种、以黄浆水为基质进行发酵,得到具有功能活性的新型黄浆水发酵产品。本研究结果可支持一种改善营养价值和功能特性的红茶菌发酵饮品的开发。经发酵后的黄浆水营养和功能特性相比未发酵黄浆水明显提高。相比于未发酵黄浆水,发酵至第6天黄浆水中的游离型苷元质量浓度增加至(150.95±0.79)mg/L,是未发酵黄浆水的5.3 倍;黄豆黄素质量浓度从(9.69±1.32)mg/L增加至(77.61±1.72)mg/L;染料木素质量浓度从(18.49±1.67)mg/L增加至(73.34±1.46)mg/L。经红茶菌发酵后的黄浆水抗氧化活性明显提高。本研究结果表明,苷元型大豆异黄酮质量浓度的增加是发酵黄浆水抗氧化活性提高的重要原因。
[1] DUFRESNE C, FARNWORTH E. Tea, kombucha, and health:a review[J]. Food Research International, 2000, 33(6): 409-421.DOI:10.1016/S0963-9969(00)00067-3.
[2] 吴燕, 阮晖, 何国庆. 红茶菌的研究和应用进展[J]. 食品工业科技, 2012, 33(8): 436-438; 443. DOI:10.13386/j.issn1002-0306.2012.08.053.
[3] 李云捷, 周哲, 刘志, 等. 大豆黄浆水综合利用研究进展[J]. 科技与创新, 2016(5): 9-10. DOI:10.15913/j.cnki.kjycx.2016.05.009.
[4] XIAO Yu, WANG Lixia, RUI Xin, et al. Enhancement of the antioxidant capacity of soy whey by fermentation with Lactobacillus plantarum B1-6[J]. Journal of Functional Foods, 2015, 12: 33-44.DOI:10.1016/j.jff.2014.10.033.
[5] 王欣欣, 张莉, 蕾蕾, 等. 益生菌发酵黄浆水过程中大豆异黄酮的生物转化[J]. 大豆科学, 2014, 33(4): 583-588. DOI:10.11861/j.issn.1000-9841.2014.04.0583.
[6] 刘平, 李晓峰, 谭新敏. 利用大豆黄浆水发酵生产维生素B12的工艺探索[J]. 陕西科技大学学报, 2003, 21(4): 83-85. DOI:10.3969/j.issn.1000-5811.2003.04.022.
[7] 谢惠青, 赵力超, 杨翠琪, 等. 红茶菌发酵咖啡液制备低咖啡因饮料[J].食品科技, 2016, 41(11): 57-62; 67. DOI:10.13684/j.cnki.spkj.2016.11.016.
[8] VITAS J S, CVETANOVIC A D, MASKOVIC P Z, et al. Chemical composition and biological activity of novel types of kombucha beverages with yarrow[J]. Journal of Functional Foods, 2018, 44: 95-102. DOI:10.1016/j.jff.2018.02.019.
[9] SENGUPTA S, JANA M L, SENGUPTA D, et al. A note on the estimation of microbial glycosidase activities by dinitrosalicylic acid reagent[J]. Applied Microbiology and Biotechnology, 2000, 53(6):732-735. DOI:10.1007/s0025300003.
[10] FEI Yongtao, LIU Li, LIU Dongmei, et al. Investigation on the safety of Lactobacillus amylolyticus L6 and its fermentation properties of tofu whey[J]. LWT-Food Science and Technology, 2017, 84: 314-322.DOI:10.1016/j.lwt.2017.05.072.
[11] CHAKRAVORTY S, BHATTACHARYA S, CHATZINOTAS A, et al.Kombucha tea fermentation: microbial and biochemical dynamics[J].International Journal of Food Microbiology, 2016, 220: 63-72.DOI:10.1016/j.ijfoodmicro.2015.12.015.
[12] JIA Zhishen, TANG Mengcheng, WU Jianming. The determination of flavonoid contents in mulberry and their scavenging effects on superoxide radicals[J]. Food Chemistry, 1999, 64(4): 555-559.DOI:10.1016/S0308-8146(98)00102-2.
[13] 丁艳如, 陈爽, 朱忠顺, 等. 红茶菌的发酵条件及抗氧化活性[J]. 食品科技, 2016, 41(3): 21-26. DOI:10.13684/j.cnki.spkj.2016.03.005.
[14] XIAO Yu, XING Guangliang, RUI Xin, et al. Enhancement of the antioxidant capacity of chickpeas by solid state fermentation with Cordycepsmilitaris SN-18[J]. Journal of Functional Foods, 2014, 10:210-222. DOI:10.1016/j.jff.2014.06.008.
[15] 朱晓庆, 陈义伦, 张亚伟, 等. 红茶菌发酵过程中抗氧化能力的变化规律[J]. 食品与发酵工业, 2010(11): 111-114. DOI:10.13995/j.cnki.11-1802/ts.2010.11.029.
[16] LI S, LI P, FENG F, et al. Microbial diversity and their roles in the vinegar fermentation process[J]. Applied Microbiology &Biotechnology, 2015, 99(12): 4997-5024. DOI:10.1007/s00253-015-6659-1.
[17] JAYABALAN R, SUBATHRADEVI P, MARIMUTHU S, et al.Changes in free-radical scavenging ability of kombucha tea during fermentation[J]. Food Chemistry, 2008, 109(1): 227-234.DOI:10.1016/j.foodchem.2007.12.037.
[18] BHANJA T, KUMARI A, BANERJEE R. Enrichment of phenolics and free radical scavenging property of wheat koji prepared with two fi lamentous fungi[J]. Bioresource Technology, 2009, 100(11): 2861-2866. DOI:10.1016/j.biortech.2008.12.055.
[19] CHENG K C, WU J Y, LIN J T, et al. Enhancements of isoflavone aglycones, total phenolic content, and antioxidant activity of black soybean by solid-state fermentation with Rhizopus spp.[J].European Food Research and Technology, 2013, 236(6): 1107-1113.DOI:10.1007/s00217-013-1936-7.
[20] SUN T Y, LI J S, CHEN C. Effects of blending wheatgrass juice on enhancing phenolic compounds and antioxidant activities of traditional kombucha beverage[J]. Journal of Food and Drug Analysis, 2015,23(4): 709-718. DOI:10.1016/j.jfda.2015.01.009.
[21] SUN J H, LEE S Y, KIM Y C, et al. Effect of fermentation on the antioxidant activity in plant-based foods[J]. Food Chemistry, 2014,160(10): 346-356. DOI:10.1016/j.foodchem.2014.03.112.
[22] GIOIA D D, STRAHSBURGER E, LACEY A M L D, et al. Flavonoid bioconversion in Bifidobacterium pseudocatenulatum, B7003: a potential probiotic strain for functional food development[J]. Journal of Functional Foods, 2014, 7(1): 671-679. DOI:10.1016/j.jff.2013.12.018.
[23] CHUA J Y, LU Y, LIU S Q. Biotransformation of soy whey into soy alcoholic beverage by four commercial strains of Saccharomyces cerevisiae[J]. International Journal of Food Microbiology, 2017, 262:14-22. DOI:10.1016/j.ijfoodmicro.2017.09.007.
[24] 杨守凤, 徐建雄. β-葡萄糖苷酶转化大豆异黄酮及其保健功能的研究进展[J]. 饲料研究, 2014(1): 6-12. DOI:10.13557/j.cnki.issn1002-2813.2014.01.003.
[25] MCCUE P, HORII A, SHETTY K. Solid-state bioconversion of phenolic antioxidants from defatted soybean powders by Rhizopus oligosporus: role of carbohydrate-cleaving enzymes[J]. Journal of Food Biochemistry, 2003, 27(6): 501-514. DOI:10.1111/j.1745-4514.2003.tb00597.x.
[26] KWAK C S, LEE M S, SANG C P. Higher antioxidant properties of Chungkookjang, a fermented soybean paste, may be due to increased aglycone and malonylglycoside isoflavone during fermentation[J].Nutrition Research, 2007, 27(11): 719-727. DOI:10.1016/j.nutres.2007.09.004.
[27] MARAZZA J A, NAZARENO M A, DE GIORI G S, et al.Enhancement of the antioxidant capacity of soymilk by fermentation with Lactobacillus rhamnosus[J]. Journal of Functional Foods, 2012,4(3): 594-601. DOI:10.1016/j.jff.2012.03.005.
[28] DANI C, OLIBONI L S, VANDERLINDE R, et al. Antioxidant activity and phenolic and mineral content of rose grape juice[J].Journal of Medicinal Food, 2009, 12(1): 188-192. DOI:10.1089/jmf.2008.0090.
[29] YANG J H, MAU J L, KO P T, et al. Antioxidant properties of fermented soybean broth[J]. Food Chemistry, 2000, 71(2): 249-254.DOI:10.1016/S0308-8146(00)00165-5.
[30] MATEOS-APARICIO I, MATEOS-PEINADO C, JIMÉNEZ-ESCRIG A,et al. Multifunctional antioxidant activity of polysaccharide fractions from the soybean byproduct okara[J]. Carbohydrate Polymers, 2010,82(2): 245-250. DOI:10.1016/j.carbpol.2010.04.020.
[31] VÁZQUEZ-CABRAL B D, LARROSA-PÉREZ M, GALLEGOSINFANTE J A, et al. Oak kombucha protects against oxidative stress and in fl ammatory processes[J]. Chemico-Biological Interactions, 2017,272: 1-9. DOI:10.1016/j.cbi.2017.05.001.
[32] VADIVEL V, STUETZ W, SCHERBAUM V, et al. Total free phenolic content and health relevant functionality of Indian wild legume grains: effect of indigenous processing methods[J]. Journal of Food Composition and Analysis, 2011, 24(7): 935-943. DOI:10.1016/j.jfca.2011.04.001.
Antioxidant Activity of Fermented Soy Whey with Kombucha Consortium
TANG Sijie, TU Chuanhai, HU Wenxiu, et al. Antioxidant activity of fermented soy whey with kombucha consortium[J].Food Science, 2019, 40(17): 1-6. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180705-080.http://www.spkx.net.cn