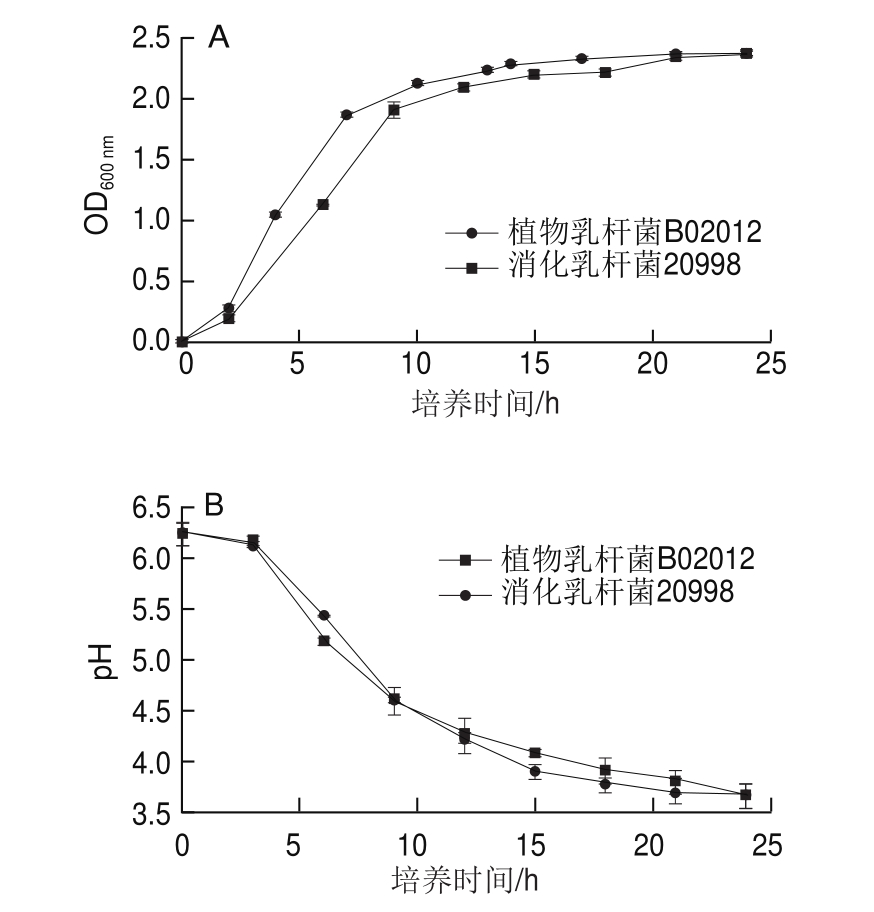
图1 植物乳杆菌B02012和消化乳杆菌20998的生长曲线(A)和pH值变化曲线(B)
Fig. 1 Growth curves (A) and pH curves (B) of Lactobacillus plantarum B02012 and Lactobacillus alimentarius 20998
乳酸菌是食品工业中应用广泛的一类益生菌。在老酵头和酸面团等传统发酵剂中,包含20余种酵母菌、50余种乳酸菌,主要以植物乳杆菌(Lactobacillus plantarum)、短乳杆菌(Lactobacillus brevis)、发酵乳杆菌(Lactobacillus fermentum)等为优势菌种[1-4]。乳酸菌主要作用于糖类和蛋白质降解,产生乳酸等有机酸以及小肽和游离氨基酸[5-6]。它在酸面团发酵过程中对提高面团风味、营养价值、抗菌性及改善面团流变学特性至关重要。此外,乳酸菌发酵可以减少乳糜泻人群对小麦面制品的致敏性[7-8]。乳糜泻是基因易感人群因摄入来自小麦、大麦、黑麦和衍生食品中的麸质而诱发T细胞介导的慢性肠炎疾病[9]。麦醇溶蛋白是乳糜泻免疫反应的主要抗原蛋白[10],富含大量谷氨酸(Glu)和天冬氨酸(Asp),难以被人体完全消化吸收。目前,加入乳酸菌长时(>24 h)发酵酸面团降敏策略得到业界的认同,可对面团整体发挥降敏作用,被认为是一种安全无害、便捷有效的降敏方法,已应用于无麸质食品研制中并备受关注[11-13]。
不同种类的乳酸菌在面团发酵期间产生一系列特殊的蛋白水解酶,例如氨肽酶、羧肽酶和内肽酶等可以水解富含脯氨酸等肽段,消除致敏性表位,降低小麦面制品对乳糜泻人群的致敏性[14]。植物乳杆菌是酸面团中最具竞争力的菌种[15],Rollán[16]、Gerez[17]等从自然酸面团中分离的植物乳杆菌CRL759和CRL778能够水解α-醇溶蛋白中的致乳糜泻肽段p31~43和p62~75;旧金山乳杆菌(Lactobacillus sanfranciscensis)7A、LS3、LS10、LS19、LS23、LS38、LS47、短乳杆菌14G、消化乳杆菌(Lactobacillus alimentarius)15M和希氏乳杆菌(Lactobacillus hilgardii)51B等多种乳杆菌先后被报道用于长时发酵制备酸面团,降低了小麦蛋白致敏性和炎症因子表达[18-19]。
本研究以与麦醇溶蛋白降敏程度显著相关的产酸速率、酸化性能和蛋白质水解度为依据,筛选出具有相似表现的两株乳酸菌——植物乳杆菌B02012和消化乳杆菌20998制备长时发酵面团,其中植物乳杆菌B02012由本实验室前期紫外诱变获得,具有高产酸和耐消化的特点,可作为一种乳酸菌制剂广泛应用于微生态制剂中。同时,以可食性有机酸脱酰胺降敏小麦蛋白制备的发酵面团(化学酸化面团)和传统酵母菌长时发酵面团为对照,探究两株乳杆菌长时发酵对酸面团麦醇溶蛋白二、三级分子结构和免疫特性的影响及其相关性,以期初步筛选出可应用于开发低敏面食品的优势乳酸菌。本研究可为揭示乳酸菌发酵面团降敏机理提供一定理论依据,对于初步构建低敏长时发酵酸面团工业化生产体系有着重要的实际意义。
植物乳杆菌B02012由实验室自主诱变筛选后贮藏;消化乳杆菌20998 中国工业微生物菌种保藏管理中心;酵母菌 安琪酵母股份有限公司;周麦28 河南周园种业有限公司。
一抗Wheat Gliadin 武汉华美生物工程有限公司;二抗免疫球蛋白G(immunoglobulin G,IgG)-辣根过氧化物酶(horseradish peroxidase,HRP)、BCA试剂盒上海贝博生物公司;MRS肉汤培养基 广东环凯微生物科技有限公司;其他试剂均为分析纯 国药集团化学试剂有限公司。
FD5-3真空冷冻干燥机 美国西蒙国际公司;Nikon-E100显微镜 日本Nikon公司;PHS-3C pH计上海仪电科学仪器股份有限公司;DYCZ-24DN电泳仪北京六一仪器厂;JS-680B全自动凝胶成像分析仪 上海培清科技有限公司;8210E傅里叶变换红外光谱(Fourier transform infrared Spectroscopy,FTIR)仪美国尼高力仪器公司;FluoroMax-4荧光分光光度计法国HORIBA Jobin Yvon公司;MULTIAKAMK3酶标仪芬兰雷勃集团。
1.3.1 乳酸菌生长曲线和pH值变化曲线的测定
取植物乳杆菌B02012和消化乳杆菌20998扩大培养的菌液,按照体积比1∶100的接种量接种于3 瓶MRS液体培养基中,37 ℃下振荡培养,并分别于培养0、3、6、9、12、15、18、21、24 h取菌液5 mL,在600 nm波长处测定各菌液光密度值(OD600 nm)。以各时间点菌液OD600 nm为纵坐标,培养时间为横坐标,绘制乳酸菌生长曲线。同样条件下,采用pH计测定pH值,以各时间点菌液的pH值为纵坐标,培养时间为横坐标,绘制乳酸菌生长期间pH值变化曲线。
1.3.2 乳酸菌活化及酸面团制备
乳酸菌的活化:参照王金水等[20]的方法并适当修改。无菌条件下分别取植物乳杆菌B02012、消化乳杆菌20998菌液,接入MRS液体培养基,于37 ℃、pH 6.8条件下培养24 h使乳酸菌活化。当用于面团发酵时,将活化的乳酸菌于37 ℃、pH 6.8条件下培养约14 h,再以体积分数为2%的接种量转接到75 mL MRS液体培养基中,于37 ℃培养20 h,直至后期指数生长到成熟阶段(约OD600 nm=2.3),菌体密度达到109 CFU/mL。
酸面团的制备:取6 g小麦面粉、6 mL蒸馏水、1.1%的酵母菌(以小麦面粉质量计,后同)和/或8 mL乳酸菌悬浮液(菌体密度109 CFU/mL),按以下方案混合得20 g面团,于37 ℃、200 r/min条件下发酵24 h后,冷冻干燥备用。各菌种发酵面团具体为:1)CK组:面团中不添加接种菌,添加0.05 mg/g红霉素;2)SY组:面团中只添加1.1%(质量分数,下同)的酵母菌;3)SCA组:面团中不添加接种菌,采用乳酸和乙酸(物质的量比为4∶1)的混合物化学酸化至pH 3.9;4)SLB02012组:面团中只添加植物乳杆菌B02012悬浮液;5)SYLB02012组:面团中添加1.1%的酵母菌和植物乳杆菌B02012悬浮液;6)SL20998组:面团中只添加消化乳杆菌20998悬浮液;7)SYL20998组:面团中添加1.1%的酵母菌和消化乳杆菌20998悬浮液。将上述各组发酵0 h和24 h的面团冷冻干燥,磨粉备用。
1.3.3 发酵过程中面团pH值的测定
按照上述方法制备酸面团,各组面团分别于发酵0、3、6、9、12、15、18、21、24 h取样1 g,均匀分散于3 mL水中,采用pH计测定发酵面团的pH值。
1.3.4 麦醇溶蛋白的提取
将面团等分试样(每份12.75 g)用30 mL 50 mmol/L的Tris-HCl(pH 8.8)溶液稀释,4 ℃条件下每15 min漩涡混合1 次,每次持续1 h,20 000×g下离心20 min。蒸馏水洗涤去除缓冲液离子,沉淀物悬浮于30 mL体积分数75%的乙醇溶液中,25 ℃下搅拌2 h,按上述条件进行离心。所得上清液即为麦醇溶蛋白,冷冻干燥保存。发酵面团中提取的麦醇溶蛋白简写为CK、SY、SCA、SLB02012、SYLB02012、SL20998、SYL20998(同1.3.2节)。
1.3.5 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳
根据Laemmli[21]的方法进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE),并略作改动。配制质量分数10%的分离胶和质量分数5%的浓缩胶。取发酵0 h和24 h的冷冻干燥面团粉末于2 mL离心管中,加入pH 6.8、0.0625 mol/L Tris-HCl溶液,用体积分数5% β-巯基乙醇、质量分数2% SDS、体积分数10%丙三醇和体积分数0.002%溴酚蓝组成的缓冲液配制2 mg/mL蛋白溶液,煮沸5 min。取10 μL上清液进样,电泳结束后凝胶染色及脱色,于凝胶成像系统拍照观察。
1.3.6 傅里叶变换红外光谱测定
参照Wang Yu等[22]的方法进行FTIR测定。将各麦醇溶蛋白样品和溴化钾以质量比1∶100进行研磨,压成1~2 cm薄片。全波长扫描(4 000~400 cm-1),每个光谱的扫描次数为64 次,分辨率为4 cm-1。用Omnic和PeakFit v4.12软件计算酰胺I带(1 700~1 600 cm-1)峰面积比例,分析蛋白质二级结构含量。
1.3.7 内源性荧光光谱测定
参照Wang Kaiqiang等[23]的方法进行内源性荧光光谱(intrinsic fluorescence scanning,IFS)测定。采用0.01 mol/L、pH 4.4的磷酸盐缓冲液配制得到30 mL 0.2 mg/mL麦醇溶蛋白样品溶液。于280 nm波长处激发,发射波长在300~400 nm范围内记录光谱,发射和激发狭缝宽度均为5 nm。
1.3.8 酶联免疫吸附测定分析
参照宋宏新[24]、Dupont-Deshorgue等[25]的方法进行酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA),并略作修改。1)抗原包被:将麦醇溶蛋白样品用碳酸盐缓冲液(0.015 mol/L碳酸钠和0.027 mol/L碳酸氢钠)稀释至10 μg/mL。各取100 μL/孔加入96 孔酶标板中,4 ℃过夜;2)洗涤:次日倾去酶标板96 孔板内的包被液,用磷酸盐-吐温缓冲液(phosphate buffered saline-Tween-20,PBST)洗板3 次;3)封闭:加入3%~55%的脱脂牛乳封闭液封阻,200 μL/孔,37 ℃封闭1 h,洗板;4)一抗孵育:根据前期探索的最佳稀释度,采用1%牛血清白蛋白(bovine serum albumin,BSA)+PBST按体积比1∶1 000稀释一抗,将稀释后的一抗以100 μL/孔加入96 孔酶标板中,37 ℃孵育1 h;5)采用1% BSA+PBST按体积比1∶2 500稀释二抗,将稀释后的二抗以100 μL/孔加入96孔酶标板中,37 ℃孵育1 h;6)四甲基联苯胺(tetramethylbenzidine,TMB)显色:弃酶标二抗,将TMB底物A、B等体积混合均匀,100 μL/孔,37 ℃恒温箱中避光反应15 min;7)终止显色:加入1 mol/L HCl终止液,100 μL/孔,终止显色反应,用酶联免疫检测仪在450 nm波长处测定各孔的吸光度。
所有实验数据均为3 次平行实验计算所得平均值。结果应用SPSS软件中最小显著性差异多维分析法进行方差和显著性分析(P<0.05)。使用数据软件XL-Stat(2016)进行聚类分析,以对麦醇溶蛋白二、三级分子结构和免疫特性数据归类,进行统计学相关性分析。

图1 植物乳杆菌B02012和消化乳杆菌20998的生长曲线(A)和pH值变化曲线(B)
Fig. 1 Growth curves (A) and pH curves (B) of Lactobacillus plantarum B02012 and Lactobacillus alimentarius 20998
由图1可知,植物乳杆菌B02012和消化乳杆菌20998两株菌的生长曲线和pH值变化趋势相似。0~2 h为乳酸菌生长延滞期,此时乳酸菌正在复苏;4~15 h为对数生长期,乳酸菌呈指数型生长,大量繁殖;15~24 h为稳定期,由于营养物质不足,乳酸菌的生长和死亡处于动态平衡。因此,两株乳杆菌用于酸面团发酵的最佳收获时间为20 h左右。从pH值变化情况来看,植物乳杆菌B02012和消化乳杆菌20998在生长24 h内pH值降低,且pH值下降趋势与乳酸菌生长曲线相符合,乳酸菌处于对数生长期时pH值下降迅速,24 h后两株菌的pH值均为3.6左右。

图2 面团发酵过程中pH值变化
Fig. 2 Changes in pH during dough fermentation
由图2可知,添加植物乳杆菌B02012和消化乳杆菌20998面团的pH值变化趋势接近,SLB02012、SYLB02012、SL20998和SYL20998组面团的pH值随着发酵的进行开始迅速降低,发酵9 h后趋于平缓。此外,SLB02012、SL20998组面团的pH值最终至3.0,发酵6 h后始终低于SYLB02012和SYL20998组。CK和SCA组面团pH值在发酵过程中变化较小。面团SY的pH值在发酵前期缓慢降低,稳定在pH 5左右,当发酵16 h后pH值由5快速降低至约3.5。以上结果说明,乳酸菌在面团发酵期间对pH值的变化起到主导作用,相对于酵母菌产酸速率更快。这是由于乳酸菌一方面可以产生以乳酸为主的有机酸,使面团快速酸化,pH值下降;另一方面较低的pH值可以促进溶解酸溶化合物。王金水等[8]在研究乳酸菌对发酵酸面团pH值的影响时发现,植物乳酸菌M616发酵期间可将面团的pH值从6.0降低至3.73,相比之下,植物乳杆菌B02012和消化乳杆菌20998酸化能力更强,酸化对于面团的风味至关重要。
由图3A可知,面团在发酵0 h时CK、SY、SCA、SLB02012、SYLB02012、SL20998、SYL20998组的全蛋白亚基条带保持完好,说明此时蛋白质还未开始水解。与发酵0 h相比,面团发酵24 h(图3B)变化较为明显,部分高分子质量麦谷蛋白(high molecular weight glutenin subunits,HMW-GS)和麦醇溶蛋白条带明显变浅。CK组在整个发酵过程中各蛋白质条带无明显变化,SY和SCA组面团中HMW-GS和部分麦醇溶蛋白条带变淡。SCA组面团中可食性有机酸会电离产生H+,作为催化剂对小麦蛋白进行脱酰胺改性,导致蛋白肽链的断裂和酰胺键水解反应,进而引起蛋白质发生部分降解[26]。2 种乳杆菌发酵面团的蛋白质条带较其他组变化显著。SL20998和SYL20998组面团,分子质量在66.2 kDa以上的条带几乎完全解离,而50 kDa左右的低分子质量亚基条带和35 kDa处的条带保持较好。植物乳杆菌B02012降解蛋白质能力大于消化乳杆菌20998,因此SLB02012、SYLB02012组面团在50 kDa左右及低分子质量麦醇溶蛋白的条带变淡,且SLB02012中的蛋白质条带相比SYLB02012更淡,这可能是因为乳酸菌产生的酸性环境在一定程度上抑制了酵母菌的生长,酵母菌同其竞争营养物质也影响了乳酸菌的生长[27]。小麦面粉中的蛋白酶主要是天冬氨酸蛋白酶及羧肽酶,它们在酸性条件下活力较强,由图1、2可知,乳酸菌生长发酵过程中pH值下降,这为蛋白酶的最大活力提供了适宜条件,促进了蛋白酶对蛋白质的水解[28];同时,乳酸菌中复杂的酶系对蛋白质也有降解作用,由于乳酸菌酶系的差异,各样品蛋白质降解程度表现不同。
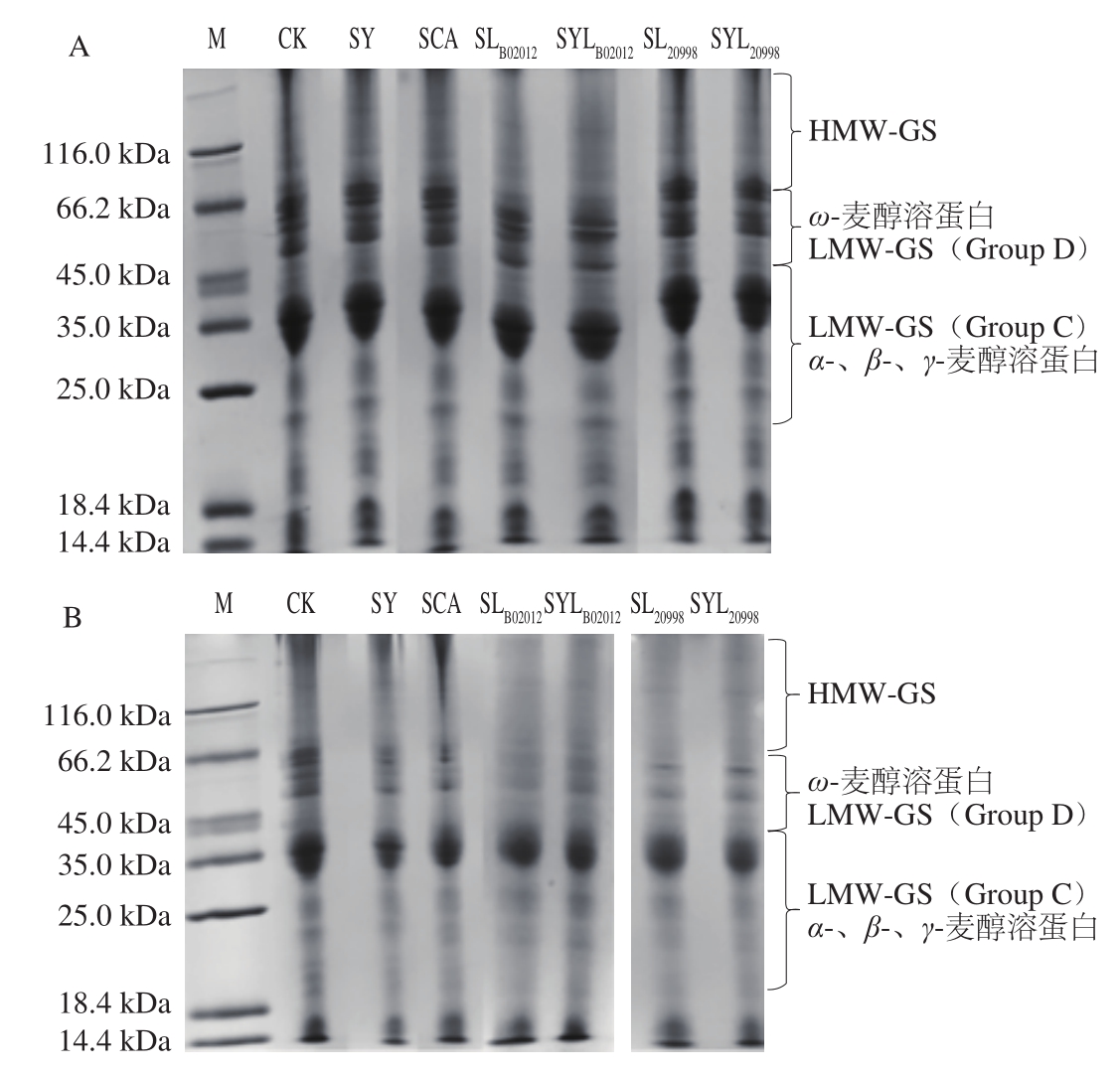
图3 酸面团发酵0 h(A)和24 h(B)后小麦总蛋白条带变化
Fig. 3 SDS-PAGE of whole wheat proteins in sourdough after fermentation for 0 h (A) and 24 h (B)
为进一步研究乳酸菌发酵面团对麦醇溶蛋白二级结构的影响,利用FTIR对从发酵24 h面团中提取的麦醇溶蛋白进行测定。前人研究表明,3 200~3 600 cm-1代表—OH的伸缩振动,而2 800~3 000 cm-1代表—CH的伸缩振动。酰胺I带(1 600~1 700 cm-1)主要为C=O的伸缩振动,用来表征麦醇溶蛋白的二级结构,5 个峰位置对应于蛋白质中的二级结构,1 604.5、1 625.7、1 693.2 cm-1 3 个峰代表β-折叠,1 658.6 cm-1和1 679.7 cm-1分别代表α-螺旋和β-转角[29],结果如表1所示。

图4 发酵24 h酸面团中麦醇溶蛋白的FTIR图
Fig. 4 FTIR spectra of gliadins in sourdough after fermentation for 24 h
表1 发酵24 h酸面团中麦醇溶蛋白二级结构含量
Table 1 Secondary structures of gliadins in sourdough after fermentation for 24 h
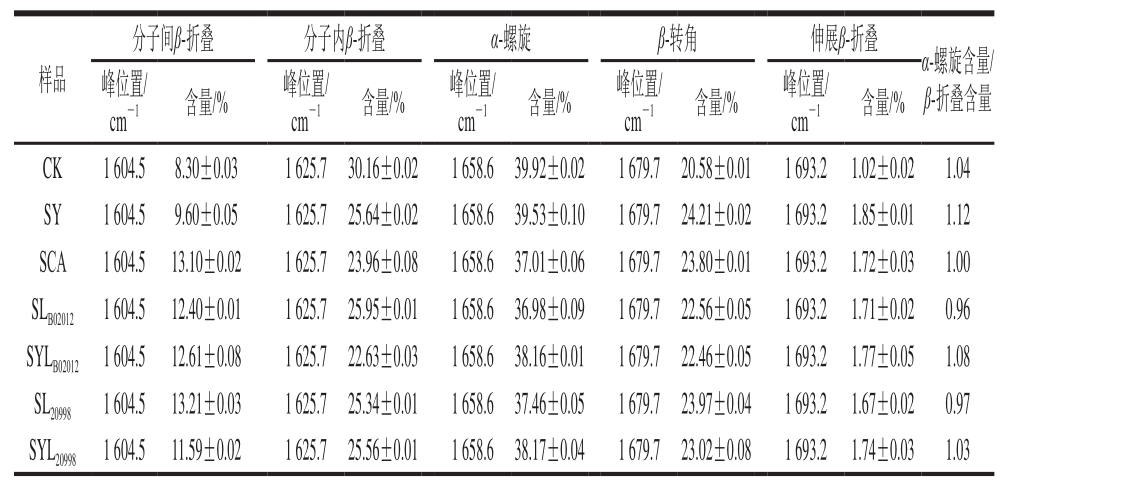
分子间β-折叠 分子内β-折叠 α-螺旋 β-转角 伸展β-折叠样品 峰位置/cm-1 含量/% 峰位置/cm-1 含量/% 峰位置/cm-1 含量/% 峰位置/cm-1 含量/% 峰位置/cm-1 含量/%α-螺旋含量β-折叠含量CK 1 604.5 8.30±0.03 1 625.7 30.16±0.02 1 658.6 39.92±0.02 1 679.7 20.58±0.01 1 693.2 1.02±0.02 1.04 SY 1 604.5 9.60±0.05 1 625.7 25.64±0.02 1 658.6 39.53±0.10 1 679.7 24.21±0.02 1 693.2 1.85±0.01 1.12 SCA 1 604.5 13.10±0.02 1 625.7 23.96±0.08 1 658.6 37.01±0.06 1 679.7 23.80±0.01 1 693.2 1.72±0.03 1.00 SLB02012 1 604.5 12.40±0.01 1 625.7 25.95±0.01 1 658.6 36.98±0.09 1 679.7 22.56±0.05 1 693.2 1.71±0.02 0.96 SYLB02012 1 604.5 12.61±0.08 1 625.7 22.63±0.03 1 658.6 38.16±0.01 1 679.7 22.46±0.05 1 693.2 1.77±0.05 1.08 SL20998 1 604.5 13.21±0.03 1 625.7 25.34±0.01 1 658.6 37.46±0.05 1 679.7 23.97±0.04 1 693.2 1.67±0.02 0.97 SYL20998 1 604.5 11.59±0.02 1 625.7 25.56±0.01 1 658.6 38.17±0.04 1 679.7 23.02±0.08 1 693.2 1.74±0.03 1.03/
由图4可知,经长时发酵处理后,蛋白质分子的很多特征吸收峰都发生了偏移。CK的—OH伸缩振动特征吸收峰为3 421.15 cm-1,而SY、SCA、SLB02012、SYLB02012、SL20998、SYL20998特征峰发生偏移,SLB02012和SYLB02012移动范围分别为109 cm-1和112 cm-1,说明植物乳酸杆菌B02012对蛋白质中—OH影响显著,这可能是其发酵过程中对氢键的作用所导致。SLB02012的—CH伸缩振动特征吸收峰从2 924.47 cm-1偏移到2 929.15 cm-1。与SL20998相比,SCA、SLB02012在酰胺I带振动强度较大,表明可食性有机酸酸化和植物乳酸杆菌B02012发酵面团中麦醇溶蛋白分子的构象发生了变化,相比消化乳酸杆菌20998更能促进麦醇溶蛋白结构中的酰胺I带伸缩振动。此外,SLB02012、SL20998相比SYLB02012和SYL20998在酰胺I带振动强度更大,说明加入酵母菌后能够减少2 种乳杆菌对麦醇溶蛋白中酰胺I带的影响,这可能是因为加入的酵母菌与乳酸菌之间相互影响,两者表现出一定的拮抗作用。
在蛋白质分子中,发射荧光的氨基酸有色氨酸(Trp)、酪氨酸(Tyr)以及苯丙氨酸(Phe)。Trp、Tyr以及Phe由于其侧链生色基团的不同,表现出的荧光激发和发射光谱也不同[27]。蛋白质中Tyr和Phe残基对环境变化不敏感,而Trp残基的天然荧光及其变化值可直接反映蛋白质三级结构本身和周围环境的变化,可作为探针广泛用于检测蛋白质构象的变化[30]。
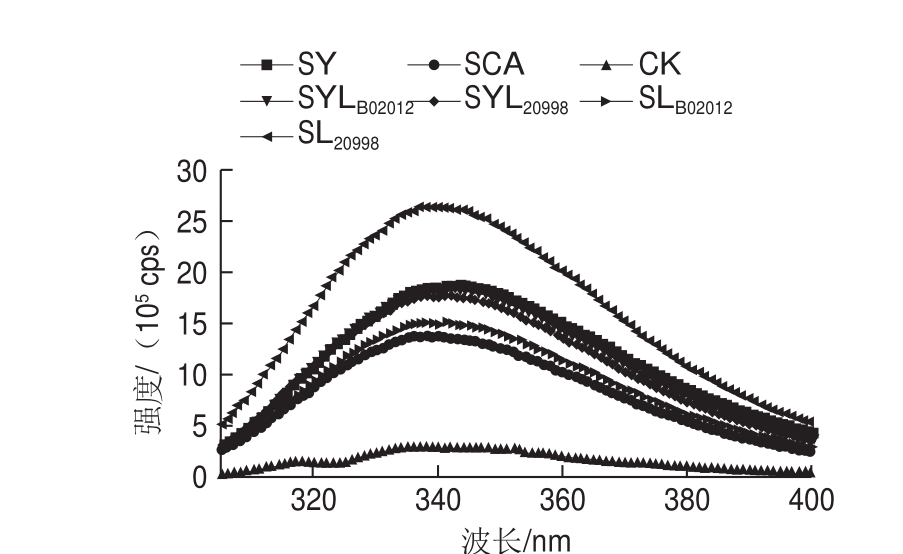
图5 发酵24 h酸面团中麦醇溶蛋白的IFS图
Fig. 5 Intrinsic fluorescence spectra of gliadins in sourdough after fermentation for 24 h
由图5可知,不同的发酵处理条件对麦醇溶蛋白IFS光谱的最大发射波长和荧光强度有一定影响。SL20998荧光强度最大,SCA和SLB02012相对较小。表2列出了样品IFS扫描峰的波长及峰值(荧光强度)。
表2 发酵24 h酸面团中麦醇溶蛋白的IFS出峰波长和峰值
Table 2 IFS maximum wavelengths and peak heights of gliadins in sourdough after fermentation for 24 h
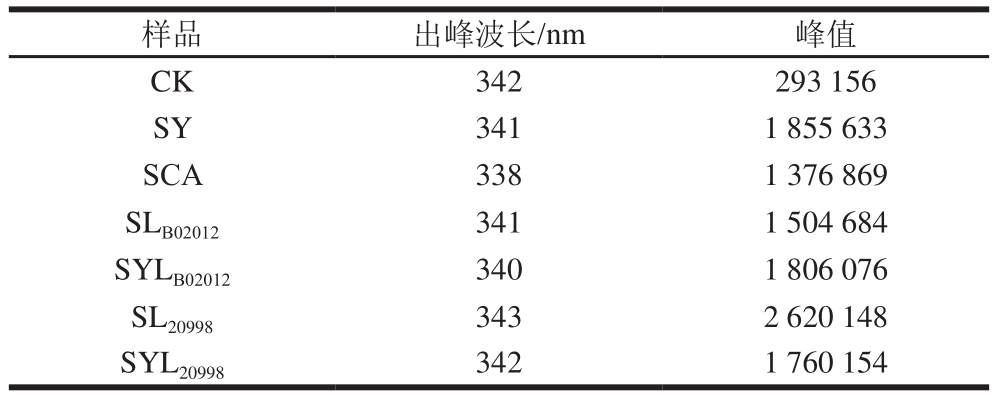
样品 出峰波长/nm 峰值CK 342 293 156 SY 341 1 855 633 SCA 338 1 376 869 SLB02012 341 1 504 684 SYLB02012 340 1 806 076 SL20998 343 2 620 148 SYL20998 342 1 760 154
由表2可知,SL20998的λmax发生红移(从342 nm到343 nm),可能是因为在天然蛋白质中,色氨酸一般处于分子内部,被非极性氨基酸包围,经消化乳杆菌20998长时发酵后,蛋白质三级结构展开,聚集程度降低,处于分子内部的色氨酸逐渐暴露出来;因此,荧光强度增加,λmax发生红移。相对于CK,SY、SLB02012和SYLB02012的λmax发生了蓝移(从342 nm分别到341、341、340 nm),表明植物乳杆菌B02012发酵的面团中麦醇溶蛋白发生三级结构聚集,色氨酸暴露程度减少。
由图6可知,SCA、SY、SLB02012、SYLB02012组面团经过24 h发酵后麦醇溶蛋白免疫反应性相对于CK组呈下降趋势,SLB02012中麦醇溶蛋白的免疫反应性降低了35%,下降最显著,该降敏程度高于可食性有机酸酸化发酵面团和传统酵母菌发酵面团。而SL20998和SYL20998组面团中麦醇溶蛋白免疫反应性非但没有降低反而增强,分别增加了30%和14%。由IFS分析可知,SCA、SLB02012和SYLB02012的λmax发生蓝移,蛋白质聚集,抗原表位被覆盖,暴露程度小,被抗体识别的可能性小,从而使得免疫反应性降低。由SDS-PAGE分析可知,SLB02012组面团中的HMW-GS、中分子质量蛋白及麦醇溶蛋白条带较其他各组面团的蛋白质水解程度更大,这可能使得原本可以被抗体识别的免疫表位由于蛋白发生了更大程度的水解,随机去除抗原活性位点或增加了活性位点空间位阻,抗原暴露量减少,免疫反应性降低。FTIR结果表明,SCA组分子内β-折叠含量显著减小,蛋白质可能发生了有机酸脱酰胺反应,有研究发现,脱酰胺反应可使麦醇溶蛋白免疫反应性降低具有降敏的效果[31]。消化乳杆菌20998引起免疫反应性增加,可能是由于麦醇溶蛋白降解成肽段反而暴露出更多的免疫性原位,从而受到抗体的识别,导致免疫反应性增加。SL20998、SYL20998组中β-转角的含量明显增加,有研究发现,β-转角主要是天冬氨酸和谷氨酸构成的处于分子表面的二级结构[32],面团经过消化乳杆菌20998长时发酵后天冬氨酸和谷氨酸暴露程度增加,进而导致抗原表位增加,故免疫反应性较CK组呈现增强的现象。SL20998的λmax发生红移,蛋白质聚集程度减小,结构伸展,更易暴露出免疫表位,这也导致了消化乳杆菌20998发酵面团免疫反应性增强[33]。
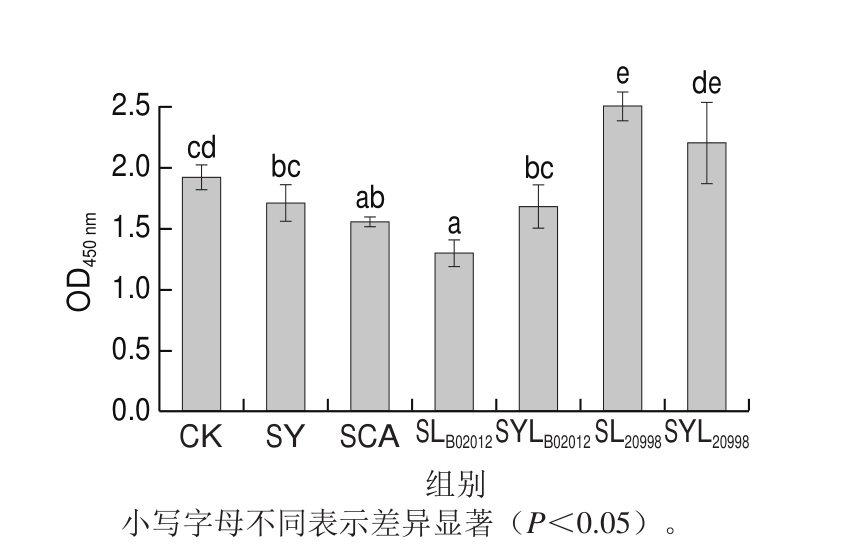
图6 发酵24 h各面团中麦醇溶蛋白的酶联免疫吸附能力
Fig. 6 ELISA measurement of wheat gliadins in sourdough after fermentation for 24 h
为进一步验证以上结果,采用层次聚类分析对各发酵面团样品中麦醇溶蛋白二、三级分子结构与其酶联免疫吸附能力进行统计学相关性分析。
由图7可知,7 个样品分为3 类:第1类样品是加入了消化乳杆菌20998发酵的面团(SL20998、SYL20988),免疫反应性增强大于23%;第2类样品为SY和SYLB02012,免疫反应性下降约14%;第3类样品为SCA和SLB02012,免疫反应性降低约30%。该结果说明,相同聚类的样品免疫反应性变化表现出相似性,且本研究中植物乳杆菌B02012发酵面团表现出和可食性有机酸酸化面团相近的降敏效果。有机酸脱酰胺虽然有大量文献报道其降敏效果,但现有的酸随机脱酰胺改性小麦蛋白方法仍存在争议和不足。Denery-Papini等[34]研究指出,脱酰胺小麦蛋白仍对乳糜泻敏感患者带来强烈的致敏反应。Rahaman等[35]研究发现,低温脱酰胺条件无降敏效果,当温度高于100 ℃的中酸性条件时小麦蛋白的抗原性才会降低。相比之下,植物乳酸菌B02012在面团品质改善和降敏稳定性表现出一定的优势。

图7 层次聚类分析谱系图
Fig. 7 Dendrogram of agglomerative hierarchical clustering
通过对7 种长时发酵面团(CK、SY、SCA、SLB02012、SYLB02012、SL20998、SYL20998)中蛋白质分子结构变化测定发现,乳杆菌是面团中蛋白质降解的主导者。两株乳杆菌虽然具有相似的产酸速率和酸化性能,但其发酵面团中蛋白质分子二、三级结构变化表现差异。与CK组相比,SLB02012组面团中β-折叠含量减少,α-螺旋含量下降最明显,且α-螺旋含量/β-折叠含量的比值最小;SL20998和SYL20998中β-转角含量明显增加;SY、SLB02012和SYLB02012的λmax发生蓝移,蛋白质聚集程度增加,SL20998荧光发生红移,蛋白质三级结构展开,聚集程度降低。
对7 种长时发酵面团中麦醇溶蛋白免疫性的研究表明,消化乳杆菌20998引起免疫反应性增强,植物乳酸菌B02012具有显著降低免疫反应的效果。
植物乳杆菌B02012是本实验室经紫外诱变后用于微生态制剂的乳酸菌,在酸面团长时发酵过程中对蛋白质进行降解,产生的小分子肽段、氨基酸和乳酸等物质可以丰富面团风味,而且表现出较好的降低免疫反应性的效果。植物乳杆菌B02012可作为优势菌用于开发低敏食品,对于构建低敏长时发酵酸面团工业化生产体系有着重要的实际意义。
[1] GUEL H, OEZCELIK S, SAGDIC O, et al. Sourdough bread production with and S. cerevisiae isolated from sourdoughs[J]. Process Biochemistry, 2005, 40(2): 691-697. DOI:10.1006/jcrs.1994.1055.
[2] ZOTTA T, PIRAINO P, PARENTE E, et a1. Characterization of lactic acid bacteria isolated from sourdoughs for Cornetto, a traditional bread produced in Basilicata (Southern Italy)[J]. World Journal of Microbiology and Biotechnology, 2008, 24(9): 1785-1795.DOI:10.1007/s11274-008-9671-0.
[3] PARAMITHIOTIS S, GIOULATOS S, TSAKALIDOU E, et al.Interactions between Saccharomyces cerevisiae, and lactic acid bacteria in sourdough[J]. Process Biochemistry, 2006, 41(12): 2429-2433. DOI:10.1016/j.procbio.2006.07.001.
[4] 周春艳, 张华铮, 陈红兵, 等. 酸面团发酵技术应用研究进展[J].食品工业科技, 2014, 35(17): 375-380. DOI:10.13386/j.issn1002-0306.2014.17.076.
[5] SPIROS P, STEFANIA T, ELEFTHERIOSH D. Comparative study of spontaneously fermented sourdoughs originating from two regions of Greece: Peloponnesus and Thessaly[J]. European Food Research and Technology, 2010, 231(6): 883-890. DOI:10.1007/s00217-010-1345-0.
[6] 傅航, 余健霞. 乳酸菌发酵在食品加工中的应用[J]. 黑龙江科技信息, 2017(13): 44.
[7] ROLLÁN G, ANGELIS M D, GOBBETTI M, et al. Proteolytic activity and reduction of gliadin-like fractions by sourdough lactobacilli[J]. Journal of Applied Microbiology, 2010, 99(6): 1495-1502. DOI:10.1111/j.1365-2672.2005.02730.x.
[8] 王金水, 杨森, 尹艳丽, 等. 植物乳酸菌M616对发酵酸面团发酵特性的影响[J]. 现代食品科技, 2015, 31(4): 83-87. DOI:10.13982/j.mfst.1673-9078.2015.4.014.
[9] 于凤莲, 李素云, 袁娟丽, 等. 小麦α-麦醇溶蛋白中致乳糜泻肽段的研究进展[J]. 食品工业科技, 2014, 35(2): 364-368; 374.DOI:10.13386/j.issn1002-0306.2014.02.065.
[10] GIANFRANI C, AURICCHIO S, TRONCONE R. Adaptive and innate immune responses in celiac disease[J]. Immunology Letters,2005, 99(2): 141-145. DOI:10.1016/j.imlet.2005.02.017.
[11] GOBBETTI M, RIZZELLO C G, DI CANGO R, et al. Sourdough lactobacilli and celiac disease[J]. Food Microbiology, 2007, 24(2):187-196.DOI:10.1016/j.fm.2006.07.014.
[12] CABRERACHÁVEZ F, CALDERÓN D L B A M. Trends in wheat technology and modification of gluten proteins for dietary treatment of coeliac disease patients[J]. Journal of Cereal Science, 2010, 52(3):337-341. DOI:10.1016/j.jcs.2010.06.020.
[13] ANGELIS M D, CODA R, SILANO M, et al. Fermentation by selected sourdough lactic acid bacteria to decrease coeliac intolerance to rye flour[J]. Journal of Cereal Science, 2006, 43(3): 301-314.DOI:10.1016/j.jcs.2005.12.008.
[14] DI CAGNO R, DE ANGELIS M, LAVERMICOCCA P, et al.Proteolysis by sourdough lactic acid bacteria: effects on wheat flour protein fractions and gliadin peptides involved in human cereal intolerance[J]. Applied & Environmental Microbiology, 2002, 68(2):623-633. DOI:10.1128/AEM.68.2.623–633.2002.
[15] FENG X M, ERIKSSON A R, SCHNÜRER J. Growth of lactic acid bacteria and Rhizopus oligosporus during barley tempeh fermentation[J]. International Journal of Food Microbiology, 2005,104(3): 249-256. DOI:10.1016/j.ijfoodmicro.2005.03.005.
[16] ROLLÁN G, DE A M, GOBBETTI M, et al. Proteolytic activity and reduction of gliadin-like fractions by sourdough lactobacilli[J]. Journal of Applied Microbiology, 2005, 99(6): 1495-1502. DOI:10.1111/j.1365-2672.2005.02730.x.
[17] GEREZ C L, FONT D V G, ROLLÁN G C. Functionality of lactic acid bacteria peptidase activities in the hydrolysis of gliadin-like fragments[J]. Letters in Applied Microbiology, 2008, 47(5): 427-432.DOI:10.1111/j.1472-765X.2008.02448.x.
[18] RIZZELLO C G, DE ANGELIS M, DI CANGO R, et al. Highly efficient gluten degradation by lactobacilli and fungal proteases during food processing: new perspectives for celiac disease[J]. Applied and Environmental Microbiology, 2007, 73(14): 4499-4507. DOI:10.1128/AEM.00260-07.
[19] DE ANGELIS M, CASSONE A, RIZZELLO C, et al. Mechanism of degradation of immunogenic gluten epitopes from Triticum turgidum L.var. durum by sourdough Lactobacilli and fungal proteases[J]. Applied and Environmental Microbiology, 2010, 76(2): 508-518. DOI:10.1128/AEM.01630-09.
[20] 王金水, 冯景丽, 贾峰, 等. 酸面团发酵过程中麦谷蛋白含量变化规律研究[J]. 河南工业大学学报(自然科学版), 2016, 37(4): 6-10.DOI:10.16433/j.cnki.issn1673-2383.2016.04.002.
[21] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.DOI:10.1038/227680a0.
[22] WANG Yu, CHEN Yiheng, ZHOU Yun, et al. Effects of konjac glucomannan on heat-induced changes of wheat gluten structure[J]. Food Chemistry, 2017, 229(2): 409-416. DOI:10.1016/j.foodchem.2017.02.056.
[23] WANG Kaiqiang, LUO Shuizhong, ZHONG Xiyang, et al. Changes in chemical interactions and protein conformation during heat-induced wheat gluten gel formation[J]. Food Chemistry, 2017, 214(1): 393-399. DOI:10.1016/j.foodchem.2016.07.037.
[24] 宋宏新, 程妮, 薛海燕, 等. 快速定量分析牛乳中α-乳白蛋白的竞争酶联免疫吸附法[J]. 中国科学院大学学报, 2016, 33(3): 360-364.DOI:10.7523/j.issn.2095-6134.2016.03.012.
[25] DUPONT-DESHORGUE A, OUDART J B, BRASSART B, et al. A competitive enzyme-linked immunosorbent assay for quantification of tetrastatin in body fluids and tumor extracts[J]. Analytical Biochemistry, 2015, 482(4): 16-21. DOI:10.1016/j.ab.2015.04.023.
[26] SHIH F F. Modification of food proteins by non-enzymatic methods[M]// HUDSON B J F. Biochemistry of food proteins. Berlin:Springer, 1992: 235-248.
[27] KATO A, NAKAI S. Hydrophobicity determined by a fluorescence probe method and its correlation with surface properties of proteins[J]. Biochimica et Biophysica Acta, 1980, 624(1): 13-20.DOI:10.1016/0005-2795(80)90220-2.
[28] 宋佳锟, 张灏, 赵建新. 乳酸菌对老面团发酵过程中可溶性糖和游离氨基酸含量的影响[J]. 安徽农业科学, 2015, 43(16): 256-259.DOI:10.13989/j.cnki.0517-6611.2015.16.090.
[29] SERRANO V, LIU W, FRANZEN S. An infrared spectroscopic study of the conformational transition of elastin-like polypeptides[J].Biophysical Journal, 2007, 93(7): 2429-2435. DOI:10.1529/biophysj.106.100594.
[30] KATO A, TANAKA A, LEE Y, et al. Effects of deamidation with chymotrypsin at pH 10 on the functional properties of proteins[J].Journal of Agricultural & Food Chemistry, 1987, 35(2): 285-288.DOI:10.1021/jf00074a029.
[31] KANERVA P, BRINCK O, SONTAG-STROHM T, et al. Deamidation of gluten proteins and peptides decreases the antibody affinity in gluten analysis assays[J]. Journal of Cereal Science, 2011, 53(3): 335-339. DOI:10.1016/j.jcs.2011.02.003.
[32] RAJAGOPAL S N, SANDINE W E. Associative growth and proteolysis of Streptococcus thermophilus and Lactobacillus bulgaricus in skim milk[J]. Journal of Dairy Science, 1990, 73(4):894-899. DOI:10.3168/jds.S0022-0302(90)78745-0.
[33] WANG Y Q, GAN J, ZHOU Y, et al. Improving solubility and emulsifying property of wheat gluten by deamidation with four different acids: effect of replacement of folded conformation by extended structure[J]. Food Hydrocolloids, 2017, 72(4): 105-114.DOI:10.1016/j.foodhyd.2017.04.013.
[34] DENERY-PAPINI S, BODINIER M, LARRÉ C, et al. Allergy to deamidated gluten in patients tolerant to wheat: specific epitopes linked to deamidation[J]. Allergy, 2012, 67(8): 1023-1032. DOI:10.1111/j.1398-9995.2012.02860.x.
[35] RAHAMAN T, VASILJEVIC T, RAMCHANDRAN L. Shear, heat and pH induced conformational changes of wheat gluten-impact on antigenicity[J]. Food Chemistry, 2016, 196(9): 180-188. DOI:10.1016/j.foodchem.2015.09.041.
Impacts ofLactobacillus plantarum B02012 on Gluten Structure and Immunoreactivity in Sourdough
LIAO Lan, WEN Xiaoyan, CHEN Linping, et al. Impacts of Lactobacillus plantarum B02012 on gluten structure and immunoreactivity in sourdough[J]. Food Science, 2019, 40(17): 22-29. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180802-006. http://www.spkx.net.cn