
图1 中心代谢途径简化图
Fig. 1 Central metabolic pathways in fish
在我国,多数消费者喜欢购买活鱼,因此活鱼销售一直是最主要的鱼类产品销售方式之一,但由于运输方法的限制,由沿海深入内陆的长途活鱼运输经常会造成大量活鱼死亡,甚至导致鱼腐败。据估算,每年运输途中死亡的活鱼至少在148.5万 t以上,而夏季是活鱼运输死亡的高峰期[1-2],因此对于活鱼的运输与贮藏一直是近年来水产行业的难题。鱼类作为冷血动物,其体温和代谢速率依赖于水温,且某些鱼种具有冬眠习性[3]。为了能够实现活鱼贮运,多数采用鱼、水一起运输的方式,但是在长途运输中,特别是山地运输途中往往由于颠簸、冲撞会造成鱼大量死亡。为了解决这些问题,有学者探讨使用乙醇、碳酸等麻醉剂使鱼进入休眠状态,进行离水贮运实验,并取得一定效果[4-6],但是麻醉剂的使用是否对人体和鱼类有害需要进一步调查和评估。研究表明,诱导鱼类进入冬眠需要保持生态冰温、梯度降温和保持湿度等条件[7-8],而且要使鱼进入休眠或冬眠状态还需要使其处于静止状态,因为大多数鱼离开水后会因挣扎、蹿跳加快其死亡进程。麻醉剂使用的本质就是使鱼类进入静止状态。可见,在静止状态下鱼才能存活更长时间,从而顺利进入到休眠或冬眠状态。在福建建瓯,当地居民为将活鱼运输到山外的集市上出售,发明了一种名为“弓鱼”的绑鱼技术,利用这种技术可使离水后进行长途运输的鱼仍保持存活状态,在冬季甚至可保活3 d,夏季也可保活2 d[9]。弓鱼技术可以减少鱼的活动和挣扎,从而有效地延长鱼的离水存活时间。
生物界存在代谢越旺盛的生物其寿命也会越短暂的普遍规律,而代谢越慢的生物寿命也会越长。因此,延长寿命就是最大可能地降低生物的代谢速率。冬眠是生物在一定的低温条件下为了存活而使自身代谢维持在较低水平;与此同时,机体还必须为在环境温度变得合适的条件下重新复苏和恢复体力储存足够多的能量,即褐色脂肪组织[10]。所以冬眠或近似冬眠的状态应该判定为机体处于最低代谢的状态[11],在此状态下动物可以有效延长寿命。另一方面,低温诱导冬眠并不意味着温度越低越好,因为随着温度的降低,动物会通过冷应激来增强分解代谢、加强氧化呼吸和氧化磷酸化作用以为机体提供能量,从而使代谢速率升高,以免被冻死[12]。可见,生物寿命的长短主要取决于中心代谢途径的代谢速率。研究发现,乳酸盐可以通过单羧酸运载体在组织、细胞和细胞器中穿梭运输,其在调节机体合成与分解代谢中发挥关键作用[13]。同时乳酸盐作为一种中间产物参与糖酵解、生物合成和氧化呼吸,在调节多细胞有机体的细胞呼吸代谢、氧化磷酸化以及合成与分解代谢等方面发挥信号调节作用[14-15]。由此可见,乳酸盐代谢通量可以作为分解代谢的重要标志[16],乳酸盐通量越低,分解代谢水平越低,生物存活时间越长。
鲤鱼是品种最多、分布最广、养殖历史最悠久、产量最高的淡水鱼类之一,鲇鱼也是常见的淡水鱼类,两者的适应生存能力都极强,同时都有禁食蛰伏过冬的生理现象;因此,本研究首次对不同温度下弓鲤鱼和弓鲇鱼中心代谢途径的代谢通量进行测定,寻找延长弓鲤鱼与弓鲇鱼离水存活时间的最适温度和条件,以期为诱导休眠的离水活鱼运输提供一种新方法和理论依据。
鲤鱼和鲇鱼于天津水产养殖基地捕捞后,选取无疾病、大小均匀、成熟度近似的优质个体。
磷酸盐缓冲液、乳酸-葡萄糖标准液 山东省科学院生物研究所;1,3-二磷酸甘油酸、3-磷酸甘油醛脱氢酶、二羟磷酸丙酮 美国Sigma公司。
3K15高速冷冻离心机 德国Sigma公司;J2-21高速冷冻离心机 美国Beckman公司;HVE-50高压灭菌器 日本Hirayama Manufacturing公司;SBA-40C生物传感器分析仪 山东省科学院生物研究所。
1.3.1 样品制备
按照弓鱼简化工艺[9],用竹签在鱼鼻处穿孔,用棉绳经鼻孔穿唇而过并打结,再把鱼身沿内侧向右弯曲,把绳子另一端移到鱼尾肛门上端系紧打结,将鱼固定成“弓”形,再将弓好的鲤鱼和鲇鱼分别放于生化培养箱中。将温度设置为0、4、6、10、15 ℃(采取梯度降温的方法以减少对鱼的损伤),且在培养箱底部放满水以保持箱内湿度,维持相对湿度在(95±5)%。每个温度下分别设置5 条鲤鱼和鲇鱼作为平行。5 h后取出鲤鱼和鲇鱼,穿刺尾动脉取血[17],采得血样于4 ℃静置3 h后,3 000 r/min离心10 min,分离出血清,分装后于-80 ℃保存备用[18]。
1.3.2 鲤鱼和鲇鱼乳酸代谢网络图的构建
根据代谢网络的研究方法及构建原则[19],本实验以鲤鱼和鲇鱼为研究对象,选择糖酵解、戊糖磷酸途径和三羧酸循环为主要代谢途径来构建代谢网络,将没有分支的直线反应合并为一个反应,忽略不在研究范围内的代谢途径,减少代谢网络的反应数目,得到代谢网络图(图1)。

图1 中心代谢途径简化图
Fig. 1 Central metabolic pathways in fish
1.3.3 葡萄糖、乳酸和NADH的测定
如图1、表1所示,在整个乳酸盐代谢网络中,有9 个需要测定的代谢速率(r1~r9),根据代谢网络通量分析的原则[20],由胞内中间代谢产物(G6P、F6P、GAP、PEP、PYR、AcCoA)可确定的质量平衡方程有6 个(表2)。假定胞内中间途径的代谢物通量都处于拟稳态,即这6 个途径代谢物在机体稳态环境状态下没有积累,它们的质量平衡方程都为0,这样就可以得到关于9 个代谢速率的6 个约束向量;此时该系统的自由度为F=3。而代谢产物系统中NADH的代谢速率(P3=r5+r8-r7+3r9)可通过实验测得,乳酸盐代谢变化速率r7、葡萄糖代谢变化速率r1也可以通过实验测得,因此可以得到唯一解。通过通量计算方法提取可测量代谢物平衡方程系数,并与其余中间代谢物平衡方程系数的负逆矩阵相乘进而得到系数矩阵[21-22],按下式计算所构建代谢网络图中每一条代谢途径的通量。

表1 中心代谢途径中生化反应的方程式
Table 1 Biochemical reaction equations involved in central metabolic pathways
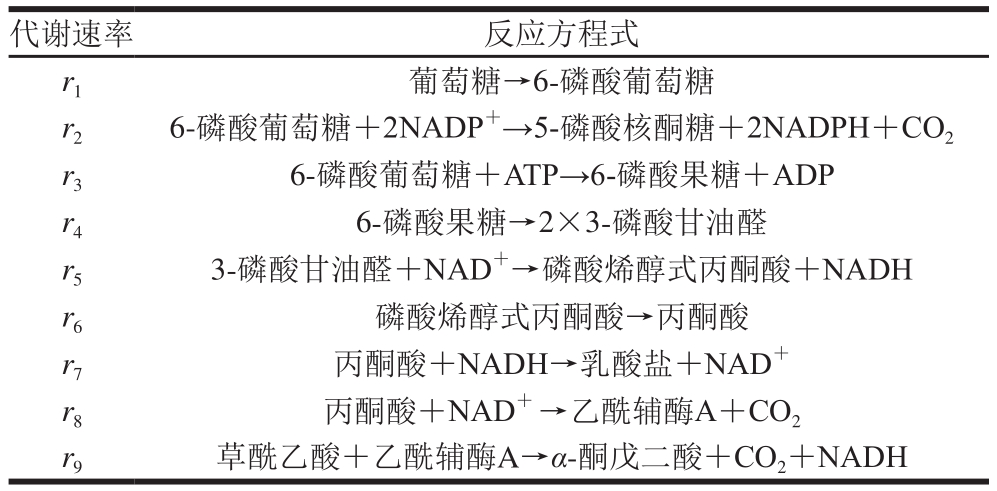
代谢速率 反应方程式r1 葡萄糖→6-磷酸葡萄糖r2 6-磷酸葡萄糖+2NADP+→5-磷酸核酮糖+2NADPH+CO2 r3 6-磷酸葡萄糖+ATP→6-磷酸果糖+ADP r4 6-磷酸果糖→2×3-磷酸甘油醛r5 3-磷酸甘油醛+NAD+→磷酸烯醇式丙酮酸+NADH r6 磷酸烯醇式丙酮酸→丙酮酸r7 丙酮酸+NADH→乳酸盐+NAD+r8 丙酮酸+NAD+ →乙酰辅酶A+CO2 r9 草酰乙酸+乙酰辅酶A→α-酮戊二酸+CO2+NADH
表2 质量平衡方程式
Table 2 Metabolic flux model equations
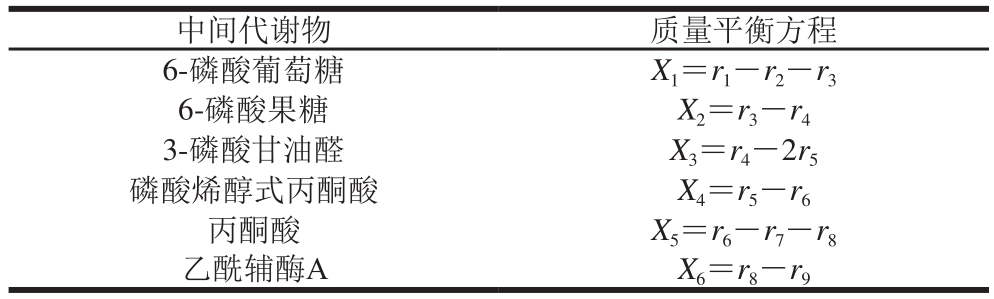
注:Xi.相应中间代谢物。
中间代谢物 质量平衡方程6-磷酸葡萄糖 X1=r1-r2-r3 6-磷酸果糖 X2=r3-r4 3-磷酸甘油醛 X3=r4-2r5磷酸烯醇式丙酮酸 X4=r5-r6丙酮酸 X5=r6-r7-r8乙酰辅酶A X6=r8-r9
运用SBA-40C型生物传感器分析仪测定不同温度贮藏的弓鲤鱼和弓鲇鱼血清中葡萄糖和乳酸的含量,用于乳酸代谢通量的计算。NADH代谢通量参考Theobald[23]和Hoquea[24]等的方法并作改进,采用酶偶联法通过Fluoroskan Ascent FL荧光-化学发光检测仪测定。反应体系为0.25 mmol/L 4-羟乙基哌嗪乙磺酸/乙二胺四乙酸缓冲液、100 mmol/L KCl、10 mmol/L MgSO4、3 mmol/L 1,3-二磷酸甘油酸、0.5 mmol/L二羟磷酸丙酮、0.4 U/mL 3-磷酸甘油醛脱氢酶。
1.3.4 延长离水存活期实验
通过乳酸盐代谢网络分析,可以分别得出2 种鱼最适贮藏温度。理论上,在此温度下鱼的离水存活期最长。但实际情况如何仍需要通过实验证明,因此进一步进行延长离水存活期实验。取鲤鱼和鲇鱼各14 条,分别放置在具有弹性且透气的网兜中固定以减少弓鱼过程中对鱼的损伤,用物理方法使鱼进入静止状态。用木条将网兜串联成竖排,这样既能节省空间,也方便鱼的放入和取出。将做好的简易装置分别放入两组培养箱中,梯度降温至最适贮藏温度,维持箱内相对湿度(95±5)%,观察并记录存活情况。
使用Matlab 7.0软件以及SPSS 17.0软件进行计算,使用Origin软件作图。
实验测得不同温度下(0、4、6、10、15 ℃)下弓鲇鱼和弓鲤鱼葡萄糖、乳酸盐代谢变化速率。将测得数据代入平衡方程计算得出弓鲇鱼和弓鲤鱼乳酸盐代谢通量图中各代谢物通量(图2、3)。从代谢通量图中可以看出弓鲇鱼与弓鲤鱼在不同贮藏温度下的乳酸盐代谢通量明显不同。

图2 0~15 ℃弓鲇鱼乳酸盐代谢网络图
Fig. 2 Lactate metabolism network diagram for bow-bound catfish at 0-15 ℃
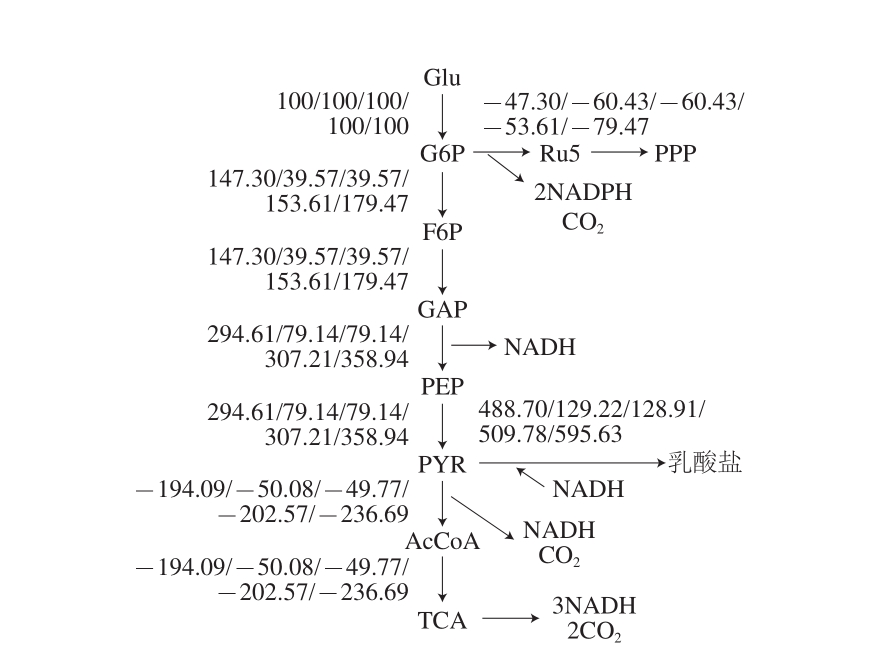
图3 0~15 ℃弓鲤鱼乳酸盐代谢网络图
Fig. 3 Lactate metabolism network diagram for bow-bound carp at 0–15 ℃
由图2、3可知,弓鲇鱼和弓鲤鱼在0、4、6、10 ℃和15 ℃时PPP代谢通量分别为66.96、84.20、81.07、70.98、62.21 mg/dL以及-47.30、60.43、60.43、-53.61、-79.47 mg/dL;乳酸盐代谢通量分别为107.44、50.22、60.12、94.14、123.10 mg/dL以及488.70、129.22、128.91、509.78、595.63 mg/dL。同时结合图4可以看出,随着温度的变化弓鲇鱼和弓鲤鱼的乳酸盐代谢通量均呈现出一个谷值,而且随着温度的降低PPP通量逐渐增加,乳酸盐代谢通量逐渐降低,弓鲇鱼和弓鲤鱼分别在4、6 ℃时,乳酸代谢通量达到最小,PPP代谢通量达到最大,且与10 ℃相比弓鲤鱼的乳酸盐代谢通量大幅降低,PPP通量由负变为正。由此可知,此时机体分解代谢水平最低且合成代谢水平较大。随着温度的继续降低,达到0 ℃时,弓鲇鱼和弓鲤鱼的乳酸盐代谢通量大幅增加,PPP代谢通量也重新回落,说明继续降低温度会造成这2 种鱼冷应激。
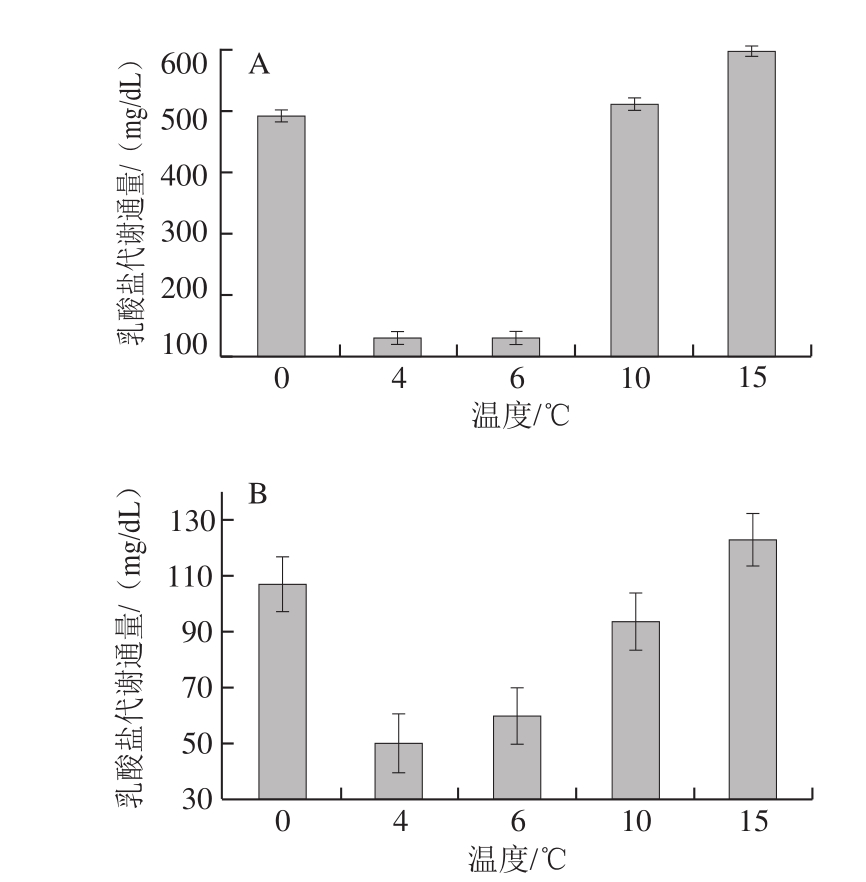
图4 弓鲤鱼(A)和弓鲇鱼(B)的乳酸盐代谢通量
Fig. 4 Lactate metabolism flux in bow-bound carp (A) and bow-bound catfish (B)
由图2、3可以看出,在较高的温度下,线粒体较强的氧化呼吸作用促使葡萄糖进行分解代谢和有氧氧化,葡萄糖经丙酮酸进入TCA循环彻底分解为水和二氧化碳,为机体提供ATP作为生命活动的能量。随着温度的降低,机体的生理活动和耗能也不断降低,线粒体氧化呼吸速率随之降低,NADH+H+积累,于是代谢所产生的NADH只能将脱出的氢交回丙酮酸生成乳酸盐。鱼通过鳃在水中呼吸,离开水后,作为气体交换场所的鳃丝和鳃小片会彼此黏连,呼吸面积大大减小[25],无法补充充足的氧气,为获得能量,鱼体会进行大量的糖酵解从而产生大量乳酸,这就说明在15 ℃和10 ℃时,鲇鱼和鲤鱼仍在进行大量糖酵解为其生存提供能量,但是这种方法会加速其死亡。而在4 ℃和6 ℃时,温度的降低使机体进入类似冬眠的状态,耗能明显减少,乳酸盐通量大幅降低,从而有效延长存活期。但是,随着温度继续降低至0 ℃时,机体为抵御寒冷必须通过加大分解代谢提供能量,以保证其生理活性激活冷应激反应[26-27],产生大量乳酸盐,反而使分解代谢增加,加速死亡进程。
从图4可以看出,弓鲤鱼产生的乳酸盐通量明显大于弓鲇鱼,结合2 种鱼的习性,鲤鱼与多数淡水鱼一样属于无胃鱼种,且肠道细短,新陈代谢速率快,故摄食习惯为少吃勤食,在离水禁食后会更多地进行分解代谢来为机体提供能量;而鲇鱼则不同,其昼伏夜出并且多以小型鱼类为食,在饱食后能量充足,其分解代谢水平较为平均。另外,2 种鱼的最适温度和其他温度对代谢通量的作用也有明显不同。弓鲤鱼和弓鲇鱼最高与最低乳酸盐代谢通量的差值分别为466.72 mg/dL和72.88 mg/dL,随着温度的变化,弓鲤鱼的乳酸盐代谢通量变化更加显著,而弓鲇鱼相较弓鲤鱼各个温度的乳酸盐代谢通量变化程度较小,这说明鲤鱼比鲇鱼更适合用低温诱导休眠方法进行离水贮运。研究结果证明,弓鲇鱼耗能最小、合成代谢最高、分解代谢最低的温度为4 ℃;弓鲤鱼耗能最小、合成代谢最高、分解代谢最低的温度为6 ℃;鲤鱼与鲇鱼相比更适于离水贮运。有学者将3~5 ℃作为较好的保活温度[28],这与本实验所得温度基本一致。
通过乳酸盐代谢网络的分析,得到弓鲤鱼和弓鲇鱼的最适贮运温度分别为6 ℃和4 ℃。通过离水贮运验证最适贮运温度是否能够有效延长这2 种鱼的离水存活期。在日常贮运中,弓鱼技术过于繁琐,浪费人力物力,而本实验利用弓鱼技术的根本目的是为了使鱼静止不动,因此设计了透气弹性网兜与木条制作的简易固鱼工具,来替代弓鱼技术进行延长离水存活期实验。挑选鲤鱼和鲇鱼各14 条进行2 个最适温度的离水存活期实验,结果见表3。
表3 最适存活温度下鲇鱼与鲤鱼的离水存活时间
Table 3 Survival time of carp and catfish at optimum survival temperature

受试鱼 存活时间/h 平均值±标准差1 2 3 4 5 6 7 8 9 10 11 12 13 14鲤鱼(6 ℃) 46 51 22 33 77 39 72 66 63 47 46 34 32 57 48.93±16.38鲇鱼(4 ℃) 19 24 37 41 70 51 24 50 52 32 33 42 38 21 38.14±14.31
由表3可知,在最适温度下可以有效延长弓鲇鱼和弓鲤鱼的离水存活时间,且弓鲤鱼的最长存活间达到77 h,鲇鱼稍短也达到了70 h;通过离水存活的平均时间也可以看出,在最适温度下鲤鱼离水存活期明显长于鲇鱼。通过实验可以证明在这2 个温度下鲤鱼(6 ℃)和鲇鱼(4 ℃)机体分解代谢最低而合成代谢最高,进入类似休眠的状态,离水存活时间更长。但通过存活实验结果并不能认定这2 个温度可以诱导鲤鱼和鲇鱼进入冬眠状态,因为在2 个温度下,2 种鱼均没有出现超过1 周的冬眠惊厥周期,而这是冬眠的重要标志。进入冬眠不仅需要较低的温度和保持静止状态,更重要的是形成褐色脂肪组织[29]。由于冬眠期间不能进食,使得冬眠生物生存和复苏所需ATP主要来源于储脂[30],因此褐色脂肪组织的累积是冬眠生物所必需的。对于鲤鱼和鲇鱼能否可以通过诱导其储藏褐色脂肪组织成功进入冬眠,尚需进一步研究。
本研究探究了不同温度(0、4、6、10、15 ℃)和离水条件下弓鲤鱼和弓鲇鱼的中心代谢网络通量,结果表明,在6 ℃时弓鲤鱼中代表合成代谢的PPP代谢通量最高,为60.43 mg/dL;而代表分解代谢和呼吸强度的乳酸盐代谢通量最低,为128.91 mg/dL,因此判定6 ℃为鲤鱼的最优贮运温度,可以作为诱导鲤鱼进入休眠状态的最适温度;在4 ℃时鲇鱼代表合成代谢的PPP代谢通量最高,为84.20 mg/dL;而代表分解代谢和呼吸强度的乳酸盐代谢通量最低,为50.22 mg/dL,因此判定4 ℃为鲇鱼的最优贮运温度,且通过存活实验可知在这2 个温度下鲤鱼与鲇鱼存活时间最长分别达到77 h和70 h,平均存活时间分别达到48.93 h和38.14 h,证明通过代谢网络的通量控制分析可以优化离水贮运条件,减少能量消耗,延长存活期。而温度继续降低至最适温度以下时,反而会使鱼类产生冷应激,从而增加分解代谢和供能,减少其存活期。同时,本研究中使用了透气弹性网兜与木条制作的简易固鱼工具具有简便易放、随取随用等特点,可离水运输,运达后也可直接放入水中,经适当改进后具有较大的推广和应用前景。
[1] 聂小宝, 张玉晗, 孙小迪, 等. 活鱼运输的关键技术及其工艺方法[J].渔业现代化, 2014, 41(4): 34-39. DOI:10.3969/j.issn.1007-9580.2014.04.008.
[2] THIANSILAKUL Y, BENJAKUL S, RICHARDS M P. The effect of different atmospheric conditions on the changes in myoglobin and colour of refrigerated Eastern little tuna (Euthynnus affinis) muscle[J].Journal of the Science of Food and Agriculture, 2011, 91(6): 1103-1110. DOI:10.1002/jsfa.4290.
[3] LALL S P, TIBBETTS S M. Nutrition, feeding, and behavior of fish[J]. Veterinary Clinics of North America: Exotic Animal Practice,2009, 12(2): 361-372. DOI:10.1016/j.cvex.2009.01.005.
[4] 王琦. 冰温保鲜技术的发展与研究[J]. 食品研究与开发, 2013,34(12): 131-132. DOI:10.3969/j.issn.1005-6521.2013.12.036.
[5] 殷邦忠, 梁萌青, 刘淇, 等. 海水鱼类保活运输原理及其发展趋势[J].现代渔业信息, 1994, 9(6): 8-9.
[6] 吴际萍, 程君晖, 王海霞, 等. 淡水活鱼运输现状及发展前景[J]. 农技服务, 2008, 25(3): 72-73. DOI:10.3969/j.issn.1004-8421.2008.03.055.
[7] GRAHAM W H, GRAHAM D W, DENOYELLES F, et al.Metolachlor andalachlor breakdown product formation patterns in aquatic field mesocosms[J]. Environmental Science and Technology,1999, 33(24): 4471-4476. DOI:10.1021/es990686z.
[8] AHMED M, BIMBAO M A P. Economic considerations in introducing integrated agriculture-aquaculture technology[J]. FAO Fisheries Technical Paper, 2001, 407: 9-12.
[9] 叶文红. 建瓯市“弓鱼”技术简介[J]. 河北渔业, 2014(6): 74.DOI:10.3969/j.issn.1004-6755.2014.06.023.
[10] NEDERGAARD J, CANNON B. Brown adipose tissue: a seasonal tissue in mammals, incoluding humans?[M]// RUF T, BIEBER C,ARNOLD W. Living in seasonal world. Heideberg: Springer-Verlag,2012: 447-458. DOI:10.1007/978-3-642-28678-0_39.
[11] BLIGH J, JOHNSON K G. Glossary of terms for thermal physiology[J]. Journal of Applied Physiology, 1973, 35(6): 941-61.DOI:10.1007/BF00691252.
[12] 许友卿, 郑一民, 丁兆坤. 冷应激对水生动物代谢的影响及调控研究进展[J]. 中国水产科学, 2017, 24(5): 1149-1159. DOI:10.3724/SP.J.1118.2017.16267.
[13] 庞广昌, 陈庆森, 胡志和. 乳酸盐代谢及其在健康中的关键作用[J].食品科学, 2012, 33(1): 1-15.
[14] 李阳, 王兴亚, 王茜茜, 等. 乳酸盐通量及其控制分析: 食品功能的定量化评价方法[J]. 食品科学, 2015, 36(1): 185-190. DOI:10.7506/spkx1002-6630-201501035.
[15] 王会松, 庞广昌, 刘婷婷. 热处理对甜瓜的蔗糖和乳酸代谢网络通量的影响[J]. 食品工业科技, 2016, 37(6): 314-319. DOI:10.13386/j.issn1002-0306.2016.06.055.
[16] FAIZ H, CONJARD-DUPLANY A, BOGHOSSIAN M, et al.Cadmium chloride inhibits lactate gluconeogenesis in isolated human renal proximal tubules: a cellular metabolomic approach with13C-NMR[J]. Archives of Toxicology, 2011, 85(9): 1067-1077.DOI:10.1007/s 00204-010-0633-6.
[17] 杨兴棋. 鱼类的采血技术[J]. 淡水渔业, 1979(增刊1): 45-46; 13.
[18] 李阳. 不同加工方法的食品对人体中心代谢途径的作用[D]. 天津:天津商业大学, 2015: 48-50.
[19] STEPHANOPOULOS G, ARISTIDOU A A, NIELSEN J. Metabolic engineering principles and methodologies[M]. San Diego: Academic Press, 1998: 75.
[20] STEPHANOPOUHOS G N. 代谢工程: 原理与方法[M]. 赵学明, 译.北京: 化学工业出版社, 2003: 110-133.
[21] 白冬梅, 付卫明, 赵学明, 等. 代谢通量分析优化米根霉R1021发酵生产L(+)-乳酸过程[J]. 无锡轻工大学学报, 2002, 21(6): 554-558.DOI:10.3321/j.issn:1673-1689.2002.06.002.
[22] SCHAEFER U, BOOS W, TAKORS R, et al. Automated sampling device for monitoring intracellular metabolite dynamic[J].AnalyBiochem, 1999, 270: 88-96. DOI:10.1006/abio.1999.4048.
[23] THEOBALD U, MILINGER, BALTES M, et al. In vivo analysis of metabolic dynamics in Saccharomyces cerevisiae experimental observations[J]. Biotechnology and Bioengineering, 1997, 55(2):305-316. DOI:10.1002/(SICI)1097-0290(19970720)55:2<305::AIDBIT8>3.0.CO;2-M.
[24] HOQUEA M A, USHIYAMA H, TOMIT M, et al. Dynamic responses of the intracellular metabolite concentrations of the wild type and pykA mutant Escherichia coli against pulse addition of glucose or NH3 under those limiting continuous cultures[J]. Biochemical Engineering Journal, 2005, 26: 38-49. DOI:10.1016/j.bej.2005.05.012.
[25] 张圆圆, 沈建忠, 王海生, 等. 鱼类呼吸器官形态与功能适应性研究进展[J]. 水产科学, 2012, 31(6): 382-386. DOI:10.3969/j.issn.1003-1111.2012.06.015.
[26] SELYE H. A syndrome produced by diverse nocuous agents[J].Nature, 1998, 10: 230-231. DOI:10.1038/138032a0.
[27] 杨焕民, 李士泽. 动物冷应激的研究进展[J]. 黑龙江畜牧兽医,1999(3): 42-44.
[28] 张玉晗, 谢晶. 鱼贝类生态冰温无水活运研究进展[J]. 渔业现代化,2017(2): 38-42. DOI:10.3969/j.issn.1007-9580.2017.02.007.
[29] TOWNSENT K, TSENG Y H. Brown adipose tissue[J]. Adipocyte,2012, 1(1): 13-24. DOI:10.4161/adip.18951.
[30] HELDMAIER G, ORTMANN S, ELVERT R. Natural hypometabolism during hibernation and daily torpor in mammals[J].Respiratory Physiology & Neurobiology, 2004, 141(3): 317-329.DOI:10.1016/j.resp.2004.03.014.
Effects of Different Temperatures on Lactate Metabolic Network Flux in Bow-Bound Carp and Bow-Bound Catfish
YUAN Shuai, PANG Guangchang. Effects of different temperatures on lactate metabolic network flux in bow-bound carp and bow-bound catfish[J]. Food Science, 2019, 40(17): 53-58. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20190414-178. http://www.spkx.net.cn