油脂和含油脂的食品在长期贮存过程中,经酶、氧气氧化产生异味、臭味称为酸败[1]。氧化酸败会产生小分子醛、酮、酸等化合物,使食品的风味发生劣变并使营养大幅降低,同时会对人体健康造成巨大危害,造成如癌症、心脏病、肝损害、神经退化性疾病和其他与炎症有关的退行性疾病[2-4]。在食品中添加抗氧化剂,不仅能够防止油脂和富脂食品的氧化酸败,延长保质期,而且还有许多防病保健功能[5-6]。目前,市售的有合成抗氧化剂和天然抗氧化剂,合成抗氧化剂主要包括丁基羟基茴香醚(butylated hydroxyanisole,BHA)、丁基羟基甲苯(butylated hydroxytoluene,BHT)、没食子酸丙酯和叔丁基对苯二酚(tertiary butylhydroquinone,TBHQ)[7-8]。合成抗氧化剂会通过干扰生物体中的酶活性而产生不良影响,其安全性越来越受到质疑,例如BHA和BHT被怀疑是导致肝损伤和癌症的原因[9]。天然抗氧化剂能对食品中因氧化所引起的各种不良反应起到缓解或阻止作用,并具有保健功能,因此研究开发高效天然食品抗氧化剂具有巨大的前景[4,10]。在我国,提取抗氧化剂的原料多为植物源(辛香料、草药等),存在资源不足的问题,这对天然抗氧化剂产业化的进程有很大影响[11]。
昆虫病原线虫共生菌作为天然抗氧化剂的重要来源,其次生代谢产物的多样性受到广大专家和学者的重视[12]。二烷基间苯二酚(dialkylresorcinols,DAR)属于二苯乙烯类化合物,是昆虫病原线虫共生菌产生的[13]具有抗细菌、抗真菌[14-15]和抗癌[16]的活性物质,其中3,5-二羟基-4-异丙基二苯乙烯在100 μg/mL时对超氧阴离子自由基和羟自由基的清除活性分别达到92.1%和83.4%,均优于已知商用抗氧化剂BHA[16]。
本实验室前期对具有生物活性的天然产物进行了一定的研究[17-20],为进一步发掘生物活性优良的天然产物,本研究采用活性追踪法锁定活性组分,利用硅胶柱层析、凝胶柱层析、高效液相色谱等化学分离技术对发光杆菌SN259的发酵液进行分离纯化并得到活性化合物,通过波谱技术和相关文献调研确定所得活性化合物的结构,并测试了活性化合物在体外的抗氧化能力和对花生油氧化稳定性的影响,为二苯乙烯类化合物作为天然抗氧化剂应用提供一定的科学依据。
发光杆菌(Photohabdus temperata)SN259保存于沈阳农业大学植物保护学院微生物代谢产物实验室。
TBHQ、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS) 上海麦克林生化有限公司;柱层析硅胶(48~74 μm) 青岛海洋化工厂;SephadexTM LH-20柱层析凝胶 瑞典Pharmacia公司;XAD-16 大孔树脂 罗门哈斯国际贸易有限公司;无添加剂花生油为市售;所有分离用有机溶剂(色谱纯)均购自国药集团化学试剂有限公司。
NBTA培养基:牛肉膏3.0 g/L、蛋白胨10.0 g/L、氯化钠5.0 g/L、琼脂粉15.0 g/L、氯化三苯基四氮唑0.040 g/L、溴百里酚蓝0.025 g/L,pH值为7.0。
LB培养基:胰蛋白胨10.0 g/L、酵母提取物5.0 g/L、氯化钠10.0 g/L,pH值为7.0。
M培养基:葡萄糖6.13 g/L、蛋白胨 21.29 g/L、硫酸镁1.50 g/L、硫酸铵2.46 g/L、磷酸二氢钾0.86 g/L、磷酸氢二钾1.11 g/L、硫酸钠1.72 g/L,pH值为7.2~7.6。
ZF-8暗箱四用紫外线分析仪 上海嘉鹏科技有限公司;N-1100旋转蒸发仪 上海爱朗仪器有限公司;6540飞行时间质谱仪、LC-1260半制备高效液相色谱仪(配有可变波长紫外检测器) 美国Agilent Technologies公司;AV-600 Hz核磁共振仪 德国Bruker公司。
1.3.1 菌株培养
将于-80 ℃冰箱保存的发光杆菌SN259均匀涂布在NBTA培养基上,28 ℃下培养48 h,得到的蓝色单菌落用于下一步发酵。用已灭菌的接种环挑取单菌落接种于5 mL液体LB培养基中,于180 r/min、28 ℃下恒温摇床培养18 h得到种子发酵液,再将8 mL种子发酵液接种于含400 mL M培养基的2 L三角瓶中,总发酵量为24 L,于180 r/min、28 ℃下恒温摇床培养120 h得到发酵液。
1.3.2 DAR衍生物的分离与纯化
将1.3.1节中得到的发酵液于室温12 000 r/min条件下离心12 min除去菌体,收集上清液。向上清液中加入质量分数5%的大孔树脂吸附4 h,之后将大孔树脂取出放置在30 ℃烘箱中充分烘干。将烘干的大孔树脂用甲醇浸泡3~4 次,每次4~5 h,将收集的甲醇液减压浓缩成固体。将固体用甲醇-水溶液(1∶1,V/V)再次溶解,再用相同体积的二氯甲烷萃取3 次,收集二氯甲烷相并减压浓缩,得到6.45 g棕色浸膏。
将收集到的浸膏用正相硅胶柱(350 mm×30 mm)分离纯化,用石油醚(沸程60~90 ℃)-乙酸乙酯进行梯度洗脱(二者体积比依次为100∶5、100∶10、100∶20、100∶30、100∶40和0∶100),每个梯度3 L,得到5 个组分(A1~A5)。以ABTS阳离子自由基和DPPH自由基清除率为指标,测定各组分的抗氧化能力,发现A1~A3组分具有较强的抗氧化能力。
将A1组分依次经过正相硅胶柱层析、Sephadex LH-20凝胶柱层析(石油醚(沸程60~90 ℃)、二氯甲烷、甲醇体积比为2∶1∶1)、半制备高效液相色谱仪(色谱柱为ZORBAX Eclipse XDB柱(250 mm×9.4 mm,5 μm);流动相为70%(体积分数,后同)甲醇水溶液+0.1%甲酸溶液;流速3.0 mL/min;紫外检测波长210 nm;保持25 min)制备得到化合物1(29 mg、19.77 min(保留时间,后同))、化合物2(11 mg、22.09 min)、化合物3(15 mg、9.10 min)及其混合物。将混合物通过半制备高效液相色谱仪(流动相为51%甲醇水溶液+0.1%甲酸溶液,其他条件同上)制备得到化合物4(13 mg、96.30 min)。将A2组分反复进行凝胶柱纯化,最终得到化合物9(600 mg)及其混合物,所得混合物再用半制备高效液相色谱仪(流动相为72%甲醇水溶液+0.1%甲酸溶液,其他条件同上)制备得到化合物8(50 mg、35.14 min)。将A3组分反复进行凝胶柱洗脱,然后用半制备高效液相色谱仪(流动相为51%甲醇水溶液+0.1%甲酸溶液,其他条件同上)制备得到化合物5(16 mg、30.86 min)、化合物6(200 mg、35.08 min)和化合物7(15 mg、50.13 min)。
1.3.3 化学结构鉴定方法
分别称取约10 mg化合物1~9于样品瓶中,用干燥器将样品中的水分和有机溶剂充分干燥。化合物1、2、4、5、7、8和9分别用1 mL氘代二甲基亚砜((dimethyl sulfoxide,DMSO)-d6)溶解,化合物3和6分别用1 mL氘代氯仿(CDCl3)溶解,溶解后的化合物尽可能多地转入洁净干燥的核磁管中密封。将样品瓶中剩余的样品加入1 mL分析用甲醇溶解进行质谱分析。
1.3.4 DAR衍生物对ABTS阳离子自由基清除能力测定
ABTS阳离子自由基清除能力测定方法参考Li Xican等[21]的方法并稍作改动。以商用抗氧化剂TBHQ为阳性对照。将0.35 mL 7.4 mmol/L的ABTS与0.35 mL 2.6 mmol/L的K2S2O8充分混匀,于暗处室温放置12 h制得ABTS阳离子自由基母液。将母液用95%乙醇稀释45~50 倍以使稀释后的工作液在734 nm波长处的吸光度为0.70±0.02。分别取160 µL ABTS工作液和40 µL不同质量浓度(1.56~100 μg/mL)的样品溶液充分摇匀后静置6 min,然后测定734 nm波长处的吸光度As。ABTS阳离子自由基工作液空白吸光度为Ac,不同质量浓度样品溶液的吸光度为Ao。ABTS阳离子自由基清除率按式(1)计算。
1.3.5 DAR衍生物对DPPH自由基清除能力测定
DPPH自由基清除能力测定方法参考Zhou Li等[22]的方法并稍作改动。以TBHQ为阳性对照,分别将100 µL新制备的0.1 mmol/L DPPH溶液与100 µL不同质量浓度(1.56~100 μg/mL)的样品溶液充分摇匀后于室温条件下避光静置30 min,然后测定在517 nm波长处的吸光度As。DPPH自由基工作液空白吸光度为Ac,不同质量浓度样品溶液的吸光度为Ao。DPPH自由基清除率按式(2)计算。
1.3.6 DAR衍生物对花生油氧化稳定性的影响测定
DAR衍生物对花生油氧化稳定性的影响测定采用Schaal烘箱法。将3 mg的样品和3 mg的阳性对照TBHQ分别与6 g花生油充分摇匀后置于60 ℃恒温烘箱中,按照GB/T 5009.37—2003《食用植物油卫生标准的分析方法》[23]中的方法,每24 h测定1 次各处理样品的过氧化值(peroxide value,POV)。为探究不同质量分数样品对花生油氧化稳定性的影响,取效果最好的2 个样品分别调整其质量分数为0.05%、0.10%和0.20%,与6 g花生油充分摇匀后置于60 ℃恒温烘箱中,参照GB/T 5009.37—2003中的方法,每24 h测定1 次各处理样品的POV。
1.3.7 DAR衍生物的亲脂性测定
采用ChemDraw Standard 14.0软件分别绘制每个化合物的结构并生成.sdf文件,然后将.sdf文件导入ALOGPS 2.1软件中,计算每个化合物的亲脂性[24]。
所有数据均采用Microsoft Excel 2007和SPSS软件进行统计分析,结果以平均值±标准偏差表示,每个实验重复3 次。核磁共振(nuclear magnetic resonance,NMR)波谱采用MestReNova处理,化学结构式采用ChemDraw Standard 14.0软件绘制。DAR衍生物的亲脂性采用ALOGPS 2.1软件计算。
发光杆菌SN259菌株的发酵液用二氯甲烷萃取并收集二氯甲烷相,该相通过硅胶色谱柱层析、凝胶色谱柱层析和半制备高效液相色谱纯化后得到9 种化合物,化合物1~9结构如图1所示。

图1 化合物1~9的化学结构
Fig. 1 Chemical structures of compounds 1-9
化合物1:无色固体,高分辨电喷雾电离质谱(high resolution electrospray ionization-mass spectroscopy,HRESIMS)得到分子离子峰249.186 6 [M-H]-(计算值为249.185 4),可推出分子式为C16H26O2,不饱和度为4。1H NMR(600 MHz,DMSO-d6)谱中展示了DAR的特征信号峰,包括1 个四取代苯环信号δH 6.07(2H,s)和1 个次甲基信号δH 3.38(1H,m),另外还包括2 个甲基信号δH 1.22(6H,d,J=7.1 Hz)和2 个羟基信号δH 8.80(2H,s)(表1)。从异核多键相关(1H detected heteronuclear multiple bond correlation,HMBC)谱中可看出,H-7与C-1和C-3相关,H3-8和H3-9与C-2相关(图2),因此可确信这些信号为DAR的残基。在1H NMR谱中还显示出2 个甲基信号δH 0.84(6H,d,J=6.6 Hz)、3 个亚甲基信号(δH 1.46 (2H,m)、δH 1.28(2H,dd,J=15.2,7.7 Hz)和δH 1.18(2H,dd,J=15.4,6.9 Hz))和1 个次甲基信号δH 1.51(1H,m)(表1)。在13C NMR谱中展示了6 个碳原子信号,包括2 个甲基碳、3 个亚甲基碳和1 个次甲基碳,并根据这些信号在HMBC谱和1H-1H化学位移相关谱(1H-1H chemical shift correlation spectroscopy,1H-1H COSY)中显示的相关性,推断出这些基团的连接次序(图2)。最后由HMBC谱图中可知1 个亚甲基信号(δH 2.31(2H,t,J=7.6 Hz))与C-4和C-6相关,因此推断出C-10与C-5连接(图2)。因此得出化合物1的结构如图1所示,并将其命名为temperatacinol A。
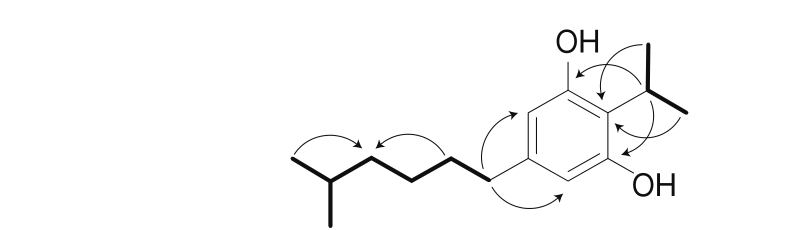
图2 化合物1的COSY(加黑)和HMBC(箭头)主要相关信号
Fig. 2 Key signals such as COSY (bold) and HMBC (arrows) in NMR spectroscopy of compound 1
化合物2:无色固体,HRESI-MS得到分子离子峰249.185 6 [M-H]-(计算值为 249.185 4),可推出分子式为C16H26O2,不饱和度为4。通过仔细比较化合物1和化合物2的1H和13C NMR谱可知,两者结构非常相似,其中不同的是化合物2比化合物1少1 个甲基信号而多1 个亚甲基信号。通过进一步分析HMBC谱、异核单量子关系(heteronuclear single quantum coherence,HSQC)谱和1H-1H COSY谱最终确定化合物2的结构如图1所示,并将其命名为temperatacinol B。
化合物3:无色固体,HRESI-MS得到分子离子峰223.169 9 [M-H]+(计算值为223.169 8),可推出分子式为C14H22O2,不饱和度为4。通过仔细比较化合物2和化合物3的1H和13C NMR谱可看出,两者结构非常相似,其中不同的是化合物3比化合物2少2 个亚甲基信号。通过进一步分析HMBC谱、HSQC谱和1H-1H COSY谱最终确定化合物3的结构如图1所示,并将其命名为temperatacinol C。
化合物4:通过比较该化合物的低分辨质谱和1H NMR(400 MHz,DMSO-d6)可发现其数据与文献[25]报道的基本一致,因此确定化合物4的结构如图1所示,并将其命名为temperatacinol D。
根据文献[19]可知,化合物5~9的结构已被鉴定报道。
总地来说,从发光杆菌SN259中分离纯化得到9 个DAR衍生物。根据NMR和MS分析确定化合物的结构,其中化合物1为新发现化合物,化合物2和3已有对发光杆菌代谢产物的高效液相色谱-质谱分析报道[26],但为首次被分离纯化得到。
表1 化合物1~3的核磁数据
Table 11H (600 MHz) and13C (150 MHz) NMR data of compounds 1–3
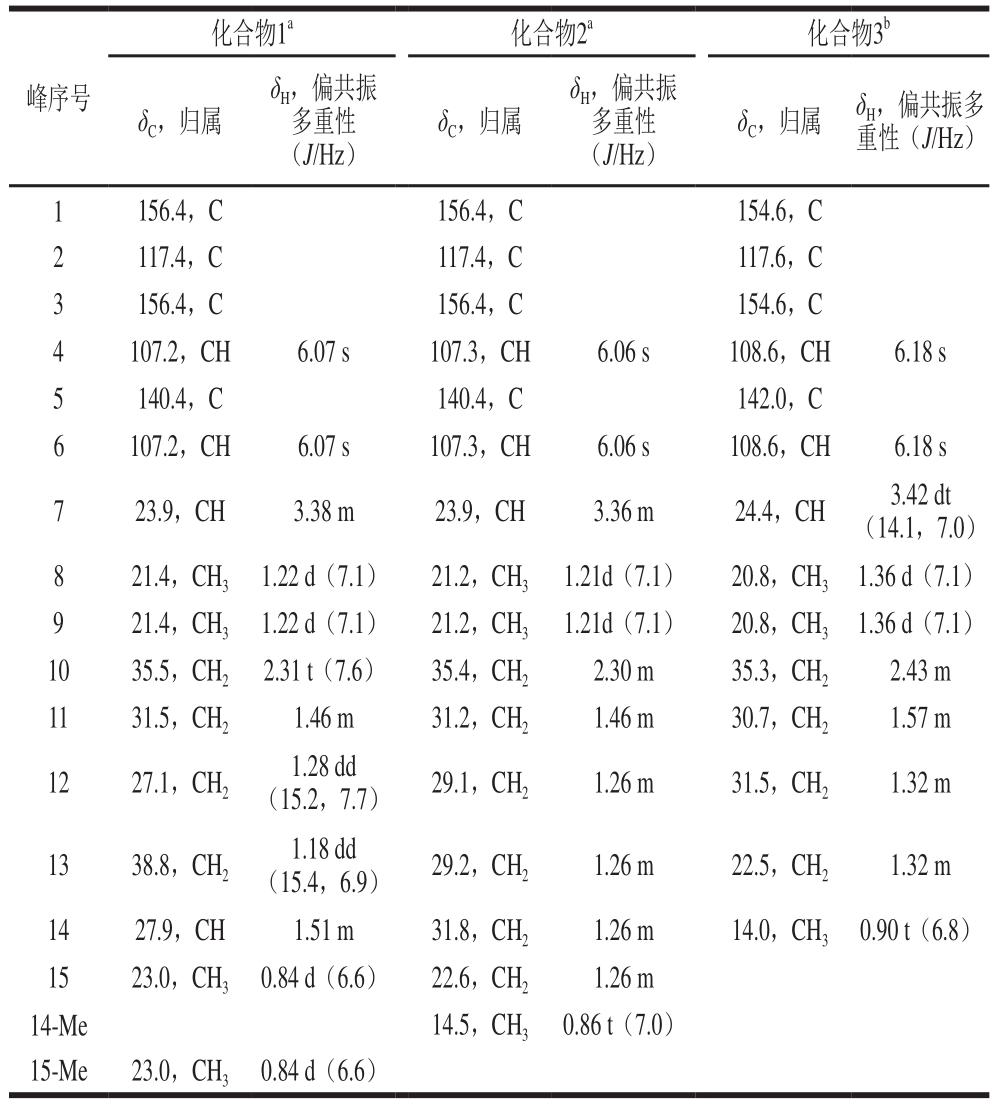
注:a.核磁检测溶剂为DMSO-d6;b.核磁检测溶剂为CDCl3。
化合物1a 化合物2a 化合物3b峰序号 δC,归属δH,偏共振多重性(J/Hz)δC,归属δH,偏共振多重性(J/Hz)δC,归属 δH,偏共振多重性(J/Hz)1 156.4,C 156.4,C 154.6,C 2 117.4,C 117.4,C 117.6,C 3 156.4,C 156.4,C 154.6,C 4 107.2,CH 6.07 s 107.3,CH 6.06 s 108.6,CH 6.18 s 5 140.4,C 140.4,C 142.0,C 6 107.2,CH 6.07 s 107.3,CH 6.06 s 108.6,CH 6.18 s 7 23.9,CH 3.38 m 23.9,CH 3.36 m 24.4,CH 3.42 dt(14.1,7.0)8 21.4,CH3 1.22 d(7.1) 21.2,CH3 1.21d(7.1) 20.8,CH3 1.36 d(7.1)9 21.4,CH3 1.22 d(7.1) 21.2,CH3 1.21d(7.1) 20.8,CH3 1.36 d(7.1)10 35.5,CH2 2.31 t(7.6) 35.4,CH2 2.30 m 35.3,CH2 2.43 m 11 31.5,CH2 1.46 m 31.2,CH2 1.46 m 30.7,CH2 1.57 m 12 27.1,CH2 1.28 dd(15.2,7.7) 29.1,CH2 1.26 m 31.5,CH2 1.32 m 13 38.8,CH2 1.18 dd(15.4,6.9) 29.2,CH2 1.26 m 22.5,CH2 1.32 m 14 27.9,CH 1.51 m 31.8,CH2 1.26 m 14.0,CH3 0.90 t(6.8)15 23.0,CH3 0.84 d(6.6) 22.6,CH2 1.26 m 14-Me 14.5,CH3 0.86 t(7.0)15-Me 23.0,CH3 0.84 d(6.6)
对9 个化合物的ABTS阳离子自由基和DPPH自由基清除能力进行测试,其抗氧化能力用商用抗氧化剂TBHQ作对照,每个化合物的抗氧化能力用ABTS阳离子自由基和DPPH自由基清除率达到50%时化合物的有效浓度(half maximal effective concentration,EC50)表示。由表2可知,对于ABTS阳离子自由基清除能力,化合物1、8、9比阳性对照组TBHQ更好,其EC50分别为(4.95±0.11)、(6.17±0.09)、(4.55±0.07)µg/mL。对于DPPH自由基清除能力,化合物9的较好,其EC50为(26.74±1.86)µg/mL。TBHQ在ABTS阳离子自由基和DPPH自由基清除实验中的EC50分别为(6.25±0.02)、(6.40±0.50)µg/mL。通过比较2 个实验可以看出,化合物5的抗氧化能力最差,其EC50分别为(16.24±0.24)、(427.33±0.77)µg/mL,可推测酰胺基取代羟基在很大程度上降低了化合物的抗氧化活性。Won等[27]报道白藜芦醇的酚羟基被取代会降低其抗氧化活性。比较化合物7和9的抗氧化能力,可推测出取代R6上的羟基会增强化合物的抗氧化活性。比较化合物8和9的抗氧化能力,可推测出C-2上连接异丙基比连接已基有助于提高化合物的抗氧化能力。比较化合物1、2、3、4和9的抗氧化能力,可推测出C-5上连接苯乙烯基比连接烷基链有助于提高化合物的抗氧化能力。比较化合物1和2的抗氧化能力,可推测出当C-5上连接烷基链的碳原子数相同时,有支链的化合物抗氧化活性更好。
表2 化合物1~9的ABTS阳离子自由基和DPPH自由基清除能力、亲脂性和对花生油氧化稳定性的影响
Table 2 ABTS cation and DPPH radical scavenging activity and lipophilicity of compounds 1–9 and peanut oil oxidation stability in the presence of each of them
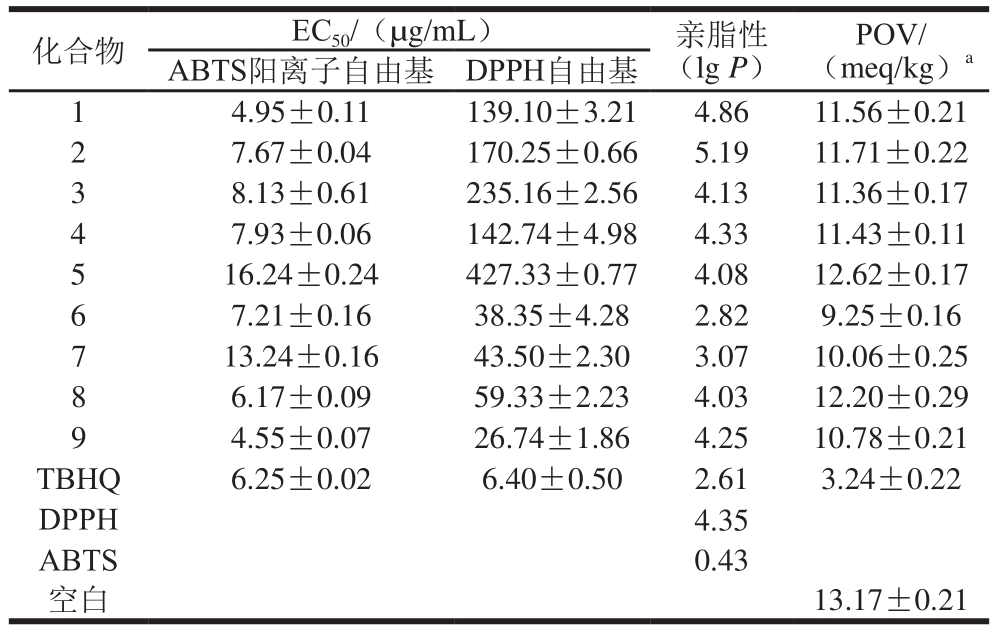
注:a.质量分数为0.05%的化合物1~9对240 h内花生油氧化稳定性的影响;lgP.该化合物在辛醇-水中分配系数的对数。
化合物 EC50/(µg/mL) 亲脂性(lg P)POV/(meq/kg)a ABTS阳离子自由基 DPPH自由基4.95±0.11 139.10±3.21 4.86 11.56±0.21 2 7.67±0.04 170.25±0.66 5.19 11.71±0.22 3 8.13±0.61 235.16±2.56 4.13 11.36±0.17 4 7.93±0.06 142.74±4.98 4.33 11.43±0.11 5 16.24±0.24 427.33±0.77 4.08 12.62±0.17 6 7.21±0.16 38.35±4.28 2.82 9.25±0.16 7 13.24±0.16 43.50±2.30 3.07 10.06±0.25 8 6.17±0.09 59.33±2.23 4.03 12.20±0.29 9 4.55±0.07 26.74±1.86 4.25 10.78±0.21 TBHQ 6.25±0.02 6.40±0.50 2.61 3.24±0.22 DPPH 4.35 ABTS 0.43空白13.17±0.21 1
为探究DAR衍生物对花生油氧化稳定性的影响,首先将质量分数为0.05%的化合物和商用抗氧化剂TBHQ添加在花生油中,结果如表2所示。在240 h时空白组花生油的POV为(13.17±0.21)meq/kg,添加DAR衍生物花生油的POV均低于空白组,其中化合物6的抗氧化效果最好,POV为(9.25±0.16)meq/kg。而从表3可以看出,化合物质量分数越高对花生油的抗氧化性越好。同样油脂中茶多酚和橄榄饼等提取物的添加量越大,抗氧化效果越好[28]。当化合物6和7的质量分数增加到0.20%时花生油的POV分别为(5.66±0.23)、(4.96±0.21)meq/kg。Baur[29]和Torres[30]等报道酚类化合物的亲水性限制了白藜芦醇在亲脂性系统中的应用,并认为其可能在脂肪食品、药物和化妆品中表现出降低的抗氧化活性。因此,推测通过具有不同链长和不同饱和度的脂肪酸修饰化合物6、7的结构可以增加其抗氧化活性。另外,由于该类化合物本身含有酚羟基,稳定性差,在空气中易被氧化,后续可以继续探究使用其他制剂如微乳剂、水凝胶、纳米乳等[31-32]是否可有效提高其对花生油的抗氧化性。
表3 不同质量分数的化合物6和7在240 h内对花生油氧化稳定性的影响
Table 3 Oxidative stability of peanut oil with different concentrations of compounds 6 and 7 during 240 h
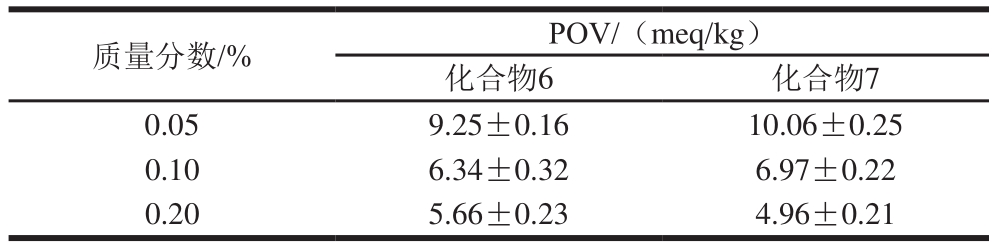
质量分数/% POV/(meq/kg)化合物6 化合物7 0.05 9.25±0.16 10.06±0.25 0.10 6.34±0.32 6.97±0.22 0.20 5.66±0.23 4.96±0.21
由表2中可知,化合物1~9均有较好的亲脂性,从整体上看化合物对花生油氧化稳定性的影响和亲脂性呈负相关。其中化合物5和8不符合该关系,其对花生油氧化稳定性效果较差,同时这2 个化合物的ABTS阳离子自由基和DPPH自由基清除能力也较差,因此可推断化合物的官能团对其抗氧化能力影响较大。比较化合物1~4的抗氧化能力可推断出C-5上连接不同的烷基链时对化合物的抗氧化能力影响较小,并且由于实验误差导致实验结果并不符合化合物的亲脂性和氧化稳定性呈负相关。由于DAR具有丰富的生物活性,因此在食用油中添加该类物质不仅可以提高食用油的氧化稳定性,还可以提高其保健功能。有研究报道绿茶酚类化合物添加在特级初榨橄榄油中显著改善了橄榄油的抗动脉粥样硬化功能,从而显著降低了动脉粥样硬化的发生率[33]。
为寻找来源广、高效的天然抗氧化剂,根据活性追踪法利用硅胶柱层析、凝胶柱层析、高效液相色谱等化学分离技术对发光杆菌SN259的发酵液进行分离纯化,得到9 种化合物并通过波谱技术和相关文献调研确定其结构,其中化合物1为新发现化合物,化合物2和3已有对发光杆菌代谢产物的高效液相色谱-质谱分析报道,但为首次被分离纯化得到。对化合物进行了ABTS阳离子自由基、DPPH自由基清除实验和花生油氧化稳定性检测,采用商用抗氧化剂TBHQ作为阳性对照。在ABTS阳离子自由基清除实验中,化合物1、8和9的抗氧化能力均优于阳性对照,其EC50分别为(4.95±0.11)、(6.17±0.09)、(4.55±0.07)µg/mL,TBHQ的EC50为(6.25±0.02)µg/mL。在花生油氧化稳定性实验中,化合物6与TBHQ添加量相同时,其抗油脂氧化能力显著弱于TBHQ,然而添加量为0.2%时,其抗氧化能力同TBHQ相当。进一步探究后发现化合物对油脂抗氧化能力与其亲脂性呈负相关。在本研究中发现化合物的亲脂性和官能团是影响化合物抗氧化能力的重要指标,这为未来简洁、快速寻找新抗氧化剂提供了一定的参考依据。
[1] 朱臻怡, 冯民, 熊华萱, 等. 食品中抗氧化剂的应用及其检测技术研究进展[J]. 化学分析计量, 2013, 22(5): 104-108. DOI:10.3969/j.issn.1008-6145.2013.05.031.
[2] KOHEN R, NYSKA A. Oxidation of biological systems: oxidative stress phenomena, antioxidants, redox reactions, and methods for their quantification[J]. Toxicologic Pathology, 2002, 30: 620-650.DOI:10.1080/01926230290166724.
[3] LAI L S, CHOU S T, CHAO W W. Studies on the antioxidative activities of Hsian-tsao (Mesona procumbens Hemsl) leaf gum[J].Journal of Agricultural and Food Chemistry, 2001, 49: 963-968.
[4] 吕双双, 李书国. 植物源天然食品抗氧化剂及其应用的研究[J].粮油食品科技, 2013, 21(5): 60-65. DOI:10.16210/j.cnki.1007-7561.2013.05.020.
[5] 左玉, 张国娟, 惠芳, 等. 食品抗氧化剂的研究进展[J]. 粮食与油脂,2018, 31(5): 1-3.
[6] 黄海兰, 王国明, 李增新, 等. 鸭跖草抗氧化成分提取及其活性研究[J].食品科学, 2008, 29(9): 55-58.
[7] GHELICHI S, SØRENSEN A M, GARCÍA-MORENO P J, et al.Physical and oxidative stability of fish oil-in-water emulsions fortified with enzymatic hydrolysates from common carp (Cyprinus carpio) roe[J]. Food Chemistry, 2017, 237: 1048-1057. DOI:10.1016/j.foodchem.2017.06.048.
[8] KIM S I, SIM K H, CHOI H. A comparative study of antioxidant activity in some Korean medicinal plant used as food materials[J].Molecular & Cellular Toxicology, 2010, 6: 279-285. DOI:10.1007/S13273-010-0038-X.
[9] SHAHIDI F, ZHONG Y. Measurement of antioxidant activity[J].Journal of Functional Foods, 2015, 18: 757-781. DOI:10.1016/j.jff.2015.01.047.
[10] GARCÍA-MORENO P J, GUADIX A, GUADIX E M, et al. Physical and oxidative stability of fish oil-in-water emulsions stabilized with fish protein hydrolysates[J]. Food Chemistry, 2016, 203: 124-135.DOI:10.1016/j.foodchem.2016.02.073.
[11] 张泽生, 郭擎, 高云峰, 等. 天然抗氧化剂的产业化进展[J].食品研究与开发, 2017, 38(7): 206-209. DOI:10.3969/j.issn.1005-6521.2017.07.046.
[12] ELEFTHERIANOS I G. Novel antibiotic compounds produced by the insect pathogenic bacterium Photorhabdus[J]. Recent Patents on Anti-infective Drug Discovery, 2009, 4(2): 81-89.DOI:10.2174/157489109788490280.
[13] KANDA N, ISHIZAKI N, INOUE N, et al. DB-2073, a new alkylresorcinol antibiotic: I. taxonomy, isolation and characterization[J]. Journal of Antibiotics, 1975, 28(12): 935-942.DOI:10.7164/antibiotics.28.935.
[14] KITAHARA T, KANDA N. DB-2073, a new alkylresorcinol antibiotic:II. the chemical structure of DB-2073[J]. The Journal of Antibiotics,1975, 28(12): 943-946. DOI:10.7164/antibiotics.28.943.
[15] CAZORLA F M, DUCKETT S B, BERGSTRÖM E T, et al.Biocontrol of avocado dematophora root rot by antagonistic Pseudomonas fluorescens PCL1606 correlates with the production of 2-hexyl 5-propyl resorcinol[J]. Molecular Plant-Microbe Interactions,2006, 19(4): 418-428. DOI:10.1094/MPMI-19-0418.
[16] KUMAR S N, NAMBISAN B, KUMAR B D, et al. Antioxidant and anticancer activity of 3,5-dihydroxy-4-isopropylstilbene produced by Bacillus sp.N strain isolated from entomopathogenic nematode[J]. Archives of Pharmacal Research, 2013, 2013: 1-11. DOI:10.1007/s12272-013-0207-2.
[17] BI Y H, YU Z G. Diterpenoids from Streptomyces sp. SN194 and their antifungal activity against Botrytis cinerea[J]. Journal of Agriculture and Food Chemistry, 2016, 64: 8525-8529. DOI:10.1021/acs.jafc.6b03645.
[18] BI Y H, GAO C Z, YU Z G. Rhabdopeptides from Xenorhabdus budapestensis SN84 and their nematicidal activities against Meloidogyne incognita[J]. Journal of Agricultural and Food Chemistry,2018, 6(15): 3833-3839. DOI:10.1021/acs.jafc.6b03645.
[19] SHI D S, AN R, ZHANG W B, et al. Stilbene derivatives from Photorhabdus temperata SN259 and their antifungal activities against Phytopathogenic Fungi[J]. Journal of Agriculture and Food Chemistry,2017, 65: 60-65. DOI:10.1021/acs.jafc.6b04303.
[20] TIAN H, SHAFI J, JI M S, et al. Antimicrobial metabolites from Streptomyces sp. SN0280[J]. Journal of Natural Products, 2017, 80:1015-1019. DOI:10.1021/acs.jnatprod.6b01016.
[21] LI Xican, LIN Jing, GAO Yaoxiang, et al. Antioxidant activity and mechanism of Rhizoma cimicifugae[J]. Chemistry Central Journal,2012, 6(1): 140-150.
[22] ZHOU Li, WANG Yan, WANG Xiaolin, et al. MALDI-TOF/TOF mass spectrometric determination and antioxidative activity of purified phosphatidylcholine fractions from shrimp species[J]. Journal of Agricultural and Food Chemistry, 2017, 65: 1229-1238. DOI:10.1021/acs.jafc.7b00217.
[23] 卫生部. 食用植物油卫生标准的分析方法: GB/T 5009.37—2003[S].北京: 中国标准出版社, 2003: 304-312.
[24] TETKO I V, BRUNEAU P. Application of ALOGPS to predict 1-octanol/water distribution coefficients, logP, and logD, of AstraZeneca in-house database[J]. European Journal of Pharmaceutical Science, 2004, 93: 3103-3110. DOI:10.1002/jps.20217.
[25] FUCHS S W, BOZHÜYÜK K A J, KRESOVIC D, et al. Formation of 1,3-cyclohexanediones and resorcinols catalyzed by a widely occuring ketosynthase[J]. Angewandte Chemie International Edition, 2013, 52:4108-4112. DOI:10.1002/anie.201210116.
[26] BRAMEYERA S, KRESOVICB D, BODEB H B, et al.Dialkylresorcinols as bacterial signaling molecules[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112: 572-577. DOI:10.1073/pnas.1417685112/-/DCSupplemental.
[27] WON Y O, FEREIDOON S. Lipophilization of resveratrol and effects on antioxidant activities[J]. Journal of Agricultural and Food Chemistry, 2017, 65: 8617-8625. DOI:10.1021/acs.jafc.7b03129.
[28] TAGHVAEI M, JAFARI S M. Application and stability of natural antioxidants in edible oils in order to substitute synthetic additives[J].Journal of Food Science and Technology, 2015, 52(3): 1272-1282.DOI:10.1007/s13197-013-1080-1.
[29] BAUR J A, SINCLAIR D A. Therapeutic potential of resveratrol: the in vivo evidence[J]. Nature Reviews Drug Discovery, 2006, 5: 493-506. DOI:10.1038/nrd2060.
[30] TORRES P, POVEDA A, JIMENEZ-BARBERO J, et al.Regioselective lipase-catalyzed synthesis of 3-O-acyl derivatives of resveratrol and study of their antioxidant properties[J]. Journal of Agricultural and Food Chemistry, 2010, 58: 807-813.
[31] 张越, 高春辉, 韩玉翠, 等. 二苯乙烯类化合物的纳米乳及其制备方法: CN101822638A[P]. (2010-09-08)[2018-07-21]. http://www.pss-system.gov.cn/sipopublicsearch/patentsearch/showViewListjumpToView.shtml.
[32] 张越. 3,5-二羟基-4-异丙基二苯乙烯微乳剂及其制备方法:CN 102657610A[P]. (2012-09-12)[2018-07-21]. http://www.pss-system.gov.cn/sipopublicsearch/patentsearch/showViewListjumpToView.shtml.
[33] ROSENBLAT M, VOLKOVA N, COLEMAN R, et al.Antiatherogenicity of extra virgin olive oil and its enrichment with green tea polyphenols in the atherosclerotic apolipoprotein-E-deficient mice: enhanced macrophage cholesterol efflux[J]. The Journal of Nutritional Biochemistry, 2008, 19(8): 514-523. DOI:10.1016/j.jnutbio.2007.06.007.
Isolation, Identification and Antioxidant Activity of Stilbene Derivatives from Fermentation Broth of Photohabdus temperata SN259
WANG Baojuan, WANG Yu, SHI Danshu, et al. Isolation, identification and antioxidant activity of stilbene derivatives from fermentation broth ofPhotohabdus temperata SN259[J]. Food Science, 2019, 40(17): 79-84. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180821-226. http://www.spkx.net.cn