粉蕉后熟过程中香气品质变化及其关键基因表达特性
朱孝扬,李秋棉,罗 均,陈维信,陆旺金,李雪萍*
(华南农业大学园艺学院,亚热带农业生物资源保护与利用国家重点实验室,南方园艺产品保鲜教育部工程研究中心,广东省果蔬保鲜重点实验室,广东 广州 510642)
摘 要: 为深入了解粉蕉(MusaABB Pisang Awak)采后品质变化特征,本实验研究了粉蕉(‘广粉一号’)采后常温(25 ℃)贮藏过程中果实生理品质、不同成熟阶段果实香气物质变化及香气合成相关基因的表达特性。结果表明:粉蕉果实在采后2 d内硬度急剧下降,果实可溶性固形物质量分数以及可溶性糖含量都显著增加;果实在第6天完熟,第8天已经过熟,此阶段硬度降到很低,同时可溶性糖、总香气物质含量达到最高值,而可溶性固形物质量分数、氨基酸含量在第6天最高。未成熟粉蕉果实的挥发性物质种类及其含量较少,主要以C6~C9的醛类和醇类为主,而酯类极其微量;当果实完熟时挥发性物质含量明显增加,酯类含量明显上升,包括异丁酸异戊酯、乙酸己酯、乙酸异戊酯等,形成粉蕉特有的香气特征。对果实香气合成相关关键基因表达分析发现,脂氧合酶、醇酰基转移酶、醇脱氢酶、支链氨基酸转移酶和氢过氧化物裂解酶基因的表达随着果实成熟软化而增强,果实完熟后又迅速下降;丙酮酸脱羧酶基因的表达量在贮藏前期和后期较高,而在果实成熟的中期表达量很低,与果实在未熟期与过熟期醛类与醇类含量密切相关。本实验初步揭示粉蕉主要挥发性物质在成熟过程中的变化规律及其与相关生理活动的关系,为粉蕉采后的品质保持和保鲜技术提供了理论依据。
关键词: 粉蕉;成熟;品质;挥发性物质;基因表达
香蕉是我国热带亚热带地区大量栽培的水果之一,栽培品种除香牙蕉(属AAA群)外,还有大蕉、粉蕉(属ABB群)等特色品种。粉蕉(Musa ABB Pisang Awak)是芭蕉属的一个香蕉杂交栽培种,其果实外型美观、果肉质地柔滑口感好、风味特别,广受种植者和消费者喜爱。但是,粉蕉果实采后货架期短、不耐贮藏,容易腐烂劣变[1]。
果实香气成分的变化不但是衡量果实采后贮藏及货架寿命的重要指标之一,也是评价果实品质的一个重要因素。目前已知香蕉果实的香气成分有230 种以上,多为酯类、醇类和羰基化合物[2]。产于海南海口的香蕉果实中,主要的挥发性物质为酯类与酸类,还有少量的烷烃、烯烃、醇和酮类。其中,含量较高的有异戊酸2-甲基丁酯、丁酸异戊酯、丁酸己酯、亚油酸、丁酸丁酯和己酸异戊酯[3]。产于广州的巴西香蕉,绿熟阶段香蕉挥发性物质中绝大部分是醛类;完熟阶段酯类成分的比例明显增加,其中乙酸酯和丁酸酯是两类主要成分;随着香蕉由完熟向过熟阶段转变,酯类成分的比例发生明显变化,主要表现在乙酸酯类比例下降,同时丁酸酯类比例增加[4]。影响香蕉香气差异的因素很多,包括蕉类品种、种植区域和方式、采收时果实的饱满度和贮藏方式等[5]。而关于粉蕉成熟过程中香气物质变化及调控的研究报道较少[6]。
果实中香气物质的合成,主要通过脂肪酸氧化途径与氨基酸代谢途径[7],这两个途径中参与代谢的酶很多。在氨基酸代谢途径中,支链氨基酸在氨基酸转移酶(branched-chain amino acid transaminase,BCAT)的作用下生成支链酮,然后在丙酮酸脱羧酶(pyruvate decarboxylase,PDC)的作用下生成支链的醛,醛在醇脱氢酶(pyruvate decarboxylase,ADH)的作用下生成醇,醇与酰基辅酶A在醇酰基转移酶(acyltransferase,AAT)的作用下生成相应的酯类[8]。在此途径中,BCAT是支链酮生成的关键酶。脂氧合酶(lipoxygenase,LOX)参与了以脂肪酸为前体的直链酯的合成[9]。LOX催化亚油酸、亚麻酸产生C6、C9化合物(如己醇、己醛、己烯醛、壬醛、壬烯醛等)[9]。在苹果中,随着果实的成熟,香气合成相关基因LOX、HPL、ADH、PDC2、AAT、BACT等的表达都显著上调,而1-MCP处理显著延缓了果实成熟,抑制了这些香气合成相关基因的表达[10]。在香蕉果实中,这些基因在果实成熟过程中表达显著上调,与香气合成呈现密切的正相关关系[11]。上述研究结果都表明这些基因在果实香气合成中起着重要的作用。
虽然果实成熟过程香气成分分析及香气合成的分子机理在多种水果上已经有报道,然而粉蕉香气和风味较特别,其相关成熟过程香气物质的变化规律鲜有报道。本研究分析了粉蕉贮藏特性、粉蕉成熟过程中挥发性物质的变化和香气合成相关基因的表达特性以及它们之间的关系,以期揭示粉蕉主要挥发性物质在成熟过程的变化规律及其与相关生理活动的关系,为保持粉蕉采后的品质和保鲜技术提供理论依据。
1 材料与方法
1.1 材料与试剂
供试粉蕉‘广粉1号’(Musa ABB Pisang Awak cv.‘Guangfen No.1’),采自广东省番禺市南沙区。
各标准品(色谱纯)、所有分离用有机溶剂(均为国产分析纯) 上海生工生物工程技术服务有限公司;异菌脲 江苏快达农化股份有限公司;辉丰百克江苏辉丰农化股份有限公司;Invitrogen M-MLV逆转录酶试剂盒 美国Thermo Fisher Scientific公司;SYBR Premix ExTaq II试剂盒 宝生物工程(大连)有限公司。
1.2 仪器与设备
5542型果蔬材料硬度测试机 美国Instron公司;香气灰色萃取头 美国Supelco公司;G3900型气相色谱(gas chromatography,GC)仪 日本岛津有限公司;ICS3000多功能离子色谱仪 美国Dionex公司;IQ5荧光定量聚合酶链式反应(quantitative polymerase chain reaction,qPCR)仪 美国伯乐有限公司;BILON96-II超声波细胞粉碎机 上海比朗公司;855-350氨基酸自动分析仪 日本日立公司;Finnigan Trace GC-质谱(mass spectrometer,MS)联用仪 美国Thermo公司。
1.3 方法
1.3.1 材料预处理及取样
蕉指落梳后,挑选果形端正、无机械伤、无病虫斑和果实饱满度一致的果实,采收后立刻运回实验室。首先用自来水和含氯清洗剂清洗果实,然后用终质量浓度为500 mg/L的杀菌剂异菌脲和500 mg/L的辉丰百克混合液体浸泡果实1 min,取出晾干后,装入0.02 mm厚的聚乙烯防雾袋中,放于室温(24±1)℃贮藏,定期监测果实成熟进程,取样及测定挥发性物质的组分与含量。
1.3.2 成熟相关指标的测定
硬度测定:采用果蔬材料硬度测试机测定,探头直径为8 mm。每次重复3 个果实,将蕉横切后均匀测定3 个部位。
可溶性固形物质量分数测定:每个处理取3 根粉蕉,去皮后用榨汁机搅拌均匀,然后取5 g浆状果肉于烧杯中加5 mL蒸馏水,再经过两层纱布过滤,使用数显式糖度计进行测定,3 次重复。
成熟指数测定:香蕉的成熟分级参考Zhu Hong等[2]的方法,定期观察,测定成熟指数。
可溶性糖含量测定:可溶性糖的提取方法与分析条件参考王海蓝等[12]的方法。使用ICS3000多功能离子色谱仪对粉蕉果实糖组分和含量进行测定。
脂肪酸质量分数和氨基酸含量测定:参照Zhu Xiaoyang等[11]的方法进行测定。
1.3.3 果实香气物质的测定
参考朱虹等[4]的香气提取方法,选用灰色萃取头(50/30 μm DVB/CAR/PDMS)提取香蕉果实挥发性物质。选取果实不同成熟度时期进行香气物质分析:绿熟期(刚采收的生理成熟果实,采收0 d)、转色期(果实黄绿相间、由绿转黄时期,采收3 d)、完熟期(果实、果皮全部转黄,采收6 d);过熟期(果实开始衰老,采收8 d)。取香蕉果实中段的果肉,用榨汁机压榨成细小颗粒,取5 g果肉于20 mL采样瓶中,密封瓶盖,将萃取头插入瓶中顶空部分,与样品表面保持1.5 cm距离,萃取温度约为常温,萃取25 min。每个处理做3 次重复,取平均值。通过GC-MS技术,采集到的MS图在NIST谱库搜索,与有关文献进行核对,同时对峰面积进行归一化定量,得到各组分的相对含量。再结合保留时间、MS、实际成分和保留指数等参数对部分组分进一步确定,从而确定粉蕉果实中共有7 种主要挥发性物质:乙酸异戊酯、异戊酸异戊酯、异丁酸异戊酯、乙酸己酯、己醛、反-2-己烯醛以及己醇。总挥发性物质含量分别用不同时期挥发性物质峰面积总和表示。同时使用GC仪对这7 种挥发性物质在不同时期的含量进行分析,以标准样品的保留时间对GC谱图的组分峰定性,以峰面积法定量分析各组分在贮藏过程中的含量的变化,挥发性物质含量分别用各自物质的出峰面积表示。
G C条件:S u p e l c o W a x 1 0极性毛细管柱(30 m×0.53 mm,1 μm)。载气He(99.99%),流速1.0 mL/min,使用氢火焰离子化检测器检测,检测器温度250 ℃,进样口温度220 ℃,不分流,固相微萃取进样,热解吸脱附时间5 min。程序升温:40 ℃保持1 min,以2 ℃/min升温至60 ℃,保持2 min,再以20 ℃/min升温至180 ℃,保持1 min。
1.3.4 RNA提取、cDNA合成和qPCR分析
RNA的提取采用热硼酸法[13]。提取各粉蕉果肉组织样品的总RNA,按照Invitrogen M-MLV逆转录酶试剂盒说明书,合成cDNA第1链,贮存于-20 ℃低温冰箱中。
根据获得的各个基因的序列,设计荧光引物(表1),选取MaCAC为内参基因[14]。按SYBR Premix ExTaq II试剂盒说明配制PCR体系,运行程序为:94 ℃预变性5 min;95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸1 min,40 个循环。测定其Ct值,用2-ΔΔCt法计算样品中各个基因的相对表达量。
表1 引物序列
Table 1 Primer sequences used in this study

基因 核苷酸序列(5’-3’)LOX F:CATCTCACATCGAGAAGAATC R:TCAGAGTGCCATCATCCT BCAT F:CTGGCAAATAAACGATGGGTA R:CGGCACGGTGAAACTCATT HPL F:CCATAGAGCAGGGGATCG R:AAGGAGTGGAGGAGGATCT AAT F:GCGTACTTGGACATCATGG R:ACTACACTGCTGCTGGTT CAC F:CTCCTATGTTGCTCGCTTATG R:GGCTACTACTTCGGTTCTTTC PDC F:FACTGTGGGTATGAGTTCCAAATGC R:TTCCGTCCCCTATGCAAGCAAT ADH F:ATTCACAAACTCAGTCACGCCAAAC R:CAAGACCACCAAAAGGTTCAACAG
1.4 数据处理与分析
使用Excel 2000软件对数据进行整理,结果以平均值±标准差表示,采用SPSS 18软件进行数据分析,方差分析采用邓肯氏新复级差检验法。使用Sigmaplot 10.0软件作图。
2 结果与分析
2.1 粉蕉在贮藏期间的品质变化
表2 粉蕉采后贮藏期间的生理变化
Table 2 Physiological changes during postharvest ripening of Pisang Awak bananas

注:同行肩标字母不同表示差异显著(P<0.05)。表3同。
指标、外观 贮藏时间/d 0 2 4 6 8硬度/N 60.77±3.07a 22.10±2.45b 5.81±0.08c 4.87±0.31c 3.25±0.23c成熟指数 1.00±0.00d 2.60±0.53c 5.00±1.00b 5.60±0.53ab 6.23±0.25a可溶性固形物质量分数/% 5.42±0.08d 20.72±0.55c 25.18±1.70b 28.42±0.11a 28.08±0.13a外观images/BZ_107_431_1020_579_1145.pngimages/BZ_107_602_1024_734_1147.pngimages/BZ_107_766_1027_898_1150.pngimages/BZ_107_935_1023_1055_1149.pngimages/BZ_107_1092_1026_1225_1152.png
由表2可以看出,粉蕉果实不耐贮藏,在采后第6天已经完熟,在第8天就已达到过熟阶段。随着采后贮藏时间延长,果实硬度不断下降,果皮颜色从深绿转为黄绿至完熟时的金黄色。在室温条件下,粉蕉果实在采后2 d内硬度急剧下降,同时果实中的可溶性固形物质量分数显著提高;当果实过熟时,硬度降到最低,可溶性固形物质量分数达到最大值。
由图1可以看出,随着果实成熟,果实中总挥发性物质和可溶性糖的含量逐渐提高,总氨基酸含量先升高然后下降,而脂肪酸质量分数则呈现先下降后上升的趋势。
2.2 粉蕉采后主要挥发性物质相对含量的变化
表3 粉蕉果实采后不同成熟阶段挥发性物质成分的变化
Table 3 Changes in the contents of volatiles compounds in Pisang Awak bananas at various ripening stages

注:—.未检出。
组分 化合物名称 相对含量/%绿熟 转色期 完熟 过熟酯类1乙酸乙酯 — 1.78c 5.84b 9.38a 2乙酸丁酯 — 0.68b 6.23a 2.13b 3乙酸异戊酯 — 1.37c 18.81a 11.49b 4丁酸丁酯 — — 5.96a 0.05b 5己酸乙酯 — — 7.71a 1.27b 6乙酸己酯 — — 1.12a 0.35b 7异丁酸异戊酯 — 2.75c 14.6a 5.35b 8异戊酸异戊酯 — 0.27b 0.96a 0.35b 9肉豆蔻酸异丙酯 0.47a 0.08b — —10 邻苯二甲酸二异丙酯 0.41a — — —11 异戊酸丁酯 — 0.16a — —总量 0.88c 7.09b 61.23a 30.37b醛类12 2-己烯醛+反-2-己烯 — 75.89a 7.17c 49.98b 13 5-羟甲基糠醛 — — — 8.09a 14 己醛 3.56b14.99a— —15 反-4-壬烯醛 1.65a — — —16 Z-6-壬烯醛 2.83a — — —17 壬醛 1.68a— — —18 (E,Z)-2,6-壬二烯醛 13.37a 0.06b — —19 (E)-壬烯醛 — 0.11a — —20 癸醛 0.58a— — —21 十二醛 0.44a 0.06b — —总量 24.11c 91.11a 7.17d 58.07b醇类22 3-己烯-1-醇(叶醇) 2.81a — — —23 己醇 1.95a— — —24 (Z)-3-壬烯-1-醇 13.34a — — —25 2,6-壬二烯醇 6.12a — — —26 反-2-壬烯醇 5.74a — — —27 十二醇 0.24a — — —总量 30.2a — — —酸类28 十四烷酸 0.47a — 0.32a 0.13b 29 十六烷酸 1.05a 0.04c 0.79a 0.37b 30 顺-十八烯酸(油酸) — — — 0.08 31 十五烷酸 0.24a — — —32 十二烷酸 — 0.14a — —总量 1.76a 0.18d 1.11b 0.58c烷烃类33 十二烷 0.44a 0.06b — —34 十三烷 — 0.08a — —35 十四烷 0.47a 0.11b — —36 十五烷 0.59a 0.22b — —37 十六烷 — 0.20a — —38 十七烷 0.30a 0.20a — —39 十九烷 0.48a 0.09b — —40 二十烷 — 0.05a — —41 环十二烷 0.40a — — —总量 2.68a 1.01b — —其他42 甲苯 8.85a— — —
从表3可以看出,不同成熟阶段粉蕉果实具有的香气物质种类和相对含量有很大的差异,绿熟期香气物质种类少、含量少,随着果实成熟,香气物质含量逐渐增加,在完熟期和过熟期种类和含量达到最高。果实在刚采收后的绿熟阶段,其挥发性物质主要以醛、醇、酸以及烷烃类物质为主。其中(E,Z)-2,6-壬二烯醛以及(Z)-3-壬烯-1-醇为此阶段最主要的挥发性物质,占总挥发性物质的26.71%。此阶段的酯类物质形成较少,只出现两种含量较少的肉豆蔻酸异丙酯以及邻苯二甲酸二异丙酯。
当果皮处于褪绿转黄临界期(转色期),挥发性物质绝大部分是醛类,占总含量的91.11%。在这些醛类物质中以C6醛为主,如己醛、2-己烯醛、反-2-己烯醛等,而且主要以不饱和醛为主,这些醛具有类似青草味的典型气味,代表了转色期粉蕉的特征挥发性物质,而(E,Z)-2,6-壬二烯醛的含量与绿熟期相比下降。除此之外,在此阶段未检测到醇类,但存在烷烃类物质。同时,还出现了一些酯类,但含量较少,说明香气还没有完全形成。
在完熟阶段,果实中的醛类含量急剧下降,酯类成分的比例明显增加,这对于形成粉蕉浓郁的酯香气作用很大。其中乙酸酯、丁酸酯和3-甲基丁酸酯类(异丁酸酯)是3 类主要成分,如乙酸异戊酯的相对含量达到18.81%,异丁酸异戊酯相对含量达到14.6%。除此之外,此阶段的醇类以及烷烃类物质都没有检测到,而醛类物质含量急剧减少,部分醇类和醛类物质可能在后期形成相应的酯类物质(表3)。
随着粉蕉后熟衰老,酯类成分的种类未发生变化,但相对含量较完熟期时显著降低;过熟期醛类物质主要是2-己烯醛、反-2-己烯醛,这两者的总相对含量显著高于完熟期,5-羟甲基糠醛也在过熟期检测到,其他醛类种类与完熟阶段基本相同。酸类物质在整个贮藏过程中都有少量出现。
将上述结果结合Zhu Hong[2]、朱虹[4]、Zhu Xiaoyang[6]等对香蕉和粉蕉主要挥发性物质的分析,再结合保留时间、MS、实际成分和保留指数等参数,发现这些峰面积较大且香气阈值较低的异戊酸异戊酯、异丁酸异戊酯、乙酸己酯、乙酸异戊酯、己醛、反-2-己烯醛以及己醇对形成粉蕉不同阶段的特征香气具有关键性的影响。进而利用外标法分别对这几种特征挥发性物质在整个贮藏过程中的相对含量进一步进行定量分析。
如图2A所示,粉蕉在完熟期的特征挥发性物质主要是酯类物质。在果实后熟过程中,异戊酸异戊酯、异丁酸异戊酯、乙酸己酯、乙酸异戊酯的含量总体上呈现逐步上升的趋势,尤其是乙酸己酯和异丁酸异戊酯的含量上升较快,而异戊酸异戊酯的含量在整个贮藏期的变化不是很明显。图2B所示为粉蕉在未完全成熟时的特征挥发性物质,包括乙醇、己醛和反-2-己烯醛。在果实不断后熟过程中,己醛与反-2-己烯醛含量在贮藏后第2天达到最高值,随后下降,而己醇的含量则在采后贮藏过程中不断减少。直至第8天,果实达到完全成熟期时,这3 种物质几乎检测不到。
上述这些结果进一步证实,随着果实不断后熟,果实中糖不断积累,氨基酸含量先上升后下降,挥发性物质的组成及含量发生显著变化。这些变化的协同作用使得粉蕉在不同后熟阶段呈现明显的香气和风味品质的差异,形成了相应阶段的特征香气。
2.3 香气合成相关关键基因的表达分析
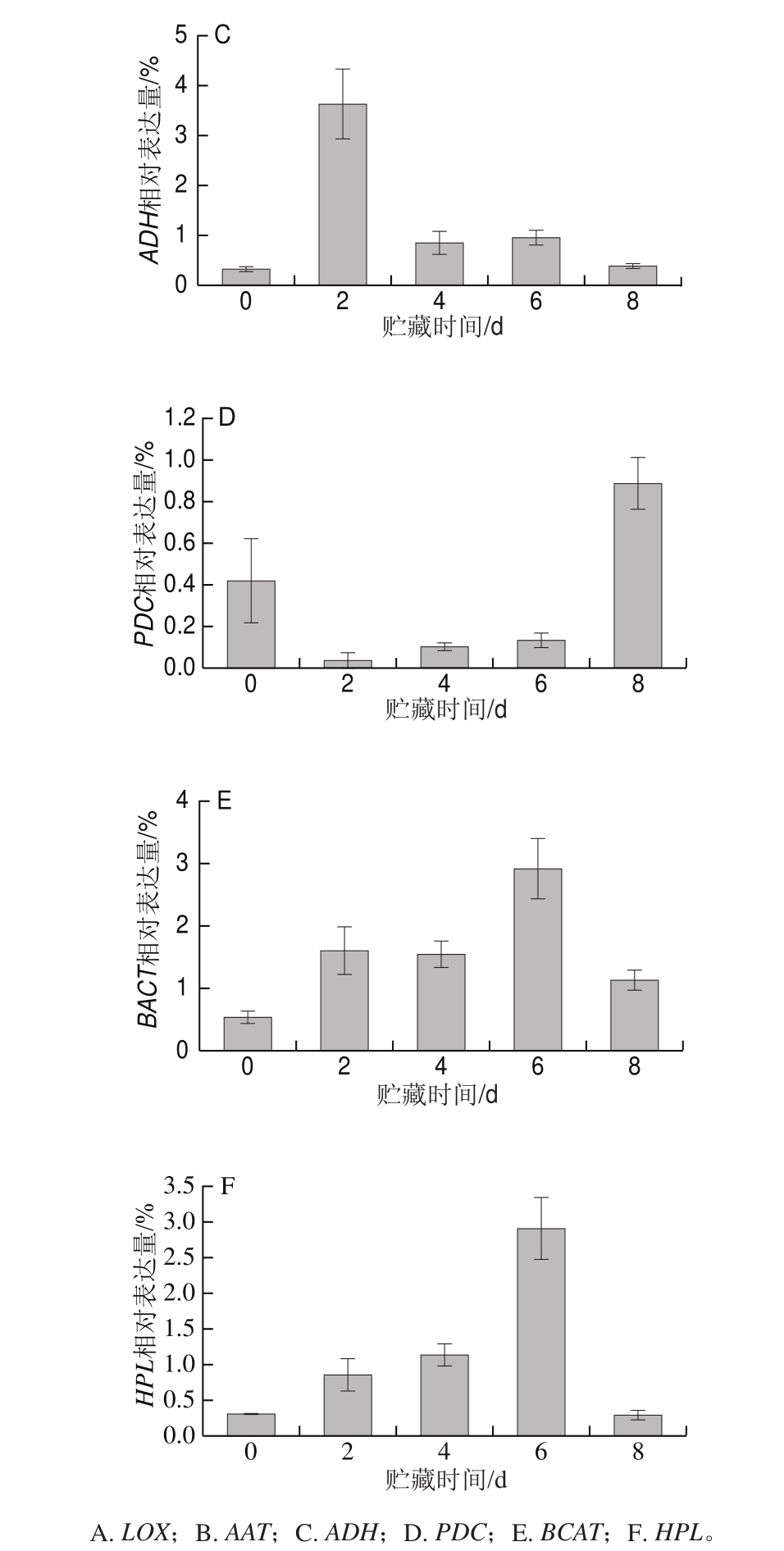
本课题组前期研究发现,基因LOX、AAT、ADH、PDC、BCAT和HPL在香蕉成熟过程中的表达显著上调,与香气物质的合成呈现出显著的相关性,为香气合成的关键基因[10-11]。LOX基因的表达量随着果实的后熟进程逐渐增强,完熟后迅速下降(图3A)。当果实向完熟转化时(0~4 d),AAT基因表达急剧上升,当果实完熟衰老时,表达量又迅速下降(图3B)。ADH基因的表达呈现先上升后下降的趋势,第2天达到最大,随后急剧下降(图3C)。PDC基因的表达量在贮藏前期与末期较高,而在果实成熟中期表达量很低(图3D),这可能是果实在未熟与过熟期,醛类与醇类含量比完熟时高的原因。BCAT与HPL基因在采后贮藏期间随着果实的后熟表达不断增强,在贮藏第6天(完熟时)表达量达到最大,完熟后衰老时表达量降低(图3E、F)。
3 讨 论
3.1 粉蕉采后生理生化特性的变化
已有国内学者报道,粉蕉乙烯的释放在采后第6天达到高峰,峰值为22.3 µL/(kg·h),第10天出现呼吸高峰,CO2释放量峰值为69.31 mL/(kg·h)。常温贮藏8 d,粉蕉开始出现过熟迹象[15],与本实验结果一致。对粉蕉淀粉颗粒性质的研究发现,粉蕉果肉淀粉色泽白,不易产生褐变[16]。果实的品质在很大程度上取决于果实中所含糖的种类与含量[17]。有研究表明,不同果实糖积累的方式存在明显差异。在发育过程中果实通常以淀粉、蔗糖和已糖的形式积累碳水化合物。香蕉果实发育后期可溶性糖的积累主要是蔗糖、果糖和葡萄糖的积累,其来源主要是淀粉的水解。采后蔗糖、葡萄糖、果糖含量不断上升,且这3 种糖含量差异不显著[18]。香蕉、粉蕉、大蕉3 个品种在刚采收与软熟期时,粉蕉的果肉淀粉含量均最高,大蕉次之,香蕉最少;可食时,香蕉果肉蔗糖含量大于还原性糖含量,粉蕉刚达可食成熟度时,蔗糖含量较高,之后以还原糖为主[15]。
本课题组前期研究发现,粉蕉和香蕉果实的成熟进程有很大差异,粉蕉果实采后极易成熟劣变。粉蕉果实常温贮藏4 d就出现一个明显的呼吸跃变,在第6天时出现乙烯高峰,第8天又出现一个呼吸高峰[6],此时由于果实已经进入过熟阶段且开始腐烂,病原微生物本身的呼吸作用和病原微生物侵入造成伤呼吸或伤乙烯加强,导致呼吸强度显著增加。这些结果与前人的研究结果[15]中呼吸跃变出现差异的原因可能是由于品种、采收时生理状态以及采后贮藏条件等不同,造成了果实耐藏能力不同。粉蕉果实中主要的可溶性糖为葡萄糖、果糖与蔗糖。在刚采收时,3 种糖的含量较低,随着果实的不断后熟,可溶性糖含量迅速增加。当果实完熟时主要以葡萄糖与果糖为主,蔗糖的含量有所下降[6]。
3.2 粉蕉挥发性物质的变化
粉蕉的后熟过程伴随着一系列生理生化反应,从而影响了果实香气挥发性物质的明显变化。粉蕉果实主要在呼吸跃变出现前后产生挥发性芳香物质,果实在后期产生大量的酯类,这是果香型香气的主要成分。有研究报道,不同产区、不同品种的香蕉香气的成分与含量不同[6]。全熟香蕉(6 级成熟度)中的特征香气物质主要有异戊醇、乙酸丁酯、乙酸异戊酯、榄香脂素、异丙醇、乙酸乙酯、丁酸丁酯、异丁酸异戊酯、丁酸异戊酯、2-甲基丁酸异戊酯、戊酸异戊酯、己酸异戊酯[2]。乙酸异戊酯被认为是最主要的特征香气物质[19]。香蕉在采后贮藏过程中,不同成熟阶段主要香气物质不同,果实中的主要挥发性物质为己醛、乙酸异丁酯、乙酸异戊酯、乙酸乙酯、丁酸丁酯以及乙醇。己醛的含量在采后贮藏过程中先上升后下降。各酯类物质在刚采收时含量很少或者几乎没有出现,随着果实的不断成熟,含量逐渐增加,后期含量达到最高[2]。沈玲[20]研究也发现,在绿硬香蕉果肉中主要是不饱和的烯醛和饱和的正己醛;完熟香蕉中酯类物质所占的峰面积比例增大,对形成完熟香蕉的特征香气起到了主要作用,因而完熟香蕉浓郁的香气主要是酯类香气,主要是乙酸、丁酸和戊酸等酸类和支链醇类脱羧形成的酯类,其中的乙酸异戊酯、丁酸异戊酯、丁酸丁酯、乙酸异丁酯4 种香气物质在香蕉完熟和后熟时期含量较高且阈值较低,呈现典型香气,推测这几种物质为香蕉的特征性香气物质。
本课题组前期对比了香蕉和粉蕉在后熟期间香气成分的变化,结果发现香蕉和粉蕉果实中都是随着果实成熟,香气物质不断增加,但粉蕉与香蕉香气物质的含量和种类在后熟阶段有很大的差异[6]。在绿熟阶段,香蕉和粉蕉果实香气物质都是主要以醛和醇类为主,且含量差异不显著,而到了成熟阶段,在粉蕉中,酯类物质含量的变化趋势是先缓慢上升,然后迅速增加。与此相反,香蕉呈现酯类物质含量先迅速增加、后缓慢增长的趋势,但总的变化都是随着果实的不断完熟,酯类物质的组分与相对含量均不断增加。成熟粉蕉富含乙酸酯与丁酸酯类物质,其次是一些甲基乙酸、甲基丙酸和甲基丁酸酯类,且有一些少量其他的酯类,如辛酸酯类与癸酸酯类,这与香蕉不同,从而形成粉蕉特有的香气[6]。本研究中测定的粉蕉果实成熟过程中香气物质和前期结果有少许差异,主要体现在果实绿熟时期的醛类物质包括己醛和2-己烯醛+反-2-己烯醛含量、成熟期一些酯类如丁酸酯含量存在一定差异,但是总体的香气物质含量和特征香气物质含量及变化趋势基本一致。相对于完熟期,过熟期果实中酯类物质含量减少,而醛类物质含量显著增加。总体而言,粉蕉果实香气物质变化的基本趋势为:粉蕉果实在未成熟阶段主要以C6的醛与醇为主,并且随着果实的不断成熟,其含量不断下降,且酯类物质含量较低;到果实处于完熟期时,酯类物质大量产生,其中乙酸乙酯、乙酸异戊酯、乙酸丁酯、乙酸己酯、3-甲基丙酸-3-甲基丁酯(异丁酸异戊酯)含量较高,且参考相关文献以及前人对香气阈值的研究[2,4,19],推测这几种物质为粉蕉的特征性香气物质。而综合所有的酯类发现,乙酸酯、丁酸酯以及异丁酸异戊酯为主要的酯类物质。
3.3 香气合成相关基因与香气的关系
果实中香气物质的合成主要通过脂肪酸氧化途径与氨基酸代谢途径[7]。在香气合成的氨基酸代谢途径中可能参与的酶有氨基酸转移酶、脱羧酶、乙醇脱氢酶;通过氨基酸合成途径产生的香气物质主要是前体物质氨基酸在转氨酶和PDC两种关键酶的作用下通过转氨基和脱羧基两步反应得到的[21]。在氨基酸代谢途径中的BCAT在哈密瓜果实(Cucumis melo L.)中首次被证明可能与支链氨基酸的转氨基反应有关[22]。在微生物中,支链氨基酸的转氨基作用被认为是支链挥发性香气物质合成途径的第一步[23]。成熟香蕉释放大量与3-甲基丁酯和3-甲基丙酯类似支链结构的挥发性香气物质,因此BCAT可能参与了香蕉支链挥发性香气物质的合成[24]。
目前认为,LOX参与了植物不饱和脂肪酸的代谢,为直链挥发性香气物质的生物合成提供了重要的底物。LOX途径中包括LOX、氢过氧化物裂解酶(hydroperoxide lyase,HPL)和ADH等酶类。首先,LOX参与了不饱和脂肪酸的过氧化作用,在直链香气物质的生物合成途径中起到了关键性的作用[25]。在HPL的作用下,果实能够进一步将LOX的产物降解为己烯醛或己醛类[26],然而其表达模式可能存在组织特异性,这说明LOX途径对于香气物质的合成起到重要的作用。
AAT是酯类合成的关键酶,催化酯类合成的最后一步。在AAT的作用下,底物酰基辅酶A能够通过转酰基化与醇类底物结合,形成酯类化合物。González等[27]研究表明,草莓果实采后AAT活性的变化与酯类(尤其是乙酸酯与己酸酯类)的总增加量呈正相关,且与香气相关的酯类含量变化一致,因此,AAT基因可能对于酯类的生物合成起重要作用。苹果果实在成熟期间酯类挥发性物质释放量增加,但是AAT活性没有大的变化。因此推测,酯类物质的增加还可能与底物的供给有关[28]。
果实香气物质的形成与果实的成熟进程有很大关系,乙烯作为果实成熟的主要信号因子,调控着香气物质合成相关基因的表达。在‘Golden Delicious’苹果果实中,乙烯参与AAT2基因调控酯类物质的形成[10,29]。粉蕉果实中,随着果实的不断成熟,伴随BCAT、AAT以及LOX基因的表达量不断增加,酯类物质的含量也在不断上升,尤其是乙酸酯类。当果实逐渐成熟到达完熟并进入衰老时,3 个基因的表达都表现为不同程度的降低,此时,乙酸己酯与异丁酸异戊酯的含量达到最大,乙酸异戊酯的含量有下降的趋势,这些结果与前人的结论[11]相同,表明BCAT、AAT以及LOX基因的表达可能受乙烯的调控,并对果实中酯类物质的生物合成起重要作用。
在果实中,ADH与香蕉香气中醇类和醛类的含量有着密切的联系[5]。本研究也发现,当果实中的醛类与醇类物质含量最高时(表3),ADH基因的表达量最大(图4C)。参与糖酵解途径中丙酮酸的脱羧反应,与果实在胁迫条件下的无氧呼吸密切相关,在PDC作用下,果实产生大量乙醇及乙酯类物质,并且在支链氨基酸的合成时,可将支链的酮酸催化为支链的醛类,进而形成支链的酯类;因此,其基因表达以及酶活性水平直接影响果实的香气品质[22]。粉蕉中,PDC基因在果实贮藏前期与后期表达量较大(图3D),前期的大量表达可能与醇类物质的产生有关,而后期可能与酯类物质的生成有关。
4 结 论
粉蕉果实总香气物质含量随着果实成熟不断增加,而醇类物质和醛类物质的合成主要在果实贮藏前期,酯类物质则是在果实成熟的中后期大量合成。除基因PDC外,香气合成关键基因的表达均随着果实的成熟呈现出现先上升后下降的趋势,其中ADH和PDC基因在果实贮藏前期的表达量很高,对应果实前期大量的醇类和醛类物质的产生,可能主要参与了粉蕉果实醛类和醇类物质的合成;而AAT、LOX、BACT和HPL基因表达高峰主要出现在果实成熟的中后期,对应果实在中后期特征香气物质酯类物质的合成,表明其可能主要参与了粉蕉果实酯类物质的合成。
本实验初步揭示了特色蕉类粉蕉的贮藏特性、成熟过程中挥发性物质的变化和香气合成相关关键基因的表达特性以及它们之间的关系,为粉蕉采后的保鲜技术提供理论指导,也为后续的粉蕉果实品质形成分子机制研究提供参考。
参考文献:
[1] 方仁, 龙兴, 王文林, 等. 9 个香蕉栽培品种在广西的引种试验初报[J].广东农业科学, 2013, 40(10): 42-44. DOI:10.3969/j.issn.1004-874X.2013.10.014.
[2] ZHU Hong, LI Xueping, YUAN Rencai, et al. Changes in volatile compounds and associated relationships with other ripening events in banana fruit[J]. Journal of Horticultural Science and Biotechnology,2010, 85(4): 283-288. DOI:10.1080/14620316.2010.11512669.
[3] 陶晨, 王道平, 杨小生, 等. 固相微萃取气相色谱质谱法分析香蕉中的香气成分[J]. 甘肃农业大学学报, 2010, 45(4): 139-141.DOI:10.3969/j.issn.1003-4315.2010.04.029.
[4] 朱虹, 陈玉芬, 李雪萍, 等. 顶空固相微萃取气-质联用分析香蕉的香气成分[J]. 园艺学报, 2007, 34(2): 485-488. DOI:10.3321/j.issn:0513-353X.2007.02.042.
[5] FELLMAN J K, MILLER T W, MATTINSON D S, et al. Factors that influence biosynthesis of volatile flavor compounds in apple fruits[J]. Hortscience, 2000, 32(3): 1026-1033. DOI:10.21273/HORTSCI.32.3.554C.
[6] ZHU Xiaoyang, LI Qiumian, LI Jun, et al. Comparative study of volatile compounds in the fruit of two banana cultivars at different ripening stages[J]. Molecules, 2018, 23(10): 2456. DOI:10.3390/molecules23102456.
[7] 李秋棉, 罗均, 李雪萍, 等. 果实香气物质的合成与代谢研究进展[J].广东农业科学, 2012, 39(19): 104-107. DOI:10.3969/j.issn.1004-874X.2012.19.035.
[8] SCHWAB W, DAVIDOVICH-RIKANATI R, LEWINSOHN E.Biosynthesis of plant-derived flavor compounds[J]. The Plant Journal,2008, 54(4): 712-732. DOI:10.1111/j.1365-313X.2008.03446.x.
[9] LEONE A, BLEVE-ZACHEO T, GERARDI C, et al. Lipoxygenase involvement in ripening strawberry[J]. Journal of Agricultural and Food Chemistry, 2006, 54(18): 6835-6844. DOI:10.1021/jf061457g.
[10] YANG Xiaotang, SONG Jun, DU Lina, et al. Ethylene and 1-MCP regulate major volatile biosynthetic pathways in apple fruit[J]. Food Chemistry, 2016, 194: 325-336. DOI:10.1016/j.foodchem.2015.08.018.
[11] ZHU Xiaoyang, LUO Jun, LI Qiumian, et al. Low temperature storage reduces aroma-related volatiles production during shelf-life of banana fruit mainly by regulating key genes involved in volatile biosynthetic pathways[J]. Postharvest Biology and Technology, 2018, 146: 68-78.DOI:10.1016/j.postharvbio.2018.08.015.
[12] 王海蓝, 李雪萍, 陈维信. 离子色谱法测定贮藏期间菠萝果实的糖分变化[J]. 保鲜与加工, 2010, 10(3): 37-41. DOI:10.3969/j.issn.1009-6221.2010.03.011.
[13] WAN C Y, WILKINS T A. A Modified hot borate method significantly enhances the yield of high-quality RNA from cotton (Gossypium hirsutum L.)[J]. Analytical Biochemistry, 1994, 223(1): 7-12.DOI:10.1006/abio.1994.1538.
[14] CHEN L, ZHONG H Y, KUANG J F, et al. Validation of reference genes for RT-qPCR studies of gene expression in banana fruit under different experimental conditions[J]. Planta, 2011, 234(2): 377-390.DOI:10.1007/s00425-011-1410-3.
[15] 李为为, 黄邦彦. 香蕉采后乙烯释放率和呼吸速率与后熟变化的研究[J]. 园艺学报, 1988, 1(15): 18-22.
[16] 赵国建, 鲍金勇, 杨公明. 三种香蕉淀粉颗粒性质的研究[J]. 食品科学, 2006, 27(2): 46-49. DOI:10.3321/j.issn:1002-6630.2006.02.004.
[17] 张秀梅, 孙光明, 杜丽清, 等. 菠萝果实生长发育过程中营养品质的变化[J]. 中国农学通报, 2008, 24(7): 457-461.
[18] 吴岚芳, 黄绵佳. 香蕉果实发育过程中糖代谢的研究[J].安徽农业科学, 2008, 36(12): 4862-4863. DOI:10.3969/j.issn.0517-6611.2008.12.030.
[19] BOUDHRIOUA N, GIAMPAOLI P, BONAZZI C. Changes in aromatic components of banana during ripening and air-drying[J].LWT-Food Science and Technology, 2003, 36(6): 633-642.DOI:10.1016/S0023-6438(03)00083-5.
[20] 沈玲. 1-MCP处理对香蕉后熟和香气形成的影响[D]. 广州: 华南农业大学, 2011: 29-37.
[21] KNEE M. Fruit quality and its biological basis[M]. Boca Raton(Florida): Sheffield Academic Press, 2002: 93-97.
[22] GONDA I, BAR E, PORTNOY V, et al. Branched-chain and aromatic amino acid catabolism into aroma volatiles in Cucumis melo L.fruit[J]. Journal of Experimental Botany, 2010, 61(4): 1111-1123.DOI:10.1093/jxb/erp390.
[23] DE PALENCIA P F, DE LA PLAZA M, AMÁRITA F, et al. Diversity of amino acid converting enzymes in wild lactic acid bacteria[J].Enzyme and Microbial Technology, 2006, 38(1): 88-93. DOI:10.1016/j.enzmictec.2005.04.018.
[24] WYLLIE S G, FELLMAN J K. Formation of volatile branched chain esters in bananas (Musa sapientum L.)[J]. Journal of Agricultural and Food Chemistry, 2000, 48(8): 3493-3496. DOI:10.1021/jf0001841.
[25] 张波, 李鲜, 陈昆松. 脂氧合酶基因家族成员与果实成熟衰老研究进展[J]. 园艺学报, 2007, 34(1): 245-250. DOI:10.3321/j.issn:0513-353X.2007.01.051.
[26] PORTA H, ROCHA-SOSA M. Plant lipoxygenases. physiological and molecular features[J]. Plant Physiology, 2002, 130(1): 15-21.DOI:10.1016/0929-7855(95)00020-Q.
[27] GONZÁLEZ M, GAETE-EASTMAN C, VALDENEGRO M, et al.Aroma development during ripening of Fragaria chiloensis fruit and participation of an alcohol acyltransferase (FcAAT1) gene[J].Journal of Agricultural and Food Chemistry, 2009, 57(19): 9123-9132.DOI:10.1021/jf901693j.
[28] VILLATORO C, ALTISENT R, ECHEVERRÍA G, et al. Changes in biosynthesis of aroma volatile compounds during on-tree maturation of ‘Pink Lady®’ apples[J]. Postharvest Biology and Technology, 2008,47(3): 286-295. DOI:10.1016/j.postharvbio.2007.07.003.
[29] LI D P, XU Y F, XU G M, et al. Molecular cloning and expression of a gene encoding alcohol acyltransferase (MdAAT2) from apple(cv. Golden Delicious)[J]. Phytochemistry, 2006, 67(7): 658-667.DOI:10.1016/j.phytochem.2006.01.027.
Evolution of Aroma Components and Key Gene Expression during Postharvest Ripening of Banana(Musa ABB Pisang Awak)
ZHU Xiaoyang, LI Qiumian, LUO Jun, CHEN Weixin, LU Wangjin, LI Xueping*
(State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources, Engineering Research Center of Southern Horticultural Products Preservation, Ministry of Education, Guangdong Provincial Key Laboratory of Postharvest Science of Fruits and Vegetables, College of Horticulture, South China Agricultural University, Guangzhou 510642, China)
Abstract: With the aim of gaining insights into the evolution of quality characteristics of banana (Musa ABB Pisang Awak)during postharvest ripening, the cultivar ‘Guangefen 1’ was used to investigate the changes in physiological quality, the changes in volatile aroma components with maturity and the changes in the expression patterns of the gene related to aroma synthesis during postharvest storage at room temperature (25 ℃). The results showed that fruit firmness decreased sharply within 2 days after harvest, and the contents of total soluble solids (TSS) and soluble sugar increased significantly. Full ripening was reached on the 6th day of storage. On the 8th day, fruit firmness was reduced to a very low level, and the contents of TSS, and total aroma substances were maximized while the maximum contents of TSS and amino acid occurred on the 6th day. A smaller number of volatile compounds were detected in immature bananas at lower levels, consisting mainly of C6–C9 aldehydes and alcohols along with a lesser amount of esters. The content of volatile compounds increased significantly with fruit ripening, including isoamyl isobutyrate, hexyl acetate, isoamyl acetate as esters, contributing to the unique aroma of Pisang Awak bananas. Expression analysis of the key genes involved in fruit aroma synthesis revealed that the expression ofLOX (lipoxygenase),AAT (alcohol acyltransferase),ADH (alcohol dehydrogenase),BCAT (branched chain amino acid transferase) and HPL (hydroperoxide lyase) genes increased with fruit ripening and softening, and then rapidly decreased. However, the expression level of PDC (pyruvate decarboxylase) was higher during the earlier and later storage periods, but lower at the mid-ripening stage, which may closely relate to the high contents of aldehydes and alcohols in unripe and overripe bananas. This present work preliminarily revealed the change profiles of the main volatile substances during banana fruit ripening process and its relationship with fruit physiological activities, which could provide a theoretical basis for postharvest quality maintenance of Pisang Awak bananas.
Keywords: Pisang Awak bananas; ripening; quality; volatile compounds; gene expression
收稿日期:2019-01-01
基金项目:现代农业产业技术体系建设专项(CARS-32-09);“珠江人才计划”引进高层次人才项目(2017GC010321);“十三五”国家重点研发计划项目(2016YFD0400103)
第一作者简介:朱孝扬(1985—)(ORCID: 0000-0002-7491-7124),男,副教授,博士,研究方向为果蔬采后生理和分子生物学。E-mail: xiaoyang_zhu@scau.edu.cn
*通信作者简介:李雪萍(1966—)(ORCID: 0000-0002-6184-3912),女,教授,博士,研究方向为果蔬采后贮运保鲜技术、采后病理及采后生物技术。E-mail: lxp88@scau.edu.cn
DOI:10.7506/spkx1002-6630-20190101-007
中图分类号:TS255.1
文献标志码:A
文章编号:1002-6630(2019)17-0096-08
引文格式:朱孝扬, 李秋棉, 罗均, 等. 粉蕉后熟过程中香气品质变化及其关键基因表达特性[J]. 食品科学, 2019, 40(17): 96-103.DOI:10.7506/spkx1002-6630-20190101-007. http://www.spkx.net.cn
ZHU Xiaoyang, LI Qiumian, LUO Jun, et al. Evolution of aroma components and key gene expression during postharvest ripening of banana (Musa ABB Pisang Awak)[J]. Food Science, 2019, 40(17): 96-103. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-20190101-007. http://www.spkx.net.cn