
黑果枸杞(Lycium ruthenicum Murr.)为茄科枸杞属多年生灌木,主要分布在我国宁夏、新疆、西藏、青海、内蒙古、甘肃等地区的盐碱地、干旱地,属于典型的荒漠植物。其早期作为一种藏药收载于《本草晶珠》、《四部医典》等藏医药著作中,用于治疗心热病、心脏病、月经不调、停经、高血压、内分泌失调等病症[1]。现代研究表明,黑果枸杞果实富含鲜见的酰化矮牵牛素花色苷[2-4],该类花色苷具有显著的抗氧化等生物活性,可清除各种自由基[5],有效地保护血管内皮细胞[6]、PC12神经细胞[7]的氧化损伤。同其他花色苷一样,黑果枸杞花色苷稳定性易受到外界环境如氧化剂、亲核试剂、酶、金属离子、温度以及光照等外界环境影响,因而限制了其在食品工业中的广泛应用[8-9]。
微胶囊技术是一种用天然或合成高分子将固体、液体等物质包埋形成微小粒子的技术。它使被包埋物质与外界环境隔离,有效保护了其原有活性,增加其贮存稳定性。因食品来源带电荷的多糖和蛋白质具有良好的生物降解性和无毒性,成为制备食品纳米输送载体的良好高分子材料[10-11]。其中,多糖类最常用的是壳聚糖(聚葡萄糖胺(1-4)-2-氨基-P-D-葡萄糖(chitosan,CS))和海藻酸钠。CS是甲壳素的脱乙酰衍生物,具有良好的亲水性、生物相容性和生物可降解性,对人体安全、无毒副作用。CS带有氨基,是唯一一种带正电荷的多糖。因此,CS在水溶液中能够通过静电相互作用与带负电的聚合物、大分子及一些多聚阴离子组装形成纳米胶囊,在包封生物活性分子的过程中发挥独特的作用[12]。
酪蛋白磷酸肽(casein phosphopeptides,CPP)是以牛乳酪蛋白为原料,用胰酶或胰蛋白酶水解的具有生物活性的多肽。CS与CPP复合凝胶体系包埋多酚类物质,能够有效地降低茶叶儿茶素等功效成分在胃肠道降解,增强其在小肠的吸收,从而提高其生物利用率[13]。此外,CPP与CS复合能够有效降低CS纳米颗粒的细胞毒性。Shoichet认为多肽修饰改性高分子聚合物能够有效地消除高分子本身的细胞排异性,从而增强材料的生物相容性[14]。
花色苷通过纳米微胶囊技术包埋,与游离花色苷溶液相比不会破坏其固有特性,且表现出更强的抗氧化损伤[15]、神经保护[16]、皮肤成纤维细胞暴露于长波长紫外线辐射下的潜在光保护能力[17]等生物活性,可能的机制在于纳米包埋能够提高其生物稳定性[18]。用于花色苷纳米包埋的材料有金属[16]和生物可降解大分子材料(CS[18]、聚乙二醇[19]、卵磷脂[20]、牛血清白蛋白[21]等)。本研究在上述研究的理论和技术基础上,通过CS与CPP复合凝胶体系制备CS-CPP黑果枸杞花色苷纳米颗粒,并优化其制备工艺,旨在通过微胶囊技术提高黑果枸杞花色苷的稳定性。同时,研究了CS-CPP黑果枸杞花色苷纳米颗粒对体外氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)诱导的人脐静脉内皮EAhy926细胞氧化损伤的保护作用,为黑果枸杞花色苷的生物利用提供理论和技术依据。
CS(分子质量100 kDa、脱乙酰率90%) 金壳生化试剂公司;CPP(含量99%) 湖北鑫源顺医药化工有限公司;黑果枸杞 国家枸杞工程技术研究中心。
EAhy926细胞 上海细胞库;胎牛血清 美国Gemini公司;高糖型DMEM培养基 美国Gibco公司;噻唑蓝(thiazolyl blue tetrazolium bromide,MTT)试剂盒南京凯基生物公司。
Amicon Ultra-15夹膜离心装置、超纯水制备系统美国Millipore公司;动态光散射仪 美国Brookhaven公司;Zetasizer Nano-ZlS90表面电位仪 美国Malvern公司;高速离心机 美国Beckman公司;NanoScope原子力显微镜 美国Veeco公司;全波长酶标仪、CO2培养箱、8025型pH计 美国Thermo Scientific公司;Axio Vert Al倒置生物显微镜 德国ZEISS公司。
1.3.1 黑果枸杞花色苷的提取及质量浓度测定
黑果枸杞花色苷的提取及质量浓度测定依据闫亚美等[5]方法。采用质量分数0.5%三氟乙酸-甲醇溶液提取、旋转蒸发仪浓缩制备黑果枸杞花色苷。采用pH示差法测定其质量浓度。
1.3.2 CS-CPP黑果枸杞花色苷纳米颗粒的制备
采用离子凝胶化法[13]进行黑果枸杞花色苷纳米颗粒制备。将不同质量浓度CS溶于体积分数1%醋酸溶液,超声辅助溶解,直到溶液呈透明状。用1 mol/L盐酸或氢氧化钠溶液调节CS和质量分数0.5% CPP溶液的pH值至4。室温条件下搅拌,将2 mg/mL黑果枸杞花色苷溶液等体积添加到质量分数0.5% CPP溶液中。然后分别将1.0、0.8、0.6、0.5、0.4、0.2 mg/mL CS溶液等体积加入CPP-黑果枸杞花色苷溶液中,使其自发形成CS-CPP黑果枸杞花色苷纳米颗粒。
1.3.3 CS-CPP黑果枸杞花色苷纳米颗粒粒径及分布的测定
动态光散射方法[20]测定CS-CPP黑果枸杞花色苷纳米颗粒的粒径及聚合分散系数。散射光角度固定在90°,测定温度为(25±1)℃。仪器所用光源是固定激光,操作波长658 nm,功率30 mW。所有实验均进行4 次。
1.3.4 CS-CPP黑果枸杞花色苷纳米颗粒表面电势的测定
应用Zetasizer Nano-ZlS90表面电位仪测定CS-CPP黑果枸杞花色苷纳米颗粒混合物的表面电势[13]。实验在(25±1)℃下进行4 次。
1.3.5 CS-CPP黑果枸杞花色苷纳米颗粒表面形态的观察
应用原子力显微镜观察纳米颗粒的表面形态[13]。样品溶液浸涂在新鲜清洁的云母片表面1 h,氮气吹干。弹簧常数为40 N/m。室温下观察颗粒表面形态。
1.3.6 CS-CPP黑果枸杞花色苷纳米颗粒中花色苷包封率和载药量的测定
花色苷包封率根据Dupeyrón等[19]的方法测定。将CS-CPP黑果枸杞花色苷纳米颗粒转入Amicon Ultra-15夹膜离心过滤装置中,离心,冷冻干燥被截留在过滤装置中的纳米颗粒。采用pH示差法测定滤液中花色苷的质量浓度。包封率、载药量的计算分别如式(1)、(2)所示。

1.3.7 花色苷体外释放曲线的测定
将1.3.2节获得的CS-CPP黑果枸杞花色苷纳米颗粒(CS最终质量浓度为0.25 mg/mL)用0.01 mol/L pH 7.0磷酸盐缓冲液(phosphate buffered saline,PBS)稀释,定容到2 mL,置于37 ℃水浴锅中。分别将孵育0、1、2、4、6、8 h的CS-CPP黑果枸杞花色苷纳米颗粒加入到Amicon Ultra-15夹膜离心过滤装置中,离心、收集滤液,检测滤液中花色苷的质量浓度[13]。花色苷体外释放率按式(3)计算。采用Higuchi方程计算纳米颗粒体外释放花色苷的释放曲线。
1.3.8 MTT法检测CS-CPP黑果枸杞花色苷纳米颗粒对EAhy926细胞增殖的影响
将浓度为4×105 个/mL的EAhy926细胞悬液接种于96 孔板,每孔加入100 µL,置于37 ℃、5% CO2培养箱内继续培养12 h后更换培养液,加入花色苷质量浓度分别为0(对照)、100、200、300、400 μg/L的CS-CPP黑果枸杞花色苷纳米颗粒,每个质量浓度梯度设5 个复孔。以只含培养基和CS-CPP黑果枸杞花色苷纳米颗粒、无细胞孔为空白。培养箱内孵育24 h后每孔加入50 µL 1×MTT溶液(1 000 mg/L),37 ℃培养箱内孵育4 h,弃去孔内含有MTT的培养液,加入150 µL二甲基亚砜,室温低速摇床振荡10 min使结晶物充分溶解,在全波长酶标仪550 nm波长处测定细胞OD值[2]。细胞相对存活率按式(4)计算。
式中:ODs为样品孔OD值;ODb为空白孔OD值;ODc为对照孔OD值。
1.3.9 CS-CPP黑果枸杞花色苷纳米颗粒对ox-LDL诱导的EAhy926细胞氧化损伤的影响
将浓度为4×105 个/mL的EAhy926细胞悬液接种于96 孔板,加入含花色苷质量浓度分别为0(对照)、50、100、150、200 μg/L的CS-CPP黑果枸杞花色苷纳米颗粒,每个质量浓度设5 个复孔。培养12 h后,除对照组外,每孔加入终质量浓度为80 mg/L的ox-LDL。以只含培养基和CS-CPP黑果枸杞花色苷纳米颗粒、无细胞孔为空白。37 ℃培养箱内孵育12 h后,每孔加入50 µL 1×MTT(1 000 mg/L),之后于37 ℃培养箱内孵育4 h,弃去孔内含有MTT的培养液,加入150 µL二甲基亚砜,室温低速摇床振荡10 min使结晶物充分溶解,用全波长酶标仪在550 nm波长处测定细胞OD值。细胞存活率按式(4)计算。
实验所有数据进行4 次重复,并使用SAS软件单因素方差分析进行统计分析,P<0.05为差异显著。使用Excel 2007软件作图。
一般情况下,理想的纳米微胶囊应具有较小的粒径[22-23]。由图1可见,CS质量浓度对CS-CPP黑果枸杞花色苷纳米颗粒粒径及分布影响较大。当CS质量浓度为0.10 mg/mL时,形成的颗粒粒径为290 nm,聚合分散系数为0.32;当CS质量浓度增加到0.20~0.30 mg/mL时,颗粒粒径下降到215~239 nm,聚合分散系数也下降到0.10~0.14,说明此时的CS-CPP黑果枸杞花色苷纳米颗粒体系比较稳定;当CS质量浓度升高到0.40~0.50 mg/mL时,CS-CPP黑果枸杞花色苷纳米颗粒粒径呈增大趋势,聚合分散系数也升高到0.26~0.37,说明该体系不稳定。贺博[24]制备的蓝莓花色苷纳米胶囊颗粒粒径为214 nm,与本实验所得较稳定的CS-CPP黑果枸杞花色苷纳米颗粒粒径差异较小。

图1 CS质量浓度对CS-CPP黑果枸杞花色苷纳米颗粒粒径及分布的影响
Fig. 1 Effect of CS concentration on particle size and polydispersity index of CS-CPP nanoparticles containing Lycium ruthenicum Murr. anthocyanins

图2 CS质量浓度对CS-CPP黑果枸杞花色苷纳米颗粒表面电势的影响
Fig. 2 Effect of CS concentration on zeta potential of CS-CPP nanoparticles containing Lycium ruthenicum Murr. anthocyanins
由图2可见,随着CS质量浓度的升高,形成的纳米颗粒表面电势开始增加,当CS质量浓度在0.20~0.30 mg/mL时,表面电势从36 mV升至38 mV。纳米颗粒表面电势与分子的稳定性有关,溶液中纳米微胶囊的表面电势绝对值越大,其凝胶状态相对越稳定,即溶解或分散可以抵抗聚集。相反,表面电势绝对值越小,纳米微胶囊越倾向于凝结或凝聚,即吸引力超过了排斥力,分散稳定性被破坏,易发生凝结或凝聚。当CS质量浓度大于0.20 mg/mL后,CS-CPP黑果枸杞花色苷纳米微胶囊具有较大的表面电势,表明其稳定性相对较好。该结果高于贺博[24]制得的羧甲基CS-CS盐酸盐纳米胶囊。
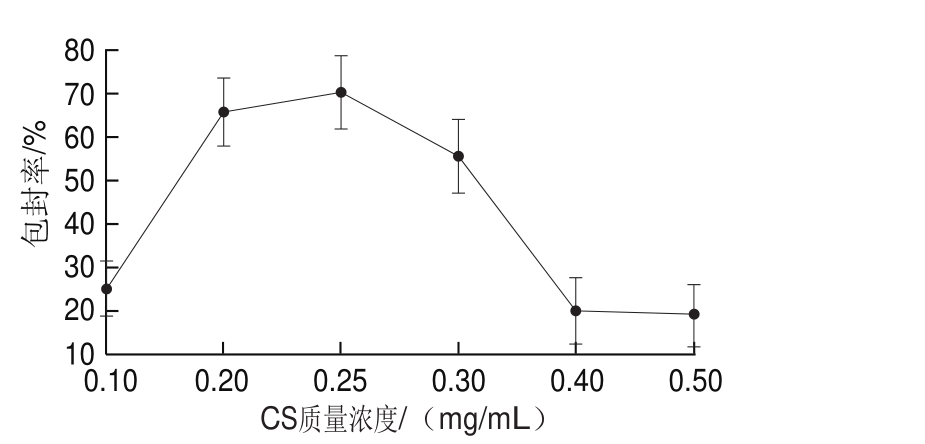
图3 CS质量浓度对CS-CPP黑果枸杞花色苷纳米颗粒包封率的影响
Fig. 3 Effect of CS concentration on encapsulation efficiency of CS-CPP nanoparticles containing Lycium ruthenicum Murr. anthocyanins
由图3可见,当CS质量浓度从0.10 mg/mL增加到0.25 mg/mL时,CS-CPP对黑果枸杞花色苷的包封率也不断增加;CS质量浓度为0.25 mg/mL时包封率达到最高(70.2%);当CS质量浓度增加到0.30~0.50 mg/mL时,包封率快速下降。
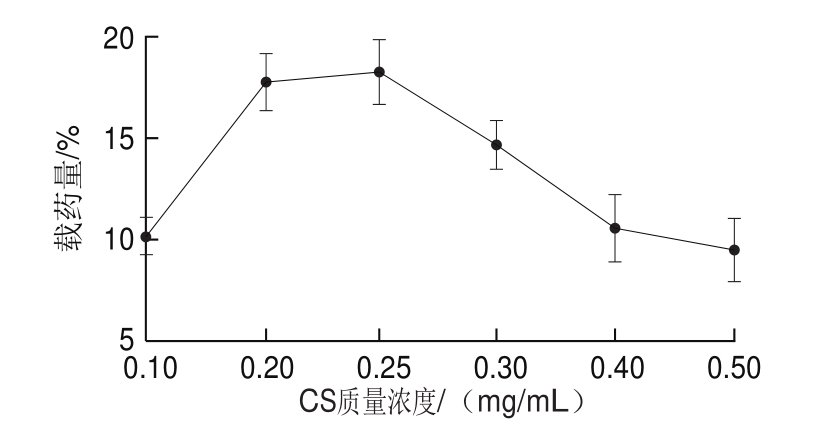
图4 CS质量浓度对CS-CPP黑果枸杞花色苷纳米颗粒载药量的影响
Fig. 4 Effect of CS concentration on loading rate of CS-CPP nanoparticles containing Lycium ruthenicum Murr. anthocyanins
由图4可见,CS-CPP黑果枸杞花色苷纳米颗粒的载药量变化曲线与包封率相似。这可能是因为随着CS质量浓度的升高,其形成更大的凝胶复合物结构,使得包封率和载药量增加。但是,继续增加CS质量浓度,不仅减小了用于包封黑果枸杞花色苷凝胶状结构的空间体积,而且使溶液中纳米颗粒团聚而形成絮状沉淀,导致包封率和载药量下降[25]。药物包封率低是高分子药物输送系统中的一个缺点,在很大程度上限制了其应用。CS-CPP纳米颗粒具有较高的黑果枸杞花色苷包封率,可作为其潜在的包封和输送载体。
由图5可见,当将制备的CS-CPP黑果枸杞花色苷纳米颗粒在pH 7.0 PBS中37 ℃孵育时,随着孵育时间的延长,花色苷的释放率增加。在2 h时其释放率为24.3%;4~8 h时释放率在54.4%~64.2%之间,且增加速率减慢。胡冰[12]发现CS-CPP纳米颗粒中表没食子儿茶素没食子酸酯体外释放2 h时释放率为20.5%,6 h时为32.4%。利用Higuchi方程对释放曲线进行回归分析,建立载药纳米颗粒的释放动力学函数关系方程式:Q/%=31.42t1/2-18.02(R2=0.953),其中t1/2=2.16 h。He Bo等[26]报道体外释放2 h时CS纳米颗粒中花色苷释放率为47.73%,CS能显著降低花色苷体外释放率,利于花色苷活性的保存。纳米颗粒释放率的差异可能与纳米颗粒与包封物交联的结构有关[27]。

图5 CS-CPP黑果枸杞花色苷纳米颗粒体外释放率
Fig. 5 Release percentage of CS-CPP nanoparticles containing Lycium ruthenicum Murr. anthocyanins

图6 CS-CPP黑果枸杞花色苷纳米颗粒表面形态
Fig. 6 Surface morphology of CS-CPP nanoparticles containing Lycium ruthenicumMurr. anthocyanins
应用原子力显微镜观察CS-CPP黑果枸杞花色苷纳米颗粒的表面形态。如图6所示,形成的纳米颗粒呈不规则球形,直径为215.3 nm,表面电势为36 mV,颗粒粒径聚合分散系数为0.10。CS-CPP自组装形成纳米颗粒主要是由于CPP上带负电荷的磷酸基团与CS上带正电荷的—NH3+基团之间的静电相互作用[28]。Lan Yaqi等[29]报道CPP-CS纳米粒子的典型粒径为100~400 nm,而当发生复合凝聚时,其粒径增加到900 nm。本实验制备的CS-CPP黑果枸杞花色苷纳米颗粒粒径较小,且正的表面电荷能够防止中和络合物的聚集,导致纳米颗粒分布均匀。
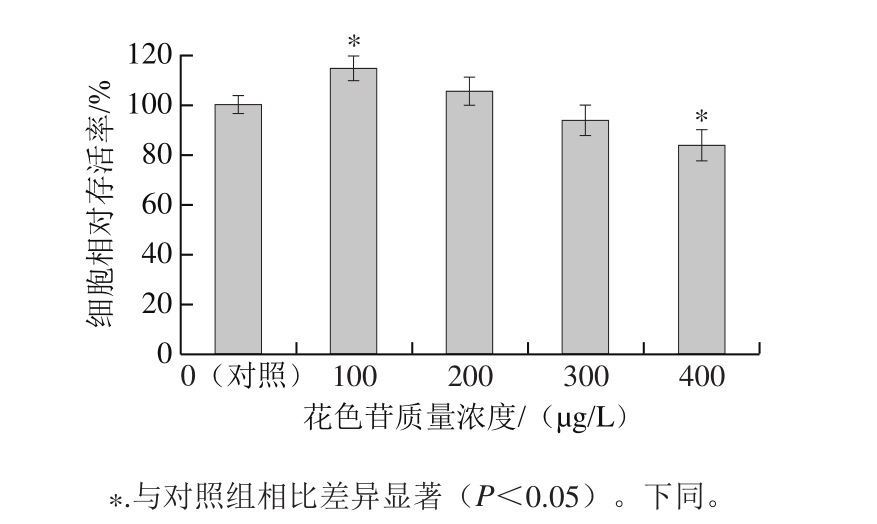
图7 CS-CPP黑果枸杞花色苷纳米颗粒对EAhy926细胞增殖的影响
Fig. 7 Effect of CS-CPP nanoparticles containing Lycium ruthenicum Murr. anthocyanins on the proliferation of EAhy926 cells
如图7所示,当CS-CPP纳米颗粒中黑果枸杞花色苷质量浓度为100 μg/L时,能显著促进EAhy926细胞增殖;但当黑果枸杞花色苷质量浓度为400 μg/L时,能够显著降低EAhy926细胞存活率。花色苷是植物界中数量最多的水溶性色素,属于黄酮类化合物家族。很多研究表明富含花色苷的水果具有保护心血管的作用[30-32]。本实验中,低黑果枸杞花色苷质量浓度的CS-CPP纳米颗粒具有促进EAhy926细胞增殖的作用,而高黑果枸杞花色苷质量浓度的CS-CPP纳米颗粒呈现一定的毒性作用,其作用机制需要进一步研究。
EAhy926细胞氧化损伤的影响
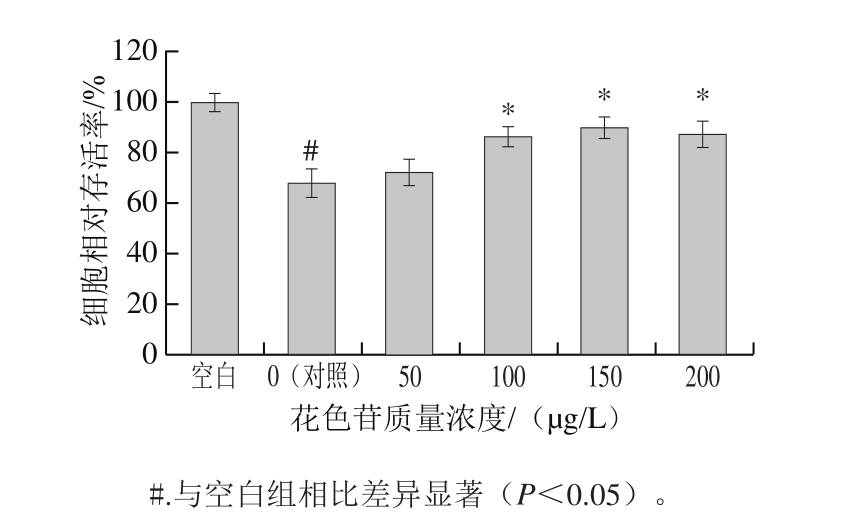
图8 CS-CPP黑果枸杞花色苷纳米颗粒对ox-LDL诱导的EAhy926细胞氧化损伤的影响
Fig. 8 CS-CPP nanoparticles containingLycium ruthenicum Murr.anthocyanins protected against ox-LDL-induced oxidative damage in EAhy926 cells
如图8所示,ox-LDL诱导的氧化损伤EAhy926细胞存活率随黑果枸杞花色苷质量浓度增大而升高,黑果枸杞花色苷质量浓度为100~200 μg/L时,EAhy926细胞存活率显著升高。花色苷结构中有多个酚羟基,具有抗氧化、清除自由基、抑制细胞氧化损伤的作用[33-34]。林丽等[35]报道黑果枸杞花色苷具有保护血管内皮细胞免受氧化损伤的作用。本实验中100~200 μg/mL黑果枸杞花色苷CS-CPP纳米颗粒能够保护血管内皮细胞免受ox-LDL诱导的氧化损伤。这可能与胡冰[12]报道的CS-CPP纳米颗粒能够提高活性成分的稳定性并促进更多活性成分进入细胞有关。
利用CS与CPP复合凝胶体系制备CS-CPP黑果枸杞花色苷纳米颗粒最佳条件为:pH 4条件下,2 mg/mL黑果枸杞花色苷溶液与质量分数0.5% CPP溶液等体积混合,室温搅拌,然后添加等体积0.20~0.30 mg/mL CS溶液。所得CS-CPP黑果枸杞花色苷纳米颗粒粒径为215.3 nm,表面电势为36 mV,包封率为65.0%~72.2%。体外释放实验结果表明,CS-CPP黑果枸杞花色苷纳米颗粒在pH 7.0时释放率为24.3%~64.2%。体外细胞实验结果表明,CS-CPP黑果枸杞花色苷纳米颗粒在花色苷质量浓度为100~200 μg/L时能够显著提高ox-LDL诱导的氧化损伤EAhy926细胞存活率。
[1] BARTOSZ K, ANNA G M. Goji berry (Lycium barbarum):composition and health effects: a review[J]. Polish Journal of Food and Nutrition Sciences, 2016, 66(2): 67-76. DOI:10.1515/pjfns-2015-0040.
[2] 闫亚美, 戴国礼, 冉林武, 等. 不同产地野生黑果枸杞资源果实多酚组成分析[J]. 中国农业科学, 2014, 47(22): 4540-4550. DOI:10.3864/j.issn.0578-1752.2014.22.020.
[3] TANG J L, YAN Y M, RAN L W, et al. Isolation, antioxidant property and protective effect on PC12 cell of the main anthocyanin in fruit of Lycium ruthenicum Murray[J]. Journal of Functional Foods, 2017,30(3): 97-107. DOI:10.1016/j.jff.2017.01.015.
[4] 唐骥龙, 闫亚美, 曹有龙, 等. 黑果枸杞中一种花色苷类物质的分离纯化及抗氧化活性[J]. 食品科学, 2016, 37(15): 113-117.DOI:10.7506/spkx1002-6630-201615019.
[5] 闫亚美, 代彦满, 冉林武, 等. 黑果枸杞与5 种果蔬中花色苷组成及体外抗氧化活性比较[J]. 食品工业科技, 2014, 35(16): 133-136.DOI:10.13386/j.issn1002-0306.2014.16.021.
[6] 闫亚美. 黑果枸杞多酚的组成、抗氧化活性及指纹图谱研究[D]. 南京: 南京农业大学, 2014: 57-59.
[7] 张建琪, 杨文宇, 石冬俊, 等. 黑果枸杞色素在水溶液中的降解动力学及护色剂的筛选[J]. 食品科学, 2016, 37(19): 94-99. DOI:10.7506/spkx1002-6630-201619016.
[8] 李进, 赵红艳, 原惠, 等. 黑果枸杞色素性质研究[J]. 食品科学, 2006,27(10): 146-151. DOI:10.3321/j.issn:1002-6630.2006.10.032.
[9] 韩爱芝, 蒋卉, 贾清华, 等. 响应面试验优化黑果枸杞花色苷微胶囊制备工艺及其稳定性分析[J]. 食品科学, 2016, 37(10): 82-87.DOI:10.7506/spkx1002-6630-201610014.
[10] YOUSSEF A M, EL-SAYED S M. Bionanocomposites materials for food packaging applications: concepts and future outlook[J].Carbohydrate Polymers, 2018, 193(1): 19-27. DOI:10.1016/j.carbpol.2018.03.088.
[11] LI M F, CHEN L, XU M Z, et al. The formation of zein-chitosan complex coacervated particles: relationship to encapsulation and controlled release properties[J]. International Journal of Biological Macromolecules, 2018, 116: 1232-1239. DOI:10.1016/j.ijbiomac.2018.05.107.
[12] 胡冰. 壳聚糖纳米颗粒的形成机理、包封茶叶儿茶素及提高其生物利用率的研究[D]. 南京: 南京农业大学, 2011: 64-82.
[13] JABEEN F, NAJAM-UL-HAQ M, ASHIQ M N, et al. Gadolinium oxide: exclusive selectivity and sensitivity in the enrichment of phosphorylated biomolecules[J]. Journal of Separation Science, 2016,39(21): 4175-4182. DOI:10.1002/jssc.201600651.
[14] SHOICHET M S. Polymer scaffolds for biomaterials applications[J].Macromolecules, 2010, 43(2): 581-591. DOI:10.1021/ma901530r.
[15] AMIN F U, SHAH S A, BADSHAH H, et al. Anthocyanins encapsulated by PLGA@PEG nanoparticles potentially improved its free radical scavenging capabilities via p38/JNK pathway against Aβ(1-42)-induced oxidative stress[J]. Journal Nanobiotechnology,2017, 15(1): 1-12. DOI:10.1186/s12951-016-0227-4.
[16] ALI T, KIM M J, REHMAN S U, et al. Anthocyanin-loaded PEG-gold nanoparticles enhanced the neuroprotection of anthocyanins in an Aβ(1-42) mouse model of Alzheimer’s disease[J]. Molecular Neurobiology, 2017, 54(8): 6490-6506. DOI:10.1007/s12035-016-0136-4.
[17] GASPARRINI M, FORBES-HERNANDEZ T Y, AFRIN S, et al.A pilot study of the photoprotective effects of strawberry-based cosmetic formulations on human dermal fibroblasts[J]. International Journal Molecular Sciences, 2015, 16(8): 17870-17884. DOI:10.3390/ijms160817870.
[18] HE B, GE J, YUE P X, et al. Loading of anthocyanins on chitosan nanoparticles influences anthocyanin degradation in gastrointestinal fl uids and stability in a beverage[J]. Food Chemistry, 2017, 221: 1671-1677. DOI:10.1016/j.foodchem.2016.10.120.
[19] DUPEYRÓN D, KAWAKAMI M, RIEUMONT J, et al. Formulation and characterization of anthocyanins-loaded nanoparticles[J]. Current Drug Delivery, 2017, 14(1): 54-64. DOI:10.2174/15672018136661609 15102151.
[20] RAVANFAR R, TAMADDON A M, NIAKOUSARI M, et al.Preservation of anthocyanins in solid lipid nanoparticles: optimization of a microemulsion dilution method using the Placket-Burman and Box-Behnken designs[J]. Food Chemistry, 2016, 199: 573-580.DOI:10.1016/j.foodchem.2015.12.061.
[21] CHEN J, TAO X Y, ZHANG M, et al. Properties and stability of blueberry anthocyanin: bovine serum albumin nanoparticles[J]. Journal Science Food Agriculture, 2014, 94(9): 1781-1786. DOI:10.1002/jsfa.6492.
[22] XIAO J, NIAN S, HUANG Q R. Assembly of kafirin/carboxymethyl chitosan nanoparticles to enhance the cellular uptake of curcumin[J]. Food Hydrocolloids, 2015, 51: 166-175. DOI:10.1016/j.foodhyd.2015.05.012.
[23] JAIN A, JAIN S K. Optimization of chitosan nanoparticles for colon tumors using experimental design methodology[J]. Artificial Cells Nanomedicine and Biotechnology, 2016, 44(8): 1917-1926. DOI:10.3109/21691401.2015.1111236.
[24] 贺博. 蓝莓花色苷纳米微胶囊制备及其性能研究[D]. 合肥: 安徽农业大学, 2016: 12-20.
[25] WOITISKI C B, VEIGA F, RIBEIRO A, et al. Design for optimization of nanoparticles integrating biomaterials for orally dosed insulin[J].European Journal of Pharmaceutics and Biopharmaceutics, 2009,73(1): 25-33. DOI:10.1016/j.ejpb.2009.06.002.
[26] HE Bo, GE Jiao, YUE Pengxiang, et al. Loading of anthocyanins on chitosan nanoparticles influences anthocyanin degradation in gastrointestinal fl uids and stability in a beverage[J]. Food Chemistry,2017, 221: 1671-1677. DOI:10.1016/j.foodchem.2016.10.120.
[27] FENG C, WANG Z G, JIANG C Q, et al. Chitosan/O-carboxymethyl chitosan nanoparticles for efficient and safe oral anticancer drug delivery: in vitro and in vivo evaluation[J]. International Journal of Pharmaceutics, 2013, 457(1): 158-167. DOI:10.1016/j.ijpharm.2013.07.079.
[28] ESPINOSA-ANDREWS H, BÁEZ-GONZÁLEZ J G, CRUZSOSA F, et al. Gum arabic-chitosan complex coacervation[J].Biomacromolecules, 2007, 8(4): 1313-1318. DOI:10.1021/bm0611634.
[29] LAN Yaqi, WANG Li, CAO Sufang, et al. Rational design of foodgrade polyelectrolyte complex coacervate for encapsulation and enhanced oral delivery of oenothein B[J]. Food Function, 2017, 8(11):4070-4080. DOI:10.1039/c7fo01009e.
[30] MAZZA G. Anthocyanins and heart health[J]. Annali Dell Istituto Superiore di Sanita, 2007, 43(4): 369-374.
[31] WALLACE T C. Anthocyanins in cardiovascular disease[J]. Advances in Nutrition, 2011, 2(1): 1-7. DOI:10.3945/an.110.000042.
[32] JIN Y, ALIMBETOV D, GEORGE T, et al. A randomised trial to investigate the effects of acute consumption of a blackcurrant juice drink on markers of vascular reactivity and bioavailability of anthocyanins in human subjects[J]. European Journal of Clinical Nutrition, 2011, 65(7): 849-856. DOI:10.1038/ejcn.2011.5.
[33] MARTIN-NIZARD F, SAHPAZ S, FURMAN C, et al. Natural phenylpropanoids protect endothelial cells against oxidized LDL-induced cytotoxicity[J]. Planta Medica, 2003, 69(3): 207-211.DOI:10.1055/s-2003-38474.
[34] NOWAK D, GOŚLIŃSKI M, WOJTOWICZ E, et al. Antioxidant properties and phenolic compounds of vitamin C-rich juices[J]. Journal Food Science, 2018, 83(8): 2237-2246. DOI:10.1111/1750-3841.
[35] 林丽, 李进, 李永洁, 等. 黑果枸杞花色苷对氧化低密度脂蛋白损伤血管内皮细胞的保护作用[J]. 中国药学杂志, 2013, 48(8): 606-611.DOI:10.11669/cpj.2013.08.008.
Preparation of Anthocyanin-Loaded Nanoparticles from Lycium ruthenium Murr. and Its Protective Effect on Oxidative Damage of EAhy926 Cells Induced by Oxidized Low-Density Lipoprotein
闫亚美(1982—)(ORCID: 0000-0003-2309-3281),女,副研究员,博士,研究方向为枸杞加工与贮藏。E-mail: yanyamei@163.com
黄庆荣(1966—)(ORCID: 0000-0002-7648-4414),男,教授,博士,研究方向为食品纳米技术。E-mail: qhuang@aesop.rutgers.edu
RAN Linwu, MI Jia, LU Lu, et al. Preparation of anthocyanin-loaded nanoparticles from Lycium ruthenium Murr. and its protective effect on oxidative damage of EAhy926 cells induced by oxidized low-density lipoprotein[J]. Food Science, 2019,40(17): 162-168. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180710-134. http://www.spkx.net.cn