豆乳粉是在豆乳生产的基础上,将豆乳进一步杀菌,添加甜味剂、乳化剂、食用香精(乳香型)、增味剂等食品添加剂,经乳化、均质、喷雾干燥再制成的速溶乳粉体。目前,湿法工艺是制备豆乳粉最常用的方法,其工艺过程一般包括黄豆浸泡、磨浆、浓缩调配及喷雾干燥[1]。豆乳粉含有丰富的蛋白质、脂肪酸等营养物质及大豆低聚糖、大豆异黄酮、大豆卵磷脂等功能性成分,在温水或凉水中就能迅速溶化,是一种营养价值很高的植物蛋白质饮料,可以代替牛奶或其他奶制品,深受消费者的喜爱[2]。但由于豆乳粉溶解性不高,氮溶解指数(70%~80%)低,在实际生产中存在冲调性差等问题,不仅影响了豆乳粉的食用性,而且阻碍了豆乳粉的推广[3]。
动态高压微射流技术是一种新兴的高压加工技术,与传统高压均质相比,其均质压力更高,碰撞能量更大,产品颗粒更细(破碎细度可达1 μm以下)[4]。微射流均质过程中,高压、强烈剪切、空穴爆炸、高频振荡等机械力的综合作用导致物料分子发生显著变化[5]。涂宗财等[6]研究发现微射流均质可破坏大豆蛋白、花生蛋白的内部基团,使蛋白分子伸展,并使多项功能特性改善。万红霞等[7]研究了不同均质压力(40~200 MPa)对大米蛋白溶解性的影响,发现大米蛋白颗粒(分子)的结构解聚、疏水基团和极性基团暴露及蛋白所带电荷发生变化,蛋白质的水化作用增强,从而使大米蛋白的溶解性得到改善。同时,陈林等[8]的研究结果表明,微射流均质可破坏蛋白聚集体和球蛋白分子高级结构,有可能使被包埋的酶解位点暴露,提高蛋白的酶解敏感性。目前许多研究主要集中在在微射流均质对蛋白功能特性的影响,但国内外关于微射流均质对豆乳粉蛋白结构及溶解性影响的研究报道较少。
因此,本实验旨在研究微流化处理对豆乳粉蛋白结构及溶解性的影响,并通过比较预处理前后豆乳粉蛋白结构和溶解性的变化,探讨改善豆乳粉溶解性能的机理。明晰该机理对提高豆乳粉溶解性能具有重要的理论和实践意义,可为优质豆乳粉加工提供理论和方法指导。
东北大豆 哈尔滨品辰科技有限公司;Protex-6L碱性蛋白酶(1.0×105 U/g) 丹麦novo公司;Tris试剂、甘氨酸试剂、5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB) 北京索莱宝生物科技有限公司;8-苯胺基-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS) 美国Sigma公司;氢氧化钠、盐酸 北京新光化工试剂厂。
WK2102型微波炉 广东美的生活电器制造有限公司;0-40型阿贝折光仪 上海淋誉贸易有限公司;M-110EH30型高压微射流均质机 上海鲤跃精密机械贸易有限公司;JT-8000Y型离心式喷雾干燥器 杭州聚同电子有限公司;ATN-300型全自动凯氏定氮仪 上海洪纪仪器设备有限公司;JJ-1型恒温磁力搅拌器 常州国华电器有限公司;RF-5301PC型荧光分光光度计、UV-2600型紫外分光光度计 日本岛津公司;Bettersize2000型激光粒度分布仪 丹东市百特仪器有限公司;SU-8010型场发射扫描电子显微镜 日本日立公司。
1.3.1 豆乳粉的制备
豆乳粉的制备流程:大豆→筛选→清洗→浸泡→热烫→磨浆→过滤→微流化处理→限制性酶解→灭酶→浓缩→喷雾干燥→豆乳粉
豆乳粉的具体制备参考江连洲等[9]的方法,称量50 g(精确至0.001 g)黄豆,用质量分数0.5% NaHCO3溶液浸泡12 h,沸水热烫5 min,按豆水比1∶7(m/V)加入弱碱水(pH 6.5~7.0、温度90 ℃)磨浆,过滤除去浆渣,对豆浆进行微流化处理(微流化处理压力42.5、89.0、123.5 MPa和152.0 MPa),将微流化处理的豆乳pH值调节至8.6,在57 ℃温度下进行限制性酶(Protex-6L碱性蛋白酶)酶解1.7 h,然后在95℃下灭酶5 min,真空浓缩至固形物质量分数为15%左右,然后喷雾干燥(进口温度185 ℃、出口温度85 ℃)得到豆乳粉样品。对照组不进行微流化处理,其他条件与上述一致。利用凯氏定氮法测定上述豆乳粉的总蛋白含量。
1.3.2 表面疏水性测定
使用ANS荧光探针法[10]测量豆乳粉中蛋白的表面疏水性,用福林-酚法测定低嘌呤脱脂豆浆中蛋白质量浓度,用0.01 mol/L磷酸盐缓冲溶液(pH 7.0)逐步稀释至蛋白质量浓度在0.04~0.20 mg/mL之间。取2 mL不同质量浓度稀释样品,在390 nm激发波长和470 nm发射波长条件下分别测定样品的荧光强度(FI0)和样品加入10 μL ANS溶液(8 mmol/L)后的荧光强度(FI1),FI1和FI0的差值即为FI,以蛋白质量浓度为横坐标,FI为纵坐标作图,曲线初始阶段的直线斜率即为蛋白质分子的表面疏水性指数。表面疏水性的计算见公式(1)。
式中:S0、S0C分别为处理组和对照组豆乳粉中蛋白质表面疏水性指数。
1.3.3 游离巯基含量的测定
参考王健等[11]的方法测定蛋白质游离巯基含量,并稍作修改。吸取2 mL豆乳粉溶液(50 mg/mL),加入5 mL Tris-Gly缓冲液(含0.086 mol/L Tris、0.09 mol/L 甘氨酸、4 mmol/L乙二胺四乙酸、8 mol/L尿素,pH 8.0)中,再加入0.100 mL Ellman试剂(0.01 mol/L),测定时溶液经恒温磁力搅拌混合后在25 ℃下保温反应15 min,用分光光度计测定其在412 nm波长处吸光度(A412 nm)。以不加Ellman试剂的溶液作为对照。游离巯基含量的计算见公式(2)。
式中:A412 nm表示实验组与对照组的吸光度之差;D表示稀释倍数;ρ表示样品的蛋白质终质量浓度/(g/mL)。
1.3.4 粒径分布测定
喷雾干燥后豆乳粉样品用激光粒度分布仪进行粒子分布测定,测定参数为:样品折射率为1.5,介质的折射率为1.3,测定时折光率为10%~15%[12]。
1.3.5 蛋白分散指数测定
按照钟芳等[13]的方法测定豆乳粉中蛋白分散指数。称取1 g(精确至0.000 1 g)左右的喷雾干燥粉,溶解于200 mL蒸馏水中,充分搅拌0.5 h后,将溶解液全部转移至离心管中,在4 ℃条件下10 000×g离心10 min,取上清液,在沉淀中加入10 mL蒸馏水混匀,随后采用相同的方法离心并弃去沉淀,将上清液合并,按照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》采用凯氏定氮法测定上清液粗蛋白含量。蛋白分散指数的计算见公式(3)。
1.3.6 溶解度测定
蒸馏水配质量分数10%的豆乳粉溶液,在室温(25 ℃)下用磁力搅拌器混合一段时间后,取豆乳粉溶液,然后在4 ℃条件下5 000×g离心10 min,取上清液25 mL,于105 ℃烘干,按1.3.5节的方法测定上清液中蛋白含量,溶解度表示为上清液中蛋白含量(参照1.3.5节中方法计算)占豆乳粉溶液蛋白含量的比例[14]。溶解度的计算见式(4)。
实验设3 组平行,使用统计学软件SPSS 20.0处理数据,采用方差分析进行差异显著性分析。采用Origin 9.0软件作图。

图1 微流化对豆乳粉的表面疏水性影响
Fig. 1 Effect of high-pressure microfluidization on surface hydrophobicity of soymilk powder
微流化处理对豆乳粉中蛋白质表面疏水性的影响见图1。当微射流压力从0 MPa增加到123.5 MPa时,豆乳粉的表面疏水性逐渐增大。微流化处理压力在123.5 MPa时,蛋白质表面疏水性达到最大值,提高至未处理样品的1.6 倍,而且微流化处理样品表面疏水性均高于对照样品,推测可能是由于微流化处理的高剪切作用破坏了豆乳粉中的蛋白结构。刘坚等[15]认为高剪切作用会逐渐破坏蛋白质分子内部疏水相互作用,使蛋白质解折叠,导致蛋白质内部更多的疏水性区域暴露,从而增加蛋白质的表面疏水性[16]。当微流化处理压力继续增大(152.0 MPa)时,豆乳粉的相对表面疏水性降低,这可能是由于微射流压力过大使蛋白质分子间相互作用形成更多聚集体,导致表面疏水性下降[15]。Wang Xiansheng等[17]采用超高压处理大豆分离蛋白时得到了相同的结论。

图2 微流化对豆乳粉游离巯基含量的影响
Fig. 2 Effect of high-pressure microfluidization on free sulfhydryl content of soymilk powder
由图2可见,当微流化处理压力在0~123.5 MPa时,随着微流化处理压力不断增加,豆乳粉的游离巯基含量呈逐渐上升的趋势,且豆乳粉中蛋白质游离巯基含量均高于对照组。当微射流压力为123.5 MPa时,蛋白质游离巯基含量达到最大值(7.62 μmol/g),与未处理样品相比增加了24.96%。钟俊桢等[18]研究发现动态高压微射流处理β态乳球蛋白能引起其二硫键断裂增加,导致蛋白质结构发生变化,巯基游离到分子的表面,促使巯基含量上升。当微流化处理压力增大到152.0 MPa时,游离巯基含量下降,可能因为是较大的微流化压力导致变性的蛋白质分子又发生了一定程度的聚集[19]。
激光粒度仪利用等效散射光能分布测定的颗粒大小及分布,能全面反映出样品溶液中颗粒的粗细特性和均匀程度[20]。微流化处理对豆乳粉粒径分布及平均粒径的影响如图3和表1所示,不同微射流压力处理后样品的体积平均粒径和粒径分布宽度均低于对照样品。微射流处理压力在0~123.5 MPa时,随着压力增加,体积平均粒径减小,123.5 MPa时最低,且与其他组差异显著(P<0.05)。这可能是经过微流化压力处理后,强烈的撞击过程中高剪切作用破坏蛋白质紧密的有序结构,使其破碎成更小的粒子[21]。但随着微流化压力进一步加大(152.0 MPa),蛋白质分子又重新聚合,导致体积平均粒径增大[18]。
粒径分布宽度可表征样品粒径的均匀程度,粒度分布越宽,表明样品颗粒的粗细不均匀[20]。由表1可知,粒径分布宽度均大于1.5,表明豆乳粉颗粒分布不均匀。微射流压力123.5 MPa时豆乳粉粒径分布宽度比42.5 MPa时有所降低,表明微流化(42.5~123.5 MPa)处理使溶液中蛋白质颗粒分布更加均匀,故而使得溶液的分散性增强[22]。

图3 微流化对豆乳粉粒径分布的影响
Fig. 3 Effect of high-pressure microfluidization on particle size distribution of soymilk powder
表1 微流化对豆乳粉粒径的影响
Table 1 Effect of high-pressure microfluidization on particle size of soymilk powder
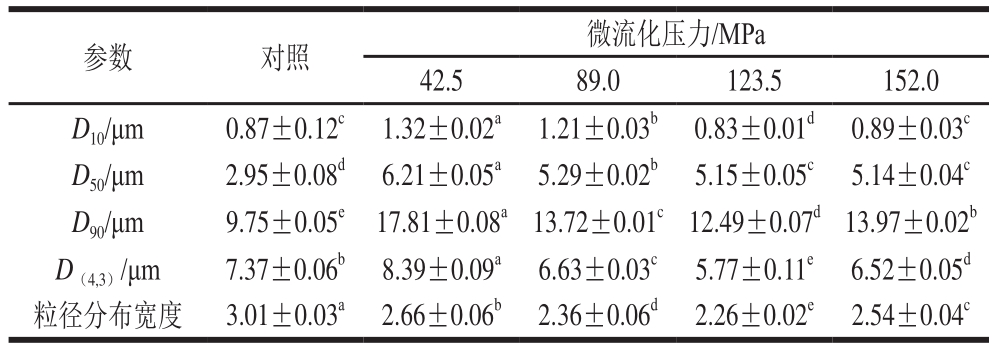
注:同行小写字母不同表示差异显著(P<0.05),D10表示样品小于该粒径的颗粒占10%;D50为中位径,表示样品超过和低于该粒径的颗粒各占50%;D90表示小于该粒径的粒子占90%;D(4,3)为体积平均粒径;粒径分布宽度为(D90-D10)/D50。
参数 对照 微流化压力/MPa 42.5 89.0 123.5 152.0 D10/μm 0.87±0.12c 1.32±0.02a 1.21±0.03b 0.83±0.01d 0.89±0.03c D50/μm 2.95±0.08d 6.21±0.05a 5.29±0.02b 5.15±0.05c 5.14±0.04c D90/μm 9.75±0.05e 17.81±0.08a13.72±0.01c12.49±0.07d13.97±0.02b D(4,3)/μm 7.37±0.06b 8.39±0.09a 6.63±0.03c 5.77±0.11e 6.52±0.05d粒径分布宽度 3.01±0.03a 2.66±0.06b 2.36±0.06d 2.26±0.02e 2.54±0.04c
溶解特性是喷雾干燥产品质量的重要指标,是评价喷雾干燥产品品质优劣的基础,蛋白分散指数和溶解度是判定溶解特性的重要因素。微流化处理压力对豆乳粉的蛋白分散指数和溶解度的影响见图4,当微射流处理压力在0~123.5 MPa时,随着微流化压力逐渐增加,蛋白质分散指数和溶解度均显著增加(P<0.05),当微射流压力为123.5 MPa时,蛋白质分散指数和溶解度均达到最大,分别为83.26%和79.47%。推测这种现象可能是由于微流化处理的高速剪切、高频振荡、空穴效应和对流撞击等机械力作用和相应的热效应,诱使蛋白聚集物解聚,增加了蛋白分子的扩散性,使蛋白质分子的肽链或氨基酸侧链与水分子发生水合作用,宏观上主要表现为溶解性增加[22-23];另一方面高压动态微射流处理使蛋白质内部的极性基团和疏水基团暴露出来,蛋白质分子表面电荷发生改变,使水化作用增强,以致蛋白质分散指数提高[24]。但随着微流化压力继续增加(152.0 MPa),蛋白质分散指数和溶解度稍有降低(P>0.05),样品溶解度降低可能是因为豆乳蛋白形成不溶性聚合物[25]。沈兰等[26]发现高压微流化微射流均质压力下,大量活性基团暴露,使得蛋白质分子间又相互形成新的化学键,导致溶解度变化不大甚至略有降低。Mao Xueying等[16]研究发现溶解度与表面疏水性没有严格的关系,但当样品溶解度最高时其表面疏水性最高,本实验也出现了类似结果。

图4 微流化对豆乳粉的蛋白分散指数和溶解度的影响
Fig. 4 Effect of high-pressure microfluidization on protein dispersibility index and solubility of soymilk powder
经微流化处理后,豆乳粉中蛋白质的表面疏水性、游离巯基含量、蛋白分散指数及溶解度均发生了改变,且均高于未处理样品,豆乳粉体积平均粒径及粒径分布宽度均低于未处理样品。当微流化压力从0 MPa增加到123.5 MPa时,豆乳粉蛋白的表面疏水性、游离巯基含量、蛋白分散指数及溶解度逐渐增加。微流化处理破坏了蛋白质分子内部疏水相互作用,蛋白质分子解折叠,暴露出更多的疏水性基团;高剪切作用也引起蛋白质二硫键断裂,蛋白质结构发生变化,巯基游离到分子的表面,同时将豆乳粉颗粒破碎成更小的粒子,促进蛋白质分子与水分子发生水合作用,增加其溶解性。当微流化为压力152.0 MPa时,微流化处理产生的高压及热效应会破坏维系蛋白聚合物之间的次级相互作用力,诱导豆乳粉蛋白中不溶性聚集物解聚,从而导致样品的溶解度略有下降。
[1] 唐璐, 郭顺堂. 添加CaCl2对豆乳粉溶解性的影响[J]. 大豆科学,2009, 28(2): 290-295. DOI:10.11861/j.issn.1000-9841.2009.02.0290.
[2] AGUILERA Y, ESTRELLA I, BENITEZ V, et al. Bioactive phenolic compounds and functional properties of dehydrated bean flours[J].Food Research International, 2011, 44(3): 774-780. DOI:10.1016/j.foodres.2011.01.004.
[3] 陈莉. 无糖速溶速凝豆奶粉的研制[D]. 无锡: 江南大学, 2005: 132-135.
[4] OBOROCEANU D, WANG L Z, KROES-NIJBOER A, et al. The effect of high pressure microfluidization on the structure and length distribution of whey protein fibrils[J]. International Dairy Journal,2011, 21(10): 823-830. DOI:10.1016/j.idairyj.2011.03.015.
[5] SHEN L, TANG C H. Microfluidization as a potential technique to modify surface properties of soy protein isolate[J]. Food Research International, 2012, 48(1): 108-118. DOI:10.1016/j.foodres.2012.03.006.
[6] 涂宗财, 汪菁琴, 阮榕生, 等. 动态超高压微射流均质对大豆分离蛋白起泡性、凝胶性的影响[J]. 食品科学, 2006, 27(10): 168-170.DOI:10.3321/j.issn:1002-6630.2006.10.038.
[7] 万红霞, 孙海燕, 刘冬. 动态超高压微射流均质对大米蛋白功能特性的影响[J]. 食品工业科技, 2015, 36(16): 155-161; 166.DOI:10.3969/j.issn.1002-6819.2015.05.046.
[8] 陈林, 吴克刚, 柴向华, 等. 微射流均质预处理提高大豆分离蛋白酶解效率及酶解产物乳化性能[J]. 农业工程学报, 2015, 31(5):331-338. DOI:10.3969/j.issn.1002-6819.
[9] 江连洲, 寻崇荣, 綦玉曼, 等. 超高压-限制性酶解法降低豆乳粉致敏性工艺优化[J]. 食品科学, 2018, 39(24): 268-275. DOI:10.7506/spkx1002-6630-201824040.
[10] KATO A, NAKAI S. Hydrophobicity determined by a fluorescence probe methods and its correlation with surface properties of proteins[J]. Biochimica et Biophysica Acta, 1980, 624(1): 13-20.DOI:10.1016/0005-2795(80)90220-2.
[11] 王健, 徐晔晔, 于洁, 等. 不同热处理大豆蛋白柔性与结构的关系[J]. 食品科学, 2018, 39(7): 85-90. DOI:10.7506/spkx1002-6630-201807013.
[12] LEE Y J, YOON W B. Effects of particle size and heating time on thiobarbituric acid (TBA) test of soybean powder[J]. Food Chemistry,2013, 138(2/3): 841-850. DOI:10.1016/j.foodchem.2012.11.113.
[13] 钟芳, 王璋, 许时婴. 喷雾干燥条件对豆粉速溶性的影响[J]. 食品工业科技, 2003, 24(12): 17-20. DOI:10.3969/j.issn.1002-0306.2003.12.017.
[14] CANO-CHAUCA M C, STRINGHETA P C, RAMOS A M, et al.Effect of the carriers on the microstructure of mango powder obtained by spray drying and its functional characterization[J]. Innovative Food Science and Emerging Technologies, 2005, 6(4): 420-428. DOI:10.1016/j.ifset.2005.05.003.
[15] 刘坚, 江波, 张涛, 等. 超高压对鹰嘴豆分离蛋白功能性质的影响[J].食品与发酵工业, 2006, 32(12): 64-68.
[16] MAO Xueying, TONG P S, GUALCO S, et al. Effect of NaCl addition during diafiltration on the solubility, hydrophobicity, and disulfide bonds of 80% milk protein concentrate powder[J]. Journal of Dairy Science, 2012, 95(7): 3481-3488. DOI:10.3168/jds.2011-4691.
[17] WANG Xiansheng, TANG Chuanhe, LI Biansheng, et al. Effects of high-pressure treatment on some physicochemical and functional properties of soy protein isolates[J]. Food Hydrocolloids, 2008, 22(4):560-567. DOI:10.1016/j.foodhyd.2007.01.027.
[18] 钟俊桢, 涂越, 刘伟, 等. 动态高压微射流协同糖基化对β-乳球蛋白乳化性和结构的影响[J]. 食品科学, 2014, 35(1): 7-11. DOI:10.3321/j.issn:1002-6630.2009.17.024.
[19] 毕爽, 隋晓楠, 韩天翔, 等. 超声波作用于大豆分离蛋白-磷脂复合体系的流变性和拉曼光谱变化[J]. 食品科学, 2016, 37(21): 61-66.DOI:10.7506/spkx1002-6630-201621011.
[20] 崔素萍, 许琳, 王颖, 等. 超声波处理对低嘌呤脱脂豆粉巯基含量、疏水性及粒径分布的影响[J]. 食品科学, 2015, 36(21): 50-55. DOI:10.7506/spkx1002-6630-201521011.
[21] IORDACHE M, JELEN P. High pressure micro-fluidization treatment of heat denatured whey proteins for improved functionality[J].Innovative Food Science and Emerging Technologies, 2003, 4(4):367-376. DOI:10.1016/j.jfoodeng.2017.10.020.
[22] 苏丹, 李树君, 赵凤敏, 等. 超高压处理对大豆分离蛋白结构的影响[J].食品科技, 2009, 34(12): 51-55.
[23] YANG J Q, LIU G Y, ZENG H B, et al. Effects of high pressure homogenization on faba bean protein aggregation in relation to solubility and interfacial properties[J]. Food Hydrocolloids, 2018, 83:275-286. DOI:10.1016/j.foodhyd.2018.05.020.
[24] PRIMOZIC M, DUCHEK A, NICKERSON M, et al. Formation, stability and in vitro, digestibility of nanoemulsions stabilized by high-pressure homogenized lentil proteins isolate[J]. Food Hydrocolloids, 2017, 77:126-141. DOI:10.1016/j.foodhyd.2017.09.028.
[25] 姜梅, 董明盛, 芮昕, 等. 高压均质和热处理对豆乳蛋白质溶解性的影响[J]. 食品科学, 2013, 34(21): 125-130. DOI:10.3321/j.issn:1002-6630.2003.04.006.
[26] 沈兰, 王昌盛, 唐传核. 高压微射流处理对大豆分离蛋白构象及功能特性的影响[J]. 食品科学, 2012, 33(3): 72-76.
Effect of Microfluidization on Protein Structure and Solubility of Soymilk Powder
王中江(1987—)(ORCID: 0000-0001-8434-7316),男,讲师,博士,研究方向为粮食、油脂及植物蛋白工程。E-mail: wzjname@126.com
范志军(1978—)(ORCID: 0000-0003-2529-9494),男,工程师,学士,研究方向为粮食、油脂及植物蛋白工程。E-mail: neau2016@126.com
LI Liang, ZHOU Yan, WANG Dongmei, et al. Effect of microfluidization on protein structure and solubility of soymilk powder[J]. Food Science, 2019, 40(17): 178-182. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180918-199. http://www.spkx.net.cn