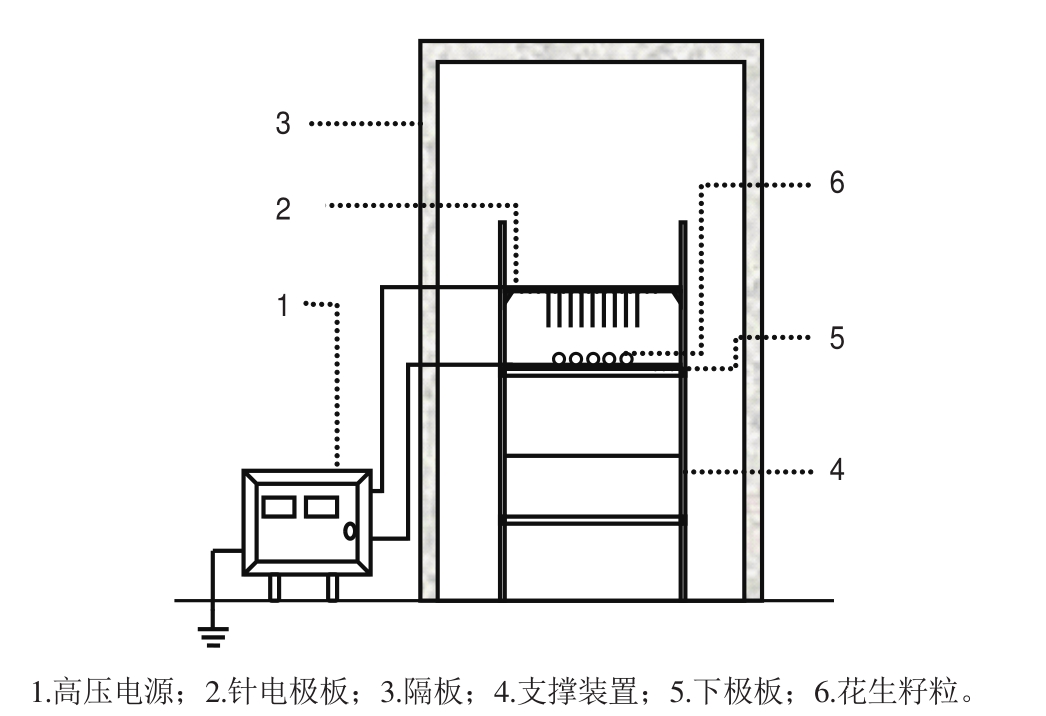
图1 HVEF实验装置示意图
Fig. 1 Schematic diagram of the high-voltage electrostatic field
花生(Arachis hypogaeaL.)又名落花生,属双子叶豆科作物,其不仅是中国重要的经济作物,还是含优良高蛋白的油料作物[1]。花生籽粒含有丰富的营养物质,研究报道其营养价值能够媲美肉、蛋及奶类食物,其与大豆一样是农产品中优质的高价值油料作物[2]。花生籽粒不仅包含丰富的脂肪﹑蛋白质﹑维生素(VE)﹑矿物质等常见营养素,还含有如酚类(白藜芦醇)、黄酮类及植物固醇(β-谷甾醇)等活性成分,其中白藜芦醇被称作“100 种热门抗衰老物质”之一,花生也被营养学家评为A+级作物[3]。
高压静电场(high-voltage electrostatic field,HVEF)技术是目前一种重要的种子处理方法。HVEF处理能够对植物(如经济作物、水果、蔬菜等)种子内部水分子、酶等物质产生刺激作用[4],适宜的HVEF处理有利于种子体内ATP的合成和酶的活化,从而优化种子原有性质,促进其抗逆性,以达到种子发芽生长所需的良好条件。近些年的研究结果表明,静电场处理对水稻、黄瓜和番茄等农作物的萌发生长均有显著影响[5-6]。Huang Rukui等[7]用电场处理黄瓜种子进行发芽和膜通透性实验,结果表明电场处理组黄瓜种子的发芽率得到显著提高。
发芽目前被认为是应用广泛的能够提高种子营养成分生物利用率的成熟手段[8]。当休眠种子浸泡吸水之后,各种生理代谢随水合作用的进行不断增强[9],种子发芽过程中贮藏物质降解,小分子活性物质合成或含量增加,抗营养因子(如单宁等)减少,通常表现为含水量升高、呼吸作用增强、根芽生长迅速、干物质不断消耗等[10]。这种由豆类、蔬菜等种子或其他营养贮藏器官萌发生长的嫩芽及芽苗即为芽苗类蔬菜,因其具有生产工艺简便、口感独特及营养丰富等特点深受消费者青睐[11]。Lin Bosi等[12]对萌芽花生的毒理学进行评价,大鼠喂养萌芽花生18 周后,基本上未在其体内检测到有害物质,且发现大鼠摄取适量花生芽后血清中甘油三酯含量减少。花生芽菜是近年出现的一种新型芽菜品种,目前对于花生发芽及其活性成分变化等方面缺少系统的研究。本实验以花生籽粒为原料,研究了HVEF对于花生发芽过程中活性成分及抗氧化活性的影响规律,旨在寻找提高花生芽活性物质含量、增强其抗氧化能力的适宜的HVEF预处理条件,为花生芽产品的深度开发和利用提供参考依据。
花生籽粒(‘小白沙’,手工剥壳)购自山东省花生研究所。
白藜芦醇、福林-酚试剂、芦丁、水溶性V E(Trolox)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 美国Sigma公司;2,4,6-三吡啶基三嗪 南京都莱生物技术有限公司;2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt,ABTS) 日本东京化成工业株式会社。
100H恒温恒湿培养箱 科发豆芽机械设备有限公司;HVEF装置由中国农业大学中日食品研究中心实验室自行研制;UV-1600紫外-可见分光光度计 日本岛津公司;6460液相色谱-质谱联用仪 美国安捷伦公司;LGJ-18真空冷冻干燥机 北京四环科学仪器厂。
1.3.1 HVEF预处理
HVEF装置示意图如图1所示。

图1 HVEF实验装置示意图
Fig. 1 Schematic diagram of the high-voltage electrostatic field
为研究不同电场强度HVEF对花生芽活性成分及抗氧化能力的影响,分别控制电场强度为250、300、400、450 kV/m,处理30 min后备用。以未经HVEF处理组作为对照。不同电场强度通过控制HVEF的电压和极板间距调节。
1.3.2 花生芽生产
挑选饱满、整齐一致的210 粒花生籽粒,单层平铺在金属板上进行HVEF处理,用28 ℃、4 倍籽粒体积的自来水浸泡6 h;蒸馏水冲洗3 次,沥干水分;将其整齐均匀地铺在湿润纱布上,于26 ℃催芽24 h。将花生芽尖倒置插入珍珠岩中,每箱均匀播种60 粒左右;放入温度28 ℃、相对湿度80%恒温恒湿培养箱中黑暗培养,对照组(CK)花生芽生产方法同上,不使用HVEF处理。发芽1、3、5、7 d后分别采收,鲜样用于测定胚轴长度,用于其他指标测定的花生芽样品作冷冻干燥处理,粉碎过40 目筛,得到花生芽粉末。
1.3.3 花生芽胚轴长度的测定
花生发芽过程中用尺子测量花生芽的胚轴长度,每个处理组30 根花生芽。
1.3.4 花生芽总酚含量的测定
样品醇提物制备:精确称取花生芽粉末0.2 g于50 mL离心管中,加入10 mL体积分数80%乙醇溶液,于超声波清洗器中60 ℃提取30 min,6 000 r/min离心10 min,取上清液备用。
总酚含量测定[13]:根据福林-酚比色法稍作修改,取500 µL上清液,加入福林-酚显色剂1 mL,混匀,然后加入质量分数7.5%碳酸钠溶液1 mL,用蒸馏水定容至10 mL,混合均匀,在室温、避光条件下放置2 h,用紫外-可见分光光度计测定765 nm波长处的吸光度。以试剂空白为参比。以没食子酸为标准品绘制标准曲线,总酚含量以没食子酸质量计。
1.3.5 花生芽总黄酮含量的测定
总黄酮含量测定[14]:根据硝酸铝-亚硝酸钠光度法测定并稍作修改。取500 µL 1.3.4节得到的上清液,加入质量分数5%亚硝酸钠溶液0.5 mL,混匀,静置6 min;加入质量分数10%硝酸铝溶液0.5 mL,混匀,静置6 min。再加入1 mol/L氢氧化钠溶液4 mL,用乙醇定容至10 mL,放置15 min,于510 nm波长处测定吸光度。以试剂空白为参比。以芦丁为标准品绘制标准曲线,总黄酮含量以芦丁质量计。
1.3.6 花生芽白藜芦醇含量的测定
样品的提取[15]:精确称取花生芽粉末1 g于50 mL离心管中,加入10 mL体积分数80%乙醇溶液,于超声波清洗器中60 ℃提取30 min,6 000 r/min离心10 min,取上清液,重复提取2 次,合并上清液并定容至25 mL,过0.45 μm微孔滤膜,得到预处理样品。
高效液相色谱-质谱测定条件:Poroshell 120 EC-C18色谱柱(100 mm×3.0 mm,2.7 μm);流动相:体积分数0.1%甲酸-乙腈(60∶40,V/V);柱温:30 ℃;流速:0.3 mL/min;进样量为3 μL。对样品进行分离后,再经质谱检测,质谱条件为:正离子扫描,选择离子[M+H]+ m/z 229检测。
1.3.7 花生芽抗氧化活性的测定
1.3.7.1 亚铁还原能力的测定
亚铁还原能力(ferric reducing antioxidant power,FRAP)工作液的制备:取0.3 mol/L醋酸钠缓冲液(pH 3.6)50 mL,加入20 mmol/L FeCl3溶液5 mL混匀,再加入5 mL 2,4,6-三吡啶基三嗪溶液(10 mmol/L)混匀,于37 ℃水浴锅中预热备用。
取100 μL 1.3.4节得到的上清液,加入300 μL蒸馏水,加入预热至37 ℃的FRAP工作液3 mL(现用现配),混匀后于暗处反应0.5 h,于593 nm波长处测其吸光度,以蒸馏水作为空白对照[16]。以Trolox作标准曲线,FRAP以每克花生芽相当于Trolox物质的量表示。
1.3.7.2 DPPH自由基清除能力的测定
离心管中加入200 μL 1.3.4节得到的上清液及1.0×10-4 mol/L DPPH-乙醇溶液4.8 mL,混匀后于暗处反应0.5 h,于517 nm波长处测定吸光度Ai;加入200 μL花生芽提取稀释液和4.8 mL乙醇,测定吸光度Aj;加入200 μL乙醇和4.8 mL 1.0×10-4 mol/L DPPH-乙醇溶液,测定吸光度A0
[17]。DPPH自由基清除率按式(1)计算。以Trolox作标准曲线,DPPH自由基清除能力以每克花生芽相当于Trolox物质的量来表示。
1.3.7.3 ABTS阳离子自由基清除能力的测定
ABTS混合液制备:2.45 mmol/L过硫酸钾溶液与7 mmol/L ABTS溶液混匀,在室温暗处放置12 h,即得ABTS工作液。将工作液与乙醇按照体积比约1∶45混合,于734 nm波长处调节其吸光度至0.700,即得ABTS混合液,于30 ℃水浴锅中预热备用。
取200 μL 1.3.4节得到的上清液,加入9.8 mL ABTS混合液(现用现配),在室温下于暗处反应0.5 h,于734 nm波长处测其吸光度,以乙醇作为空白对照[18]。以Trolox作标准曲线,ABTS阳离子自由基清除能力以每克花生芽相当于Trolox物质的量表示。
1.3.8 花生籽粒电解质外渗率的测定
活花生籽粒外液电导率的测定[6]:供试的花生籽粒经HVEF处理后,各组取20 粒,用蒸馏水洗净,再用滤纸吸干水分。将花生籽粒置于250 mL烧杯中,加入100 mL蒸馏水,24 h后摇晃烧杯,使溶液混匀并过滤,测电导率a。
死花生籽粒外液电导率的测定:各组取籽粒20 粒,用蒸馏水洗净,再用滤纸吸干水分。将花生籽粒置于250 mL烧杯中,加入100 mL蒸馏水,煮沸20 min,冷却后加蒸馏水至原刻度,以补充蒸发掉的水分,摇晃烧杯使溶液混匀并过滤,测电导率b。电解质外渗率按式(2)计算。
实验独立重复3 次,结果以平均值±标准差表示。采用SPSS软件分析数据显著性(Duncan’s检验),P<0.05表示差异显著。使用Origin软件作图。
由表1可以看出,花生芽在生长过程中,随着发芽时间的延长胚轴长度逐渐增加;前3 d胚轴生长较为缓慢,从第3天起生长迅速,胚轴长度呈明显增长趋势。不同电场强度对花生芽的生长影响不同,发芽至第7天时,电场强度为250、300 kV/m的处理组胚轴长度略高于对照组,但差异不显著;400 kV/m HVEF处理对花生芽生长的促进作用最大,第7天时胚轴长10.19 cm,显著高于对照组(9.14 cm),提升11.49%。当电场强度达到450 kV/m时,胚轴长度较对照组有所下降,原因可能是HVEF处理具有临界效应,当电场强度超过其阈值范围则会对生长产生不利影响[19]。
表1 花生发芽过程中胚轴长度的变化
Table 1 Changes in hypocotyl length of peanut sprouts during germination
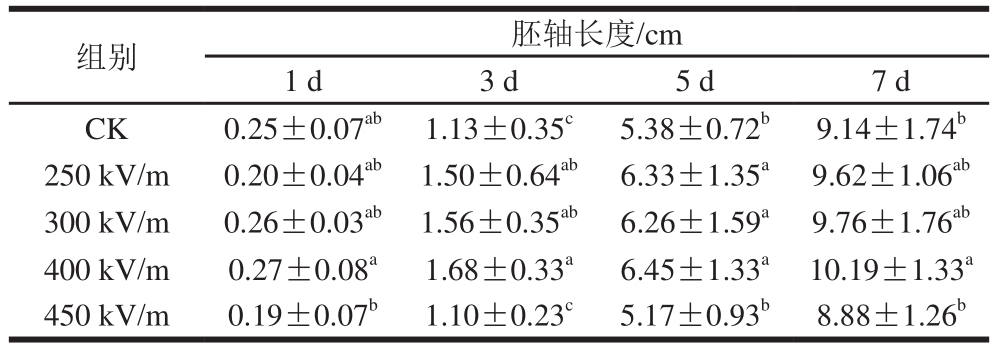
注:同列肩标小写字母不同表示存在显著差异(P<0.05)。下同。
组别 胚轴长度/cm 1 d 3 d 5 d 7 d CK 0.25±0.07ab 1.13±0.35c 5.38±0.72b 9.14±1.74b 250 kV/m 0.20±0.04ab 1.50±0.64ab 6.33±1.35a 9.62±1.06ab 300 kV/m 0.26±0.03ab 1.56±0.35ab 6.26±1.59a 9.76±1.76ab 400 kV/m 0.27±0.08a 1.68±0.33a 6.45±1.33a 10.19±1.33a 450 kV/m 0.19±0.07b 1.10±0.23c 5.17±0.93b 8.88±1.26b
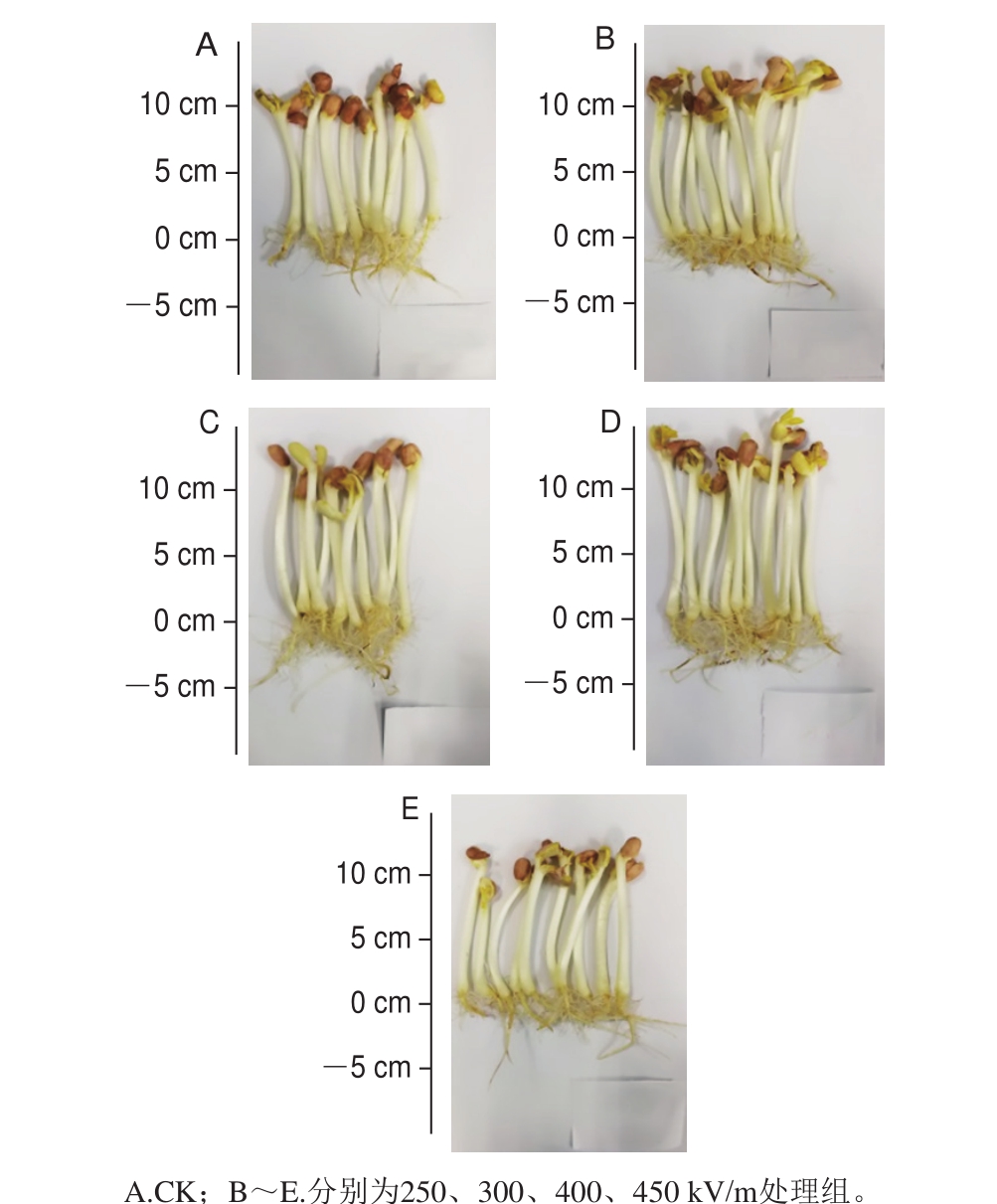
图2 发芽7 d的花生芽形态
Fig. 2 Morphology of peanut sprouts after germination for 7 days
不同电场强度HVEF预处理花生籽粒发芽7 d后花生芽表观形态如图2所示,结合表1结果可知,在本实验条件下400 kV/m HVEF处理最适宜花生芽生长。
经测定,‘小白沙’花生籽粒总酚含量为(149.70±4.59)mg/100 g(图中未显示)。结合图3可知,花生经发芽后,总酚含量呈现不断增加趋势,在第7天时达到最大值。徐世杰等[20]对花生发芽期间总酚及黄酮含量变化进行研究,结果发现在发芽过程中总酚含量呈逐渐上升趋势,未发芽籽粒中总酚含量仅为1.53 mg/g,而经过发芽5 d后其总酚含量可达2.73 mg/g,约为原籽粒的1.8 倍。该结果与本研究结果一致,进一步说明发芽可以提高花生中总酚含量。目前学者认为种子中植物多酚含量经发芽后显著提高的原因可能是木质素会与酚酸交联参与细胞壁构成,因此种子发芽及生长过程中会产生更多的酚酸,从而支撑细胞壁的形成[21]。
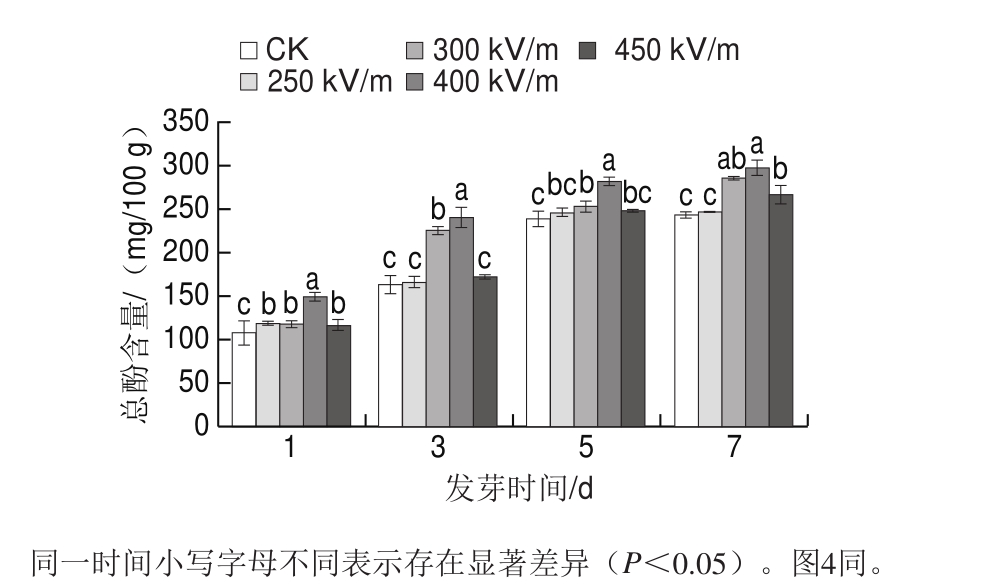
图3 花生发芽过程中总酚含量的变化
Fig. 3 Changes in total phenol conten in peanut sprouts during germination
花生芽生长过程中,HVEF预处理组总酚含量普遍高于对照组,其中400 kV/m处理组总酚含量较高,第7天可达297.67 mg/100 g,较对照组提升了22.09%。根据文献[22]推测,HVEF处理花生籽粒后会引起机体组织细胞的氧化伤害,因此植物体需通过自身应激机制产生更多的抗氧化物质(如酚类)以抵御环境中活性氧对机体的损伤,因而适宜电场强度的HVEF预处理能够促进植物体酚类物质的积累。
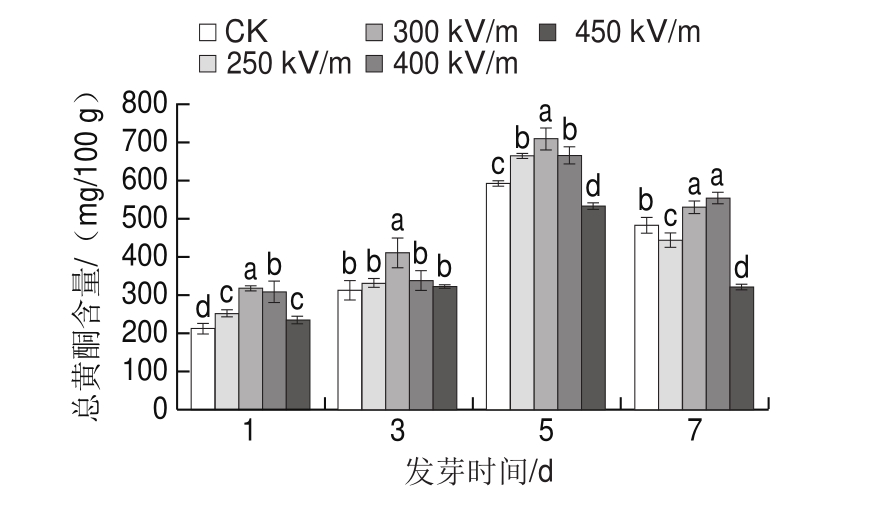
图4 花生发芽过程中总黄酮含量的变化
Fig. 4 Changes in total flavonoid content in peanut sprouts during germination
经测定,‘小白沙’花生籽粒总黄酮含量为(326.00±8.40)mg/100 g(图中未显示)。结合图4可知,花生芽总黄酮含量随着发芽时间的延长呈现先升高后降低的趋势,并且在第5天时达到最大值。有学者研究发现花生籽粒发芽4 d后黄酮含量明显上升,约为未发芽籽粒的2 倍[20],与本研究结果一致,说明花生经过发芽能明显提高其总黄酮含量。
花生发芽过程中,HVEF处理组总黄酮含量普遍高于对照组。花生芽生长第5天时,300 kV/m处理后总黄酮含量最高,达到707.48 mg/100 g,较对照组增加了19.91%。说明电场辅助发芽能够提高花生芽中总黄酮含量,推测其原因可能是植物体在受到外界环境刺激后容易产生更多的多酚和黄酮等抗氧化剂,以清除过多的活性氧物质,这些抗氧化剂既能够直接还原活性氧,又能作为酶的底物发挥作用[22]。

图5 培育7 d后花生芽的白藜芦醇含量
Fig. 5 Resveratrol content in peanut sprouts after germination for 7 days
经测定,‘小白沙’花生籽粒中未检测到白藜芦醇,发芽7 d后其白藜芦醇含量增加至(3.82±0.06)μg/g,说明花生经过发芽,一定程度上提高了白藜芦醇含量,这与Yu Miao等[23]的研究结果一致。此外,由图5可以看出,随着电场强度的不断增加,花生芽中白藜芦醇含量呈现先增加后降低的趋势。与对照组相比,400、450 kV/m处理组的花生芽中白藜芦醇含量显著高于对照组,相比对照组分别提升了32.46%和20.94%;电场强度为400 kV/m的HVEF处理对花生芽中白藜芦醇含量的提升作用最明显。Tang Ke等[24]研究了紫外辐射对花生幼苗中白藜芦醇含量及抗氧化酶活性的影响,发现植物会产生一种机制来降低和修复胁迫损伤,胁迫产生的自由基会激活抗氧化防御系统。白藜芦醇为一种植物抗毒素,受到紫外辐射后,内源性白藜芦醇以及芪合成酶含量迅速增加,植物中丙二醛含量及芽苗叶片表观形态的变化呈现相似性。丙二醛含量是植物细胞膜过氧化程度的体现,植物体内丙二醛含量越高说明植株细胞膜受到的损伤越严重。Tang Ke等[24]测定了紫外辐射实验组过氧化氢、超氧阴离子自由基清除率及抗氧化酶活性的变化,发现其变化趋势与白藜芦醇处理组显示出相似性。因此,推测HVEF预处理后花生发芽可能对植物造成氧化胁迫,故需通过自身应激机制产生更多的植物抗氧化物质以抵御环境中活性氧对机体的损伤,从而导致花生芽中白藜芦醇的积累。
表2 培育7 d后花生芽的抗氧化能力
Table 2 Antioxidant activity of peanut sprouts after germination for 7 days
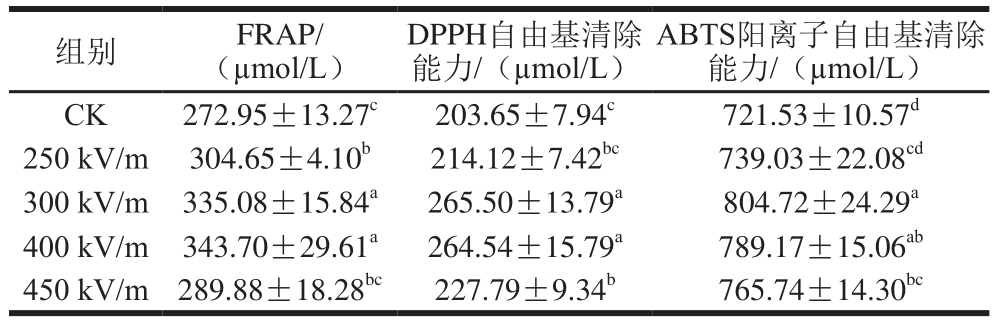
ABTS阳离子自由基清除能力/(µmol/L)CK 272.95±13.27c 203.65±7.94c 721.53±10.57d 250 kV/m 304.65±4.10b 214.12±7.42bc 739.03±22.08cd 300 kV/m 335.08±15.84a 265.50±13.79a 804.72±24.29a 400 kV/m 343.70±29.61a 264.54±15.79a 789.17±15.06ab 450 kV/m 289.88±18.28bc 227.79±9.34b 765.74±14.30bc组别 FRAP/(µmol/L)DPPH自由基清除能力/(µmol/L)
实验结果表明,随着发芽时间的延长,花生芽抗氧化能力不断增加(未在表中显示),于第7天达到最高值,可见花生经过萌发生长可明显增强花生芽的抗氧化活性。如表2所示,生长至第7天时,250、300、400 kV/m处理组花生芽FRAP显著高于对照组,分别为304.65、335.08、343.70 µmol/L,分别较对照组提升11.61%、22.76%和25.93%;300、400、450 kV/m处理组花生芽的DPPH自由基清除能力显著高于对照组,分别较对照组提升了30.37%、29.90%和11.85%,其中300 kV/m处理组效果较佳;300 kV/m处理组ABTS阳离子自由基清除能力(804.72 µmol/L)显著高于对照组,相比对照组提升了11.53%。
Kang等[25]对萌芽花生乙醇提取物DPPH自由基和ABTS阳离子自由基清除能力进行测定,发现萌芽9 d后的花生芽具有较高的抗氧化活性,并且其子叶强于根茎。Limmongkon等[26]对西班牙5 种不同品种花生芽总酚含量及其抗氧化活性进行测定,发现对于不同花生品种,总酚含量及抗氧化活性随发芽时间的延长变化规律有所差别,对于‘Tainan9’花生,其总酚含量及抗氧化活性(DPPH自由基清除能力和FRAP)随发芽时间的延长而增强,说明花生经发芽后可显著提高总酚含量及其抗氧化活性。参考文献[27-28],推测发芽期间抗氧化活性主要源于芽培期间花生中还原性物质的产生,如黄酮类、多酚类以及含巯基和酚羟基的氨基酸等物质。
电解质外渗率是考察籽粒种皮细胞膜完整程度的重要指标之一,籽粒的活力与其电解质外渗率呈负相关。植物组织处于逆境损伤时,因其细胞膜结构遭到破坏或功能受损,使其透性增大,细胞内电解质会有一定程度的渗出,其浸泡液的电导率也会升高。因此,组织外渗液电导率的改变能够在一定程度上反映细胞膜完整程度。如图6所示,HVEF处理组花生籽粒的电解质外渗率比对照组降低了13.34%~15.59%,表明经HVEF处理后的花生籽粒细胞膜完整性较好,具有较高的生理活性。Wang Guixue等[6]研究了HVEF对老化水稻籽粒活性的影响,发现不同电场强度处理组相较对照组水稻籽粒电解质外渗率均有不同程度下降,说明HVEF处理能够维持籽粒细胞膜的完整性。
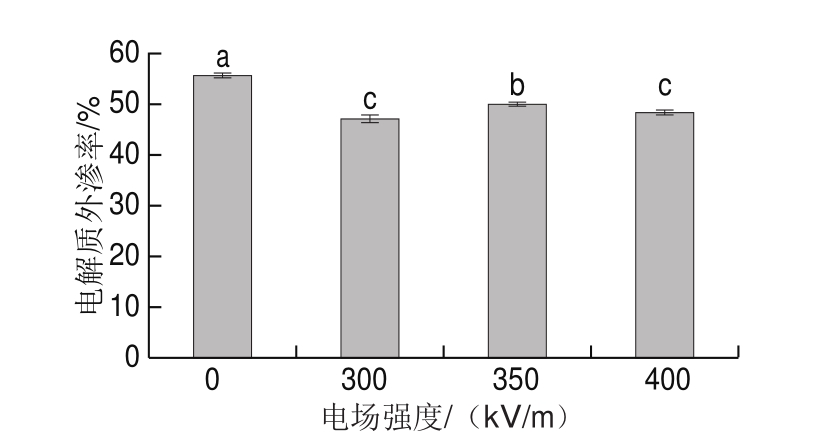
图6 HVEF处理对花生籽粒电解质外渗率的影响
Fig. 6 Effect of HVEF treatment on leakage percentage of electrolytes from peanut seeds
本研究发现,花生籽粒经适宜电场强度的HVEF预处理后发芽,其体内活性成分及抗氧化活性有所提升,花生芽总酚、总黄酮、白藜芦醇含量相比对照组均显著增加,其中300、400 kV/m的HVEF处理对花生芽体内抗氧化成分含量的提升较显著,300 kV/m处理组发芽第5天时总黄酮含量较对照组提升了19.91%;400 kV/m处理组发芽第7天时总酚和白藜芦醇含量较对照组分别提升了22.09%和32.46%。经HVEF处理花生芽的FRAP及对DPPH自由基、ABTS阳离子自由基的清除能力均有不同程度提升,300、400 kV/m处理组花生芽提取物的抗氧化能力较强。由此可见,经适宜外源电场诱导能够提高花生芽的营养价值和保健功能,对功能性花生产品的开发具有一定意义。
[1] 赵贵兴, 陈霞, 刘昊飞, 等. 花生的功能成分、营养价值及其开发利用研究[J]. 安徽农学通报, 2011, 17(12): 39-42. DOI:10.3969/j.issn.1007-7731.2011.12.026.
[2] 李占娟. 花生红衣乙醇提取物及其不同部位抗氧化与抑菌活性研究[D]. 兰州: 兰州理工大学, 2011: 1-2.
[3] 于淼. 花生发芽过程中白藜芦醇富集技术与机理研究[D]. 沈阳: 沈阳农业大学, 2016: 5-6.
[4] 周盛祥, 李法德, 张春庆, 等. 高压静电场处理种子研究现状与发展对策[J]. 农业工程, 2016, 6(4): 88-91. DOI:10.3969/j.issn.2095-1795.2016.04.029.
[5] PATWARDHAN M S, GANDHARE W Z. High voltage electric field effects on the germination rate of tomato seeds[J]. Acta Agrophysica,2013, 20(2): 403-413.
[6] WANG Guixue, HUANG Junli, GAO Weina, et al. The effect of highvoltage electrostatic field (HVEF) on aged rice (Oryza sativa L.) seeds vigor and lipid peroxidation of seedlings[J]. Journal of Electrostatics,2009, 67(5): 759-764. DOI:10.1016/j.elstat.2009.05.004.
[7] HUANG Rukui, SUKPRAKARN S, PHAVAPHUTANON L, et al. A comparison of electric field treatments to hydropriming on cucumber seed germination enhancement[J]. Kasetsart Journal-Natural Science,2006, 40(3): 559-565.
[8] BENÍTEZ V, CANTERA S, AGUILERA Y, et al. Impact of germination on starch, dietary fiber and physicochemical properties in non-conventional legumes[J]. Food Research International, 2013,50(1): 64-69. DOI:10.1016/j.foodres.2012.09.044.
[9] KOORNNEEF M, BENTSINK L, HILHORST H. Seed dormancy and germination[J]. Current Opinion in Plant Biology, 2002, 5(1): 33-36.DOI:10.1199/tab.0119.
[10] OHTSUBO K, SUZUKI K, YASUI Y, et al. Bio-functional components in the processed pre-germinated brown rice by a twinscrew extruder[J]. Journal of Food Composition and Analysis, 2005,18(4): 303-316. DOI:10.1016/j.jfca.2004.10.003.
[11] 孙丽平, 杨美智子, 刘蒙蒙, 等. 不同生长期花生芽中主要营养成分变化[J]. 食品工业科技, 2013, 34(2): 343-346. DOI:10.13386/j.issn1002-0306.2013.02.086.
[12] LIN Bosi, LIEN Tufa, CHAO Maorong, et al. Toxicological and nutraceutical assessments of peanut sprouts as daily supplements to feed Sprague-Dawley rats for 18 weeks[J]. Journal of the Science of Food and Agriculture, 2008, 88(12): 2201-2207. DOI:10.1002/jsfa.3335.
[13] KIM S L, KIM S K, PARK C H. Introduction and nutritional evaluation of buckwheat sprouts as a new vegetable[J]. Food Research International, 2004, 37(4): 319-327. DOI:10.1016/j.foodres.2003.12.008.
[14] 蔡文国, 吴卫, 代沙, 等. 不同种质鱼腥草总酚、黄酮含量及其抗氧化活性[J]. 食品科学, 2013, 34(7): 42-46. DOI:10.7506/spkx1002-6630-201307010.
[15] 曾里, 连春霞, 夏之宁. 超声提取虎杖白藜芦醇及其液质联用分析[J]. 重庆大学学报(自然科学版), 2002, 25(7): 53-56.DOI:10.11835/j.issn.1000-582X.2002.07.015.
[16] 郑晨曦, 郝建雄, 宋曙辉, 等. 微酸性电解水对苦荞芽活性成分及抗氧化能力的影响[J]. 食品科学, 2018, 39(4): 20-25. DOI:10.7506/spkx1002-6630-201804004.
[17] 杨继涛, 李明军, 杜国荣, 等. 不同基因型柿果实抗氧化物成分分析[J]. 西北农业学报, 2010, 19(7): 138-141. DOI:10.3969/j.issn.1004-1389.2010.07.030.
[18] SIDDHURAJU P, BECKER K. The antioxidant and free radical scavenging activities of processed cowpea (Vigna unguiculata(L.) Walp.) seed extracts[J]. Food Chemistry, 2007, 101(1): 10-19.DOI:10.1016/j.foodchem.2006.01.004.
[19] 那日, 冯璐. 我国静电生物学效应机理研究新进展[J]. 物理, 2003,32(2): 87-93. DOI:10.3321/j.issn:0379-4148.2003.02.004.
[20] 徐世杰, 罗庆, 雷清芝, 等. 花生发芽过程中营养物质和功能成分的变化规律研究[J]. 湖北农业科学, 2018, 57(1): 89-92; 96.DOI:10.14088/j.cnki.issn0439-8114.2018.01.023.
[21] ZHOU Z K, ROBARDS K, HELLIWELL S, et al. The distribution of phenolic acids in rice[J]. Food Chemistry, 2004, 87(3): 401-406.DOI:10.1016/j.foodchem.2003.12.015.
[22] CHANDRASEKARA A, SHAHIDI F. Inhibitory activities of soluble and bound millet seed phenolics on free radicals and reactive oxygen species[J]. Journal of Agricultural and Food Chemistry, 2011, 59(1):428-436. DOI:10.1021/jf103896z.
[23] YU Miao, LIU Hongzhi, SHI Aimin, et al. Preparation of resveratrolenriched and poor allergic protein peanut sprout from ultrasound treated peanut seeds[J]. Ultrasonics Sonochemistry, 2016, 28(1): 334-340. DOI:10.1016/j.ultsonch.2015.08.008.
[24] TANG Ke, ZHAN Jicheng, YANG Haorui, et al. Changes of resveratrol and antioxidant enzymes during UV-induced plant defense response in peanut seedlings[J]. Journal of Plant Physiology, 2010,167(2): 95-102. DOI:10.1016/j.jplph.2009.07.011.
[25] KANG H I, KIM J Y, KWON S J, et al. Antioxidative effects of peanut sprout extracts[J]. Journal of the Korean Society of Food Science &Nutrition, 2010, 39(7): 941-946.
[26] LIMMONGKON A, JANHOM P, AMTHONG A, et al. Antioxidant activity, total phenolic, and resveratrol content in five cultivars of peanut sprouts[J]. Asian Pacific Journal of Tropical Biomedicine,2017, 7(4): 332-338. DOI:10.1016/j.apjtb.2017.01.002.
[27] SEO A, MORR C V. Activated carbon and ion exchange treatments for removing phenolics and phytate from peanut protein products[J].Journal of Food Science, 1985, 50(1): 262-263. DOI:10.1111/j.1365-2621.1985.tb13326.x.
[28] WANG S, MECKLING K A, MARCONE M F, et al. Synergistic,additive, and antagonistic effects of food mixtures on total antioxidant capacities[J]. Journal of Agricultural and Food Chemistry, 2011, 59(3):960-968. DOI:10.1021/jf1040977.
Effect of High-Voltage Electrostatic Field on Bioactive Components and Antioxidant Activity of Peanut Sprouts
ZHANG Qian, ZHENG Yaying, LI Yan, et al. Effect of high-voltage electrostatic field on bioactive components and antioxidant activity of peanut sprouts[J]. Food Science, 2019, 40(17): 190-195. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-20180706-087. http://www.spkx.net.cn