
图1 各组婴幼儿肠道菌群稀释曲线
Fig. 1 Rarefaction curve of intestinal flora in infants from each group
微生物与人体高度共生,在人体肠道中数量、种类多,甚至被看作一个人体“器官”,其构成极为复杂多样,已有大量研究表明肠道微生物与人体的诸多疾病,如炎症、肥胖症、糖尿病、肿瘤等显著相关[1-2]。人生初期的1 000 d是肠道菌群定植关键期,遗传、环境、月龄、分娩方式及喂养方式均影响肠道微生物的定植[3-4]。在诸多因素中,喂养方式、分娩方式及月龄对肠道菌群影响较为显著。有研究表明,喂养方式对6 月龄的婴幼儿肠道菌群构建和生长发育影响显著[5-8]。母乳作为婴幼儿的首选食物,除了能提供婴幼儿所需的各种营养物质之外,还含有丰富的微生物信息及免疫因子,可使微生物快速定植在婴幼儿肠道中,这些肠道菌群的定植有助于婴幼儿先天免疫系统的形成[9]。母乳喂养的婴幼儿患病率(如过敏性疾病、自身免疫性疾病和肥胖症等)大幅降低[9-11]。由于受到社会因素、生理原因、个人健康等因素的影响,我国母乳喂养率偏低,所以选择适宜的配方奶粉对婴幼儿成长发育至关重要。近年来,人们对山羊乳的营养价值、生物利用率及功能等方面进行了大量系统性研究,取得较大进展,以山羊乳为基质的婴配奶粉也越来越受到青睐,特别是对过敏或患肠道疾病的婴幼儿尤为有益[12-13]。但目前对于羊乳配方粉、牛乳配方粉及母乳喂养对婴幼儿肠道菌群构建的影响鲜见报道。
分娩方式亦是婴幼儿肠道菌群构建的关键因素之一,影响着早期婴幼儿肠道微生态的形成[14-15],新生儿肠道菌群的构建及多样性主要取决于母体和新生儿之间的菌群交换,剖宫产破坏了母婴之间肠道菌群的交换方式,使新生儿突然从子宫环境来到外界环境,从而造成新生儿的肠道菌群传递链条缺失,增加了婴幼儿患腹腔疾病及肥胖的风险[1,16-17]。而目前尚鲜有在相同月龄、相同喂养方式下研究分娩方式对婴幼儿肠道菌群的影响,也鲜有在相同月龄、相同分娩方式下喂养母乳、牛乳、羊乳配方粉对婴幼儿肠道菌群影响的差异分析,不同的分娩方式及喂养方式对婴幼儿肠道菌群的构建具有重要的影响。因此,本研究基于高通量测序(Illumina)技术探讨不同喂养方式、不同分娩方式(顺产、剖宫产)对不同月龄(I段:0~6 个月、II段:6~12 个月、III段:12~36 个月)婴幼儿肠道菌群构建的影响,重点分析了在其他两种因素相同的情况下,喂养方式、分娩方式、月龄对婴幼儿肠道菌群的影响,降低其他差异造成的影响,从而为婴配食品开发及婴幼儿科学喂养提供较为准确的技术支撑,为婴幼儿的健康成长提供理论依据。
粪便基因组DNA提取试剂盒 北京天根生化科技有限公司;GeneJET胶回收试剂盒、Ion Plus Fragment Library Kit 48 rxns建库试剂盒 美国Thermo Scientific公司;其他试剂均为国产分析纯。
SW-CJ-2D型双人单面超净台 苏州净化设备有限公司;TDL-5-A型低速台式离心机 上海安亭科学仪器厂;立式蒸汽灭菌器 上海博迅实业有限公司医疗设备厂;T100型聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Bio-Rad公司;Ion S5TMXL美国Thermo Scientific公司。
1.3.1 婴幼儿粪便样本的采集
粪便样本采集于陕西地区0~36 个月内健康婴幼儿,均为足月正常体质量新生儿,一周内无腹泻、无胃肠道病史、未使用过任何抗生素类药物。根据采样原则及分组共采集婴儿粪便样本54 份,包括0~6 月(I段)顺产母乳喂养(MV1)婴幼儿6 名,0~6 月剖宫产母乳喂养(MF1)婴幼儿6 名,0~6 月顺产羊乳配方粉喂养(YV1)婴幼儿6 名,6~12 月(II段)顺产羊乳配方粉喂养(YV2)婴幼儿6 名,12~36 月(III段)顺产羊乳配方粉喂养(YV3)婴幼儿6 名,6~12 月剖宫产羊乳配方粉喂养(YF2)婴幼儿6 名,12~36 月剖宫产羊乳配方粉喂养(YF3)婴幼儿6 名,6~12 月顺产牛乳配方粉喂养(NV2)婴幼儿6 名,12~36 月顺产牛乳配方粉喂养(NV3)婴幼儿6 名。采集粪便时,采取粪便内部,避免混入尿液和其他杂质,放于无菌采样器中,并于2 h内送入实验室,冻存于-80 ℃冰箱。
1.3.2 DNA提取和测序
采用十六烷基三甲基溴化铵方法提取样本的基因组DNA,利用琼脂糖凝胶电泳检测DNA的纯度和质量浓度,取适量的样品于离心管中,使用无菌水稀释样品至1 ng/μL。以稀释后的基因组DNA为模板对16S rRNA基因V3~V4区对样品进行PCR扩增。使用带Barcode的特异引物(515F-806R)。根据PCR产物质量浓度进行等体积混样,充分混匀后使用1×TAE缓冲液配制的质量分数2%琼脂糖胶电泳纯化,剪切回收目标条带。使用GeneJET胶回收试剂盒回收产物。使用Ion Plus Fragment Library Kit 48 rxns建库试剂盒进行文库的构建,构建好的文库经过Qubit法定量且文库检测合格后,使用Ion S5TMXL进行测序。
1.3.3 生物信息学分析
利用Uparse软件[18]对所有样品的全部Clean Reads进行聚类,以97%的一致性将序列聚类成为操作分类单元(operational taxonomic units,OTUs),对OTUs代表序列进行物种注释,综合运用Mothur方法、SILVA数据库[19]和真核微生物的小亚基rRNA数据库[20]对物种进行注释分析,获得分类学信息,并分别在各个分类水平统计各样本的群落组成。使用MUSCLE软件[21]进行快速多序列比对,得到所有OTUs代表序列的系统发生关系。最后对各样品的数据进行均一化处理,以样品中数据量最少的OTUs为标准进行均一化处理,后续的Alpha多样性分析和Beta多样性分析都是基于均一化处理后的数据。Alpha多样性分析反映样品的菌群丰度和多样性,其描述方法有Chao1指数、ACE指数、Shannon指数、Simpson指数。Chao1、ACE指数越大,表明菌群丰度越高;Shannon指数越大,说明群落多样性越高;Simpson指数越大,说明群落多样性越低。Beta多样性分析中的LefSe分析使用LefSe软件,设置线性判别分析(linear discriminant analysis,LDA)得分的筛选值为4。
菌群多样性数据以平均值±标准差表示,采用SPSS Statistics 20.0软件进行单因素方差分析,P<0.05表示差异显著。

图1 各组婴幼儿肠道菌群稀释曲线
Fig. 1 Rarefaction curve of intestinal flora in infants from each group
由图1可知,随着测序数据量的增加,曲线趋于平缓,说明测序深度已经基本覆盖到样品中所有的物种。当测序数据量相同时,除III段婴幼儿以外,顺产婴幼儿菌群多样性高于剖宫产,这是因为剖宫产破坏了母婴之间肠道菌群的交换,顺产婴幼儿菌群多样性较高;羊乳配方粉喂养组菌群多样性高于母乳喂养和牛乳配方粉喂养组,这为选择合适的配方粉提供了参考依据。在顺产羊乳配方粉喂养的婴幼儿中,II段婴幼儿菌群多样性最高,III段次之,I段最低,推测与婴幼儿的健康发育相关,II段作为婴幼儿系统发育成熟的关键时期,生长所需营养及热能量最多,故婴幼儿肠道菌群最为丰富,多样性最高。
表1 不同分娩方式各组婴幼儿肠道菌群的OTU数量及Alpha多样性
Table 1 OTU number and alpha diversity of intestinal flora in infants born by different delivery modes
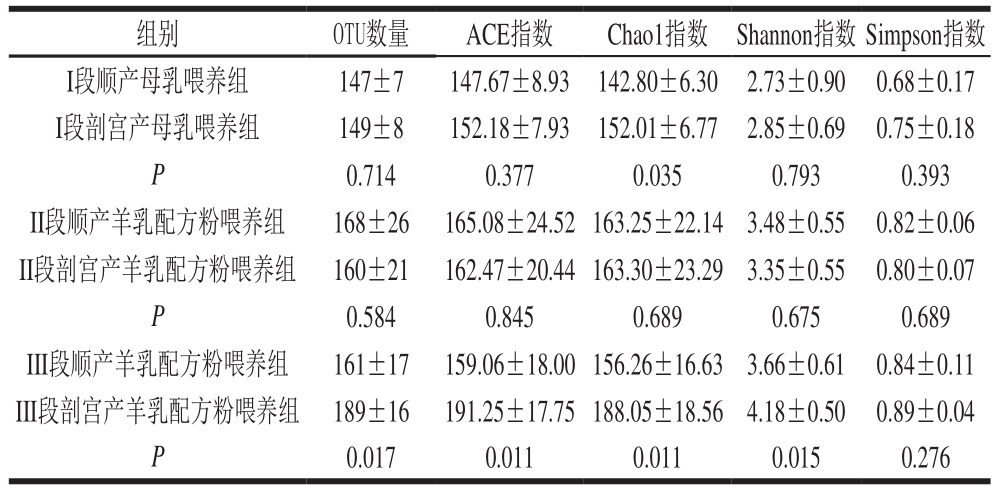
注:P<0.05表示差异显著。表2同。
组别 OTU数量 ACE指数 Chao1指数 Shannon指数 Simpson指数I段顺产母乳喂养组 147±7 147.67±8.93 142.80±6.30 2.73±0.90 0.68±0.17 I段剖宫产母乳喂养组 149±8 152.18±7.93 152.01±6.77 2.85±0.69 0.75±0.18 P 0.714 0.377 0.035 0.793 0.393 II段顺产羊乳配方粉喂养组 168±26 165.08±24.52 163.25±22.14 3.48±0.55 0.82±0.06 II段剖宫产羊乳配方粉喂养组 160±21 162.47±20.44 163.30±23.29 3.35±0.55 0.80±0.07 P 0.584 0.845 0.689 0.675 0.689 III段顺产羊乳配方粉喂养组 161±17 159.06±18.00 156.26±16.63 3.66±0.61 0.84±0.11 III段剖宫产羊乳配方粉喂养组 189±16 191.25±17.75 188.05±18.56 4.18±0.50 0.89±0.04 P 0.017 0.011 0.011 0.015 0.276
表1结果表明,在所有样品中,I段母乳喂养组和II段羊乳配方粉喂养组不同分娩方式下微生物丰度差异不显著,在III段羊乳配方粉喂养组中,分娩方式不同,微生物丰度差异显著,这是由于III段婴幼儿辅食种类多,从而导致微生物丰度差异较大[22-23]。同时,Alpha多样性分析也表明,在I段、II段喂养组中,顺产和剖宫产组各指标差异不显著,但在I段喂养组中Chao1指数差异显著。在III段喂养组中,两种分娩方式下婴幼儿粪便肠道菌群的多样性构成存在明显差异。
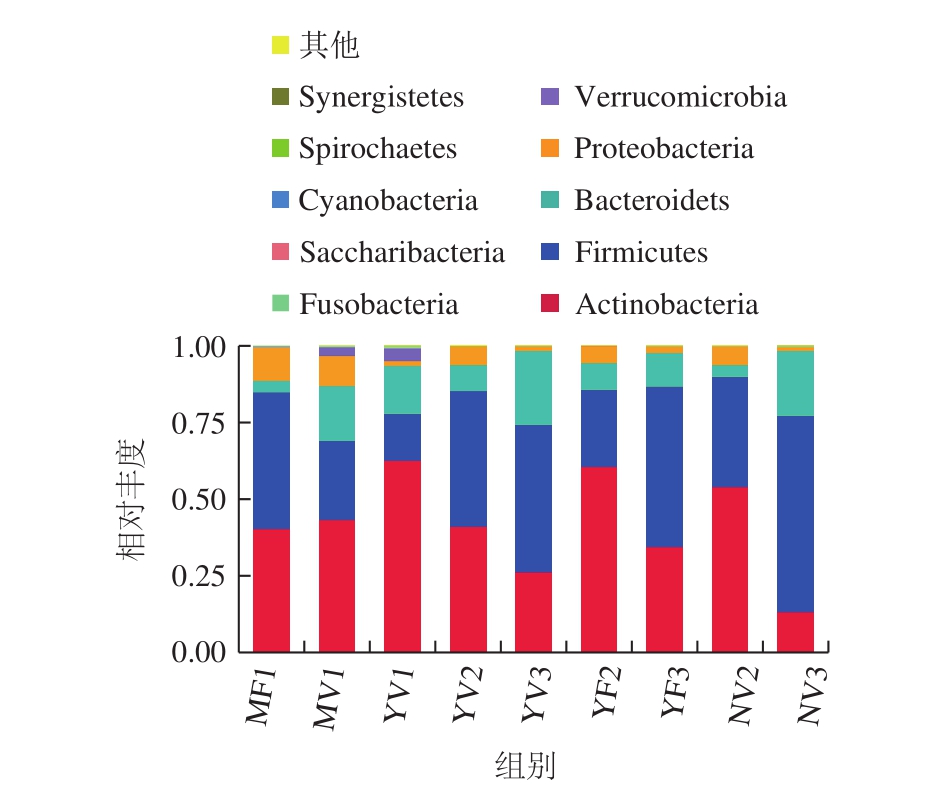
图2 各组婴幼儿肠道菌群在门水平上的相对丰度
Fig. 2 Relative abundance of intestinal flora in infants from each group at the level of phylum
通过对所有样品中微生物的16S rRNA基因V3~V4区序列进行测序,由图2可知,共检测到10 个主要菌门,但是所有样品中99.09%以上的序列主要由4 个菌门组成,分别是Actinobacteria(放线菌门)、Firmicutes(厚壁菌门)、Bacteroidets(拟杆菌门)、Proteobacteria(变形菌门)。所有样品均以Actinobacteria、Firmicutes为优势菌门。MV1组中Actinobacteria、Firmicutes、Bacteroidets和Proteobacteria的相对丰度分别是43.74%、25.48%、17.93%、9.71%;MF1组分别为40.83%、44.31%、3.81%、11.01%;YV2组分别为41.44%、43.84%、8.38%、6.27%;YF2组分别为60.76%、24.85%、8.66%、5.70%;YV3组分别为26.58%、47.73%、24.07%、1.58%;YF3组分别为34.77%、51.94%、11.10%、2.16%;YV1组分别是62.98%、15.23%、15.45%、1.51%;YV2组分别是41.44%、43.84%、8.38%、6.27%;NV2组分别是54.20%、35.71%、3.91%、6.11%;YV3组分别是26.58%、47.73%、24.07%、1.58%;NV3组分别是13.87%、63.53%、21.29%、1.29%。在0~6 月母乳喂养组中,顺产婴幼儿和剖宫产婴幼儿优势菌群组成相同,但顺产婴幼儿Actinobacteria丰度较高,剖宫产婴幼儿Firmicutes丰度明显高于顺产婴幼儿;在6~12 月羊乳配方粉喂养组中,顺产婴幼儿Firmicutes丰度高于剖宫产婴幼儿,但剖宫产婴幼儿Actinobacteria丰度高于顺产婴幼儿;在12~36 月羊乳配方粉喂养组中,顺产婴幼儿Actinobacteria、Firmicutes丰度均低于剖宫产婴幼儿。在0~6 月母乳喂养组中,顺产组检测到了Verrucomicrobia(疣微球菌门),而剖宫产组没有检测到。尽管统计学分析表明4 种菌门在相同月龄、相同喂养方式下差异不显著(P>0.05),但分娩方式不同,优势菌门构成比例存在一定差异。在0~6 月母乳喂养组中,顺产组比剖宫产组Actinobacteria相对丰度更高,Firmicutes较少,可能与剖宫产影响了新生儿的肠道菌群相关,本研究结果也为进一步了解分娩方式与婴幼儿健康发育之间的关联提供依据。
由图3可以看出,在科水平上,在0~6 月母乳喂养组中,顺产组以Staphylococcaceae(链球菌科)为优势菌,而剖宫产组以Clostridiaceae(梭菌科)为优势菌;在6~12 月羊乳配方粉喂养组中,顺产组中优势菌为Enterobacteriaceae(肠杆菌科),剖宫产组中优势菌为Prevotellaceae(普氏菌科);在12~36 月羊乳配方粉喂养组中,顺产组以Bacteroidaceae(拟杆菌科)和Ruminococcaceae(瘤胃菌科)为优势菌,剖宫产组以Alcaligenaceae(粪产碱菌)为优势菌。
综上,在相同喂养方式、相同月龄婴幼儿中,分娩方式对婴幼儿肠道菌群构建多样性影响不显著,但是显著影响主要优势菌的丰度。

图3 各组婴幼儿肠道菌群丰度聚类图
Fig. 3 Species abundance of intestinal flora in infants from each group
表2 不同喂养方式各组婴幼儿肠道菌群的OTU数量及Alpha多样性
Table 2 OTU number and alpha diversity of intestinal flora in infants fed by different methods

组别 OTU数量 ACE指数 Chao1指数 Shannon指数 Simpson指数I段顺产母乳喂养组 147.00±7.28 147.67±8.93 142.80±6.30 2.73±0.90 0.68±0.17 I段顺产羊乳配方粉喂养组 159.00±6.66 163.07±10.41 157.72±2.84 3.14±0.68 0.77±0.11 P 0.013 0.020 0.029 0.394 0.289 II段顺产羊乳配方粉喂养组 168.00±26.05 165.08±24.52 163.25±22.14 3.48±0.55 0.82±0.06 II段顺产牛乳配方粉喂养组 146.00±27.14 141.01±27.80 139.77±28.74 3.05±0.68 0.74±0.10 P 0.182 0.143 0.144 0.247 0.123 III段顺产羊乳配方粉喂养组 161.00±17.08 159.06±18.00 156.26±16.63 3.66±0.61 0.84±0.11 III段顺产牛乳配方粉喂养组 181.00±7.66 181.58±8.82 177.51±8.22 4.47±0.28 0.92±0.01 P 0.030 0.020 0.019 0.015 0.091
由表2可知,在I段顺产组,羊乳配方粉喂养组OTU数量高于母乳喂养组,表明羊乳配方粉喂养组肠道菌群丰度较高;其ACE指数和Chao1指数显著高于母乳喂养组,也表明了羊乳配方粉喂养组肠道菌群丰度较高;而两组Shannon指数和Simpson指数无显著差异。在II段顺产组中,羊乳配方粉喂养组肠道菌群丰度略高于牛乳配方粉喂养组,但差异不显著。王逸斌等[12]的研究表明,喂养羊乳配方粉对婴幼儿的生长发育有促进作用,而本研究从基因层次阐明了羊乳配方粉对婴幼儿健康成长有一定的促进作用。在III段顺产组中,两种喂养方式差异显著,这是由于12~36 月龄的婴幼儿加入大量辅食,配方粉添加量相对较少[23]。
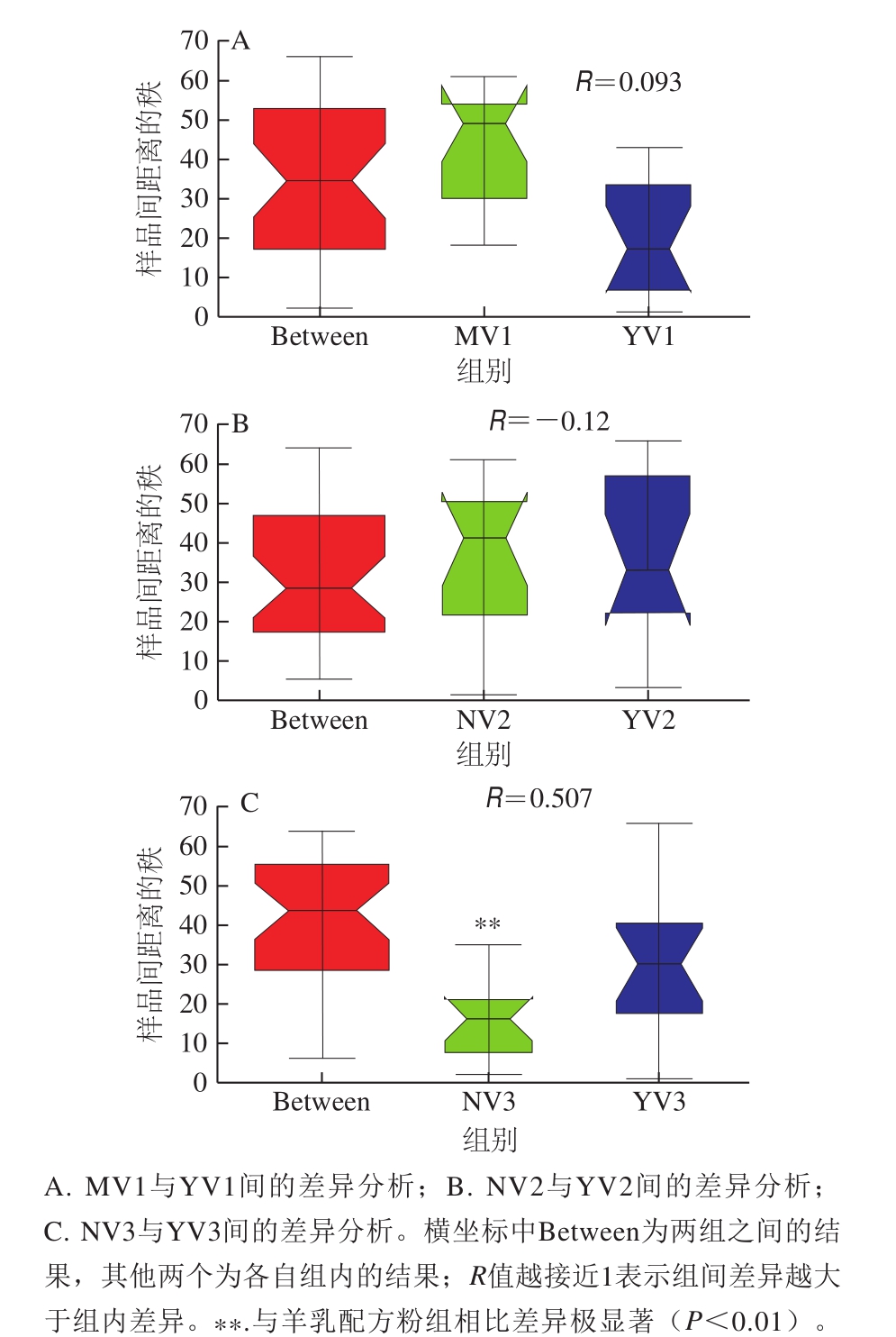
图4 各组婴幼儿肠道菌群结构差异性分析
Fig. 4 Analysis of difference in intestinal community structure between groups
图4 A显示I段顺产婴幼儿中母乳喂养组和羊乳配方粉喂养组间有差异(R>0),但差异不显著(P>0.05);图4B表明II段顺产婴幼儿中羊乳配方粉喂养组和牛乳配方粉喂养组无差异(R<0);图4C表明III段顺产婴幼儿中羊乳配方粉和牛乳配方粉喂养组间差异极显著(P<0.01),与表4得到的结论一致。
图5显示,在属水平上,I段顺产婴幼儿中,母乳喂养和羊乳配方粉喂养主要由Bifidobacterium(双歧杆菌属)、Clostridium_sensu_stricto_1(梭菌属)、Bacteroides(拟杆菌属)组成,羊乳配方粉喂养婴幼儿的Bifidobacterium丰度大于母乳喂养,而母乳喂养婴幼儿的Clostridium_sensu_stricto_1、Bacteroides丰度略大于羊乳喂养;II段顺产婴幼儿中,牛乳配方粉和羊乳配方粉喂养婴幼儿在属水平菌群组成无显著差异,但羊乳配方粉喂养组Bacteroides、Enterococcus(肠球菌属)丰度略大于牛乳配方粉喂养组,而Bifidobacterium、Streptococcus(链球菌属)略小于牛乳配方粉喂养组;III段顺产婴幼儿中,两组Bifidobacterium的丰度都明显小于I、II段婴幼儿,而羊乳配方粉喂养组Bifidobacterium、Bacteroides、Prevotella_9(普拉梭菌属)的丰度都高于牛乳配方粉喂养组。这与之前的研究结果[7]有差异,可能的原因是本研究在相同的分娩方式、相同的月龄下进行,降低了其他差异造成的影响。因此,不同月龄下的婴幼儿肠道菌群丰度有显著差异,对于相同月龄、相同分娩方式的婴幼儿,母乳、羊乳配方粉、牛乳配方粉喂养组肠道菌群组成无明显差异,但丰度存在着一定的差异。
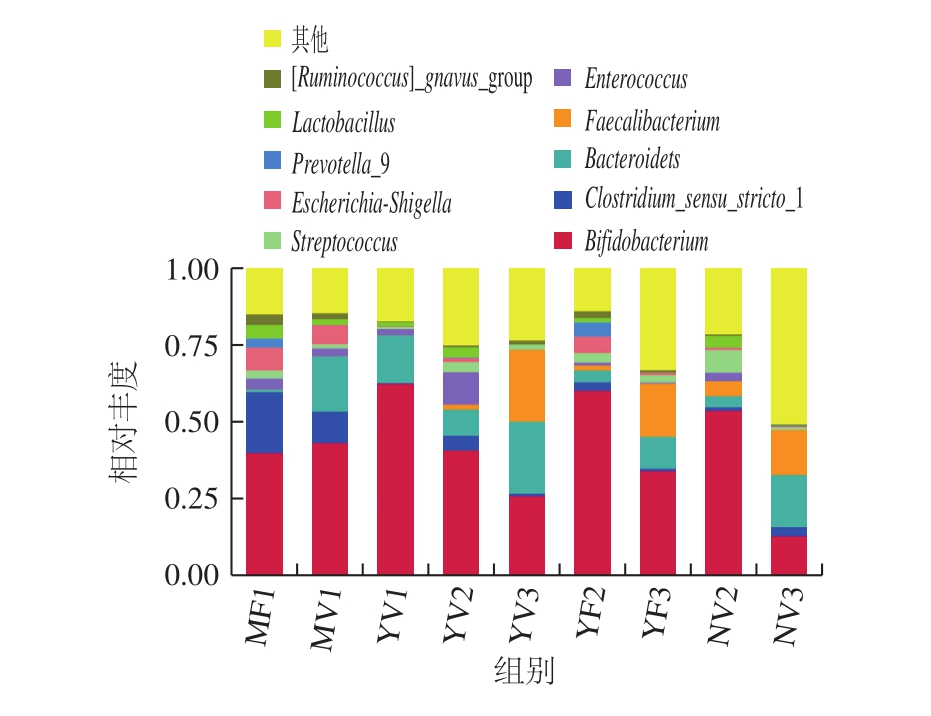
图5 各组婴幼儿肠道菌群在属水平上的相对丰度
Fig. 5 Relative abundance of intestinal flora in infants from each group at the level of genus
由图2可以看出,在门水平上,0~6、6~12、12~36 月羊乳配方粉顺产婴幼儿中的优势菌组成无显著差异,但其构成丰度存在一定差异,4 种优势菌门分别占I、II、III段所有菌门的95.17%、99.94%、99.96%。Actinobacteria丰度在I段婴幼儿中最高,II段次之,III段最低;Firmicutes、Bacteroidets和Proteobacteria丰度在II段婴幼儿中最高,I段次之,III段最低。说明随着婴幼儿的生长发育,肠道菌群有着明显变化。因此,本实验在相同的分娩方式和喂养方式下研究3 个月龄婴幼儿肠道菌群的定植。
对3 个月龄阶段顺产羊乳配方粉喂养婴幼儿进行LefSe分析,不同月龄婴幼儿肠道菌群组成存在一定差异。如图6A所示,6~12 月顺产羊乳配方粉喂养组区别于其他两组的微生物菌群分别是Enterococcaceae(肠球菌科)、Lactobacillales(乳杆菌目)、Bacilli(芽孢杆菌纲)、Clostridiaceae(梭菌科)、Veillonellaceae(韦荣氏球菌科)、Selenomonadales、Negativicutes、Enterobacteriaceae(肠杆菌科)、Enterobacteriales(肠杆菌目);12~36 月顺产羊乳配方粉喂养组中Ruminococcaceae(瘤胃球菌科)是优势菌群。由图6B可知,假链状双歧杆菌是0~6 月婴幼儿中的优势菌种;Ruminococcaceae和青春双歧杆菌是12~36 月婴幼儿优势菌;Lactobacillales、Enterococcaceae、Clostridiaceae、Veillonellaceae是6~12 月婴幼儿的优势菌。6~12 月婴幼儿中肠道菌群最丰富。
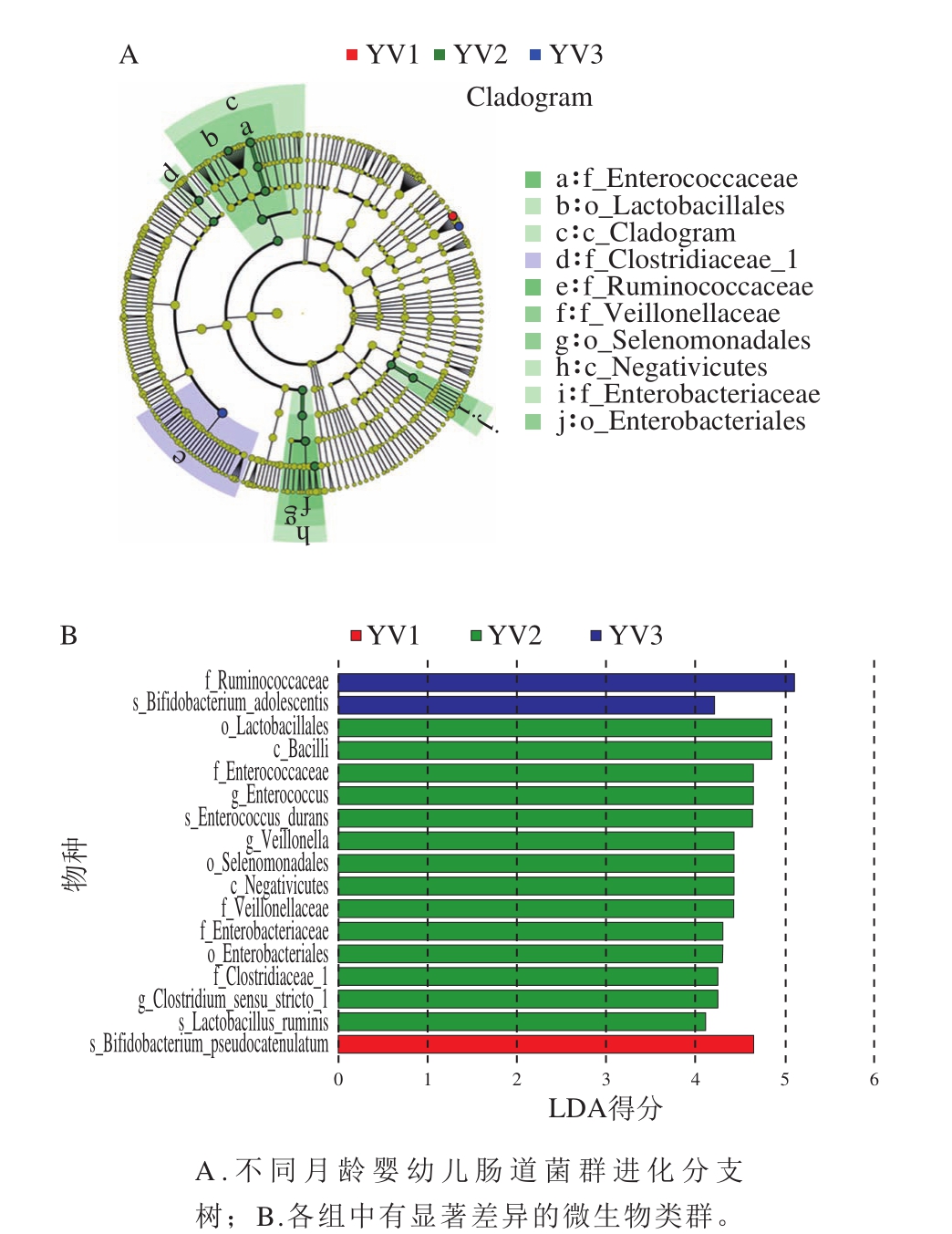
图6 不同月龄羊乳配方粉喂养顺产婴幼儿肠道菌群的差异
Fig. 6 Difference in intestinal flora in infants of different ages
婴幼儿肠道微生物的建立是一个复杂的过程,其定植的过程受多种因素的影响,其中喂养方式、月龄和分娩方式是婴幼儿肠道菌群建立的主要因素。之前虽然有关于喂养方式和分娩方式对婴幼儿肠道菌群影响的研究,但在相同月龄、相同喂养方式下分娩方式对婴幼儿肠道菌群影响的研究甚少,而且鲜有研究在相同月龄、相同分娩方式下进行喂养母乳、牛乳、羊乳配方粉对婴幼儿肠道菌群影响的差异分析。因此,本研究重点分析了在其他两种因素相同的情况下,喂养方式、分娩方式、月龄对婴幼儿肠道菌群的影响。
有研究表明,早期微生物在婴幼儿肠道中的定植受分娩方式的影响,定植在顺产和剖宫产婴幼儿肠道中的微生物不同[22-24]。本研究通过高通量测序技术分析分娩方式对相同喂养方式、不同月龄下的婴幼儿肠道菌群的影响,与文献[22-24]的结果不同。结果表明,在I、II段喂养组中,分娩方式不同,婴幼儿微生物丰度有差异但不显著,而在III段喂养组中微生物丰度差异显著,是由于III段喂养组辅食的添加占主导,婴幼儿个体差异较大,最近也有研究表明分娩方式未对婴幼儿生长发育产生影响[25],也佐证了本研究结果。
一些研究报道,在新生儿期,母乳喂养和人工喂养婴幼儿肠道菌群均以双歧杆菌为优势菌,但在母乳喂养婴幼儿肠道中双歧杆菌丰度较高[26];而人工喂养婴幼儿粪便中拟杆菌、肠杆菌、梭菌、肠球菌、链球菌等的丰度要高于母乳喂养婴幼儿[13]。另外一些研究认为,母乳喂养婴幼儿与人工喂养婴幼儿粪便中均含有大量的肠杆菌,而双歧杆菌数量在两组之间没有太大区别[27]。早期对婴幼儿肠道菌群的研究主要建立在传统培养技术上,研究结果存在较大争议。近十几年来,Haarman等采用荧光原位杂交及核酸探针技术对出生后20 d内母乳喂养和人工喂养婴幼儿肠道菌群进行了对比,发现所有母乳喂养婴幼儿肠道均以双歧杆菌为优势菌,其次是乳酸杆菌和链球菌;而人工喂养婴幼儿肠道中乳酸杆菌和双歧杆菌的数量相似[28]。本实验基于高通量测序技术,研究在月龄、分娩方式相同的情况下喂养方式对婴幼儿肠道菌群的影响,结果发现在0~6 月顺产婴幼儿中,Actinobacteria在羊乳配方粉喂养组占62.98%,远高于母乳喂养组(43.74%);羊乳配方粉喂养组双歧杆菌丰度也高于母乳喂养组。这一结果作为喂养方式对婴幼儿肠道菌群的新发现,对婴幼儿配方粉的开发有一定价值。
虽然母乳喂养被认为是金标准,母乳是婴幼儿生长发育最理想的营养物质,但由于各种原因导致我国母乳喂养率偏低,而羊乳以其低致敏性和高营养价值的优势,更适合作为婴幼儿配方奶粉的原料[13,25,29]。本研究采用高通量测序技术检测,发现I段顺产婴幼儿中母乳喂养和羊乳配方粉喂养组间肠道菌群有差异但不显著,母乳喂养和羊乳配方粉喂养主要由Bifidobacterium、Clostridium_sensu_stricto_1、Bacteroides组成,并且羊乳配方粉喂养的婴幼儿Bifidobacterium丰度大于母乳喂养;II段顺产婴幼儿中羊乳配方粉喂养组和牛乳配方粉喂养组无显著差异;III段顺产婴幼儿中羊乳配方粉和牛乳配方粉喂养组间差异明显,两组不同喂养方式Bifidobacterium的丰度都明显小于I、II段婴幼儿,而羊乳配方粉喂养组Bifidobacterium、Bacteroides、Prevotella_9的丰度都高于牛乳配方粉喂养组。
婴幼儿肠道菌群的建立是一个动态演变的过程,而婴幼儿期肠道微生物组成与机体病变有很大关系,因此研究婴幼儿期肠道微生态以及合理建立尤为重要,但很少有对婴幼儿0~36 个月整个阶段肠道菌群变化的研究。本研究通过排除喂养方式和分娩方式的影响,选择顺产喂养羊乳配方粉的婴幼儿,降低了其他因素的影响,利用高通量测序技术比较了婴幼儿3 个阶段肠道菌群的变化。发现3 个阶段优势菌门都是由Actinobacteria、Firmicutes、Bacteroidets和Proteobacteria组成,但是丰度存在明显差异,随着月龄的增长,Actinobacteria和Bifidobacterium的丰度逐渐降低;6~12 月婴幼儿Lactobacillales相对丰度较I、III段更高。本研究结果为配方粉的研发提供理论依据。
目前,关于分娩方式及月龄相同的条件下,羊乳配方粉对肠道菌群影响的研究甚少,故本实验通过高通量测序技术研究了分娩方式、喂养方式、月龄对婴幼儿肠道菌群的影响,表明相同喂养方式、相同月龄的婴幼儿,分娩方式对其肠道菌群的影响有一定差异;相同分娩方式、相同月龄时,喂养羊乳配方粉的婴幼儿肠道菌群丰度更高。本研究对相同分娩方式、相同喂养方式的婴幼儿在生命初期(0~36 个月)肠道菌群组成、结构进行分析,为婴幼儿的健康、代谢及相关疾病的防御提供参考依据。
[1] CHIU C M, HUANG W C, WENG S L, et al. Systematic analysis of the association between gut fl ora and obesity through high-throughput sequencing and bioinformatics approaches[J]. BioMed Research International, 2014, 2014: 906168. DOI:10.1155/2014/906168.
[2] SIM K, POWELL E, SHAW A G, et al. The neonatal gastrointestinal microbiota: the foundation of future health?[J]. Archives of Disease in Childhood-Fetal and Neonatal Edition, 2013, 98(4): 362-364.DOI:10.1136/archdischild-2012-302872.
[3] MATAMOROS S, GRAS-LEGUEN C, FRANÇOISE L V, et al.Development of intestinal microbiota in infants and its impact on health[J]. Trends in Microbiology, 2013, 21(4): 167-173.DOI:10.1016/j.tim.2012.12.001.
[4] CONG X, XU W, ROMISHER R, et al. Gut microbiome and infant health: brain-gut-microbiota axis and host genetic factors[J]. Yale Journal of Biology & Medicine, 2016, 89(3): 299-308.
[5] FAN W G, HUO G C, LI X M, et al. Impact of diet in shaping gut microbiota revealed by a comparative study in infants during the fi rst six months of life[J]. Journal of Microbiology and Biotechnology,2014, 24: 133-143. DOI:10.4014/jmb.1309.0902.
[6] FERNÁNDEZ L, LANGA S, MARTÍN V, et al. The human milk microbiota: origin and potential roles in health and disease[J].Pharmacological Research, 2013, 69(1): 1-10. DOI:10.1016/j.phrs.2012.09.001.
[7] 王秋丽, 吕红艳, 李佳红. 不同喂养方式对新生儿肠道菌群定植的影响[J]. 中国妇幼保健, 2017, 32(11): 2506-2509. DOI:10.7620/zgfybj.j.issn.1001-4411.2017.11.83.
[8] SONG S J, DOMINGUEZBELLO M G, KNIGHT R. How delivery mode and feeding can shape the bacterial community in the infant gut[J]. Canadian Medical Association Journal, 2013, 185(5): 373-374.DOI:10.1503/cmaj.130147.
[9] JEURINK P V, VAN BERGENHENEGOUWEN J, JIMÉNEZ E, et al.Human milk: a source of more life than we imagine[J]. Beneficial Microbes, 2013, 4(1): 17-30. DOI:10.3920/BM2012.0040.
[10] COLLADO M C, RAUTAVA S, ISOLAURI E, et al. Gut microbiota:a source of novel tools to reduce the risk of human disease?[J].Pediatric Research, 2015, 77(1/2): 182-188. DOI:10.1038/pr.2014.173.
[11] 赵洁, 孙天松. 母乳对婴儿肠道菌群及免疫系统影响的研究进展[J]. 食品科学, 2017, 38(1): 289-296. DOI:10.7506/spkx1002-6630-201701048.
[12] 王逸斌, 朱晗, 朱凌燕, 等. 全羊乳蛋白配方羊奶粉对婴儿生长发育的影响研究[J]. 中国食物与营养, 2013, 19(8): 78-81. DOI:10.3969/j.issn.1006-9577.2013.08.021.
[13] HAN Y S, CHANG E Y, KIM J, et al. Association of infant feeding practices in the general population with infant growth and stool characteristics[J]. Nutrition Research & Practice, 2011, 5(4): 308-312.DOI:10.4162/nrp.2011.5.4.308.
[14] BIASUCCI G, RUBINI M, RIBONI S, et al. Mode of delivery affects the bacterial community in the newborn gut[J]. Early Human Development, 2010, 86(Suppl 1): 13-15. DOI:10.1016/j.earlhumdev.2010.01.004.
[15] AZAD M B, KONYA T, MAUGHAN H, et al. Gut microbiota of healthy Canadian infants: profiles by mode of delivery and infant diet at 4 months[J]. Canadian Medical Association Journal, 2013, 185(5):385-394. DOI:10.1503/cmaj.121189.
[16] MARILD K, STEPHANSSON O, MONTGOMERY S, et al.Pregnancy outcome and risk of celiac disease in offspring: a nationwide case-control study[J]. Gastroenterology, 2012, 142(1): 39-45. DOI:10.1053/j.gastro.2011.09.047.
[17] 李勇超, 张波. 婴幼儿肠道菌群定殖及对健康的影响研究进展[J]. 食品科学, 2016, 37(1): 258-262. DOI:10.7506/spkx1002-6630-201601044.
[18] EDGAR R C. UPARSE: highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods, 2013, 10(10): 996-998.DOI:10.1038/nmeth.2604.
[19] WANG Q, GARRITY G M, TIEDJE J M, et al. Naive bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J]. Applied & Environmental Microbiology, 2007,73(16): 5261-5267. DOI:10.1128/AEM.00062-07.
[20] QUAST C, PRUESSE E, YILMAZ P, et al. The SILVA ribosomal RNA gene database project: improved data processing and web-based tools[J]. Nucleic Acids Research, 2013, 41: 590-596. DOI:10.1093/nar/gks1219.
[21] EDGAR R C. Muscle: multiple sequence alignment with high accuracy and high throughput[J]. Nucleic Acids Research, 2004, 32(5): 1792-1797. DOI:10.1093/nar/gkh340.
[22] BÄCKHED F, ROSWALL J, PENG Y, et al. Dynamics and Stabilization of the human gut microbiome during the first year of life[J]. Cell Host & Microbe, 2015, 17(5): 690-703. DOI:10.1016/j.chom.2015.04.004.
[23] BOKULICH N A, CHUNG J, BATTAGLIA T, et al. Antibiotics,birth mode, and diet shape microbiome maturation during early life[J].Science Translational Medicine, 2016, 8: 343-382. DOI:10.1126/scitranslmed.aad7121.
[24] MARTIN R, HIROSHI M, YAVUZ A C, et al. Early-life events,including mode of delivery and type of feeding, siblings and gender,shape the developing gut microbiota[J]. PLoS ONE, 2016, 11(6):e0158498. DOI:10.1371/journal.pone.0158498.
[25] 金莉娜, 李迪, 王逸斌, 等. 不同分娩和喂养方式对婴儿生长发育的影响研究[J]. 中国食物与营养, 2016, 22(12): 73-76. DOI:10.3969/j.issn.1006-9577.2016.12.018.
[26] SANG A L, JI Y L, KIM B S, et al. Comparison of the gut microbiota profile in breast-fed and formula-fed Korean infants using pyrosequencing[J]. Nutrition Research & Practice, 2015, 9(3): 242-248.DOI:10.4162/nrp.2015.9.3.242.
[27] LIU Z, ROY N C, GUO Y, et al. Human breast milk and infant formulas differentially modify the intestinal microbiota in human infants and host physiology in rats 1-3[J]. Journal of Nutrition, 2016,146(2): 191-199. DOI:10.3945/jn.115.223552.
[28] HAARMAN M, KNOL J. Quantitative real-time PCR analysis of fecal Lactobacillus species in infants receiving a prebiotic infant formula[J].Applied & Environmental Microbiology, 2006, 72(4): 2359-2365.DOI:10.1128/AEM.72.4.2359-2365.2006.
[29] TANNOCK G W, LAWLEY B, MUNRO K, et al. Comparison of the compositions of the stool microbiotas of infants fed goat milk formula,cow milk-based formula, or breast milk[J]. Applied & Environmental Microbiology, 2013, 79(9): 3040-3048. DOI:10.1128/AEM.03910-12.
Effects of Feeding and Delivery Modes on Intestinal Flora of Infants of different Ages Investigated by High-Throughput Sequencing
YANG Li, GE Wupeng, LIANG Xiuzhen, et al. Effects of feeding and delivery modes on intestinal flora of infants of different ages investigated by high-throughput sequencing[J]. Food Science, 2019, 40(17): 208-215. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180612-182. http://www.spkx.net.cn