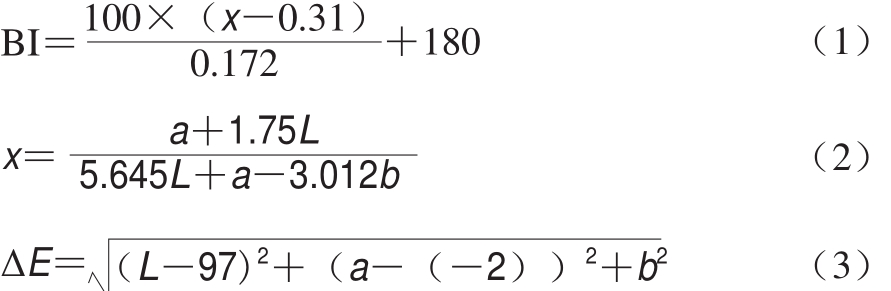
双孢菇(Agaricus bisporus)属伞菌科蘑菇属,俗称口蘑、白蘑菇,占世界食用菌总量的32%[1]。双孢菇富含VB3、烟酸、叶酸、矿物元素等营养成分,具有独特的风味和口感及清除自由基的抗氧化活性[2-3],深受消费者青睐。由于双孢菇具有易失水、呼吸速率和代谢活性较高等特性[4-5],加之没有外皮保护其免受物理伤害或微生物浸染;因此,采后易发生由酶促酚类化合物氧化所引起的褐变[6-7],常温下货架期通常只有1~3 d[8]。随着消费者“方便食用同营养兼具”新观念的形成,鲜切产品在近几十年来迅速发展[9]。但鲜切加工过程中的去皮、切割等操作会破坏组织的完整性,扰乱菇子实体正常的生理代谢[10],造成伤胁迫,加剧褐变的发生。
纳他霉素是由纳塔尔链霉菌(Streptomyces natelensis)产生的天然抗真菌剂,是一种天然防腐剂,通过抑制真菌细胞膜甾醇类物质的合成,增强膜的通透性,使细胞膜溶解从而起到防腐的作用[11]。与其他化学防腐剂相比,纳他霉素具有无潜在过敏性及高效等特点[12],是一种安全无毒的防腐剂,美国农业部将其列为一般公认安全(编号:GRAS 21CFR 172.155, FDA-ASP/1577,007681-93-8),欧盟也将其列为天然防腐剂行列(编号:EEC No.235)[11]。抗坏血酸是一种天然抗氧化剂,具有清除自由基、促进氧化金属离子螯合等作用[13]。D-异抗坏血酸钠是抗坏血酸的衍生物,它们具有相同的抗氧化能力,可将醌类物质及其衍生物还原为酚类,防止黑色素的形成[14]。本研究采用纳他霉素、纳他霉素与D-异抗坏血酸钠复配处理鲜切双孢菇,旨在筛选出抑制鲜切双孢菇褐变的最佳处理方法,解析其抗褐变机理,为鲜切双孢菇的保鲜贮藏提供科学的理论依据。
双孢菇购于辽宁省岫岩满族自治县嘉韵食用菌种植专业社,采后立即低温运至实验室,选取大小、形状适中,没有开伞,无机械损伤和病虫害的新鲜双孢菇作为实验材料。
聚乙烯吡咯烷酮、邻苯二酚、愈创木酚、过氧化氢、苯丙氨酸等 天津市科密欧化学试剂有限公司;羟脯氨酸(hydroxyproline,HYP)和还原性谷胱甘肽(reduced glutathione,GSH)含量试剂盒 苏州科铭生物技术有限公司。
GC-2010型气相色谱仪 日本岛津公司;TA.XT Plus型质构仪 英国Stable Micro Systems公司;酶标仪 美国Thermo Scientific公司;UV-9200紫外-可见分光光度计北京瑞利分析仪器有限公司;CR400/CR410色差计日本Konica Minolta公司;DJS-1C型电导率仪上海精密科学仪器有限公司;TGL-20M高速台式冷冻离心机 湖南湘仪离心机仪器有限公司;AL240电子精密天平 瑞士Mettler-Toledo公司。
1.3.1 样品处理
将实验涉及的菜刀、菜板和塑料托盘等工具在体积分数为2%的次氯酸钠溶液中浸泡10 min,取出后用蒸馏水冲洗2~3 次,沥干,将双孢菇子实体按照纵线切成1 cm厚的切片,随机平均分为3 组,分别立即用0.1 g/kg的纳他霉素溶液(将1 g纳他霉素、1 g乙二胺四乙酸溶于10 L去离子水中,搅拌均匀)、复合试剂(0.1 g/kg纳他霉素+10 g/kgD-异抗坏血酸钠)、去离子水(对照)浸泡处理5 min。将样品沥干后放入塑料托盘中,使用家用聚乙烯保鲜膜包装,于4 ℃下贮藏,分别在第0、3、6、9、12天测定相关指标。
1.3.2 色泽、硬度的测定
使用色差计在双孢菇中轴线部位测定L值、a值和b值,每个处理重复测定10 次。褐变指数(browning index,BI)参照Palou等[15]的方法并按照公式(1)、(2)进行计算。ΔE表示与理想双孢菇的色泽(L=97、a=-2、b=0)相比,整体色泽的变化程度,用公式(3)[16]进行计算。
使用配备有直径为5 mm圆柱形探头的TA.XT Plus型质构仪,以1 mm/s的下压速率测定鲜切双孢菇的硬度,单位为g。
1.3.3 霉菌和酵母总数的测定
霉菌和酵母总数的检测方法参考GB 4789.15—2016《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》[17]。其中对照和各处理0 d的数据是在双孢菇晾干2 h后测得的。
1.3.4 质量损失率的测定
质量损失率采用公式(4)进行计算。
式中:m0表示样品的初始质量/g;m表示取样时的质量/g。
1.3.5 呼吸强度、相对电导率的测定
呼吸强度的测定参照姜爱丽等[18]的方法,以每小时每千克双孢菇产生CO2的体积计,单位为mL/(kg·h)。
相对电导率的测定:每组处理随机取10 片鲜切双孢菇切碎混合后,取1.0 g样品,加入90 mL去离子水,煮沸25 min,用电导率仪分别测定常温下(E/(µS/cm))和煮沸后(E0/(µS/cm))的电导率,用公式(5)计算相对电导率[19]。
1.3.6 VC、总酚、GSH、HYP含量的测定
VC含量采用2,6-二氯酚靛酚滴定法测定,单位为mg/100 g。
总酚含量的测定采用Pirie等[20]的方法并稍作修改,取1.0 g样品,加入5 mL预冷的体积分数1%盐酸-甲醇溶液,于4 ℃、13 000×g离心20 min,测定其在280 nm波长处的吸光度。样品定量采用外标法[21],以没食子酸(gallic acid,GA)为标准品,总酚含量用每克果蔬组织相当于GA的物质的量表示,单位为mmol/g。
GSH含量的测定采用Wang Bin等[22]的方法并加以修改。取5.0 g样品,加入5.0 mL 50 g/L三氯乙酸溶液,于4 ℃、12 000×g离心10 min,收集上清液。参照GSH含量试剂盒的说明书进行操作,基于2-硝基苯甲酸与GSH反应时生成黄色产物,在反应10 min后,于412 nm波长处测定显色液的吸光度。
HYP含量的测定参照HYP含量试剂盒说明书方法。
1.3.7 相关酶活力的测定
过氧化氢酶(catalase,CAT)和谷胱甘肽还原酶(glutathione reductase,GR)活力测定参照Wang Qing等[23]的方法。超氧化物歧化酶(superoxide dismutase,SOD)活力测定参照Han Cong等[24]的方法。苯丙氨酸解氨酶(phenylalanine ammonialyase,PAL)和多酚氧化酶(polyphenol oxidase,PPO)活力的测定参照姜爱丽等[18]的方法。酪氨酸酶(tyrosinase,TYR)活力的测定参照Zou Yu等[25]的方法。
1.3.8 抗氧化能力的测定
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率和羟自由基清除率的测定参照Wang Lei等[26]的方法。总抗氧化能力的测定参照Duarte-Sierra等[27]的方法。
利用SPSS 17.0软件对数据进行统计分析,结果用 表示,对数据进行最小差异显著性分析,参数间的相关性利用皮尔森积差相关法进行分析,主成分分析(principal component analysis,PCA)参照武松等[28]的方法进行,PCA中的综合得分参照邵明灿等[29]的方法进行计算。
表示,对数据进行最小差异显著性分析,参数间的相关性利用皮尔森积差相关法进行分析,主成分分析(principal component analysis,PCA)参照武松等[28]的方法进行,PCA中的综合得分参照邵明灿等[29]的方法进行计算。
表1 不同处理对鲜切双孢菇色泽、质地及微生物指标的影响
Table 1 Effects of different treatments on color, texture and microbial indicators of fresh-cutAgaricus bisporus

注:—.表示未检出;相同贮藏时间同列肩标小写字母不同表示差异显著(P<0.05)。表2同。
时间/d 处理 L ∆E BI 硬度/g 霉菌和酵母总数(lg(CFU/g))贮藏0 CK 90.71±0.20a 14.62±0.61a21.31±0.64a 29 283.81±578.90a 2.35±0.36a 0.1 g/L纳他霉素 90.71±0.20a 14.62±0.61a21.31±0.64a 29 283.81±578.90a —复合试剂 90.71±0.20a 14.62±0.61a21.31±0.64a 29 283.81±578.90a —3 CK 82.34±0.14b 22.22±0.27a 34.37±0.43a 23 715.34±609.62b 5.56±0.19a 0.1 g/L纳他霉素 81.77±0.75b 21.09±0.44a32.38±0.27a 25 977.05±603.51a —复合试剂 85.32±0.58a 18.91±0.42b28.24±0.57b 26 501.68±573.52a —6 CK 76.61±0.51c 27.08±0.23a 44.07±0.24a 18 607.85±389.78c 6.17±0.09a 0.1 g/L纳他霉素 78.14±0.43b 25.33±0.24b40.55±0.17b 20 392.15±777.11b 2.27±0.21b复合试剂 81.35±0.55a 22.35±0.43c34.52±0.38c 22 269.19±286.36a —9 CK 72.14±0.30c 30.87±0.23a50.07±0.37a 15 369.85±676.21b 6.37±0.29a 0.1 g/L纳他霉素 75.10±0.48b 28.21±0.37b 45.42±0.23b 14 780.53±864.81b 3.32±0.37b复合试剂 80.12±0.66a 23.75±0.27c37.78±0.26c 17 174.87±543.88a 2.09±0.31c 12 CK 69.09±0.66c 33.88±0.17a57.14±0.28a 10 004.53±423.32b 7.05±0.43a 0.1 g/L纳他霉素 71.80±0.44b 31.38±0.28b 51.98±0.17b 11 212.46±426.03b 3.96±0.41b复合试剂 76.19±0.37a 27.07±0.04c43.70±0.04c 14 908.34±778.19a 2.79±0.39c
L值表示亮度,其值越大说明色泽越亮,由表1可知,样品的L值在贮藏期间不断下降,其中,纳他霉素和复合试剂处理组的L值始终高于对照组,且差异显著(P<0.05),但复合试剂处理对L值降低的抑制效果最显著。ΔE值表示双孢菇的色泽变化程度(褐变程度)。3 个处理组的ΔE值和BI在贮藏期间的变化趋势完全一致,均随着贮藏时间的延长而逐渐上升,但复合试剂处理组在整个贮藏期间ΔE值和BI均显著低于纳他霉素处理和对照组(P<0.05)。与对照组相比,纳他霉素处理也可有效抑制ΔE值和BI的上升,且在贮藏6 d后二者差异显著(P<0.05)。
硬度是代表果蔬质构的重要物理指标,随着贮藏时间的延长和呼吸消耗的加剧,果蔬的质地会变得疏松,导致硬度下降。如表1所示,所有样品的硬度在贮藏期间呈下降趋势,但复合试剂处理组双孢菇的硬度在整个贮藏期间均显著高于对照和纳他霉素处理组(P<0.05)。
对照组的霉菌和酵母总数在1 2 d时高达7.05(lg(CFU/g)),比纳他霉素和复合试剂处理高3~4 个数量级,其中,复合试剂处理更有利于降低鲜切双孢菇的霉菌和酵母总数。
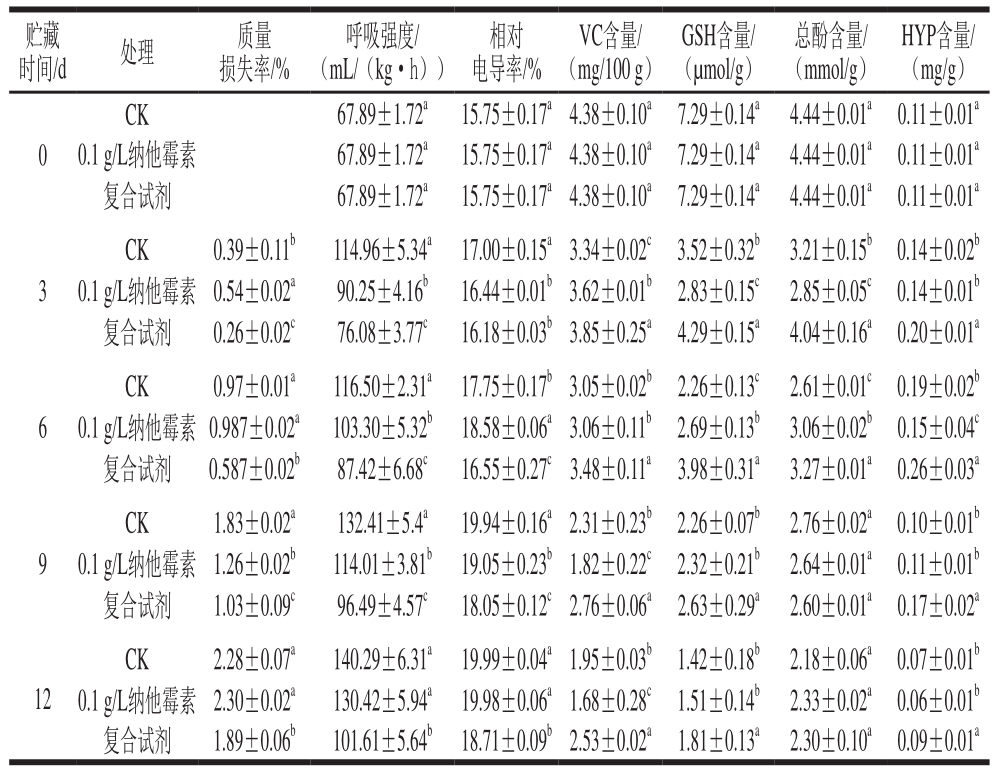
蒸腾失水和呼吸消耗是果蔬贮藏过程中质量损失和新鲜度下降的主要原因。双孢菇经过鲜切加工后,失水面积增加,呼吸代谢加速,导致贮藏过程中质量损失率和呼吸强度均呈上升趋势(表2),但与对照和纳他霉素处理组相比,复合试剂处理组质量损失率和呼吸强度始终显著更低。贮藏结束时(12 d),对照组的呼吸强度高达140.29 mL/(kg·h),比复合试剂处理组高38.1%。
表2 不同处理对鲜切双孢菇质量损失率、呼吸强度、相对电导率和VC、总酚、GSH、HYP含量的影响
Table 2 Effects of different treatments on mass loss rate, respiration intensity, relative electrical conductivity, and vitamin C, total phenols,GSH and hydroxyproline contents in fresh-cutAgaricus bisporus
时间/d 处理 质量损失率/%贮藏 呼吸强度/(mL/(kg·h))相对电导率/%VC含量/(mg/100 g)GSH含量/(µmol/g)总酚含量/(mmol/g)HYP含量/(mg/g)0 CK 67.89±1.72a 15.75±0.17a4.38±0.10a 7.29±0.14a 4.44±0.01a 0.11±0.01a 0.1 g/L纳他霉素 67.89±1.72a 15.75±0.17a4.38±0.10a 7.29±0.14a 4.44±0.01a 0.11±0.01a复合试剂 67.89±1.72a 15.75±0.17a4.38±0.10a 7.29±0.14a 4.44±0.01a 0.11±0.01a 3 CK 0.39±0.11b 114.96±5.34a 17.00±0.15a3.34±0.02c 3.52±0.32b 3.21±0.15b 0.14±0.02b 0.1 g/L纳他霉素 0.54±0.02a 90.25±4.16b 16.44±0.01b3.62±0.01b 2.83±0.15c 2.85±0.05c 0.14±0.01b复合试剂 0.26±0.02c 76.08±3.77c 16.18±0.03b3.85±0.25a 4.29±0.15a 4.04±0.16a 0.20±0.01a 6 CK 0.97±0.01a 116.50±2.31a 17.75±0.17b3.05±0.02b 2.26±0.13c 2.61±0.01c 0.19±0.02b 0.1 g/L纳他霉素 0.987±0.02a 103.30±5.32b 18.58±0.06a3.06±0.11b 2.69±0.13b 3.06±0.02b 0.15±0.04c复合试剂 0.587±0.02b 87.42±6.68c 16.55±0.27c3.48±0.11a 3.98±0.31a 3.27±0.01a 0.26±0.03a 9 CK 1.83±0.02a 132.41±5.4a 19.94±0.16a2.31±0.23b 2.26±0.07b 2.76±0.02a 0.10±0.01b 0.1 g/L纳他霉素 1.26±0.02b 114.01±3.81b 19.05±0.23b1.82±0.22c 2.32±0.21b 2.64±0.01a 0.11±0.01b复合试剂 1.03±0.09c 96.49±4.57c 18.05±0.12c2.76±0.06a 2.63±0.29a 2.60±0.01a 0.17±0.02a 12 CK 2.28±0.07a 140.29±6.31a 19.99±0.04a1.95±0.03b 1.42±0.18b 2.18±0.06a 0.07±0.01b 0.1 g/L纳他霉素 2.30±0.02a 130.42±5.94a 19.98±0.06a1.68±0.28c 1.51±0.14b 2.33±0.02a 0.06±0.01b复合试剂 1.89±0.06b 101.61±5.64b 18.71±0.09b2.53±0.02a 1.81±0.13a 2.30±0.10a 0.09±0.01a
切割会导致双孢菇细胞膜破损,使细胞内容物外渗,电导率增加。所有处理组在贮藏期间的相对电导率均呈上升趋势,但复合试剂处理的相对电导率显著低于同期的其他两组(P<0.05)。
植物体内存在着重要的抗氧化系统——VC-GSH循环系统,可与其他活性氧清除系统协同作用,清除植物体内过多的自由基[30]。VC和还原型GSH均为果蔬体内重要的非酶抗氧化物质,GSH可将脱氢抗坏血酸还原成VC,而VC具有直接清除H2O2的作用,同时提高细胞抗氧化系统的还原势。贮藏过程中各处理组的VC和GSH含量均呈下降趋势(表2),复合试剂处理组在贮藏期间的VC和GSH含量显著高于对照和纳他霉素处理组(P<0.05),贮藏结束时(12 d),这两种物质含量分别为对照组的1.30 倍和1.27 倍。
总酚是一种重要的抗氧化物质,其中多酚是多酚氧化反应中的底物,参与褐变反应[20]。由表2可知,总酚含量的变化趋势与VC和GSH基本相似,均呈持续下降,但复合试剂处理组鲜切双孢菇总酚含量下降的速度较慢,并在3 d和6 d时显著高于其他两组(P<0.05)。HYP不仅是一种抗氧化物质,也是一种胶原氨基酸,对胶原蛋白的形成有重要影响[31],而胶原蛋白则影响双孢菇的质地和感官性状。3 组双孢菇的HYP含量在贮藏期间呈先上升后下降趋势(表2),在第6天时达到峰值,其中复合试剂处理组的HYP含量在贮藏过程中显著高于其他两组(P<0.05)。
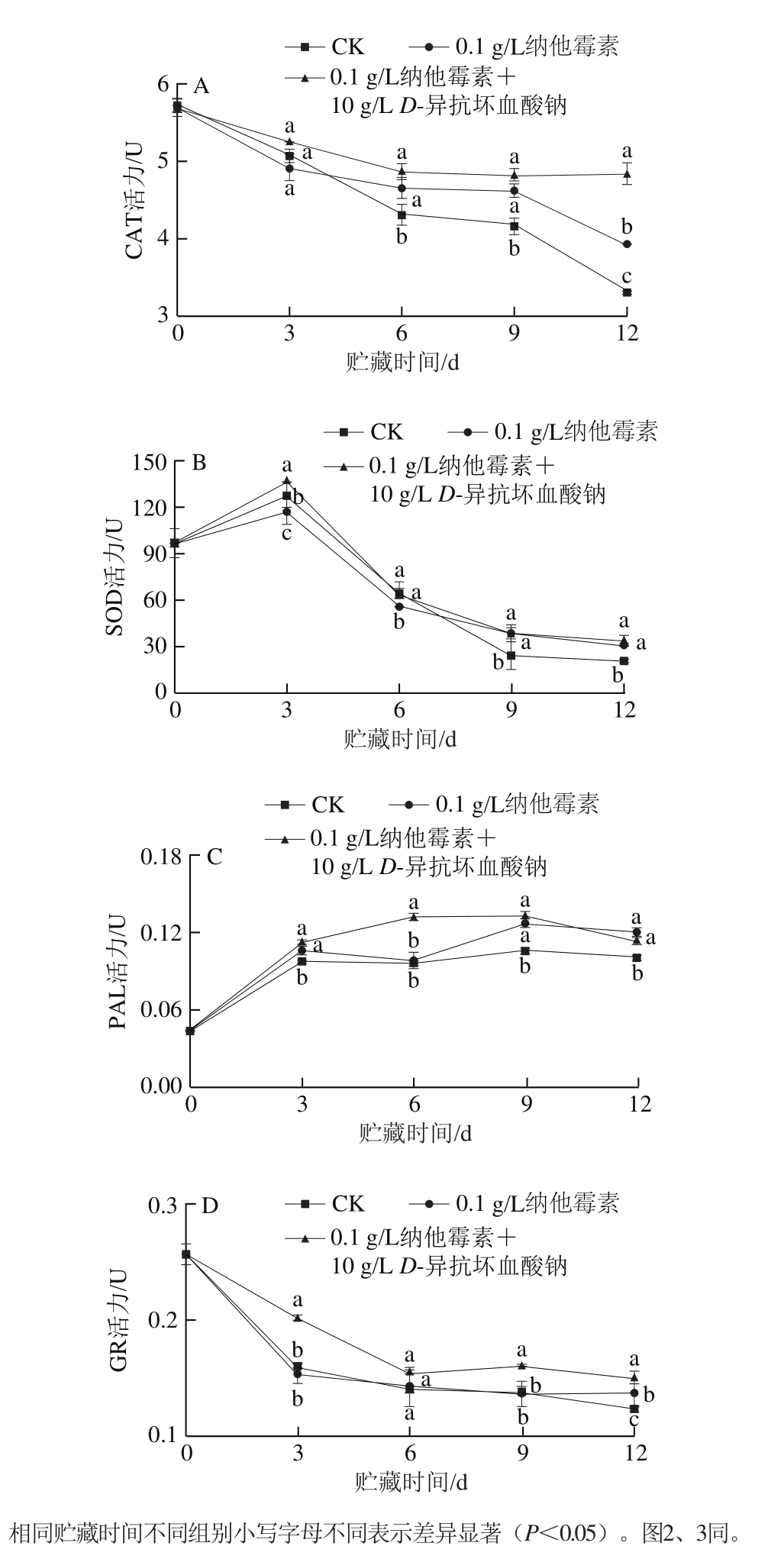
图1 不同处理对鲜切双孢菇CAT(A)、SOD(B)、PAL(C)和GR(D)活力的影响
Fig. 1 Effects of different treatments on CAT (A), SOD (B), PAL (C)and GR (D) activities in fresh-cut Agaricus bisporus
作为自由基清除系统重要的工具酶,CAT的作用机理与VC的抗氧化作用机理相似,都是通过分解H2O2来抑制H2O2对组织造成的氧化损伤[23]。如图1A所示,所有处理在贮藏期间CAT活力均呈下降趋势,其中纳他霉素和复合试剂处理组在6 d后CAT活力显著高于对照组(P<0.05),复合试剂处理更有利于维持CAT活力,从而清除组织中的H2O2,减轻自由基引起的氧化损伤,进而抑制鲜切双孢菇的褐变程度。
SOD可将超氧阴离子分解为H2O2,CAT将H2O2分解为水和氧气,从而降低氧化损伤[24]。3 个处理组的SOD活力在贮藏过程中均呈先上升后下降趋势(图1B),3 d时SOD活力均达到峰值,且复合试剂处理组的SOD活力显著高于其余两组(P<0.05),而在贮藏的第9天和12天,两种纳他霉素处理组的SOD活力均显著高于对照组(P<0.05),但两个处理组之间差异不显著(P>0.05)。
PAL是植物苯丙烷代谢重要的工具酶,影响植物抗病性的产生,在植物的生长发育过程中起重要作用[18]。如图1C所示,3 个处理组的PAL活力在贮藏期间呈先迅速上升后趋于平缓的趋势,3 d时对照组、纳他霉素和复合试剂处理组的PAL活力分别是0 d时的2.24、2.44 倍和2.57 倍,说明切割处理有效诱导了PAL活性。在第3、9 天和12 天时两种纳他霉素处理组的PAL活力均显著高于对照组(P<0.05),且复合试剂处理更有利于PAL活力的保持。
GR是一种利用烟酰胺腺嘌呤二核苷酸(磷酸)将氧化型谷胱甘肽催化反应成GSH的酶,在VC-GSH循环系统中起到重要的氧化应激作用[23]。图1D结果表明,复合试剂处理最有利于鲜切双孢菇在贮藏期间GR活力的保持,表现为3、9 d和12 d时GR活力显著高于对照组和纳他霉素处理组(P<0.05),说明D-异抗坏血酸钠的添加是鲜切双孢菇保持较高GR活力的原因所在。

图2 不同处理对鲜切双孢菇PPO(A)和TYR(B)活力的影响
Fig. 2 Effects of different treatments on PPO (A) and TYR (B)activities in fresh-cut Agaricus bisporus
褐变是双孢菇采后商品性迅速下降的主要原因,引起双孢菇褐变的酶主要有PPO和TYR,其中PPO是以双酚为底物将其催化形成褐色的醌类物质,而TYR是一种具有双重功能的酶,TYR先催化单酚的羟基化反应形成双酚,再将双酚氧化形成左旋多巴和黑色素等有生物活性的物质[5,25],双孢菇子实体内TYR结构与人体内的非常相似,因此,双孢菇被认为是重要的营养功效性食物。黑色素的形成也是双孢菇在受到环境胁迫时的一个自我保护机制[5]。PPO和TYR活力在贮藏过程中的变化趋势如图2A、B所示,二者均呈整体上升趋势,其中复合试剂处理最有利于抑制PPO和TYR活力的上升,表现为贮藏期内该处理的PPO和TYR活力始终显著低于其他两组(P<0.05)。
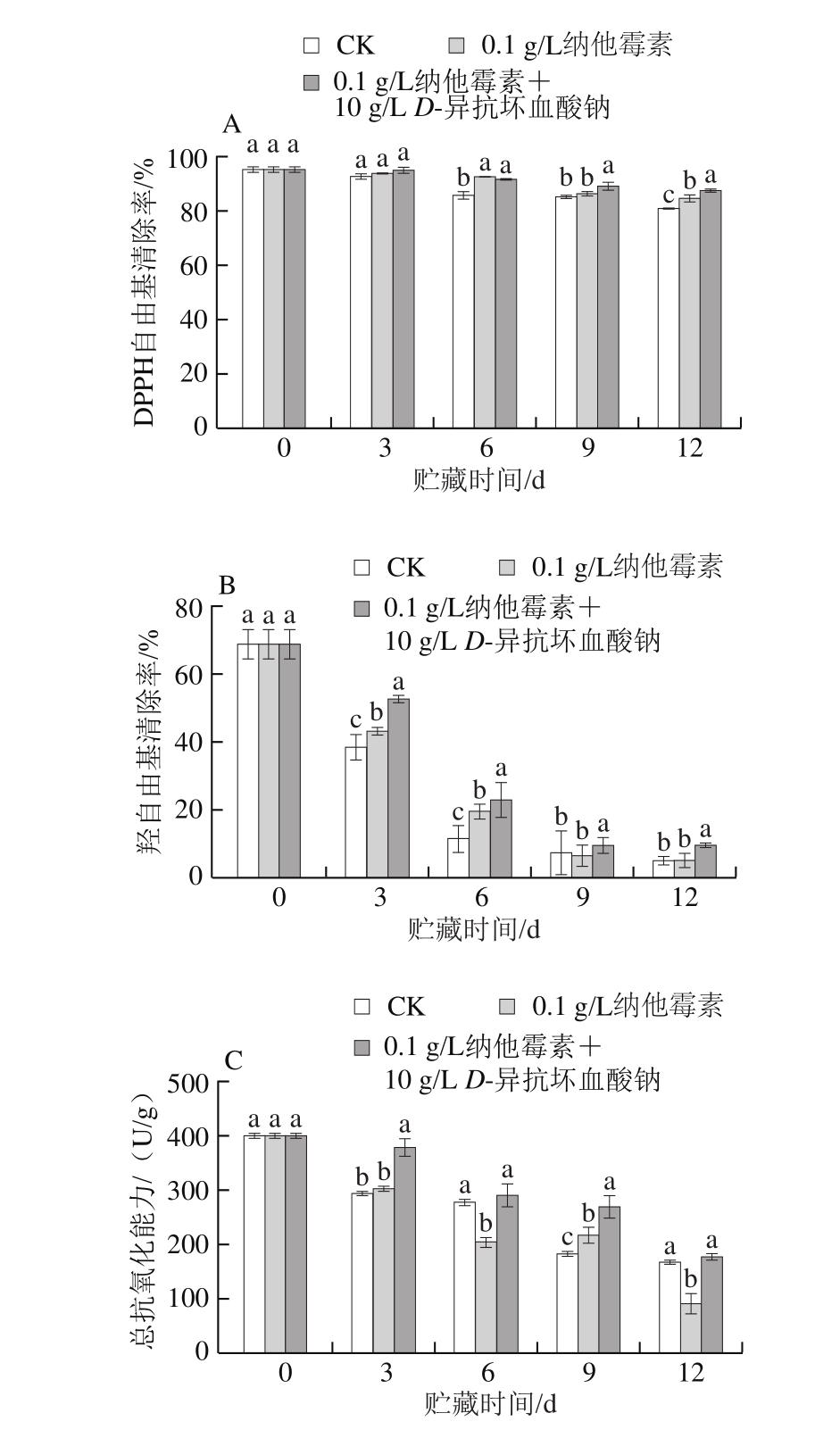
图3 不同处理对鲜切双孢菇DPPH自由基清除率(A)、羟自由基清除率(B)和总抗氧化能力(C)的影响
Fig. 3 Effects of different treatments on DPPH (A), hydroxyl (B)radical scavenging rate, and total antioxidant capacity (C) of fresh-cut Agaricus bisporus
双孢菇采后衰老是一个复杂的生理生化过程,与活性氧的代谢平衡密切相关。自由基是植物代谢过程中的毒副产品,可引起生物大分子物质的氧化损伤,自由基积累会使组织细胞膜损伤,引起代谢紊乱[32]。DPPH是一种稳定的自由基,已被广泛用于测定抗氧化剂清除自由基的能力,羟自由基具有极强的氧化能力,是生物组织中最具活性的自由基[33-34]。植物在成熟衰老的过程中会产生大量的活性氧,细胞中的活性氧自由基清除系统能通过清除过多的活性氧自由基来维持膜的稳定性和完整性[35]。总抗氧化能力是机体所有物质的抗氧化能力的总和,可作为评价果蔬采后品质的重要指标。
表3 各生理指标的相关性
Table 3 Correlation of physiological indexes
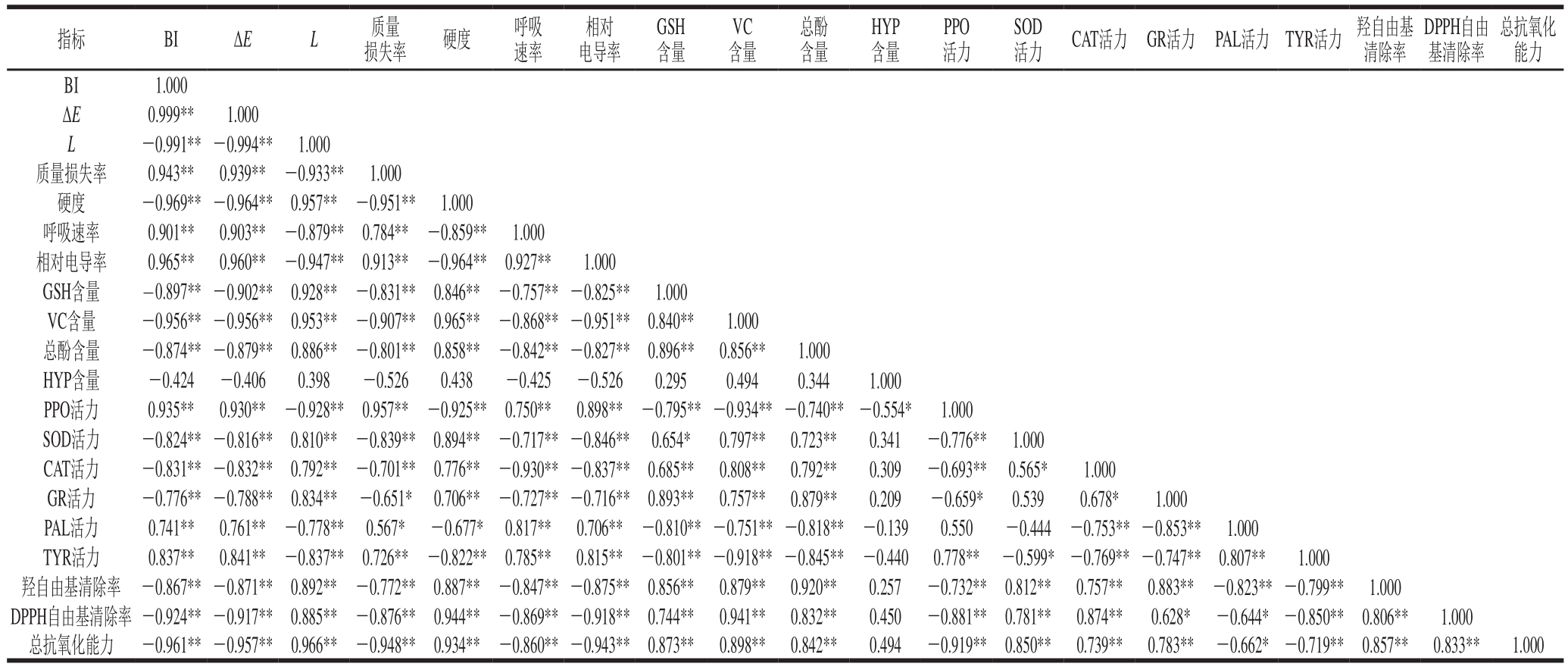
注:*.显著相关(P<0.05);**.极显著相关(P<0.01)。
总抗氧化能力BI 1.000 ΔE 0.999** 1.000 L -0.991**-0.994** 1.000质量损失率 0.943** 0.939** -0.933** 1.000硬度 -0.969**-0.964** 0.957** -0.951** 1.000呼吸速率 0.901** 0.903** -0.879** 0.784** -0.859** 1.000相对电导率 0.965** 0.960** -0.947** 0.913** -0.964** 0.927** 1.000 GSH含量 -0.897**-0.902** 0.928** -0.831** 0.846** -0.757**-0.825** 1.000 VC含量 -0.956**-0.956** 0.953** -0.907** 0.965** -0.868**-0.951** 0.840** 1.000总酚含量 -0.874**-0.879** 0.886** -0.801** 0.858** -0.842**-0.827** 0.896** 0.856** 1.000 HYP含量 -0.424 -0.406 0.398 -0.526 0.438 -0.425 -0.526 0.295 0.494 0.344 1.000 PPO活力 0.935** 0.930** -0.928** 0.957** -0.925** 0.750** 0.898** -0.795**-0.934**-0.740** -0.554* 1.000 SOD活力 -0.824**-0.816** 0.810** -0.839** 0.894** -0.717**-0.846** 0.654* 0.797** 0.723** 0.341 -0.776** 1.000 CAT活力 -0.831**-0.832** 0.792** -0.701** 0.776** -0.930**-0.837** 0.685** 0.808** 0.792** 0.309 -0.693** 0.565* 1.000 GR活力 -0.776**-0.788** 0.834** -0.651* 0.706** -0.727**-0.716** 0.893** 0.757** 0.879** 0.209 -0.659* 0.539 0.678* 1.000 PAL活力 0.741** 0.761** -0.778** 0.567* -0.677* 0.817** 0.706** -0.810**-0.751**-0.818** -0.139 0.550 -0.444 -0.753**-0.853** 1.000 TYR活力 0.837** 0.841** -0.837** 0.726** -0.822** 0.785** 0.815** -0.801**-0.918**-0.845** -0.440 0.778** -0.599* -0.769**-0.747** 0.807** 1.000羟自由基清除率 -0.867**-0.871** 0.892** -0.772** 0.887** -0.847**-0.875** 0.856** 0.879** 0.920** 0.257 -0.732** 0.812** 0.757** 0.883** -0.823**-0.799** 1.000 DPPH自由基清除率 -0.924**-0.917** 0.885** -0.876** 0.944** -0.869**-0.918** 0.744** 0.941** 0.832** 0.450 -0.881** 0.781** 0.874** 0.628* -0.644* -0.850** 0.806** 1.000总抗氧化能力 -0.961**-0.957** 0.966** -0.948** 0.934** -0.860**-0.943** 0.873** 0.898** 0.842** 0.494 -0.919** 0.850** 0.739** 0.783** -0.662* -0.719** 0.857** 0.833** 1.000指标 BI ΔE L 质量损失率 硬度 呼吸速率相对电导率GSH含量VC含量总酚含量HYP含量PPO活力SOD活力 CAT活力 GR活力 PAL活力 TYR活力 羟自由基清除率DPPH自由基清除率
如图3所示,贮藏期间3 个处理组鲜切双孢菇的DPPH自由基清除能力、羟自由基清除率和总抗氧化能力均呈下降趋势,其中以DPPH自由基清除能力下降的速度最为缓慢(图3A),贮藏结束时(12 d),对照组、纳他霉素和复合试剂处理组的DPPH自由基清除率分别为80.8%、84.5%和87.5%,比0 d分别降低了15.2%、11.3%和8.1%,而羟自由基清除率下降的速度最快(图3B),贮藏12 d时,对照组、纳他霉素和复合试剂处理组的羟自由基清除率仅为0 d时的6.9%、7.1%和13.6%。在第9天时,复合试剂处理组的总抗氧化能力比对照组提高了46.7%(图3D)。
PCA是现代多元数据分析的标准工具,可将原来众多具有一定相关性的数据重新组成一组新的互相无关的综合指标,从而来代替原来的指标用于综合分析[29]。由图4A可知,主成分1的贡献率为80.362%,主成分2的贡献率为6.582%,两个主成分解释了86.944%的总方差,因此双孢菇中检测的20 个指标可由两个主成分来表示,其中主成分1与L值、硬度、VC含量、总抗氧化能力呈高度正相关,与BI、ΔE、相对电导率、质量损失率、PPO活力呈高度负相关,主成分2与GR活力呈高度正相关,与HYP、PAL活力呈高度负相关,因此,两个主成分可以综合表现双孢菇品质。以主成分1为横轴,主成分2为纵轴建立坐标系,横轴数值越大表示样品抗氧化能力越强,反之则表示样品品质越差,纵轴数值越大表示样品品质越好。由图4B可看出,CK-0样品的横轴和纵轴数值皆最大,表明第0天样品品质最好,随着横轴及纵轴数值的减小,各样品品质逐渐下降,总体来看,样品品质排序为复合试剂处理组>单独纳他霉素处理>对照。
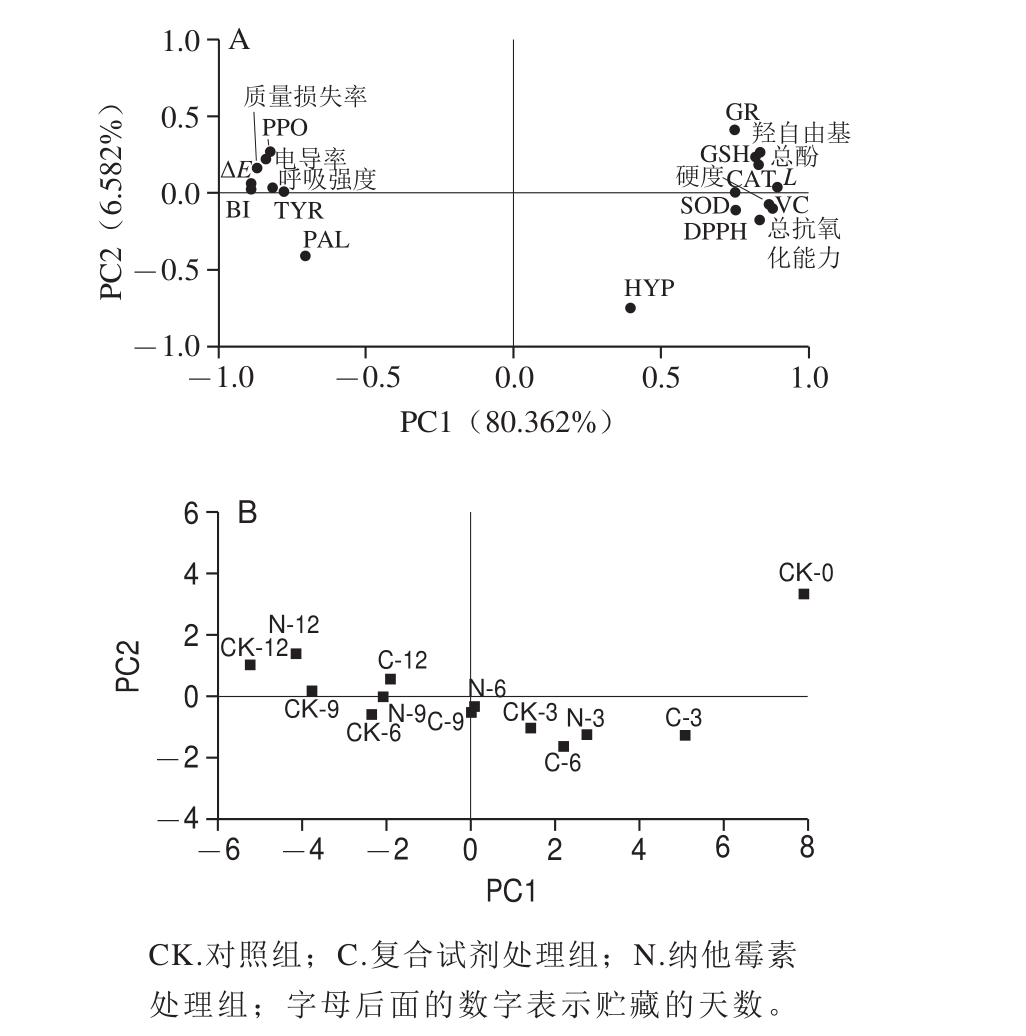
图4 不同处理对鲜切双孢菇各生理指标的主成分载荷(A)和得分(B)的影响
Fig. 4 Principal component loading (A) and comprehensive scores plots (B)for physiological indexes of fresh-cutAgaricus bisporus with different treatments
由表3可知,双孢菇品质相关的20 个指标相互间大部分呈极显著相关(P<0.01),其中BI与L值、硬度及抗氧化物质(GSH和VC)含量呈极显著负相关(P<0.01),与质量损失率、呼吸速率及相对电导率呈极显著正相关(P<0.01)。此外,PPO和TYR活力与BI之间存在着极显著正相关关系(P<0.01),说明鲜切双孢菇的褐变主要是由PPO和TYR活力上升引起的。PPO和TYR活力升高导致鲜切双孢菇产生褐变是把双刃剑,一方面降低了鲜切产品的商品性;另一方面是双孢菇对切割伤害的自我保护,尤其是TYR催化产生的左旋多巴和黑色素等是对人体具有重要作用的营养素。DPPH自由基清除率、羟自由基清除率、总抗氧化能力与相对电导率、PPO活力、TYR活力均呈极显著负相关(P<0.01),而与抗氧化酶(SOD、CAT)活力呈极显著正相关(P<0.01)。表明双孢菇采后贮藏期间过多的活性氧自由基加速了组织的脂质氧化,对细胞膜造成了损伤,导致酶和底物隔离分布减弱,从而诱导菇子实体褐变,而纳他霉素和复合试剂处理组可通过提高清除自由基能力来增强机体的抗氧化能力。上述分析表明双孢菇的呼吸代谢、抗氧化物质含量、抗氧化能力与双孢菇品质密切相关。
由酚酶催化和自动氧化引发的褐变是双孢菇品质劣变的主要原因[25]。为此,研究者曾从多方面入手寻求解决或缓解褐变问题的方法,如采前在灌溉液中加入氯化钙可增加采收时双孢菇的白度并减轻采后褐变的发生[36],纳他霉素+纯氧复合处理能延缓褐变和帽裂,减少酵母菌和霉菌的微生物数量[37],使用H2O2冲洗+异抗坏血酸钠溶液喷洒模拟工艺生产线可减轻采后双孢菇褐斑损伤[38]。纳他霉素作为一种高效、安全的新型生物保鲜剂,可有效抑制绿芦笋等多种果蔬的酵母菌和霉菌总数及褐变[39],D-异抗坏血酸钠是一种绿色、安全、有效的食品添加剂,能有效防止鲜切苹果及鲜切莲藕等果蔬褐变现象的发生[40-41],但这两种试剂在鲜切蘑菇褐变方面应用较少,特别是对菇子实体抗褐变的机理研究更是鲜有报道。
活性氧的积累会引起膜脂过氧化,导致细胞破裂,致使PPO与酚类物质接触,使双孢菇产生褐变现象[42],Kukura等[43]认为细胞膜完整性的保持可抑制TYR与底物的结合,从而降低菇子实体的褐变程度。本研究发现,双孢菇的BI与相对电导率、PPO活力、TYR活力呈极显著正相关(P<0.01),与总酚含量、抗氧化酶(CAT、SOD、PAL、GR)活力、自由基清除力及总抗氧化能力呈极显著负相关(P<0.01),推测双孢菇采后鲜切贮藏过程中产生过多的活性氧自由基会对组织细胞膜造成损伤,导致酶和底物接触,从而诱导双孢菇子实体褐变;而细胞的抗氧化系统能清除过多的活性氧自由基来维持膜的稳定性和完整性,对褐变起到一定的抑制作用。这一结论与水杨酸处理后的双孢菇通过提高抗氧化系统活性和酚类物质的积累来延缓菇子实体褐变[44]一致。
本实验结果表明,纳他霉素及复合处理能降低双孢菇的褐变程度,维持采后鲜切品质,其机制可能是抑制了菇子实体酵母和霉菌总数、PPO和TYR活力的上升及抗氧化能力的下降。因此,纳他霉素和D-异抗坏血酸钠可作为安全高效的食品添加剂用于鲜切双孢菇的贮藏保鲜。
[1] JIANG T J, ZHENG X L, LI J R, et al. Integrated application of nitric oxide and modified atmosphere packaging to improve quality retention of button mushroom (Agaricus bisporus)[J]. Food Chemistry, 2011,126(4): 1693-1699. DOI:10.1016/j.foodchem.2010.12.060.
[2] RZYMSKI P, MLECZEK M, NIEDZIELSKI P, et al. Cultivation of Agaricus bisporus enriched with selenium, zinc and copper[J].Journal of Science of Food and Agriculture, 2017, 97(3): 923-928.DOI:10.1002/jsfa.7816.
[3] LIN Q, LU Y Y, ZHANG J, et al. Effects of high CO2 in-package treatment on flavor, quality and antioxidant activity of button mushroom (Agaricus bisporus) during postharvest storage[J].Postharvest Biology and Technology, 2017, 123: 112-118.DOI:10.1016/j.postharvbio.2016.09.006.
[4] WRONA M, BENTAYEB K, NERIN C. A novel active packaging for extending the shelf-life of fresh mushrooms (Agaricus bisporus)[J]. Food Control, 2015, 54: 200-207. DOI:10.1016/j.foodcont.2015.02.008.
[5] MUSZYNSKA B, KALA K, ROJOWSKI J, et al. Composition and biological properties of Agaricus bisporus fruiting bodies: a review[J].Polish Journal of Food and Nutrition Sciences, 2017, 67(3): 173-181.DOI:10.1515/pjfns-2016-0032.
[6] GUAN W Q, FAN X T, YAN R X. Effects of UV-C treatment on inactivation of Escherichia coli O157:H7, microbial loads, and quality of button mushrooms[J]. Postharvest Biology and Technology, 2012,64(1): 119-125. DOI:10.1016/j.postharvbio.2011.05.017.
[7] BRENNAN M, LE PORT G, GORMLEY R. Post-harvest treatment with citric acid on hydrogen peroxide to extend the shelf life of fresh sliced mushrooms[J]. LWT-Food Science and Technology, 2000,33(4): 285-289. DOI:10.1006/fstl.2000.0657.
[8] NASIRI M, BARZEGAR M, SAHARI M A, et al. Application of Tragacanth gum impregnated with Satureja khuzistanica essential oil as a natural coating for enhancement of postharvest quality and shelf life of button mushroom (Agaricus bisporus)[J]. International Journal of Biological Macromolecules, 2018, 106: 218-226. DOI:10.1016/j.ijbiomac.2017.08.003.
[9] ALARCÓN-FLORES M I, ROMERO-GONZÁLEZ R, MARTÍNEZ V J L, et al. Monitoring of phytochemicals in fresh and fresh-cut vegetables: a comparison[J]. Food Chemistry, 2014, 142(1): 392-399.DOI:10.1016/j.foodchem.2013.07.065.
[10] 李顺峰, 李静, 王安建, 等. 热风预处理对冷藏鲜切双孢蘑菇生理生化性质的影响[J]. 食品科学, 2016, 37(24): 292-298. DOI:10.7506/spkx1002-6630-201624045 .
[11] JIANG T J, FENG L F, ZHENG X L, et al. Physiocochemical responses and microbial characteristics of shiitake mushroom (Lentinus edodes) to gum arabic coating enriched with natamycin during storage[J]. Food Chemistry, 2013, 138(2/3): 1992-1997. DOI:10.1016/j.foodchem.2012.11.043.
[12] KALLINTERI L D, KOSTOULA O K, SAVVAIDIS I N. Efficacy of nisin and/or natamycin to improve the shelf-life of Galotyri cheese[J]. Food Microbiology, 2013, 36(2): 176-181. DOI:10.1016/j.fm.2013.05.006.
[13] BREWER M S. Natural antioxidants: sources, compounds,mechanisms of action, and potential applications[J]. Comprehensive Reviews in Food Science and Food Safety, 2011, 10(4): 221-247.DOI:10.1111/j.1541-4337.2011.00156.x.
[14] 陈迪新, 赵梁怡, 杨英军, 等. 银杏叶提取液结合异抗坏血酸钠对鲜切砀山梨贮藏品质的影响[J]. 食品科学, 2017, 38(11): 243-248.DOI:10.7506/spkx1002-6630-201711039.
[15] PALOU E, LÓPEZ-MALO A, BARBOSA-CÁNOVAS G V, et al.Polyphenoloxidase activity and color of blanched and high hydrostatic pressure treated banana puree[J]. Journal of Food Science, 1999, 64(1):42-45. DOI:10.1111/j.1365-2621.1999.tb09857.x.
[16] JIANG T J. Effects of alginate coating on physiocochemcial and sensory qualities of button mushroom (Agaricus bisporus) under a high oxygen modified atmosphere[J]. Postharvest Biology and Technology,2013, 76: 91-97. DOI:10.1016/j.postharvbio.2012.09.005.
[17] 国家卫生和计划生育委员会. 食品安全国家标准 食品微生物学检验 霉菌和酵母计数: GB 4789.15—2016[S]. 北京: 中国标准出版社,2016.
[18] 姜爱丽, 胡文忠, 孟宪军, 等. 外源水杨酸处理对采后蓝莓果实苯丙烷代谢的影响[J]. 食品工业科技, 2013, 34(6): 334-337; 341.
[19] ADAY M S. Application of electrolyzed water for improving postharvest quality of mushroom[J]. LWT-Food Science and Technology, 2016, 68: 44-51. DOI:10.1016/j.lwt.2015.12.014.
[20] PIRIE A, MULLINS M G. Changes in anthocyanin and phenolics content of grapevine leaf and fruit tissues treated with sucrose,nitrate, and abscisic acid[J]. Plant Physiology, 1976, 58(4): 468-472.DOI:10.1104/pp.58.4.468.
[21] 姜爱丽, 胡文忠, 张维娜, 等. 异硫氰酸烯丙酯处理对鲜切紫甘蓝生理代谢的影响[J]. 食品科学, 2018, 39(3): 252-258. DOI:10.7506/spkx1002-6630-201803038.
[22] WANG Bin, ZHU Shijiang. Pre-storage cold acclimation maintained quality of cold-stored cucumber through differentially and orderly activating ROS scavengers[J]. Postharvest Biology and Technology,2017, 129: 1-8. DOI:10.1016/j.postharvbio.2017.03.001.
[23] WANG Qing, DING Tian, ZUO Jinhua, et al. Amelioration of postharvest chilling injury in sweet pepper by glycine betaine[J].Postharvest Biology and Technology, 2016, 112: 114-120.DOI:10.1016/j.postharvbio.2015.07.024.
[24] HAN Cong, ZUO Jinhua, WANG Qing, et al. Effects of 1-MCP on postharvest physiology and quality of bitter melon (Momordica charantia L.)[J]. Scientia Horticulturae, 2015, 182: 86-91.DOI:10.1016/j.scienta.2014.07.024.
[25] ZOU Yu, HU Wenzhong, JIANG Aili, et al. Partial purification and characterization of a novel extracellular tyrosinase from Auricularia auricula[J]. Applied Biochemistry and Biotechnology, 2014, 172:1460-1469. DOI:10.1007/s12010-013-0638-8.
[26] WANG Lei, ZHANG Hua, JIN Peng, et al. Enhancement of storage quality and antioxidant capacity of harvested sweet cherry fruit by immersion with β-aminobutyric acid[J]. Postharvest Biology and Technology, 2016, 118: 71-78. DOI:10.1016/j.postharvbio.2016.03.023.
[27] DUARTE-SIERRA A, FORNEY C F, MICHAUD D, et al. Influence of hormetic heat treatment on quality and phytochemical compounds of broccoli fl orets during storage[J]. Postharvest Biology and Technology,2017, 128: 44-53. DOI:10.1016/j.postharvbio.2017.01.017.
[28] 武松, 潘发明. SPSS统计分析大全[M]. 北京: 清华大学出版社,2014: 334-344.
[29] 邵明灿, 胡花丽, 王毓宁, 等. 基于主成分分析法分析一氧化氮对绿芦笋贮藏品质的影响[J]. 食品科学, 2012, 33(20): 318-322.
[30] MITTLER R. Oxidative stress, antioxidants and stress tolerance[J].Trends in Plant Science, 2002, 7(9): 405-410. DOI:10.1016/S1360-1385(02)02312-9.
[31] XIONG Z J, SUN D W, XIE A G, et al. Potential of hyperspectral imaging for rapid prediction of hydroxyproline content in chicken meat[J]. Food Chemistry, 2015, 175: 417-422. DOI:10.1016/j.foochem.2014.11.161.
[32] 王丽芳, 王晓拓, 王志东. 贮藏温度对双孢蘑菇褐变和抗氧化活性的影响及动力学研究[J]. 现代食品科技, 2015, 31(2): 157-163.DOI:10.13982/j.mfst.1673-9078.2015.2.027.
[33] OZCELIK B, LEE J H, MIN D B. Effects of light, oxygen, and pH on the absorbance of 2,2-diphenyl-1-picrylhydrazyl[J]. Journal of Food Science,2010, 68(2): 487-490. DOI:10.1111/j.1365-2621.2003.tb05699.x.
[34] WICKENS A P. Ageing and the free radical theory[J]. Respiration Physiology, 2001, 128(3): 379-391. DOI:10.1016/S0034-5687(01)00313-9.
[35] 程曦, 赵春霞, 李云云, 等. 高氧气调包装对双孢蘑菇抗氧化活性及褐变的影响[J]. 食品与发酵工业, 2016, 42(10): 68-74.DOI:10.13995/j.cnki.11-1802/ts.201610012.
[36] PHILIPPOUSSIS A, DIAMANTOPOULOV P, ZERVAKIS G.Calcium chloride irrigation influence on yield, calcium content,quality and shelf-life of the white mushroom Agaricus bisporus[J].Journal of the Science of Food and Agriculture, 2001, 81: 1447-1454.DOI:10.1002/jsfa.968.
[37] JIANG T. Effect of natamycin in combination with pure oxygen treatment on postharvest quality and selected enzyme activities of button mushroom (Agaricus bisporus)[J]. Journal of Agricultural and Food Chemistry, 2012, 60(10): 2562-2568. DOI:10.1021/jf205160c.
[38] SAPERS G M, MILLER R L, PILIZOTA V, et al. Shelf-life extension of fresh mushrooms (Agaricus bisporus) by application of hydrogen peroxide and browning inhibitors[J]. Journal of Food Science, 2001,66(2): 362-366. DOI:10.1111/j.1365-2621.2001.tb11347.x.
[39] 宋秀香, 鲁晓翔, 陈绍慧, 等. 冰温结合纳他霉素对绿芦笋采后生理品质的影响[J]. 食品科学, 2013, 34(24): 294-298.
[40] 范林林, 赵宏侠, 冯叙桥, 等. D-SE处理对鲜切寒富苹果的保鲜效果[J]. 食品工业科技, 2015, 36(2): 323-327; 330. DOI:10.13386/j.issn1002-0306.2015.02.061.
[41] 张永清. 异抗坏血酸钠对鲜切莲藕营养成分的影响[J]. 食品工业,2015, 36(7): 9-12.
[42] DOKHANIEH A Y, AGHDAM M S. Postharvest browning alleviation of Agaricus bisporus, using salicylic acid treatment[J].Scientia Horticulturae, 2016, 207: 146-151. DOI:10.1016/j.scienta.2016.05.025.
[43] KUKURA J L, BEELMAN R B, PEIFFER M, et al. Calcium chloride added to irrigation water of mushrooms (Agaricus bisporus) reduces postharvest browning[J]. Journal of Food Science, 1998, 63(3): 454-457. DOI:10.1111/j.1365-2621.1998.tb15763.x.
[44] DOKHANIEH A Y, AGHDAM M S. Postharvest browning alleviation of Agaricus bisporus, using salicylic acid treatment[J].Scientia Horticulturae, 2016, 207: 146-151. DOI:10.1016/j.scienta.2016.05.025.
Inhibitory Mechanism of Natamycin on Browning of Fresh-Cut Agaricus bisporus
姜爱丽(1971—)(ORCID: 0000-0003-0100-5009),女,副教授,博士,研究方向为采后生物学与技术。E-mail: jal@dlnu.edu.cn
胡文忠(1959—)(ORCID: 0000-0002-0209-4317),男,教授,博士,研究方向为采后生物学与技术。E-mail: hwz@dlnu.edu.cn
XU Dongying, GU Sitong, ZHOU Fuhui, et al. Inhibitory mechanism of natamycin on browning of fresh-cut Agaricus bisporus[J].Food Science, 2019, 40(17): 255-262. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180926-284.http://www.spkx.net.cn