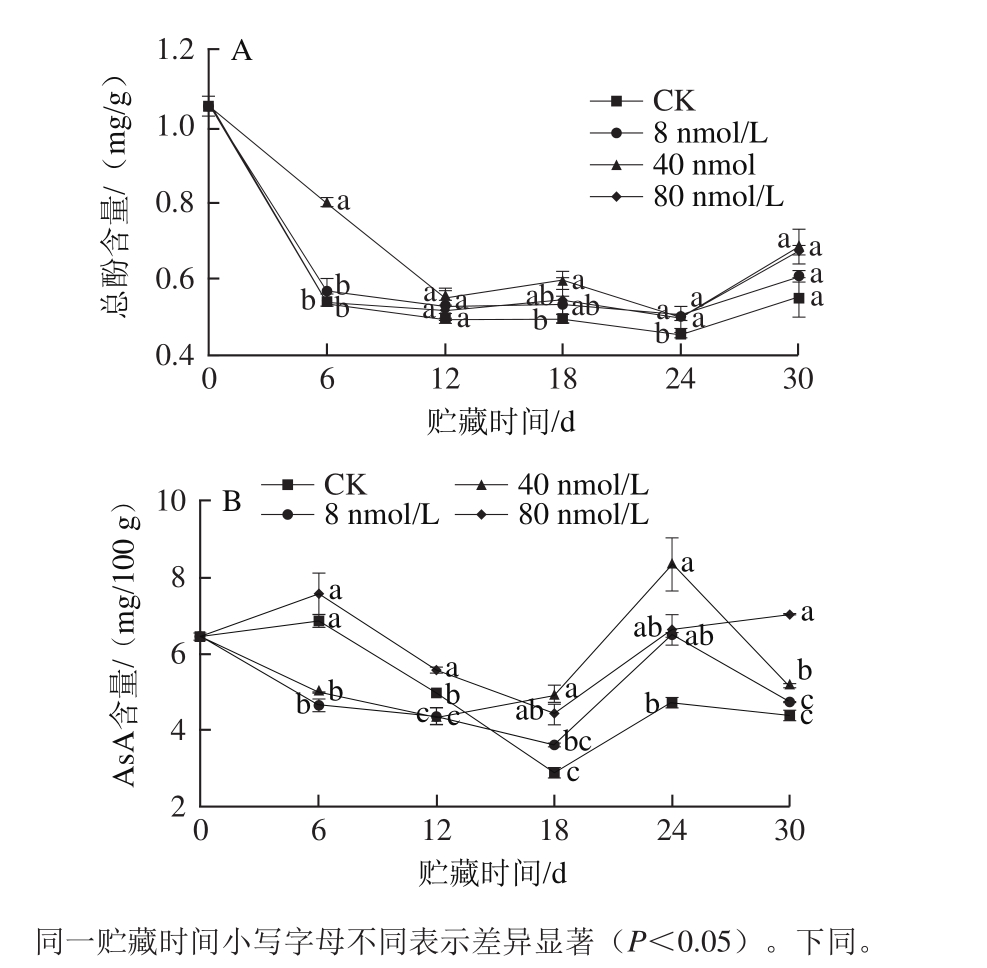
图1 肉桂醛熏蒸处理对香菇总酚(A)和AsA(B)含量的影响
Fig. 1 Effects of cinnamaldehyde fumigation on total phenolic (A) and AsA (B) content in shiitake mushroom during storage
香菇(Lentinus edodes)又称黑蘑菇、橡木蘑菇、厚菇等,是一种世界著名的食用菌。其具有较高的营养价值,富含多种人体必需的氨基酸和微量元素,且有低脂肪、高蛋白的特点;在药用价值上,其具有抗氧化、降血脂等功效。因香菇具有良好的营养价值和药用价值,被赋予“菇中之王”等美誉[1-2]。采后的香菇极易发生霉变和褐变,其菌盖与菌褶在常温下放置1~2 d就会发生褐变[3],是一种高度易腐的农产品。目前,香菇的保鲜方法有低温贮藏、涂膜处理、气调保鲜、辐射处理及化学保鲜等。这些方法在一定程度上能够延长香菇的贮藏期,但具有一定的局限性,低温处理易造成香菇冻害,辐射处理须严格控制剂量,化学试剂具有致癌、致畸变等副作用[4-5]。因此,开发更加可靠、安全、绿色的香菇保鲜剂尤为重要。
肉桂精油是一类从肉桂植物中以压榨、蒸馏方式提炼出来的芳香精油,属植物精油中的一种,因其具有抑菌、抗病毒和保持果蔬品质等作用,可作为优良的天然防腐剂,应用于水果和蔬菜的保鲜。其中,有研究者发现将草莓[6]、鳄梨[7]、覆盆子[8]、蓝莓[9]等用植物精油处理后能够很好地提高其抗氧化能力,起到很好的保鲜效果。而Wu Yalan等[10]用肉桂醛熏蒸处理柑橘,发现肉桂醛熏蒸处理能够显著提高柑橘的超氧化物歧化酶活力和苯丙氨酸解氨酶活力,继而降低果实酸败腐病的发生率。Wang Yuan等[11]用肉桂醛处理猕猴桃,发现能够提高猕猴桃的抗氧化能力并延缓其衰老。吕明珠等[12]等用肉桂醛处理红提葡萄,发现肉桂醛熏蒸处理能够较好地维持红提葡萄的风味品质,降低烂果率,有效地延长了贮藏期。有研究发现,肉桂醛熏蒸处理能有效保持香菇采后的品质,通过抑制丙二醛(malondialdehyde,MDA)含量上升,降低质量损失率和脯氨酸的积累量,从而起到延缓衰老的作用,同时抑菌效果较显著,能够达到较好的保鲜效果[13-14];但有关肉桂醛熏蒸处理对香菇抗氧化性和多胺的影响目前鲜见报道。
多胺是一类具有生理活性的含氮化合物,分别以腐胺(putrescine,Put)、亚精胺(spermidine,Spd)和精胺(spermine,Spm)3 种形式存在植物中。其主要通过加速细胞分化和影响酶活力来参与植物体的生长发育过程,在一定程度上有利于遗传物质、细胞膜的稳定性,且在抗逆性、抗衰老等方面发挥着重要作用[15-16]。当植株遭受水分胁迫、干旱胁迫、低温胁迫、盐胁迫等环境胁迫时,植株内游离态多胺的形态会发生相应的转化,游离态Put会转化为游离态Spd、游离态Spm,且胁迫程度不同,游离态多胺形态的转化程度不同。游离态多胺形态的转变在一定程度上能够减缓逆境胁迫所造成的伤害,维持正常的代谢活动。目前,游离态多胺在逆境胁迫中的生理功能、合成及代谢也愈加受到关注[17-18]。
本实验以香菇为原材料,通过测定香菇在贮藏过程中的总酚含量、抗坏血酸(ascorbic acid,AsA)含量、相关抗氧化物酶活力、2,2’-联氮-二(3-乙基苯并噻唑-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基清除能力及总抗氧化能力来研究肉桂精油熏蒸处理对香菇抗氧化能力的影响;测定Put、Spd、Spm含量来反映肉桂精油熏蒸处理对游离态多胺的影响;且通过观察各指标的变化趋势,并与对照组进行比较,揭示肉桂精油熏蒸处理的作用效果,以期为进一步控制香菇采后褐变、延长贮藏期提供理论依据和生产指导。
鲜香菇品种为‘香菇808’,采自浙江省杭州市老沙村茗香居农庄。挑选个体大小均匀、菌盖光滑、朵形完好、无机械损伤的香菇,采摘后当日运回实验室。
肉桂醛、Put、Spd、Spm 美国Sigma公司;总抗氧化能力测定试剂盒(比色法)、谷胱甘肽还原酶(glutathione reductase,GR)测定试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒 南京建成生物工程研究所;总抗氧化能力检测试剂盒(ABTS法)碧云天生物技术研究所;乙腈、无水甲醇为色谱纯。
I n fin i t e 2 0 0酶标仪 瑞士Te c a n公司;KQ2200DB数控超声波清洗仪 巴克超声波科技有限公司;OrionStarSeries pH计 美国Thermo公司;ASW2-0501-U型实验室超纯水系统 法国Aquapro公司;POLYTRONPT-MR2100匀浆机 瑞士Kinematica公司;AB135-S电子天平 美国Mettlertoledo公司;UV-1800分光光度计 日本岛津公司;DZF-6021型真空干燥箱上海齐欣科学仪器有限公司;100SERIES高效液相色谱仪美国Agilent公司;SORVALLStratos冷冻高速离心机德国Sigma公司;AF-10制冰机 美国Scotsman公司。
1.3.1 处理方法
剔除次品,挑选个体大小均匀、菌盖光滑、朵形完好、无机械损伤、无开伞的香菇作为供试样品。将挑选好的香菇随机分成3 组,并从中选取20 个香菇放入由生产厂商定制的2 L大小的密封塑料保鲜盒中(贴有滤纸),每盒分别用0(CK)、8、40、80 nmol/L的肉桂醛溶液(溶剂为体积分数30%乙醇溶液)处理,且溶液须充分铺于滤纸上,快速盖上盒盖,于密闭条件下充分熏蒸2 h。将处理后的香菇于4 ℃下贮藏30 d,贮藏期间每隔6 d取样测定香菇的主要抗氧化活性和多胺指标。每个处理做3 次平行实验,整个实验重复3 次。
1.3.2 指标测定
1.3.2.1 总酚含量的测定
总酚含量参考李巨秀等[19]的方法测定。
1.3.2.2 AsA含量的测定
AsA含量的测定采用2,6-二氯酚靛酚法[20]。
1.3.2.3 APX活力的测定
参考Nakano等[21]的方法进行抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活力测定。取4.0 g香菇,加入到pH 7.5 50 mmol/L的磷酸缓冲液(含0.1 mmol/L乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、体积分数0.3%辛基苯基聚氧乙烯醚(polyethylene glycol tert-octylphenyl ether,Triton X-100)、2 mmol/L AsA和4 g/100 mL聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP))中,并于冰浴中研磨,将得到的匀浆再用pH 7.5 50 mmol/L的磷酸盐缓冲液定容到10 mL,然后在10 000 ×g、4 ℃下离心30 min得到上清液(酶液),并于290 nm波长处测量吸光度。
1.3.2.4 CAT活力的测定
参考Wang Yousheng等[22]的方法进行氧化氢酶(catalase,CAT)活力测定。取4.0 g样品,并立刻放入冰预冷过的pH 7.0、0.1 mol/L的10 mL磷酸钾缓冲液(含1 mmol/L的EDTA、2 g/100 mL PVP)中,用匀浆机打成浆液,再在4 ℃下,13 000×g离心30 min得上清液,于240 nm波长处测量吸光度,酶活力单位为U/g。
1.3.2.5 SOD、GR活力和ABTS阳离子自由基清除能力、总抗氧化能力的测定
SOD、GR活力分别按照SOD、GR测定试剂盒使用说明书进行测定。ABTS阳离子自由基清除能力、总抗氧化能力的测定分别参考总抗氧化能力检测试剂盒(ABTS法)、总抗氧化能力测定试剂盒(比色法)使用说明书进行测定。
1.3.2.6 游离态多胺含量的测定
参考魏云潇[23]的方法进行游离态多胺(Put、Spd、Spm)含量的测定。
各指标均以香菇鲜质量进行计算。采用SPSS 17.0软件进行数据分析和Duncan’s差异显著性检验,P<0.05表示差异显著,采用Origin 8.5软件作图。

图1 肉桂醛熏蒸处理对香菇总酚(A)和AsA(B)含量的影响
Fig. 1 Effects of cinnamaldehyde fumigation on total phenolic (A) and AsA (B) content in shiitake mushroom during storage
酚类物质和AsA是香菇的活性成分,与香菇的抗氧化性具有一定的相关性。一般而言,酚类物质含量越高,抗氧化性越强[24]。而AsA作为果蔬中的自由基清除剂,能有效清除单线态氧、超氧化物、羟自由基,从而保持一些化合物的生物活性,抑制酶促反应[25]。由图1A可知,各处理组总酚含量变化趋势基本一致,0~24 d总体呈下降趋势,24 d后再呈上升趋势。在整个贮藏期间,各肉桂醛熏蒸处理组的总酚含量均高于对照组,其中,40 nmol/L肉桂醛熏蒸处理组于0~12 d的总酚含量明显高于对照组,较为有效地抑制了总酚含量的下降。但总体而言,各组无明显差异。因此肉桂醛熏蒸处理对香菇总酚含量无明显影响。
由图1B可知,在整个贮藏过程中,对照组的AsA含量始终低于80 nmol/L肉桂醛熏蒸处理组。贮藏前12 d,对照组AsA含量低于80 nmol/L肉桂醛熏蒸处理组,但高于8 nmol/L和40 nmol/L肉桂醛熏蒸处理组。之后,对照组的AsA含量低于各浓度的肉桂醛熏蒸处理组。8 nmol/L肉桂醛熏蒸处理的AsA含量呈现0~18 d内先下降、18~24 d上升、24 d后再下降趋势。40 nmol/L肉桂醛熏蒸处理的AsA含量变化趋势与8 nmol/L肉桂醛熏蒸处理组相似,只是40 nmol/L肉桂醛熏蒸处理组的AsA含量于第12天处于最低点,并于第24天达到最高值,为8.320 3 mg/100 g,与此时对照组差异显著(P<0.05)。对照组和80 nmol/L肉桂醛熏蒸组的AsA含量呈现前6 d内先上升、6~18 d下降、18 d后再上升的趋势。在24 d后,80 nmol/L肉桂醛熏蒸处理组的AsA含量仍持续升高。由此可得出,前期处理过程中,高浓度的肉桂醛处理有助于提高AsA含量,而低浓度的肉桂醛处理会对AsA含量的升高具有抑制效果。而后期(24 d后),各浓度的肉桂醛熏蒸处理均能较好地减少AsA含量的降低。

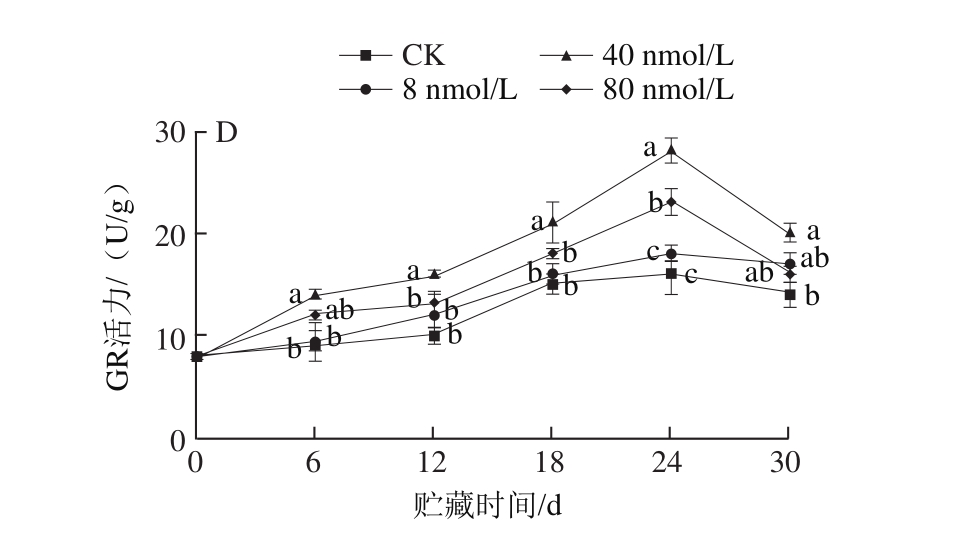
图2 肉桂醛熏蒸处理对香菇APX(A)、CAT(B)、SOD(C)、GR(D)活力的影响
Fig. 2 Effects of cinnamaldehyde fumigation on APX (A), CAT (B),SOD (C) and GR (D) activity in shiitake mushroom during storage
APX、CAT、SOD、GR均是植物代谢中的抗氧化酶,其中APX在植物活性氧代谢中起着重要的作用,能够延缓果蔬的衰老褐变[26];CAT是一种广泛存在于植物中的末端氧化酶,其能在活性氧代谢过程中起到清除过氧化氢的作用,从而提高植物的抗逆性[27];SOD是植物体内活性氧自由基清除系统的第一道防线,其能催化氧自由基转化为O2和H2O2,从而降低具有毒性的氧自由基对细胞造成的伤害[28];GR是一种低分子质量巯基化合物,是抗坏血酸-谷胱甘肽循环中的关键酶,能够使植物体内的谷胱甘肽从氧化态变成还原态,并在植物逆境响应代谢途径中起到保护细胞的作用[29]。由图2可知,在整个贮藏期间,各肉桂醛熏蒸处理组的APX、CAT、SOD、GR活力均高于对照组。由图2A可知,在整个贮藏过程中,各组APX活力先降低后升高。在第24天,各肉桂醛熏蒸处理组与对照组存在显著性差异(P<0.05),可得出采用肉桂醛熏蒸处理有助于提高香菇APX活力。
由图2B可知,香菇中的CAT活力在0~6 d先下降、6~18 d上升、18 d后再下降的趋势。CAT活力在第18天达到最大值,其中40 nmol/L肉桂醛熏蒸处理组CAT活力为753.0 U/g,而对照组为421.13 U/g,各处理组显著大于对照组(P<0.05)。表明经过肉桂醛熏蒸处理可明显地提高香菇的CAT活力,进而起到清除活性氧的作用,提高抗逆性。
由图2C可知,在贮藏过程中,香菇的SOD活力总体上在0~6 d先上升,6 d后再下降。其中,8 nmol/L的肉桂醛熏蒸处理组的SOD活力于第6天达到最大值(729.0 U/g)。在0~12 d,各处理组的SOD活力和对照组无显著差异。随后,各肉桂醛熏蒸处理组的SOD活力均逐渐高于对照组,40 nmol/L的肉桂醛熏蒸处理组的SOD活力最高,且于第30天,与对照组有显著差异(P<0.05)。因此,香菇通过一定浓度的肉桂醛处理可提高抗氧化酶SOD活力,从而有利于细胞膜的稳定性。
由图2D可知,香菇的GR活力于0~24 d上升,24 d后下降。其中,40 nmol/L肉桂醛处理组于第24天的GR活力为28.14 U/g,显著高于对照组(P<0.05)。表明肉桂醛熏蒸处理能够有效提高香菇的GR活力。

图3 肉桂醛熏蒸处理对香菇ABTS阳离子自由基清除能力(A)和总抗氧化能力(B)的影响
Fig. 3 Effects of cinnamaldehyde fumigation on ABTS cation radical scavenging capacity (A) and total antioxidant activity (B) in shiitake mushroom during storage
香菇的ABTS阳离子自由基清除能力与总抗氧化能力的强弱紧密相关,可反映总抗氧化能力[30]。由图3可知,在整个贮藏期间,各肉桂醛熏蒸处理组的ABTS阳离子自由基清除能力和总抗氧化能力均高于对照组。由图3A可知,在0~6 d,各组香菇的ABTS阳离子自由基清除能力均有较大幅度的提升;其中,40 nmol/L肉桂醛熏蒸处理组的ABTS阳离子自由基清除能力上升较明显,于第6天达到241.23 μg/g,比对照组高39.39%。贮藏后期(24~30 d),各组的ABTS阳离子自由基清除能力均呈略微下降的趋势,且各处理组的下降幅度低于对照组。结果表明肉桂醛熏蒸处理能够提高香菇的抗氧化能力,从而延缓香菇的衰老褐变。
如图3B所示,不同浓度的肉桂醛熏蒸处理对香菇的总抗氧化能力均有不同程度的影响。在整个贮藏期间,各处理组的总抗氧化能力均高于对照组,40 nmol/L处理组和80 nmol/L处理组总抗氧化能力变化趋势基本一致,均为上升趋势。而8 nmol/L肉桂醛熏蒸处理组和对照组呈下降趋势。其中,40 nmol/L肉桂醛熏蒸处理组于第30天的抗氧化能力为23.74 U/g,为对照组的1.79 倍,差异显著(P<0.05)。结果表明不同浓度的肉桂醛处理对香菇总抗氧化能力的变化趋势有较大影响,且均能显著提高香菇的总抗氧化能力。

图4 肉桂醛熏蒸处理对香菇游离态多胺含量的影响
Fig. 4 Effects of cinnamaldehyde fumigation on free polyamines content in shiitake mushroom during storage
由图4A可得,在整个贮藏过程中,游离态Put含量总体呈先上升后下降的趋势。40、80 nmol/L肉桂醛熏蒸处理组的游离态Put始终高于对照组,在贮藏第10天与对照组的差距最大,此时40 nmol/L肉桂醛熏蒸处理组的游离态Put含量达到了0.259 7 mg/g,与对照组显著差异(P<0.05)。在香菇的贮藏后期(20 d后),各组游离态Put含量均呈下降趋势,且各处理组的游离态Put含量均高于对照组。
由图4B可得,香菇中游离态Spd含量趋势是先上升后下降,最后趋向于稳定。各处理组的游离态Spd含量总体上均低于对照组,只是在贮藏15 d时,40 nmol/L肉桂醛熏蒸处理组的游离态Spd含量要略高于对照组。在第5天时,对照组的Spd含量达到最大值(1.750 mg/g),高于各处理组。在后期(15~25 d)各组游离态Spd含量相近。
由图4C可得,香菇在贮藏期间,各组游离态Spm含量总体上是先上升后下降,各处理组的游离态Spm含量于第5天达到峰值,而对照组于第10天达到峰值。在第5 天,8、40、80 nmol/L的肉桂醛熏蒸处理组游离态Spm含量分别比对照组显著高357.1%、235.0%、347.1%(P<0.05)。在贮藏10 d后,各组的游离态Spm含量相对稳定,且对照组游离态Spm含量高于各肉桂醛处理组。
综上,在香菇的贮藏期间,整体上对照组的游离态Put含量相对低于各肉桂醛处理组,而游离态Spd和Spm含量要高于各肉桂醛处理组,这可能与香菇的防卫反应相关,使游离态Put转化成游离态Spd和Spm,游离态Spd和Spm含量增多,从而得以应对活性氧的毒害作用和衰老过程中的一些生理伤害。而肉桂醛熏蒸处理能够减少游离态多胺形态之间的转化,说明肉桂醛处理可缓解采后香菇在成熟衰老过程中所造成的伤害,延长香菇的贮藏期。
褐变、衰老是存在于采后果蔬中的普遍现象,其与活性氧代谢紧密相关。果蔬在采后贮藏过程中,活性氧清除系统的功能会相对减弱且活性氧代谢极易失衡,导致活性氧的积累,从而破坏细胞膜,对细胞产生伤害[31]。而植物体自身具有自由基清除系统,通过清除自由基抵御自由基产生的伤害[32]。自由基清除系统包含了抗氧化体系中各抗氧化代谢循环、抗氧化物质、大部分抗氧化酶,在植物体的成熟衰老过程中发挥着重要的作用[33-34]。植物精油是一种具有挥发性的次级代谢产物,适宜浓度的植物精油能在一定程度上提高采后果蔬的抗氧化物含量及抗氧化酶活力,控制褐变,延缓植物的成熟与衰老[35]。有研究表明,植物精油在蓝莓、油桃、草莓采后保鲜应用中较为广泛,其能在一定程度上清除自由基并维持酚类物质及抗氧化物质的含量,继而提高果实的抗氧化能力[36-39]。肉桂醛作为植物精油中的有效成分,在采后果蔬保鲜方面取得了良好的效果。本研究采用不同浓度的肉桂醛处理香菇,发现处理组的AsA含量于贮藏后期下降的趋势得以抑制,同时能够保持相关抗氧化酶APX、CAT、SOD、GR活力。处理组ABTS阳离子自由基清除能力和总抗氧化能力均优于对照组。Jin Peng等[40]研究发现肉桂醛处理能够提高杨梅相关的抗氧化酶活力和抗氧化能力;李述刚等[41]发现一定浓度的环氧乙烷高级脂肪醇与肉桂精油复合处理冬枣,能够很好地保持过氧化氢酶活力,达到较好的保鲜效果,二者的结论与本研究相一致。由此可见,肉桂醛熏蒸处理能够维持较高的抗氧化酶活力及抗氧化物含量,提高果蔬的抗氧化性,继而有利于细胞膜的稳定性,延缓衰老褐变,延长贮藏期。
多胺是一类植物体内具有生物活性的低分子质量的生长调节物质,其作为信号分子,可通过加速细胞分化和影响酶活力来参与植物体的生长发育过程,在遗传物质的稳定性和蛋白质的合成方面发挥着巨大作用。此外,其可提高植物对外界环境的抗逆性,从而延缓衰老[42]。有研究表明,当果蔬受到逆境胁迫时,为维持正常的生理、代谢活动,游离态Put会转变为游离态Spd、Spm,得到较高含量的游离态Spd及Spm,进而抵御外界及自身成熟衰老过程中产生的一系列伤害[43]。在本实验中,各肉桂醛处理组游离态Put含量相对高于对照组,而游离态Spd、Spm含量要低于对照组,表明肉桂醛熏蒸处理能够一定程度上减少果蔬衰老过程中所造成的一些生理伤害。
不同浓度的肉桂醛熏蒸处理均能够提高香菇的相关抗氧化物酶(APX、CAT、SOD、GR)活力、ABTS阳离子自由基清除能力、总抗氧化能力,且抑制贮藏后期AsA含量的下降,使其保持较高的抗氧化能力,从而抵抗自由基产生的伤害,保护细胞,延缓衰老变质;然而,肉桂醛熏蒸处理对总酚含量的影响甚微。此外,肉桂醛熏蒸处理能够通过减少游离态Put向游离态Spd、Spm的转化,起到保护细胞膜、稳定细胞内部成分的作用,提高香菇的抗逆性。其中,40 nmol/L肉桂醛熏蒸处理香菇的效果最佳。综上,适宜浓度的肉桂醛熏蒸处理能够显著提高和保持香菇的抗氧化能力和抗逆性,本实验结果在香菇的贮藏保鲜中具有良好的研究意义和应用价值。
[1] 顾可飞, 周昌艳, 李晓贝. 食用菌的营养价值及药用价值[J]. 食品工业, 2017, 38(10): 228-231.
[2] 刘晓, 闫语婷. 香菇的营养价值及综合利用现状与前景[J]. 食品工业, 2017, 38(3): 207-210.
[3] 韩春然, 闫宝军, 唐均安. 香菇采后贮藏期间褐变的因素研究[J].现代食品科技, 2012, 28(11): 1441-1444. DOI:10.13982/j.mfst.1673-9078.2012.11.016.
[4] 刘燕, 卢立新. 香菇气调保鲜包装工艺研究[J]. 食品与发酵工业,2007, 33(11): 155-157. DOI:10.13995/j.cnki.11-1802/ts.2007.11.037.
[5] 李安静. 植物精油对香菇保鲜作用的研究[D]. 雅安: 四川农业大学,2013: 6-8.
[6] WANG C Y, WANG S Y, YIN J J, et al. Enhancing antioxidant,antiproliferation, and free radical scavenging activities in strawberries with essential oils[J]. Journal of Agricultural and Food Chemistry,2007, 55(16): 6527-6532. DOI:10.1021/jf070429a.
[7] SELLAMUTHU P S, SIVAKUMAR D, SOUNDY P, et al. Essential oil vapours suppress the development of anthracnose and enhance defence related and antioxidant enzyme activities in avocado fruit[J].Postharvest Biology & Technology, 2013, 81(3): 66-72. DOI:10.1016/j.postharvbio.2013.02.007.
[8] JIN P, WANG S Y, GAO H Y, et al. Effect of cultural of system and essential oil treatment on antioxidant capacity in raspberries[J].Food Chemistry, 2012, 132(1): 399-405. DOI:10.1016/j.foodchem.2011.11.011.
[9] WANG C Y, WANG S Y, CHEN C. Increasing antioxidant activity and reducing decay of blueberries by essential oils[J]. Journal of Agricultural & Food Chemistry, 2008, 56(10): 3587-3592.DOI:10.1021/jf7037696.
[10] WU Yalan, DUAN Xiaofang, JING Guoxing, et al. Cinnamaldehyde inhibits the mycelial growth of geotrichum citri-aurantii and induces defense responses against sour rot in citrus fruit[J].Postharvest Biology & Technology, 2017, 129: 23-28. DOI:10.1016/j.postharvbio.2017.03.004.
[11] WANG Yuan, SHAN Tingting, YUAN Yahong, et al. Overall quality properties of kiwifruit treated by cinnamaldehyde and citral: microbial,antioxidant capacity during cold storage[J]. Journal of Food Science,2016, 81(12): 3043-3051. DOI:10.1111/1750-3841.13536.
[12] 吕明珠, 于爽, 朱恩俊. 肉桂精油对红提葡萄保鲜效果的影响[J]. 食品科学, 2016, 37(6): 272-277. DOI:10.7506/spkx1002-6630-201606049.
[13] 温小礼, 张伟, 周巧丽, 等. 肉桂醛熏蒸处理对香菇采后生理和品质的影响[J]. 中国食品学报, 2014, 14(8): 190-196. DOI:10.16429/j.1009-7848.2014.08.025.
[14] 温小礼. 肉桂醛熏蒸对香菇品质、抗氧化及多胺的影响[D]. 杭州:浙江工商大学, 2013: 1-49.
[15] 赵福庚, 刘友良. 高等植物体内特殊形态多胺的代谢及调节[J]. 植物生理学通讯, 2000, 36(1): 1-6. DOI:10.13592/j.cnki.ppj.2000.01.001.
[16] TIBURRCIO A F, BESFORD R T, CAPELL T, et al. Mechanism of polyamine action during senescence responses induced by osmotic stress[J]. Journal of Experimental Botany, 1994, 45(12): 1789-1800.DOI:10.1093/jxb/45.12.1789.
[17] 陆芳勤, 王欣, 沈潼, 等. 多胺代谢与植物环境胁迫[J]. 天津农业科学, 2014, 20(3): 15-17. DOI:10.3969/j.issn.1006-6500.2014.03.004.
[18] 袁祖丽, 刘秀敏, 李华鑫. 多胺与环境胁迫关系研究进展[J].西北植物学报, 2008, 28(9): 1912-1919. DOI:10.3321/j.issn:1000-4025.2008.09.034.
[19] 李巨秀, 王柏玉. 福林-酚比色法测定桑椹中总多酚[J]. 食品科学,2009, 30(18): 292-295. DOI:10.3321/j.issn:1002-6630.2009.18.066.
[20] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化指导[M]. 北京: 中国轻工业出版社, 2013: 34-37.
[21] NAKANO Y, ASADA K. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J]. Plant & Cell Physiology, 1981, 22(5): 867-880. DOI:10.1093/oxfordjournals.pcp.a076232.
[22] WANG Yousheng, TIAN Shiping, XU Yong. Effects of high oxygen concentration on pro- and anti-oxidant enzymes in peach fruits during postharvest periods[J]. Food Chemistry, 2005, 91(1): 99-104.DOI:10.1016/j.foodchem.2004.05.053.
[23] 魏云潇. 采后处理对芦笋品质、抗氧化及多胺的影响[D]. 杭州: 浙江大学, 2011: 21-22.
[24] LIMMONGKON A, JANHOM P, AMTHONG A, et al. Antioxidant activity, total phenolic,and resveratrol content in five cultivars of peanut sprouts[J]. Asian Pacific Journal of Tropical Biomedicine,2017, 7(4): 332-338. DOI:10.1016/j.apjtb.2017.01.002.
[25] SIKORA M, SWIECA M. Effect of ascorbic acid postharvest treatment on enzymatic browning, phenolics and antioxidant capacity of stored mung bean sprouts[J]. Food Chemistry, 2018, 239: 1160-1166. DOI:10.1016/j.foodchem.2017.07.067.
[26] 闵九康. 植物抗氧化剂及其应用[M]. 北京: 中国农业科学技术出版社, 2013: 93-127.
[27] 于德玲, 王昌留. 过氧化氢酶的研究进展[J]. 中国组织化学与细胞化学杂志, 2016, 25(2): 190-194. DOI:10.16705/j.cnki.1004-1850.2016.02.017.
[28] GILL S S, ANJUM N A, GILL R, et al. Superoxide dismutase-mentor of abiotic stress tolerance in crop plants[J]. Environmental Science &Pollution Research, 2015, 22(14): 10375-10394. DOI:10.1007/s11356-015-4532-5.
[29] 林源秀, 顾欣昕, 汤浩茹. 植物谷胱甘肽还原酶的生物学特性及功能[J]. 中国生物化学与分子生物学报, 2013, 29(6): 534-542.DOI:10.13865/j.cnki.cjbmb.2013.06.009.
[30] MILLER N J, RICE-EVANS C, DAVIES M J, et al. A novel method for measuring antioxidant capacity and its application to the monitoring the antioxidant status in premature neonates[J]. Clinical Science, 1993, 84(4): 407-412. DOI:10.1042/cs0840407.
[31] 王静, 孙广宇, 姬俏俏, 等. 活性氧在果蔬采后衰老过程中的作用及其控制[J]. 包装与食品机械, 2015, 33(5): 51-54; 58. DOI:10.3969/j.issn.1005-1295.2015.05.012.
[32] 张刚, 李里特, 丹阳. 果蔬成熟衰老中的活性氧代谢[J]. 食品科学,2004, 25(增刊1): 225-230. DOI:10.3321/j.issn1002-6630.2004.z1.055.
[33] MOLLER I M. Plant mitochondria and oxidative stress: electron transport, NADPH turnover, and metabolism of reactive oxygen species[J]. Annual Review of Plant Biology, 2001, 52(4): 561-591.DOI:10.1146/annurev.arplant.52.1.561.
[34] 沈成国. 植物衰老生理与分子生物学[M]. 北京: 中国农业出版社,2001: 95-99.
[35] 段伟丽, 包怡红. 植物精油在食品保鲜中的应用研究[J]. 中国林副特产, 2015(1): 94-97. DOI:10.13268/j.cnki.fbsic.2015.01.044.
[36] AYALA-ZAVALA J F, WANG S Y, WANG C Y, et al. Methyl jasmonate in conjunction with ethanol treatment increases antioxidant capacity, volatile compounds and postharvest life of strawberry fruit[J]. European Food Research & Technology, 2005, 221(6): 731-738. DOI:10.1007/s00217-005-0069-z.
[37] CHANJIRAKUL K, WANG S Y, WANG C Y, et al. Natural volatile treatments increase free-radical scavenging capacity of strawberries and blackberries[J]. Journal of the Science of Food and Agriculture,2007, 87(8): 1463-1472. DOI:10.1002/jsfa.2841.
[38] 王靖博, 张敏, 董睿, 等. 3 种植物精油熏蒸处理对油桃保鲜效果的影响[J]. 核农学报, 2018, 32(5): 933-940. DOI:10.11869/j.issn.100-8551.2018.05.0933.
[39] 潘怡丹, 郜海燕, 陈杭君, 等. 麝香草酚/聚乳酸抗菌包装对蓝莓保鲜效果的影响[J]. 核农学报, 2018, 32(4): 715-722. DOI:10.11869/j.issn.100-8551.2018.04.0715.
[40] JIN Peng, WU Xin, XU Feng, et al. Enhancing antioxidant capacity and reducing decay of Chinese bayberries by essential oils[J].Journal of Agricultural & Food Chemistry, 2012, 60(14): 3769-3775.DOI:10.1021/jf300151n.
[41] 李述刚, 黄芳, 许倩, 等. OHAA肉桂在冬枣保鲜中的应用研究[J]. 塔里木大学学报, 2011, 23(3): 1-8. DOI:10.3969/j.issn.1009-0568.2011.03.001.
[42] IMAI A, MATSUYAMA T, HANZAWA Y, et al. Spermidine synthase genes are essential for survival of arabidopsis[J]. Plant Physiology, 2004, 135(3): 1565-1573. DOI:10.1104/pp.104.041699.
[43] 王聪, 杨恒山, 董永义, 等. NaCl胁迫对结荚期菜用大豆叶片游离态多胺水平的影响[J]. 生态学杂志, 2012, 31(5): 1123-1128.DOI:10.13292/j.1000-4890.2012.0164.
Effect of Cinnamaldehyde Fumigation on Antioxidant Capacity and Polyamines in Shiitake Mushroom
QIAN Xiaochen, LIN Kaili, HUANG Qi, et al. Effect of cinnamaldehyde fumigation on antioxidant capacity and polyamines in shiitake mushroom[J]. Food Science, 2019, 40(17): 263-269. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180918-192. http://www.spkx.net.cn