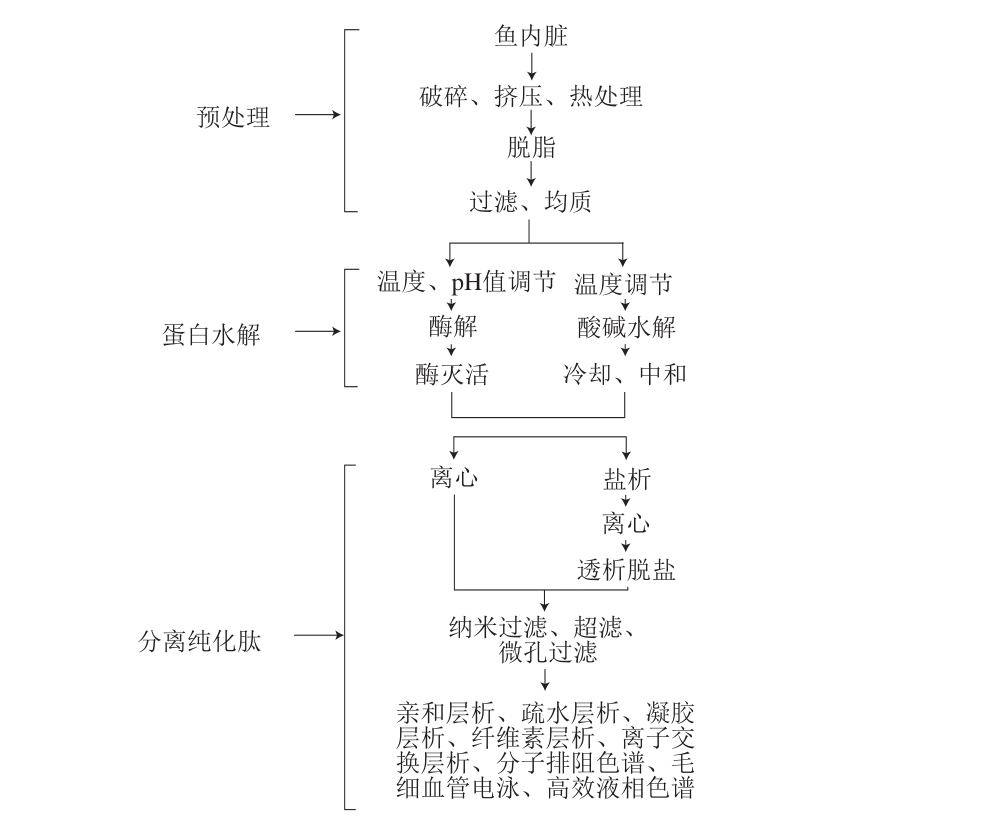
图1 鱼内脏蛋白水解制备活性肽的工艺流程
Fig. 1 Flow chart for preparation of bioactive peptides by hydrolysis of fish viscera
全球人均鱼肉消费量已从1960年的9.9 kg升至2014年的20.1 kg[1]。与此同时,在鲜鱼加工过程中产生了大量的副产物,包括内脏、鱼头、鱼骨、鱼鳞、鱼皮等。根据鱼的种类不同,这些副产物的总质量可占鲜鱼总质量的50%~70%[1]。据统计,这些副产物中50%左右被直接丢弃,仅有30%被初步加工为低值的动物饲料、肥料或发酵鱼露[2]。鱼类加工副产物若得不到妥善处理,极易污染土壤和水源[3]。另一方面,企业往往忽视了鱼类加工副产物潜在价值的开发。鱼类加工副产物通常含有胶原蛋白、糖胺聚糖、多不饱和脂肪酸、磷脂、维生素、酶、活性肽等多种生物活性物质[4]。这些成分决定鱼类加工副产物有着极大的精深加工潜力。对此类副产品进行有目的的加工,不仅能够提升加工单元的额外收益,也能够避免因直接丢弃而引发的环境污染。
鱼内脏一般可占整鱼质量的7.5%~15.0%[5]。鱼内脏蛋白类物质的质量可达内脏干质量的20%以上,其所占比例与鱼种类、年龄、季节、饲料及其他因素有直接关系[6]。本文涉及到的鱼内脏蛋白类物质的加工产品有5 类,分别为生物活性肽、细菌素、生物降解膜、蛋白胨和内脏酶。本文将逐一对上述产品的加工技术及其产品功能特性的研究进展、成果进行综述,并展望鱼类内脏蛋白类物质的未来研究方向和发展趋势。
通过酸碱法水解或酶法水解将鱼内脏蛋白转化为低分子质量肽或游离氨基酸,是提高鱼内脏蛋白生物活性的常见方法[7]。在酸碱水解或酶解之前,需要进行一系列的预处理工艺。若预处理工艺不当,蛋白溶液极易发生氧化、变色甚至产生恶臭味和有毒物质[8]。预处理手段通常包括破碎、挤压、热处理、脱脂、过滤、均质等一系列操作单元。热处理的目的是将鱼内脏酶类灭活,若需用鱼内脏内源蛋白酶进行自水解,则可不进行热处理这一预处理工艺[2,9-10]。
用酸或碱水解鱼内脏蛋白已被广泛研究[11-12]。酸碱水解法最主要的优势是成本低,因此在工业中的应用较为广泛。然而在酸碱水解过程中,必需氨基酸如色氨酸、蛋氨酸、胱氨酸和半胱氨酸容易被破坏,导致氨基酸损失[13]。此外,从产品角度来说,因需要对酸或碱液进行中和,所以所得蛋白水解液含盐量通常较高。因此,采用酸碱法制备活性肽需要后续的纳米过滤、离子交换树脂等方法除盐[14]。
与酸碱水解法不同,通过酶解法获得鱼内脏蛋白酶解液的反应条件通常较为温和,且具有品质可控、副产物少等优点[15]。因此近年来,越来越多的学者采用酶法水解鱼内脏蛋白制备活性肽。在酶解工艺中,因不同种类的蛋白酶对切割位点具有选择性,所以蛋白酶种类的选择极其重要。综合文献来看,在鱼内脏蛋白酶解工艺中常用的商用蛋白酶有碱性蛋白酶、风味蛋白酶、中性蛋白酶、胰蛋白酶、糜蛋白酶等[15-16]。显然,蛋白酶的高价格是制约酶解法制备鱼内脏蛋白酶解液在工业生产中应用的主要因素。出于降低成本的考虑,部分研究者们利用鱼类内源蛋白酶系水解内脏蛋白[17]。
在酸碱水解或酶解步骤之后,为了去除水解液中未完全水解的、不具有生物活性的蛋白质或其他物质,通常会采用离心、盐析、微孔过滤、纳米膜过滤、超滤等手段处理酶解液[18-19]。之后,根据肽理化性质的不同,采用亲和层析、凝胶层析、疏水层析、纤维素层析、离子交换层析、分子排阻色谱、高效液相色谱、毛细管电泳中的一种或几种方法组合的方式,对生物活性肽进行靶向分离纯化[19-20]。鱼内脏蛋白水解制备活性肽的工艺流程如图1所示。后续如需对肽的氨基酸序列进行鉴定,常采用质谱分析,如连续流快原子轰击质谱、电喷雾离子质谱、基质辅助激光解吸电离-飞行时间质谱等[21-23]。此外,核磁共振法也可用于氨基酸个数小于30的肽的氨基酸序列分析[24]。

图1 鱼内脏蛋白水解制备活性肽的工艺流程
Fig. 1 Flow chart for preparation of bioactive peptides by hydrolysis of fish viscera
关于鱼内脏蛋白水解物中肽的生理活性的研究较多。国内方面,李致瑜等通过Alcalase蛋白酶酶解大黄鱼内脏蛋白制备抗氧化肽,发现肽的1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率为85.97%,羟自由基清除率为75.79[25]。杨晓军等以斑点叉尾鮰内脏为原料,经木瓜蛋白酶酶解后得到血管紧张素转化酶(angiotensin converting enzyme,ACE)抑制率为72.34%的活性肽[26]。国外方面,Kumar等用胃蛋白酶、胰蛋白酶和α-糜蛋白酶水解马鲛鱼内脏蛋白,之后采用离子交换色谱和凝胶过滤色谱分离得到一种抗氧化肽,并用电喷雾串联质谱测定出氨基酸序列为Ala-Cys-Phe-Leu。这种抗氧化肽在0.2 mg/mL下对羟自由基和DPPH自由基的清除率分别可达59.1%和89.2%[27]。与此相似,Ganesh等用胃蛋白酶、胰蛋白酶和α-糜蛋白酶水解乌鲳内脏蛋白,鉴定出一种氨基酸序列为Ala-Met-Thr-Gly-Leu-Glu-Ala的抗氧化肽,发现其具有抗DNA氧化损伤的作用[16]。Bougatef等利用沙丁鱼内脏自身蛋白酶系来酶解内脏蛋白,并从中分离并鉴定出一种ACE抑制肽,但未测定其氨基酸序列[28]。Motamedzadegan等采用中性蛋白酶来改善黄鳍金枪鱼内脏酶系酶解内脏蛋白工艺,并确定了最佳水解工艺所需的温度、酶添加量等工艺[29]。表1总结了近年来国内外关于酶解鱼内脏蛋白制备活性肽的研究进展。这些活性肽虽然有潜在的生理功效,但缺乏完善的临床实验而无法对其生理功效提供实质性证据,导致其尚未实现工业化应用。
表1 鱼内脏蛋白酶解物中活性肽的氨基酸序列及生理活性
Table 1 Amino acid sequences and bioactivities of peptides from protein hydrolysates of fish viscera
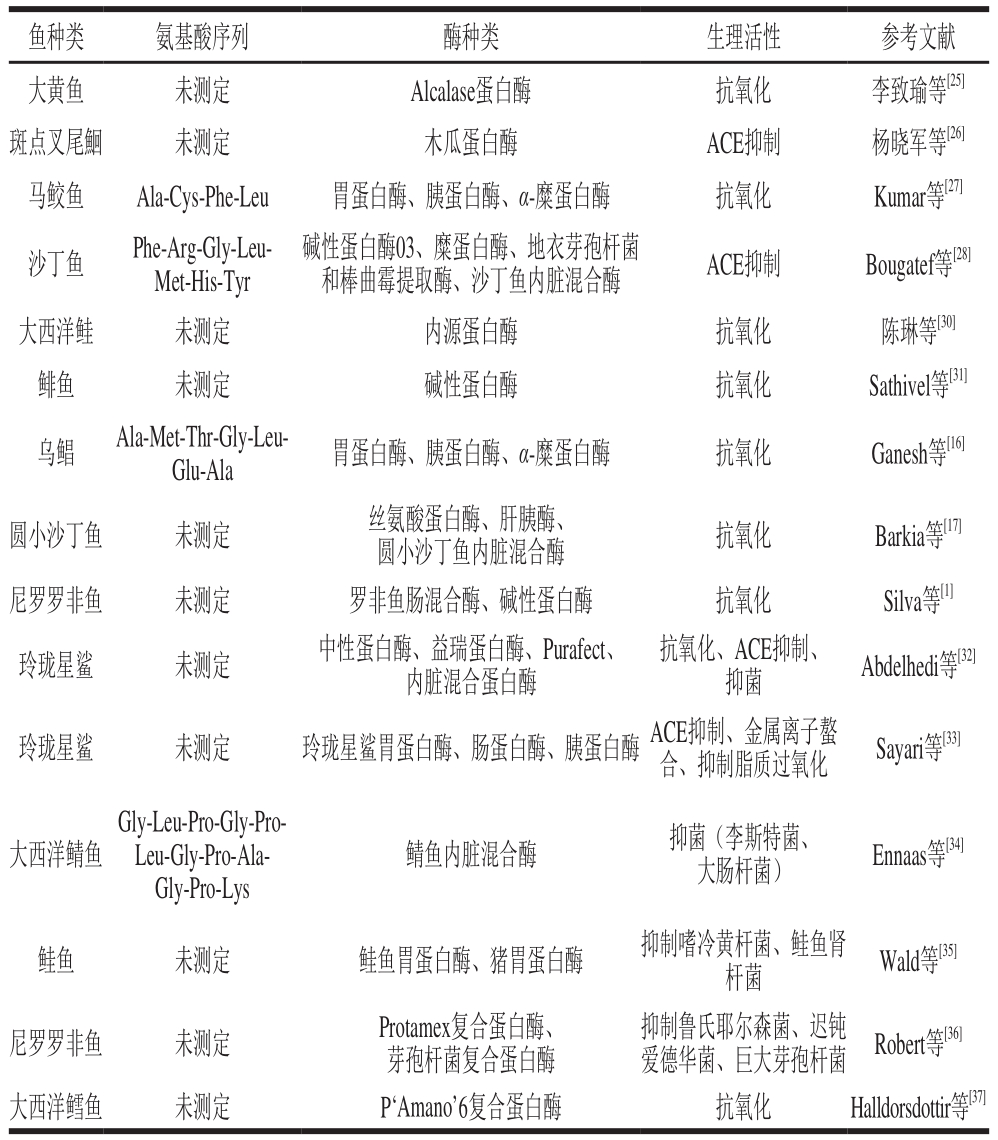
鱼种类 氨基酸序列 酶种类 生理活性 参考文献大黄鱼 未测定 Alcalase蛋白酶 抗氧化 李致瑜等[25]斑点叉尾鮰 未测定 木瓜蛋白酶 ACE抑制 杨晓军等[26]马鲛鱼 Ala-Cys-Phe-Leu 胃蛋白酶、胰蛋白酶、α-糜蛋白酶 抗氧化 Kumar等[27]沙丁鱼 Phe-Arg-Gly-Leu-Met-His-Tyr碱性蛋白酶03、糜蛋白酶、地衣芽孢杆菌和棒曲霉提取酶、沙丁鱼内脏混合酶 ACE抑制 Bougatef等[28]大西洋鲑 未测定 内源蛋白酶 抗氧化 陈琳等[30]鲱鱼 未测定 碱性蛋白酶 抗氧化 Sathivel等[31]乌鲳 Ala-Met-Thr-Gly-Leu-Glu-Ala 胃蛋白酶、胰蛋白酶、α-糜蛋白酶 抗氧化 Ganesh等[16]圆小沙丁鱼 未测定 丝氨酸蛋白酶、肝胰酶、圆小沙丁鱼内脏混合酶 抗氧化 Barkia等[17]尼罗罗非鱼 未测定 罗非鱼肠混合酶、碱性蛋白酶 抗氧化 Silva等[1]玲珑星鲨 未测定 中性蛋白酶、益瑞蛋白酶、Purafect、内脏混合蛋白酶抗氧化、ACE抑制、抑菌 Abdelhedi等[32]玲珑星鲨 未测定 玲珑星鲨胃蛋白酶、肠蛋白酶、胰蛋白酶 ACE抑制、金属离子螯合、抑制脂质过氧化 Sayari等[33]大西洋鲭鱼Gly-Leu-Pro-Gly-Pro-Leu-Gly-Pro-Ala-Gly-Pro-Lys鲭鱼内脏混合酶 抑菌(李斯特菌、大肠杆菌) Ennaas等[34]鲑鱼 未测定 鲑鱼胃蛋白酶、猪胃蛋白酶 抑制嗜冷黄杆菌、鲑鱼肾杆菌 Wald等[35]尼罗罗非鱼 未测定 Protamex复合蛋白酶、芽孢杆菌复合蛋白酶抑制鲁氏耶尔森菌、迟钝爱德华菌、巨大芽孢杆菌 Robert等[36]大西洋鳕鱼 未测定 P‘Amano’6复合蛋白酶 抗氧化 Halldorsdottir等[37]
细菌素是某些细菌合成的一类具有抑菌活性的多肽、蛋白或蛋白复合物。细菌素对人体无毒副作用,且不影响食品风味,因此可作为天然防腐剂和保鲜剂[38]。细菌素一直是食品天然防腐剂领域的研究热点。鱼肠道菌群的种类十分丰富,研究表明其中存在多种可合成较强抑菌活性细菌素的细菌。国内研究方面,安俊莹等从宝石石斑鱼肠道解淀粉芽孢杆菌ZJHD-06中分离出一种可抑制单核增生李斯特菌的细菌素[39]。邓梅等从额尔齐斯河冷水鱼肠道筛选到一株产细菌素的耐低温肠球菌Enterococcus sp. MB2-1,研究发现此细菌素可抑制革兰氏阳性菌李斯特氏菌、金黄色葡萄球菌、枯草芽孢杆菌及革兰氏阴性菌大肠杆菌。进一步的实验显示,此细菌素对胃蛋白酶、胰蛋白酶和尿素敏感,但对过氧化氢酶、Triton X-100、十二烷基硫酸钠,吐温-80和乙二胺四乙酸稳定[40]。国外研究方面,Ghomrassi等从地中海8 种鱼类的内脏肠球菌中分离出细菌素,发现得到的细菌素对病鱼中致病菌(副乳房链球菌、漫游球菌、肉杆菌、寒黄杆菌等)具有广谱抑菌作用[41]。Sarra等从黑斑小鲷肠道中分离出3 种屎肠球菌,发现这3 种屎肠球菌可产生抑制食品腐败菌和鱼类致病菌的细菌素[42]。
表2 鱼肠道菌株细菌素的抑菌特性
Table 2 Antibacterial properties of bacteriocins from fish intestinal bacteria

浸麻芽孢杆菌、短小芽孢杆菌
鱼蛋白,包括鱼明胶蛋白、肌原纤维蛋白、肌浆蛋白等已被广泛开发为食品包装的生物膜[59-61]。但是,将鱼内脏蛋白开发为食品级生物降解膜的研究还比较少见。Abdelhedi等采用Purafect蛋白酶,在pH 10、温度50 ℃、水解时间580 min、比酶活力6 U/mg的条件下水解前鳍星鲨内脏蛋白,并用超滤法得到分子质量小于1 kDa的肽。所得肽液(6%,质量分数,后同)与0.95%甘油(塑化剂)混合并在40 ℃下均质30 min,制成成膜溶液。将适量成膜溶液涂于有机硅树脂板上干燥成膜,研究发现所得生物降解膜比骨明胶膜抗拉强度更好,但断裂拉伸率低于骨明胶膜。同时,研究发现内脏蛋白-明胶混合膜的机械强度和玻璃化转变温度高于内脏蛋白-明胶双层膜,而变形性小于双层膜。混合膜在相对湿度为30%~84%的条件下阻止水分转移的能力强于双层膜[62]。
通过酶解等手段,将鱼类加工副产物加工为微生物培养所需蛋白胨的研究已进行了数10 年。鱼类加工副产物制备蛋白胨的一般步骤包括洗净、破碎、脱脂、混合液调整pH值、蛋白酶酶解、煮沸灭酶、离心、脱盐、浓缩、干燥、粉碎等。国内关于鱼内脏蛋白胨的研究较少。国外方面,Vázquez等将金枪鱼、黄线喉盘鱼、剑鱼、虹鳟鱼的内脏制成各类蛋白胨,以满足不同种微生物(如假单胞菌、弧菌、玫瑰杆菌等)的生长需要。实验表明这些鱼内脏来源的蛋白胨含有丰富多肽和游离氨基酸,比商业培养基更适于微生物培养[63]。Gildberg等用甲酸和磷酸处理冷肚鱼内脏蛋白并将所得自溶物作为3 种病原菌的氮源,发现与月示蛋白胨相比,广布肉杆菌的生长速度增长了两倍[64]。与此类似的,Klompong等发现黄鳍金枪鱼内脏蛋白经碱性蛋白酶和风味蛋白酶处理后所得蛋白胨对金黄色葡萄球菌和大肠杆菌的生长促进作用优于商业蛋白胨[6]。以上研究为鱼内脏蛋白胨在发酵工业和医药工业的应用提供了一定理论基础。显然,单一品种的鱼内脏蛋白不可能适用于所有种类微生物的生长。因此,选择不同种类鱼的内脏蛋白并调整制备工艺,开发为不同种类微生物生长所需的蛋白胨,具有较大的发掘潜力。
鱼内脏中的酶活性通常较高,这种特质一方面决定了内脏这一副产物难以长时间保持完整性;另一方面又为从中提取高活性的酶提供了可能性。国内方面,张培等用硫酸铵分级沉淀法从金鲳鱼内脏中提取出一种酸性蛋白酶,发现该酸性蛋白酶酶解鱼皮明胶的能力和提取虾壳中虾青素的能力均优于猪胃蛋白酶;进一步研究发现该酸性蛋白酶的分子质量为18.5 ku,最适pH值为4.0,最适反应温度为35 ℃[65]。国外方面,Ketnawa等用双水相萃取法从湄公河巨鲇内脏中提取肽酶,发现这种肽酶对温度、盐浓度有很强的耐受性[66]。进一步的实验表明,该肽酶水解鱼皮明胶的能力强于牛胰蛋白酶,且明胶水解液具有ACE抑制活性以及DPPH自由基和2,2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸阳离子自由基清除活性[67]。Saranya等从大比目鱼胃部分离出的一种高活性蛋白酶并将其应用于山羊皮脱毛工艺中,结果表明经该蛋白酶脱毛后的山羊皮,与传统脱毛工艺后所得的山羊皮粒面效果相当,且废水中的固形物更少,从而降低了后续废水处理的成本[68]。Younes等从赤鲉内脏中分离出一种碱性蛋白酶,可作为洗涤剂的添加剂并可应用于虾副产物脱蛋白[69]。
通过多种技术手段提高鱼内脏蛋白类物质的附加值,不仅可带来可观的经济效益,也可完善我国鱼类加工副产品综合利用产业链。但在现阶段,对鱼内脏蛋白类物质的研究仍停留在实验方面,工业化应用仍偏少,导致其未能达到资源增值、惠及民生的目的。因此,仍需通过实验不断增强对内脏蛋白类物质特性的了解,并与其他领域成熟产品建立密切联系,实现共同发展。
如前所述,鱼内脏蛋白水解物具有多种生理活性,对水解物生理活性的研究涉及到抗氧化、ACE抑制、免疫调节、金属离子螯合、抑菌、抗糖尿病等多个方面。但国内外关于其抗癌能力、抗过敏及其他生理活性的研究还不够深入。此外,鲜见通过微生物发酵方式制得鱼内脏源活性肽的研究。另一方面,大多数关于鱼内脏水解物中活性肽的研究为体外实验,到目前为止,鲜见关于将鱼内脏源活性肽加入谷物、甜点或肉类等使之成为功能性食品的报道。
目前,乳酸菌细菌素是唯一商业化使用的细菌素。从自然界中筛选菌种,并运用合适育种方法得到高产细菌素菌株,具有广阔的开发前景。近年来,鱼内脏源产细菌素的研究主要集中在菌种分离筛选和抑菌特性的研究,关于其分子结构鉴定及耐药机制的研究还不完全。此外,关于鱼内脏源细菌素的体外实验、动物实验乃至人体实验的研究还不完善,这也限制了其在食品工业中的应用。进一步地,对鱼内脏产细菌素细菌的相关基因组测序工作也需完善。
将鱼内脏蛋白应用于生物降解膜的研究还较少。综合已报道的文献来看,还需要一定的研究工作来全面提高鱼内脏蛋白降解膜的拉伸强度、断裂延伸率、穿刺强度等机械性能,以及阻水性、阻气性等阻隔性能。若能改善其制备工艺,并与其他生物降解膜的性能进行综合对比,应当能拓展此类生物降解膜在食品工业中的开发利用。
商业蛋白胨的价格通常较高,且可能存在营养素比例不平衡、微生物利用率较低等缺点。以鱼内脏蛋白通过外源酶酶解或内源酶自水解等手段将鱼内脏蛋白研制为蛋白胨,可能会弥补商业蛋白胨的缺陷。由于水生环境中重金属(汞、镉、砷、铬、铅)超标问题日益突出,鱼内脏中重金属含量通常比其他组织要高[70]。重金属离子可能对微生物的生长产生抑制作用,因此需将重金属离子的检测纳入此类蛋白胨的质量控制指标。此外,在工业应用之前,也需对此类蛋白胨的澄清度、亚硝酸盐含量、酸碱度、含氮量、氨基氮含量、干燥质量损失、炽灼残渣含量等常见蛋白胨理化指标进行测定,检测其是否满足相关质控标准。
酶类尤其是蛋白酶市场需求量极大,但目前市场酶制剂的价格通常较高。以廉价而丰富的鱼类内脏酶作为酶的来源,具有极大的市场竞争优势。多项研究表明鱼内脏酶普遍具有良好的酸碱稳定性和耐盐能力,且活性较高。因此,在提取纯化、酶活性、酶学性质等多方面继续进行深入研究,才能拓展其在食品工业中的应用。
[1] SILVA J F X, RIBEIRO K, SILVA J F, et al. Utilization of tilapia processing waste for the production of fish protein hydrolysate[J].Animal Feed Science & Technology, 2014, 196: 96-106. DOI:10.1016/j.anifeedsci.2014.06.010.
[2] HE S, FRANCO C, ZHANG W. Functions,applications and production of protein hydrolysates from fish processing co-products (FPCP)[J].Food Research International, 2013, 50(1): 289-297. DOI:10.1016/j.foodres.2012.10.031.
[3] SHERIFF S A, SUNDARAM B, RAMAMOORTHY B, et al.Synthesis and in vitro antioxidant functions of protein hydrolysate from backbones of Rastrelliger kanagurta by proteolytic enzymes[J]. Saudi Journal of Biological Sciences, 2014, 21(1): 19-26. DOI:10.1016/j.sjbs.2013.04.009.
[4] SHIRAHIGUE L D, SILVA M O, CAMARGO A C, et al. The feasibility of increasing lipid extraction in tilapia (Oreochromis niloticus) waste by proteolysis[J]. Journal of Aquatic Food Product Technology, 2016, 25(2): 265-271. DOI:10.1080/10498850.2013.845276.
[5] MARTINS G I, SECCO D, TOKURA L K, et al. Potential of tilapia oil and waste in biodiesel production[J]. Renewable & Sustainable Energy Reviews, 2015, 42(2): 234-239. DOI:10.1016/j.rser.2014.10.020.
[6] KLOMPONG V, BENJAKUL S, KANTACHOTE D, et al. Use of protein hydrolysate from yellow stripe trevally (Selaroides leptolepis)as microbial media[J]. Food & Bioprocess Technology, 2012, 5(4):1317-1327. DOI:10.1007/s11947-010-0402-9.
[7] KETNAWA S, BENJAKUL S, MARTÍNEZ-ÁLVAREZ O, et al.Three-phase partitioning and proteins hydrolysis patterns of alkaline proteases derived from fish viscera[J]. Separation &Purification Technology, 2014, 132(3): 174-181. DOI:10.1016/j.seppur.2014.05.006.
[8] DONG S Y, ZENG M Y, WANG D F, et al. Antioxidant and biochemical properties of protein hydrolysates prepared from silver carp (Hypophthalmichthys molitrix)[J]. Food Chemistry, 2008, 107(4):1485-1493. DOI:10.1016/j.foodchem.2007.10.011.
[9] 李致瑜. 大黄鱼内脏抗氧化肽的制备、分离纯化及其理化性质研究[D]. 福州: 福建农林大学, 2016: 28-30.
[10] 吴莎. 淡水鱼内脏制备复合酶的工艺研究[D]. 武汉: 湖北工业大学,2011: 38-40.
[11] 王金路, 仪淑敏, 励建荣, 等. 草鱼内脏水解蛋白对鲈鱼肉保水性的影响[J]. 食品工业科技, 2015, 36(24): 315-320; 333. DOI:10.13386/j.issn1002-0306.2015.24.060.
[12] GAO M T, HIRATA M, TOORISAKA E, et al. Acid-hydrolysis of fish wastes for lactic acid fermentation[J]. Bioresource Technology,2006, 97(18): 2414-2420. DOI:10.1016/j.biortech.2005.10.002.
[13] TAVANO O L. Protein hydrolysis using proteases: an important tool for food biotechnology[J]. Journal of Molecular Catalysis B Enzymatic, 2013, 90(3): 1-11. DOI:10.1016/j.molcatb.2013.01.011.
[14] WANG Y N, TANG C Y. Protein fouling of nanofiltration, reverse osmosis, and ultrafiltration membranes: the role of hydrodynamic conditions, solution chemistry,and membrane properties[J]. Journal of Membrane Science, 2011, 376(1): 275-282. DOI:10.1016/j.memsci.2011.04.036.
[15] HATHWAR S C, BIJINU B, RAI A K, et al. Simultaneous recovery of lipids and proteins by enzymatic hydrolysis of fish industry waste using different commercial proteases[J]. Applied Biochemistry &Biotechnology, 2011, 164(1): 115-124. DOI:10.1007/s12010-010-9119-5.
[16] GANESH R J, NAZEER R A, KUMAR N S S. Purification and identification of antioxidant peptide from black pomfret,Parastromateus niger (Bloch, 1975) viscera protein hydrolysate[J].Food Science & Biotechnology, 2011, 20(4): 1087-1094.DOI:10.1007/s10068-011-0147-x.
[17] BARKIA A, BOUGATEF A, KHALED H B, et al. Antioxidant activities of sardinelle heads andor viscera protein hydrolysates prepared by enzymatic treatment[J]. Journal of Food Biochemistry,2010, 34: 303-320. DOI:10.1111/j.1745-4514.2009.00331.x.
[18] KETNAWA S, PHONGTHAI S, BENJAKUL S, et al.Characterization of acid and alkaline proteases from viscera of farmed giant catfish[J]. Food Bioscience, 2014, 6(1): 9-16. DOI:10.1016/j.fbio.2014.01.001.
[19] 郭利平, 荣婧, 杨宁, 等. 罗非鱼酶解肽抑制冷藏鱼糜中油脂和蛋白质氧化能力[J]. 食品科学, 2016, 37(5): 89-93. DOI:10.7506/spkx1002-6630-201605017.
[20] 朱静静, 王楠, 沈佳盈, 等. 甲鱼抗氧化肽的超滤分离研究[J].食品工业科技, 2017, 38(7): 101-104; 165. DOI:10.13386/j.issn1002-0306.2017.07.011.
[21] ROSE K, STOCKLIN R, SAVOY L A, et al. Reaction mechanism of trypsin-catalysed semisynthesis of human insulin studied by fast atom bombardment mass spectrometry[J]. Protein Engineering, 2017, 4(4):409-412. DOI:10.1093/protein/4.4.409.
[22] MCMILLEN C L, WRIGHT P M, CASSADY C J. Negative ion in-source decay matrix-assisted laser desorptionionization mass spectrometry for sequencing acidic peptides[J]. Journal of the American Society for Mass Spectrometry, 2016, 27(5): 847-855.DOI:10.1007/s13361-016-1345-9.
[23] BECHARA C, BOLBACH G, BAZZACO P, et al. MALDI-TOF mass spectrometry analysis of amphipol-trapped membrane proteins[J].Analytical Chemistry, 2016, 84(14): 6128-6135. DOI:10.1021/ac301035r.
[24] MAHLING R, KILPATRICK A M, SHEA M A. Backbone resonance assignments of complexes of human voltage-dependent sodium channel NaV12 IQ motif peptide bound to apo calmodulin and to the C-domain fragment of apo calmodulin[J]. Biomolecular NMR Assignments, 2017, 11(2): 297-303. DOI:10.1007/s12104-017-9767-2.
[25] 李致瑜, 庄玮婧, 张宁宁, 等. Alcalase蛋白酶酶解大黄鱼内脏制备抗氧化肽[J]. 中国食品学报, 2016, 16(8): 109-117. DOI:10.16429/j.1009-7848.2016.08.016.
[26] 杨晓军, 陆剑锋, 林琳, 等. 酶解斑点叉尾鮰内脏制备血管紧张素转化酶抑制产物[J]. 食品科学, 2010, 31(22): 237-241. DOI:10.7666/d.y1886818.
[27] KUMAR N S S, NAZEER R A, GANESH R J. Functional properties of protein hydrolysates from different body parts of horse mackerel(Magalaspis cordyla) and croaker (Otolithes ruber)[J]. Mediterranean Journal of Nutrition & Metabolism, 2012, 5(2): 105-110. DOI:10.1007/s12349-011-0078-3.
[28] BOUGATEF A, NEDJAR-ARROUME N, RAVALLEC-PLÉ R, et al.Angiotensin I-converting enzyme (ACE) inhibitory activities of sardinelle (Sardinella aurita) by-products protein hydrolysates obtained by treatment with microbial and visceral fish serine proteases[J]. Food Chemistry, 2008, 111(2): 350-356. DOI:10.1016/j.foodchem.2008.03.074.
[29] MOTAMEDZADEGAN A, DAVARNIAM B, ASADI G, et al.Optimization of enzymatic hydrolysis of yellowfin tuna Thunnus albacares viscera using Neutrase[J]. International Aquatic Research,2010, 2(3): 173-181.
[30] 陈琳, 李秉钧, 冯俊荣. 利用大西洋鲑内源酶酶解加工废弃物制取抗氧化肽的研究[J]. 渔业现代化, 2016, 43(4): 64-69. DOI:10.3969/j.issn.1007-9580.2016.04.012.
[31] SATHIVEL S, BECHTEL P J, BABBITT J, et al. Biochemical and functional properties of herring (Clupea harengus) byproduct hydrolysates[J]. Journal of Food Science, 2003, 68(7): 2196-2200.DOI:10.1111/j.1365-2621.2003.tb05746.x.
[32] ABDELHEDI O, JRIDI M, JEMIL I, et al. Combined biocatalytic conversion of smooth hound viscera: protein hydrolysates elaboration and assessment of their antioxidant, anti-ACE and antibacterial activities[J]. Food Research International, 2016, 86(8): 9-23.DOI:10.1016/j.foodres.2016.05.013.
[33] SAYARI N, SILA A, HADDAR A, et al. Valorisation of smooth hound (Mustelus mustelus) waste biomass through recovery of functional, antioxidative and antihypertensive bioactive peptides[J].Environmental Science & Pollution Research International, 2016,23(1): 366-376. DOI:10.1007/s11356-015-5244-6.
[34] ENNAAS N, HAMMAMI R, BEAULIEU L, et al. Purification and characterization of four antibacterial peptides from protamex hydrolysate of Atlantic mackerel (Scomber scombrus) by-products[J].Biochemical & Biophysical Research Communications, 2015, 462(3):195-200. DOI:10.1016/j.bbrc.2015.04.091.
[35] WALD M, SCHWARZ K, REHBEIN H, et al. Detection of antibacterial activity of an enzymatic hydrolysate generated by processing rainbow trout by-products with trout pepsin[J]. Food Chemistry, 2016, 205(8): 221-228. DOI:10.1016/j.foodchem.2016.03.002.
[36] ROBERT M, ZATYLNY-GAUDIN C, FOURNIER V, et al.Molecular characterization of peptide fractions of a tilapia(Oreochromis niloticus) by-product hydrolysate and in vitro evaluation of antibacterial activity[J]. Process Biochemistry, 2015, 50(3): 487-492. DOI:10.1016/j.procbio.2014.12.022.
[37] HALLDORSDOTTIR S M, SVEINSDOTTIR H, FREYSDOTTIR J,et al. Oxidative processes during enzymatic hydrolysis of cod protein and their influence on antioxidant and immunomodulating ability[J]. Food Chemistry, 2014, 142(1): 201-209. DOI:10.1016/j.foodchem.2013.07.053.
[38] BALCIUNAS, MARCOS E, MARTINEZ C, et al. Novel biotechnological applications of bacteriocins: a review[J]. Food Control, 2013, 32(1): 134-142. DOI:10.1016/j.foodcont.2012.11.025.
[39] 安俊莹, 刘颖, 朱雯娟, 等. 响应面法优化Bacillus amyloliquefaciens ZJHD-06产类细菌素发酵培养基[J]. 食品工业科技, 2014, 35(1):191-195. DOI:10.13386/j.issn1002-0306.2014.01.031.
[40] 邓梅, 王俊钢, 高阳, 等. 耐低温肠球菌Enterococcus sp. MB2-1产细菌素的生物学特性[J]. 食品科学, 2013, 34(19): 170-175.DOI:10.7506/spkx1002-6630-201319036.
[41] GHOMRASSI H, BEN B O, CHOISET Y, et al. Evaluation of marine bacteriocinogenic enterococci strains with inhibitory activity against fish-pathogenic Gram-negative bacteria[J]. Diseases of Aquatic Organisms, 2016, 118(1): 31-43. DOI:10.3354/dao02953.
[42] SARRA M, TAOUFIK G, PATRICK L C, et al. Isolation and characterization of Enterococci bacteriocinic strains from Tunisian fish viscera[J]. Food and Nutrition Sciences, 2013, 4(6): 701-708.DOI:10.4236/fns.2013.46089.
[43] 俞春红, 彭宽, 史玉婷, 等. 草鱼肠道细菌素的分离纯化及活性研究[J]. 动物医学进展, 2012, 33(10): 20-24. DOI:10.3969/j.issn.1007-5038.2012.10.006.
[44] 任士菊, 王俊钢, 周红, 等. 冷水鱼肠道抑菌活性乳酸菌的筛选及其生理特性分析[J]. 食品工业科技, 2014, 35(14): 178-181; 185.DOI:10.13386/j.issn1002-0306.2014.14.031.
[45] 马欢欢, 吕欣然, 林洋, 等. 鲈鱼肠道Lactobacillus sakei LY1-6对荧光假单胞菌抑制作用研究[J]. 食品工业科技, 2016, 37(23): 150-155.DOI:10.13386/j.issn1002-0306.2016.23.020.
[46] 缪璐欢, 杜静芳, 马欢欢, 等. 淡水鱼肠道中抗芽孢杆菌性乳酸菌的筛选与鉴定[J]. 食品工业科技, 2015, 36(16): 188-192.DOI:10.13386/j.issn1002-0306.2015.16.030.
[47] 马欢欢, 吕欣然, 林洋, 等. 海水鱼肠道源性抗哈维氏弧菌乳酸菌的筛选与鉴定[J]. 食品科学, 2017, 38(8): 96-101. DOI:10.7506/spkx1002-6630-201708016.
[48] 杜静芳, 缪璐欢, 马欢欢, 等. 淡水鱼肠道中拮抗副溶血弧菌乳酸菌的筛选及鉴定[J]. 中国食品学报, 2017, 17(5): 168-175.DOI:10.16429/j.1009-7848.2017.05.022.
[49] LIN Y H, CHEN Y S, WU H C, et al. Screening and characterization of LAB-produced bacteriocin-like substances from the intestine of grey mullet (Mugil cephalus L) as potential biocontrol agents in aquaculture[J]. Journa of Applied Microbiology, 2013, 114(2): 299-307. DOI:10.1111/jam.12041.
[50] LOH J Y, LIM Y Y, TING A S Y. Bacteriocin-like substances produced by Lactococcus lactis subsplactis CF4MRS isolated from fish intestine: antimicrobial activities and inhibitory properties[J].International Food Research Journal, 2017, 24(1): 394-400.
[51] LÜ Xiaoran, MIAO Luhuan, MA Huanhuan, et al.Purification,characterization and action mechanism of plantaricin JY22, a novel bacteriocin against Bacillus cereus produced by Lactobacillus plantarum JY22 from golden carp intestine[J]. Food Science and Biotechnology, 2018, 27(3): 695-703. DOI:10.1007/s10068-017-0280-2.
[52] CHAUHAN S. Screening of potential probiotic lactic acid bacteria from fresh water fish intestine[D]. Rourkela: National Institute of Technology, 2012: 21-42.
[53] LÜ Xiaoran, DU Jingfang, JIE Yu, et al. Purification and antibacterial mechanism of fish-borne bacteriocin and its application in shrimp(Penaeus vannamei) for inhibiting Vibrio parahaemolyticus[J]. World Journal of Microbiology and Biotechnology, 2017, 33(8): 156-160.DOI:10.1007/s11274-017-2320-8.
[54] VENKATASAMY D V, SATHIYANARAYANAN G, PARTHIBAN K, et al. Functional assessment of bacteriocin-subtilosin A against Aeromonas spp causing gastroenteritis and hemorrhagic septicaemia[J].Indian Journal of Biotechnology, 2015, 14(3): 442-448.
[55] HEO W S, KIM E Y, KIM Y R, et al. Salt effect of nisin Z isolated from a marine fish on the growth inhibition of Streptococcus iniae, a pathogen of streptococcosis[J]. Biotechnology Letters, 2012, 34(2):315-320.
[56] M E I D O N G R, K H O T C H A N A L E K H A K,DOOLGINDACHBAPORN S, et al. Evaluation of probiotic Bacillus aerius B81e isolated from healthy hybrid catfish on growth, disease resistance and innate immunity of Pla-mong Pangasius bocourti[J].Fish Shellfish Immunology, 2017, 34(2): 315-320. DOI:10.1007/s10529-011-0766-6.
[57] GHOSH A S, SELVAM D G, NEETHU C S, et al. Diversity and antimicrobial activity of lactic acid bacteria from the gut of marine fish Rastrelliger kanagurta against fish, shrimp and human pathogens[J].Journal of the Marine Biological Association of India, 2013, 55(2): 22-27. DOI:10.6024/jmbai.2013.55.2.01778-04.
[58] BINDIYA E S, TINA K J, RAGHUL S S, et al. Characterization of deep sea fish gut bacteria with antagonistic potential, from Centroscyllium fabricii (deep sea shark)[J]. Probiotics Antimicrob Proteins, 2015, 7(2): 157-163. DOI:10.1007/s12602-015-9190-x.
[59] ATHAILLAH Z A, PARK J W. Characterization of surimi slurries and their films derived from myofibrillar proteins with different extraction methods[J]. Food Bioscience, 2016, 15(1): 118-125. DOI:10.1016/j.fbio.2016.07.002.
[60] BLANCO-PASCUAL N, FERN NDEZ-MART N F, MONTERO P.Jumbo squid (Dosidicus gigas) myofibrillar protein concentrate for edible packaging films and storage stability[J]. LWT-Food Science and Technology, 2014, 55(2): 543-550. DOI:10.1016/j.lwt.2013.10.025.
[61] JRIDI M, SOUISSI N, MBAREK A, et al. Comparative study of physico-mechanical and antioxidant properties of edible gelatin films from the skin of cuttlefish[J]. International Journal of Biological Macromolecules, 2013, 61(10): 17-25. DOI:10.1016/j.ijbiomac.2013.06.040.
[62] ABDELHEDI O, NASRI R, JRIDI M, et al. Composite bioactive films based on smooth-hound viscera proteins and gelatin: physicochemical characterization and antioxidant properties[J]. Food Hydrocolloids,2018, 74(2): 176-186. DOI:10.1016/j.foodhyd.2017.08.006.
[63] VÁZQUEZ J A, GONZÁLEZ M P, MURADO M A. A new marine medium: use of different fish peptones and comparative study of the growth of selected species of marine bacteria[J]. Enzyme &Microbial Technology, 2004, 35(5): 385-392. DOI:10.1016/S0141-0229(04)00180-2.
[64] GILDBERG A, DAHL R, MIKKELSEN H, et al. Peptones from Atlantic cod stomach as nitrogen sources in growth media to marine bacteria[J]. Journal of Aquatic Food Product Technology, 2010, 19(2):75-83. DOI:10.1080/10498850.2010.486523.
[65] 张培, 申铉日, 李川, 等. 金鲳鱼内脏酸性蛋白酶的分离纯化及酶学性质研究[J]. 食品工业科技, 2017, 38(2): 210-214. DOI:10.13386/j.issn1002-0306.2017.02.032.
[66] KETNAWA S, MARTÍNEZ-ALVAREZ O, BENJAKUL S, et al.Extraction and biochemical characterization of peptidases from giant catfish viscera by aqueous two-phase system[J]. Journal of Food Biochemistry, 2015, 39(4): 429-438. DOI:10.1111/jfbc.12145.
[67] KETNAWA S, BENJAKUL S, MARTÍNEZ-ALVAREZ O, et al. Fish skin gelatin hydrolysates produced by visceral peptidase and bovine trypsin: bioactivity and stability[J]. Food Chemistry, 2017, 215(15):383-390. DOI:10.1016/j.foodchem.2016.07.145.
[68] SARANYA R, PRASANNA R, JAYAPRIYA J, et al. Value addition of fish waste in the leather industry for dehairing[J]. Journal of Cleaner Production, 2016, 118(1): 179-186. DOI:10.1016/j.jclepro.2015.12.103.
[69] YOUNES I, NASRI R, BKHAIRIA I, et al. New proteases extracted from red scorpionfish (Scorpaena scrofa) viscera: characterization and application as a detergent additive and for shrimp waste deproteinization[J]. Food & Bioproducts Processing, 2015, 94(1): 453-462. DOI:10.1016/j.fbp.2014.06.003.
[70] KWOK C K, LIANG Y, WANG H, et al. Bioaccumulation of heavy metals in fish and Ardeid at Pearl River Estuary, China[J].Ecotoxicology & Environmental Safety, 2014, 106: 62-67.DOI:10.1016/j.ecoenv.2014.04.016.
Recent Progress in Development and Application of Proteins from Fish Viscera
ZHENG Ziyi, LI Lin, SU Dan, et al. Recent progress in development and application of proteins from fish viscera[J]. Food Science,2019, 40(17): 295-301. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180923-248. http://www.spkx.net.cn