
图1 运动性疲劳相关信号通路
Fig. 1 Exercise fatigue-related signaling pathways
机体在进行长时间高强度的运动过程中,糖原被大量消耗,血糖浓度降低,引起蛋白质的利用增加,骨骼肌蛋白分解供能,能量代谢产物堆积,致使内环境稳态被破坏,可能导致骨骼肌损伤,从而影响机体的运动能力,导致机体疲劳的发生。这种由于运动引起的运动能力以及身体功能暂时性下降,称之为运动性疲劳。适度的运动性疲劳可通过一定手段恢复,但是过度的运动性疲劳会引起机体的骨骼肌损伤,损害身体健康[1];因此,研究缓解运动性疲劳的方式具有重大的实际意义。目前,许多食品机构或企业利用大豆多肽的生物学特性研制出的运动饮料能起到很好的抗疲劳作用,并证实大豆多肽在抗疲劳或者缓解运动性疲劳等方面有比较积极的效果[2-3]。
自19世纪以来,为了研究清楚运动性疲劳产生的机制与机理,研究人员对运动性疲劳进行了大量研究,同时尝试从不同角度解释运动性疲劳的产生原因,并提出了“耗竭学说”、“阻塞学说”、“内环境稳态失调学说”等一系列的假说[4-5]。目前,关于对运动性疲劳普遍认可的定义为:在运动过程当中,当机体生理过程不能继续保持它在特定水平上进行或者不能维持某一预定的运动强度,即称之为运动性疲劳。
运动性疲劳是人体运动过程中正常且比较复杂的生理现象,是身体为保持健康的一种自我警报信号,它迫使机体降低运动负荷,防止机体发生过度的机能衰竭。适度的运动性疲劳对于增强体质、获得训练效果以及提高运动成绩具有促进作用。运动性疲劳根据疲劳产生部位的不同,一般可以分为中枢性疲劳和外周性疲劳两部分[6]。
在运动性疲劳的发展过程当中,中枢神经系统絮乱与运动性疲劳的产生有着密不可分关系[7]。中枢性疲劳的产生实质是中枢神经系统的一种自我保护性抑制作用,以防止身体机能过度消耗。当机体发生运动性中枢疲劳时,神经中枢系统的兴奋-抑制过程平衡将会被破坏,基底神经节功能调控不足,导致机体运动能力、学习能力下降以及情绪激动等[8]。
中枢性疲劳主要是中枢性神经系统应对激烈的、高负荷的活动从而出现的保护性抑制措施。这种抑制是运动员出现整体机能以及运动能力下降外在表现的前提,有研究表明中枢神经系统是机体产生兴奋、发出冲动以及调节肌肉收缩舒张的机能系统,中枢神经系统的机能障碍会使人体运动能力以及工作能力水平下降。由于中枢神经系统非常复杂,因此,研究者在对中枢性疲劳进行探索研究的过程当中,还有很多问题没有得到解决。目前,中枢性疲劳的研究主要集中在与中枢性神经活动有关的氨基酸代谢、脑神经递质(如5-羟色胺、γ-氨基丁酸、多巴胺、乙酰胆碱)以及血氨的代谢与转运等[8-9]。
一般说来,外周性疲劳主要发生在神经肌肉节点、突出传递点以及骨骼肌收缩舒张位置,从而引起肌肉最大收缩力以及收缩速度下降,导致运动员运动能力的降低。外周性疲劳可以分为神经肌肉接头疲劳、能源物质耗竭引起的疲劳以及代谢产物堆积引起的疲劳[10]。
肌肉是机体运动的主要功能单位。外周疲劳的研究重点主要集中在肌肉内部能源物质代谢与调节、肌肉细胞以及局部肌肉的血液内环境变化等方面。当肌肉剧烈运动时,生物体内糖类、脂类等能源物质被大量消耗用于供能,而乳酸、氨等代谢产物开始在体内大量堆积,导致骨骼肌内pH值逐渐降低,肌肉细胞中Ca2+转移受到抑制,肌肉收缩能力显著下降,导致运动性疲劳的发生[11]。另外,氧自由基及其引起的脂质过氧化反应增强,破坏了生物体内环境的平衡[12],引起机体生化指标变化以及运动能力下降[13],也会导致运动性疲劳的发生。
磷脂酰肌醇3激酶(phosphatidynositol 3 kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路是促进骨骼肌蛋白质合成、修复肌肉损伤的主要途径之一[14](图1)。PI3K是细胞内重要的信号因子,机体在长时间大量运动过程中,细胞受到内环境因素变化引起的刺激如缺氧、pH值降低等,从而激活PI3K[15]。Akt可以通过磷酸化多种酶、激酶或转录因子等下游因子的方式,介导多种生物学效应。Akt是重要的抗凋亡调节因子,被认为是PI3K下游的作用靶物[16]。当细胞在受到过量运动引起的内环境变化刺激后,PI3K被激活,促使质膜磷酸肌醇磷酸化,催化生成磷脂酰肌醇三磷酸(phosphatidylinositol(3,4,5)bisphosphate,PIP3),PIP3可以作为细胞信号传递的信使介导PI3K多种功能[17]。PIP3同时招募拥有pH结构域特征的3-磷酸肌醇依赖性激酶-1(3-phosphoinsitide-dependentprotein kinase-1,PDK1)和Akt至细胞质膜上,促使PDK1通过将Akt激酶区的Thr308位点磷酸化从而实现Akt的激活[18]。激活的Akt主要是通过介导下游底物mTOR磷酸化的方式,发挥促进蛋白质合成、修复骨骼肌蛋白质损伤的作用[19]。mTOR是PI3K/Akt信号通路下游的一个靶蛋白,mTOR主要是通过激活核糖体蛋白S6激酶1(ribosomal protein S6 kinase β1,RPS6KB1或S6K1)的方式磷酸化核糖体蛋白6(ribosomal protein S6,RPS6)或者磷酸化真核翻译起始因子4E(eukaryotic initiation factor 4E,eIF4E)的抑制因子——4E结合蛋白(4E-binding protein 1,4E-BP1),达到调控蛋白质合成过程的作用[20]。

图1 运动性疲劳相关信号通路
Fig. 1 Exercise fatigue-related signaling pathways
S6K1可以通过磷酸化的方式调节mRNA翻译过程的蛋白质,例如eIF4B、核糖体蛋白S6(ribosomal protein S6,rpS6)和真核翻译延伸因子2(eukaryotic elongation factor-2,eEF2)。因此,mTOR介导S6K1磷酸化可以间接调节mRNA翻译的起始和延伸阶段[21]。而mTOR磷酸化4E-BP1,可以促使4E-BP1与eIF4E分离,使得游离的eIF4E能够与eIF4G结合,促进翻译起始[22]。有研究者证实,通过调控Akt/mTOR信号通路,可以促进翻译的起始和延伸,增加蛋白质的合成,最终导致骨骼肌肥大,强化骨骼肌功能[23]。
机体内大部分蛋白质的周转活动都是由泛素-蛋白酶体系统完成的[24]。泛素蛋白酶体系统工作途径为:蛋白质被泛素标记之后,依次通过泛素活化酶(ubiquitin-activating enzyme,E1)、泛素结合酶(ubiquitin-conjugating enzyme,E2)、泛素连接酶(ubiquitin-ligase enzyme,E3)的作用,完成底物蛋白质的泛素化,最终在26S蛋白酶体内完成蛋白质的降解。其中泛素连接酶E3是泛素-蛋白酶体系中的限速酶,它的主要功能是负责底物蛋白特异性识别以及促进泛素转移到相关底物蛋白上,其活动受到严格的调节,在骨骼肌蛋白质分解过程中起到了至关重要的作用[25]。骨骼肌蛋白质的泛素化降解主要是依赖于特殊的E3、肌肉特异性环指蛋白1(muscle RING finger-1,MuRF1)和肌肉萎缩盒F蛋白(muscle atrophy F-box protein,MAFbx)[26]。骨骼肌蛋白质主要是通过介导叉头状转录因子O家族蛋白(forkhead box O,FOXO)和转录因子NF-κB的表达,进行实现对泛素-蛋白酶体途径的活性调节。FOXO3a是MuRF1和MAFbx的转录因子,激活FOXO3a的转录活性可以上调MuRF1和MAFbx的基因表达,促进泛素-蛋白酶体的作用[27]。AMP激活的蛋白激酶(AMP-activated protein kinase,AMPK)/Sirt1信号通路可以激活FOXO3a的转录活性,促进MuRF1和MAFbx的表达和泛素蛋白酶体途径的蛋白质降解,而胰岛素样生长因子1(insulin-like growth factor 1,IGF-1)/PI3K/AKT信号通路则是通过抑制FOXO3a的转录活性,下调MuRF1和MAFbx的基因表达,抑制肌肉蛋白质降解[28]。当细胞受到损伤等刺激的时候,NF-κB的抑制蛋白激酶(IκB kinase,IKK)被激活,引起抑制蛋白kappa Bα(inhibitor of kappa Bα,I-κBα)上多个位点被磷酸化,进而被蛋白酶降解,促使NF-κB与其抑制物I-κB蛋白分离,被释放转移进入细胞核,通过调节MuRF-1、MAFbx、FOXO3a的转录等方式实现调控蛋白质降解的功能[29-30]。在生物分子实验中发现,在肌细胞培养中加入肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),可激活NF-κB和增加泛素载体蛋白(ubiquitin carrier protein H2,UbcH2)表达量,增加NF-κB与UbcH2的结合能力;相反的,可通过抑制NF-κB的活性,从而抑制C2、C12肌管蛋白分解[31-32]。在大鼠进行力竭跑台运动后,研究者发现其腓肠肌NF-κB活性增加[33],提示运动性疲劳会造成骨骼肌细胞的降解。
一般说来,骨骼肌的供能主要是依赖葡萄糖代谢,人体内大部分葡萄糖被骨骼肌所利用,因此骨骼肌内糖类的储备以及摄取能力在维持人体血糖浓度稳态和调控能量代谢平衡等方面发挥着重要的作用[34]。葡萄糖转运体4(glucose transporter 4,GLUT4)是骨骼肌细胞内非常重要的葡萄糖运载体,它的主要作用是通过易化扩散、浓度差等作用方式将细胞外的葡萄糖跨膜转运进入细胞内[35]。对敲除骨骼肌中GLUT4基因的小鼠进行研究发现,GLUT4基因的敲除将会引起严重的胰岛素抵抗和葡萄糖耐受等不良症状,说明GLUT4的表达或活性下降致使骨骼肌对葡萄糖摄取能力降低,以及GLUT4在骨骼肌细胞糖代谢系统当中的重要性[36]。GLUT4的活性主要是由PI3K/Akt信号通路调控。当骨骼肌细胞受到胰岛素刺激之后,细胞膜上的胰岛素受体迅速与胰岛素结合,并且募集和磷酸化胰岛素受体底物(insulin receptor substrate,IRS)。随后,IRS蛋白与PI3K相互作用,激活PI3K促使质膜磷酸肌醇磷酸化,促进PIP3的生成。PIP3在细胞膜上招募并激活一些参与葡萄糖摄取、包含PH结构域的色氨酸/苏氨酸激酶,例如PDK1和mTORC2,从而激活Akt。Akt作为一个关键中心分子,可以通过调控含有GLUT4的囊泡转位、靶向运转和融合等过程,从而影响GLUT4运转的整个过程[37-38]。
近年来,功能活性多肽营养保健品已经逐渐成为社会生活讨论的热点。自20世纪90年代开始,活性多肽及其相关营养产品的开发研究备受关注。为了促进运动性疲劳和身体机能的快速恢复、提高运动健身爱好者的运动能力,活性肽营养品的补充是非常有意义的尝试。
大豆营养丰富,其蛋白质含量高、氨基酸组成均衡,是对人体非常重要的食品。在大豆蛋白酶解工艺中,酶的选择非常重要。由于蛋白酶具有特异性,会导致大豆蛋白水解工艺条件和最终多肽产品特性的差异性。大豆多肽的制备方法比较多,包括蛋白水解、生物发酵、食品加工等。目前大豆多肽工业化常规的生产方法是在确定的温度、pH值、底物浓度、酶浓度等条件下,通过木瓜醇蛋白酶等酶催化作用将大豆水解为多肽混合物。
有研究者对大豆多肽产品进行分析,发现大豆多肽具有与大豆蛋白相同的氨基酸组成,其水分、含氮化合物和多肽的质量分数分别为6.84%、74.32%和50.0%。并且,该产品当中多肽和游离氨基酸的质量分数总和为76.33%,其中人体的必需氨基酸(He、Leu、Met、Phe、Thr、Lys、Trp、Val)和两种半必需氨基酸(Arg和His)质量分别占氨基酸总质量的24.94%和6.77%[39]。
巯基是非常重要的自由基清除剂,大豆植物蛋白中巯基基团含量高,大豆蛋白水解产物中巯基的含量明显高于大豆蛋白,因此大豆多肽具有较强的抗氧化性[40]。实验研究已经证实,大豆多肽抗氧化能力与蛋白水解酶种类以及水解度有关,蛋白酶浓度、水解产物多肽长度和多肽链N末端、C末端的氨基酸组成以及氨基酸顺序不同,均会影响抗氧化性基团的表达,导致大豆多肽的抗氧化性功能不同[40-41]。
大豆多肽基本是由小分子质量的寡肽混合物组成,所以与分子质量比较大的大豆分离蛋白相比,大豆多肽具有两个优点:溶解性在较宽的pH值范围内均较好,且受温度影响比较小;黏度随浓度变化不明显,即使在高浓度的条件下依然呈现溶解状态。因此,大豆多肽更容易被机体所吸收,营养物质吸收更充分[42]。
在进行长时间高强度训练的过程中,机体内部的氧气被大量消耗,造成内环境缺氧,使得葡萄糖分解供能之后转化为乳酸,最终导致血液当中乳酸堆积、身体内部pH值降低,进而引起酸中毒。这种酸中毒可能会刺激神经末梢,引起肌肉痉挛、疼痛,与此同时,它还能一定程度上增加某些细胞膜的通透性[43],引起肌肉收缩强度下降,最终导致疲劳[44]。一般说来,机体进行高强度运动训练的时候,主要是依赖于糖类供能,激烈运动之后,体内的肝糖原以及肌糖原大量被消耗,身体内糖原储备的多少在一定程度上可以决定机体的运动能力,因此糖原合成、储备是运动性疲劳恢复的一个重要环节[34]。
过度的运动将会引起人体内部自由基生成量增加,破坏与人体自由基清除能力之间的平衡,内源性自由基的堆积将会引起脂质过氧化反应增强,破坏生物膜,影响内环境的稳定性。当细胞中活性氧(reactive oxygen species,ROS)过量时,可以抑制PI3K/Akt信号通路,进而下调GULT4的表达与活性,导致细胞对葡萄糖的摄取能力受到限制,引起血糖供应异常。关于运动是否可以促进骨骼肌GULT4蛋白以及GULT4 mRNA表达量增加,目前还没有一个一致的结论。但是目前已经有研究证实,经过6 周过度训练后,小鼠腓肠肌的GULT4蛋白表达量没有明显增加,反而出现了下降的趋势[45]。已经研究证实,枯草芽孢杆菌发酵生产的大豆多肽能够促进GLUT4的表达,进而可以增强细胞对葡萄糖的摄取能力[46]。此外,另有动物实验利用大豆多肽喂养小鼠30 d之后,随剂量(200、400、800 mg/(kg·d))增加,小鼠体内的肌糖原以及肝糖原的储备量呈现梯度性增加,维持机体运动时血糖浓度的能力增加,可为机体提供更多的能量,从而达到抗疲劳的作用(图2)[41]。
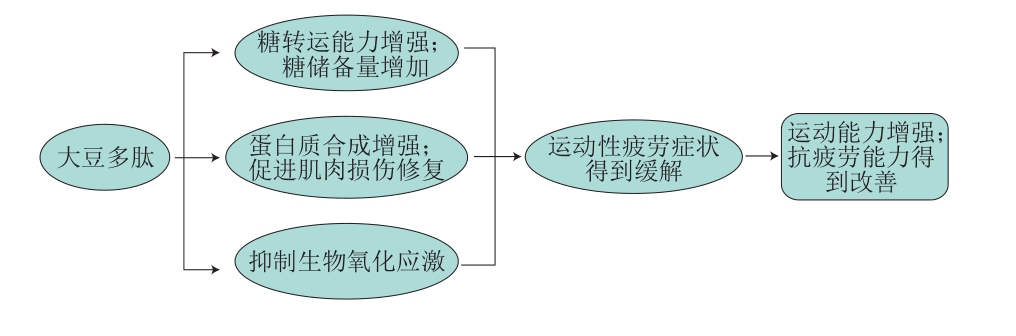
图2 大豆多肽缓解运动性疲劳机制
Fig. 2 Mechanisms by which soybean polypeptide alleviates exercise-induced fatigue
美国营养协会、加拿大营养师协会以及美国运动医学学会专家们进行的一项联合研究探讨了运动后恢复期饮食与肌糖原合成的关系,指出在运动后恢复期可以通过健康饮食手段提高血糖浓度,从而促进肌糖原恢复,保持血糖浓度维持在正常范围当中[47]。以上的研究结果提示,恢复期摄入一定量的大豆多肽可以增加肌糖原的储备,缓解机体疲劳症状。
在进行高强度运动的过程当中,肌肉持续性收缩舒张活动将会导致骨骼肌发生可逆性的微损伤,常表现为延迟性肌肉酸痛(delayed onset muscle soreness,DOMS),主要出现在运动后数小时至48 h内。一般说来,人在进行高强度运动训练或者运动训练方式不合理的时候,极易诱发DOMS,DOMS常伴有肌肉酸痛、肌肉抽筋等症状,影响运动员主观疲劳感觉以及下一次比赛的表现。但这种症状只是暂时的,运动后及时采取有效措施进行干预,有助于修复肌肉微损伤,缓解运动性疲劳。
有研究表明,在运动后2 h内,补充蛋白质和氨基酸能够促进胰岛素的分泌,促使骨骼肌蛋白质合成代谢加强,减少蛋白质的分解代谢,促进糖原的恢复,使骨骼肌快速恢复和修复[48-49]。人体体外实验已经证实,运动后补充支链氨基酸(包括亮氨酸、异亮氨酸和缬氨酸)、苯丙氨酸等必需氨基酸可以缓解运动导致的骨骼肌蛋白质水解,促进人体肌肉蛋白质的合成代谢,降低组织损伤,有助于积极有效地修复骨骼肌损伤[50-51]。这些骨骼肌损伤的恢复可以通过控制蛋白质合成的信号通路来调节,包括哺乳动物mTOR的磷酸化、S6K1蛋白激酶和eIF4e结合蛋白1的序列激活[52]。
已有研究表明,无训练的大鼠进行一次间歇性下坡跑运动,分别于运动结束后即刻和24、48、72 h补充大豆多肽、大豆蛋白,相比于补水,均能对运动引起的血清肌酸激酶(creatine kinase,CK)、血清丙二醛、β-葡萄糖苷酸酶(beta-glucuronidase,GUS)以及葡萄糖-6-磷酸脱氢酶(glucose 6-phosphatedehydrogenase,G6PDH)含量升高起到一定抑制作用,而且大豆多肽抑制效果更明显。GUS和G6PDH水平可以反映骨骼肌炎症反应的程度[53]。大豆多肽和大豆分离蛋白都可以预防运动性骨骼肌微损伤的发生,但是大豆活性多肽的作用要明显强于大豆分离蛋白,而且在促进运动后微损伤修复方面的效果也更为明显[54]。在大鼠耐力性实验过程当中,血浆氨基酸特别是Ala、Gly、Val、lle、Thr、Ser、Tyr等氨基酸含量会迅速下降。在上述氨基酸当中,大豆多肽中Val、lle、Tyr含量比较高,说明大豆多肽可以补充运动过程当中缺乏的某些氨基酸,促进骨骼肌蛋白质的合成,从而最终强化导致骨骼肌肌力以及功能。此外,大豆多肽含有Asp和Glu,这也有助于延缓训练疲劳的发生[55-56]。
在运动的过程中,骨骼肌在强烈收缩过程当中不断生成ROS。随着机体运动量的不断增加,ROS的生成量也不断增多,过量的ROS作用于骨骼肌纤维蛋白,可降低肌纤维功能、减少Ca2+的释放量,抑制Ca2+-ATP酶活性;还可使生物体发生氧化应激,导致氧化损伤,例如DNA羟基化、组织损伤以及蛋白质变性等[57-58]。
补充抗氧化剂或者生物活性肽有助于人体减少氧化损伤、促进运动性疲劳恢复[59]。补充高剂量的辅酶Q10(300 mg/d)[60]、甲基磺胺甲烷(3 g/d)[61]和N-乙酰半胱氨酸(N-acetylcysteine,NAC)[62]等抗氧化剂已被证实可缓解运动性疲劳所引起的氧化应激损伤,促进运动性疲劳恢复。在进行NAC缓解运动性疲劳的研究时,观察到高剂量的NAC给受试者带来了轻微的胃肠道副反应,因此,需要进一步研究既能促进治疗功效且无副反应的抗氧化剂[59]。
大豆的抗氧化性能已被大量研究证实[63]。在大豆蛋白水解过程中,大豆蛋白暴露出更多的活性氨基酸R基团。因此,大豆多肽具有比完整蛋白更高的抗氧化活性[64]。同时大豆多肽还具有溶解性好、黏度低、抗凝胶形成、蛋白质利用率高、抗原性低和不致敏等优点,因此是非常优良的活性多肽补充剂。同时,已经有小鼠实验证明,从大豆蛋白水解液中纯化出的黑大豆肽具有非常高的1,1-二苯基-2-三硝基苯肼自由基清除活性,能够显著减轻小鼠的身体疲劳[65]。
随着全民健身热潮的来袭,运动性疲劳的缓解机理研究也越来越具有一定的社会现实意义。补充水分和食物是当前比较便捷的运动疲劳恢复手段。已有人体实验证实,可以通过补充大豆多肽固体饮料缓解运动性疲劳、促进运动性损伤的恢复,并且其效果比传统方法更为显著[66]。目前,关于大豆多肽缓解运动性疲劳、提升机体运动能力的研究非常多,但是目前大豆多肽的抗疲劳研究还停留在宏观的表象阶段,并没有深入到分子信号通路的研究中去,这也给后续功能活性肽的研究提出了新的要求。
大豆多肽可以通过促进骨骼肌蛋白质合成恢复肌肉运动性损伤、抑制机体自由基的氧化应激作用以及提升糖原转运能力、增加糖原的储备等方式缓解机体运动性疲劳的症状,进而达到提高机体运动能力的目的。现如今生活节奏越来越快,不管是脑力劳动者和体力劳动者在身体上和精神上或多或少会出现疲劳。因此,可以针对不同人群的需求,联合大豆多肽的抗疲劳作用以及其他天然中药作物的恢复作用,结合现代运动科学理论知识,研制出适用于不同人群加速恢复疲劳的营养保健产品,例如(颗粒冲剂型或胶囊型)营养补充剂、运动饮料等。
大量研究证实活性功能肽以及天然营养物质在缓解运动性疲劳、增强机体运动能力等方面发挥着显著的功效。本文结合大豆多肽的蛋白质资源丰富、营养价值高、易于吸收等特点,针对运动性疲劳所引起的氧化应激、血糖浓度降低,以及骨骼肌氧化应激等症状,从理论和已有的实验结果出发,探讨了大豆多肽在缓解运动性疲劳方面的可行性,为抗疲劳营养补足品的研究提供理论依据。
[1] 甘桂芳, 邵春海, 刘景芳. 运动性疲劳及促进其恢复的营养手段[J]. 体育科研, 2013, 34(3): 61-66. DOI:10.3969/j.issn.1006-1207.2013.03.012.
[2] 任海伟, 马文鹏, 王常青. 大豆多肽的性质及其在运动饮料中的应用[J]. 饮料工业, 2007, 10(8): 8-11. DOI:10.3969/j.issn.1007-7871.2007.08.003.
[3] 陈菽, 乐超银, 刘海军, 等. 大豆多肽运动饮料的研制[J]. 现代食品科技, 2010, 26(1): 100-101. DOI:10.3321/j.issn:0253-990X.2003.04.020.
[4] DAVIS J M, BAILEY S P. Possible mechanisms of central nervous system fatigue during exercise[J]. Medicine and Science in Sports and Exercise, 1997, 29(1): 45-57. DOI:10.1097/00005768-199701000-00008.
[5] 钟大鹏, 张新运. 运动性疲劳的产生与消除[J]. 武汉体育学院学报,2002, 36(5): 50-51.
[6] PAUL L, WOOD L. Skeletal muscle fatigue[J]. Physical Therapy Reviews, 2013, 7(2): 123-132. DOI:10.1179/108331902125001815.
[7] 乔德才, 刘军, 刘晓莉. 运动疲劳的中枢机制研究进展: 基于基底神经节-皮层环路紊乱的视角[J]. 北京体育大学学报, 2014, 37(2): 51-58; 65.
[8] 张蕴琨. 运动性中枢疲劳的影响因素及其机制研究进展[J]. 体育科研, 2013, 34(3): 33-40. DOI:10.3969/j.issn.1006-1207.2013.03.007.
[9] 吴宏江, 张冬梅. 氨基酸复合制剂对高强度间歇运动后中枢疲劳的影响[J]. 中国临床康复, 2018, 22(20): 3150-3154. DOI:10.3969/j.issn.2095-4344.0858.
[10] 张燕, 丁建国, 赵光. 运动性疲劳的机制研究与进展[J].中国临床康复, 2006, 10(44): 133-136. DOI:10.3321/j.issn:1673-8225.2006.44.057.
[11] 侯春丽, 闫守扶, 孙红梅. 运动性疲劳的细胞机制及研究进展[J].首都体育学院学报, 2003, 15(1): 89-92. DOI:10.3969/j.issn.1009-783X.2003.01.027.
[12] 杨波, 张钧. 氧自由基脂质过氧化反应致运动性疲劳产生的机制研究[J]. 中国临床康复, 2005, 9(4): 188-190. DOI:10.3321/j.issn:1673-8225.2005.04.090.
[13] 田峰. 对中枢与外周运动性疲劳的再认识[J]. 中国组织工程研究,2015, 19(42): 6849-6854. DOI:10.3969/j.issn.2095-4344.2015.42.023.
[14] 王丽, 丁树哲. 细胞生长中的PI3K/Akt/mTOR信号通路及其与运动的关系[J]. 体育科学, 2007, 27(5): 77-82. DOI:10.3969/j.issn.1000-677X.2007.05.013.
[15] STEELMAN L S, CHAPPELL W H, ABRAMS S L, et al. Roles of the Raf/MEK/ERK and PI3K/PTEN/Akt/mTOR pathways in controlling growth and sensitivity to therapy-implications for cancer and aging[J].Aging, 2011, 3(3): 192-222. DOI:10.18632/aging.100296.
[16] RISSO G, BLAUSTEIN M, POZZI B, et al. Akt/PKB: one kinase,many modifications[J]. Biochemical Journal, 2015, 468(2): 203-214.DOI:10.1042/bj20150041.
[17] WITKOWSKI S, LOVERING R M, SPANGENBURG E E.High-frequency electrically stimulated skeletal muscle contractions increase p70s6k phosphorylation independent of known IGF-I sensitive signaling pathways[J]. FEBS Letters, 2010, 584(13): 2891-2895. DOI:10.1016/j.febslet.2010.05.003.
[18] 袁向飞, 陆敏. Ras/MAPK与PI3K/Akt信号转导通路及其相互作用[J]. 国际检验医学杂志, 2006, 27(3): 261-263. DOI:10.3969/j.issn.1673-4130.2006.03.025.
[19] HANADA M, FENG J H, HEMMINGS B A. Structure, regulation and function of PKB/AKT: a major therapeutic target[J].Biochimica et Biophysica Acta, 2004, 1697(1): 3-16. DOI:10.1016/j.bbapap.2003.11.009.
[20] WULLSCHLEGER S, LOEWITH R, HALL M N. TOR signaling in growth and metabolism[J]. Cell, 2006, 124(3): 471-484. DOI:10.1016/j.cell.2006.01.016.
[21] MARABITA M, BARALDO M, SOLAGNA F, et al. S6K1 is required for increasing skeletal muscle force during hypertrophy[J]. Cell Reports, 2016, 17(2): 501-513. DOI:10.1016/j.celrep.2016.09.020.
[22] TSAI S, SITZMANN J M, DASTIDAR S G, et al. Muscle-specific 4E-BP1 signaling activation improves metabolic parameters during aging and obesity[J]. Journal of Clinical Investigation, 2015, 125(8):2952-2964. DOI:10.1172/JCI77361.
[23] CAI X, ZHU C, XU Y, et al. Alpha-ketoglutarate promotes skeletal muscle hypertrophy and protein synthesis through Akt/mTOR signaling pathways[J]. Scientific Reports, 2016, 6: 26802.DOI:10.1038/srep26802.
[24] FUKASAWA H, FUJIGAKI Y, YAMAMOTO T, et al. Protein degradation by the ubiquitin-proteasome pathway and organ fibrosis[J]. Current Medicinal Chemistry, 2012, 19(6): 893-900.DOI:10.2174/092986712799034941.
[25] 朱荣. 泛素蛋白酶体途径在运动骨骼肌领域的研究进展[J]. 北京体育大学学报, 2012, 35(9): 85-91.
[26] BODINE S C, BAEHR L M. Skeletal muscle atrophy and the E3 ubiquitin ligases MuRF1 and MAFbx/atrogin-1[J]. American Journal of Physiology-Endocrinology and Metabolism, 2015, 307(6):E469-E484. DOI:10.1152/ajpendo.00204.2014.
[27] BAPTISTA I L, SILVESTRE J G, SILVA W J, et al. FoxO3a suppression and VPS34 activity are essential to anti-atrophic effects of leucine in skeletal muscle[J]. Cell & Tissue Research, 2017, 369(2):381-394. DOI:10.1007/s00441-017-2614-z.
[28] SANDRI M, SANDRI C, GILBERT A, et al. Foxo transcription factors induce the atrophy-related ubiquitin ligase atrogin-1 and cause skeletal muscle atrophy[J]. Cell, 2004, 117(3): 399-412. DOI:10.1016/s0092-8674(04)00400-3.
[29] SCHMUKLE A C, WALCZAK H. No one can whistle a symphony alone: how different ubiquitin linkages cooperate to orchestrate NF-κB activity[J]. Journal of Cell Science, 2012, 125(3): 549-559.DOI:10.1242/jcs.091793.
[30] RAJAKUMAR D, ALEXANDER M, OOMMEN A. Oxidative stress,NF-kappa B and the ubiquitin proteasomal pathway in the pathology of calpainopathy[J]. Neurochemical Research, 2013, 38(10): 2009-2018. DOI:10.1007/s11064-013-1107-z.
[31] LI Y P, REID M B. NF-kappa B mediates the protein loss induced by TNF-alpha in differentiated skeletal muscle myotubes[J].American Journal of Physiology Regulatory Integrative and Comparative Physiology, 2000, 279(4): R1165. DOI:10.1152/ajpregu.2000.279.4.R1165.
[32] LI Y P, LECKER S H, CHEN Y, et al. TNF-α increases ubiquitinconjugating activity in skeletal muscle by up-regulating UbcH2/E220k[J]. Journal Official Publication of the Federation of American Societies for Experimental Biology, 2003, 17(9): 1048-1057.DOI:10.1096/fj.02-0759com.
[33] JI L L, GOMEZ-CABRERA M C, STEINHAFEL N, et al. Acute exercise activates nuclear factor (NF)-kappa B signaling pathway in rat skeletal muscle[J]. THE FASEB Journal, 2004, 18(13): 1499-1506.DOI:10.1096/fj.04-1846com.
[34] SPACCAROTELLA K J, ANDZEL W D. Building a beverage for recovery from endurance activity: a review[J]. Journal of Strength and Conditioning Research, 2011, 25(11): 3198-3204. DOI:10.1519/JSC.0b013e318212e52f.
[35] 林强, 吴毅, 胡永善. 骨骼肌细胞葡萄糖运载体4的研究进展[J].中国康复医学杂志, 2007, 22(5): 471-475. DOI:10.3969/j.issn.1001-1242.2007.05.030.
[36] 唐海双, 王清松, 焦炳华, 等. GLUT4在胰岛素调控葡萄糖转运中作用[J]. 生命的化学, 2014, 34(2): 285-290.
[37] RAMACHANDRAN R, CARL D S, CYNTHIA H, et al. AKT inhibitors promote cell death in cervical cancer through disruption of mTOR signaling and glucose uptake[J]. PLoS ONE, 2014, 9(4):e92948. DOI:10.1371/journal.pone.0092948.
[38] 汤璇, 陈静, 沈旭. 葡萄糖转运蛋白4功能调节信号通路及其在药物研发中的应用[J]. 中国科学: 化学, 2012(12): 1760-1773.DOI:10.1360/032012-333.
[39] 李志忠, 袁惠君, 赵萍. 大豆多肽产品的主要成分分析[J].兰州理工大学学报, 2005, 31(1): 82-83. DOI:10.3969/j.issn.1673-5196.2005.01.021.
[40] 陈湘宁, 张艳艳, 范俊峰, 等. 大豆多肽的凝胶性及抗氧化性研究[J]. 食品科学, 2005, 26(5): 71-75. DOI:10.3321/j.issn:1002-6630.2005.05.011.
[41] 周勇, 陈烨, 王权, 等. 大豆肽的解酒作用及其机制研究[J]. 中药材,2014, 37(6): 1033-1036.
[42] 荣建华. 大豆多肽及其生物活性的研究[D]. 武汉: 华中农业大学,2001: 30-31.
[43] GOBATTO C A, DE MELLO M A, SIBUYA C Y, et al. Maximal lactate steady state in rats submitted to swimming exercise[J].Comparative Biochemistry & Physiology. Part A: Molecular &Integrative Physiology, 2001, 130(1): 21-27. DOI:10.1016/S1095-6433(01)00362-2.
[44] JIA J M, WU C F. Antifatigue activity of tissue culture extracts of saussurea involucrata[J]. Pharmaceutical Biology, 2008, 46(6): 433-436. DOI:10.1080/13880200802055909.
[45] 衣雪洁, 张庆荣, 于莹. 健脾补糖对过度训练脾虚大鼠骨骼肌GLUT4和P38活性的影响[J]. 北京体育大学学报, 2007, 30(9): 1212-1215. DOI:10.3969/j.issn.1007-3612.2007.09.021.
[46] HWANG J W, DO H J, KIM O Y, et al. Fermented soy bean extract suppresses differentiation of 3T3-L1 preadipocytes and facilitates its glucose utilization[J]. Journal of Functional Foods, 2015, 15: 516-524.DOI:10.1016/j.jff.2015.04.002.
[47] RODRIQUEZ N R, DI MARCO N M, LANGLEY S. Nutrition and athletic performance[J]. Medicine and Science in Sports and Exercise,2009, 41(3): 709-731. DOI:10.1249/MSS.0b013e318190eb86.
[48] 李世成, 吴维, 杨则宜. 运动后骨骼肌微结构的损伤及修复与蛋白质补充[J]. 中国运动医学杂志, 2004, 23(2): 216-219. DOI:10.3969/j.issn.1000-6710.2004.02.024.
[49] HOLEČEK M. Beta-hydroxy-beta-methylbutyrate supplementation and skeletal muscle in healthy and muscle-wasting conditions[J].Journal of Cachexia, Sarcopenia and Muscle, 2017, 8(4): 529-541.DOI:10.1002/jcsm.12208.
[50] MATSUMOTO K, MIZUNO M, MIZUNO T, et al. Branched-chain amino acids and arginine supplementation attenuates skeletal muscle proteolysis induced by moderate exercise in young individuals[J].International Journal of Sports Medicine, 2007, 28(6): 531-538.DOI:10.1055/s-2007-964940.
[51] ETHERIDGE T, PHILP A, WATT P W. A single protein meal increases recovery of muscle function following an acute eccentric exercise bout[J]. Applied Physiology, Nutrition, and Metabolism,2008, 33(3): 483-488. DOI:10.1139/H08-028.
[52] BLOMSTRAND E, TANNERSTEDT J, KARLSSON H K R, et al.Branched-chain amino acids activate key enzymes in protein synthesis after physical exercise[J]. The Journal of Nutrition, 2006, 136(1):269S-273S. DOI:10.1093/jn/136.1.269S.
[53] DE OLIVEIRA A C C, PEREZ A C, MERINO G, et al. Protective effects of Panax ginseng on muscle injury and inflammation after eccentric exercise[J]. Comparative Biochemistry and Physiology Part C: Toxicology and Pharmacology, 2001, 130(3): 369-377.DOI:10.1016/S1532-0456(01)00262-9.
[54] 魏源, 周亮, 李良鸣, 等. 补充活性肽对离心运动后骨骼肌微损伤及修复效果的观察研究[J]. 体育科学, 2007, 27(3): 59-67.DOI:10.3969/j.issn.1000-677X.2007.03.011.
[55] YU B, LU Z X, BIE X M, et al. Scavenging and anti-fatigue activity of fermented defatted soybean peptides[J]. European Food Research and Technology, 2008, 226(3): 415-421. DOI:10.1007/s00217-006-0552-1.
[56] DICKINSON J M, VOLPI E, RASMUSSEN B B. Exercise and nutrition to target protein synthesis impairments in aging skeletal muscle[J]. Exercise & Sport Sciences Reviews, 2013, 41(4): 216-223.DOI:10.1097/JES.0b013e3182a4e699.
[57] COOKE M S, EVANS M D, DIZDAROGLU M, et al. Oxidative DNA damage: mechanisms, mutation, and disease[J]. Federation of American Societies for Experimental Biology Journal, 2003, 17(10):1195-1214. DOI:10.1096/fj.02-0752rev.
[58] 章梦瑶, 付乐, 张蕴琨. GBE对运动大鼠中脑SOD活力、MDA含量和DA浓度的影响[J]. 南京体育学院学报(自然科学版), 2015, 14(4):54-57.
[59] YANG J H, MAU J L, KO P T, et al. Antioxidant properties of fermented soybean broth[J]. Food Chemistry, 2000, 71(2): 249-254.DOI:10.1016/S0308-8146(00)00165-5.
[60] KEI M, MASAAKI T, SATOSHI N, et al. Antifatigue effects of coenzyme Q10 during physical fatigue[J]. Nutrition, 2008, 24(4): 293-299. DOI:10.1016/j.nut.2007.12.007.
[61] KALMAN D S, FELDMAN S, SCHEINBERG A R. Influence of methylsulfonylmethane on markers of exercise recovery and performance in healthy men: a pilot study[J]. Journal of the International Society of Sports Nutrition, 2012, 9(1): 46.DOI:10.1186/1550-2783-9-46.
[62] COBLEY J N, CHRIS M G, MORTON J P, et al. N-Acetylcysteine’s attenuation of fatigue after repeated bouts of intermittent exercise:practical implications for tournament situations[J]. International Journal of Sport Nutrition & Exercise Metabolism, 2011, 21(6): 451-461. DOI:10.1016/j.nut.2015.02.005.
[63] YANG J H, MAU J L, KO P T, et al. Antioxidant properties of fermented soybean broth[J]. Food Chemistry, 2000, 71(2): 249-254.DOI:10.2174/2212798407666150629134141.
[64] SINGH B P, VIJ S, HATI S. Functional significance of bioactive peptides derived from soybean[J]. Peptides, 2014, 54(2): 171-179.DOI:10.1016/j.peptides.2014.01.022.
[65] 刘恩岐, 李华, 巫永华, 等. 黑豆肽的抗氧化活性与缓解体力疲劳作用[J]. 食品科学, 2013, 34(11): 273-277. DOI:10.7506/spkx1002-6630-201311059.
[66] 王启荣, 李肃反, 杨则宜, 等. 补充大豆多肽对中长跑运动员训练期生化指标的影响[J]. 中国运动医学杂志, 2004, 23(1): 33-37.DOI:10.3969/j.issn.1000-6710.2004.01.006.
Progress in Understanding the Mechanism of Exercise-Induced Fatigue and Its Regulation by Soybean Peptide
WU Liangwen, CHEN Ning. Progress in understanding the mechanism of exercise-induced fatigue and its regulation by soybean peptide[J]. Food Science, 2019, 40(17): 302-308. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20190118-219. http://www.spkx.net.cn