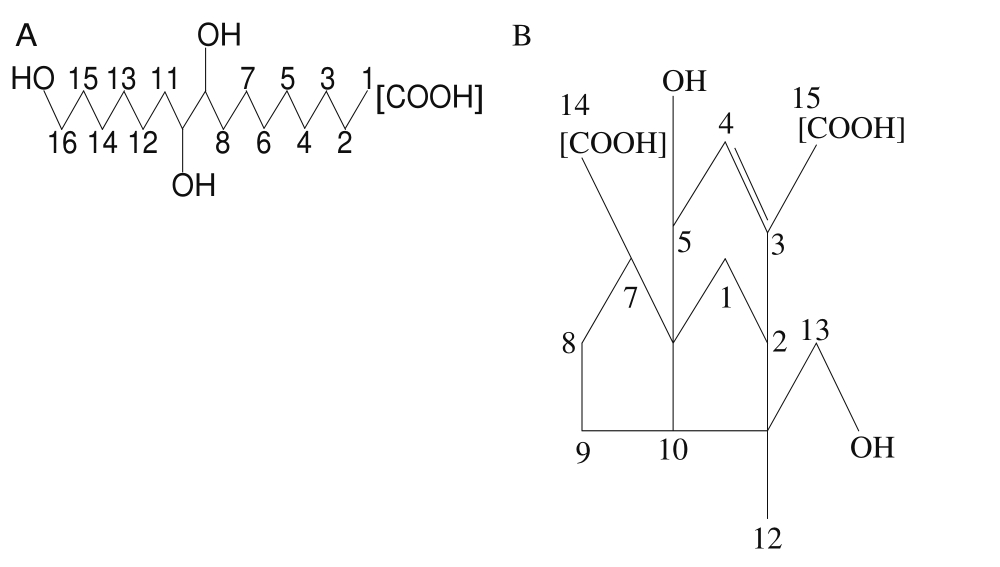
图1 紫胶桐酸(A)和壳脑酸(B)的分子结构[8]
Fig. 1 Molecular structures of aleuritic acid (A) and shellolic acid (B)[8]
虫胶又名紫胶,是一种以树脂为主要成分的天然胶体,是紫胶虫(Laccifer lacca Keer.)吸食豆科植物树汁后分泌的一种红色物质,无毒、生理无害、生物可降解,被美国食品与药品监督管理局列为一般公认的安全类添加剂[1-2]。虫胶是重要的农副加工产品,在中国、印度、泰国、马来西亚等国家具有重要的经济价值。虫胶在国内外使用历史悠久,如在古代可作为木质家具和字画作品的储藏保护剂[3]。在近代,虫胶因其无毒无害、优良的成膜性和耐酸性,在食品行业和医药行业中被用作膜剂或包衣,然而由于其软化点和熔点较低、耐水性和耐溶剂性较差、膜脆性较高,特别是随着成膜性良好的半合成、合成聚合物的发展,虫胶作为膜剂和包衣的应用逐渐减少[4]。但最新细胞毒理学和动物实验研究表明,长期摄入合成类聚合物对动物和人体具有一定毒性,这使得虫胶又重新获得研究热度。本文综述了虫胶的组成、物化特性,归纳总结了近年来虫胶微囊化应用领域和微囊化方法的研究进展,并对虫胶在微囊化方面应用的前景做出展望。
虫胶又名紫胶,是紫胶虫寄生在豆科(Leguminosae)和桑科(Moraceae)等植物上,吸食其树液后通过新陈代谢分泌胶质,胶质在树枝上积累形成的一种紫红色动物质树脂;它主要由虫胶树脂、虫胶蜡、虫胶色素组成,还含有少量杂质,如糖类、盐类、蛋白质、虫尸和木屑等[1-2]。
1.1.1 虫胶树脂
虫胶树脂是虫胶的主要成分,在虫胶中含量占70%~90%[5]。根据虫胶树脂在乙醚中的溶解度,可大体上分为醚溶性的软树脂以及醚不溶性的硬树脂,软树脂在适当条件下会聚合生成硬树脂[6]。从化学组分上讲,虫胶树脂分为聚酯、脂肪族多羟基酸、脂环族多羟基酸3 类组分,其中紫胶桐酸和壳脑酸分别是脂肪族多羟基酸和脂环族多羟基酸的代表组分[2](图1)。哈成勇等根据长链脂肪酸和环状萜烯酸盐类性质差异,分离纯化并鉴定了紫胶桐酸和壳脑酸的分子结构[7-8]。印度科学家在虫胶树脂组成研究上也做了很多突破性工作,通过对树脂进行碱水解和分步纯化,得到3 种链状脂肪酸(紫胶桐酸、开醇酸和布醇酸)和8 种环状萜烯酸(壳脑酸、壳脑醛酸、壳脑醇酸、表壳脑酸、表壳脑醇酸、虫胶壳脑酸、虫胶壳脑醛酸和表虫胶壳脑酸)[9],并分离鉴定出紫胶软树脂的4 个聚酯组分,分别为紫草茸酸脂I、紫草茸醇酸脂I、紫草茸酸脂II和紫草茸醇酸脂II[6]。哈成勇等通过溶剂分级和紫外吸收测定证明了虫胶树脂是由链状脂肪酸和环状萜烯酸以物质的量之比1∶1结合而成[6]。另外,Wang Lili等在有机碱羟化四甲铵存在的条件下,通过反应裂解气相色谱法测定了天然紫胶树脂的化学组成,结果表明,印度紫胶中萜烯酸、紫胶桐酸、其他脂肪酸的物质的量之比为53∶34∶14,而泰国紫胶中三者比例为51∶35∶14[1]。由于虫胶存放时间、采集、光照、空气和温度的影响,以及分子中醛基的不稳定,其结构发生变化,造成不同来源的虫胶结构解析具有一定的差异性。

图1 紫胶桐酸(A)和壳脑酸(B)的分子结构[8]
Fig. 1 Molecular structures of aleuritic acid (A) and shellolic acid (B)[8]
1.1.2 虫胶蜡
虫胶蜡是虫胶的重要疏水组分,具有良好的成膜性,可喷涂或刷涂在蔬菜、水果和蛋类等食品表面,减少水分蒸发,延长贮存期,保持原有风味和色泽,是食品保鲜中常用的一种生物蜡[10]。虫胶蜡主要是由三十酸、三十二酸、廿六酸以及廿八酸等高级一元酸和三十醇、三十二醇、廿六醇及廿八醇等一元醇构成的酯类混合物,还含有少量的游离脂肪酸[11]。
1.1.3 虫胶色素
虫胶色素是一种天然可食性色素,是虫胶加工中的重要产品,其附加值甚至高于虫胶本身,在食品、药品、化妆品中应用甚广。虫胶色素为红色或桃红色,组分上可分为虫胶红色素和虫胶黄色素两类。刘跃明等总结了虫胶色素的组成、特性及提取技术等方面的研究进展[12],本文不再重复说明。
虫胶树脂是由链状脂肪酸与环状萜烯酸以质量比和物质的量之比均为1∶1结合而成的,平均相对分子质量在1 000左右,每一个分子含有1 个游离羧基、1 个醛基、2~3 个酯基以及4~5 个羟基。虫胶树脂分为软树脂和硬树脂两类。软树脂是由1 个长链脂肪酸与1 个环状萜烯酸组合成的结构单元;硬树脂则是由软树脂中羟基通过聚合反应后以二聚、三聚乃至四聚体混合而成,随着羟基数量的减少,虫胶树脂的亲水性也会减小[6-7]。
1.2.1 溶解性
在碱性水溶液中,虫胶可部分溶解或者完全溶解,在pH<7时,几乎不溶于酸性至中性的水性介质中,这与虫胶的解离常数pKa=6.7相符[13-14]。虫胶易溶于甲醇、乙醇、正丙醇等溶剂,这些溶剂与虫胶在组成和结构上有相似之处,符合相似相容原理[5,15]。Banerjee等发现虫胶树脂仅溶于具有中强氢键力的溶剂,醇为最好的溶剂[16]。
1.2.2 热性能
虫胶树脂具有突出的热性能,兼具有热固性和热塑性,在软化点以下,虫胶树脂呈固态,当温度升高至软化点时,虫胶树脂会随着温度升高逐渐熔化,但冷却后又恢复成固体状态。虫胶树脂的软化点不是固定的,在高温、高湿条件下虫胶树脂会发生聚合反应,软化点升高,最后甚至变成为不熔、不溶的三维网状结构的聚合物[1,17-18]。
表1 虫胶在不同功能性组分微囊化中的应用
Table 1 Applications of shellac in the microencapsulation of various functional ingredients
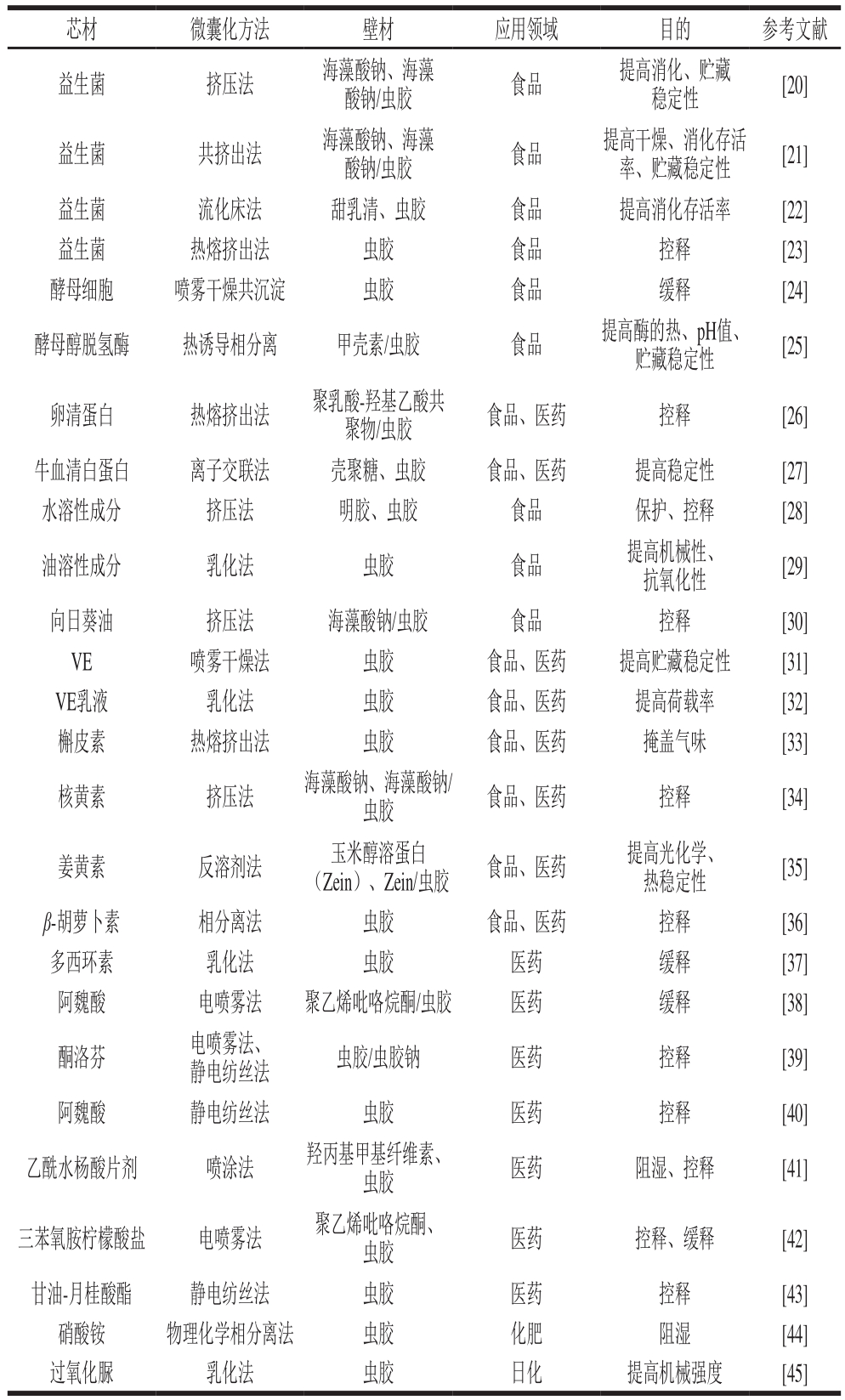
芯材 微囊化方法 壁材 应用领域 目的 参考文献益生菌 挤压法 海藻酸钠、海藻酸钠/虫胶 食品 提高消化、贮藏稳定性 [20]益生菌 共挤出法 海藻酸钠、海藻酸钠/虫胶 食品 提高干燥、消化存活率、贮藏稳定性 [21]益生菌 流化床法 甜乳清、虫胶 食品 提高消化存活率 [22]益生菌 热熔挤出法 虫胶 食品 控释 [23]酵母细胞 喷雾干燥共沉淀 虫胶 食品 缓释 [24]酵母醇脱氢酶 热诱导相分离 甲壳素/虫胶 食品 提高酶的热、pH值、贮藏稳定性 [25]卵清蛋白 热熔挤出法 聚乳酸-羟基乙酸共聚物/虫胶 食品、医药 控释 [26]牛血清白蛋白 离子交联法 壳聚糖、虫胶 食品、医药 提高稳定性 [27]水溶性成分 挤压法 明胶、虫胶 食品 保护、控释 [28]油溶性成分 乳化法 虫胶 食品 提高机械性、抗氧化性 [29]向日葵油 挤压法 海藻酸钠/虫胶 食品 控释 [30]VE 喷雾干燥法 虫胶 食品、医药 提高贮藏稳定性 [31]VE乳液 乳化法 虫胶 食品、医药 提高荷载率 [32]槲皮素 热熔挤出法 虫胶 食品、医药 掩盖气味 [33]核黄素 挤压法 海藻酸钠、海藻酸钠/虫胶 食品、医药 控释 [34]姜黄素 反溶剂法 玉米醇溶蛋白(Zein)、Zein/虫胶 食品、医药 提高光化学、热稳定性 [35]β-胡萝卜素 相分离法 虫胶 食品、医药 控释 [36]多西环素 乳化法 虫胶 医药 缓释 [37]阿魏酸 电喷雾法 聚乙烯吡咯烷酮/虫胶 医药 缓释 [38]酮洛芬 电喷雾法、静电纺丝法 虫胶/虫胶钠 医药 控释 [39]阿魏酸 静电纺丝法 虫胶 医药 控释 [40]乙酰水杨酸片剂 喷涂法 羟丙基甲基纤维素、虫胶 医药 阻湿、控释 [41]三苯氧胺柠檬酸盐 电喷雾法 聚乙烯吡咯烷酮、虫胶 医药 控释、缓释 [42]甘油-月桂酸酯 静电纺丝法 虫胶 医药 控释 [43]硝酸铵 物理化学相分离法 虫胶 化肥 阻湿 [44]过氧化脲 乳化法 虫胶 日化 提高机械强度 [45]
微胶囊是一种半透性或密封的微型“容器”,在芯材和外界环境之间提供屏障,提高芯材的生物活性和货架期稳定性,使芯材在口腔、胃肠道、肿瘤等部位可控定点释放,掩盖芯材的不良气味和风味,减缓低沸点芯材的挥发性和降解,抑制芯材的潮解[19]。虫胶作为一种天然产物,对人体没有毒性和刺激性,可生物降解,具有较好的成膜性,适用于食品、制药、化肥、日化等多种行业(表1),而虫胶不溶于酸也不溶于水,与其他天然或合成聚合物相比具有更好的水汽阻隔性,其溶于碱的特性尤适用于药物和生物活性组分的胃肠道控释。因此,下面对虫胶在食品、制药、化肥、日化等行业中不同功能组分的微囊化应用进行综述。
在食品体系中,益生菌、维生素、天然食品色素、油脂、蛋白质、酶等组分十分重要,但在实际应用中容易遇到溶解度差、理化性质不稳定、无法靶向释放、贮藏活性丧失等问题,微囊化可以改善上述问题,而壁材的选择则是微囊化的关键。虫胶在溶解性上的特性能够降低芯材在常温贮藏中的吸湿性,以及避免在消化过程中胃酸造成的损失,在食品功能性组分微囊化应用中具有很大的潜力。
2.1.1 益生菌
益生菌作为重要的功能性食品原料,具有维持肠道微生物平衡、控制血胆固醇、增强机体免疫力等重要生理功能,但益生菌是一种高敏感性生物活性物质,环境耐受性差,在加工贮藏和消化过程中易死亡,益生菌微囊化可有效改善该问题[46]。Silva等以含有益生菌的葵花油和椰子脂为内核、海藻酸钠和海藻酸钠/虫胶混合物为外壳,采用共挤出法制备益生菌微胶囊,并通过流化床和冷冻干燥两种方式进行干燥,研究表明虫胶在益生菌微胶囊的干燥、贮藏以及模拟胃肠液消化过程中均具有良好的保护作用,以葵花油内核、流化床干燥组为例,海藻酸钠/虫胶微胶囊的模拟胃肠液益生菌存活数量比海藻酸钠微胶囊高1.3(lg(CFU/g))[20]。Schell等以甜乳清为壁材、海藻糖为热保护剂,采用流化床法制备益生菌微胶囊,再用虫胶溶液对该微胶囊进行顶部喷雾涂层,结果显示,虫胶涂层微胶囊的模拟胃肠液消化后,益生菌存活率较甜乳清微胶囊高51.74%,这一结果也证明了虫胶可以提高益生菌在胃肠道运输期间的存活率[22]。Gately等将益生菌干粉与虫胶混合,采用热熔挤出法制备益生菌/虫胶共混物,在37 ℃、pH 1.2和pH 6.8的酸性溶液中保温24 h,该共混物降解程度均小于5%,在37 ℃、pH 7.4的磷酸盐缓冲液中保温10~11 h后,共混物完全解离,这主要是因为虫胶具有不溶于酸性和中性水溶液、溶于碱性水溶液的特性[23]。目前,虫胶作为益生菌壁材的研究主要集中在胃肠道控释方面,缺少阻湿性方面的研究。益生菌干粉的贮藏失活是益生菌工业应用的重大瓶颈之一,虫胶良好的阻湿性可为益生菌因水分活度的增加而造成贮藏失活提供一种解决方案。
2.1.2 维生素
维生素是重要的微量营养化合物,在人体生长代谢过程中发挥着重大作用,但维生素非常敏感,在食物加工、贮存、消化过程中极不稳定。微囊化可提高维生素稳定性,也可对其进行肠道控释[47]。Messaoud等以溶解有核黄素的甘油/CaCl2水溶液为液芯,采用挤压法制备海藻酸钠微胶囊,再采用酸沉淀和钙交联两种方法,用虫胶涂层海藻酸钠微胶囊,制备了虫胶/海藻酸钠涂层微胶囊,研究表明,与海藻酸钠微胶囊相比,在酸性条件下虫胶/海藻酸钠涂层微胶囊能有效降低核黄素的释放率,在偏中性条件却不影响核黄素的释放;以钙交联涂层组为例,在浸入pH 1的强酸性溶液300 min后,虫胶涂层微胶囊的核黄素释放率较海藻酸钠微胶囊低51.4%,而浸入pH 5的偏中性溶液300 min后,虫胶涂层微胶囊的核黄素释放率仅比海藻酸钠微胶囊低8.9%[34]。潘正东等以虫胶钠盐为壁材、以Span-80和Tween-80为复配乳化剂,通过喷雾干燥成功制备VE微胶囊,提高了VE的稳定性,该微胶囊包埋率可达到78.06%[31]。Luo Qingming等也采用虫胶钠盐以乳化法包埋VE乳液,提高了VE的荷载率[32]。上述研究说明虫胶作为壁材既适用于包埋脂溶性维生素,也适用于包埋水溶性维生素,但目前关于虫胶包埋维生素的研究仍然较少,可深入研究虫胶与不同壁材的复配保护效果,该保护效果可包括肠道控释、常温贮藏、热解、光解等方面。
2.1.3 天然食品色素
天然食品色素是从动物、植物和微生物及其代谢产物中提取出来的一种食品添加剂,能够改变食品的色泽和营养特性,且具有良好的抗氧化功能,但其本身对pH值、光、氧、热等因素敏感,在食品工业中的应用受到极大的限制[48]。Sun Cuixia等以Zein和Zein/虫胶为壁材,通过反溶剂法制备姜黄素微胶囊,当Zein与虫胶的质量比为1∶1时,Zein/虫胶能有效提高姜黄素的光和热稳定性,经紫外、60 ℃热处理、90 ℃热处理后,与游离姜黄素溶液相比,Zein/虫胶微囊的姜黄素保留率分别提高了64%、64%和22%[35]。Chen Dong等以含β-胡萝卜素和虫胶的乙酸乙酯/乙醇混合溶液为内相、聚乙烯醇水溶液为外相,制备水包油乳液,待内相溶剂扩散至外相中,虫胶析出形成微胶囊,结果表明,与普通β-胡萝卜素固体颗粒相比,在常温贮藏4 个月后,虫胶微囊仍保留80%未被氧化的β-胡萝卜素,且该微胶囊不溶于酸性和中性水溶液,在pH 8时才溶解,说明虫胶不仅能减缓β-胡萝卜素在贮存期间的降解速率,还实现了β-胡萝卜素的肠道靶向释放[36]。目前,虫胶作为微胶囊壁材包埋天然食品色素多集中在脂溶性色素,缺少水溶性天然食品色素的微囊化应用研究。
2.1.4 油脂
油脂是食品中的重要组分,但在加工和贮藏过程中极易被氧化,且其水不溶性限制了其食品工业应用。微囊化不仅能防止油脂的泄露和氧化,还能改善其疏水性,实现功能性油脂的胃肠道可控释放[49]。Long Yue等以虫胶铵盐为水相、葵花油为油相,制备了油包水乳液,通过钙离子交联包埋两种初级微胶囊(三聚氰胺甲醛微胶囊和CaCO3纳米颗粒稳定的微胶囊),均以两种初级微胶囊和两种钙虫胶复合微胶囊内部包埋油溶性成分,结果表明两种钙虫胶复合微胶囊的机械性能均高于初级微胶囊,与钙虫胶复合微胶囊相比,两种初级微胶囊的油溶性成分泄露比例分别增加了37 倍和14 倍[29],说明虫胶微胶囊能有效地抑制油脂的泄露和氧化。虫胶不仅能增强油脂的稳定性,还能靶向释放油脂,Morales等将向日葵油制备成乳液,以海藻酸钠/虫胶为壁材,采用挤压法包埋该乳液,研究表明,与油脂乳液相比,海藻酸钠/虫胶微胶囊在模拟胃液中油脂释放量仅提高了4.66%,而在模拟肠液中油脂释放量提高了47.9%[30]。目前,关于虫胶包埋油脂的研究仍然较少,其微囊化方法也比较单一(均利用虫胶和钙离子交联),诸多细节性问题,如壁材复合、虫胶在复合壁材中所占比例等都需要深入研究。
2.1.5 蛋白质
蛋白质在食品工业中应用广泛,部分蛋白存在易降解、易失活的问题,如酶、酸不稳定蛋白等,微囊化可提高该类蛋白的环境稳定性,可通过特殊壁材实现蛋白质的靶向释放[50]。Mei Shuang等以热诱导相分离法制备酵母醇脱氢酶的甲壳素/虫胶微胶囊,结果显示,甲壳素/虫胶微胶囊的荷载量为79.0 mg/g,固定化酶的热稳定性、pH值稳定性以及贮藏稳定性均有所提高,如在pH 4.0和pH 10.0的水溶液中温育2 h后,固定化酶相对活性比游离酶分别高7.9%和38.3%;在70 ℃保持2 h后,游离酶完全失去活性,固定化酶仍能保持22%的活性[25]。Duque等以卵清蛋白为酸不稳定的模式蛋白,以聚乳酸-羟基乙酸共聚物和虫胶为壁材,采用热熔挤出法制备卵清蛋白种植体,将种植体放入37 ℃的磷酸盐缓冲液(10 mmol/L,pH 7.4)中进行3 个月的卵清蛋白释放实验,研究发现,聚乳酸-羟基乙酸的水溶特性使上述混合物的pH值处于动态变化过程,由初期的7.4降低至中期的3.5左右,末期又上升至7.0左右;当卵清蛋白和虫胶的质量比分别为1∶0、1∶1、1∶5和1∶10时,种植体卵清蛋白的最终释放率分别为25%、40%、75%和85%左右,这一结果主要是由虫胶酸不溶、碱溶的溶解特性造成的[26]。上述结果表明虫胶在酶的固定化、酸不稳定蛋白质递送、蛋白质靶向释放等方面有着良好的应用前景,但如何利用虫胶溶解特性实现酶和蛋白质的靶向释放仍然缺少深入的研究。
在医药行业中,微囊化不仅能够改善药物的理化性质、掩盖不良气味、降低毒副作用,还能达到控释和缓释药物的效果[51],一般采用天然、合成或半合成高分子材料作为药物的包衣和胶囊制剂。虫胶无毒无害,兼具热塑性和热固性双重性能,成膜性好,且它不溶于酸和水,却溶于碱性溶液,独特的溶解性使虫胶较其他高分子材料在药物的防潮和控释、缓释方面更具有优势。Cui Lei等以虫胶和聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP)为核壳基质,采用电喷雾法制备阿魏酸(ferulic acid,FA)纳米粒子,研究发现,当纳米粒子的壳核基质分别为PVP、PVP/虫胶、虫胶时,在浸入pH 2.0水溶液2 h后,纳米粒子中FA的释放率分别为99.7%、51.2%和1.7%,调节pH值至7.0,PVP/虫胶和虫胶纳米粒子分别在6 h和9 h后完全释放FA,该实验表明虫胶能在酸性介质中保护药物,并调控药物的肠道释放[38]。Pearnchob等采用虫胶和羟丙基甲基纤维素(hydroxypropyl methylcellulose,HPMC)作为乙酰水杨酸片剂的包衣,结果表明,在相同涂层厚度下,当相对湿度在100%时,虫胶包衣片剂吸湿率比HPMC包衣片剂吸湿率低5%左右,且模拟胃液实验显示,薄涂层虫胶包衣与厚涂层HPMC包衣对药物的保护效果相同[41]。Phaechamud等以橄榄油为外相、甘油单硬脂酸酯为乳化剂,以含有漂白虫胶的N-甲基吡咯烷酮、二甲基亚砜和2-吡咯烷酮混合溶液为内相,制备油包油乳液,包埋多西环素(doxycycline,DH)以提高其稳定性,研究表明,包埋后的DH可有效地抑制牙龈卟啉单胞菌、变形链球菌和金黄色葡萄球菌,且体外释放实验表明,DH可持续释放40 d[37]。Khor等以虫胶为微胶囊壁材采用热熔挤出法,包埋槲皮素以掩盖苦味[33]。虫胶作为微胶囊壁材包埋药物的报道较多,这表明虫胶在药物防潮、控释、缓释等方面效果显著。
虫胶作为微胶囊壁材在其他行业也被广泛应用。郝清伟等以虫胶为壁材、正丁醇和正己烷为溶剂和沉淀剂,采用相分离法包埋硝酸铵,并获得最优配方:正丁醇与正己烷的体积比为1∶3,混合溶剂与硝酸铵的配比为5∶1(V/m),沉淀剂滴加速率为6 s/滴,实验表明,经最优配方包埋的硝酸铵吸湿率可下降到55%[44]。Xue Jing等以虫胶盐溶液为壁材、牙齿漂白剂过氧化脲为芯材,通过乳化法制备虫胶微胶囊,实验结果表明,该微胶囊包埋率可达到51%~65%,且制得的微胶囊结构紧密,具有较好的机械强度[45]。这充分说明虫胶适用于化肥、日化等多个行业。
虫胶具有独特的溶解性、良好的成膜性、突出的热性能,兼具热塑性和热固性的双重性能,这些特性使其适用于多种微囊化方法,如挤压法、乳化法、相分离法、电喷雾法、静电纺丝法、离子交联法、喷雾干燥法等,下面对虫胶微胶囊的包埋方法进行综述。
挤压法是将芯材均匀地分散在壁材溶液中,再用注射器针头或喷嘴挤压混合液,使其呈液滴状滴入固化液中,形成微胶囊[52]。虫胶不溶于酸性和中性水溶液,可与钙离子交联形成凝胶,故虫胶挤压法制备微胶囊,多以虫胶盐溶液为壁材,以钙离子溶液、水溶液或酸性溶液为固化液(图2)。Silva等以海藻酸钠和海藻酸钠/虫胶为壁材、葵花籽油为芯材、氯化钙溶液为固化液,采用挤压法包埋益生菌,通过两种喷嘴制备不同结构的海藻酸钠微胶囊和海藻酸钠/虫胶微胶囊;其中,以单喷嘴(内径750 μm)挤压壁材和芯材的混合物制备无核芯微胶囊,以同心喷嘴共挤压壁材(外喷嘴,内径700 μm)和含益生菌的向日葵油(内喷嘴,内径450 μm)制备含核芯的微胶囊,研究发现,核芯微胶囊在模拟消化、常温贮藏实验中益生菌存活率均高于对应非核芯微胶囊[21]。Hamad等以虫胶铵盐为壁材、乙酸溶液为固化液,通过喷嘴将酵母细胞与虫胶铵盐的混合液喷洒至固化液中,形成微胶囊,研究发现,虫胶铵盐的质量分数(5%、6%、7%、14%)对微胶囊的尺寸范围、致密性、机械稳定性具有较大的影响,当虫胶铵盐的质量分数为7%时,该微胶囊具有良好的致密性和机械稳定性,通过将羧甲基纤维素、聚丙烯酸钠与虫胶铵盐复配,可以调控微胶囊在不同pH值下释放酵母细胞[24]。Patel等以虫胶和明胶为壁材,采用挤压法制备微胶囊载体,研究表明该载体可用于药物、色素、风味物质、酶等组分的包封和释放[28]。
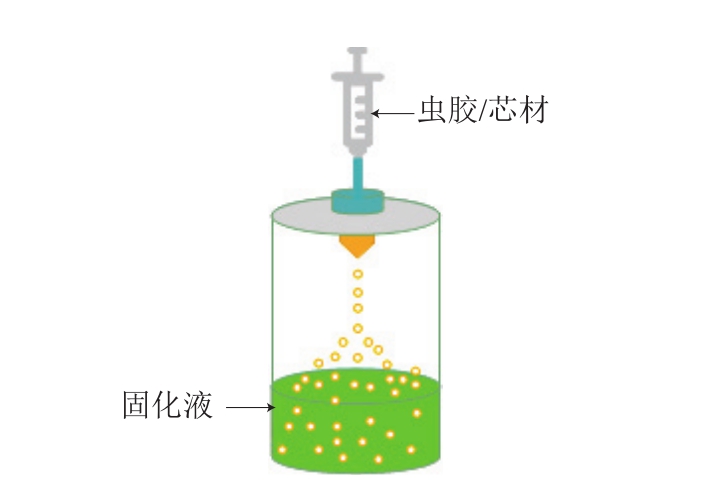
图2 虫胶挤压法制备微胶囊[20,28,30,34]
Fig. 2 Preparation of microcapsules by shellac extrusion[20,28,30,34]
乳化法是以不互溶的两相为分散相和连续相,通过搅拌形成W/O或O/W乳液,在交联剂作用下固化,形成微胶囊,其中芯材一般位于分散相[53]。一般来讲,虫胶乳化法以虫胶盐溶液和芯材的混合物为内相,加油、搅拌,制备W/O乳液,再向乳液中加入钙离子交联,形成微胶囊(图3)。Long Yue等首先以油溶性成分为内相、CaCO3纳米颗粒分散溶液和甲醛/三聚氰胺/聚(丙烯酰胺-丙烯酸)钠共聚物混合液为外相,制备两种O/W初乳乳液,再以虫胶铵盐和初乳乳液的混合液为内相、以葵花籽油为外相、以氯化钙粉末为交联剂,采用多重乳化法包埋该油溶性成分,以提高油脂的抗氧化性[29]。Xue Jing等以葵花籽油为油相、牙齿漂白剂过氧化脲为芯材、以虫胶盐溶液为壁材制备W/O乳液,通过钙离子交联制备了钙-虫胶微胶囊[45]。
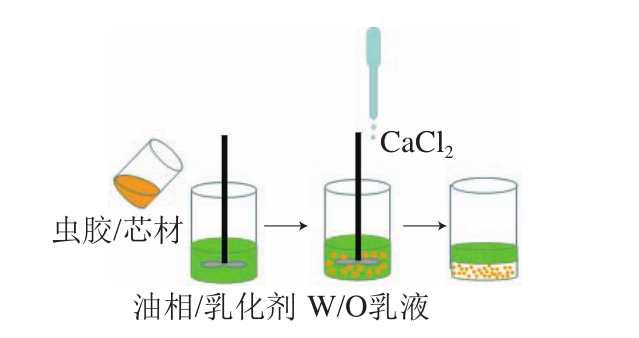
图3 虫胶乳化法制备微胶囊[29,32,37]
Fig. 3 Preparation of microcapsules by shellac emulsification[29,32,37]
相分离法是向芯材与壁材的混合溶液中,加入不良溶剂、凝聚剂、凝聚诱导剂或非溶剂,改变温度或pH值使壁材的溶解度降低,沉积在芯材表面形成微胶囊[54]。虫胶相分离法多利用虫胶醇溶、中酸性水溶液不溶的特性:包埋油溶性组分时,将虫胶与包埋物共溶于适当有机溶剂中,制备O/W乳液,有机溶剂向外扩散、水溶剂向内扩散,虫胶沉淀,形成微胶囊(图4A);包埋亲水性组分时,以虫胶盐溶液为壁材,加入包埋物共混,再滴加酸或水,虫胶沉淀,形成微胶囊(图4B)。Sun Cuixia等以反溶剂共沉淀法包埋姜黄素,该法先将Zein和虫胶分别溶于乙醇-磷酸盐溶液中,然后将Zein和虫胶以不同比例混合成Zein/虫胶溶液,再加入姜黄素乙醇水溶液,最后将混合液缓慢加入磷酸盐缓冲液中,Zein/虫胶析出形成微胶囊,结果表明,当Zein与虫胶的质量比例为1∶1时,微胶囊中的姜黄素光化学和热稳定性最好[35]。Chen Dong等使用玻璃微流控装置制备微胶囊,该装置以锥状圆柱形毛细管为内管道、以方形毛细管为外管道,构成同心管道,以含β-胡萝卜素和虫胶的乙酸乙酯/乙醇混合溶液为内相、聚乙烯醇水溶液为外相,通过同心管道同时将内外相泵入水相中,在毛细管顶端形成O/W乳液,当内相溶剂扩散至水相,虫胶析出形成微胶囊,该微囊提高了β-胡萝卜素的抗氧化稳定性和色泽稳定性[36]。
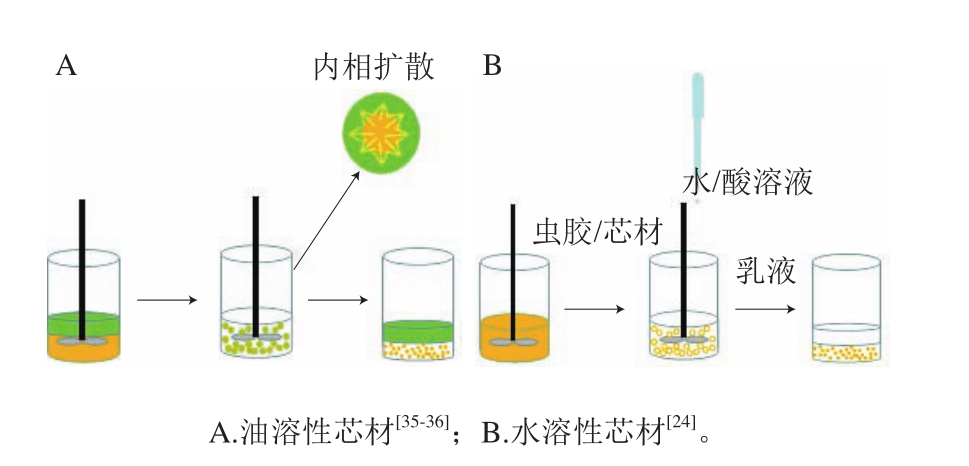
图4 虫胶相分离法制备微胶囊
Fig. 4 Preparation of microcapsules by shellac phase separation
电喷雾法是利用单喷嘴将芯材与壁材的混合液形成液滴,或利用同心喷头将内管道核芯溶液和外管道壳体溶液形成核壳液滴,在高压电场下将液滴击碎成带电喷雾,再用金属收集器收集微胶囊[55]。虫胶电喷雾法一般以虫胶溶液为外壳、包埋物为核芯,利用同心喷头制备核壳液滴(图5)。Wang Ke等以含有PVP、三苯氧胺柠檬酸盐(tamoxifen citrate,TC)的二氯甲烷/乙醇混合液为核芯、含虫胶的乙醇溶液为外壳,采用电喷雾法包埋TC,利用同心喷头制备了PVP单核微胶囊和虫胶/PVP壳核微胶囊,研究表明,与单核PVP微胶囊相比,虫胶/PVP壳核微胶囊可在模拟消化过程中可控释放TC[42]。Ma Ke等以溶于乙醇溶液中的虫胶和虫胶/虫胶钠为壁材,也采用电喷雾法成功制备了酮洛芬微胶囊,利用虫胶和虫胶钠在模拟胃肠液消化中具有不同的崩解效率,虫胶/虫胶钠复合微胶囊成功调控了酮洛芬在胃肠道的释放[39]。
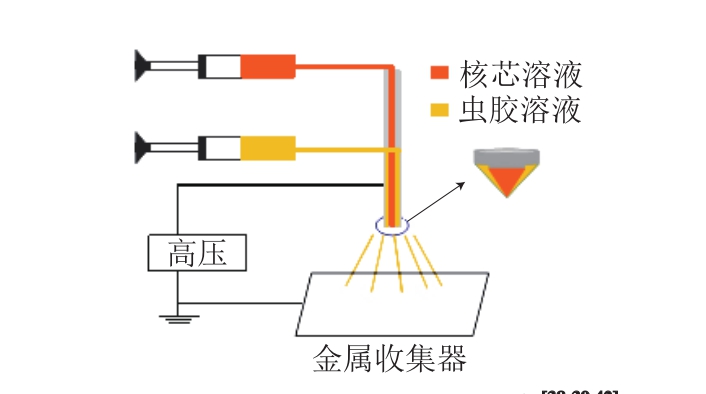
图5 虫胶电喷雾法制备微胶囊[38-39,42]
Fig. 5 Preparation of microcapsules by shellac electrospray[38-39,42]
静电纺丝法是利用静电场力吸引芯材和壁材溶液从喷丝头向另一电极喷射,混合液暴露在电场中,因电荷排斥作用,大分子伸展成纤维形态,以此荷载芯材[56]。虫胶静电纺丝法一般是将芯材和虫胶溶于乙醇溶液中,以静电场力吸引喷头尖端带电小液滴不断延伸成纤维细丝,形成虫胶纳米纤维(图6)。Wang Xia等以含有虫胶和FA的乙醇溶液为芯材、乙醇/N,N-二甲基甲酰胺混合液为壁材,利用同心喷头以静电纺丝法制备虫胶纳米纤维,研究表明,该虫胶微胶囊能调控FA在胃肠道中的释放[40]。Chinatangkul等将虫胶和甘油-月桂酸酯溶于乙醇溶液,也采用静电纺丝法制备虫胶纳米纤维,所得到的虫胶纳米纤维实现了甘油-月桂酸酯的缓释[43]。Ma Ke等也采用虫胶静电纺丝法成功包埋了酮洛芬[39]。

图6 虫胶静电纺丝法制备微胶囊[40,42-43]
Fig. 6 Preparation of microcapsules by shellac electrospinning[40,42-43]
离子交联法和喷雾干燥法同样适用于虫胶微胶囊的包埋。Kraisit等以壳聚糖和虫胶为壁材,采用离子交联法成功构建了封装牛血清白蛋白的纳米颗粒载体[27]。潘正东等以虫胶钠盐为壁材采用喷雾干燥法包埋VE,增强了VE的贮藏稳定性[31]。
虫胶作为一种无毒无害的天然树脂,具有独特的溶解性和良好的成膜性,还兼具热塑性和热固性双重热性能,在食品、医药、化肥、日化等多种行业的微囊化中被广泛利用。目前,大多数虫胶微囊化研究多集中在其耐酸及胃肠道控释特性,缺少阻湿性设计和微囊干粉的常温常湿贮藏研究。另外,虫胶的基础理化特性研究较为薄弱,虫胶树脂的分子结构、化学组成、不同条件下软硬树脂转化等科学问题有待进一步研究。
[1] WANG Lili, ISHIDA Y, OHTANI H, et al. Characterization of natural resin shellac by reactive pyrolysis-gas chromatography in the presence of organic alkali[J]. Analytical Chemistry, 1999, 71(7): 1316-1322.DOI:10.1021/ac981049e.
[2] LABUSCHAGNE P W, NAICKER B, KALOMBO L. Micronization,characterization and in-vitro dissolution of shellac from PGSS supercritical CO2 technique[J]. International Journal of Pharmaceutics,2016, 499(1): 205-216. DOI:10.1016/j.ijpharm.2015.12.021.
[3] COELHO C, NANABALA R, MÉNAGER M, et al. Molecular changes during natural biopolymer ageing: the case of shellac[J].Polymer Degradation and Stability, 2012, 97(6): 936-940.DOI:10.1016/j.polymdegradstab.2012.03.024.
[4] LUANGTANA-ANAN M, LIMMATVAPIRAT S, NUNTHANID J,et al. Effect of salts and plasticizers on stability of shellac film[J].Journal of Agricultural and Food Chemistry, 2007, 55(3): 687-692.DOI:10.1021/jf061922+.
[5] GARDNER W H, WHITMORE W F. Nature and constitution of shellac I: preliminary investigation of the action of organic solvents[J].Industrial and Engineering Chemistry, 1929, 21(3): 226-229.DOI:10.1021/ie50231a009.
[6] 哈成勇, 王定选. 国产紫胶树脂组成的研究[J]. 林产化学与工业,1992, 12(1): 43-48.
[7] 哈成勇, 王定选. 国产紫胶树脂组成的研究(续)[J]. 林产化学与工业, 1993, 13(3): 203-208.
[8] 哈成勇, 袁金伦, 李静. 中国紫胶树脂基本组成的研究[J]. 分析化学,1999, 27(2): 178-181.
[9] PRASAD N, AGARWAL S C. A convenient method for isolation of jalaric and aleuritic acids from shellac[J]. Research and Industry, 1990,35(3): 164-166.
[10] CHAUHAN O P, NANJAPPA C, ASHOK N, et al. Shellac and Aloe vera gel based surface coating for shelf life extension of tomatoes[J].Journal of Food Science and Technology, 2015, 52(2): 1200-1205.DOI:10.1007/s13197-013-1035-6.
[11] 张汝国, 郑华, 张弘, 等. 差示量热扫描法分析紫胶蜡的热性质[J].食品科学, 2009, 30(17): 137-140. DOI:10.7506/spkx1002-6630-200917032.
[12] 刘跃明, 卢贵忠. 天然紫胶色素的特性及提取技术研究进展[J]. 云南农业大学学报, 2005, 20(1): 120-123. DOI:10.16211/j.issn.1004-390x(n).2005.01.024.
[13] PEARNCHOB N, DASHEVSKY A, BODMEIER R. Improvement in the disintegration of shellac-coated soft gelatin capsules in simulated intestinal fluid[J]. Journal of Controlled Release, 2004, 94(2/3):313-321. DOI:10.1016/j.jconrel.2003.10.004.
[14] LIMMATVAPIRAT S, LIMMATVAPIRAT C, LUANGTANA-ANAN M,et al. Modification of physicochemical and mechanical properties of shellac by partial hydrolysis[J]. International Journal of Pharmaceutics,2004, 278(1): 41-49. DOI:10.1016/j.ijpharm.2004.02.030.
[15] QUSSI B, SUESS W G. The influence of different plasticizers and polymers on the mechanical and thermal properties, porosity and drug permeability of free shellac films[J]. Drug Development and Industrial Pharmacy, 2006, 32(4): 403-412. DOI:10.1080/03639040600559099.
[16] BANERJEE P K, SRIVASTAVA B C, KUMAR S. Shellac-solvent interaction parameter[J]. Polymer, 1982, 23(8): 1244-1245.DOI:10.1016/0032-3861(82)90388-3.
[17] 陈奇, 张弘, 郑华, 等. 紫胶树脂在氨水中的溶解性及其铵盐的理化性质[J].食品科学, 2013, 34(23): 77-82. DOI:10.7506/spkx1002-6630-201323017.
[18] PATEL A R, SCHATTEMAN D, DE VOS W H, et al. Shellac as a natural material to structure a liquid oil-based thermo reversible soft matter system[J]. RSC Advances, 2013, 3(16): 5324-5327.DOI:10.1039/c3ra40934a.
[19] YE Qianyu, GEORGES N, SELOMULYA C. Microencapsulation of active ingredients in functional foods: from research stage to commercial food products[J]. Trends in Food Science & Technology,2018, 78: 167-179. DOI:10.1016/j.tifs.2018.05.025.
[20] SILVA M P, TULINI F L, RIBAS M M, et al. Microcapsules loaded with the probiotic Lactobacillus paracasei BGP-1 produced by co-extrusion technology using alginate/shellac as wall material:characterization and evaluation of drying processes[J]. Food Research International, 2016, 89: 582-590. DOI:10.1016/j.foodres.2016.09.008.
[21] SILVA M P, TULINI F L, MARTINS E, et al. Comparison of extrusion and co-extrusion encapsulation techniques to protect Lactobacillus acidophilus LA3 in simulated gastrointestinal fluids[J].LWT-Food Science and Technology, 2018, 89: 392-399. DOI:10.1016/j.lwt.2017.11.008.
[22] SCHELL D, BEERMANN C. Fluidized bed microencapsulation of Lactobacillus reuteri with sweet whey and shellac for improved acid resistance and in-vitro gastro-intestinal survival[J]. Food Research International, 2014, 62: 308-314. DOI:10.1016/j.foodres.2014.03.016.
[23] GATELY N M, KENNEDY J E. The development of a melt-extruded shellac carrier for the targeted delivery of probiotics to the colon[J].Pharmaceutics, 2017, 9(4): 38. DOI:10.3390/pharmaceutics9040038.
[24] HAMAD S A, STOYANOV S D, PAUNOV V N. Triggered cell release from shellac-cells composite microcapsules[J]. Soft Matter,2012, 8(18): 5069-5077. DOI:10.1557/opl.2013.333.
[25] MEI Shuang, HAN Pingping, WU Hong, et al. One-pot fabrication of chitin-shellac composite microspheres for efficient enzyme immobilization[J]. Journal of Biotechnology, 2018, 266: 1-8.DOI:10.1016/j.jbiotec.2017.11.015.
[26] DUQUE L, KÖRBER M, BODMEIER R. Improving release completeness from PLGA-based implants for the acid-labile model protein ovalbumin[J]. International Journal of Pharmaceutics, 2018,538(1/2): 139-146. DOI:10.1016/j.ijpharm.2018.01.026.
[27] KRAISIT P, LIMMATVAPIRAT S, NUNTHANID J, et al.Nanoparticle formation by using shellac and chitosan for a protein delivery system[J]. Pharmaceutical Development and Technology,2013, 18(3): 686-693. DOI:10.3109/10837450.2012.685657.
[28] PATEL A R, REMIJN C, CABERO A M, et al. Novel all-natural microcapsules from gelatin and shellac for biorelated applications[J].Advanced Functional Materials, 2013, 23(37): 4710-4718.DOI:10.1002/adfm.201300320.
[29] LONG Yue, SONG Kai, YORK D, et al. Composite microcapsules with enhanced mechanical stability and reduced active ingredient leakage[J]. Particuology, 2016, 26: 40-46. DOI:10.1016/j.partic.2015.09.003.
[30] MORALES E, RUBILAR M, BURGOS-DÍAZ C, et al. Alginate/shellac beads developed by external gelation as a highly efficient model system for oil encapsulation with intestinal delivery[J].Food Hydrocolloids, 2017, 70: 321-328. DOI:10.1016/j.foodhyd.2017.04.012.
[31] 潘正东, 李凯, 徐涓, 等. 响应面试验优化紫胶树脂钠盐为壁材制备VE微胶囊工艺[J]. 食品科学, 2016, 37(12): 19-26. DOI:10.7506/spkx1002-6630-201612004.
[32] LUO Qingming, LI Kai, XU Juan, et al. Novel biobased sodium shellac for wrapping disperse multiscale emulsion particles[J]. Journal of Agricultural and Food Chemistry, 2016, 64(49): 9374-9380.DOI:10.1021/acs.jafc.6b04417.
[33] KHOR C M, NG W K, KANAUJIA P, et al. Hot-melt extrusion microencapsulation of quercetin for taste-masking[J]. Journal of Microencapsulation, 2017, 34(1): 29-37. DOI:10.1080/02652048.2017.1280095.
[34] MESSAOUD G B, SÁNCHEZ-GONZÁLEZ L, PROBST L, et al.Physico-chemical properties of alginate/shellac aqueous-core capsules: influence of membrane architecture on riboflavin release[J]. Carbohydrate Polymers, 2016, 144: 428. DOI:10.1016/j.carbpol.2016.02.081.
[35] SUN Cuixia, XU Chenqi, MAO Like, et al. Preparation,characterization and stability of curcumin-loaded zein-shellac composite colloidal particles[J]. Food Chemistry, 2017, 228: 656-667.DOI:10.1016/j.foodchem.2017.02.001.
[36] CHEN Dong, ZHAO Chunxia, LAGOIN C, et al. Dispersing hydrophobic natural colourant β-carotene in shellac particles for enhanced stability and tunable colour[J]. Royal Society Open Science,2017, 4(12): 170919. DOI:10.1098/rsos.170919.
[37] PHAECHAMUD T, CHANYABOONSUB N, SETTHAJINDALERT O.Doxycycline hyclate-loaded bleached shellac in situ forming microparticle for intraperiodontal pocket local delivery[J]. European Journal of Pharmaceutical Sciences, 2016, 93: 360-370. DOI:10.1016/j.ejps.2016.08.034.
[38] CUI Lei, LIU Zhepeng, YU Dengguang, et al. Electrosprayed core-shell nanoparticles of PVP and shellac for furnishing biphasic controlled release of ferulic acid[J]. Colloid and Polymer Science, 2014, 292(9):2089-2096. DOI:10.1007/s00396-014-3226-8.
[39] MA Ke, QIU Yiping, FU Yaqin, et al. Improved shellac mediated nanoscale application drug release effect in a gastric-site drug delivery system[J]. RSC Advances, 2017, 7(84): 53401-53406. DOI:10.1039/c7ra10757a.
[40] WANG Xia, YU Dengguang, LI Xiaoyan, et al. Electrospun medicated shellac nanofibers for colon-targeted drug delivery[J]. International Journal of Pharmaceutics, 2015, 490(1/2): 384-390. DOI:10.1016/j.ijpharm.2015.05.077.
[41] PEARNCHOB N, SIEPMANN J, BODMEIER R. Pharmaceutical applications of shellac: moisture-protective and taste-masking coatings and extended-release matrix tablets[J]. Drug Development & Industrial Pharmacy, 2003, 29(8): 925-938. DOI:10.1081/ddc-120024188.
[42] WANG Ke, WEN Haifeng, YU Dengguang, et al. Electrosprayed hydrophilic nanocomposites coated with shellac for colon-specific delayed drug delivery[J]. Materials & Design, 2018, 143: 248-255.DOI:10.1016/j.matdes.2018.02.016.
[43] CHINATANGKUL N, LIMMATVAPIRAT C, NUNTHANID J,et al. Design and characterization of monolaurin loaded electrospun shellac nanofibers with antimicrobial activity[J]. Asian Journal of Pharmaceutical Sciences, 2018, 13(5): 459-471. DOI:10.1016/j.ajps.2017.12.006.
[44] 郝清伟, 杨艳玲. 虫胶包覆硝酸铵工艺研究[J]. 粘接, 2015, 36(2):66-68.
[45] XUE Jing, ZHANG Zhibing. Physical, structural, and mechanical characterization of calcium-shellac microspheres as a carrier of carbamide peroxide[J]. Journal of Applied Polymer Science, 2009,113(3): 1619-1625. DOI:10.1002/app.30090.
[46] RAGAVAN M L, DAS N. Process optimization for microencapsulation of probiotic yeasts[J]. Frontiers in Biology, 2018,13(3): 197-207. DOI:10.1007/s11515-018-1495-1.
[47] ESTEVINHO B N, CARLAN I, BLAGA A, et al. Soluble vitamins(vitamin B12 and vitamin C) microencapsulated with different biopolymers by a spray drying process[J]. Powder Technology, 2016,289: 71-78. DOI:10.1016/j.powtec.2015.11.019.
[48] COMUNIAN T A, RAVANFAR R, ALCAINE S D, et al.Water-in-oil-in-water emulsion obtained by glass microfluidic device for protection and heat-triggered release of natural pigments[J].Food Research International, 2018, 106: 945-951. DOI:10.1016/j.foodres.2018.02.008.
[49] ERATTE D, WANG B, DOWLING K, et al. Complex coacervation with whey protein isolate and gum arabic for the microencapsulation of omega-3 rich tuna oil[J]. Food & Function, 2014, 5(11): 2743-2750.DOI:10.1039/c4fo00296b.
[50] RODRIGUEZ Y E, LAITANO M V, PEREIRA N A, et al.Exogenous enzymes in aquaculture: alginate and alginate-bentonite microcapsules for the intestinal delivery of shrimp proteases to Nile tilapia[J]. Aquaculture, 2018, 490: 35-43. DOI:10.1016/j.aquaculture.2018.02.022.
[51] JIA Jiru, WANG Chaoxia, CHEN Kunlin, et al. Drug release of yolk/shell microcapsule controlled by pH-responsive yolk swelling[J].Chemical Engineering Journal, 2017, 327: 953-961. DOI:10.1016/j.cej.2017.06.170.
[52] ACKENBERG M W, KLEINEBUDDE P. Encapsulation of liquids via extrusion: a review[J]. Current Pharmaceutical Design, 2015, 21(40):5815-5828. DOI:10.2174/1381612821666151008150142.
[53] RAMAKRISHNAN S, FERRANDO M, ACEÑA-MUÑOZ L,et al. Influence of emulsification technique and wall composition on physicochemical properties and oxidative stability of fish oil microcapsules produced by spray drying[J]. Food and Bioprocess Technology, 2014, 7(7): 1959-1972. DOI:10.1007/s11947-013-1187-4.
[54] ABULATEEFEH S R, ALKAWAREEK M Y, ABDULLAH F R, et al.Preparation of aqueous core-poly (D,L-lactide-co-glycolide) shell microcapsules with mononuclear cores by internal phase separation:optimization of formulation parameters[J]. Journal of Pharmaceutical Sciences, 2017, 106(4): 1136-1142. DOI:10.1016/j.xphs.2016.12.027.
[55] LAELORSPOEN N, WONGSASULAK S, YOOVIDHYA T, et al.Microencapsulation of Lactobacillus acidophilus in zein-alginate core-shell microcapsules via electrospraying[J]. Journal of Functional Foods, 2014, 7: 342-349. DOI:10.1016/j.jff.2014.01.026.
[56] NGUYEN D K, SON Y M, LEE N E. Hydrogel encapsulation of cells in core-shell microcapsules for cell delivery[J]. Advanced Healthcare Materials, 2015, 4(10): 1537-1544. DOI:10.1002/adhm.201500133.
Recent Progress in the Application Shellac as a Natural Edible Wall Material in the Microencapsulation of Functional Ingredients
HUANG Xue, ZHANG Hui, PENG Shuyue, et al. Recent progress in the application shellac as a natural edible wall material in the microencapsulation of functional ingredients[J]. Food Science, 2019, 40(17): 317-324. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180917-182. http://www.spkx.net.cn