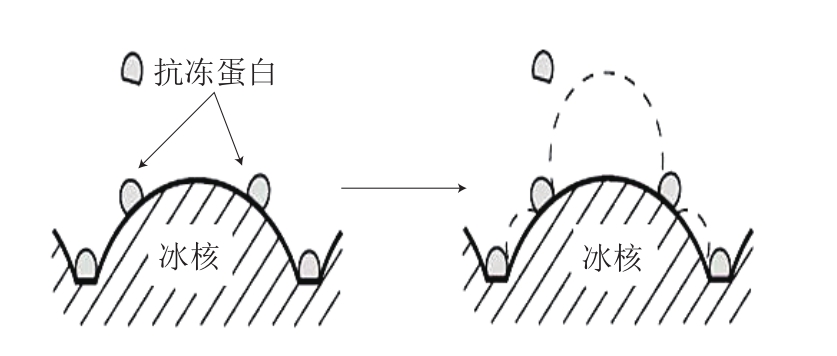
图1 抗冻蛋白与冰晶结合模型图[29]
Fig. 1 Model diagram of AFPs combined with ice crystal[29]
低温冷链技术是长期贮存食物最常见有效的手段之一。而食品在低温冷链中冷冻、贮存、运输和冻融过程导致的冰晶生长和重结晶问题是制约产品品质的关键[1-2]。温度的反复波动使产品不断遭受冰晶生长、冻融和重结晶带来的伤害,损伤细胞和组织结构,从而使产品失去原有的品质,其导致的质量破坏和巨大经济损失越来越受到人们的关注[1]。全球范围内的相关领域科学家正面临严峻的挑战[1-2]:如何控制冰晶生长及重结晶,实现低温冷链过程中抑制产品的冰晶生长,是保证众多食品品质的关键所在。
目前,添加抗冻剂是缓解冷冻食品在冷链过程中品质劣变的有效方法之一。传统食品中的商业抗冻剂多为多聚磷酸盐类、糖类、醇类及其复配物。多聚磷酸盐的添加受到严格限制,添加量偏高时食品有苦涩味,磷酸盐摄入量高会影响人体钙质吸收[3],并且多聚磷酸盐的摄入会加重高血压及慢性肾病患者症状;而蔗糖等糖类抗冻剂由于其热量、甜度高等因素不利于高血糖、糖尿病患者及肥胖人群,从而限制了其使用范围。此外,高浓度的糖醇类及多聚磷酸盐类抗冻剂虽然能减小冷藏过程中形成的冰晶颗粒,但是冷链过程中的温度波动会使小冰晶发生重结晶,冰晶颗粒变大,破坏食品原本的组织结构,造成营养成分流失,同样造成冷冻食品的品质下降[4]。
处于高寒、高海拔地区生物体经过长期自然环境选择,应激性地产生一类活性蛋白——抗冻蛋白(antifreeze protein,AFP),用以抵御外界严寒环境。抗冻蛋白的最大特点就是能吸附在冰晶表面,从而制约冰晶生长,抑制冰晶重结晶,改变冰晶形态,因此抗冻蛋白亦称为冰结构蛋白[5]。伴随着多种抗冻蛋白的发现和研究的深入[6-12],制约天然抗冻蛋白在食品领域中研究和应用的两大关键问题也日益凸显:1)天然分离纯化所得到的抗冻蛋白数量微少,非常有限的数量制约了其在食品工业中的大规模应用前景;2)当科学家致力于转基因技术以扩大生物体来源的抗冻蛋白产量时,转基因抗冻蛋白在食品应用中的安全性顾虑又成为广大消费者、欧盟组织和美国食品药品监督管理局所共同担忧的焦点问题[2,12]。因此,具有高活性的食源性抗冻肽成为近年来的研究热点。本文根据近年来国内外研究的最新报道,综述了抗冻肽研究进展及前景,以期为抗冻肽作为新型抗冻剂的应用提供理论依据。
抗冻蛋白主要来源于高寒、高海拔等极端条件下生长的鱼、昆虫、细菌和植物等生物体内。抗冻蛋白按其来源可分为鱼源抗冻蛋白、昆虫源抗冻蛋白、细菌源抗冻蛋白和植物源抗冻蛋白4 类;按照活性可分为:AFP I~IV、hyperactive-AFP和抗冻糖蛋白[13-17]。天然源抗冻蛋白本身生物体内含量极低、纯化成本高,纯化过程中活性损耗较大,限制了抗冻蛋白的研究与规模化应用。
而抗冻肽主要以食源性蛋白源为原料,通过特异性的酶切位点水解获得,具有可控、高效的制备特点。目前报道的食源性抗冻肽多以食用明胶[18-19]或者动物皮[20-25]、鱼鳞[26]等加工副产物制备得到。有研究报道抗冻肽分子结构一般具有Gly-Pro-x三肽重复序列、GTPG-和GPP(OH)G-结构指纹等结构特征,且一般具有特定的氨基酸序列长度,其分子质量一般小于2 000 Da[21,23-25]。
抗冻蛋白能特异性地降低溶液的冰点而不影响其熔点,这样冰点与熔点间产生的差值称为热滞活性。目前研究结果认为抗冻蛋白主要通过结合到冰晶表面,使得冰晶曲面变大,曲面变大使蒸汽压力升高,导致冰点降低,从而起到降低溶液冰点的作用,也就是所谓的Kelvin效应[27]。Liu Kai等[28]通过分子动力学模拟发现,抗冻蛋白存在Janus效应,即存在“冰结合面”和“非冰结合面”2 种不同面。其中冰结合面能形成一种“类冰”的结构结合在冰核表面,而非冰结合面能抑制冰晶形成。如图1所示,抗冻蛋白一旦结合在冰核表面,新的冰层需跨过非冰结合面空隙,进而冰核表面曲率变大[29-30],所需要越过的能垒就越高,导致局部凝固点亦随之下降,从而使整个体系的冰点下降。

图1 抗冻蛋白与冰晶结合模型图[29]
Fig. 1 Model diagram of AFPs combined with ice crystal[29]
研究表明,抗冻蛋白的抗冻活性片段只存在于局部的特异多肽链结构域,其抗冻活性并不是整体蛋白质在起作用[31-32]。洪晶[22]和Wu Jinhong[33]等同样通过分子动力学模拟发现,具有特定氨基酸长度和结构的胶原抗冻肽能够通过氢键与冰层结合,再通过疏水相互作用协同起到抑制冰晶形成的作用,说明抗冻蛋白的Kelvin效应同样适用于抗冻肽,一样具有热滞活性。

图2 冰晶重结晶示意图[33]
Fig. 2 Diagram of ice recrystallization[33]
当温度低于融点时,冰晶有聚集的趋势,重结晶效应是冰晶间聚集,小冰晶聚集形成大冰晶,如图2所示,在-14~-12 ℃间经过5 次冻融循环后冰晶颗粒明显增多。而抗冻肽的重结晶抑制效应则能够调控冰晶,防止冰晶聚集,使得冰晶的大小和形状得以调控,形成的冰晶细小均匀。在氢键、疏水相互作用和范德华力作用下[34],抗冻肽可以调控冰晶[35-36],降低冰晶对有机体造成的机械损伤[37]。据报道,在生物体内抗冻蛋白的重结晶抑制活性高低相比于热滞活性更为重要。而抗冻蛋白或抗冻肽只需添加极少量就能有较高的重结晶抑制活性[33,38-39]。
当细胞处于结冰或者过冷状态时,细胞周围及内部环境产生的冰晶会对细胞造成机械损伤,冷应激会诱发细胞发生凋亡,进而加速细胞死亡。Hirano[40]、Tatsuro[41]以及Davies[42]等报道了鱼类抗冻蛋白能够保护细胞膜免受低温伤害。Jessie等[43]研究发现在昆虫细胞膜上的部分抗冻蛋白在冰点以下能增强细胞活力。Tomczak等[44]认为抗冻蛋白能与细胞膜上的磷脂基团结合,提高细胞膜相变温度,降低冰晶对细胞膜损伤,进而防止细胞内容物泄漏,维持细胞内外离子平衡,从而提高生物体的抗寒性。Chen Xu[26]和Wang Wenlong[45]等研究发现,抗冻肽同样可能通过与细胞膜上的磷脂双分子层结合(图3),起到保护细胞的作用。

图3 抗冻肽与细胞相互作用模型图[26]
Fig. 3 Schematic illustration of the interaction between antifreeze peptides and cells[26]
基于活性分子氨基酸序列结构,汪少芸[21,23]以及Damodaran[25]等发现抗冻肽分子结构一般具有Gly-Pro-x三肽重复序列和GTPG-、GPP(OH)G-结构指纹等结构特征;进一步结合分子动力学模拟技术,构建了抗冻肽与冰结构分子表面相互作用理论模型,阐明了抗冻肽与冰结构分子的作用机制服从表面亲水-互补作用模式[21-22](图4),即具有特定氨基酸长度和结构的胶原抗冻肽在冰核棱晶面内与水分子形成氢键,多肽分子通过氢键结合于冰核棱晶的表面,分子质量小于2 000 Da的肽链具有足够的亲水性、柔韧性,同时抗冻肽富含的脯氨酸和丙氨酸残基等烷基侧链可以提供部分非极性环境以稳定氢键间的作用,并能够对抗冰-水之间氢键相互作用的竞争性,使之表现出显著的冰晶抑制活性。
此外,Wu Jinhong等[33]应用气相色谱串联质谱技术解析得到来源于丝胶肽的新型抗冻肽SM-AFP的氨基酸序列结构为TTSPTNVSTT,并通过化学合成制备此肽段,结合活性分析和分子模拟分析,确证其具有抗冻活性并且其与冰晶相互作用的主要方式为氢键、疏水相互作用和一些非键相互作用。
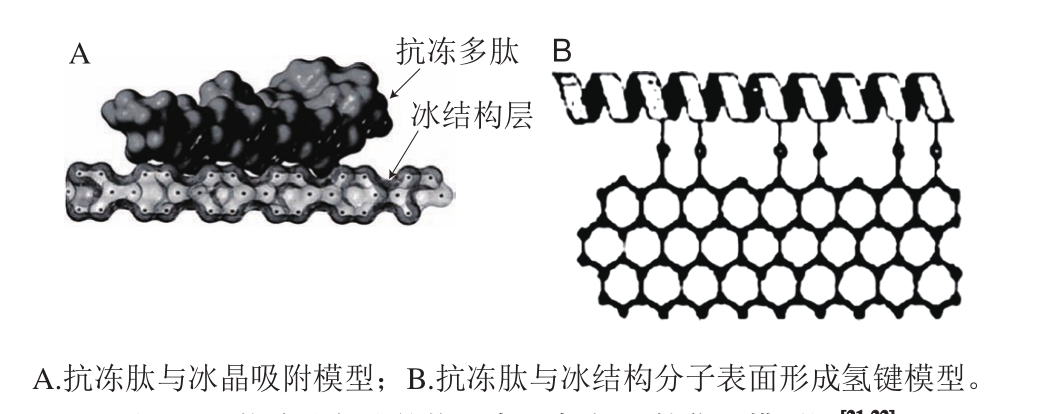
图4 抗冻肽与冰结构层表面亲水-互补作用模型图[21-22]
Fig. 4 Surface hydrophilic-complementary interaction between antifreeze peptides and ice molecules[21-22]
吸附抑制学说最早由Raymond等在1977年提出,他们认为抗冻蛋白吸附在冰晶表面通过Kelvin效应抑制其生长[46]。其机制的模型为:在纯水体系中,冰晶主要沿a轴方向垂直于晶体表面生长(图5A),如果有其他杂质分子吸附于冰晶生长途径的表面,这就需要再外加一推动力促使冰晶在杂质间生长。这种生长结构导致冰晶曲率变大,使边缘的表面积也增大,抑制正常状态下冰晶的生长方向,导致冰晶形态发生变化(图5B)[47-50]。

图5 冰晶生长轨迹
Fig. 5 Trajectory of ice crystal growth
这一学说同样适用于抗冻肽分子,汪少芸[21]和Wu Jinhong[33]等研究发现,具有特定氨基酸长度和结构的抗冻肽,能在冰晶的棱晶面内与水分子形成氢键,通过氢键紧密吸附于冰核表面,从而起到改变冰晶生长轨迹,抑制冰晶生长及重结晶的作用。
随着全球贸易的增长和产销间距的扩大,冷链加工食品的需求也随之增加。冷冻食品在食品工业中所占的份额也日益增长。然而,冷冻食品通常水分含量较高,在冷链过程中水分形成冰晶,冰晶变大及重结晶对冷冻食品所造成的品质下降是冷冻食品所面临的巨大挑战[51]。抗冻肽作为一类新型食品添加剂,可以有效减少冷链过程食品中冰晶的形成和重结晶,从而提高低温冷链食品的品质。
冷藏过程中冰晶的生长是冰淇淋等冷冻产品制造商面临的主要挑战之一,因为在冷藏和处理过程中温度的波动会促进冰晶的生长,影响冰淇淋口感,使产品品质下降。众所周知,冰晶的大小与粗糙程度和/或冰晶结构的形成之间有着直接的密切关系。因此,在冰淇淋生产配方、加工、贮藏和分销条件等环节都必须努力减小冰晶尺寸和减少重结晶的发生,因为冰晶大小及重结晶的形成均会对冰淇淋质地产生较大影响[52-55]。
Wang Shaoyun[18-19]和Damodaran[25]等利用胶原蛋白水解筛分出冰结构肽,经研究发现这类冰结构肽能明显减小冰淇淋中冰晶尺寸,并且通过冷热循环系统模拟冷链过程中的温度波动,发现该类冰结构肽能明显抑制冰淇淋中冰晶重结晶。在-14~-12 ℃之间分别经过7 次和25 次冻融循环的空白组(图6A、C)冰晶尺寸明显大于添加4%冰结构肽的实验组(图6B、D)。

图6 冰结构肽对-14~-12 ℃冻融后冰淇淋冰晶生长的影响[19]
Fig. 6 Effect of ice-structuring peptides on ice crystal growth in an ice cream mix after 7 and 25 freeze-thaw cycles at −14 to −12 ℃[19]
益生菌是食品加工过程中常用的有益菌,也是分子生物学、结构生物学、微生物学和传染病研究的关键载体[56]。菌种长时间的连续培养不仅耗时耗力,而且不切实际,因此,在工业应用和学术研究中通常采用低温保存和冷冻干燥技术[57]。然而,冷应激处理时会发生各种物理化学反应,导致细胞结构破坏,细胞存活率及细胞代谢活力降低等不良现象。如图7所示,细菌、细胞在冷冻及冷冻干燥过程中主要受到的损伤包括:溶质损伤、机械损伤、细胞膜及结构变化、蛋白质和DNA变性5 个方面。此外,大量研究表明,低温保存也可能与细胞凋亡有关[58-62]。低温保存通常需要添加有机溶剂,以减少冰晶形成和生长以及膜破裂和渗透胁迫造成的损害,否则会导致细胞死亡[63]。对于细菌来说,甘油是应用最广泛的低温保护剂,用于缓慢冷冻和玻璃化(取决于甘油浓度),对于哺乳动物细胞,通常使用二甲基亚砜。尽管这些方法非常成功,并在全球范围内得到了应用,但它们同样对细胞具有不可逆损害。典型的低温贮藏需要高质量分数(10%~40%)的有机溶剂,这种有机溶剂可能存在细胞毒性影响并造成不可逆转的细胞损伤[64-65]。
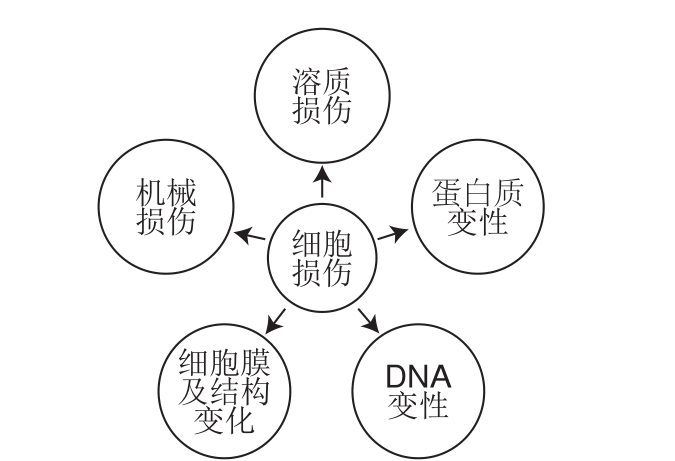
图7 冷冻过程中细胞主要损伤
Fig. 7 Major cell damages during freezing
细胞膜表面通常含有大量的水分,这些水分与磷脂的极性头部PO2-通过氢键结合,在细胞膜上的磷脂双分子层周围形成一层水化层,从而起到维持细胞膜结构及功能的作用。但是在冷冻过程中这部分水会形成冰晶,加速菌体细胞机械损伤。针对这些问题,汪少芸课题组以益生菌为模式菌,筛选得到系列新型抗冻肽,经研究发现,分子质量集中在180~2 000 Da的抗冻肽活性最佳[29]。抗冻肽能显著提高益生菌冷冻存活率、冷冻稳定性和维持菌体细胞代谢活力[66-69]。此外,抗冻肽一方面能与细胞膜通过氢键形式结合保护细胞膜,减少胞内物质泄漏[45];另一方面抗冻肽能进入细胞内,降低冷冻过程中细胞内形成的冰晶对细胞的损伤[26]。
现代冷冻技术是解决传统主食易老化、货架期短等难题的有效手段。然而,长时间的冷链过程中,由于冰晶的长大及小颗粒冰晶的重结晶会导致冷冻面团等制品出现面筋网络结构被破坏的现象,活力酵母细胞受损或死亡,最终导致冷冻面团醒发难,比容减小及产品质构特性下降等劣变[70-72]。因此,近年来学者们试图挖掘各种抗冻剂,用于改善冷冻面团制品的贮藏稳定性,提升冷冻面团制品品质。
抗冻肽或冰结构多肽作为一种新型食品抗冻剂,近年来将其应用于冷冻面团制品低温保藏的相关研究屡见报道。其中,福州大学汪少芸团队、江南大学张晖团队和黄卫宁团队等成功将抗冻肽应用于冷冻面团[73-75]、冷冻马铃薯面团[76-77]。如图8所示,添加抗冻肽后,冷冻面团的发酵时间相比于对照组显著缩短(图8A),冷冻后比容显著高于对照组。此外,研究还发现由添加抗冻肽冷冻面团制作的馒头比容明显高于对照组(图8B)。
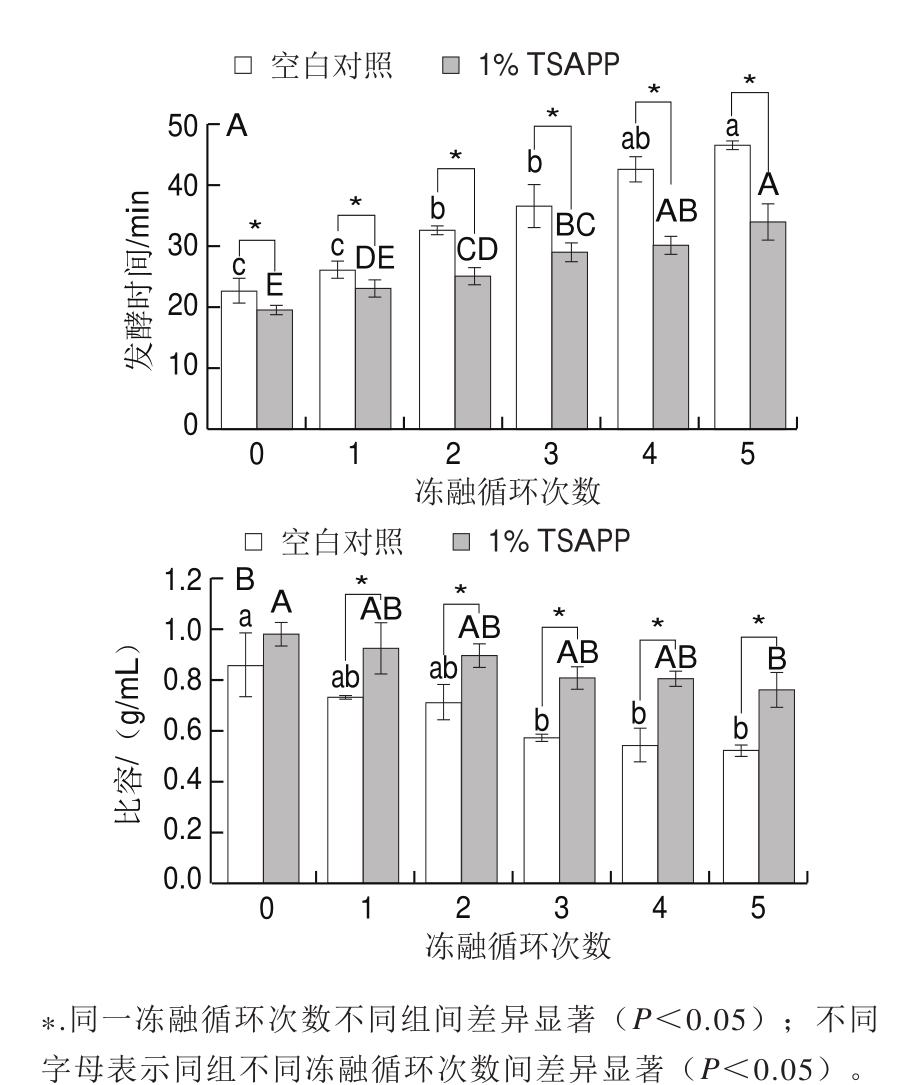
图8 抗冻肽对冷冻面团发酵时间(A)和比容(B)的影响[74]
Fig. 8 Effect of antifreeze peptides on fermentation time (A) and specific volume (B) of frozen dough[74]
目前,全球肉类出口总额超过130亿 美元,冷冻技术在确保供应世界各地肉类产品安全方面发挥着至关重要的作用。然而,冷冻和解冻对肉类品质的影响仍然是一个重大问题[78]。反复冻融主要影响肉的水分含量。由于水分包含在肌肉纤维内部和间隙处,当水分结冰时,剩余溶质(蛋白质、脂类、碳水化合物、矿物质和维生素)的浓度增加,冻结过程和冷链过程中冰晶长大、重结晶,从而破坏了复杂的肉类系统稳态,损害肉类原本的组织结构[78-80]。
李晓坤[81]报道了抗冻肽应用于鱼糜的低温保护作用,在新鲜制备的鱼糜中添加质量分数为2%、4%、8%抗冻肽以及8%商业抗冻剂,于-18 ℃冻藏,测定二硫键含量、巯基含量、表面疏水性、盐溶性蛋白含量、Ca2+-ATPase活力在冻藏过程中的变化,进而研究蛋白质的冷冻变性情况。结果表明,抗冻肽可以抑制鱼糜中二硫键含量和表面疏水性的增加,保留巯基和盐溶性蛋白含量,抑制Ca2+-ATPase活力的降低。其中添加8%抗冻肽的效果最佳,其次是添加4%抗冻肽、8%商业抗冻剂、2%抗冻肽。
添加抗冻剂是降低冷冻食品品质下降的有效途径,而抗冻肽等新型抗冻剂取代传统高糖、高盐商业抗冻剂是随着消费者对生活品质及健康食品需求增长的必然趋势。具有特定肽链长度和结构域组成的食源性抗冻肽是解决天然抗冻蛋白研究和应用受限问题的有效途径。本文综述了近年来基于食源性抗冻肽的研究进展,以期为开发基于食品源的抗冻肽以及探索其在食品领域的广泛应用提供理论研究参考。
[1] HARTEL R W. Crystallization in foods[M]. Gaithersburg: Aspen Publishers Inc., 2001: 374-380.
[2] SUN D W. Emerging technologies for food processing[M].Amsterdam: Elsevier Academic Press, 2005: 468-556. DOI:10.1016/C2012-0-07021-4.
[3] 杨振, 孔保华. 抗冻剂对冷冻鱼糜蛋白理化和凝胶特性的影响综述[J]. 食品科学, 2011, 32(23): 321-325. DOI:10.7506/spkx1002-6630-201123065.
[4] DU L, BETTI M. Identification and evaluation of cryoprotective peptides from chicken collagen: ice-growth inhibition activity compared to that of type I antifreeze proteins in sucrose model systems[J]. Journal of Agricultural and Food Chemistry, 2016, 64(25):5232-5240. DOI:10.1021/acs.jafc.6b01911.
[5] CLARKE C J, BUCKLEY S L, LINDNER N. Ice structuring proteins: a new name for antifreeze proteins[J]. Cryo Letters, 2002, 23(2): 89-92.
[6] MARSHALL C B, FLETCHER G L, DAVIES P L. Hyperactive antifreeze protein in a fish[J]. Nature, 2004, 429: 153. DOI:10.1038/429153a.
[7] GRAHAM L A, MARSHALL C B, LIN F H, et al. Hyperactive antifreeze protein from fish contains multiple ice-binding sites[J].Biochemistry, 2008, 47(7): 2051-2063. DOI:10.1021/bi7020316.
[8] GRAHAM L A, DAVIES P L. Glycine-rich antifreeze proteins from snow fleas[J]. Science, 2005, 310: 461-462. DOI:10.1126/science.1115145.
[9] GRAETHER S P, SYKES B D. Cold survival in freeze-tolerant insects: the structure and function of beta-helical antifreeze proteins[J]. European Journal of Biochemistry, 2004, 271: 3285-3296.DOI:10.1111/j.1432-1033.2004.04256.x.
[10] KONTOGIORGOS V, REGAND A, YADA Y R, et al. Isolation and characterization of ice structuring proteins from cold-acclimated winter wheat grass extract for recrystallization inhibition in frozen foods[J].Journal of Food Biochemistry, 2007, 31: 139-160. DOI:10.1111/j.1745-4514.2007.00112.x.
[11] ZHANG C, ZHANG H, WANG L, et al. Purification of antifreeze protein from wheat bran (Triticum aestivum L.) based on its hydrophilicity and ice-binding capacity[J]. Journal of Agricultural and Food Chemistry, 2007, 55(19): 7654-7658. DOI:10.1021/jf0715065.
[12] GILBERT J A, HILL P J, DODD C E, et al. Demonstration of antifreeze protein activity in antarctic lake bacteria[J]. Microbiology,2004, 150(1): 171-180. DOI:10.1099/mic.0.26610-0.
[13] MOCHIZUKI K, MOLINERO V. Antifreeze glycoproteins bind reversibly to ice via hydrophobic groups[J]. Journal of the American Chemical Society, 2018, 140: 4803-4811. DOI:10.1021/jacs.7b13630.
[14] SICHERI F, YANG D S C. Ice-binding structure and mechanism of an antifreeze protein from winter flounder[J]. Nature, 1995, 375: 427-431. DOI:10.1038/375427a0.
[15] STEFFEN P G, CAROLYN M S, PETER L D, et al. Structure of type I antifreeze protein and mutants in supercooled water[J]. Biophysics,2001, 81(3): 1677-1683. DOI:10.1016/S0006-3495(01)75821-3.
[16] SMOLIN N, DAGGETT V. Formation of ice-like water structure on the surface of an antifreeze protein[J]. Journal of Physical Chemistry B,2008, 112(19): 6193-6202. DOI:10.1021/jp710546e.
[17] WIERZBICKI A, DALAL P, CHEATHAM T E, et al. Antifreeze proteins at the ice/water interface: three calculated discriminating properties for orientation of type I proteins[J]. Biophysical Journal,2007, 93(5): 1442-1451. DOI:10.1529/biophysj.107.105189.
[18] WANG Shaoyun, DAMODARAN S. Ice-structuring peptides derived from bovine collagen[J]. Journal of Agricultural and Food Chemistry,2009, 57(12): 5501-5509. DOI:10.1021/jf900524y.
[19] WANG Shaoyun, AGYARE K, DAMODARAN S. Optimisation of hydrolysis conditions and fractionation of peptide cryoprotectants from gelatin hydrolysate[J]. Food Chemistry, 2009, 115(2): 620-630.DOI:10.1016/j.foodchem.2008.12.079.
[20] 汪少芸, 赵珺, 吴金鸿, 等. 抗冻蛋白的研究进展及其在食品工业中的应用[J]. 北京工商大学学报(自然科学版), 2011, 29(4): 50-57.DOI:10.3969/j.issn.1671-1513.2011.04.013.
[21] 汪少芸, 赵立娜, 周焱富, 等. 食源性明胶多肽的制备、分离及其抗冻活性[J]. 食品科学, 2013, 34(9): 135-139. DOI:10.7506/spkx1002-6630-201309028.
[22] 洪晶, 汪少芸, 吴金鸿, 等. 食品源抗冻多肽的制备及冰晶抑制作用研究[J]. 中国食品学报, 2013, 13(1): 11-18.
[23] WANG Shaoyun, ZHAO Jun, CHEN Lin, et al. Preparation, isolation and hypothermia protection activity of antifreeze peptides from shark skin collagen[J]. LWT-Food Science and Technology, 2014, 55(1):210-217. DOI:10.1016/j.lwt.2013.07.019.
[24] CAO Hui, ZHAO Ying, ZHU Yubing, et al. Antifreeze and cryoprotective activities of ice-binding collagen peptides from pig skin[J]. Food Chemistry, 2016, 194: 1245-1253. DOI:10.1016/j.foodchem.2015.08.102.
[25] DAMODARAN S, WANG S Y. Ice crystal growth inhibition by peptides from fish gelatin hydrolysate[J]. Food Hydrocolloids, 2017,70: 46-56. DOI:10.1016/j.foodhyd.2017.03.029.
[26] CHEN Xu, WU Jinhong, LI Ling, et al. Cryoprotective activity and action mechanism of antifreeze peptides obtained from tilapia scales on Streptococcus thermophilus during cold stress[J].Journal of Agricultural and Food Chemistry, 2019, 67: 1918-1926.DOI:10.1021/acs.jafc.8b06514.
[27] RAYMOND J A, DEVRIESA L A. Adsorption inhibition as a mechanism of freezing resistance in polar fishes[J]. Proceedings of the National Academy of Sciences of the United States of America, 1977,74(6): 2589-2593. DOI:10.1073/pnas.74.6.2589.
[28] LIU Kai, WANG Chunlei, MA Ji, et al. Janus effect of antifreeze proteins on ice nucleation[J]. Proceedings of the National Academy of Sciences, 2016, 113(51): 14739-14744. DOI:10.1073/pnas.1614379114.
[29] TAKAMICHI M, NISHIMIYA Y, MIURA A, et al. Effect of annealing time of an ice crystal on the activity of type III antifreeze protein[J]. FEBS Journal, 2010, 274(24): 6469-6476. DOI:10.1111/j.1742-4658.2007.06164.x.
[30] GAMHARN C P, CAMPBELL R L, DAVIES P L. Anchored clathrate waters bind antifreeze proteins to ice[J]. Proceedings of the National Academy of Sciences, 2011, 108(18): 7363-7367. DOI:10.1073/pnas.1100429108.
[31] NOBEKAWA T, HAGIWARA Y. Interaction among the twelveresidue segment of antifreeze protein, or its mutants, water and a hexagonal ice crystal[J]. Molecular Simulation, 2008, 34(6): 591-610.DOI:10.1080/08927020801986556.
[32] KUN H, MASTAI Y. Activity of short segments of type I antifreeze protein[J]. Biopolymers, 2007, 88(6): 807-814. DOI:10.1002/bip.20844.
[33] WU Jinhong, RONG Yuzhi, WANG Zhengwu, et al. Isolation and characterisation of sericin antifreeze peptides and molecular dynamics modelling of their ice-binding interaction[J]. Food Chemistry, 2015,174(1): 621-629. DOI:10.1016/j.foodchem.2014.11.100.
[34] DAVIES P L, BAARDSNESJ, KUIPER M J, et al. Structure and function of antifreeze proteins[J]. Philosophical Transactions of the Royal Society of London Series B-Biological Sciences, 2002, 357:927-935. DOI:10.1098/rstb.2002.1081.
[35] DALEYM E, SPYRACOPOULOS L, JIA Z C, et al. Structure and dynamics of a β-helical antifreeze protein[J]. Biochemistry, 2002,41(17): 5515-5525. DOI:10.1021/bi0121252.
[36] BAARDSNES J, KUIPER M J, DAVIES P L. Antifreeze protein dimmer, when two ice-binding faces are better than one[J]. Journal Biology Chemistry, 2003, 278(40): 38942-38947. DOI:10.1074/jbc.M306776200.
[37] SWANSON W J, AQUADRO C F. Positive darwinian selection promotes heterogeneity among members of the antifreeze protein multigene family[J]. Journal of Molecular Evolution, 2002, 54(3): 403-410. DOI:10.1007/s00239-001-0030-0.
[38] 江勇, 贾士荣, 费云标, 等. 抗冻蛋白及其在植物抗冻生理中的作用[J]. 植物学报, 1999, 41(7): 677-685. DOI:10.1088/0256-307X/16/12/025.
[39] LI Ling, WU Jinhong, ZHANG Li, et al. Investigation of the physiochemical properties, cryoprotective activity and possible action mechanisms of sericin peptides derived from membrane separation[J].LWT-Food Science and Technology, 2017, 77: 532-541. DOI:10.1016/j.lwt.2016.12.004.
[40] HIRANO Y, NISHIMIYA Y, MATSUMOTO S, et al. Hypothermic preservation effect on mammalian cells of type III antifreeze proteins from notched-fin eelpout[J]. Cryobiology, 2008, 57(1): 46-51.DOI:10.1016/j.cryobiol.2008.05.006.
[41] TATSURO K, MAMI S, AI M, et al. Antifreeze protein prolongs the life-time of insulinoma cells during hypothermic preservation[J]. PLoS ONE, 2013, 8(9): 1-6. DOI:10.1371/journal.pone.0073643.
[42] DAVIES P L, HEW C L. Biochemistry of fish antifreeze proteins[J].FASEB Journal: Official Publication of the Federation of American Societies for Experimental Biology, 1990, 4(8): 2460-2468.DOI:10.1089/dna.1990.9.293.
[43] JESSIE N, JOSEPH E O T, JOHN G D. Expression of a beetle,Dendroides canadensis, antifreeze protein in Drosophila melanogaster[J]. Journal of Insect Physiology, 2006, 52: 888-896.DOI:10.1016/j.jinsphys.2006.05.009.
[44] TOMCZAK M M, HINEHA D K, ESTRADA S D, et al. A mechanism for stabilization of membranes at low temperatures by an antifreeze protein[J]. Biophysical Journal, 2002, 82(2): 874-881. DOI:10.1016/S0006-3495(02)75449-0.
[45] WANG Wenlong, CHEN Mengshi, WU Jinhong, et al. Hypothermia protection effect of antifreeze peptides from pigskin collagen on freeze-dried Streptococcus thermophiles and its possible action mechanism[J]. LWT-Food Science and Technology, 2015, 63(2): 878-885. DOI:10.1016/j.lwt.2015.04.007.
[46] RAYMOND J A, DEVRIES A L. Adsorption inhibition as a mechanism of freezing resistance in polar fishes[J]. Proceedings of the National Academy of Sciences, 1977, 74(6): 2589-2593. DOI:10.1073/pnas.74.6.2589.
[47] FEENEY R E, FINK W H, HALLET J, et al. Investigations of the differential affinity of antifreeze glycoprotein for single crystals of ice[J]. Journal of Crystal Growth, 1991, 113(3/4): 417-429.DOI:10.1016/0022-0248(91)90076-h.
[48] KNIGHT C A, DEVRIES A L, OOLMAN L D. Fish antifreeze protein and the freezing and recrystallization of ice[J]. Nature, 1984, 308: 295-296. DOI:10.1038/308295a0.
[49] WILSON P W, GOULD M, DEVIRIES A L. Hexagonal shaped ice spicules in frozen antifreeze protein solutions[J]. Cryobiology, 2002,44(3): 240-250. DOI:10.1016/s0011-2240(02)00028-7.
[50] GRANDUM S, YABE A, NAKAGOMI K, et al. Analysis of ice crystal growth for a crystal surface containing adsorbed antifreeze proteins[J]. Journal of Crystal Growth, 1999, 205(3): 382-390.DOI:10.1016/S0022-0248(99)00267-5.
[51] MAITY T, SAXENA A, RAJU P S. Use of hydrocolloids as cryoprotectant for frozen foods[J]. Critical Reviews in Food Science and Nutrition, 2018, 58(3): 420-435. DOI:10.1080/10408398.2016.1182892.
[52] ADAPA S, SCHMIDT K A, JEON I J, et al. Mechanisms of ice crystallization and recrystallization in ice cream: a review[J]. Food Reviews International, 2000, 16(3): 259-271. DOI:10.1081/FRI-100100289.
[53] HAASE R, SCHONERT H. Solid-liquid equilibrium[M]. Oxford:Pergamon Press, 1969: 47-81.
[54] HATTEL R W. Mechanisms and kinetics of recrystallization in ice cream[M]. Boston: Springer, 1998: 287-328.
[55] REGAND A, GOFF H D. Effect of biopolymers on structure and ice recrystallization in dynamically frozen ice cream model systems[J].Journal of Dairy Science, 2002, 85(11): 2722-2732. DOI:10.3168/jds.s0022-0302(02)74359-2.
[56] HEYLEN K, HOEFMAN S, VEKEMAN B, et al. Safeguarding bacterial resources promotes biotechnological innovation[J]. Applied Microbiology & Biotechnology, 2012, 94(3): 565-574. DOI:10.1007/s00253-011-3797-y.
[57] REDDY K B P K, AWASTHI S P, MADHU A N, et al. Role of cryoprotectants on the viability and functional properties of probiotic lactic acid bacteria during freeze drying[J]. Food Biotechnology, 2009,23(3): 243-265. DOI:10.1080/08905430903106811.
[58] BAUST J M, VAN BUSKIRK R, BAUST J G. Cell viability improves following inhibition of cryopreservation-induced apoptosis[J]. In Vitro Cellular & Developmental Biology Animal, 2000, 36(4): 262-270.DOI:10.1290/1071-2690(2000)0362.0.CO;2.
[59] MARTIN H, BOURNIQUE B, SARSAT J P, et al. Cryopreserved rat liver slices: a critical evaluation of cell viability, histological integrity,and drug-metabolizing enzymes[J]. Cryobiology, 2000, 41(2): 135-144. DOI:10.1006/cryo.2000.2275.
[60] FU T, GUO D, HUANG X, et al. Apoptosis occurs in isolated and banked primary mouse hepatocytes[J]. Cell Transplantation, 2001,10(1): 59-66. DOI:10.3727/000000001783987043.
[61] YAGI T, HARDIN J A, VALENZUELA Y M, et al. Caspase inhibition reduces apoptotic death of cryopreserved porcine hepatocytes[J]. Hepatology, 2001, 33(6): 1432-1440. DOI:10.1053/jhep.2001.24560.
[62] ZENG C, TANG K, HE L, et al. Effects of glycerol on apoptotic signaling pathways during boar spermatozoa cryopreservation[J].Cryobiology, 2014, 68(3): 395-404. DOI:10.1016/j.cryobiol.2014.03.008.
[63] ZACHARIASSEN K E, KRISTIANSEN E. Ice nucleation and anti-nucleation in nature[J]. Cryobiology, 2000, 41(4): 257-279.DOI:10.1006/cryo.2000.2289.
[64] CAPICCIOTTI C J, KURACH J D, TURNER T R, et al. Small molecule ice recrystallization inhibitors enable freezing of human red blood cells with reduced glycerol concentrations[J]. Scientific Reports,2015, 29(4): 9692. DOI:10.1016/j.tmrv.2015.05.005.
[65] MUHAMMAD H, FAYTER A E R, GIBSON M I. Ice recrystallization inhibiting polymers enable glycerol-free cryopreservation of micro-organisms[J]. Biomacromolecules, 2018, 19: 3371-3376.DOI:10.1021/acs.biomac.8b00660.
[66] WANG S Y, ZHAO J, XU Z B, et al. Preparation, partial isolation of antifreeze peptides from fish gelatin with hypothermia protection activity[J]. Applied Mechanics and Materials, 2012, 140: 411-415.DOI:10.4028/www.scientific.net/AMM.140.411.
[67] 周焱富, 汪少芸, 王文龙, 等. 丝胶肽对乳酸菌冷藏及冷冻干燥的保护作用[J]. 中国食品学报, 2014, 14(7): 150-154.
[68] 颜阿娜, 陈旭, 吴金鸿, 等. 天然抗冻多肽的性质与对乳酸菌的低温胁迫保护作用[J]. 中国食品学报, 2018, 18(10): 38-44.DOI:10.16429/j.1009-7848.2018.10.006.
[69] 王文龙, 陈旭, 饶平凡, 等. 抗冻多肽对嗜热链球菌冷冻干燥的保护作用[J]. 中国食品学报, 2018, 18(7): 116-121. DOI:10.16429/j.1009-7848.2018.07.015.
[70] JIA Chunli, YANG Wwendan, YANG Zixuan, et al. Study of the mechanism of improvement due to waxy wheat flour addition on the quality of frozen dough bread[J]. Journal of Cereal Science, 2017, 75:10-16. DOI:10.1016/j.jcs.2017.03.007.
[71] RIBOTTA P D, LEON A E, ANON M C. Effects of yeast freezing in frozen dough[J]. Cereal Chemistry, 2003, 80(4): 454-458.DOI:10.1094/CCHEM.2003.80.4.454.
[72] SELOMULYO V O, ZHOU W. Frozen bread dough: effects of freezing storage and dough improvers[J]. Journal of Cereal Science,2007, 45(1): 1-17. DOI:10.1016/j.jcs.2006.10.003.
[73] CHEN Xu, WU Jinhong, LI Ling, et al. The cryoprotective effects of antifreeze peptides from pigskin collagen on texture properties and water mobility of frozen dough subjected to freeze-thaw cycles[J].European Food Research and Technology, 2017, 243(7): 1149-1156.DOI:10.1007/s00217-016-2830-x.
[74] 孙丽洁, 张晖, 王立, 等. 鱼皮抗冻多肽的制备及其对冷冻面团热力学性质的影响[J]. 食品与发酵工业, 2017, 43(7): 87-92.DOI:10.13995/j.cnki.11-1802/ts.013469.
[75] 潘振兴, 邹奇波, 黄卫宁, 等. 冰结构蛋白对长期冻藏冷冻面团抗冻发酵特性与超微结构的影响[J]. 食品科学, 2008, 29(8): 39-42.DOI:10.3321/j.issn:1002-6630.2008.08.001.
[76] 李灵, 陈旭, 汪少芸. 冻融循环下抗冻多肽对冷冻马铃薯面团的品质保护及作用机理[J]. 食品科学, 2018, 39(10): 7-13. DOI:10.7506/spkx1002-6630-201810002.
[77] 张莉, 王晨笑, 陈姗姗, 等. 丝胶抗冻肽在马铃薯冷冻馒头中的应用研究[J]. 食品工业科技, 2017, 38(11): 49-54. DOI:10.13386/j.issn1002-0306.2017.11.001.
[78] LEYGONIE C, BRITZ T J, HOFFMAN L C. Impact of freezing and thawing on the quality of meat: a review[J]. Meat Science, 2012,91(2): 93-98. DOI:10.1016/j.meatsci.2012.01.013.
[79] 姜晴晴, 刘文娟, 鲁珺, 等. 冻结与解冻处理对肉类品质影响的研究进展[J]. 食品工业科技, 2015, 36(8): 384-389. DOI:10.13386/j.issn1002-0306.2015.08.072.
[80] 胡宏海, 路立立, 张泓. 肉品冻结解冻及无损检测技术研究现状与展望[J]. 中国农业科技导报, 2015, 17(5): 6-10.
[81] 李晓坤. 利用猪皮明胶制备抗冻多肽及其低温保护作用研究[D].福州: 福州大学, 2013: 52-58.
Recent Progress and Application Prospects of Antifreeze Peptides in Food Industry