
图1 常见的黄酮类化合物的结构[20-21]
Fig. 1 Structures of common flavonoids[20-21]
果蔬中的生物活性物质对人体具有多种生理功能,是当前研究的热点。由于果蔬中生物活性物质具有含量少、易降解等特点,导致其提取难度大。因此,探究生物活性物质的有效提取是加快其产业化、商业化的共识。传统的提取方法有浸渍法、索氏提取法等,利用有机溶剂提取不仅增加生产成本,而且耗时长、耗能高,极易导致生物活性物质的氧化和水解[1]。超声辅助提取作为一种创新型提取技术,具有操作简单、提取效率高、绿色环保、适用性广等优势,被广泛应用于实验室研究,进而逐渐规模化、工业化[2-4]。
超声波在介质中以纵波的形式传输,产生局部压力的变化,导致介质中存在的气核形成空穴气泡,空穴气泡在达到一定尺寸时会变得不稳定进而崩塌,由此产生空化效应[5-7]。空化效应被Thornycroft[8]于1895年首次发现,他发现水下螺旋桨的表面在相对短的运行周期便会出现凹痕,发生腐蚀,进一步研究发现这是由于水动力产生的空穴气泡破裂,在其附近产生强烈的压力和温度梯度造成的。1927年,Richards等[9]首次报道了超声波的机械效应和生物学效应,并发现空化效应可能有利于促进化学反应。1937年,Brohult[10]发现超声波诱导的空化效应会导致生物多聚物的降解。1963年,Lott等[11]首次将植物组织在超声条件下连续处理提取植物中多种活性成分,发现提取效率明显提高。21世纪初,超声增强提取的机理通过超声波破坏植物组织细胞壁、加快释放内含物被证明。同时,植物多酚有益于健康的特性加快了超声提取技术应用于植物活性物质的研究。2004年,Herrera等[12]利用超声从草莓中提取酚类化合物,结果表明超声提取效率明显优于传统浸提法和搅拌法,相比传统浸提法(提取时间2~20 h),超声提取仅需要90 s,这一结论与超声波提取石榴皮中酚类化合物的研究结果[13]相似,超声提取石榴皮中酚类化合物的提取时间缩短了90%,并且其抗氧化活性提高了24%。但温度高于25 ℃的超声条件下,草莓中酚类化合物会发生一定程度的降解。Sun Jianxia等[14]发现增加超声功率(200~500 W)和延长提取时间(0~60 min)会促进声化学效应产生更多的羟自由基,导致花青素降解。因此,合理控制超声波提取参数对酚类化合物的提取具有关键影响。Virot等[15]通过中心复合设计响应面法对超声参数(功率、温度、时间)进行优化,并通过探索固液比、溶剂类型以及中试实验,发现超声提取酚类化合物含量比传统浸提法高20%,证明了规模化超声提取酚类化合物的可能性。超声提取主要依赖于空化效应,空化效应作为超声声学效应中最重要的效应之一,已经被广泛研究报道。此外,超声波还具有其他声学效应,包括毛细效应、破碎效应、湍动效应等,这些效应在提取过程中也发挥了一定作用,但是其作用机理尚不完全清楚,有待进一步研究。
目前,在实验室层面开展了大量关于超声提取技术的研究,已获得的详实数据表明超声技术在未来有广阔的应用潜力和前景,而超声声学效应在果蔬酚类化合物的提取中发挥关键作用。因此,本文主要分析超声声学效应在酚类化合物提取过程中可能产生的增强效果、降解反应等,并探讨超声提取酚类化合物的规模化应用以及未来的发展趋势,从而为超声波辅助提取的参数优化、过程控制及其工业化应用提供依据。
酚类化合物广泛分布于植物界,大约有8 000 种,作为植物的次级代谢物,其在植物体中承担着防御及促进生长发育的作用[16]。酚类化合物在果蔬中的存在形式有游离态和结合态两种,但以游离态酚类化合物的研究居多,结合态的酚类化合物经常忽略不计,因此果蔬中总酚含量的实际值要高于测量值[17]。游离态酚类化合物具有一个或多个带有羟基基团的芳香环,主要分为黄酮类化合物、酚酸、单宁、芪类、木脂素等。其中,以黄酮类化合物种类繁多,迄今已鉴定分离出5 000多种黄酮类化合物[18]。黄酮类化合物主要分为黄酮、黄酮醇、黄烷酮、黄烷醇、异黄酮、花青素[19],C6-C3-C6的三环骨架是黄酮类化合物的基本结构[20-21](图1)。酚酸共有的化学结构是苯环上连有的羧基官能团,主要分为苯甲酸型酚酸(如对羟基苯甲酸和香草酸等)和苯乙烯型酚酸(如咖啡酸、芥子酸和阿魏酸等),其碳骨架的结构特征为C6-C3和C6-C1[21-22](图2),咖啡酸是许多水果和蔬菜中含量最丰富的一种酚酸;另一种常见的酚酸是阿魏酸,它广泛存在于谷物中[23]。酚类化合物主要来源于蓝莓、葡萄、柑橘等果蔬,也可以从果蔬的副产物如葡萄酒中获得[21-24]。果蔬中总酚含量取决于果蔬的成熟程度、气候、土壤成分、贮藏条件等[25]。通常蓝莓和葡萄中的酚类化合物的含量要高于香蕉、荔枝、芒果和柿子,如蓝莓中总酚含量为261.95~929.62 mg/100 g[26],而香蕉中的总酚含量为(90.4±3.2)mg/100 g[17],芒果中的总酚含量则为(56.0±2.1)mg/100 g[27]。

图1 常见的黄酮类化合物的结构[20-21]
Fig. 1 Structures of common flavonoids[20-21]

图2 苯甲酸型酚酸(A)和苯乙烯型酚酸(B)分子结构[22-23]
Fig. 2 Molecular structures of benzoic acid phenolic acids (A) and styrene phenolic acids (B)[22-23]
酚类化合物具有较强的生物活性,通过向自由基传递电子使其丧失氧化性,从而保护人体器官免受伤害,益于人体健康[28]。人体的炎症是由于炎症因子过度分泌造成的,从杨梅中提取分离的硫化酚类化合物可抑制肿瘤坏死因子-α、白细胞介素-1β、白细胞介素-6的分泌和脂多糖诱导的诱导型一氧化氮合酶和环氧合酶-2蛋白的表达,对治疗人体炎症有一定的功效[29]。
酚类化合物的微生物代谢产物对人体也具有生物活性,可抑制泌尿致病性大肠杆菌ATCC®5350对T24上皮细胞的黏附能力[30]。利用超声提取技术从甜菜中提取没食子酸(gallic acid,GA)、氯化氰-3-葡萄糖苷(cyanide-3- glucoside,CGC)和表儿茶素,发现3 种物质均具有较强的抗氧化性,GA的抗氧化活性最强,CGC对人体结肠癌细胞Caco-2、肝癌细胞HepG2和乳腺癌细胞MCF-7均有抑制作用,其抑制活性分别为94.86%、87.27%和67.13%[31]。柑橘中含有较为丰富的类黄酮,一定浓度的类黄酮对抑制A549人肺癌细胞的增殖具有关键作用,能显著增加亚G1(凋亡细胞群)和G2/M期群体数量,造成细胞核凝聚和破碎,说明柑橘类黄酮在治疗人类肺癌方面较为有效[32]。进一步研究发现,不同柑橘品种中结合酚和游离酚对高血糖和高血压相关酶的抑制作用不同,从柠檬中提取的酚类化合物对α-葡萄糖苷酶和血管紧张素转换酶(angiotensin converting enzyme,ACE)的抑制活性为100%,但是,从柑橘中提取的结合酚的水解产物却能诱导ACE和α-淀粉酶的活化,不利于人体健康[33]。黄海智[34]探究了杨梅酚类化合物对人铂耐受型卵巢癌细胞A2780/CP70和OVCAR-3的抑制作用,发现GA、杨梅素和咖啡酸的抑制效果较好,有可能成为治疗卵巢癌的天然活性物质。除了以上所提到的生物活性外,最新研究结果表明酚类化合物还具有抗银屑病[35]、抗乙酰胆碱酶活性[36]等。
超声提取技术已被广泛应用于酚类化合物、色素、果胶等各种生物活性物质的提取,其操作温度低,避免了提取物的热损伤,同时能较好地保持提取物的天然特性,适用于热敏性物质的提取。酚类化合物作为一种热敏性物质,超声提取技术对其提取具有很好的应用价值,提取过程中主要依靠超声波在液体介质中传播所产生的极端理化条件。超声波是一种振动波,在介质中传输会产生一系列声学效应,包括物理效应(振动、剪切力、压力、微射流)和化学效应(空化效应、声化学效应),物理效应具有破碎细胞壁和搅拌的作用,化学效应具有加快反应速率的作用。不同频率的超声波声学效应不同,20~100 kHz的超声波中物理效应占主导地位,100~1 000 kHz的超声波中化学效应占主导地位。
声学效应是对超声波提取机制的总称,其中空化效应被认为是提取机制中的主要效应。超声波在液体中传输时会产生压力起伏,压力的变化被称为超声波的声压,声压分为正压和负压,当负压减小到某个阈值会产生空穴气泡,空穴气泡经过形成、成长到最后崩塌的周期循环的动态变化,产生空化效应(图3)[37]。空化效应可分为稳态空化和瞬态空化,稳态空化中,稳态气泡在多个声周期内均衡振荡,相对稳定,产生微射流等物理现象;瞬态空化中,瞬态气泡在整流扩散或者聚结过程中生长达到共振尺寸,在单个或者更短的声周期内剧烈坍塌产生更多的子气泡,这些子气泡再次迅速崩塌,从而使原始气泡完全湮灭,在作用于提取液和固体基质的交界处时会形成高温(5 000 K)和高压(100 MPa)环境,由此产生极端的物理化学环境[37-38]。高温环境有助于提取物的溶解和扩散,高压环境有助于提取液的渗透和物质转移[39]。同时,超声波在液体中给予质点不同的加速度产生机械效应,如振动波、微射流(速率可达400 km/h)、湍流等,也可促进物质的转移[40]。

图3 超声声学效应的形成过程[37]
Fig. 3 Formation process of ultrasonic acoustic effect[37]
但是,超声波在提取过程中并非只有空化效应和机械效应。Toma等[41]用显微镜观察超声波对蔬菜组织的影响,发现其对蔬菜组织具有明显的破碎作用。Tzanakis等[42]通过熔铝实验证实了超声波的毛细效应。毛细效应会促进溶剂在物料组织中的扩散及可溶性成分的溶解[43-45]。最近,有研究人员综述了超声声学效应对提取物料表现出的腐蚀效应、声孔效应、剪切效应、破碎效应、声毛细效应等方面的研究[46]。腐蚀效应会随着自由基的产生对物料结构造成腐蚀性的破坏;声孔效应可促进细胞膜表面的微孔张大,使内容物释放;剪切效应是空穴气泡崩塌引发微射流产生的,可破坏物料组织表面的油腺结构。其他如湍动效应、界面效应、微扰效应等也发挥了一定作用[47]。上述各声学效应不仅单独作用,在提取过程中也可能产生各种互作效应。尽管各类报道中具体阐述了上述超声提取效应,但是,对于超声提取效应的概念界定、效应区分(是物理效应还是化学效应)以及具体应用方面的相关研究报道仍比较少,因此,探究超声提取机理仍然是研究重点。
声化学效应是超声波在介质中传输时由气泡崩塌引起的化学效应。气泡崩塌时温度达5 000 K,可以破坏分子键,导致水分子分解形成H•和•OH,引发一系列的链式反应。现已开发出多种方法量化声化学效应产生的初级自由基的数量,包括对苯二酸法和碘化物法等,其中碘化物法常用于评估自由基的数量[48]。声化学效应可以通过声化学反应速率公式R=KRM[R•]衡量,其中R表示声化学反应速率/(mol/(L·s)),M表示反应物的浓度/(mol/L),[R•]表示空化效应产生自由基的浓度/(mol/L),KR表示速率常数/((mol/L)1-n/s)。因此控制声化学反应速率可以通过控制反应物的浓度或者自由基的生成来实现[49]。自由基的生成依赖于空化效应,减少介质中溶解的气体会显著增强空化效应[50]。Liu Liyan等[51]通过对比自来水和排气水在超声条件下的空化现象、能量波谱以及空化区域的具体分布,评估了溶液中气体含量对空化强度的影响,结果表明,排气水中空化区域分布更广泛,且强度和广度被显著提高,溶液中氧气质量浓度在3.17~5.02 mg/L时有助于空化气泡的产生。而且,在脱气介质中,超声波衰减较小,气泡的平衡尺寸由于整流扩散而收缩,使得气泡崩塌得更剧烈,从而产生更多的自由基;但是,增加初始反应物浓度会降低自由基的产率[49]。
颗粒尺寸、表面粗糙程度和固体浓度对声化学效应的影响也至关重要,声化学效应的强度随着固体浓度的增加先减少再逐渐增加,随着颗粒尺寸和表面粗糙度的增加而增加[52]。另外,反应物与气泡崩塌所产生的自由基的碰撞概率可以通过影响反应速率常数来影响声化学效应[49]。除上面所提到的因素外,液体高度[53]、换能器类型[54]、pH值[55]等因素也会影响声化学效应。声化学效应在一定程度上有利于活性物质的提取,例如在芒果苷的提取中,声化学效应产生的自由基在25 kHz频率下要高于40 kHz,使得在25 kHz频率下芒果苷的得率较高[56]。但是也需要在一定程度上抑制声化学效应,避免酚类化合物在超声处理条件下羟基化,导致其抗氧化活性发生变化,一般建议在溶液中加入抗坏血酸或醇类物质来猝灭•OH[57]。目前,大部分的研究集中在对所提取酚类化合物的生物活性物质的鉴定以及针对不同提取物料优化提取条件,有关声化学效应在酚类化合物提取中的研究较少,尤其是声化学效应对酚类化合物的增强效应和降解效应。
溶剂提取活性物质通常包括两个阶段[58]:洗涤阶段(快速提取阶段)和扩散阶段(缓慢提取阶段)(图4)。在洗涤阶段,提取速率恒定,溶剂渗透进物料,使细胞质直接暴露于溶剂,促进活性物质向溶剂中扩散;在扩散阶段,植物活性成分直接从物料内部扩散并溶解在溶剂中,这一阶段的提取速率取决于快速提取阶段后细胞的完整性,细胞破碎程度越高,提取速率越快[59]。超声波的机械效应有助于洗涤阶段溶剂的渗透,化学效应有助于提高扩散阶段活性成分的转移速率[60]。Chen Chao等[61]发现,超过90%的酚类化合物在前5 min被提取,10 min后其提取量逐渐趋于平稳,表明提取过程主要在洗涤阶段完成。另外,溶剂会在植物组织表面形成不动层,阻碍洗涤阶段活性成分向溶剂中扩散[58]。超声波可提高细胞的破碎程度并打破物料表面的溶剂不动层,从而达到超声增强提取的效果。相比传统提取法,运用超声提取法从橙皮中提取酚类化合物的产量提升30%[62]。González-Centeno等[63]发现用传统提取法在30~50 ℃下提取产量和超声提取在20~35 ℃的提取产量无显著差异(P>0.05),结果表明,超声提取可以在较低温度下进行,同时不降低提取速率。
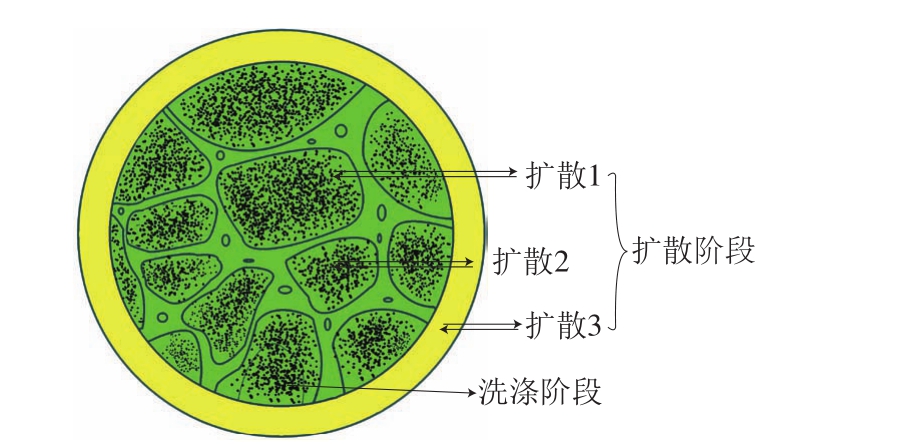
图4 提取过程中的洗涤阶段和扩散阶段[58]
Fig. 4 Washing and diffusion stages in the process of extraction[58]
超声提取能显著提高提取产量并缩短提取时间,但是,在提取过程中受到多重因素的影响,主要分为以下3 个方面:1)提取设备的影响,包括超声功率、超声频率、超声振幅、超声时间等;2)提取介质的影响,包括温度、溶剂、固液比等;3)提取物料的影响,如微粒尺寸。
超声功率诱导的剪切力可以改变物质结构从而提升提取效率,从橙皮中提取酚类化合物时,超声功率对多酚的提取效率影响显著,所优化得到的超声功率为150 W[64];低频率超声波有利于打破细胞壁从而促进可溶物的释放,同时也有利于溶剂渗透进细胞内部,提高活性成分的转移,通过比较不同频率下从马铃薯中提取多酚的效率,发现较低的频率(33 kHz)更有利于多酚的提取[65]。超声波的振幅越高,细胞壁会被打碎得更加充分,用响应面法从马郁兰中提取酚类化合物,结果表明超声振幅对酚类化合物的提取影响最显著,较高的超声振幅会破坏细胞壁释放酚类化合物进入溶液,优化的超声振幅为58~61 μm[66]。超声时间过长引发的热效应会造成酚类化合物的配糖键断裂,从葡萄渣中提取总酚和总黄酮,提取时间显著影响总酚含量,但对总黄酮含量影响不显著,表明酚酸的结构更易受到超声时间的影响,优化的提取时间为25 min[67]。
酚类化合物对高温较为敏感,因此,选择合适的温度范围就显得尤为重要[60],用Box-Behnken响应面法从橘皮中提取酚类化合物,温度在实验中作为独立变量影响橙皮苷的提取,过高温度会造成酚类化合物的降解,优化的提取温度为48 ℃[68]。提取溶剂的选择作为影响提取效率的一个重要因素,需要全面考虑溶剂的特性(例如溶剂的极性、黏性、表面张力、蒸汽压力)、目标提取物的溶解性、极性、提取溶剂的安全性等。乙醇是较为安全的溶剂,但是过高的乙醇体积分数对酚类化合物的提取有负面影响,因此选择较低的乙醇体积分数(61%)作为提取溶剂[69]。当固液比较高时会形成较大的浓度差,有利于物质的转移[70]。从蓝莓酒渣中提取酚类化合物和花青素,固液比极显著影响花青素的产量(P<0.01),优化的固液比为21.70∶1[71]。
一般来说,较小的微粒尺寸有助于提高提取效率,这是因为其可以提高物质的转移速率;然而,过小的微粒尺寸会使微粒漂浮在溶液表面,不利于超声辐射,影响提取效率。Papoutsis等[72]从橘渣中提取橙皮苷和酚酸,微粒尺寸明显影响咖啡酸和对香豆酸的含量,随着微粒尺寸的减小(2.80~1.40 mm),咖啡酸、对香豆酸和橙皮苷的产率显著增加(P<0.05);然而,微粒尺寸对绿原酸的产率影响不显著。
以上着重介绍了超声提取的增强优势以及影响超声提取的因素,其中,超声温度、超声时间、超声功率和超声频率是最重要的影响因素,但这几种超声参数针对不同提取对象的重要性有所差异,即使同一超声提取方法处理几种酚酸,每种酚酸的最佳超声条件也不同,这可能与物料特性、超声波设备类型及超声条件有关,有待进一步研究。部分超声因素对酚类化合物的增强提取结果见表1,综合比较得出超声提取酚类物质的最适工艺条件为:超声温度40 ℃、超声时间30 min、超声功率150 W、超声频率20 kHz。超声提取能明显提高提取效率,但是受内外部因素的影响较大,各因素既可以独立影响酚类化合物的提取效率,也可能会产生交互作用,这就需要对超声因素进行优化。响应面法是一种广泛用于实验条件优化的数学和统计工具,在优化实验中常用响应面法对提取过程中各因素进行分析[73]。超声提取相比传统提取法具有更多优势,但是在提取过程中,由于物料组织以及物料中酚类化合物种类的差异性,限制了超声提取向规模化生产的转变。探索同性质物料的规模化生产以及模块化超声提取设备是未来超声提取的发展趋势。
表1 超声对果蔬酚类化合物的增强提取
Table 1 Summary of published studies on ultrasound-assisted extraction of phenolic compounds from fruits and vegetables
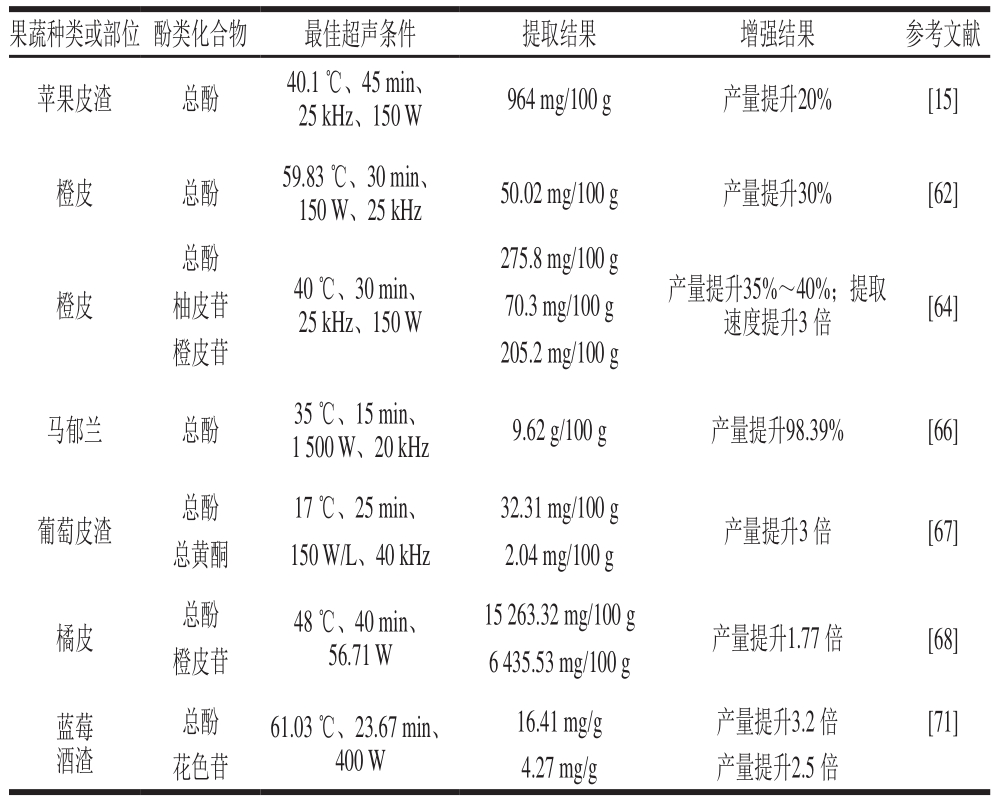
果蔬种类或部位 酚类化合物 最佳超声条件 提取结果 增强结果 参考文献苹果皮渣 总酚 40.1 ℃、45 min、25 kHz、150 W 964 mg/100 g 产量提升20% [15]橙皮 总酚 59.83 ℃、30 min、150 W、25 kHz 50.02 mg/100 g 产量提升30% [62]总酚275.8 mg/100 g橙皮 柚皮苷 70.3 mg/100 g橙皮苷 205.2 mg/100 g 40 ℃、30 min、25 kHz、150 W产量提升35%~40%;提取速度提升3 倍 [64]马郁兰 总酚 35 ℃、15 min、1 500 W、20 kHz 9.62 g/100 g 产量提升98.39% [66]葡萄皮渣 总酚 17 ℃、25 min、 32.31 mg/100 g 产量提升3 倍 [67]总黄酮 150 W/L、40 kHz 2.04 mg/100 g橘皮 总酚 48 ℃、40 min、56.71 W 15 263.32 mg/100 g 产量提升1.77 倍 [68]橙皮苷 6 435.53 mg/100 g蓝莓酒渣16.41 mg/g 产量提升3.2 倍 [71]花色苷 4.27 mg/g 产量提升2.5 倍总酚 61.03 ℃、23.67 min、400 W
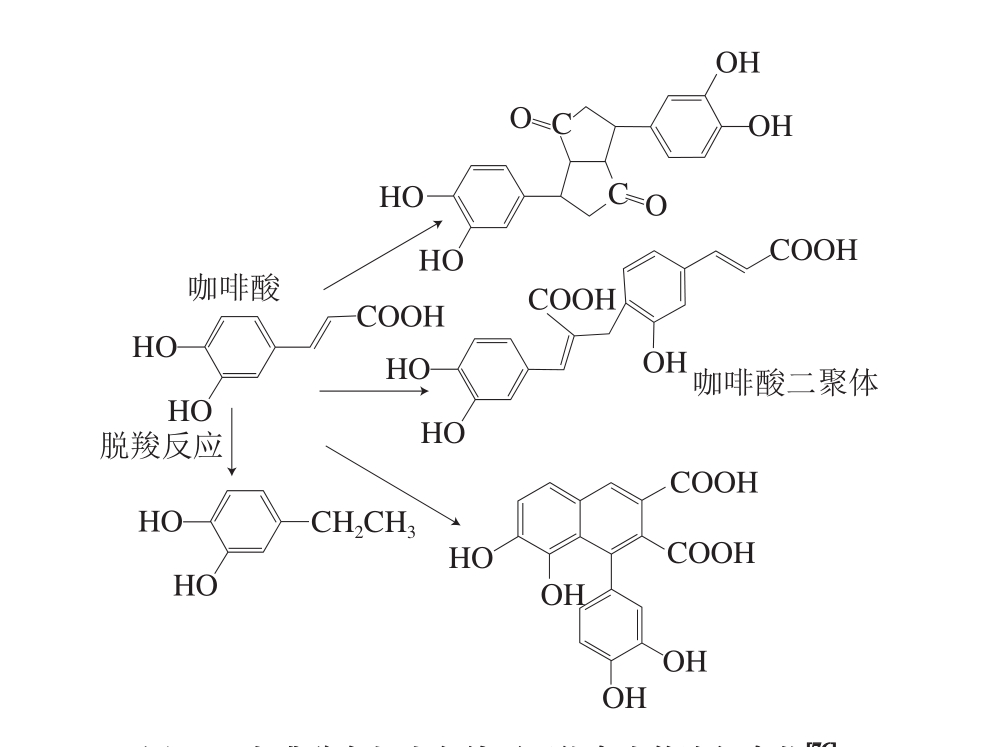
图5 咖啡酸在超声条件下可能产生的降解产物[76]
Fig. 5 Deduced degradation products of caffeic acid under ultrasonic conditions[76]
超声在增强提取效果的同时,已有研究发现经过高温或长时间的超声处理酚类化合物的结构易遭受自由基的破坏,引起酚类化合物的降解。超声处理草莓汁后其花色苷含量和抗坏血酸含量分别降低3.2%和11%[74],这可能是由于其结构遭受自由基的攻击所致。酚类化合物的结构与其稳定性密切相关,其芳香环上羟基的取代数量越多、甲氧基的取代数量越少,酚类化合物就越稳定。在40 ℃、20 min的条件下超声处理柑橘皮渣中的多酚,对香豆酸、对羟基苯甲酸以及咖啡酸均发生降解,对香豆酸和对羟基苯甲酸有一个羟基取代基,而咖啡酸有一个甲氧基取代基,这可能是酚类化合物之间发生多聚反应的结果[75]。随后,Qiao Liping等[76]对酚酸的降解展开进一步探究,在模拟体系中,分析了超声处理5 种酚酸的稳定性,发现咖啡酸在-5 ℃时的降解速率是25 ℃时的7 倍,咖啡酸和芥子酸在-5~25 ℃下的降解动力学都符合零级动力学,通过傅里叶变换红外光谱和电喷雾质谱检测法分析降解产物,发现咖啡酸和芥子酸确实发生了分解反应和多聚反应(图5、6)。最新的研究发现,咖啡酸和芥子酸在25~50 ℃条件下的降解仍然符合零级动力学,而且超声对芥子酸具有更强的声化学效应[77]。
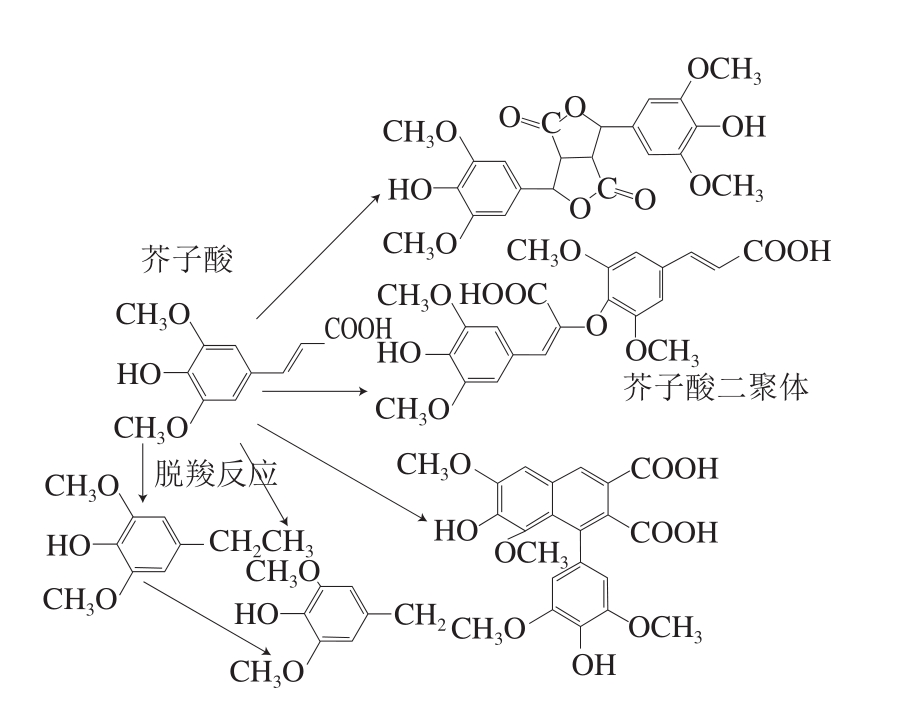
图6 芥子酸在超声条件下可能产生的降解产物[76]
Fig. 6 Deduced degradation products of sinapic acid under ultrasonic conditions[76]
为进一步分析黄酮类化合物在超声条件下的稳定性,选择柑橘中具有代表性的14 种黄酮类化合物(圣草枸橼酸苷、柚皮素芸香苷、新橙皮苷、槲皮苷、圣草酚、香蜂草苷、柚皮素、木犀草素、橙黄酮、川陈皮素、橘皮素、柚皮苷、橙皮苷、槲皮素),经过超声处理后发现有13 种稳定性良好,只有槲皮素在超声处理中同时发生4 种反应:氧化反应、加成反应、聚合反应和分解反应,初步鉴定8 种降解产物是以二聚体、醇加成物、氧化产物和分解产物形式存在的(图7)[78],这可能是自由基诱导产生的降解。
为探明声学效应的自由基对酚类化合物降解产生的影响,在低于21 ℃下对花青素单体矢车菊素-3-葡糖基芸香苷进行超声处理,发现超声明显引起了矢车菊素-3-葡糖基芸香苷降解,并导致其紫外-可见光谱、视觉颜色和抗氧化能力的变化;同时,矢车菊素-3-葡糖基芸香苷的浓度与自由基的产量呈负相关,降解动力学符合一级动力学[79]。由表2可知,酚类化合物在超声环境下易降解与介质温度和自由基关系密切,较低温度如-5 ℃下,咖啡酸和芥子酸降解15%~20%,槲皮素降解约59%,这可能是低温产生大量的自由基所致。虽然较高温度不利于空化效应的发生,减少了自由基的生成量,但是会引起酚类化合物的热降解。因此,明确自由基与酚类化合物的剂量-效应关系,对优化评估超声提取条件以及工业化生产具有一定意义。
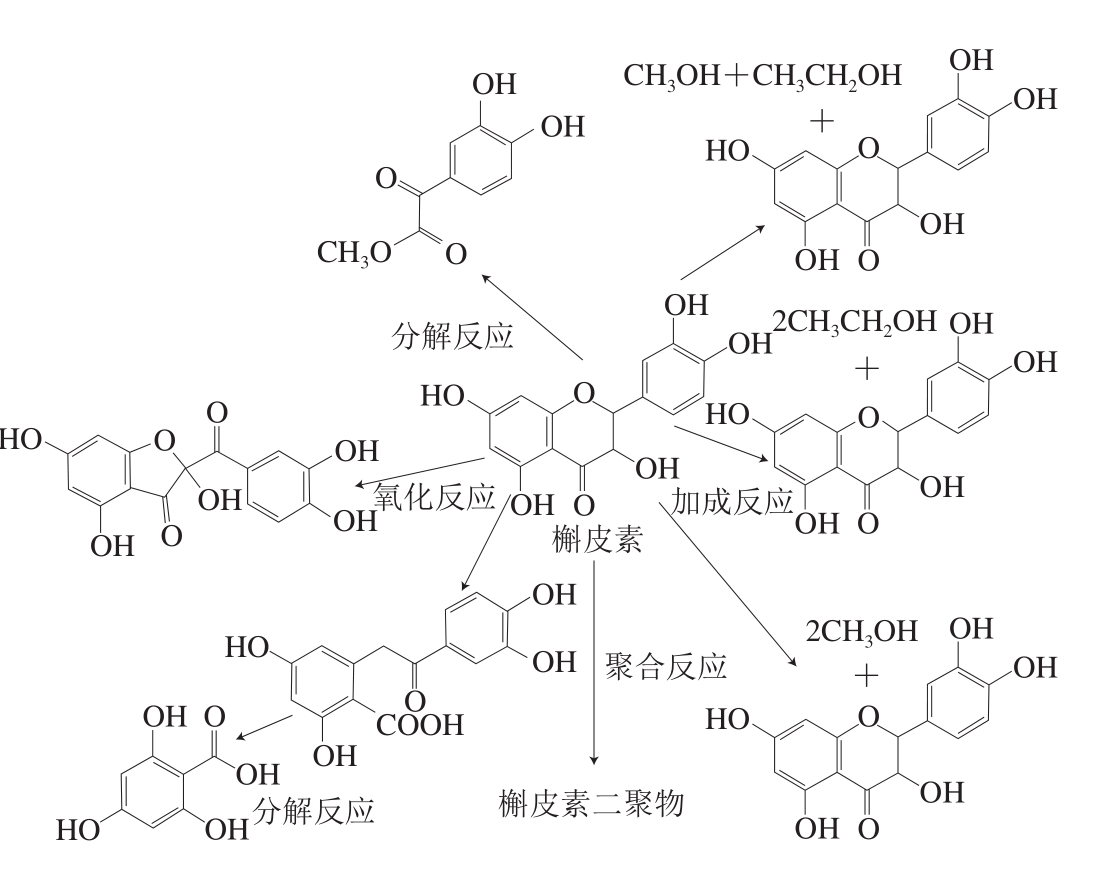
图7 槲皮素在超声条件下可能产生的降解产物[78]
Fig. 7 Deduced degradation products of quercetin under ultrasonic conditions[78]
表2 超声对酚类化合物的降解作用
Table 2 Degradation of phenolic compounds under ultrasonic conditions

研究体系 酚类化合物 最大降解超声条件 降解结果 降解原因 参考文献真实体系(草莓汁) 花色苷 25 ℃、10 min、20 kHz 降低3.2% 未明 [74]咖啡酸 降低42%真实体系(橘皮) 对香豆酸 降低19%阿魏酸 降低44%模拟体系 咖啡酸 -5 ℃、60 min、20~25 kHz 40 ℃、20 min、60 kHz 多聚反应 [75]降低15% 形成二聚物 [76]芥子酸 降低20%模拟体系 咖啡酸 10 ℃、60 min 降低11.3% 芥子酸更易降解形成二聚物 [77]芥子酸 降低9.3%模拟体系 槲皮素 -5 ℃、60 min、20~25 kHz 降低59% 二聚物、氧化产物、醇加成产物、分解产物 [78]模拟体系 矢车菊素-3-葡糖基芸香苷21 ℃、60 min、25 kHz 降低44.2% 自由基可能对酚类化合物降解有影响 [79]
超声应用于食品加工辅助技术,具有高效率、低投资和绿色环保等特点,商业应用前景广泛,研制大型超声提取设备是实现工业化应用的关键环节。超声辅助提取设备主要有超声浴设备(图8A、B)和超声探针设备(图8C)两类[80],其中换能器(压电类型和磁致伸缩类型)是超声波工作的核心部件,换能器的位置、类型、功率强度影响提取效率和能量利用。超声浴设备的换能器通常安置在超声浴底部或者侧部,优点是避免直接接触样液,物料无污染;但缺点是超声能量损耗多,降低了有效超声功率[80]。超声探针设备的探针直径在5 mm~1.5 cm之间,一般由金属钛制成,可产生高强度的空化效应,但是探针设备与样液直接接触易发生腐蚀和金属粒脱落,引起物料污染。综合考虑提取效率和能量损失,超声探针设备优于超声浴设备[61]。

图8 超声浴设备(A、B)和超声探针设备(C)[80]
Fig. 8 Ultrasonic bath equipment (A and B) and ultrasonic probe equipment (C)[80]
超声场会随着传播距离增长迅速衰减,并且几乎大部分能量在换能器附近被消耗,很大程度上限制了超声提取从实验室向工业化生产的转变。Zhai Wei等[81]在液体中应用正交超声的方法,通过求解亥姆霍兹方程,发现3 束超声的交互作用是可以实现的,且在三维超声中,其最大声压是一维的6.4 倍,平均声能密度是一维的15 倍,空化体积从一维的18%扩大到三维的67%。目前,德国Hielscher公司、法国REUS公司和我国济宁双和超声设备有限公司主要研制大型超声提取设备。使用法国REUS公司生产的PEX3超声浴设备进行多酚的中试实验(图9),提取容量为30 L,配备4 个超声频率25 kHz的超声换能器,超声功率为200 W,中试结果得到多酚产量比传统浸提法高20%[15]。Pingret等[82]以水为提取溶剂,探究了超声辅助水提取多酚的工业化应用,结果表明多酚提取量(560 mg/100 g)比传统浸提法提高了15%。Alexandru等[83]应用一种多重超声连续提取设备从干丁香花蕾中提取丁香油,使用乙醇溶液作为提取溶剂,功率强度为700 W/L,流动模式分别选择450、900、1 350 mL/min,结果表明在1 350 mL/min流动模式下得到较高的总酚含量和抗氧化活性。超声提取设备的不断改进提高了超声能量的利用率,加速了超声提取的工业化应用。但是,超声提取的过程较为复杂,在实验室中探索的条件与工业化应用的条件呈非线性关系,仍然存在诸多问题,例如实验室与工业化应用中超声声场的差异性、大规模生产中空化区域的分布、高强度超声条件下超声探针的腐蚀问题等,均尚待解决。

图9 30 L PEX3超声浴设备[15]
Fig. 9 Thirty-liter ultrasonic bath equipment (PEX3)[15]
在酚类化合物的超声提取中,一般要涉及到有机溶剂的使用,由于有机溶剂的安全性、污染性等问题,使得开发以水为溶剂的超声提取方法引起广泛关注[84]。水作为最环保的提取介质,具有良好的理化性质,在超声波提取中已被研究[63,85]。为证明水作为提取溶剂的可靠性,Goldsmith等[86]运用超声波辅助提取法从橄榄渣中提取酚类化合物,利用响应面法对超声功率、提取时间和固液比3 因素进行了优化,得到最优的提取条件为:超声功率为250 W、提取时间75 min、固液比为1∶50,其总酚含量为19.71 mg/g、1,1-二苯基-2-三硝基苯肼清除能力为31.23 mg/g,比传统提取法总酚含量高20%。Papoutsis等[72]采用超声辅助水提法从柑橘渣中提取橙皮苷和酚酸(对香豆酸、咖啡酸、绿原酸),分析了微粒尺寸、提取时间、提取温度和超声功率4 个参数对橙皮苷和3 种酚酸提取率的影响,发现微粒尺寸显著影响对香豆酸、咖啡酸和橙皮苷的提取率,微粒尺寸为1.40 mm时,对香豆酸和咖啡酸的回收率最高(分别为0.25、0.58 mg/g);微粒尺寸为2.00 mm和1.40 mm时,橙皮苷的提取率最高(分别为6.44、6.27 mg/g);提取温度对3 种酚酸的提取率无显著影响,提取时间和超声功率对酚类化合物的提取和抗氧化活性均无影响。除了超声辅助水提法,还有一些新型提取方法,包括超声负压提取法[87]、超声辅助水酶提取法[84]、超声辅助离子液体提取法[88]。综上可知,优化以水为提取溶剂从果蔬中提取酚类化合物的参数不仅能提高提取率,更重要的是能保证提取物的安全性,因此,优化以水为提取溶剂的超声参数非常必要。
超声辅助提取作为一种具有应用前景的技术,已被国内外广泛报道。超声波的声学效应产生的机械效应和空化效应能够引起植物细胞壁破碎,通过超声清洗作用加快释放内含物,增强了提取效率。超声辅助提取作为一种环境友好型技术,在提取过程中有助于降低能耗、减少污染,已对动物、植物、微生物等开展各类生物活性物质提取的研究。酚类化合物作为植物的次级代谢物,具有各种生物活性,有益人体健康。利用超声提取可使产率提高2~3 倍,有效缩短提取时间至30 min,很大程度上克服了传统提取技术的缺点。但是酚类化合物具有热不稳定性,在提取过程中易发生降解,可通过优化超声参数有效控制降解,得到目标酚类物质。此外,超声波的声化学效应产生的自由基对酚类化合物的提取具有双重作用,自由基过多会导致酚类化合物的降解,过少不利于酚类化合物的提取,超声温度、超声时间、超声频率是影响自由基产量的重要参数,提取时可根据物料特性、设备类型、超声参数有效范围等全面考虑。此外,对自由基与酚类化合物之间的剂量-效应关系的研究仍然较少,因此,关注超声参数对自由基和酚类化合物产量的影响,探究选择合适抗氧化剂消除自由基对酚类化合物的影响将是本领域的研究的难点和重点。近几年,由于科技的发展、人们对健康的关注以及对交叉学科的重视,推进了超声提取技术联合其他技术优化提取效果的新趋势如超声负压提取、超声辅助水提取、超声-微波或超声-高压联合提取等的发展,这是对超声辅助提取技术的升华和创新,也是研究人员追求最优提取工艺、提高提取效率的体现。安全、优质、高效、环保必将是该领域未来的研究趋势,也是实现超声提取工业化的关键。
[1] PORTO C D, PORRETTO E, DECORTI D. Comparison of ultrasound-assisted extraction with conventional extraction methods of oil and polyphenols from grape (Vitis vinifera L.) seeds[J].Ultrasonics sonochemistry, 2013, 20(4): 1076-1080. DOI:10.1016/j.ultsonch.2012.12.002.
[2] CHEN W, WANG W P, ZHANG H S, et al. Optimization of ultrasonicassisted extraction of water-soluble polysaccharides from Boletus edulis, mycelia using response surface methodology[J]. Carbohydrate Polymers, 2012, 87(1): 614-619. DOI:10.1016/j.carbpol.2011.08.029.
[3] KAMALJIT V, RAYMOND M, LLOYD S, et al. Applications and opportunities for ultrasound assisted extraction in the food industry: a review[J]. Innovative Food Science and Emerging Technologies, 2008,9(2): 161-169. DOI:10.1016/j.ifset.2007.04.014.
[4] AL-DHABI N A, PONMURUGAN K, MARAN J P. Development and validation of ultrasound-assisted solid-liquid extraction of phenolic compounds from waste spent coffee grounds[J].Ultrasonics Sonochemistry, 2017, 34: 206-213. DOI:10.1016/j.ultsonch.2016.05.005.
[5] FENG H, BARBOSA-CANOVAS G, WEISS J. Ultrasound technologies for food and bioprocessing[M]. New York: Springer,2011: 1-7. DOI:10.1007/978-1-4419-7472-3.
[6] WANG W J, CHEN W J, ZOU M M, et al. Applications of power ultrasound in oriented modification and degradation of pectin:a review[J]. Journal of Food Engineering, 2018, 234: 98-107.DOI:10.1016/j.jfoodeng.2018.04.016.
[7] 廖建庆. 超声波天然物提取过程建模、频率优化及应用研究[D]. 无锡: 江南大学, 2017: 3-6.
[8] THORNYCROFT J I. Torpedo boat destroyers[J]. Journal of the American Society for Naval Engineers, 1895, 7: 711-736.DOI:10.1111/j.1559-3584.1895.tb04389.x.
[9] RICHARDS W T, LOOMIS A L. The chemical effects of high frequency sound waves I. a preliminary survey[J]. Journal of the American Chemical Society, 1927, 49(12): 3086-3100. DOI:10.1021/ja01411a015.
[10] BROHULT S. Splitting of the hæmocyanin molecule by ultra-sonic waves[J]. Nature, 1937, 140: 805-805. DOI:10.1038/140805a0.
[11] LOTT J A, DEMAGGIO A E. Continuous extraction during treatment with ultrasound[J]. Science, 1963, 139: 825-826. DOI:10.1126/science.139.3557.825.
[12] HERRERA M C, CASTRO L D. Ultrasound-assisted extraction for the analysis of phenolic compounds in strawberries[J]. Analytical and Bioanalytical Chemistry, 2004, 379(7/8): 1106-1112. DOI:10.1007/s00216-004-2684-0.
[13] PAN Z L, QU W J, MA H L, et al. Continuous and pulsed ultrasoundassisted extractions of antioxidants from pomegranate peel[J].Ultrasonics Sonochemistry, 2011, 18(5): 1249-1257. DOI:10.1016/j.ultsonch.2011.01.005.
[14] SUN Jianxia, MEI Zhouxiong, TANG Yajuan, et al. Stability,antioxidant capacity and degradation kinetics of pelargonidin-3-glucoside exposed to ultrasound power at low temperature[J].Molecules, 2016, 21(9): 1109. DOI:10.3390/molecules21091109.
[15] VIROT M, TOMAO V, LE B C, et al. Towards the industrial production of antioxidants from food processing by-products with ultrasound-assisted extraction[J]. Ultrasonics Sonochemistry, 2010,17(6): 1066-1074. DOI:10.1016/j.ultsonch.2009.10.015.
[16] CAROCHO M, FERREIRA I C. The role of phenolic compounds in the fight against cancer: a review[J]. Anticancer Agents in Medicinal Chemistry, 2013, 13(8): 1236-1258. DOI:10.2174/18715206113139990301.
[17] CHU Y F, SUN J, WU X, et al. Antioxidant and antiproliferative activities of common vegetables[J]. Journal of Agricultural and Food Chemistry, 2002, 50(23): 6910-6916. DOI:10.1021/jf020665f.
[18] LAMPILA P, VAN LIESHOUT M, GREMMEN B, et al. Consumer attitudes towards enhanced flavonoid content in fruit[J]. Food Research International, 2009, 42(1): 122-129. DOI:10.1021/jf020665f.
[19] ROBBINS R J. Phenolic acids in foods: an overview of analytical methodology[J]. Journal of Agricultural and Food Chemistry, 2003,51(10): 2866-2887. DOI:10.1021/jf026182t.
[20] 郎宇曦, 马岩, 李斌, 等. 黄酮类化合物与其他化合物相互作用的研究进展[J]. 食品科学, 2018, 39(9): 258-264. DOI:10.7506/spkx1002-6630-201809039.
[21] BALASUNDRAM N, SUNDRAM K, SAMMAN S. Phenolic compounds in plants and agri-industrial by-products: antioxidant activity, occurrence, and potential uses[J]. Food Chemistry, 2006,99(1): 191-203. DOI:10.1016/j.foodchem.2005.07.042.
[22] STALIKAS C D. Extraction, separation, and detection methods for phenolic acids and flavonoids[J]. Journal of Separation Science, 2007,30(18): 3268-3295. DOI:10.1002/jssc.200700261.
[23] D’ARCHIVIO M, FILESI C, DI BENEDETTO R, et al. Polyphenols,dietary sources and bioavailability[J]. Annali Dellistituto Superiore di Sanità, 2007, 43(4): 348-361.
[24] GUTIERREZ-GRIJALVA E P, AMBRIZ-PERE D L, LEYVA-LOPEZ N,et al. Review: dietary phenolic compounds, health benefits and bioaccessibility[J]. Archivos Latinoamericanos de Nutrición, 2016,66(2): 87-100.
[25] MEDINA-TORRES N, AYORA-TALAVERA T, ESPINOSAANDREWS H, et al. Ultrasound assisted extraction for the recovery of phenolic compounds from vegetable sources[J]. Agronomy-Basel,2017, 7(3): 1-19. DOI:10.3390/agronomy7030047.
[26] SELLAPPAN S, AKOH C C, KREWER G. Phenolic compounds and antioxidant capacity of Georgia-grown blueberries and blackberries[J].Journal of Agricultural and Food Chemistry, 2002, 50(8): 2432-2438.DOI:10.1021/jf011097r.
[27] LUXIMON-RAMMA A, BAHORUN T, CROZIER A. Antioxidant actions and phenolic and vitamin C contents of common Mauritian exotic fruits[J]. Journal of the Science of Food and Agriculture, 2003,83(5): 496-502. DOI:10.1002/jsfa.1365.
[28] SHAHIDI F, AMBIGAIPALAN P. Phenolics and polyphenolics in foods, beverages and spices: antioxidant activity and health effects: a review[J]. Journal of Functional Foods, 2015, 18: 820-897.DOI:10.1016/j.jff.2015.06.018.
[29] KIM H H, OH M H, PARK K J, et al. Anti-inflammatory activity of sulfate-containing phenolic compounds isolated from the leaves of Myrica rubra[J]. Fitoterapia, 2014, 92(2): 188-193. DOI:10.1016/j.fitote.2013.10.007.
[30] DE LLANO D, ESTEBAN-FERNÁNDEZ A, SÁNCHEZ-PATÁN F,et al. Anti-adhesive activity of cranberry phenolic compounds and their microbial-derived metabolites against uropathogenic Escherichia coli in bladder epithelial cell cultures[J]. International Journal of Molecular Sciences, 2015, 16(6): 12119-12130. DOI:10.3390/ijms160612119.
[31] CHEN M S, MENG H C, ZHAO Y, et al. Antioxidant and in vitro anticancer activities of phenolics isolated from sugar beet molasses[J].BMC Complementary and Alternative Medicine, 2015, 15: 1-8.DOI:10.1186/s12906-015-0847-5.
[32] ARULKUMAR N, JEONG L H, GOWDA S V V, et al. Flavonoids isolated from Citrus platymamma induced G2/M cell cycle arrest and apoptosis in A549 human lung cancer cells[J]. Oncology Letters, 2016,12(2): 1394-1402. DOI:10.3892/ol.2016.4793.
[33] ALU’DATT M H, RABABAH T, ALHAMAD M N, et al. Profiles of free and bound phenolics extracted from Citrus fruits and their roles in biological systems: content, and antioxidant, anti-diabetic and antihypertensive properties[J]. Food & Function, 2017, 8(9): 3187-3197.DOI:10.1039/c7fo00212b.
[34] 黄海智. 杨梅酚类化合物抗氧化和抗癌功能及机理研究[D]. 杭州:浙江大学, 2015: 2-4.
[35] KANNIKA S, WORANAN N, MICHAEL H, et al. Effect of drying methods and solvent extraction on the phenolic compounds of Gynura pseudochina (L.) DC. leaf extracts and their anti-psoriatic property[J].Industrial Crops and Products, 2018, 120: 34-46. DOI:10.1016/j.indcrop.2018.04.020.
[36] KUŹNIEWSKI R, ZAŁUSKI D, OLECH M, et al. LC-ESI-MS/MS profiling of phenolics in the leaves of Eleutherococcus senticosus cultivated in the west Europe and anti-hyaluronidase and antiacetylcholinestarase activities[J]. Natural Product Research, 2018,32(4): 448-452. DOI:10.1080/14786419.2017.1308369.
[37] KUMARI B, TIWARI B K, HOSSAIN M B, et al. Recent advances on application of ultrasound and pulsed electric field technologies in the extraction of bioactives from agro-industrial by-products[J]. Food and Bioprocess Technology, 2018, 11(2): 223-241. DOI:10.1007/s11947-017-1961-9.
[38] ASHOKKUMAR M, LEE J, KENTISH S, et al. Bubbles in an acoustic field: an overview[J]. Ultrasonics Sonochemistry, 2007, 14(4): 470-475. DOI:10.1016/j.ultsonch.2006.09.016.
[39] LEONG T, ASHOKKUMAR M, KENTISH S. The fundamentals of power ultrasound: a review[J]. Acoustics Australia, 2011, 39(2): 54-63.
[40] CHANDRAPALA J, OLIVER C M, KENTISH S, et al. Use of power ultrasound to improve extraction and modify phase transitions in food processing[J]. Food Reviews International, 2013, 29(1): 67-91. DOI:10.1080/87559129.2012.692140.
[41] TOMA M, VINATORU M, PANIWNYK L, et al. Investigation of the effects of ultrasound on vegetal tissues during solvent extraction[J].Ultrasonics Sonochemistry, 2001, 8(2): 137-142. DOI:10.1016/S1350-4177(00)00033-X.
[42] TZANAKIS I, XU W W, ESKIN D G, et al. In situ observation and analysis of ultrasonic capillary effect in molten aluminium[J].Ultrasonics Sonochemistry, 2015, 27: 72-80. DOI:10.1016/j.ultsonch.2015.04.029.
[43] MASON T J. Some neglected or rejected paths in sonochemistry: a very personal view[J]. Ultrasonics Sonochemistry, 2015, 25: 89-93.DOI:10.1016/j.ultsonch.2014.11.014.
[44] SIRÓ I, VÉN C, BALLA C, et al. Application of an ultrasonic assisted curing technique for improving the diffusion of sodium chloride in porcine meat[J]. Journal of Food Engineering, 2009, 91(2): 353-362.DOI:10.1016/j.jfoodeng.2008.09.015.
[45] OZUNA C, PUIG A, GARCÍAPÉREZ J V, et al. Influence of high intensity ultrasound application on mass transport, microstructure and textural properties of pork meat (longissimus dorsi) brined at different NaCl concentrations[J]. Journal of Food Engineering, 2013, 119(1):84-93. DOI:10.1016/j.jfoodeng.2013.05.016.
[46] CHEMAT F, ROMBAUT N, SICAIRE A G, et al. Ultrasound assisted extraction of food and natural products. mechanisms,techniques, combinations, protocols and applications. a review[J].Ultrasonics Sonochemistry, 2017, 34: 540-560. DOI:10.1016/j.ultsonch.2016.06.035.
[47] 李珂昕. 逆流超声波辅助提取过程的计算机仿真模拟研究[D]. 镇江: 江苏大学, 2017: 5-6.
[48] KODA S, KIMURA T, KONDO T, et al. A standard method to calibrate sonochemical efficiency of an individual reaction system[J].Ultrasonics Sonochemistry, 2003, 10(3): 149-156. DOI:10.1016/S1350-4177(03)00084-1.
[49] SIVASANKAR T, PAUNIKAR A W, MOHOLKAR V S. Mechanistic approach to enhancement of the yield of a sonochemical reaction[J].AIChE Journal, 2007, 53(5): 1132-1143. DOI:10.1002/aic.11170.
[50] MOHOLKAR V S, WARMOESKERKEN M M C G. Integrated approach to optimization of an ultrasonic processor[J]. AIChE Journal,2003, 49(11): 2918-2932. DOI:10.1002/aic.690491121.
[51] LIU Liyan, YANG Yang, LIU Penghong, et al. The influence of air content in water on ultrasonic cavitation field[J].Ultrasonics Sonochemistry, 2014, 21(2): 566-571. DOI:10.1016/j.ultsonch.2013.10.007.
[52] STOIAN D, ESHTIAGHI N, WU J, et al. Intensification of sonochemical reactions in solid-liquid systems under fully suspended condition[J]. Chemical Engineering & Processing Process Intensification, 2018, 123: 34-44. DOI:10.1016/j.cep.2017.10.025.
[53] LIM M, ASHOKKUMAR M, SON Y. The effects of liquid height volume, initial concentration of reactant and acoustic power on sonochemical oxidation[J]. Ultrasonics Sonochemistry, 2014, 21(6):1988-1993. DOI:10.1016/j.ultsonch.2014.03.005.
[54] WOOD R J, LEE J, BUSSEMAKER M J. A parametric review of sonochemistry: control and augmentation of sonochemical activity in aqueous solutions[J]. Ultrasonics Sonochemistry, 2017, 38: 351-370.DOI:10.1016/j.ultsonch.2017.03.030.
[55] WEI Z, SPINNEY R, KE R, et al. Effect of pH on the sonochemical degradation of organic pollutants[J]. Environmental Chemistry Letters,2016, 14(2): 163-182. DOI:10.1007/s10311-016-0557-3.
[56] KULKARNI V M, RATHOD V K. Mapping of an ultrasonic bath for ultrasound assisted extraction of mangiferin from Mangifera indica leaves[J]. Ultrasonics Sonochemistry, 2014, 21(2): 606-611.DOI:10.1016/j.ultsonch.2013.08.021.
[57] MUTHUPANDIAN A, DEVI S, SANDRA K, et al. Modification of food ingredients by ultrasound to improve functionality: a preliminary study on a model system[J]. Innovative Food Science & Emerging Technologies, 2008, 9(2): 155-160. DOI:10.1016/j.ifset.2007.05.005.
[58] SALEH I A, VINATORU M, MASON T J, et al. A possible general mechanism for ultrasound-assisted extraction (UAE) suggested from the results of UAE of chlorogenic acid from Cynara scolymus L.(artichoke) leaves[J]. Ultrasonics Sonochemistry, 2016, 31: 330-336.DOI:10.1016/j.ultsonch.2016.01.002.
[59] CHAN C H, YUSOFF R, NGOH G C. Modeling and kinetics study of conventional and assisted batch solvent extraction[J]. Chemical Engineering Research and Design, 2014, 92(6): 1169-1186.DOI:10.1016/j.cherd.2013.10.001.
[60] TAO Y, ZHANG Z, SUN D W. Kinetic modeling of ultrasoundassisted extraction of phenolic compounds from grape marc:influence of acoustic energy density and temperature[J].Ultrasonics Sonochemistry, 2014, 21(4): 1461-1469. DOI:10.1016/j.ultsonch.2014.01.029.
[61] CHEN Chao, WANG Li, WANG Ren, et al. Ultrasound-assisted extraction from defatted oat (Avena sativa L.) bran to simultaneously enhance phenolic compounds and β-glucan contents: compositional and kinetic studies[J]. Journal of Food Engineering, 2018, 222: 1-10.DOI:10.1016/j.jfoodeng.2017.11.002.
[62] BOUKROUFA M, BOUTEKEDJIRET C, PETIGNY L, et al. Biorefinery of orange peels waste: a new concept based on integrated green and solvent free extraction processes using ultrasound and microwave techniques to obtain essential oil, polyphenols and pectin[J]. Ultrasonics Sonochemistry, 2015, 24: 72-79. DOI:10.1016/j.ultsonch.2014.11.015.
[63] GONZÁLEZ-CENTENO M R, COMAS-SERRA F, FEMENIA A,et al. Effect of power ultrasound application on aqueous extraction of phenolic compounds and antioxidant capacity from grape pomace (Vitis vinifera L.): experimental kinetics and modeling[J].Ultrasonics Sonochemistry, 2015, 22: 506-514. DOI:10.1016/j.ultsonch.2014.05.027.
[64] KHAN M K, ABERTVIAN M, FABIANO-TIXIER A S, et al.Ultrasound-assisted extraction of polyphenols (flavanone glycosides)from orange (Citrus sinensis L.) peel[J]. Food Chemistry, 2010,119(2): 851-858. DOI:10.1016/j.foodchem.2009.08.046.
[65] KUMARI B, TIWARI B K, HOSSAIN M B, et al. Ultrasound-assisted extraction of polyphenols from potato peels: profiling and kinetic modelling[J]. International Journal of Food Science & Technology,2017, 52(6): 1432-1439. DOI:10.1111/ijfs.13404.
[66] HOSSAIN M B, BRUNTON N P, PATRAS A, et al. Optimization of ultrasound assisted extraction of antioxidant compounds from marjoram (Origanum majorana L.) using response surface methodology[J]. Ultrasonics Sonochemistry, 2012, 19(3): 582-590.DOI:10.1016/j.ultsonch.2011.11.001.
[67] GONZÁLEZCENTENO M R, KNOERZER K, SABAREZ H, et al.Effect of acoustic frequency and power density on the aqueous ultrasonic-assisted extraction of grape pomace (Vitis vinifera L.): a response surface approach[J]. Ultrasonics sonochemistry, 2014, 21(6):2176-2184. DOI:10.1016/j.ultsonch.2014.01.021.
[68] NIPORNRAM S, TOCHAMPA W, RATTANATRAIWONG P, et al.Optimization of low power ultrasound-assisted extraction of phenolic compounds from mandarin (Citrus reticulata Blanco cv. Sainampueng)peel[J]. Food Chemistry, 2018, 241: 338-345. DOI:10.1016/j.foodchem.2017.08.114.
[69] ESPADA-BELLIDO E, FERREIRO-GONZÁLEZ M, CARRERA C,et al. Optimization of the ultrasound-assisted extraction of anthocyanins and total phenolic compounds in mulberry (Morus nigra) pulp[J]. Food Chemistry, 2017, 219: 23-32. DOI:10.1016/j.foodchem.2016.09.122.
[70] VETAL M D, LADE V G, RATHOD V K. Extraction of ursolic acid from Ocimum sanctum, by ultrasound: process intensification and kinetic studies[J]. Chemical Engineering & Processing: Process Intensification, 2013, 69: 24-30. DOI:10.1016/j.cep.2013.01.011.
[71] HE B, ZHANG L L, YUE X Y, et al. Optimization of ultrasoundassisted extraction of phenolic compounds and anthocyanins from blueberry (Vaccinium ashei) wine pomace[J]. Food Chemistry, 2016,204: 70-76. DOI:10.1016/j.foodchem.2016.02.094.
[72] PAPOUTSIS K, PRISTIJONO P, GOLDING J B, et al. Screening the effect of four ultrasound-assisted extraction parameters on hesperidin and phenolic acid content of aqueous citrus pomace extracts[J]. Food Bioscience, 2018, 21: 20-26. DOI:10.1016/j.fbio.2017.11.001.
[73] KAZEMI M, KARIM R, MIRHOSSEINI H, et al. Optimization of pulsed ultrasound-assisted technique for extraction of phenolics from pomegranate peel of Malas variety: punicalagin and hydroxybenzoic acids[J]. Food Chemistry, 2016, 206: 156-166. DOI:10.1016/j.foodchem.2016.03.017.
[74] TIWARI B K, OʼDONNELL C P, PATRAS A, et al. Anthocyanin and ascorbic acid degradation in sonicated strawberry juice[J]. Journal of Agricultural and Food Chemistry, 2008, 56(21): 10071-10077.DOI:10.1021/jf801824v.
[75] MA Y Q, CHEN J C, LIU D H, et al. Simultaneous extraction of phenolic compounds of citrus peel extracts: effect of ultrasound[J].Ultrasonics Sonochemistry, 2009, 16(1): 57-62. DOI:10.1016/j.ultsonch.2008.04.012.
[76] QIAO Liping, YE Xingqian, SUN Yujing, et al. Sonochemical effects on free phenolic acids under ultrasound treatment in a model system[J].Ultrasonics Sonochemistry, 2013, 20(4): 1017-1025. DOI:10.1016/j.ultsonch.2012.12.007.
[77] QU W J, SEHEMU R M, FENG Y T, et al. Sonochemical effect of flat sweep frequency and pulsed ultrasound (FSFP) treatment on stability of phenolic acids in a model system[J]. Ultrasonics Sonochemistry,2017, 39: 707-715. DOI:10.1016/j.ultsonch.2017.05.034.
[78] QIAO L P, SUN Y J, CHEN R R, et al. Sonochemical effects on 14 flavonoids common in citrus: relation to stability[J]. PLoS ONE, 2017,9(2): e105647. DOI:10.1371/journal.pone.0105647.
[79] SUN J X, LI X H, LIN X Y, et al. Sonodegradation of cyanidin-3-glucosylrutinoside: degradation kinetic analysis and its impact on antioxidant capacity in vitro[J]. Journal of the Science of Food and Agriculture, 2016, 97(5): 1475-1481. DOI:10.1002/jsfa.7887.
[80] TIWARI B K. Ultrasound: a clean, green extraction technology[J].Trends in Analytical Chemistry, 2015, 71: 100-109. DOI:10.1002/jsfa.7887.
[81] ZHAI Wei, LIU Haiman, HONG Zhenyu, et al. A numerical simulation of acoustic field within liquids subject to three orthogonal ultrasounds[J]. Ultrasonics Sonochemistry, 2017, 34: 130-135.DOI:10.1016/j.ultsonch.2016.05.025.
[82] PINGRET D, FABIANO-TIXIER A S, BOURVELLEC C L, et al.Lab and pilot-scale ultrasound-assisted water extraction of polyphenols from apple pomace[J]. Journal of Food Engineering, 2012, 111(1): 73-81. DOI:10.1016/j.jfoodeng.2012.01.026.
[83] ALEXANDRU L, CRAVOTTO G, GIORDANA L, et al. Ultrasoundassisted extraction of clove buds using batch- and flow-reactors: a comparative study on a pilot scale[J]. Innovative Food Science &Emerging Technologies, 2013, 20(4): 167-172. DOI:10.1016/j.ifset.2013.07.011.
[84] GOULA A M, PAPATHEODOROU A, KARASAVVA S, et al.Ultrasound-assisted aqueous enzymatic extraction of oil from pomegranate seeds[J]. Waste & Biomass Valorization, 2018, 9(1):1-11. DOI:10.1007/s12649-016-9740-9.
[85] WANG L, BOUSSETTA N, LEBOVKA N, et al. Selectivity of ultrasound-assisted aqueous extraction of valuable compounds from flesh and peel of apple tissues[J]. LWT-Food Science and Technology,2018, 93: 511-516. DOI:10.1016/j.lwt.2018.04.007.
[86] GOLDSMITH C D, QUAN V V, STATHOPOULOS C E, et al.Ultrasound increases the aqueous extraction of phenolic compounds with high antioxidant activity from olive pomace[J]. LWTFood Science and Technology, 2018, 89: 284-290. DOI:10.1016/j.lwt.2017.10.065.
[87] WANG T, GUO N, WANG S X, et al. Ultrasound-negative pressure cavitation extraction of phenolic compounds from blueberry leaves and evaluation of its DPPH radical scavenging activity[J]. Food and Bioproducts Processing, 2018, 108: 69-80. DOI:10.1016/j.fbp.2018.01.003.
[88] JI S, WANG Y J, SU Z Y, et al. Ionic liquids-ultrasound based efficient extraction of flavonoid glycosides and triterpenoid saponins from licorice[J]. RSC Advances, 2018, 8(25): 13989-13996.DOI:10.1039/c8ra01056k.
A Literature Review of Ultrasonic Effects in Extraction of Phenolic Compounds from Fruits and Vegetables
WANG Pengxu, CHENG Chuanxiang, MA Yaqin, et al. A literature review of ultrasonic effects in extraction of phenolic compounds from fruits and vegetables[J]. Food Science, 2019, 40(17): 338-347. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-20180718-228. http://www.spkx.net.cn