甜度是水果重要的食用品质之一。苹果果实的甜度主要由可溶性糖(主要是果糖、葡萄糖和蔗糖)含量决定,但其传统的测定方法步骤复杂、成本较高。而可溶性固形物主要由可溶性糖组成,两者含量极显著正相关,且可溶性固形物含量的测定方法相对更简单易行[1-2]。所以多年来可溶性固形物含量成为评估水果甜度的重要指标。
为了满足无损、快速、经济等检测需求,基于近红外、高光谱等光学技术检测苹果可溶性固形物含量的研究一直是热点。目前光学检测研究主要依赖于化学计量学方法,分析透/反射率光谱与含量之间的关系,建立含量预测模型。例如,Li Xiaona等[3]利用傅里叶变换近红外光谱对不同产地‘富士’苹果的可溶性固形物含量进行评估,预测集的决定系数(Rp)和均方根误差(root mean square error of prediction,RMSEP)分别为0.759~0.924和0.547%~0.673%。Tian Xi等[4]基于高光谱对不同果皮颜色的苹果进行研究,建立了对果皮颜色敏感的可溶性固形物模型,Rp和RMSEP分别为0.955和4.8%。Tang Chunxiao等[5]搭建了含有4 个有效波长(461、469、947 nm和1 049 nm)的多光谱设备,用于‘富士’苹果的可溶性固形物含量预测。但是,这些研究对于可溶性固形物在不同波长下如何影响吸收和散射的情况还不清楚,且可溶性固形物中的成分与吸收和散射的关系如何也尚不明晰。通过探究可溶性糖与光学吸收和散射的关系,将有助于解释光学技术检测可溶性固形物的机理,为改善模型的精度和适应性提供基础。
吸收系数和约化散射系数分别指单位路径(cm或mm)内光子因被吸收或散射而损失的光能量的比率(式(1)~(3))。果蔬光学参数测量通过求解辐射传输方程计算吸收系数和约化散射系数,定量表征吸收和散射,提供了单独研究果实化学成分和组织结构与光学性质关系的机会。目前的果蔬光学参数测量技术有空间分辨技术、时间分辨技术、频域分辨技术、积分球技术。其中积分球技术是目前公认测量最精准的技术,且组成简单、成本较低。根据前人的研究,吸收系数主要与化学成分有关,约化散射系数主要与组织结构有关[6-7]。Ma Te等[8]的研究发现,苹果可溶性固形物含量越高,组织在1 170 nm波长处吸收系数越高,但是未能将两者之间的关系进行定量。果蔬中叶绿素和残留的不溶性果胶中多糖醛酸含量均与波长670 nm附近吸收有关[9-10]。另一方面,苹果的硬度、细胞面积和等效直径与675 nm处散射系数均呈现正相关,相关系数分别为0.903~0.993、0.581~0.777和0.572~0.657[11]。且细胞结构越紧密,散射能力更强[12]。水心和瘀伤都会破坏组织结构,引起组织散射减弱[8,13-14]。但是,目前对于可溶性固形物、可溶性糖与光学吸收或散射性质之间关系的定量研究鲜见报道。
式中:μa为吸收系数/(cm-1或mm-1);I为透过纯吸收介质的光强;I0为入射光光强;d为纯吸收介质的厚度或路径长/(cm或mm)。
式中:μs为散射系数/(cm-1或mm-1);I为准直透过散射介质的光强;I0为入射光光强;d为散射介质的厚度或路径长/(cm或mm)。
式中:μ’s为约化散射系数/(cm-1或mm-1);g为各向异性因子,定量描述单个散射发生后,保持向前传播的那部分光子数,取值范围为[-1,1]。
因此,本实验旨在定量苹果采后可溶性固形物、可溶性糖与光学吸收和散射性质的关系,进一步解释光学技术检测可溶性固形物的原因。
‘富士’苹果样本采摘于江苏省徐州市丰县宋楼镇唐安果园;1% Intralipid 美国Sigma Aldrich公司。
ASBN-W100-L卤素灯、PG2000光谱仪 上海复享光学股份有限公司;4P-GPS-033-SL积分球 美国Labsphere公司;3K15离心机 德国Sigma公司;PAL-1手持式糖度仪 日本爱拓公司;Zorbax carbohydrate氨基柱 美国安捷伦公司;LC-20A高效液相色谱仪日本岛津公司。

图1 基于单积分球的农产品光学特性检测系统示意图(A)和软件界面(B)
Fig. 1 Schematic (A) and software interface (B) of optical properties measurement system for agricultural products using integrating sphere
如图1A所示,本实验室自主搭建的基于单积分球的农产品光学特性检测系统包括光源、光源架、积分球、样本架、光纤、光谱仪、滑台、运动控制器和计算机。其中光源架和积分球同轴安装,积分球的检测口通过光纤与光谱仪连接,计算机通过光谱仪采集积分球内漫反射光的光谱,并通过运动控制器控制3 个滑台调整光源架和样本架的相对位置。光源输出波长为400~2 000 nm,最大输出功率为100 W。积分球直径为84 mm,内部涂层为聚四氟乙烯,在400~1 100 nm反射率高于0.98。白板、暗背景和样本的信号通过光谱仪获取,光谱波段为366~1 050 nm,光谱分辨率为0.34 nm。
本实验室自行开发的控制软件基于Windows系统采用C#撰写,软件界面如图1B所示。软件包括光谱测量参数、测试模式控制、光谱数据采集、数据显示、数据保存五大功能模块。通过该控制软件,能实现光谱测量参数设定,信号采集以及反射透射模式的自动切换,简化了操作步骤。
1.3.1 样品制备
‘富士’苹果样本经0 ℃预冷24 h以后,挑选60 个直径为80~85 mm,成熟度一致且表面无损伤的样本。然后在冷库((0±1)℃,相对湿度>95%)中共贮存150 d,每30 d随机取样10 个。室温下冷却5 h,将整果切去10 mm厚度的果皮和果肉后,切取5 mm×30 mm×35 mm(厚度×宽度×长度)的切片。然后,用两片石英玻璃片(1 mm厚度)夹住切片进行光学性质测量。进行可溶性固形物和可溶性糖含量的测定。
1.3.2 光学性质测量
采用农产品光学特性检测系统和软件B测定400~1 050 nm样本的漫反射率Rt和漫透射率Tt,积分时间为200 ms,窗口平滑宽度为12 nm,采样平均次数为20 次。具体的测量细节参考文献[15]。通过反向倍加算法求解辐射传输方程,计算吸收系数和约化散射系数[16]。
1.3.3 检测系统的精度分析
分别采用纯水和1% Intralipid作为纯吸收介质和浑浊介质。通过计算纯水和1% Intralipid测量值与参考值之间的误差,确定本系统测量吸收和散射性质的准确性。参考值分别为邓孺孺[17-18]和Van Staveren[19]等的经验值。
1.3.4 可溶性固形物和可溶性糖含量测定
光学性质测量后,立即采用手持式糖度仪测定可溶性固形物含量。重复测量3 次,取平均值。
果糖、葡萄糖、蔗糖含量测定采用Ma Chunmei等[20]报道的方法进行相应修改。称量2 g左右果肉研磨2 min,加入30 mL超纯水混合后,80 ℃水浴60 min。悬液于10 000×g离心20 min后,收集上清液。上清液和标准品均采用0.45 μm微孔膜过膜后,进样20 μL,经过氨基柱分离(柱温40 ℃)后,于高效液相色谱仪蒸发光散射检测器进行测定。流动相采用乙腈-超纯水(75∶25,V/V),流速0.8 mL/min。可溶性糖含量单位为g/kg。果糖、葡萄糖、蔗糖的标准曲线决定系数分别为0.999 0、0.999 8和0.999 8。总可溶性糖含量为3 种可溶性糖含量的总和。
为了定量贮存期间苹果果肉可溶性固形物、可溶性糖与光学性质的关系,对不同采样时间的参数的平均值进行分析。采用IBM SPSS Statistics 20(Manugistic公司,Rockville,MD,美国)进行方差分析(P<0.05)和Pearson(P<0.05)相关性分析。并采用Matlab R2010b(Mathworks公司,Massachusetts,美国)建立可溶性固形物、总可溶性糖、果糖、葡萄糖和蔗糖含量的偏最小二乘回归(partial least square regression,PLSR)模型。3/4的样本(45 个)用于建模,剩下1/4的样本(15 个)用于预测。模型的性能用Rp和RMSEP进行评估。

图2 400~1 050 nm水的吸收系数(A)和1% Intralipid约化散射系数(B)
Fig. 2 Absorption coefficient of water (A) and reduced scattering coefficient of 1% Intralipid in the range of 400-1 050 nm (B)
如图2所示,吸收系数和约化散射系数的测量值与参考值趋势一致:吸收系数在整个波段范围内存在O—H 1 个明显的吸收峰(980 nm)和2 个较小吸收峰(740 nm和840 nm);约化散射系数出现米氏散射现象,随着波长增加单调减小[19]。
吸收系数测量值与参考值在800~950 nm非常相近,平均误差只有6.61%。但与Zhang Shu[13]、Rowe[21]等报道一样,在400~800 nm出现显著基线漂移。这可能是光在样本边缘的直接和漫射光损失造成的,从而引起吸收测量值偏高[22]。约化散射系数测量值与参考值之间的差距在400~650 nm逐渐增加,然后逐渐减小直到881 nm达到最小,881 nm以后又逐渐增加。在整个400~1 050 nm范围内,约化散射系数相对误差范围为0.03%~12.59%,平均值为7.74%,低于Moffitt[22]的平均测量误差(11.1%)。测量值与参考值之间的差距可能是不同厂商的1% Intralipid的粒径分布不同引起[23]。
如图3所示,贮存期间不同采样时间的平均吸收系数和约化散射系数的波形均相似,数值有所不同。平均吸收系数值范围为是0.02~0.11 mm-1(图3 A),与R o w e等[2 1]用积分球测得的400~1 050 nm‘嘎啦’苹果的吸收系数值相当(0.01~0.15 mm-1),但高于Qin Jianwei等[24]采用高光谱成像空间分辨技术测得的550~1 000 nm‘富士’苹果的值(0.01~0.06 mm-1)。在550~1 050 nm,吸收系数出现980 nm明显的吸收峰。在贮存150 d期间,虽然相邻采样时间吸收系数值差别不明显,但整体呈减小趋势。
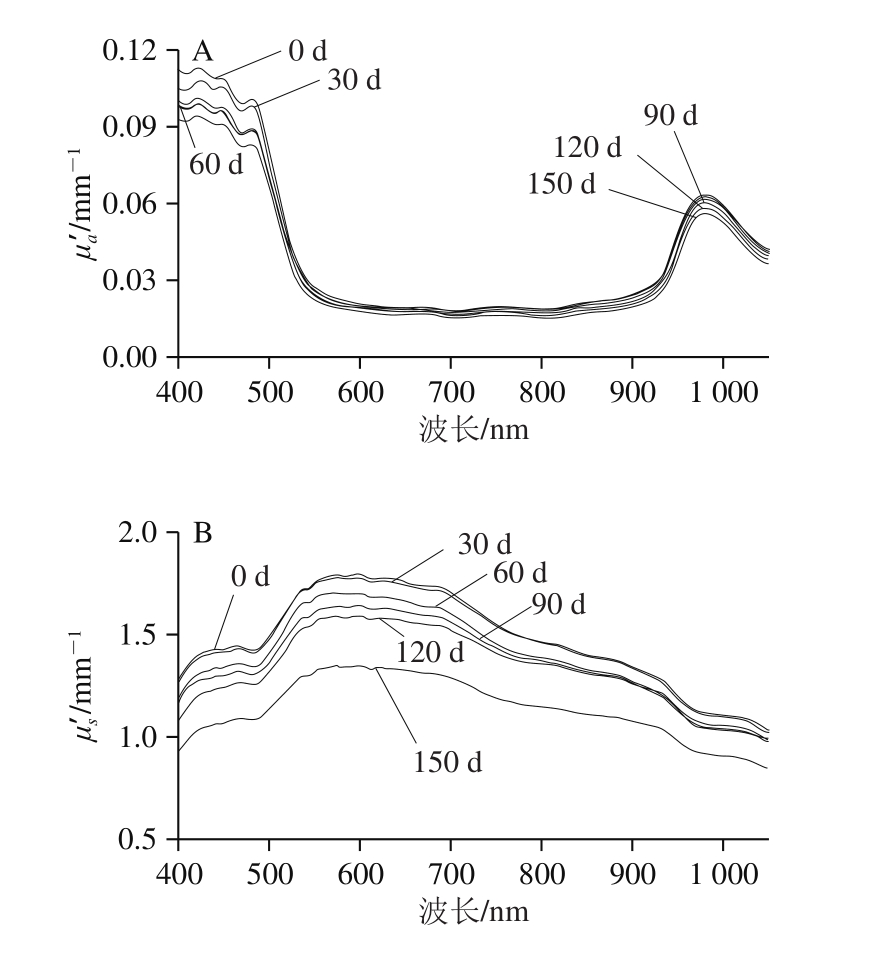
图3 不同采样时间苹果果肉平均吸收系数(A)和约化散射系数(B)
Fig. 3 Absorption coefficient (A) and reduced scattering coefficient (B)of apples at different storage times
果肉约化散射系数是吸收系数的7 倍以上,范围在0.85~1.79 mm-1之间(图3B)。这是因为果蔬等生物组织是浑浊介质,散射性质远大于吸收性质。而该测量值高于Zhang Shu等[13]用积分球技术测得的瘀伤‘富士’苹果的约化散射系数,这是因为瘀伤会破坏组织的细胞结构完整度,造成散射减小。贮存150 d后,约化散射系数明显减小。与2.1节所述问题相同,由于在果肉组织内,400~550 nm之间光损失严重,IS技术在反向迭代求解光学特性参数时,未考虑光在积分球内的损失,直接过分估计光的吸收,造成吸收系数偏高,约化散射系数偏低,未表现出随着波长增加而减小的趋势[25]。这在Rowe等[21]的研究中也有类似报道。所以在后续分析中,仅保留分析550~1 050 nm波段的光学性质与可溶性固形物和可溶性糖的关系。
如图4所示,随着贮存时间的延长,果肉可溶性成分降解速度大于合成速度,可溶性固形物和可溶性糖含量均呈现减小趋势。可溶性固形物从13.5%减小至11.7%,总可溶性糖含量从53.42 g/kg减小到45.91 g/kg。苹果是果糖积累型果实,在3 种可溶性糖中果糖含量最高(23.70~26.79 g/kg),其次是葡萄糖(14.14~16.56 g/kg)和蔗糖(8.07~10.17 g/kg)[26]。

图4 不同采样时间苹果可溶性固形物和可溶性糖含量
Fig. 4 Soluble solid contents and soluble sugar contents of apples at different storage times
表1 可溶性固形物和可溶性糖的相关性分析结果
Table 1 Correlation analysis of soluble solids and soluble sugar contents

注:*.显著相关,P<0.05;**.极显著相关,P<0.01。
指标 可溶性固形物总可溶性糖 果糖 葡萄糖 蔗糖可溶性固形物 1 0.932** 0.926** 0.771 0.961**总可溶性糖 1 0.984** 0.947** 0.900*果糖 1 0.925** 0.848*葡萄糖 1 0.737蔗糖 1
从表1可知,可溶性固形物与总可溶性糖和3 种可溶性糖均呈正相关关系,且除了葡萄糖以外,正相关关系均极显著(P<0.01),这与赵胜杰等[2]的研究结果相一致。可溶性固形物与蔗糖相关性最高,相关系数高达0.961,其次是总可溶性糖(r=0.932)和果糖(r=0.926),最后是葡萄糖(r=0.771)。李宝江等[27]研究发现,可溶性固形物与蔗糖的相关性高于其与还原糖的相关性,r分别为0.773和0.458(P<0.01)。总可溶性糖与3 种可溶性糖均呈显著正相关(r>0.9),且与果糖的相关性最强,相关系数高达0.984。这与果糖含量在总可溶性糖中所占的比例最大相符合。
如图5所示,在整个波段范围内,可溶性固形物、总可溶性糖、果糖、葡萄糖、蔗糖与2 种光学性质均呈正相关,相关系数为0.768~0.992。与Ma Te等[8]的研究结果相同,苹果可溶性固形物越低,吸收和散射也相对越弱。同时,这也印证了2.2节和2.3节所述结果,随着贮存时间的延长,可溶性成分含量减小伴随着吸收系数和约化散射系数减小的现象。此外,这5 个可溶性成分参数与吸收系数的平均相关系数均高于与约化散射系数的平均相关系数。这也显示了化学组分可能与吸收性质更相关。
而在5 个可溶性成分参数中,可溶性固形物、总可溶性糖、果糖和蔗糖与2 种光学性质的相关性(r为0.827~0.992)均比葡萄糖(r为0.768~0.907)高。可溶性固形物和总可溶性糖与吸收系数的相关系数均值均为0.948,与约化散射系数的相关系数均值分别为0.931和0.909。在3 种可溶性糖中,蔗糖与2 种光学性质的相关性最高(r为0.829~0.992),其次是果糖(r为0.826~0.935),最后是葡萄糖(r为0.768~0.907)。三者与吸收和约化散射系数的平均相关系数分别为0.963、0.910和0.834,0.890、0.887和0.813。即,虽然蔗糖含量是3 种可溶性糖中最少的,但其与2 种光学性质的平均相关性均最高,然后是果糖,最后是葡萄糖。这与可溶性固形物和3 种可溶性糖的相关性分析结果一致。这也表明,可溶性固形物与光学性质的高度相关性可能与蔗糖有关。
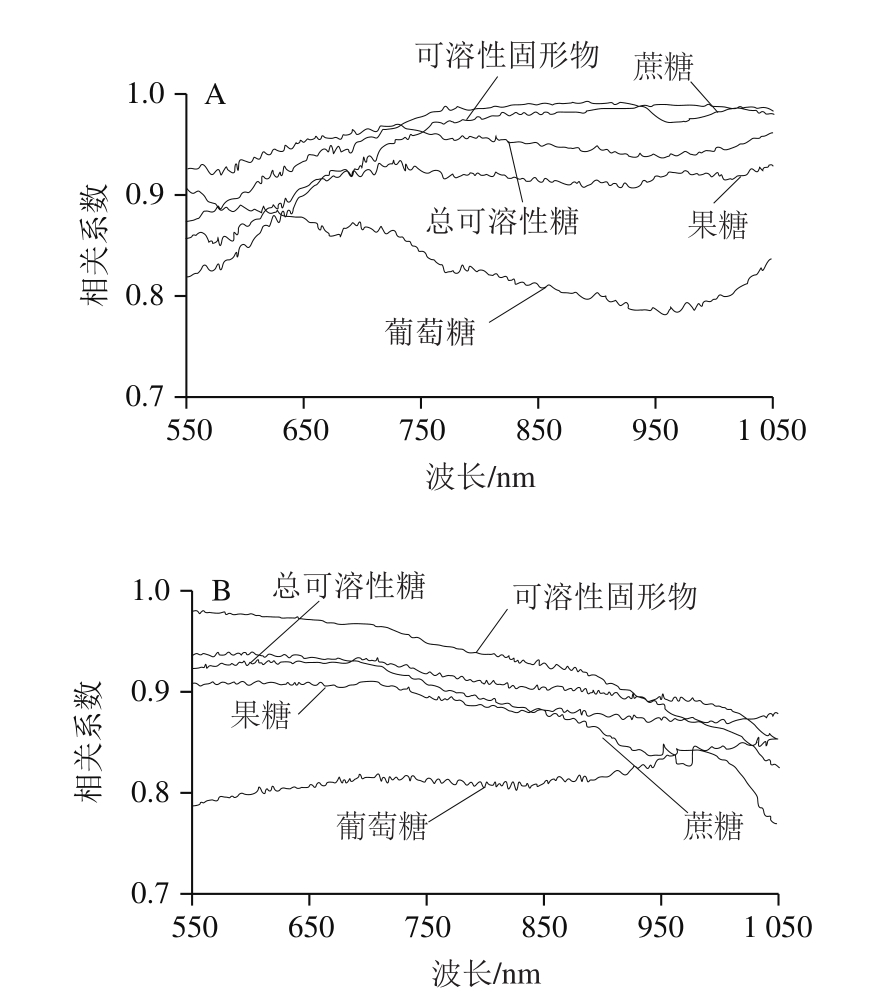
图5 可溶性固形物和可溶性糖与光学吸收系数(A)和约化散射系数(B)的相关性
Fig. 5 Correlations of soluble solide and soluble sugar contents with absorption coefficient (A) and reduced scattering coefficient (B)
表2 苹果可溶性固形物和可溶性糖与980 nm处光学性质的线性拟合方程
Table 2 Linear fi tting equations for soluble solide contents, soluble sugar contents and optical properties at 980 nm of apples

参数(自变量x)性质(因变量y)线性拟合方程决定系数R2 980 nm处光学吸收系数 y=0.003 6x+0.014 4 0.977约化散射系数 y=0.086 5x-0.063 1 0.761总可溶性糖 吸收系数 y=0.000 9x+0.018 2 0.885约化散射系数 y=0.022 0x-0.046 4 0.795果糖 吸收系数 y=0.002x+0.009 6 0.847约化散射系数 y=0.051 9x-0.263 8 0.756葡萄糖 吸收系数 y=0.002x+0.029 5 0.622约化散射系数 y=0.059 5x+0.143 3 0.710蔗糖 吸收系数 y=0.03x+0.032 5 0.951约化散射系数 y=0.068 7x+0.408 4 0.663可溶性固形物
随着波长增加,可溶性固形物、总可溶性糖、果糖和蔗糖与吸收系数的相关系数也增加。相反,随着波长增加,约化散射系数与它们的相关系数却减小。这可能是因为近红外区域相对可见光区域包含更多C—H、O—H、N—H等基团的共振信息,与吸收性质更相关[28]。而在贮存期间,约化散射系数在可见光区域的变化范围相对于近红外区域更大,所以呈现更强的相关性。为观察固定波长下可溶性成分参数与吸收和约化散射系数的关系,获取了980 nm处两者的线性拟合方程(表2)。由表2可知,可溶性固形物和蔗糖与吸收系数的线性拟合方程拟合度最高,决定系数R2分别为0.977和0.951。而其他方程的拟合度较低,R2为0.662~0.885。
表3 苹果可溶性固形物和可溶性糖的含量预测模型
Table 3 Model predictions of soluble solide and soluble sugar contents in apples

注:可溶性固形物单位为%,其他单位为g/kg。
参数 光学性质 建模集 预测集Rc RMSEC Rp RMSEP可溶性固形物吸收系数 0.898 2.747 0.890 2.924约化散射系数 0.894 2.832 0.876 3.363果糖 吸收系数 0.883 1.589 0.875 1.542约化散射系数 0.878 1.588 0.836 2.138葡萄糖 吸收系数 0.867 1.638 0.832 1.482约化散射系数 0.845 1.754 0.820 1.871蔗糖 吸收系数 0.921 0.994 0.906 1.175约化散射系数 0.886 1.158 0.864 1.326吸收系数 0.916 0.347 0.893 0.393约化散射系数 0.898 0.396 0.886 0.422总可溶性糖
如表3所示,为了进一步验证可溶性固形物和可溶性糖与光学性质的关系,分别基于吸收系数和约化散射系数建立PLSR含量预测模型。结果显示,基于吸收系数和约化散射系数建立的5 个可溶性成分参数模型建模集决定系数Rc略高于相应模型的预测集决定系数Rp,但结果相差不大,证明模型没有过拟合。
5 个可溶性成分参数的模型预测性能均较好,能满足实际需求:1)可溶性固形物的模型Rp不小于0.886,RMSEP不超过0.422%。此结果优于Peng Yankun[29]和He Xueming[30]等分别利用高光谱成像空间分辨技术和积分球技术建立的苹果和梨的可溶性固形物含量预测模型,Rp分别为0.883和0.64,RMSEP分别为0.73%和0.68%。2)总可溶性糖的预测模型Rp不小于0.876,RMSEP不超过3.363 g/kg。3 种可溶性糖预测模型Rp和RMSEP范围分别为0.820~0.906和1.175~2.138 g/kg。且蔗糖的预测结果最高(Rp≥0.864,RMSEP≤1.3 2 6 g/k g),其次是果糖(Rp≥0.8 3 6,RMSEP≤2.138 g/kg)和葡萄糖(Rp≥0.820,RMSEP≤1.871 g/kg),这与丁佳兴[31]利用高光谱对3 种可溶性糖的预测结果一致。与Oliveira-Folador等[32]利用近红外光谱建立百香果的糖含量模型(果糖、葡萄糖、蔗糖的Rp分别为0.890、0.885和0.850,RMSEP分别为2.93、2.86 g/kg和6.64 g/kg)相比,本研究对蔗糖的预测结果更优。虽然果糖和葡萄糖的预测模型Rp略低,但模型的RMSEP更小。且本研究结果高于120 个杨梅汁的果糖预测模型(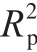 为0.71)和150 个蜜橘的葡萄糖预测模型(
为0.71)和150 个蜜橘的葡萄糖预测模型( 为0.48)[33-34]。结果表明,可溶性成分与光学性质之间有高度相关性,以及基于光学性质预测可溶性成分含量有较大潜力。3)另一方面,在这5 种可溶性成分参数的模型中,基于吸收系数建立的模型表现均优于约化散射系数建立的模型,前者Rp高出后者Rp的范围为0.007~0.042,且模型相应的RMSEP均更低。这也再次证明,化学成分与吸收性质的关联更强[35]。
为0.48)[33-34]。结果表明,可溶性成分与光学性质之间有高度相关性,以及基于光学性质预测可溶性成分含量有较大潜力。3)另一方面,在这5 种可溶性成分参数的模型中,基于吸收系数建立的模型表现均优于约化散射系数建立的模型,前者Rp高出后者Rp的范围为0.007~0.042,且模型相应的RMSEP均更低。这也再次证明,化学成分与吸收性质的关联更强[35]。
本研究搭建一套基于单积分球的农产品光学特性检测系统和软件,并分别采用纯水和1% Intralipid进行吸收性质和散射性质测量精度分析。同时,利用本系统探究苹果低温贮存期间5 种可溶性成分参数含量(可溶性固形物、总可溶性糖、果糖、葡萄糖、蔗糖)与吸收系数和约化散射系数的关系。研究结果表明,本系统和软件能够满足纯吸收介质和浑浊介质光学特性参数的测量需求,吸收系数在800~950 nm平均误差只有6.61%,约化散射系数在400~1 050 nm平均误差仅为7.74%。贮存期间,苹果可溶性固形物和可溶性糖与吸收和散射2 种光学性质均逐渐减小,且表现出与吸收性质更高的相关性(r为0.768~0.992)。可溶性固形物与总可溶性糖、果糖、葡萄糖和蔗糖呈正相关,且与蔗糖相关性最高(r为0.961 )。可溶性固形物和蔗糖与光学性质相关性高于果糖和葡萄糖,基于光学性质建立的含量预测模型结果也最优,Rp高达0.906。因此,基于光学性质能够预测可溶性固形物含量可能与可溶性糖中蔗糖和吸收性质的高度相关性有关。本研究为理解光学性质与可溶性固形物、糖类之间的关系提供了参考。在后续地研究中,可以进行多品种样本的实验研究,验证本研究中的结果。
[1] 聂继云, 李志霞, 李海飞, 等. 苹果理化品质评价指标研究[J]. 中国农业科学, 2012, 45(14): 2895-2903. DOI:10.3864/j.issn.0578-1752.2012.14.012.
[2] 赵胜杰, 高磊, 路绪强, 等. 不同类型西瓜果实糖酸组分含量分析[J].中国瓜菜, 2017, 30(8): 7-11. DOI:10.16861/j.cnki.zggc.2017.0144.
[3] LI X N, HUANG J C, XIONG Y J, et al. Determination of soluble solid content in multi-origin ‘Fuji' apples by using FT-NIR spectroscopy and an origin discriminant strategy[J]. Computers and Electronics in Agriculture, 2018, 155: 23-31. DOI:10.1016/j.compag.2018.10.003.
[4] TIAN X, LI J B, WANG Q Y, et al. A bi-layer model for nondestructive prediction of soluble solids content in apple based on ref l ectance spectra and peel pigments[J]. Food Chemistry, 2018, 239:1055-1063. DOI:10.1016/j.foodchem.2017.07.045.
[5] TAN C X, HE H Y, LI E B, et al. Multispectral imaging for predicting sugar content of ‘Fuji' apples[J]. Optics and Laser Technology, 2018,106: 280-285. DOI:10.1016/j.optlastec.2018.04.017.
[6] NICOLAÏ B M, BEULLENS K, BOBELYN E, et al. Nondestructive measurement of fruit and vegetable quality by means of NIR spectroscopy: a review[J]. Postharvest Biology & Technology, 2007,46: 99-118. DOI:10.1016/j.postharvbio.2007.06.024.
[7] 潘磊庆, 魏康丽, 曹念念, 等. 果蔬光学参数测量及其在品质检测方面的研究进展[J]. 南京农业大学学报, 2018, 41(1): 26-37.DOI:10.7685/jnau.201706029.
[8] MA T, LI X, INAGAKI T, et al. Noncontact evaluation of soluble solids content in apples by near-infrared hyperspectral imaging[J].Journal of Food Engineering, 2018, 224: 53-61. DOI:10.1016/j.jfoodeng.2017.12.028.
[9] CUBEDDU R, D'ANDREA C, PIFFERI A, et al. Nondestructive quantification of chemical andphysical properties of fruits by time-resolvedreflectance spectroscopy in the wavelength range 650-1 000 nm[J]. Applied Opticx, 2001, 40(4): 538-543. DOI:10.1364/AO.40.000538.
[10] VANOLI M, ZERBINI P E, SPINELLI L, et al. Polyuronide content and correlation to optical properties measured by time-resolved ref l ectance spectroscopy in ‘Jonagored' apples stored in normal and controlled atmosphere[J]. Food Chemistry, 2009, 115(4): 1450-1457.DOI:10.1016/j.foodchem.2009.01.081.
[11] CEN H Y, LU R F, MENDOZA F, et al. Relationship of the optical absorption and scattering properties with mechanical and structural properties of apple tissue[J]. Postharvest Biology & Technology, 2013,85(11): 30-38. DOI:10.1016/j.postharvbio.2013.04.014.
[12] WANG W L, LI C Y. Measurement of the light absorption and scattering properties of onion skin and flesh at 633 nm[J]. Postharvest Biology and Technology, 2013, 86: 494-501. DOI:10.1016/j.postharvbio.2013.07.032.
[13] ZHANG S, WU X H, ZHANG S H, et al. An effective method to inspect and classify the bruising degree of apples based on the optical properties[J]. Postharvest Biology & Technology, 2017, 127: 44-52.DOI:10.1016/j.postharvbio.2016.12.008.
[14] LU R F, CEN H Y, HUANG M, et al. Spectral absorption and scattering properties of normal and bruised apple tissue[J]. Transactions of the ASABE, 2010, 53(1): 263-269. DOI:10.13031/2013.29491.
[15] PRAHL S A, VAN GEMERT M J C, WELCH A J. Determining the optical properties of turbid media by using the adding-doubling method[J]. Applied Optics, 1993, 32(4): 559-568. DOI:10.1364/AO.32.000559.
[16] PRAHL S. Everything I think you should know about inverse addingdoubling[EB/OL]. (2011-03) [2019-01-14]. https://omlc.ogi.edu/software/iad.
[17] 邓孺孺, 何颖清, 秦雁, 等. 分离悬浮质影响的光学波段(400-900 nm)水吸收系数测量[J]. 遥感学报, 2012, 16(1): 174-191.DOI:10.11834/jrs.20121183.
[18] 邓孺孺, 何颖清, 秦雁, 等. 近红外波段(900-2 500 nm)水吸收系数测量[J]. 遥感学报, 2012, 16(1): 192-206. DOI:10.11834/jrs.20121188.
[19] VAN STAVEREN H J, MOES C J, VAN M J, et al. Light scattering in intralipid-10% in wavelength range of 400-1100 nm[J]. Applied Optics, 1991, 30(31): 4507-4514. DOI:10.1364/AO.30.004507.
[20] MA C M, SUN Z, CHEN C B, et al. Simultaneous separation and determination of fructose, sorbitol, glucose and sucrose in fruits by HPLC-ELSD[J]. Food Chemistry, 2014, 145: 784-788. DOI:10.1016/j.foodchem.2013.08.135.
[21] ROWE P I, KÜNNEMEYER R, MCGLONE A, et al. Relationship between tissue fi rmness and optical properties of ‘Royal Gala' apples from 400 to 1 050 nm[J]. Postharvest Biology & Technology, 2014,94: 89-96. DOI:10.1016/j.postharvbio.2014.03.007.
[22] MOFFITT T P. Compact fiber-optic diffuse ref l ection probes for medical diagnostics[EB/OL]. (2007-07) [2019-01-14]. https://digitalcommons.ohsu.edu/etd/126.
[23] GIUSTO A, SAIJA R, IATÌ M A, et al. Optical properties of highdensity dispersions of particles: application to intralipid solutions[J].Applied Opticx, 2003, 42: 4375-4380. DOI:10.1364/AO.42.004375.
[24] QIN J W, LU R F. Measurement of the optical properties of fruits and vegetables using spatially resolved hyperspectral diffuse reflectance imaging technique[J]. Postharvest Biology & Technology, 2008, 49(3):355-365. DOI:10.1016/j.postharvbio.2008.03.010.
[25] HU D, FU X P, WANG A C, et al. Measurement methods for optical absorption and scattering properties of fruits and vegetables[J].Transactions of the ASABE, 2015, 49(3): 1387-1401. DOI:10.13031/trans.58.11103.
[26] 梁俊, 郭燕, 刘玉莲, 等. 不同品种苹果果实中糖酸组成与含量分析[J]. 西北农林科技大学学报(自然科学版), 2011, 39(10): 163-170.DOI:10.13207/j.cnki.jnwafu.2011.10.020.
[27] 李宝江, 林桂, 荣崔宽. 苹果糖酸含量与果实品质的关系[J]. 沈阳农业大学学报, 1994, 25(3): 279-283.
[28] WILSON R H, NADEAU K P, JAWORSKI F B, et al. Review of short-wave infrared spectroscopy and imaging methods for biological tissue characterization[J]. Journal of Biomedical Optics, 2015, 20(3):30901. DOI:10.1117/1.JBO.20.3.030901.
[29] PENG Y K, LU R F. Analysis of spatially resolved hyperspectral scattering images for assessing apple fruit fi rmness and soluble solids content[J]. Postharvest Biology and Technology, 2008, 48: 52-62.DOI:10.1016/j.postharvbio.2007.09.019.
[30] HE X M, FU X P, RAO X Q, et al. Assessing firmness and SSC of pears based on absorption and scattering properties using an automatic integrating sphere system from 400 to 1 150 nm[J].Postharvest Biology and Technology, 2016, 121: 62-70. DOI:10.1016/j.postharvbio.2016.07.013.
[31] 丁佳兴. 基于高光谱和激光诱导荧光高光谱技术的贮藏期灵武长枣主要可溶性糖检测研究[D]. 银川: 宁夏大学, 2018: 25-52.
[32] OLIVEIRA-FOLADOR G, BICUDO M D O, DE ANDRADE E F,et al. Quality traits prediction of the passion fruit pulp using NIR and MIR spectroscopy[J]. LWT-Food Science & Technology, 2018, 95:172-178. DOI:10.1016/j.lwt.2018.04.078.
[33] MAGWAZA L S, LANDAHL S, CRONJE P J R, et al. The use of vis/NIRS and chemometric analysis to predict fruit defects and postharvest behaviour of ‘Nules Clementine' mandarin fruit[J]. Food Chemistry,2014, 163: 267-274. DOI:10.1016/j.foodchem.2014.04.085.
[34] XIE L J, YE X Q, LIU D H, et al. Quantification of glucose, fructose and sucrose in bayberry juice by NIR and PLS[J]. Food Chemistry,2009, 114(3): 1135-1140. DOI:10.1016/j.foodchem.2008.10.076.
[35] ADEBAYO S E, HASHIM N, HASS R, et al. Using absorption and reduced scattering coefficients for non-destructive analyses of fruit flesh firmness and soluble solids content in pear (Pyruscommunis‘Conference'): an update when using diffusion theory[J].Postharvest Biology & Technology, 2017, 130: 56-63. DOI:10.1016/j.postharvbio.2017.04.004.
Relationship between Soluble Solid and Soluble Sugar Contents and Optical Properties of Apple Flesh
WEI Kangli, LIU Chang, DING Haizhen, et al. Relationship between soluble solid and soluble sugar contents and optical properties of apple flesh[J]. Food Science, 2019, 40(18): 1-7. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20190118-218. http://www.spkx.net.cn