表1 大麦品种及产地
Table 1 Geographical origins and varieties of 8 varieties of barley used in this study

编号 品种 原料产地1 Hindmarsh 澳大利亚2 Irima 法国3 Esterel 法国4 Metcalf 加拿大5 Commander 澳大利亚6 Baudin 澳大利亚7 Scope 澳大利亚8 Sebastion 法国
大麦(Hordeum vulgareL.),属禾本科(Poaceae)、大麦属(Hordeum),别名牟麦、赤膊麦、饭麦,为一年生禾本植物。麦芽为大麦的成熟果实经发芽干燥而制备的加工品[1]。
大麦作为我国主要农作物之一,在农业和食品工业中有很重要的地位,大麦及麦芽具有助消化、催乳、抗结肠炎、降血糖血脂等药理性作用[2-6],主要用作饲料和啤酒工业原料[7-8],仅有小部分为人类直接食用。发芽使得大麦糊粉层、胚乳中的营养物质充分溶解,小分子可溶性糖及含氮化合物含量增加,胚乳结构变得疏松,使其满足啤酒工艺中制糖流程的需求[9-10]。近年我国啤酒工业快速发展,但大麦市场逐渐萎缩,国内种植大麦产量已不能满足啤酒工业对原料的需求,导致进口大麦数量猛增[11-12]。大麦及麦芽富含多酚类物质,对啤酒的色、香、味及稳定性有较大影响[13-15]。然而,对于大麦发芽前后多酚组分及抗氧化活性比较的报道较少。本实验选取8 种酿造啤酒大麦及发芽后的麦芽为原料,旨在通过测定多酚含量、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力及氧自由基吸收能力,比较大麦发芽前后多酚含量、组分及抗氧化活性上的差异,研究酿造啤酒大麦发芽前后的多酚变化,为啤酒原料选取,工艺优化,产品贮藏等提供一定的理论依据。
啤酒大麦及麦芽样品由永顺泰(秦皇岛)麦芽有限公司提供(原料产地见表1),将干燥的大麦及麦芽机械粉碎,过60 目筛,分袋真空包装,保存于低温冰箱(4 ℃)备用。
表1 大麦品种及产地
Table 1 Geographical origins and varieties of 8 varieties of barley used in this study

编号 品种 原料产地1 Hindmarsh 澳大利亚2 Irima 法国3 Esterel 法国4 Metcalf 加拿大5 Commander 澳大利亚6 Baudin 澳大利亚7 Scope 澳大利亚8 Sebastion 法国
丙酮、乙酸乙酯、氢氧化钠、正己烷等(均为分析纯)成都科龙化工试剂厂;荧光素钠盐(FL)、福林-酚试剂、水溶性VE(Trolox)、DPPH(分析纯) 美国Sigma公司;2,2’-偶氮二异丁基脒盐酸盐(ABAP)(分析纯) 日本Wako化学试剂公司;甲醇、没食子酸、原儿茶素、荭草素、阿魏酸等(均为色谱纯) 成都普瑞法科技有限公司。
XHF-D高速分散器 宁波新芝生物科技股份有限公司;HW-7FCS制冰机 日本三洋公司;RE-52AA旋转蒸发仪上海亚荣生化仪器厂;1-15PK高速离心机 美国Sigma公司;JH722分光光度计 上海精科科学仪器厂;Spectra Max M2多功能酶标仪 美国Molecular公司;LC-20A高效液相色谱仪 日本岛津公司。
1.3.1 多酚的提取
游离酚的提取:参照Okarter[16]和Adom[17]等的方法,并根据本实验室条件稍作修改。准确称取2.50 g样品加入50 mL 80%的丙酮溶液,冰浴中均质(2 min,3 次),离心(3 500 r/min,10 min),取上清液,残渣重复上述操作2 次,所得全部上清液抽滤后于45 ℃真空旋转蒸发至干,纯水定容至25 mL,分装后于-40 ℃贮存备用。
结合酚的提取:参照Okarter[16]和Nuutila[18]等的方法,根据本实验室条件稍作修改。上述残渣加入50 mL 2 mol/L NaOH溶液,避光消化1.5 h,调pH值为2。除脂:加入25 mL正己烷,避光搅拌10 min后离心(3 500 r/min,10 min),去除上清液,重复以上操作1 次。加入乙酸乙酯25 mL,避光搅拌10 min后离心(3 500 r/min,10 min),取上清液,重复提取5 次。所得全部上清液抽滤后于45 ℃真空旋转蒸发至干,纯水定容至10 mL,分装后于-40 ℃冰箱中贮存备用。
1.3.2 多酚含量的测定
没食子酸标准曲线的制备:参照Adom[17]和Chu[19]等方法,取一定浓度梯度的标准液200 μL于试管,依次加入800 μL纯水、200 μL福林-酚试剂摇匀,静置6 min,再加入2 mL 7% Na2CO3溶液和1.6 mL纯水摇匀,使其充分混合,避光静置90 min,于760 nm波长处测其吸光度。以没食子酸浓度为横坐标,吸光度为纵坐标,绘制标准曲线,得到回归方程为:y=0.003 4x+0.067 7(R2=0.991 7)
大麦及麦芽样品中多酚类化合物含量的检测:结果以每克大麦或麦芽样品(干质量)中所含的没食子酸当量(mg/g)表示。每个样品做3 组平行,结果表示为 ±s。
1.3.3 多酚组分鉴定
参照李富华[20]的方法并适当修改。
色谱条件:色谱柱:T h e r m o B D S C1 8(250 mm×4.6 mm,5 μm),流动相A:0.2%甲酸;流动相B:100%乙腈;流速:0.7 mL/min;进样量:20 μL;柱温:40 ℃;检测器:日本岛津LC-20A二极管阵列检测器,色谱数据在200~600 nm波长范围内扫描,检测波长280 nm。梯度洗脱程序为:0~5 min,10% B;5~50 min,10%~40% B;50~55 min,40%~90% B;55~62 min,90% B;62~65 min,90%~10% B;65~75 min,10% B。
1.3.4 大麦发芽前后多酚抗氧化活性的测定
1.3.4.1 多酚DPPH自由基清除活性测定
参考Vaher[21]、Alvarez[22]及Van[23]等的方法。将样品提取液做相应稀释,配制一定浓度梯度的样品反应液,加入5 mL 0.1 mmol/L的DPPH溶液混匀,避光静置30 min,于517 nm波长处检测。实验以VC为对照,纯水做空白试验。每个样品做3 个平行,以IC50值表示清除DPPH自由基强度。根据式(1)计算样品DPPH自由基清除率:
式中:Ai为样品的吸光度;Aj为空白实验的吸光度。
1.3.4.2 多酚ORAC值测定
参考Alvarez[22]和Wolfe[24]等的方法。将20 μL磷酸缓冲液(空白液)、6.25 μmol Trolox标准液和1 μg/mL的样品液,分别点样到96 孔黑色酶标板。于37 ℃温育10 min后加入200 μL 0.96 μmol/L的荧光工作液振荡20 min,迅速加入119 mmol/L ABAP工作液20 μL,于激发波长485 nm、入射波长520 nm条件下立即读数,每4.5 min进行读数,共2.5 h。根据测定值计算抗氧化能力指数(oxygen radical absorbance capacity,ORAC),按照式(2)计算荧光衰减曲线下的面积(AUC)、按照式(3)计算ORAC值。

式中:f1为第1次荧光读数值;fn为第n次荧光读数值;CT为间隔测定时间。最终的ORAC值以Trolox当量表示(μmol/g)。
数据采用Excel 2010软件进行统计分析,采用SPSS 22.0进行单因素ANOVA分析、Duncan多重比较(P<0.05)分析,多酚组分与抗氧化活性变化采用主成分分析(principal component analysis,PCA),其中变量为8(品种)×7(组分),通过PCA降维所得载荷图和不同品种样品得分图,分析大麦发芽前后多酚组分变化趋势。每组实验至少重复3 次,结果表示为 ±s。
由表2可知,大麦发芽前后多酚含量变化显著,所得结果与朱丽丽[9]、綦文涛[25]等研究相似。除Baudin、Sebastion外,大麦发芽后游离酚、结合酚、总酚含量均显著升高(P<0.05),较发芽前提升1.19~2.75、1.02~2.40 倍和1.24~2.21 倍,其中,Hindmarsh与Irima游离酚含量增幅最大(分别为2.75 倍和2.25 倍),Scope与Metcalf结合酚含量增幅最大(分别为2.40 倍和2.07 倍),Hindmarsh与Irima总酚含量增幅最大(分别为2.21 倍和2.11 倍)。此外,Hindmarsh大麦发芽后,其游离、结合及总酚含量均最高(分别为(409.66±13.22)、(196.19±5.89)、(605.86±12.98)mg/100 g)。而Sebastion发芽后游离、结合及总酚含量均显著下降(P<0.05),Baudin结合酚与总酚含量显著下降(P<0.05),而游离酚含量显著上升(P<0.05),这可能是发芽过程中多酚组分与其他还原性物质的平衡发生改变导致的。
表2 大麦发芽前后多酚含量
Table 2 Free and bound phenolic contents of eight varieties of barley and corresponding malts mg/100 g

注:字母不同表示差异显著(P<0.05)。
品种 游离酚 结合酚 总酚大麦Hindmarsh 148.52±1.26j 125.21±4.21f 273.73±4.28g Irima 148.72±4.94j 85.67±12.68g 234.38±16.99h Esterel 159.39±0.87ghi 124.72±2.42f 284.11±2.57g Metcalfe 158.77±12.22ghi64.63±11.52h 223.40±23.66hi Commander 160.26±9.08ghi141.50±6.57de301.76±15.59f Baudin 152.40±8.41hi 127.54±5.99f 279.93±2.51g Scope 101.72±3.69k 77.28±0.84g 179.00±4.50j Sebastion 255.54±5.31c 52.34±1.74i 307.88±7.01ef Hindmarsh 409.66±13.22a 196.19±5.89a 605.86±12.98a Irima 335.85±10.24b 159.28±0.09c 495.14±10.33b Esterel 245.31±4.99c 139.73±1.16de 385.04±4.35c Metcalfe 189.04±6.43f 134.10±2.01ef 323.14±8.25e Commander 230.15±5.33d 144.52±2.31d 374.68±4.40c Baudin 204.36±0.44e 10.72±0.77k 215.08±0.36i Scope 164.33±0.50gh 185.83±2.62b 350.16±2.70d Sebastion 166.36±3.06g 20.76±0.50j 187.13±2.81j麦芽
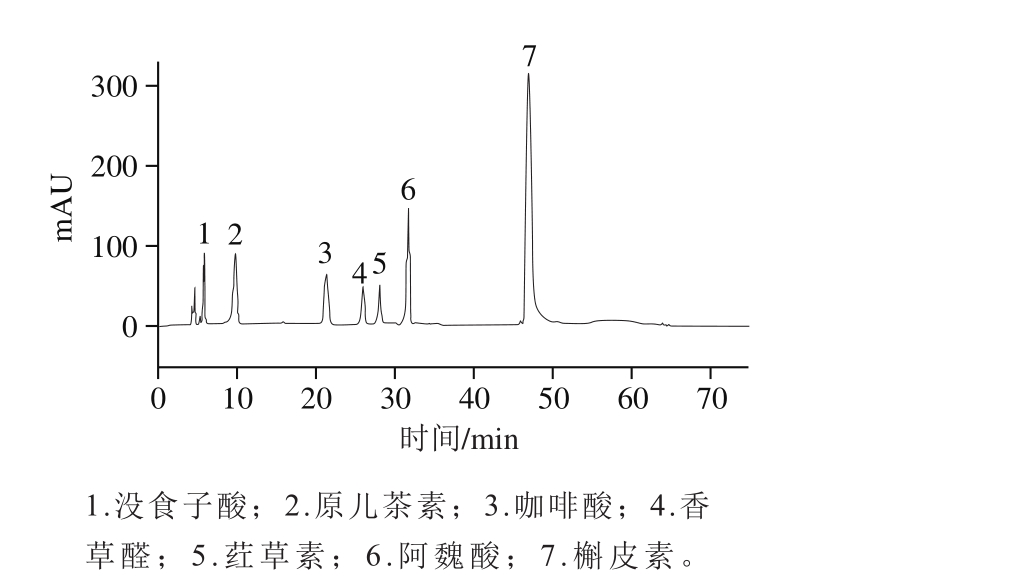
图1 多酚标准品高效液相色谱图
Fig. 1 Chromatograms of polyphenol standard mixture
表3 标准品的回归方程
Table 3 Regression equations for polyphenol standard substances
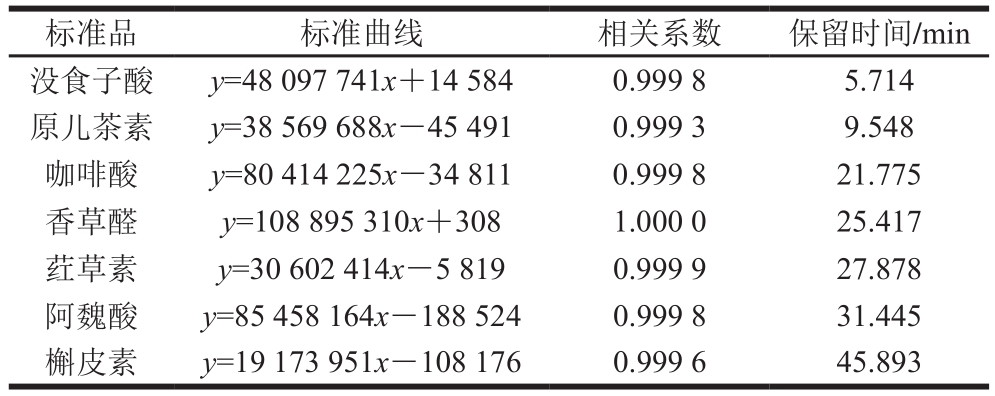
标准品 标准曲线 相关系数 保留时间/min没食子酸 y=48 097 741x+14 584 0.999 8 5.714原儿茶素 y=38 569 688x-45 491 0.999 3 9.548咖啡酸 y=80 414 225x-34 811 0.999 8 21.775香草醛 y=108 895 310x+308 1.000 0 25.417荭草素 y=30 602 414x-5 819 0.999 9 27.878阿魏酸 y=85 458 164x-188 524 0.999 8 31.445槲皮素 y=19 173 951x-108 176 0.999 6 45.893
表4 大麦发芽前后游离酚组分和含量
Table 4 Tpyes and contents of free polyphenols in barley and malt μg/g

注:ND.未检出。同列小写字母不同表示差异显著(P<0.05)。下同。
品种 没食子酸 原儿茶素 咖啡酸 香草醛 荭草素 阿魏酸大麦Hindmarsh 15.80±0.36g180.40±1.95d ND 2.06±0.02ef 8.59±0.11ab 51.53±0.14d Irima 24.60±4.10fg122.92±9.92ef ND 3.08±0.15c 10.40±064a61.23±0.38cd Esterel 31.11±3.88ef46.61±3.66hi ND 1.54±0.17fg 7.03±1.09b 62.33±0.65cd Metcalf 34.46±2.08b231.09±0.72c12.88±0.73c 3.85±0.53b ND 68.98±0.66bc Commander 50.02±1.17bcd553.24±8.48a25.14±2.97a 6.19±0.30a ND 127.87±2.42a Baudin 49.54±0.74bcd270.50±6.36b19.72±0.30b 3.96±0.24b 7.14±2.46b 54.32±1.73d Scope 14.69±0.70g273.90±0.69b ND 1.37±0.22g 7.95±0.75ab 49.10±4.10d Sebastion ND 25.60±3.22i 5.05±1.02d ND ND ND Hindmarsh 72.69±2.00a109.65±3.31f ND 6.19±0.08a 7.22±0.87b127.89±2.94a Irima 63.90±0.68ab125.54±5.84ef ND 4.01±0.02c 6.40±0.55b124.18±9.88a Esterel 53.41±28.39bc71.77±0.37g ND 4.82±0.21b 6.57±1.16b129.90±5.62a Metcalf 41.53±1.98cde67.09±6.46gh ND 4.28±0.38bc 6.33±0.86b 88.29±3.52b Commander34.78±1.82def232.92±1.65c12.93±0.73c 3.99±0.43c ND 69.26±0.47bcd Baudin 71.06±1.71a140.51±34.10e20.29±1.32b 3.96±0.21c 5.94±0.55b83.34±42.92bc Scope 37.11±1.76def197.22±0.03d ND 2.53±0.13de ND 73.10±2.92bcd Sebastion ND 22.29±3.03i ND ND ND ND麦芽
表5 大麦发芽前后结合酚组分和含量
Table 5 Types and contents of bound polyphenols in barley and malt μg/g

品种 没食子酸 原儿茶素 咖啡酸 香草醛 荭草素 阿魏酸 槲皮素大麦Hindmarsh 1.92±1.38c10.91±0.44g25.63±0.50e5.12±0.23defg101.85±4.39f507.09±26.05c106.99±6.50d Irima 2.50±0.03c7.93±1.12gh29.16±0.02d3.47±0.20gh153.36±1.29d508.15±0.31c143.92±0.70c Esterel 0.83±0.07c11.20±0.17defg24.22±1.07f2.63±0.27h209.84±10.58b532.91±22.21c74.73±5.41e Metcalf 0.82±0.05c10.63±0.04efg12.93±0.04i3.13±0.96gh90.20±0.78g313.53±0.57d58.92±0.45e Commander 2.46±0. 34c14.74±0.45cd35.82±0.16ab5.62±1.58def184.25±2.78c649.29±27.32b92.31±1.21d Baudin 4.00±1.97bc23.38±0.38a22.10±0.19g15.79±2.15a82.56±0.53gh625.19±2.68b97.40±1.23d Scope 0.54±0.05c8.04±0.46gh19.82±0.57h2.72±017h 77.76±2.21h308.09±2.65d102.19±6.00d Sebastion 2.31±0.28c11.73±1.00defg24.20±1.13bc3.95±0.39fgh73.21±14.34h495.23±27.39c142.87±23.81c麦芽Hindmarsh 3.75±0.35bc21.12±5.82a34.13±0.06c8.50±1.60b139.66±0.98e737.33±31.50a92.91±2.59f Irima 8.23±0.54b11.35±0.26fg34.66±0.13bc4.71±0.34efgh183.26±2.15c631.13±0.71d131.27±4.45c Esterel 1.58±0.34c18.19±2.67b20.40±0.67bc7.87±0.51bc222.05±3.78a653.23±3.88b131.69±2.45c Metcalf 1.98±0.10c14.00±0.11bcde24.72±0.20ef6.19±0.18cde174.98±3.02c655.83±0.66b131.24±1.15c Commander 1.99±0.03c15.58±0.52bc34.88±0.21bc7.04±1.10bcdb185.58±2.07c723.53±29.32a168.64±10.59b Baudin ND 12.01±0.02cdef5.50±0.06j4.16±0.06efgh 4.98±0.17i 63.10±0.00g 22.39±0.00f Scope 46.80±9.04a21.01±0.50a36.27±2.02a8.68±0.36b137.50±5.36e612.92±3.27b258.82±2.92a Sebastion 0.06±0.01d4.70±0.00h 5.90±0.16j4.13±0.29efgh10.54±0.10i122.28±0.64f28.29±0.10f
多酚标准品色谱图及回归方程如图1和表3所示。由表4和表5可知,大麦发芽前后游离酚、结合酚组分变化显著。
在游离酚中,大麦发芽后,没食子酸和阿魏酸总体显著高于原始大麦(P<0.05),增高幅度分别为21%~360%,49%~148%;而原儿茶素、荭草素总体显著降低,降低幅度分别为5%~71%,7%~100%。其中,发芽后没食子酸、阿魏酸含量最高的是Hindmarsh((72.69±2.00)、(127.89±2.94)μg/g)与Irima((63.90±0.68)、(124.18±9.88)μg/g)。此外,Metcalf大麦在发芽后检测到新物质荭草素,而Metcalf大麦中咖啡酸、Scope大麦中荭草素及Sebastion大麦中没食子酸在发芽后均未被检测到。这有可能是大麦发芽过程中多酚氧化酶、水解酶等作用,致使多酚某些特定组分与木质素、阿拉伯木聚糖结合等变化引起的[26]。
结合酚中,大麦发芽后,原儿茶素、香草醛、荭草素和阿魏酸总体显著高于原始大麦(P<0.05),增高幅度分别为6%~117%、25%~195%、1%~94%和11%~109%。发芽后没食子酸、原儿茶素、咖啡酸与槲皮素含量最高的是Scope((46.80±9.04)、(21.01±0.50)、(36.27±2.02)、(258.82±2.92)μg/g)。此外,较游离酚而言,结合酚增加了槲皮素。
综上,大麦发芽使得大部分单体酚含量增加,总酚含量呈上升趋势,这可能与胚乳在发芽期间某些营养物质的释放和结合有关[9]。
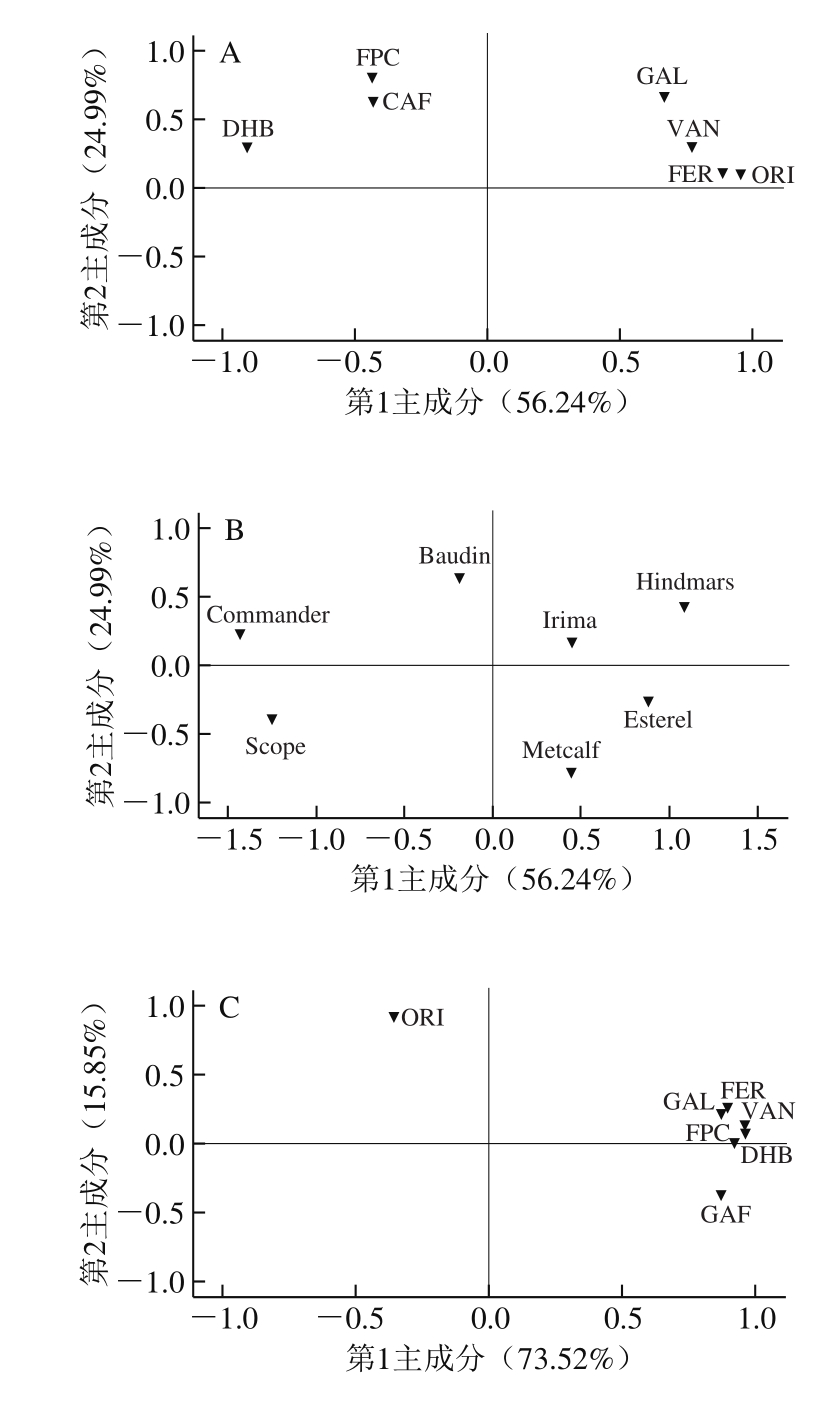
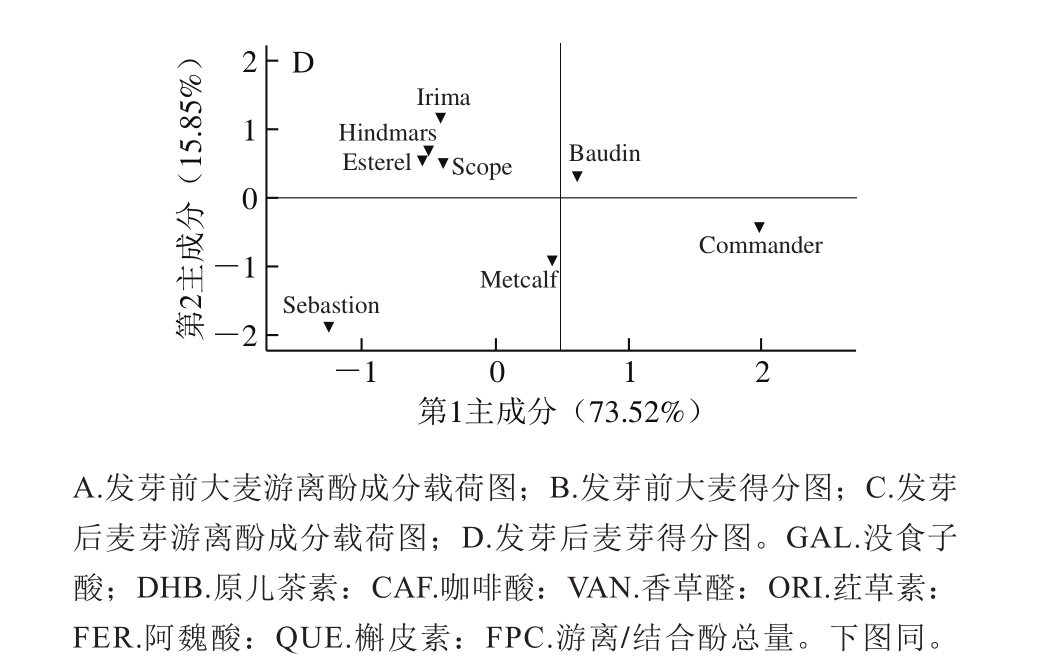
图2 大麦发芽前后游离酚PCA
Fig. 2 Principal component analysis of free phenolics in 8 varieties of barley and corresponding malts
由图2可知,在大麦游离酚中,提取前2 个主成分可以解释89.37%的总变异,其中第1主成分包含最多的“信息量”,并以香草醛、原儿茶素、阿魏酸、没食子酸、咖啡酸为主,可以解释73.52%的总变异。在麦芽游离酚中,提取前2 个主成分可以解释81.14%的总变异,其中第1主成分以原儿茶素、荭草素、阿魏酸、香草醛、没食子酸为主,可以解释56.24%的总变异。此外,这8 个品种大麦及麦芽均无明显相似性,这可能是所检测游离酚的品种差异性导致的。
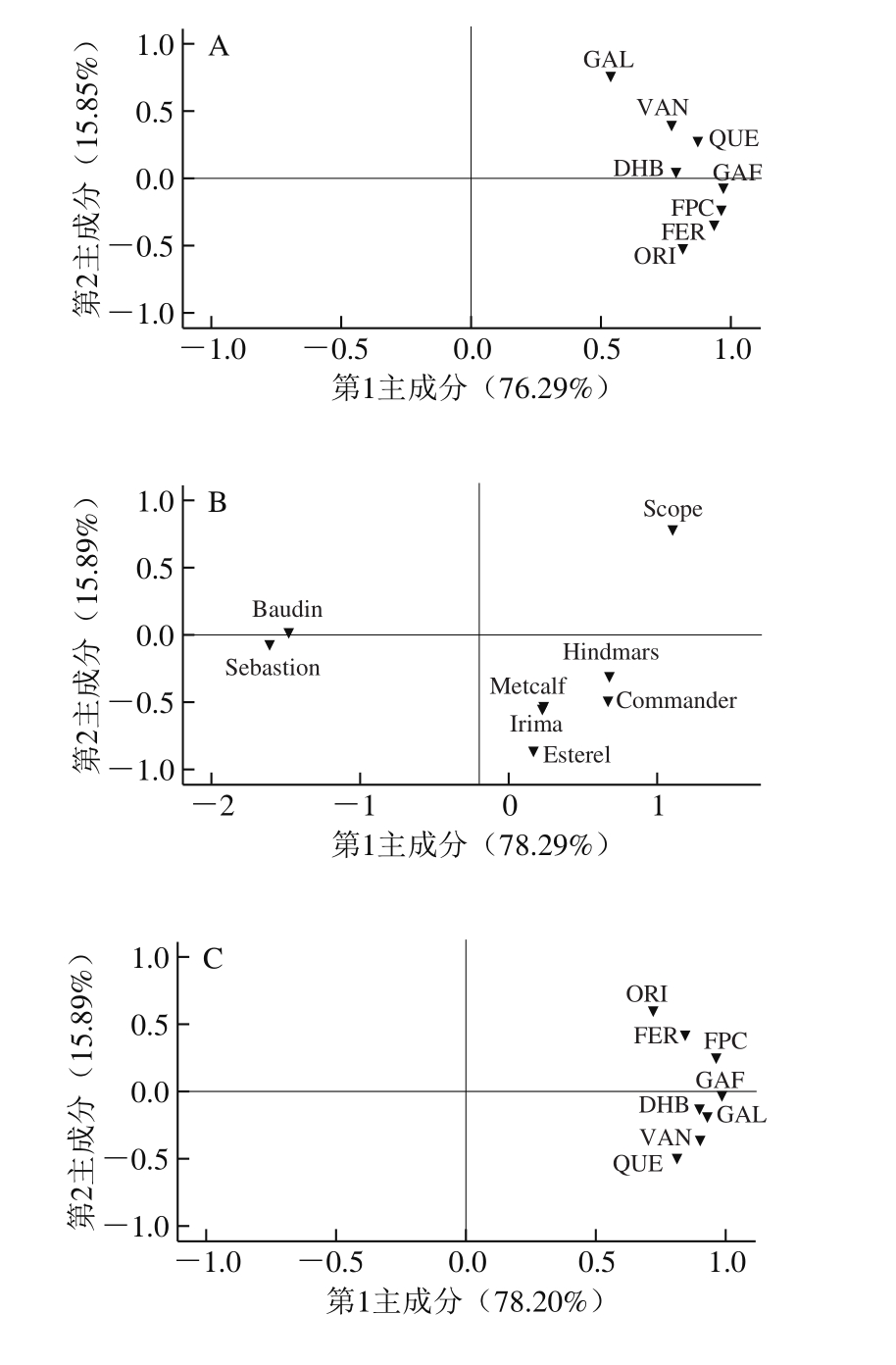

图3 大麦发芽前后结合酚PCA
Fig. 3 Principal component analysis of bound phenolics in 8 varieties of barley and corresponding malts
由图3可知,大麦结合酚中,提取前2 个主成分可以解释91.00%的总变异,其中第1主成分以没食子酸、阿魏酸、香草醛、原儿茶素、槲皮素、咖啡酸为主,可以解释78.20%的总变异。在麦芽结合酚中,提取前2个主成分可以解释86.91%的总变异,其中第1主成分以咖啡酸、槲皮素、原儿茶素、阿魏酸为主,可以解释70.92%的总变异。此外,这8 个品种大麦及麦芽均未表现出明显相似性,这可能是所检测结合酚的品种差异性导致的。
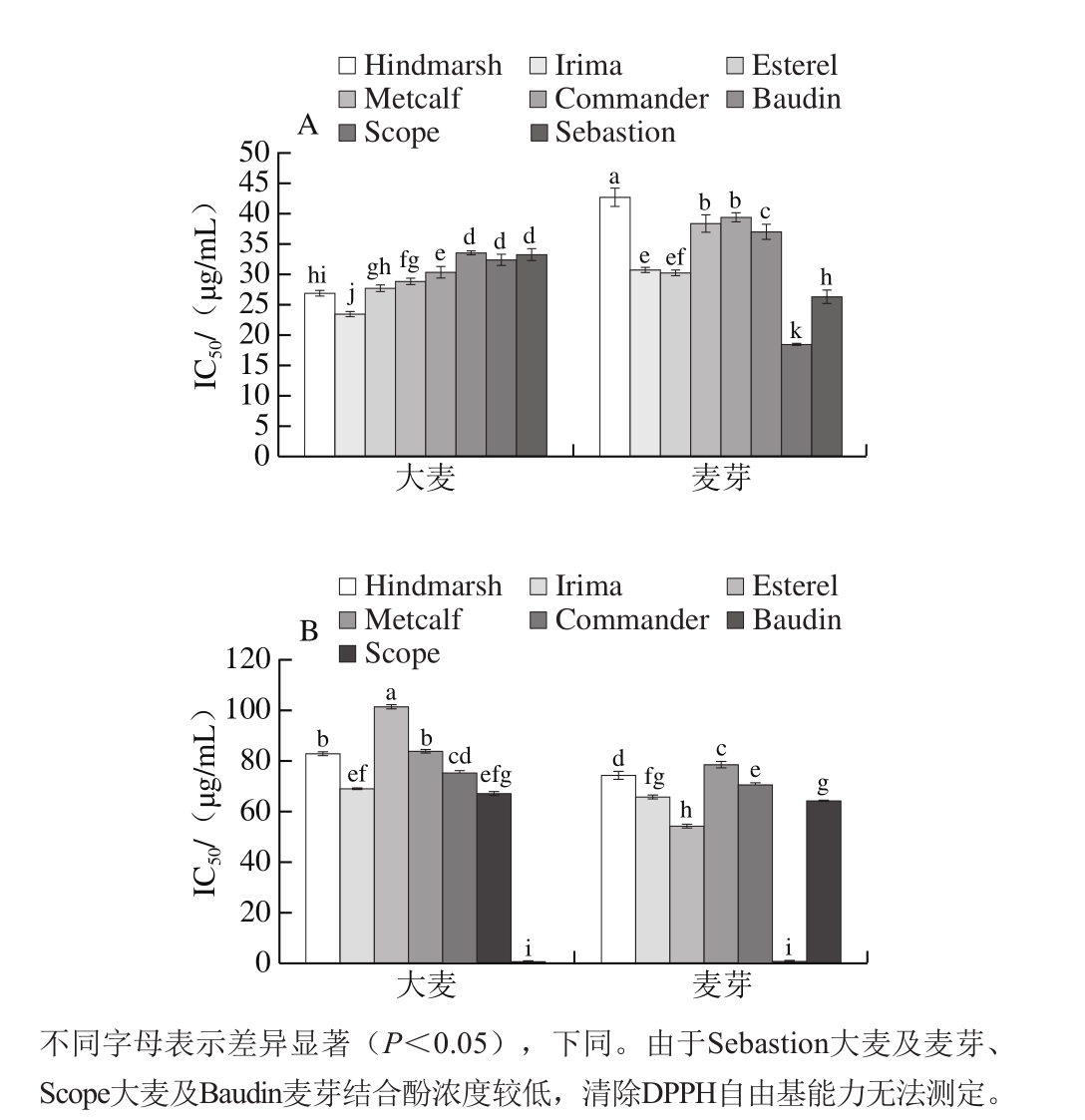
图4 大麦发芽前后游离酚(A)、结合酚(B)DPPH自由基清除能力(IC50值)
Fig. 4 DPPH radical scavenging capacity (IC50) of free (A) and bound (B)phenolic of 8 varieties of barley and corresponding malts
由图4A可知,大麦发芽之后游离酚清除DPPH自由基能力显著改变,其中Hindmarsh、Irima、Esterel、Metcalf、Commander及Baudin的IC50值显著升高(P<0.05),表明这6 种大麦发芽之后游离酚清除DPPH自由基能力显著下降;Scope、Sebastion的IC50值显著下降(下降幅度依次为43%、21%)(P<0.05),表明这两种大麦发芽后游离酚清除DPPH自由基能力显著上升。另外,Scope大麦发芽之后游离酚清除DPPH自由基能力(IC50值为18.703 μg/mL)显著高于其他品种(P<0.05)。由图4B可知,大麦发芽之后结合酚清除DPPH自由基能力显著改变,Hindmarsh、Esterel、Metcalf及Commander的IC50值显著下降(下降幅度依次为11%、46%、7%、6%)(P<0.05),表明这5 种大麦发芽后结合酚清除DPPH自由基能力显著上升。另外,Esterel大麦发芽之后结合酚清除DPPH自由基能力(IC50值为54.252 μg/mL)显著高于其他品种(P<0.05)。
综上,大麦发芽后游离、结合酚清除DPPH自由基能力变化各有差异,但结合酚清除DPPH自由基能力普遍增强,其中,Scope大麦发芽之后游离酚清除DPPH自由基能力达到最高,Esterel大麦发芽之后结合酚清除DPPH自由基能力达到最强。

图5 大麦发芽前后游离酚(A)、结合酚(B)的ORAC值
Fig. 5 Oxygen radical absorbance capacity of free (A) and bound (B)phenolics in 8 varieties of barley and corresponding malts
由图5A可知,大麦发芽之后游离酚的氧自由基吸收能力显著改变,其中Irima、Commander及Sebastion的ORAC值显著升高(上升幅度依次为130%、173%、167%)(P<0.05),表明这3 种大麦发芽之后游离酚氧自由基吸收能力显著提升;Hindmarsh、Sebastion的ORAC值显著下降(P<0.05),表明这两种大麦发芽之后游离酚氧自由基吸收能力显著下降。由图5B可知,大麦发芽之后结合酚的氧自由基吸收能力显著改变,其中Esterel与Baudin的ORAC值显著升高(上升幅度依次为129%、132%)(P<0.05),表明这两种大麦发芽之后结合酚氧自由基吸收能力显著提升;Hindmarsh与Sebastion的ORAC值显著下降(P<0.05),表明这两种大麦发芽之后结合酚氧自由基吸收能力显著下降。
综上,大麦发芽后游离、结合酚氧自由基吸收能力变化各有差异,但总体呈上升趋势,且结合酚氧自由基吸收能力普遍高于游离酚,其中,Commander大麦发芽之后游离酚氧自由基吸收能力达到最高,Baudin大麦发芽之后结合酚氧自由基吸收能力达到最强。
作为天然抗氧化剂的植物多酚是近几年的研究热点,谷物类多酚物质的研究逐渐广泛。大麦及麦芽作为啤酒工艺的主要原料,其品种属性对啤酒品质影响较大,多酚是大麦及麦芽中重要的抗氧化活性成分,对啤酒的稳定性有着较大的影响[27-30]。本实验以8 个品种酿造啤酒大麦及麦芽为原料,比较分析了大麦发芽前后多酚含量、组成及抗氧化活性的变化。
结果表明,8 种大麦总酚含量范围为(179.00±3.14)~(307.88±3.60)mg/100 g,麦芽总酚含量范围为(187.13±2.81)~(605±7.67)mg/100 g,游离态多酚是大麦及麦芽多酚的主要存在形式(占53%~95%),发芽后的麦芽成品总酚含量显著增加(P<0.05)。大麦及麦芽游离酚主要有阿魏酸、荭草素、没食子酸、香草醛、原儿茶素5 种单体酚;而结合酚有阿魏酸、荭草素、没食子酸、香草醛、原儿茶素、咖啡酸和槲皮素7 种单体酚。8 个品种大麦及麦芽均具有一定的抗氧化活性,清除DPPH自由基能力的IC50值范围为(23.70±0.34)~(101.36±1.18)μg/mL,ORAC值范围为(32.69±0.13)~(166.722±6.48)μmol/g,其中品种Scope麦芽游离酚清除DPPH自由基能力最强,品种Baudin麦芽结合酚的氧自由基吸收能力最好。发芽使没食子酸、阿魏酸含量显著上升,使游离、结合酚氧自由基吸收能力总体增强,结合酚清除DPPH自由基能力普遍提升,麦芽的总体抗氧化活性优于大麦。
大麦及麦芽富含多酚且具有较强的抗氧化活性,是植源性多酚的优良来源之一。在大麦发芽过程中多酚含量呈上升趋势,且单体酚含量的变化对多酚的抗氧化性具有较大的影响。进一步研究大麦多酚组分对抗氧化活性的影响,对啤酒工业生产具有重要意义。
[1] 卢良恕. 当代科技重要著作·农业领域: 中国大麦学[M]. 北京: 中国农业出版社, 1996: 11-12.
[2] 陈辉. 现代营养学[M]. 北京: 化学工业出版社, 2006: 86-89.
[3] 杨庆明. 大麦及麦芽提取物抗氧化活性研究[D]. 兰州: 西北师范大学, 2009: 2-5. DOI:10.7666/d.d185110.
[4] NIRUPAMA G, HOSSAIN M B, RAI D K, et al. A review of extraction and analysis of bioactives in oat and barley and scope for use of novel food processing technologies[J]. Molecules, 2015, 20(6):10884-10909. DOI:10.3390/molecules200610884.
[5] LIU Q, YAO H. Antioxidant activities of barley seeds extracts[J].Food Chemistry, 2007, 102(3): 732-737. DOI:10.1016/j.foodchem.2006.06.051.
[6] 履新. 大麦麸皮多酚类提取物抗氧化活性和抗突变性[J]. 粮食与油脂, 2004, 23(6): 9-12. DOI:10.3969/j.issn.1008-9578.2004.06.002.
[7] FALTERMEIER A, WATERS D, BECKER T, et al. Common wheat(Triticum aestivum L.) and its use as a brewing cereal: a review[J].Journal of the Institute of Brewing, 2014, 120: 1-15. DOI:10.1002/jib.107.
[8] ZHAO J, ZHOU B, GILLESPIE J, et al. Production of deoxynivalenol(DON) and DON-3-glucoside during the malting of Fusarium infected hard red spring wheat[J]. Food Control, 2017, 85: 6-10. DOI:10.1016/j.foodcont.2017.09.002.
[9] 朱丽丽. 麦芽中酚类物质与抗氧化力的研究[D]. 大连: 大连工业大学, 2013: 21-23.
[10] 蒋芮, 李雅婷, 欧阳鹏凌, 等. 发芽对黑大麦游离氨基酸及其他营养成分的影响[J]. 食品工业科技, 2018, 39(6): 38-42. DOI:10.13386/j.issn1002-0306.2018.06.007.
[11] 黄业昌. 影响啤酒大麦产量和籽粒品质的关键栽培因子研究[D].杭州: 浙江大学, 2013: 1-2.
[12] 吕亮杰. 啤用大麦品质性状的遗传分析及相关QTL定位[D]. 扬州:扬州大学, 2015: 40-41. DOI:10.7666/d.Y2909323.
[13] 杨燕萍. 啤酒大麦和麦芽中的酚类物质及其抗氧化特性研究[D].兰州: 甘肃农业大学, 2010: 1-3. DOI:10.7666/d.y1740223.
[14] MAHESH G, NISSREEN A, EIMEAR G. Barley for brewing:characteristic changes during malting, brewing and applicationgs of its by-products[J]. Comprehensive Review in Food Science and Food Safety, 2010, 9(3): 318-328. DOI:10.1111/j.1541-4337.2010.00112.x.
[15] MARKETS D V, LUIS F G, PAVEL D. Antioxidant properties of free soluble ester and insoluble-bound phenolic compounds in different barley varieties and corresponding malts[J]. Institute of Brewing,2008, 114(1): 27-33. DOI:10.1002/j.2050-0416.2008.tb00302.x.
[16] OKARTER N, LIU C, SORRELLS M E, et al. Phytochemical content and antioxidant activity of six diverse varieties of whole wheat[J]. Food Chemistry, 2010, 119(1): 249-257. DOI:10.1016/j.foodchem.2009.06.021.
[17] ADOM K K, LIU R. Antioxidant activity of grains[J]. Journal of Agricultural and Food Chemistry, 2002, 50(21): 6182-6187.DOI:10.1021/jf0205099.
[18] NUUTILA A, KAMMIOVIRTA K, OKSMAN-CALDENTEY K M.Comparison of methods for the hydrolysis of flavonoids and phenolic acids from onion and spinach for HPLC analysis[J]. Food Chemistry,2002, 76(4): 519-525. DOI:10.1016/s0308-8146(01)00305-3.
[19] CHU Y, SUN J, WU X, et al. Antioxidant and antiproliferative activities of common vegetables[J]. Journal of Agricultural and Food Chemistry, 2002, 50(23): 6910-6916. DOI:10.1021/jf0207530.
[20] 李富华. 荞麦酚类化合物抗氧化和抗增殖活性研究[D]. 重庆: 西南大学, 2014: 30-31.
[21] VAHER M, MATSO K, LEVANDI T, et al. Phenolic compounds and the antioxidant activity of the bran, flour and whole grain of different wheat varieties[J]. Procedia Chemistry, 2010, 2(1): 76-82.DOI:10.1016/j.proche.2009.12.013.
[22] ALVAREZ L, WIJNGAARD H, ARENDT E K, et al. Polyphenol composition and in vitro antioxidant activity of amaranth, quinoa buckwheat and wheat as affected by sprouting and baking[J]. Food Chemistry, 2010, 119: 770-778. DOI:10.1016/j.foodchem.2009.07.032.
[23] VAN H P, MORITA N. Distribution of phenolic compounds in the graded flours milled from whole buckwheat grains and their antioxidant capacities[J]. Food Chemistry, 2008, 109(2): 325-331.DOI:10.1016/j.foodchem.2007.12.060.
[24] WOLFE K L, KANG X, HE X, et al. Cellular antioxidant activity of common fruits[J]. Journal of Agricultural and Food Chemistry, 2008,56(18): 8418-8426. DOI:10.1021/jf801381y.
[25] 綦文涛, 陈文若, 陈银基, 等. 大麦功能活性物质含量与抗氧化活性的关系[J]. 中国食品学报, 2018, 18(11): 232-239. DOI:10.16429/j.1009-7848.2018.11.030.
[26] 陈建尧, 孔维宝, 赵海锋. 大麦和麦芽的抗氧化力及其与多酚含量的关系[J]. 啤酒科技, 2006(8): 63-67; 70. DOI:10.3969/j.issn.1008-4819.2006.08.031.
[27] OU B, HAMPSCH-WOODILL M, PRIOR R L. Development and validation of an improved oxygen radical absorbance capacity assay using fluorescein as the fluorescent probe[J]. Journal of Agricultural and Food Chemistry, 2001, 49(10): 4619-4626. DOI:10.1021/jf010586o.
[28] GOUPY P, HUGUES M, BOIVIN P, et al. Antioxidant composition and activity of barley (Hordeum vulgare) and malt extracts and of isolated phenolic compounds[J]. Journal of the Science of Food and Agriculture, 1999, 79(12): 1625-1634. DOI:10.1002/(sici)1097-0010(199909)79:12<1625::aid-jsfa411>3.0.co;2-.
[29] YANG F, LUAN B, SUN Z, et al. Application of chitooligosaccharides as antioxidants in beer to improve the flavor stability by protecting against beer staling during storage[J]. Biotechnology Letters, 2017,39(2): 305-310. DOI:10.1007/s10529-016-2248-3.
[30] LI H, ZHAO M, CUI C, et al. Antioxidant activity and typical ageing compounds: their evolutions and relationships during the storage of lager beers[J]. International Journal of Food Science and Technology,2016, 51(9): 2026-2033. DOI:10.1111/ijfs.13173.
Changes in Phenloic Components and Antioxidant Activity of Barley before and after Malting
LI Weizhou, LI Fuxiang, HE Xiaoqin, et al. Changes in phenloic components and antioxidant activity of barley before and after malting[J]. Food Science, 2019, 40(18): 15-21. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20181227-319. http://www.spkx.net.cn